Теплофизические свойства, теплопроводность поваренной соли. Физические свойства соли и воды
Физические и химические свойства солей
Соли принято делить на три группы – средние (NaCl), кислые (NaHCO3) и основные (Fe(OH)Cl). Кроме этого различают двойные (смешанные) и комплексные соли. Двойные соли образованы двумя катионами и одним анионом. Они существуют только в твердом виде.
Химические свойства солей
а) кислые соли
Кислые соли при диссоциации дают катионы металла (иона аммония), ионы водорода и анионы кислотного остатка:
NaHCO3 ↔ Na+ + H+ + CO32-.
Кислые соли – продукты неполного замещения атомов водорода соответствующей кислоты на атомы металла.
Кислые соли термически неустойчивы и при нагревании разлагаются с образованием средних солей:
Ca(HCO3)2 = CaCO3↓ + CO2↑ + h3O.
Для кислых солей характерны реакции нейтрализации со щелочами:
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3↓ + 2h3O.
б) основные соли
Основные соли при диссоциации дают катионы металла, анионы кислотного остатка и ионы ОН—:
Fe(OH)Cl ↔ Fe(OH)+ + Cl— ↔ Fe2+ + OH— + Cl—.
Основные соли – продукты неполного замещения гидроксильных групп соответствующего основания на кислотные остатки.
Основные соли, также, как и кислые, термически неустойчивы и при нагревании разлагаются:
[Cu(OH)]2CO3 = 2CuO + CO2↑ + h3O.
Для основных солей характерны реакции нейтрализации с кислотами:
Fe(OH)Cl + HCl ↔ FeCl2 + h3O.
в) средние соли
Средние соли при диссоциации дают только катионы металла (ион аммония) и анионы кислотного остатка (см. выше). Средние соли – продукты полного замещения атомов водорода соответствующей кислоты на атомы металла.
Большинство средних солей термически неустойчивы и при нагревании разлагаются:
CaCO3 = CaO + CO2;
Nh5Cl = Nh4 + HCl;
2Cu(NO3)2 = 2CuO +4NO2 + O2.
В водном растворе средние соли подвергаются гидролизу:
Al2S3 +6h3O ↔ 2Al(OH)3 + 3h3S;
K2S + h3O ↔ KHS + KOH;
Fe(NO3)3 + h3O ↔ Fe(OH)(NO3)2 + HNO3.
Средние соли вступают в реакции обмена с кислотами, основаниями и другими солями:
Pb(NO3)2 + h3S = PbS↓ + 2HNO3;
Fe2(SO4)3 + 3Ba(OH)2 = 2Fe(OH)3↓ + 3BaSO4↓;
CaBr2 + K2CO3 = CaCO3↓ + 2KBr.
Физические свойства солей
Чаще всего соли – кристаллические вещества с ионной кристаллической решеткой. Соли имеют высокие температуры плавления. При н.у. соли – диэлектрики. Растворимость солей в воде различна.
Получение солей
а) кислые соли
Основные способы получения кислых солей – неполная нейтрализация кислот, действие избытка кислотных оксидов на основания, а также действие кислот на соли:
NaOH + h3SO4 = NaHSO4 + h3O;
Ca(OH)2 + 2CO2 = Ca(HCO3)2;
CaCO3 + CO2 + h3O = Ca(HCO3)2.
б) основные соли
Основные соли получают путем осторожного добавления небольшого количества щелочи к раствору средней соли, либо действием солей слабых кислот на средние соли:
AlCl3 + 2NaOH = Al(OH)2Cl + 2NaCl;
2MgCl2 + 2Na2CO3 + h3O = [Mg(OH)]2CO3↓ + CO2↑ + 2NaCl.
в) средние соли
Основные способы получения средних солей – реакции взаимодействия кислот с металлами, основными или амфотерными оксидами и основаниями, а также реакции взаимодействия оснований с кислотными или амфотерными оксидами и кислотами, реакции взаимодействия кислотных и основных оксидов и реакции обмена:
Mg + h3SO4 = MgSO4 + h3↑;
Ag2O + 2HNO3 = 2AgNO3 + h3O;
Cu(OH)2 + 2HCl = CuCl2 + 2h3O;
2KOH + SO2 = K2SO3 + h3O;
CaO + SO3 = CaSO4;
BaCl2 + MgSO4 = MgCl2 + BaSO4↓.
Примеры решения задач
ru.solverbook.com
Агрегатное состояние поваренной соли. Поваренная соль, химия
Более 10 миллионов органических и более 500 тысяч неорганических соединений известно химикам на сегодняшний день. Среди них есть сложные по строению и свойствам, которые применяются только в химических или медицинских целях. А есть те, что совсем не сложно устроены и очень распространены в быту. Но от этого не менее важны и значимы. К одному из таких веществ относится поваренная соль. В быту ее называют еще пищевой, а в химической промышленности именуют хлоридом натрия или хлористым натрием. В технологической промышленности ее называют минералом, который она образует в природе, - галитом, а также каменной солью или твердой каменной солью. Рассмотрим подробнее агрегатное состояние поваренной соли, строение, свойства, добычу, применение и историю введения в массовое потребление.

В каких состояниях существует поваренная соль?
Что такое агрегатное состояние веществ и каким оно бывает? Это зависит от того, о каком веществе идет речь. Каждый ученик старше 7 класса может назвать агрегатное состояние поваренной соли, потому что это то вещество, которое находится у каждого дома. Сегодня без него сложно современному человеку представить свою жизнь. К тому же агрегатное состояние поваренной соли совершенно очевидно невооруженным глазом - мелко или крупно дисперсные кристаллики правильной кубической формы. Однако, растворив соль в воде, мы получим ее уже в другом агрегатном состоянии - жидком. То же самое мы получим, если просто расплавим кристаллы при высокой температуре. Единственное состояние, которое для соли не характерно, - это газообразное. Но при определенных условиях можно получить и его.
Условия для изменения агрегатного состояния
- Чтобы получить соль в жидком состоянии путем плавки твердых кристаллов естественного происхождения, необходимо применить температуру, равную 800оС.
- Для перевода соли в газообразное состояние расплавленные кристаллы нужно довести до кипения (примерно 1400оС) и кипятить до полного перехода структурных компонентов в ионы (Na+ и CL-).
- Твердое агрегатное состояние поваренной соли - это ее естественный вид в природных условиях.

Почему происходит такой разброс температур при манипуляциях с кристаллами? Объясняется это строением кристаллической решетки.
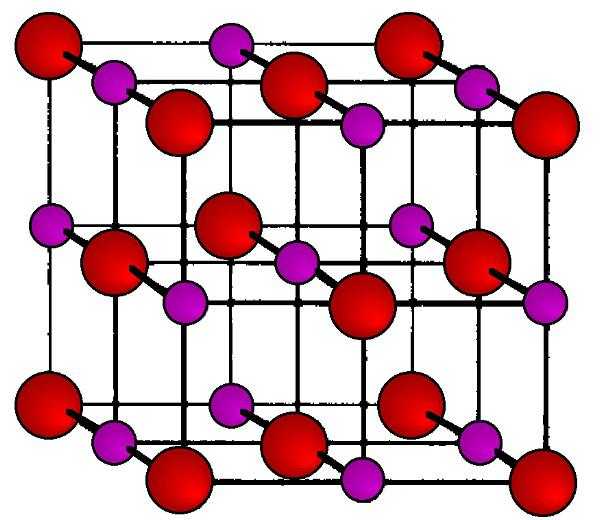
Кристаллическая решетка
Она представляет собой правильные гранецентрированные кубические прозрачные кристаллы. В каждом углу куба (узлах кристаллической решетки) находятся чередующиеся положительно заряженные ионы Na+ и отрицательно заряженные ионы CL-. Благодаря резко различающейся электроотрицательности этих атомов между ними возникает настолько сильное электростатическое притяжение, что для разрушения его необходимо приложить жесткие условия (высокую температуру, механическое воздействие). Такой тип кристаллической решетки носит название ионной, и он характерен для всех солей щелочных, щелочноземельных и переходных металлов.
Именно поэтому температура поваренной соли (как для плавления, так и для кипения) настолько высока. Однако можно получить кристаллы не только кубической формы, но и пирамидальной (восьми-, двенадцати- и двадцатигранной). Для этого необходимо просто регулировать температуру выпаривания соленого раствора определенным образом. В любом случае внутренняя полость кристаллов остается заполнена жидкостью, если речь идет о растворе соли в воде.
Химическая формула хлористого натрия проста и выражается элементным составом NaCL.
Физические свойства галита
Физические свойства хлорида натрия можно описать несколькими пунктами:
- Твердые кристаллы белого, розового, голубого, фиолетового, красного цвета. Окраска зависит от наличия примесей при добыче. Чистое вещество кристально белого цвета.
- Растворяется в воде в соотношении примерно 100/30 (в 100 г воды 30 г соли). Хорошая растворимость объясняется присутствием диполей воды, которые ассоциируют вокруг себя ионы натрия и хлора, вызывая разрушение электростатического притяжения между ними и, как следствие, разрушение кристаллической решетки.
- Плавится и закипает при высоких температурах (800-1400оС).
- Имеет едва уловимый приятный запах.
- Соленый на вкус.

Химические свойства хлористого натрия
Как и любая растворимая средняя соль, хлористый натрий способен вступать во взаимодействия с:
- Другими солями по реакции обмена (обязательное условие: реакции выделения газа, выпадения осадка или образования малодиссоциируемого вещества): NaCL + AgNO3 = NaNO3 + AgCL (белый творожистый осадок). Это качественная реакция на ион CL-.
- С металлами, стоящими в ЭХРНМ левее натрия: К + NaCL = KCL + Na.
- Диссоциирует в водном растворе на свободные гидратированные диполями воды ионы: NaCL (водный р-р) = Na+ + CL-. В результате образуется раствор поваренной соли, который является сильным электролитом.
- Гидролизу не подвергается, так как является солью, образованной сильной кислотой и сильным основанием.
- При электролизе (действие электрического тока) разлагается с образованием свободных продуктов и едкого натра (каустика): NaCL = Na + Cl2 + NaOH.
Где в природе содержится хлорид натрия?
В настоящее время поваренная соль - вещество, часто встречаемое в природе. И хотя так было всегда, но в древние времена и времена средневековья она считалась очень дорогим продуктом. Все это от того, что не знали способов добычи соли из природных источников. А таких источников в мировых запасах очень много - галит считается почти неограниченным природным ресурсом. Где же соль находится в природе?
- Моря и океаны с соленой водой.
- Соленые озера.
- Соленые источники.
- Подземные воды.
- Воды лиманов.

Добыча галита
Извлечение и переработка соли имеют свою технологию, поскольку просто добытое вещество чаще всего к употреблению непригодно из-за высокого содержания посторонних примесей. Добывают галит по-разному, например:
- путем подземных работ;
- из пластов на дне соляных водоемов;
- выпариванием или вымораживаем соленой морской или океанской воды;
- выпариванием подземных вод.
Любой из способов дает возможность получить кристаллы галита. Однако для употребления в пищу они должны пройти еще один вид обработки - измельчение. Ведь вряд ли кто-то использует дома при приготовлении пищи крупный кристалл поваренной соли. Чаще всего ее приобретают в уже очищенном от примесей, измельченном практически в порошок виде. Также существуют виды соли йодированной, фторированной и так далее не только для пищевых, но и технических целей.
Применение каменной соли
Области применения и использования хлорида натрия весьма обширны. Основные из них вместе с примерами и результатами приведены в таблице.
| Отрасль промышленности | Основа использования соли | Результат |
| Ландшафтное строительство | Смягчение грунта при низких температурах и устранение утечки воды | Построение оросительных каналов и водоемов |
| Медицина | Сходство раствора соли с кровью человека. Кровезаменяющий раствор хлорида натрия (0,85%), называемый физиологическим | Восстановление кровяного баланса после обширных кровепотерь, нормализация работы натрие-калиевого насоса в сердечно-сосудистой системе, поддержание постоянства состава желудочного сока |
| Химическая | Синтезы практически значимых веществ на основе сырья хлористого натрия | Получают: гидрокарбонат натрия, соляную кислоту, металлический натрий, хлор, гидроксид натрия, стекло, пластмассы, мыло, бумагу и другие продукты |
| Пищевая | Антисептическое и антибактериальное действие соли | Консервирование продуктов (мясо, рыба, овощи), улучшение вкусовых качеств пищи |
| Металлургическая | Физические и химические свойства соли | Получение алюминия, солевых батареек, фильтров |
| Кожевенная | Антисептическое и антибактериальное действие соли | Обработка меха и сыромятной кожи при дублении |
История появления в быту
Соль появилась на столах в каждом доме далеко не сразу. Когда-то она ценилась на вес золота, причем в самом прямом смысле. Еще в XVIII веке некоторые народы Африки обменивали горсть соли на горсть золотого песка. Чуть позже в Эфиопии брусочки соли были стандартной валютой. В Древнем Риме военным легионерам даже месячное жалованье выдавали этим веществом, что со временем привело к называнию их солдатами. Дети бедных африканских народов просто лизали каменные куски повареной соли как лакомство. В Голландии она использовалась для наказания преступников, для пытки. Провинившемуся вообще не давали соль, и человек за короткое время умирал.
Впервые выделять и потреблять в пищу это вещество люди научились еще в древности. Тогда было обнаружено, что соль содержится в растениях. Поэтому их сжигали, а золу использовали как приправу. Позже в Китае научились выпаривать соль из морской воды, и процесс развития методов ее получения начал продвигаться быстрее.

На Руси соль добывали из озер (самые знаменитые соленые озера России до сих пор - Эльтон и Баскунчак). Тогда промысловое значение вещества являлось очень редким явлением. Добывали его только немногие купцы, которые затем продавали втридорога. Позволить себе иметь соль могли только богатые и знаменитые люди. Со временем производство и добыча наладились. Стали использоваться разные способы добычи и обработки, и на сегодняшний день одно из самых распространенных бытовых веществ - поваренная соль. Химия этого соединения, свойства, применение в медицине и других отраслях стали известны примерно с XVI-XVII веков.
Изучение в школьном курсе
Изучение структуры и агрегатного состояния, а также химических свойств поваренной соли начинается со школьной скамьи, в рамках такой дисциплины, как химия (8 класс). Соли в школьном курсе исследуются во всем их многообразии в природе. Ученики получают представление о химической основе, эмпирических формулах, основных физических и химических свойствах. Для простоты и удобства запоминания формул и физических свойств на форзаце учебника обычно располагаются соли, таблица которых дает представление об их растворимости в воде. Там же можно найти информацию о растворимости кислот, щелочей и оснований.

Важной характеристикой солей является их плавкость, на основе которой также построена их добыча в природе. Учащимся легко сориентироваться при решении задач на плавкость соли. Таблица и графические изображения позволяют не только увидеть, легкоплавко вещество или тугоплавко, но и определить примерную температуру плавления и кипения. Обычно такие таблицы также располагаются в учебниках ("Химия", 8 класс). Соли должны изучаться в контексте таких наук, как биология и физика. Поэтому множество задач для учащихся построено именно на интеграции межпредметных связей.
fb.ru
кислые соли
Кислые соли — это соли, которые образуются при неполном замещении атомов водорода в молекулах кислот атомамиметаллов.Они содержат в своём составе два вида катионов: катион металла (или аммония) и катион водорода, и многозарядный анион кислотного остатка. Катион водорода даёт к названию соли приставку «гидро», например, гидрокарбонат натрия. Такие соли диссоциируют в водных растворах на катионы металлов, катионы водорода и анионы кислотных остатков. Они образуются при избытке кислоты и содержат в своём составе атомы водорода. Кислые соли образуются только многоосновными кислотами и проявляют свойства как солей, так и кислот. Кислые соли сильных кислот (гидросульфаты, дигидрофосфаты) при гидролизе дают кислую реакцию среды (с чем и связано их название). В то же время растворы кислых солей слабых кислот (гидрокарбонаты, тартраты) могут обладать нейтральной или щелочной реакцией среды.
| Содержание |
Физические свойства
Кислые соли – твёрдые кристаллические вещества, обладающие различной растворимостью, и характеризующиеся высокими температурами плавления. Окраска солей зависит от металла, входящего в их состав.
Химические свойства
1. Кислые соли реагируют с металлами, стоящими в ряду стандартных электродных потенциалов (ряд Бекетова) левее атома водорода:
2KНSO4 + Mg = h3 + MgSO4 + K2SO4,
2NaHCO3 + Fe = h3 + Na2CO3 + Fe2(CO3)3
Так как эти реакции протекают в водных растворах, для опытов нельзя применять такие металлы как литий, натрий, калий, барий и другие активные металлы, которые при обычных условиях реагируют с водой.
2. Кислые соли реагируют с кислотами, в случае если образующаяся в результате реакции кислота более слабая или летучая, чем кислота, вступающая в реакцию:
NaHCO3 + HCl = NaCl + h3O + CO2
Для проведения таких реакций обычно берут сухую соль и действуют на нее концентрированной кислотой.
3. Кислые соли реагируют с водными растворами щелочей c образованием средней соли и воды:
1) Ba(HCO3)2 + Ba(OH)2 = 2BaCO3 + 2h3O
2) 2KHSO4 + 2NaOH = 2h3O + K2SO4 + Na2SO4,
3) NaHCO3 + NaOH = h3O + Na2CO3
Такие реакции используют для получения средних солей. 4. Кислые соли реагируют с растворами солей, в случае, если в результате реакции выпадает осадок, выделяется газ или образуется вода:
1) 2KHSO4 + MgCO3 = h3O + CO2 + K2SO4 + MgSO4,
2) 2KHSO4 + BaCl2 = BaSO4 + K2SO4 + 2HCl.
3) 2NaHCO3 + BaCl2 = BaCO3 + Na2CO3 + 2HCl
Указанные реакции используются, в том числе, для получения практически нерастворимых солей.
5. Некоторые кислые соли при нагревании разлагаются:
1) Ca(HCO3)2 = CaCO3 + CO2 + h3O
2) 2NaHCO3 = CO2 + h3O + Na2CO3
6. Кислые соли реагируют с основными оксидами с образованием воды и средних солей:
1) 2KHSO4 + MgO = h3O + MgSO4 + K2SO4,
2) 2NaHCO3 + CuO = h3O + CuCO3 + Na2CO3
7. При гидролизе кислые соли распадаются на катионы металла и кислые анионы: КHSO4 → К+ + НSO4–
Образующиеся кислые анионы, в свою очередь, обратимо диссоциируют: HSO4– → H+ + SO42–
Получение
Кислые соли образуются при воздействии избытка кислоты на щелочь. В зависимости от количества молей кислоты (в данном случае — ортофосфорной) могут образовываться дигидроортофосфаты (1) и гидроортофосфаты (2):
Ba(OH)2 + 2h4PO4 → Ba(h3PO4)2 + 2h3O
Ba(OH)2 + h4PO4 → BaHPO4 + 2h3O
При получении кислых солей важны молярные соотношения исходных веществ. Например, при молярном соотношении NaOH и h3SO4 2:1 образуется средняя соль:
2NaOH + h3SO4 = Na2SO4 + 2h3O А при соотношении 1:1 - кислая: NaOH + h3SO4 = NaHSO4 + h3O
1. Кислые соли образуются в результате взаимодействия растворов кислот с металлами, стоящими в ряду активности металлов левее водорода:
Zn + 2h3SO4 = h3 + Zn(HSO4)2,
2. Кислые соли образуются в результате взаимодействия кислот с основными оксидами:
1) CaO + h4PO4 = CaHPO4+ h3O,
2) CuO + 2h3SO4 = Cu(HSO4)2 + h3O
3. Кислые соли образуются в результате взаимодействия кислот с основаниями (реакция нейтрализации):
1) NaOH + h3SO4 = NaHSO4 + h3O
2) h3SO4 + KOH = KHSO4 + h3O
3) Mg(OH)2 + 2h3SO4 = Mg(HSO4)2 + 2h3O
В зависимости от соотношений концентраций кислот и оснований, участвующих в реакциях нейтрализации, можно получать средние, кислые и основные соли.
4. Кислые соли можно получить в результате взаимодействия кислот и средних солей:
Ca3(PO4)2 + h4PO4 = 3CaHPO4
5. Кислые соли образуются в результате взаимодействия оснований с избытком кислотного оксида:
Ca(OH)2 + 2CO2 = Ca(HCO3)2
studfiles.net
Теплофизические свойства, теплопроводность поваренной соли
Что такое поваренная соль? Ее характеристика и запасы представляют интерес для школьников, планирующих связать свою будущую профессию с физикой и химией. Именно это вещество называют самым распространенным в природе. Каков ее состав? Соль поваренная состоит из атомов натрия и хлора. С химической точки зрения это типичная средняя соль.

Распространенность в природе
Данный минерал в своем составе может иметь некоторые примеси. Например, соединения железа придают веществу красные оттенки. В природе галит встречается в виде прочных тонкозернистых масс, в небольших количествах поваренная соль находится в виде кубических кристаллов.
Рассматривая главные свойства поваренной соли, выделим хорошую растворимость данного соединения в воде. Именно поэтому пласты соли не выходят на поверхность, добычу осуществляют шахтным методом. Галит является основным солевым компонентом морей и океанов, кроме того, высоко содержание хлорида натрия в подземных минеральных водах и соляных озерах. Где еще можно обнаружить такой состав? Соль поваренная входит в состав осадочных пород. К примеру, такие пласты найдены в большом количестве в Канаде и Америке.
Помимо непосредственного употребления в пищу, поваренная соль является сырьем для производства соляной кислоты и иных веществ.

Варианты образования
Поваренная соль, электро и теплопроводность которой имеет высокие показатели, образуется при просачивании соленой воды через песок. После испарения воды осажденная соль накапливается в песке, постепенно образуя огромные соленосные пласты.
Растворимость галита почти не зависит от температуры, поэтому наблюдается пресыщение раствора, появляются огромные соляные залежи. Ученым удалось посчитать, что при внезапном испарении воды в морях и океанах из оставшейся соли можно было бы построить стену толщиной в 1 метр, высотой 280 метров, которая смогла бы полностью опоясать по экватору нашу планету.

Виды залежей
В зависимости от того, каковы условия залегания поваренной соли, выделяют ее разновидности:
- каменная соль, находящаяся между пластами в твердом состоянии;
- самосадочная порода, которая формируется в виде пластов на дне замкнутых бассейнов;
- вулканическая соль;
- выцветы.

Способы добычи и переработки минерала
В результате подземных разработок получают каменную соль. При выпаривании подземных вод получают выварочную соль.
Среди экзотических вариантов добычи этого полезного ископаемого отметим осаждение при низких температурах соль из подземных источников в Якутии. Самым дешевым способом переработки является использование самосадочных технологических процессов.
Теплопроводность поваренной соли зависит от ее сорта, влажности, температуры окружающей среды. Данное вещество является отличным сырьем для химической промышленности. Путем электролиза ее расплава получают газообразный хлор и металлический натрий. В случае проведения электролиза раствора одним из продуктов реакции является гидроксид натрия (щелочь).
Хлорид натрия является основным компонентом не только морской воды, но и сыворотки крови. Это вещество необходимо для дыхания и полноценного усвоения пищи. Без галита, не вырабатываемого организмом человека, не происходит процесс переноса кислорода и питательных веществ, передача импульсов, функционирование мускулов, включая и сердечную мышцу. Взрослый организм содержит около 250 граммов этого вещества, расходующегося на разнообразные физиологические процессы.
Именно соль многие ученые считают натуральным антидепрессантом, повышающим настроение. В случае недостатка хлорида натрия у человека развивается депрессия, психические и нервные заболевания, проблема с пищеварительной и сердечно-сосудистой системами, анорексия, мышечные судороги. Переизбыток соли грозит повышением артериального давления, проблемами с почками. Поваренная соль может стать для организма смертельным ядом!

Физические свойства
Каковы ее теплофизические свойства? Теплопроводность поваренной соли снижается при впитывании воды. Соль не обладает запахом, температура плавления составляет 801°C. По шкале Мооса твердость галита составляет 2-2,5.
Теплопроводность поваренной соли объясняет ее основные физические свойства: плотность, точку кипения. Хлорид натрия имеет различные оттенки, связанные с примесями, входящими в состав природного минерала.
Так как между катионами натрия и анионами хлора образуется ионная кристаллическая решетка, у вещества достаточно высокий показатель температуры кипения и плавления.
Теплопроводность поваренной соли объясняется наличием в молекулах ионной кристаллической решетки. Силы притяжения частиц по разным направлениям распространяются одинаково, ионы прочно связаны между собой. При нагревании хлорида натрия до его температуры плавления происходит полное разрушение структуры кристалла, из твердого состояния образуется жидкость.
Практическое значение имеет не только теплопроводность поваренной соли, но и электрическая проводимость этого вещества.

Химические свойства
Как характеризует галит химия? Физические свойства вещества соли каковы? Это твердое вещество и проводник тока и тепла. А с какими простыми и сложными веществами он может взаимодействовать?
Путем взаимодействия хлорида натрия с концентрированной серной кислотой получают хлороводород, который применяется в химической промышленности.
Качественной реакцией на хлорид-ионы является взаимодействие с солями серебра. Продуктом взаимодействия является белый осадок хлорида серебра.
Смешивание растворов поваренной соли и сульфата меди (2) приводит к образованию комплексного соединения – тетрахлоркупрата натри, имеющего зеленую окраску.
Получение
Как можно получить хлорид натрия? Поваренная соль, теплопроводность растворов которой имеет высокие показатели, в достаточном количестве распространена в природе. Именно поэтому нет смысла в разработке промышленных и лабораторных способов получения данного соединения. Например, можно получить хлорид натрия путем синтеза простых веществ: хлора и натрия.

Области применения
В современной кулинарии и пищевой отрасли применяют хлорид натрия, который имеет чистоту не менее 97 процентов. Данное вещество выступает в качестве вкусовой добавки, а также в виде вещества, необходимого для консервирования продуктов питания. У него товарное название – поваренная соль. В зависимости от того, каково ее происхождение, выделяют морскую, каменную, фторированную, йодированную соль. В поваренной соли в незначительном количестве присутствуют соединения кальция, калия, магния, придающие ей жесткость и гигроскопичность.
В зависимости от процентного содержания хлорида натрия, выделяют несколько сортов:
- «экстра» при содержании в количестве более 99,5%;
- первый сорт – 97,5%;
- высший – 98,2%;
- второй – 97%.
У хлорида натрия есть незначительные антисептические свойства, поэтому 10-15 процентным раствором соли можно избежать размножения разнообразных гнилостных болезней. Это свойство объясняет применение хлорида натрия в качестве консерванта.
0,9%-ный раствор хлорида натрия используют в медицине в виде дезинтоксикационного средства, которое корректирует при обезвоживании работу систем человеческого организма.
10%-ный раствор данного вещества применяют в качестве осмотического диуретика, незаменимого в случае отека головного мозга, а также при кровотечениях. Именно этим раствором обрабатывают гнойные раны, а в офтальмологии его используют как противоотечный препарат.
В зимнее время смесь хлорида натрия, глины, песка (техническую соль) применяют как антифриз. Этим составом посыпают тротуары, чтобы бороться с гололедом. Безусловно, данная смесь негативно отражается на состоянии обуви, автомобильного транспорта.
Для умягчения воды применяют натрий-катионитовые фильтры. Для их регенерации применяют 6-10%-ный раствор поваренной соли.
В заключение
Поваренную соль стали использовать для консервирования рыбных и мясных продуктов примерно тысячу лет назад. Солонина запасалась, в основном, для корабельной кухни. В Голландии вели засол селедки, в Англии занимались производством бекона. В X-XII веках славяне стали применять соль для защиты продуктов от гнилостных микроорганизмов.
Помимо пищевой отрасли, хлорид натрия применяют в черной, а также цветной металлургии, при обработке металлов, в машиностроении, при выделке мехов, для производства охлаждающих растворов.
Большая часть добываемой поваренной соли поступает в химическую промышленность, где она идет на производство каустической соды (гидроксида натрия) и хлора. Среди отраслей использования этого минерала и изготовление удобрений, а также реагентов для окрашивания тканей и производства мыла.
Никто точно не может сказать, когда впервые человек стал добавлять соль в свою повседневную еду. В настоящее время трудно представить себе те далекие времена, когда поваренная соль была неизвестна человечеству.
По мере развития цивилизации изменялись и совершенствовались способы добычи хлорида натрия, изучались физические и химические свойства данного соединения. Надеемся, что статья оказалась интересной и полезной для вас!
fb.ru





















