Вода в трех агрегатных состояниях. Агрегатное свойство воды
Агрегатные состояния воды - Вода
Облака, дождь, снег, лед, град, роса, иней туман … все это, хорошо известные нам с раннего детства, разные агрегатные состояния воды.
С разными агрегатными состояниями воды мы ежедневно встречаемся в нашей жизни, они являются важным фактором, влияющим на всю жизнедеятельность человека.
Состояния воды
В природе в естественных условиях вода может существовать в трех основных агрегатных состояниях:
- Твердое состояние – лед, снег … ;
- Жидкое – вода, дождь, туман, роса …;
- Газообразное – пар …
К выше сказанному, важно уточнить, что туман и облака, на самом деле, не являются газообразным состоянием воды. Они являются результатом конденсации водяного пара, а не самим паром как таковым. Подробнее про Водяной пар читайте в статье “Водяной пар — газообразное состояние воды”.
Уникальное свойство воды – возможность быть в природных условиях в трех разных базовых агрегатных состояниях, обеспечивает нашей планете жизненно важный процесс – гидрологический цикл или круговорот воды в природе, который состоит, если кратко, из осадков, испарения и конденсации. Круговорот воды в природе обеспечивает ее присутствие практически во всех уголках нашей планеты, а вода, как известно, источник жизни.
Изменение агрегатных состояний воды
Процессы перехода воды с одного агрегатного состояния в другое определяются следующим образом:
- Кипение и парообразование — переход воды из жидкого состояния в пар;
- Конденсация — процесс перехода пара в жидкое состояние воды;
- Кристаллизация — переход жидкости в лед;
- Плавление – переход льда в жидкость;
- Сублимация – переход льда прямо в парообразное состояние;
- Десублимация – переход пара сразу в лед, примером может служить иней.
 Граничные точки перехода воды в состояния лед/вода и вода/пар определили соответственно как 0 и 100 градусов по Цельсию при условии атмосферного давления 760 мм рт. ст. или 101 325 Па. Всем с детства хорошо известна простая примета, температура за окном опустилась ниже нуля, ждите снега :)
Граничные точки перехода воды в состояния лед/вода и вода/пар определили соответственно как 0 и 100 градусов по Цельсию при условии атмосферного давления 760 мм рт. ст. или 101 325 Па. Всем с детства хорошо известна простая примета, температура за окном опустилась ниже нуля, ждите снега :)
Необходимо отметить такой, важный для человека факт – при понижении атмосферного давления температура кипения падает. Это необходимо учитывать, например, в условиях высокогорья. Отметим также еще одно явление, которое полезно знать человеку в повседневной жизни – объем воды в твердом состоянии больше чем в жидком. Этот факт иллюстрирует общеизвестный пример – бутылка с водой оставленная на морозе будет разорвана, образовавшимся в ней льдом.
Очевидно, что в разных своих агрегатных состояниях Вода обладает разными базовыми физическими свойствами такими как – текучесть, твердость, летучесть.
Необходимо отметить, что пар определяет такой важный для человека и других живых организмов параметр как “влажность воздуха”. Влажность воздуха напрямую зависит от количества водяного пара в атмосфере, больше пара выше влажность. На земле существуют места как с очень высокой, так и с низкой влажностью атмосферы. Одним из самых влажных мест планеты считается индийский город Черрапунджи (Cherrapunji), а одним из самых сухих Сухие долины в Антарктике.
Еще раз сделаем акцент на том, что во многом благодаря именно способности воды находиться в природных естественных условиях в трех разных агрегатных состояниях и существует жизнь на нашей планете.
Агрегатные состояния воды
Июл 5, 2014 22:28 Watermanvodamama.com
11 агрегатное состояние воды
меня очень интересует то как получили 11 агрегатное состояние воды.
Уважаемый karungold!
Все вещества в природе согласно законам термодинамики могут существовать в трех агрегатных состояниях - твердом, жидком и газообразном. Вода в свою очередь может существовать в виде жидкости, пара и льда. Лёд в свою очередь имеет 14 модификаций, большинство которых, однако, получены в условиях, близких к космическим. Переходы между ними сопровождаются скачкообразным изменением ряда физических свойств (плотности, теплопроводности и др.).
Четвертым агрегатным состоянием вещества часто считают плазму, хотя к воде плазма не имеет никакого отношения. Термин плазма (от греч. πλάσμα «вылепленное», «оформленное») был введен в 1929 году американскими учеными И. Ленгмюром и Л. Тонксом, возможно из-за ассоциации с плазмой крови, что по-сути не верно.. В физическом смысле плазма и есть четвёртое агрегатное состояние вещества.
От обычного газа плазма отличается тем, что в ней наблюдается одновременное взаимодействие большого числа частиц. Кроме того, влияние электрических и магнитных полей на плазму приводит к появлению в ней пространственных зарядов и токов. В состоянии плазмы находится подавляющая часть вещества вселенной: звезды, галактические туманности, межзвездная среда. Около Земли плазма существует в виде солнечного ветра.
Плазма - частично или полностью ионизированный газ, который образуется в результате термической ионизации атомов и молекул при высоких температурах, под действием электромагнитных полей большой напряженности, при облучении газа потоками заряженных частиц высокой энергии.
Рис. Плазма
В лабораторных условиях плазма образуется в электрическом разряде в газе, в процессах горения и взрыва. Когда луч лазера сфокусировали линзой, в воздухе в области фокуса вспыхнула искра и там образовалась плазма.
Плазма может быть как квазинейтральной, так и неквазинейтральной. Слово «ионизированный» означает, что от значительной части атомов или молекул отделён по крайней мере один электрон. Слово «квазинейтральный» означает, что, несмотря на наличие свободных зарядов (электронов иионов), суммарный электрический заряд плазмы приблизительно равен нулю. Присутствие свободных электрических зарядов делает плазму проводящей средой, что обуславливает её заметно большее (по сравнению с другими агрегатными состояниями вещества) взаимодействие с магнитным и электрическим полями.
Переход вещества из одного агрегатного состояния в другое не приводит к изменению его состава, но сопровождается изменением его структуры.
Следует отметить, что такое разделение агрегатных состояний веществ не отражает внутреннее строение вещества, степень упорядоченности его частиц.
Существует ещё и так называемое жидкокристаллическое (мезоморфное) состояние вещества, свойства которого являются промежуточными между свойствами твердого кристалла и жидкости.
Рис. 1. Жидкие кристаллы
Например, некоторые вещества (стекла, смолы) обладают свойствами характерными и для твердых, и для очень вязких переохлажденных жидкостей. В частности, некоторые органические материалы переходят из твердого состояния в жидкое, испытывая ряд переходов, включающих образование новой фазы, которую называют жидкокристаллическим состоянием (жидким кристаллом).
Жидкие кристаллы — вещества, обладающие одновременно свойствами как жидкостей (текучесть), так и кристаллов (анизотропии). По структуре жидкие кристаллы представляют собой жидкости, похожие на желе, состоящие из молекул вытянутой формы, определённым образом упорядоченных во всем объёме этой жидкости. Наиболее характерным свойством ЖК является их способность изменять ориентацию молекул под воздействием электрических полей, что открывает широкие возможности для применения их в промышленности. По типу ЖК обычно разделяют на две большие группы: нематики и смектики. В свою очередь нематики подразделяются на собственно нематические и холестерические жидкие кристаллы.
В настоящее время появились гипотезы о существовании в воде весьма устойчивых образований по типу жидкокристаллических. Способность молекул воды образовывать определенные структуры, основана на наличии так называемых водородных связей. Эти связи не химической природы. Они легко разрушаются и быстро восстанавливаются, что делает структуру воды исключительно изменчивой. Именно благодаря этим связям в отдельных микрообъемах воды непрерывно возникают своеобразные ассоциаты воды, её структурные элементы. Связь в таких ассоциатах называется водородной. Она является очень слабой, легко разрушаемой, в отличие от ковалентных связей, например, в структуре минералов или любых химических соединений.
Так, согласно гипотезе С.В. Зенина вода представляет собой иерархию правильных объемных структур, в основе которых лежит кристалло-подобный "квант воды", состоящий из 57 ее молекул, которые взаимодействуют друг с другом за счет свободных водородных связей. При этом 57 молекул воды (квантов), образуют структуру, напоминающую тетраэдр. Тетраэдр в свою очередь состоит из 4 додекаэдров (правильных 12-гранников). 16 квантов образуют структурный элемент, состоящий из 912 молекул воды. Вода на 80% состоит из таких элементов, 15% - кванты-тетраэдры и 3% - классические молекулы Н2О. Хаотически двигаются не отдельные молекулы Н2О, а структурные элементы. Отметим, что структура воды связана с платоновыми телами (тетраэдр, додекаэдр), форма которых связана с золотой пропорцией. Ядро кислорода также имеет форму платонова тела (тетраэдра).
Такая структура энергетически выгодна и разрушается с освобождением свободных молекул воды лишь при высоких концентрациях спиртов и подобных им растворителей [Зенин, 1994]. "Кванты воды" могут взаимодействовать друг с другом за счет свободных водородных связей, торчащих наружу из вершин “кванта” своими гранями. При этом возможно образование уже двух типов структур второго порядка. Их взаимодействие друг с другом приводит к появлению структур высшего порядка. Последние состоят из 912 молекул воды, которые по модели Зенина практически не способны к взаимодействию за счет образования водородных связей. Этим и объясняется, например, высокая текучесть жидкости, состоящей из громадных полимеров. Таким образом, водная среда представляет собой как бы иерархически организованный жидкий кристалл. Изменение положения одного структурного элемента в этом кристалле под действием любого внешнего фактора или изменение ориентации окружающих элементов под влиянием добавляемых веществ обеспечивает, согласно гипотезе Зенина, высокую чувствительность информационной системы воды. Если степень возмущения структурных элементов недостаточна для перестройки всей структуры воды в данном объеме, то после снятия возмущения система через 30-40 мин возвращается в исходное состояние. Если же перекодирование, т. е. переход к другому взаимному расположению структурных элементов воды оказывается энергетически выгодным, то в новом состоянии отражается кодирующее действие вызвавшего эту перестройку вещества [Зенин, 1994]. Такая модель позволяет Зенину объясненить "память воды" и ее информационные свойства [Зенин, 1997].
Интересно, что свободные, не связанные в ассоциаты молекулы воды присутствуют в воде лишь в очень небольшом количестве. В основном же вода – это совокупность беспорядочных ассоциатов и «водяных кристаллов», где количество связанных в водородные связи молекул может достигать сотен и даже тысяч единиц.
Рис. Ассоциат из шести молекул воды
«Водяные кристаллы» могут иметь самую разную форму, как пространственную, так и двухмерную (в виде кольцевых структур). В основе же всего лежит тетраэдр (простейшая пирамида в четыре угла). Именно такую форму имеют распределенные положительные и отрицательные заряды в молекуле воды. Группируясь, тетраэдры молекул h3O образуют разнообразные пространственные и плоскостные структуры. И из всего многообразия структур в природе базовой, судя по всему (пока лишь не точно доказанное предположение) является всего одна – гексагональная (шестигранная), когда шесть молекул воды (тетраэдров) объединяются в кольцо. Такой тип структуры характерен для льда, снега, талой воды, клеточной воды всех живых существ.
С уважением,К.х.н. О.В. Мосин
www.o8ode.ru
4 агрегатное состояние воды, вымысел или правда
Содержание статьи
Четвертое агрегатное состояние воды
У каждого вещества, которое существует в природе, имеется четвертое агрегатное состояние. Разогретое до невероятных температур вещество любого вида может перейти в плазму, но не вода. Пожалуй, это одно из тех веществ, которые отличаются по своей природе. Что же можно сделать с жидкостью, чтобы получить таинственное четвертое состояние, которое отличается от плазмы?
В поисках неизведанного
Так называемое таинственное состояние воды – это открытая много лет назад Дерягиным уникальная жидкость, которая по своим физическим свойствам похожа на любые другие вещества. То есть, когда температура опускается до 0 градусов и ниже, ее плотность падает. По сути, ее можно было бы назвать молекулярной водой, но это слишком серьезное упрощение, которое на самом деле не дает точного ответа на вопрос о том, почему происходит такое явление.
 Как же образуется дерягинская вода? Необычные природные явления натолкнули ученых на мысль о том, что существуют особые условия, при которых жидкость остается жидкостью даже при минусовой температуре. Что же для этого нужно было сделать в естественных условиях? Где-то в пределах Полярного круга (и даже чуть севернее) существует явление облачности на большой высоте. Если на средних широтах и южнее облака не поднимаются выше 10 километров, тогда как на севере серебристые облака находятся выше 80 километров. Это очень высоко, но ведь тогда получается, что вода может существовать и при отрицательных температурах.
Как же образуется дерягинская вода? Необычные природные явления натолкнули ученых на мысль о том, что существуют особые условия, при которых жидкость остается жидкостью даже при минусовой температуре. Что же для этого нужно было сделать в естественных условиях? Где-то в пределах Полярного круга (и даже чуть севернее) существует явление облачности на большой высоте. Если на средних широтах и южнее облака не поднимаются выше 10 километров, тогда как на севере серебристые облака находятся выше 80 километров. Это очень высоко, но ведь тогда получается, что вода может существовать и при отрицательных температурах.
Удивительная несостыковка
Откуда появился этот теоретический парадокс? Агрегатное состояние меняется при достижении водой температуры в 0 градусов. А облака, которые плавают на высоте 10 километров, все еще находятся в зоне положительной температуры. На высоте, где были обнаружены легкие серебристые облака, не существует даже зон с положительной температурой. Близость космического пространства и отдаленность от поверхности Земли, которая отражает тепло, усиливает отрицательные температуры. Причем облака – это не кристаллы льда, а капли воды, но настолько маленькие, что трудно сразу же сказать, в каком виде они находятся. И в итоге получается, что агрегатное состояние не меняется при низких температурах в верхних слоях атмосферы.
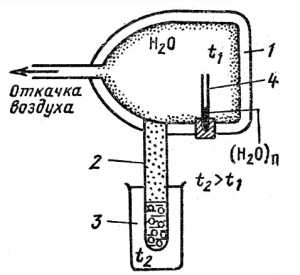 Необычное явление изучал Дерягин. Он проводил опыты в искусственно созданных условиях, поскольку в то время, когда он начал изучение, долететь до 80-километровой высоты было слишком накладно для изучения жидкости. Поэтому была использована камера Дюара. В ней располагался термометр, капилляр (очень тонкая трубка из стекла), а также большая основная камера. Это устройство работало следующим образом: при откачке воздуха температура падала, образовывался конденсат, а та его часть, которая оседала в капилляре, представляла собой воду второго типа, дерягинскую воду. То есть, то самое четвертое состояние.
Необычное явление изучал Дерягин. Он проводил опыты в искусственно созданных условиях, поскольку в то время, когда он начал изучение, долететь до 80-километровой высоты было слишком накладно для изучения жидкости. Поэтому была использована камера Дюара. В ней располагался термометр, капилляр (очень тонкая трубка из стекла), а также большая основная камера. Это устройство работало следующим образом: при откачке воздуха температура падала, образовывался конденсат, а та его часть, которая оседала в капилляре, представляла собой воду второго типа, дерягинскую воду. То есть, то самое четвертое состояние.
Изменение плотности
 В итоге получилось, что состояние новой воды, полученной в лаборатории, отличается по своим физическим параметрам от обычной жидкости. И график, показывающий изменение плотности в зависимости от температуры, больше не выглядел, как гипербола. Это была классическая прямая линия, которая пересекала график строго в точке (0; 0). Таким образом, новая вода могла существовать при минусовой температуре, не переходя в лед. Но можно ли получить не только капли, но и полноценную жидкость?
В итоге получилось, что состояние новой воды, полученной в лаборатории, отличается по своим физическим параметрам от обычной жидкости. И график, показывающий изменение плотности в зависимости от температуры, больше не выглядел, как гипербола. Это была классическая прямая линия, которая пересекала график строго в точке (0; 0). Таким образом, новая вода могла существовать при минусовой температуре, не переходя в лед. Но можно ли получить не только капли, но и полноценную жидкость?
Впоследствии, когда опыты Дерягина были свернуты, работами занимались как отечественные, так и зарубежные ученые, которые в разной степени смогли продвинуться в исследованиях капиллярной жидкости. Но самое главное, новый тип жидкости, был открыт.
Вконтакте
Google+
voday.ru
Вода в трех агрегатных состояниях
«Вода! У тебя нет ни вкуса, ни цвета, ни запаха, тебя невозможно описать, тобой наслаждаются, не ведая, что ты такое! Нельзя сказать, что ты необходима для жизни, ты – сама жизнь. Ты наполняешь нас невыразимой радостью
Ты – самое большое богатство на свете».
Антуан де Сент-Экзюпери.
Никого не удивляет дождь или падающий снег, гладь плавно текущей реки или озера. Другое дело – огромные просторы морей и океанов, гигантские ледники, сползающие с заоблачных высот, струи гейзеров, подобно фонтанам бьющие из-под земли. От этих красот дух захватывает. Но редко кто задумывается над тем, откуда взялись моря или реки, дождь или снег, каковы свойства воды, предстающей в таком разнообразном виде.
В истории нашей планеты вода имеет исключительно важное значение. Пожалуй, никакое другое вещество не может сравниться с водой по своему влиянию на ход тех величайших изменений, которые претерпела Земля за многие сотни миллионов лет своего существования.
Благодаря повседневному обращению с водой мы так привыкли к ней и к ее разнообразным проявлениям в природе, что часто не замечаем целого ряда ее отличительных свойств. А ведь именно этим свойствам мы обязаны тем, что наши озера и реки не промерзают зимой до дна, что сильные весенние паводки сравнительно редки, что, замерзая, вода может производить большие разрушения и т. д.
Вода – самая загадочная жидкость на Земле. Певцы древних степных народов – акыны и ашуги – издавна воспевали ее, поэты посвящали ей удивительные строки. Древние волхвы, жрецы и прочие кудесники умели управляться с водой, совершая на глазах людей настоящие чудеса. Например, вызывали проливные дожди или исцеляли «живой» водой. В России не было, пожалуй, ни одной деревни, чтобы в ней не жила бабка, умевшая заговаривать воду и таким образом исцелять болезни. А ученые по сей день, как и сотни лет назад, не могут дать ответа на вопрос: что такое вода?
Вода бывает разной - она может быть талая, родниковая, тяжелая, магнитная, «живая и мертвая», «Крещенская – святая вода». В настоящее время русским и зарубежным ученым известны свыше 175 природных и созданных изотопных разновидностей воды и более 200 видов льда. Русские ученые установили, что вода имеет неискаженную внутреннюю геометрическую форму и способна записывать, хранить и передавать различную информацию внутри организма человека и других живых существ.
Знания о воде не могут оставить человека равнодушным. Кроме того, все более большое влияние оказывает она на человеческую жизнь. Именно эти обстоятельства заставили начать работу над сбором информации по этому вопросу. В основе работы будет заложено:
➢ Анализ физических, химических и биологических свойств воды.
➢ Систематизация данных, полученных из различных источников средств массовой информации.
➢ Проведение в бытовых условиях эксперимента, направленного на установление ложности или истинности предположения о наличии «памяти» у данной структуры.
➢ Общие выводы работы по выбранной теме.
Прежде всего, определимся, что же такое вода. Четкого определения нет. С химической точки зрения, вода – структурированное вещество, состоящее из 2 атомов водорода и 1 – кислорода. С физической же – вещество, существующее в природе в трех агрегатных состояниях, обладающее соответствующими физическими свойствами.
Формулу воды знает, наверное, каждый: h3O. Графическое же изображение выглядит именно так. Путем разложения воды электрическим током удалось установить, что в воде по весу находится 11,11 % водорода и 88,89% кислорода, причем водорода выделяется из воды по объему в два раза больше, чем кислорода. Если оба эти выделившиеся газа смешать, то при комнатной температуре эта смесь может оставаться без изменения очень долго. Чтобы только 1/6 часть этой смеси превратилась в воду, нам пришлось бы ждать 54 миллиарда лет. Но стоит только поднести к этой смеси горящую спичку или пропустить через нее электрическую искру, как между водородом и кислородом моментально произойдет химическая реакция: водород сгорит в кислороде, и в результате получится вода.
Секрет состава воды ученым удалось раскрыть благодаря исследованиям компонентов атмосферного воздуха – кислорода, водорода и др. 24 июня 1783г. А. Лавуазье и П. Лаплас в присутствии группы своих коллег-ученых «сделали» воду из кислорода и водорода. Воду они получили как продукт сгорания водорода (а то, что в процессе горения участвует кислород – «огненный воздух», стало известно чуть раньше). При этом вес образовавшейся воды равнялся весу водорода и кислорода, участвовавших в реакции горения.
Вот так в один день стало ясно, что вода – не простой элемент, а сложное вещество. Но какой долгий и трудный путь вел к этому знаменательному дню, сколько огорчений, разочарований, ошибок и личных трагедий пережили естествоиспытатели, пока вода наконец-то раскрыла свою природу.
На вопрос: сколько нужно кислорода и водорода для образования воды, дал свой ответ в 1785г. А. Лавуазье и инженер Жан Мёнье. Они выяснили, что для ее образования необходимо соединить 2г водорода и 16г кислорода.
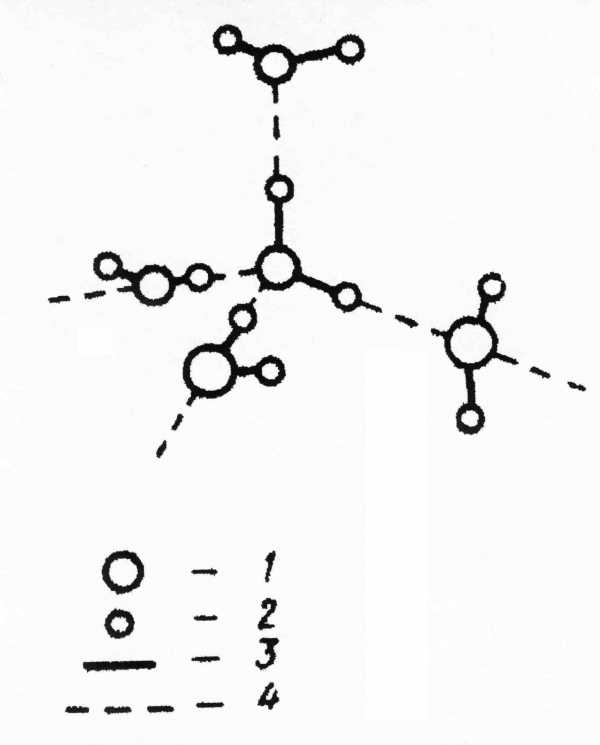
Также хорошо изучено и измерено взаимное расположение молекул ядер атомов водорода и кислорода и расстояние между ними. Расстояния между атомами водорода равно 154 десятимиллиардным долям сантиметра, а угол при вершине, в которой находится атом кислорода, составляет около 105 градусов. Оказалось, что молекула воды нелинейна, т. е. геометрически взаимное расположение зарядов в молекуле можно изобразить как простой тетраэдр.
Все молекулы воды с любым изотопным составом выглядят совершенно одинаково.
Но как же все-таки построены молекулы воды в воде? К сожалению, этот очень важный вопрос изучен еще недостаточно. Строение молекул в жидкой воде очень сложно. Когда лед плавится, его сетчатая структура частично сохраняется в образующейся воде. Молекулы в талой воде состоят из многих простых молекул – из агрегатов, сохраняющих свойства льда. При повышении температуры часть их распадается, их размеры становятся меньше.
Взаимное притяжение ведет к тому, что средний размер сложной молекулы воды в жидкой воде значительно превышает размеры одной молекулы воды. Такое необычайное молекулярное строение воды обусловливает ее необычайные физико-химические свойства.
Еще древнегреческий философ Фалес Милетский, живший две с половиной тысячи лет назад, обратил внимание на то, что вода – единственное вещество, которое в природе встречается в трех состояниях: твердом, жидком, газообразном . Оказывается, своим существованием сразу в трех состояниях вода обязана одному важному обстоятельству – тому, что Земля обращается вокруг Солнца на расстоянии в среднем 149,6 млн. км. Если это расстояние было бы менее 134 млн. км, то вода на планете испарилась бы, а больше 166 млн. км – превратилась бы в лед.
Любая вода, откуда бы она не была взята, - из Северного Ледовитого океана, из глубокой шахты Донбасса, была заключена в снежинке или сверкала ранним утром в капельке росы на цветке, - состоит из одинаково построенных молекул. Однако взаимное расположение отдельных молекул относительно друг друга в жидкой воде, снежинке или в паре из парового котла оказывается неодинаковым.
Пары воды, нагретые до трехсот градусов, при атмосферном давлении подобны обычным газам: в них расстояния между молекулами достаточно велики, так что каждая отдельная молекула может существовать более или менее самостоятельно, не испытывая существенного взаимодействия со стороны своих соседей, за исключением, конечно, тех случаев, когда молекулы в результате беспорядочного теплового движения сталкиваются друг с другом.
В снежинке или кусочке льда молекулы сближены и закреплены в определенных местах кристаллической решетки; движение молекул в большинстве своем ограничиваются колебанием около некоторых средних положений.
Еще раз повторим, что в науке еще нет строгой, твердо установленной теории, касающейся строения жидкостей, в частности воды. Предполагается, что жидкая вода по своему строению представляет нечто среднее между кристаллами льда и паром. Изучение строения воды с помощью инфракрасных и рентгеновых лучей дало возможность считать, что при температурах, близких к точке замерзания, молекулы жидкой воды собираются в небольшие группы и «упаковываются» в пространство приблизительно так, как в кристаллах, а при температурах, близких к точке кипения воды, при нормальном давлении, они располагаются более свободно, беспорядочно.
Вода – настолько необычное вещество, что все его свойства особенны и не подчиняются многим физико-химическим закономерностям, справедливым для других соединений. Проанализируем главные из них.
I. Температура кипения.
Температура кипения воды известна, наверное, каждому – она равна ста градусам выше нуля. Больше того, всем известно, что именно температура кипения воды при нормальном атмосферном давлении и выбрана в качестве одной из опорных точек температурной шкалы, условно обозначенной 100ºС. Однако поставим вопрос иначе: при какой температуре вода должна кипеть? Ведь температуры кипения различных веществ не случайны. Они зависят от положения элементов, входящих в состав их молекул, в периодической системе Менделеева.
Если сравнивать между собой одинаковые по составу химические соединения различных элементов, принадлежащих к одной и той же группе таблицы Менделеева, то легко заметить, что чем меньше атомный номер элемента, чем меньше его атомный вес, тем ниже температура кипения его соединений. Вода по химическому составу может быть названа гидридом кислорода. h3Te, h3Se и h3S – химические аналоги воды. Если проследить за температурами кипения и сопоставить, как изменяются температуры кипения гидридов в других группах периодической системы, то можно довольно точно определить температуру кипения любого гидрида, так же как и любого другого соединения. Сам Менделеев таким способом смог предсказать свойства химических соединений еще не открытых элементов.
Если же определить температуру кипения гидрида кислорода по положению его в периодической таблице, то окажется, что вода должна кипеть при -80ºС. Следовательно, вода кипит приблизительно на сто восемьдесят градусов выше, чем должна кипеть
Температура кипения – это наиболее обычное ее свойство – оказывается необычайным и удивительным.
II. Температура замерзания.
Вторая опорная точка термометра – температура замерзания воды равна нулю градусов. Это знает каждый. Но если опять же поставить вопрос чуть-чуть иначе: какова должна быть температура замерзания воды в соответствии с ее химической структурой, вода снова проявит свои необычайные свойства. Гидрид кислорода на основании его положения в таблице Менделеева должен был бы затвердевать при ста градусах ниже нуля .
III. Теплоемкость.
Климат на планете зависит и от другого свойства воды – очень большой теплоемкости, то есть способности отдавать и накапливать тепло. В одном литре воды можно запасти в 330 раз больше тепла, чем в таком же объеме воздуха. Вода медленнее нагревается, но зато долго сохраняет тепло. Поэтому летним вечером на море вода теплее, чем песок на берегу (теплоемкость песка в 5 раз ниже, чем воды).
А Мировой океан – своеобразная грелка для континентов. Его огромные запасы воды в прямом смысле слова «делают погоду» на Земле. Летом он не дает суше перегреться, а зимой постоянно «поставляет» ей тепло. Поэтому в странах, расположенных вблизи океана, мягкий морской климат, здесь не бывает ни суровой зимы, ни холодных ночей. Перепады температуры в разные сезоны здесь небольшие.
IV. Поверхностное натяжение.
Вода обладает еще одной особенностью – исключительно большим поверхностным натяжением. Молекулы воды на ее поверхности испытывают действие сил межмолекулярного притяжения только с одной стороны, а у воды это взаимодействие аномально велико. Поэтому каждая молекула на ее поверхности втягивается внутрь жидкости. В результате возникает сила, стягивающая поверхность жидкости. У воды она особенно велика: ее поверхностное натяжение составляет 72 мН/м (миллиньютона на метр).
Эта сила и придает мыльному пузырю, падающей капле и любому количеству жидкости в условиях невесомости форму шара. Она поднимает воду в почве, стенки тонких пор и отверстий в ней хорошо смачиваются водой. Вряд ли вообще было бы возможно земледелие, если бы вода не обладала этой исключительной особенностью.
V. Соленость.
Одно из самых важных свойств воды – соленость. В молекуле вещества центры положительных и отрицательных зарядов сильно смещены относительно друг друга. Поэтому вода обладает исключительно высоким, аномальным значением диэлектрической проницаемости. Для воды ع=80, а для воздуха и вакуума ع =1. Это значит, что два любых разноименных заряда в воде взаимно притягиваются друг к другу с силой, в 80 раз меньшей, чем в воздух. Ведь по закону Кулона: f= k*Q1*Q2 er2
Но все же межмолекулярные связи во всех телах, определяющие прочность тела, обусловлены взаимодействием между положительными зарядами атомных ядер и отрицательными электронами. На поверхности тела, погруженного в воду, силы, действующие между молекулами и атомами, ослабевают под влиянием воды почти в сотню раз. Если оставшаяся прочность связи между молекулами становится недостаточной, чтобы противостоять действию теплового движения, молекулы и атомы тела начинают отрываться от его поверхности и переходят в воду. Тело начинает растворяться, распадаясь либо на отдельные молекулы, как сахар в стакане чаю, либо на заряженные частицы – ионы, как поваренная соль.
Именно благодаря аномально высокой диэлектрической проницаемости вода – один из самых сильных растворителей. Она даже способна растворить любую горную породу на земной поверхности. Медленно и неотвратимо она разрушает даже граниты, выщелачивая из них легкорастворимые составные части.
Нет в природе такой прочной породы, которая могла бы сопротивляться всемогущему разрушителю – воде.
I. Общая характеристика льда.
Лед и снег – еще одно из трех агрегатных состояний воды, которое вновь и вновь поражает нас своей необычной красотой. Лед обладает таинственной кристаллической структурой. Его строение и прочность определяются прочностью водородных связей между отдельными молекулами воды. Водородная связь играет огромную роль в строении молекул биополимеров в тканях всех живых организмов. Это, быть может, имеет большое значение для жизни, так как следы структуры льда, по-видимому, долго сохраняются в талой воде.
В последние десятилетия начинает развиваться новая важная область знания – физика льда. Лед прочный, дешевый и хороший строительный материал. Из него строят жилища, склады, он создает природные надежные дороги, переправы, взлетно-посадочные полосы. Лед – причина стихийных бедствий. Он разрушает плотины, сносит мосты, сковывает грунт, вызывает обледенение самолетов и кораблей. Стало совершенно необходимо изучить все свойства льда, определить его механические, электрические, акустические, электромагнитные, радиационные характеристики.
Но сначала разберемся: много ли в наших, земных условиях видов льда? Оказалось, совсем немного – всего один. Это самый прекрасный из всех минералов. Из этого голубовато-зеленого камня сложены на Земле не только горы и колоссальные ледники, им покрыты целые материки.
В своих лабораториях человек сумел открыть еще, по крайней мере, шесть различных, не менее удивительных льдa.
Виды льда Давление Температура плавления
1. Обычный лед. До 208 МПа -22°
2. Лед - III Более 208 МПа -
3. Лед - II До 300 МПа -
4. Лед - V Более 500 МПа Выше 0°
5. Лед - VI 2 ГПа Более 80°
6. Лед - VII 3 ГПа 190°
Таблица №1.
Но существовать они могут только при очень высоких давлениях. Обычный лед сохраняется до давления 208 МПа (мегапаскалей), но при этом давлении он плавится при -22ºС. Если давление выше, чем 208 МПа, возникает плотный лед – лед III. Он тяжелее воды и тонет в ней. При более низкой температуре и большем давлении – до 300 МПа – образуется еще более плотный лед-II. Давление сверх 500 МПа превращает лед в лед-V. Этот лед можно нагреть до 0ºС и он не растает, хотя и находится под огромным давлением. При давлении около 2 ГПа (гигапаскалей) возникает лед-VI. Это буквально горячий лед – он выдерживает, не плавясь, температуру 80ºС. Лед-VII, найденный при давлении 3 ГПа, пожалуй, можно назвать раскаленным льдом. Это самый плотный и тугоплавкий из известных льдов. Он плавится только при 190ºС выше нуля.
II. Свойства льда:
1. Электрические. Лед оказался хорошим полупроводником. Причем его проводимость протонного типа. Установлено, что при замерзании воды на границе между льдом и водой возникает разность электрических потенциалов, достигающая десятков вольт.
2. Механические. В кристаллической решетке льда обнаружена подвижность молекул: они могут не только вращаться, но и перемещаться скачкообразно на сравнительно большие (в молекулярном масштабе) расстояния.
3. Акустические. При изучении процессов образования и поведения льдов в природе было установлено, что полярные льды в напряженном состоянии «кричат». Когда начинается деформация льда, то, как описывает Ф. Нансен, возникает легкий треск и стон, усиливаясь, они переходят через все роды тонов – лед то плачет, то стонет, то грохочет, то ревет, постепенно возрастая, сто «голос» становится подобным звучанию всех труб органа.
4. Тепловые. Гигантское количество тепла, освобождающееся при замерзании воды, задерживает наступление зимних холодов. Тепло, поглощаемое при таянии льдов, замедляет приход весны. С изменением массы льда на планете связаны изменения климата на Земле. Но точный расчет зависимости между погодой и колоссальной энергоемкостью этих глобальный процессов пока еще невозможен – слишком много в них неизвестного.
5. Радиационные. В старых записях сохранились предания о том, что иногда ледяные поля приобретают способность долго светиться в темноте, испуская слабый свет после того, как были освещены солнцем. Интересно было бы знать, верно ли это, когда и почему это явление происходит, чем объясняется. Есть наблюдения, что иногда светится и снег, если его при нескольких градусах мороза внести в темную комнату после освещения ярким солнцем. Рассказывают, что первые градины тоже светятся – они будто бы обладают электролюминесценцией.
III. Общая характеристика снежинок как формы льда.
В кристаллической решетке льда есть плоскости, в которых атомы кислорода расположены так, что образуют правильные шестиугольники. Наверное, с этим связана чаще всего встречающаяся шестилучевая форма изящных звездочек-снежинок.
Изумительная красота и бесконечное разнообразие форм снежинок вдохновили многих ученых на долголетние исследования этой удивительной загадки природы.
Были получены десятки тысяч фотографий снежинок в самых разнообразных условиях: и высоко в облаках, и у земли, и на Крайнем Севере, и на юге – всюду, где только может идти снег.
Кроме огромного множества самых разнообразных форм гексагональной симметрии, кроме шестигранников среди снежинок встречаются и пластиночки, и столбики, и игольчатые формы. Очень много различных форм снежинок обнаружили в природе ученые. Если быть очень точной, то, наверное, придется признать, что совершенно одинаковых снежинок не существует. В бесконечном многообразии каждая из них чем-нибудь да отличается по строению, по форме, по размеру.
Во время очень сильных морозов (при температуре ниже -30ºС) ледяные кристаллики выпадают в виде «алмазной пыли» - в этом случае на поверхности земли образуется слой очень пушистого снега, состоящего из тоненьких ледяных иголочек. Обычно же в процессе своего движения внутри ледяного облака ледяные кристаллики растут за счет непосредственного перехода водяного пара в твердую фазу. Как именно происходит этот рост, зависит от внешних условий, в частности от температуры и влажности воздуха. Характер зависимости ученые в общих чертах выявили, однако объяснить его пока не смогли.
В одних условиях ледяные шестигранники усиленно растут вдоль своей оси, и тогда образуются снежинки вытянутой формы – снежинки-столбики, снежинки-иглы. В других условиях шестигранники растут преимущественно в направлениях, перпендикулярных к их оси, и тогда образуются снежинки в виде шестиугольных пластинок или шестиугольных звездочек. К падающей снежинке может примерзнуть капелька воды – в результате образуются снежинки неправильной формы. Мы видим, таким образом, что распространенное мнение, будто снежинки обязательно имеют вид шестиугольных звездочек, является ошибочным. Формы снежинок оказываются весьма разнообразными. Существуют коллекции микрофотографий, насчитывающие более пяти тысяч снежинок, отличающихся по форме друг от друга. При определенных условиях (требуется, в частности, чтобы не было ветра) падающие снежинки сцепляются друг с другом, образуя огромные снежные хлопья. Хлопья могут быть диаметром до 10 см и даже больше.
I. Общие положения о газообразном состоянии воды. Насыщенный водяной пар.
Единственное газообразное состояние воды – пар. Сколько же существует видов пара? Столько же, сколько и вод. Водяные пары, различные по изотопному составу, обладают хотя и очень близкими, но все же различными свойствами: у них разная плотность, при одной и той же температуре они немного отличаются по упругости в насыщенном состоянии, у них чуть-чуть разные критические давления, разная скорость диффузии.
Попробуем разобраться в так называемом насыщенном водяном паре. Предположим, что мы находимся на берегу какого-нибудь водоема и глядим на поверхность воды. Она представляется нам спокойной. Но в действительности перед нами совершается великое множество микрособытий, недоступных нашему взору. Наиболее быстрые молекулы воды, преодолев притяжение со стороны других молекул, выскакивают из водной массы и образуют пар над водной поверхностью. Мы называем это испарением воды. Молекулы водяного пара сталкиваются друг с другом и с молекулами воздуха, часть молекул пара переходит обратно в жидкость. Это есть конденсация пара. При данной температуре устанавливается своеобразное равновесие (его называют динамическим), когда число молекул воды, покидающих за единицу времени жидкость, в среднем равно числу молекул воды, возвращающихся за то же время обратно. Можно сказать, что процессы испарения и конденсации взаимно компенсируются. Водяной пар, находящийся в этом случае над поверхностью воды, называют насыщенным.
Если температура вдруг повысится, пар станет ненасыщенным: процесс испарения начнет преобладать над процессом конденсации, в результате давление пара начнет расти. Это будет продолжаться до того момента, пока снова не установится динамическое равновесие между испарением и конденсацией, иначе говоря, пока пар снова не станет насыщенным.
Если, напротив, температура вдруг понизится, пар станет перенасыщенным – теперь уже конденсация начнет преобладать над испарением. В результате давление пара будет понижаться до тех пор, пока не будет снова достигнуто динамическое равновесие, т. е. состояние насыщения пара.
Мы видим, таким образом, что давление насыщенного пара зависит от температуры: оно возрастает с увеличением температуры и падает с ее уменьшением. Часто вместо давления пара рассматривается его плотность Q (массу водяных паров в единице объеме). Ясно, что плотность насыщенного пара Qн растет с увеличением температуры и падает с ее уменьшением. На рисунке 8 изображен график зависимости плотности насыщенного пара от температуры.
Из графика видно, что при повышении температуры, например, от 5°С до 40ºС плотность насыщенного пара возрастает более чем в 10 раз.
Заметим, что изображенный график подходит для плоской водной поверхности. Над выпуклой поверхностью плотность (и давление) насыщенного пара при данной температуре больше, чем над плоской поверхностью, а над вогнутой, наоборот, меньше. Дело в том, что в случае с выпуклой поверхностью имеются более благоприятные условия для преобладания испускания над конденсацией, тогда как вогнутая форма поверхности более благоприятствует конденсации.
Теперь мысленно уберем поверхность воды и представим себе некий объем воздуха, содержащий какое-то количество водяных паров. Пусть плотность этих паров равна плотности насыщенного пара при данной температуре (в соответствии с графиком на рисунке 8). Предположим, что температура воздуха в рассматриваемом объеме вдруг уменьшилась. Тогда водяной пар окажется перенасыщенным, начнется конденсация пара и на стенках объема появится влага – выпадет роса. Это будет продолжаться до тех пор, пока плотность водяных паров в рассматриваемом объеме не снизится до значения, равного плотности насыщенного водяного пара при новой температуре.
Туман как одна из форм газообразного состояния воды.
В известном смысле возникновение тумана есть явление выпадения росы. Существенно, однако, что выпадение росы происходит в данном случае не на поверхности земли или воды, не на поверхности листьев или травинок, а в объеме воздуха. При определенных условиях водяные пары, находящиеся в воздухе, частично конденсируются, в результате чего и возникают водяные капельки тумана. Сразу же отметим, что лишь очень небольшая часть массы водяных паров превращается в воду, содержащуюся в капельках тумана. Из графика на рисунке 8 видно, что при обычных температурах (близких к 20ºС) общая масса насыщенных паров в кубометре воздуха составляет 20г. В то же время водность тумана не превышает 0,1 г/м3. Значит, в воду капель тумана конденсируется примерно не более 1% массы водяных паров.
Условия конденсации водяных паров:
❖ Содержание в воздухе большого количества ядер конденсации – центров, на которых происходит конденсация пара.
❖ Наличие в воздухе перенасыщенных паров, плотность которых должна быть в несколько раз больше плотности насыщенного пара.
Для получения пара можно использовать два способа. Рассмотрим один из них. В случае (Рис. 9) воздух имеет определенную и притом достаточно большую абсолютную влажностьq0; температура воздуха постепенно понижается. По достижении температуры Т=Т1 (точки росы) пар насыщается; при дальнейшем охлаждении он становится перенасыщенным. Следует охладить воздух до такой температуры Т2, чтобы соответствующая ей плотность насыщенного пара qн оказалась в несколько раз меньше абсолютной влажности q0 (см. рисунок). выпадающий в рассматриваемом случае туман называют туманом охлаждения.
Экспериментальное исследование.
Древние волхвы, жрецы и прочие кудесники умели управляться с водой, совершая на глазах людей настоящие чудеса. Например, вызывали проливные дожди или исцеляли «живой» водой. В России не было, пожалуй, ни одной деревни, чтобы в ней не жила бабка, умевшая заговаривать воду и таким образом исцелять болезни.
Доктор Масару Эмото из Японии провел исследования, по результатам которых выходит, что знахари свое дело знают. Молекулы воды воспринимают информацию и впитывают ее, изменяя структуру. Добрые слова способны превратить жидкость в чудодейственный эликсир.
Говорят, что в Крещение любая вода, идущая даже из крана, имеет исцеляющие и очищающие свойства. А уж нырнув в этот день в прорубь, наверняка избавишься от всех хворей. Почему такое происходит? Все просто – память воды о Дне святого Крещения, когда произошло чудо, сохраняется из тысячелетия в тысячелетие. И чудо вновь и вновь совершается именно в этот день, когда миллионы людей просят воду о Спасении. Перекрестился, произнес: «С Богом!» - и нырнул. Вошел в воду старым и дряхлым, чтобы выйти молодым и здоровым, как в сказке.
Если вы не желаете обращаться к знахаркам, то можете просто прочитать над водой молитву «Отче наш» и выпить ее – так исцеляются болезни.
Как на практике происходит воздействие информации на воду, показал доктор Эмото. Японский ученый брал пробы воды из разных мест, замораживал опытные образцы, а потом рассматривал под микроскопом получившиеся кристаллы.
Для начала он сравнил воду из чистого родника и воду из городского водоема. И был поражен, насколько разными получились результаты! Кристаллы из родниковой воды отличались редкой красотой и гармонией, а вот их городским собратьям повезло меньше: у них была разрушена кристаллическая форма, и картина оказалось безобразной, дисгармоничной.
Затем ученый пошел дальше. Он взял пробу воды из озера Фудживара. После этого священник местного храма целый час молился на берегу озера, и затем ученый снова взял пробу из того же места. Изменения оказались просто поразительными: первая проба дала уродливые грязные кляксы, а вторая – чистые ярко-белые шестигранники.
Вдохновившись, доктор Эмото стал придумывать все новые эксперименты. Он давал воде «слушать» различную музыку, он приклеивал к емкостям с водой бумажки с разными словами, он ставил канистры в помещение с детьми и в помещение с агрессивно настроенными взрослыми (токийская биржа) И всякий раз сравнивал кристаллы воды «до» и «после».
Сомнений быть не могло. Вода понимает информацию, которую ей сообщают, и в зависимости от этого меняет свою структуру!
Но есть у современных ученых и другие мнения (см. Приложение, таблица №1). Как видите, эти мнения очень разнятся, причем кардинально, ни одна из сторон не может согласиться с мнением противоположной. Именно этот конфликт и вызвал во мне неподдельный интерес. К сожалению, фактов слишком много, и, вроде как, все они очень убедительны и точны. Единственный шанс разрешить мое внутреннее противоречие – самой провести этот, скажем, очень даже занимательный эксперимент.
Для начала, хотя бы в общих чертах попробуем установить порядок действий проведения эксперимента:
1. Выделение физического явления, установление цели исследования, методов его проведения.
2. Оборудование, экспериментальная установка.
3. Установление предполагаемого результата (гипотезы).
4. Описание опыта (ход работы)
5. Установление результатов опыта, вывод по работе, продолжение исследования.
Итак, начнем
Эксперимент на установление ложности или истинности предположения наличия «памяти» у воды.
Исследуемое явление: «память» воды.
Цель исследования: определение ложности или истинности гипотезы (наличие «памяти» у воды).
Методы исследования: экспериментальное наблюдение.
Оборудование: рефрижератор, 2 емкости (стакан) одинакового объема.
Предполагаемый результат: образование кристаллов льда определенной формы, в зависимости от типа воздействия на вещество.
Описание опыта.
Заполняем емкости водой из одного источника комнатной температуры. Один стакан оставляем на время без внимания. Второму даем прослушивать «тяжелый рок», фразы отрицательного характера. Первому же – классическую музыку вместе с такими фразами как «я тебя люблю», «спасибо». Помещаем оба стакана в холодильник (температура ≈ -18ºС). Через два часа вынимаем и ставим на свет.
Результат опыта.
Вода в емкости, которой говорили плохие слова, плохо промерзла изнутри, притом кристаллы чем-то напоминали зубы аллигатора. Вода, с которой были проведены противоположные действия, промерзла полностью, образовав кристаллы, похожие на вихрь.
Вывод по работе.
К сожалению, несмотря на то, что меня удивили кристаллы «отрицательной» воды, нельзя однозначно сказать, что «память» у вещества действительно существует. Как говорится, «тот, кто хочет увидеть, всегда увидит». Но и отрицать это свойство тоже никак нельзя, во всяком случае, без веского опровержения.
В данной работе техническими объектами можно считать холодильник и стеклянные емкости. Объекты природы: вода.
Исследование процесса плавления льда в воде и в воздухе.
Исследуемое явление: плавление льда в различных средах.
Цель исследования: исследовать процесс плавления льда в воде и воздухе.
Методы исследования: экспериментальный (наблюдение, эксперимент, измерение).
Оборудование: стакан, сосулька, термометр.
Предполагаемый результат: плавление льда в воздухе будет происходить быстрее, чем в воде, то есть верхняя часть сосульки растает раньше, чем нижняя (у дна стакана).
Описание опыта.
Сосульку поместим вертикально в пустой стакан. Через 10 минут в стакане появилось небольшое количество воды, т. к. часть сосульки расплавилась. Начальная температура воды 0ºС. Уровень воды в стакане постепенно увеличивается, когда воды станет много, измерим ее температуру термометром. Верхний слой воды имеет температуру 0ºС, у дна температура воды = 2ºС.
Результат опыта.
Сосулька тает по всей поверхности, но неравномерно. Верхняя часть сосульки, которая находилась в воздухе, растаяла быстрее. Чем та часть, которая находилась в воде. Если внимательно рассмотреть нижнюю часть сосульки, находящуюся в воде, то можно заметить, что сильнее подтаяла она у самого дна. Медленнее процесс плавления льда происходит на границе воздух-вода, т. к. там температура = 0ºС.
Сосулька постепенно принимает такую форму, что верхние и нижние части становятся меньше, чем центральная (ближе к границе сред).
Вывод по работе: наиболее утолщенная часть сосульки у самой поверхности воды. Температура воды на дне стакана выше 0ºС, т. к. тепло поступает от дна, стенок стакана, от воздуха.
Продолжение исследования: сосулька полностью растает, лед превратится в воду.
В данной работе техническими объектами можно считать стакан, термометр.
Объекты природы: сосулька, вода.
Исследовательская работа
«Место воды в нашей жизни».
Следующим этапом моей работы будет проведение исследования на тему «Значение воды в нашей жизни» путем проведения анкетирования среди учащихся школы и анализа полученных данных.
Вопросы, составленные для анкетирования:
1. Используете ли Вы большие водные ресурсы каждый день?
2. Как Вы оценивает качество воды в нашем городе?
3. Пьете ли Вы некипяченую воду?
4. Верите ли вы в лечебные свойства Святой воды?
5. Как Вы думаете, улучшилось или ухудшилось городское качество воды?
6. Какие способы Вы используете для улучшения качества воды?
Анализ анкетирования:
Данные школьного опроса показали:
➢ 100% учеников используют большие водные ресурсы каждодневно.
➢ Большинство (45%) опрошенных оценивают качество воды в городе как «плохое», оценку «среднее качество» поставили 20 % учеников. Основные жалобы – большое содержание хлорки в воде.
➢ На вопрос «Пьете ли Вы некипяченую воду?» 53 процента опрошенных ответили положительно. Но с оговоркой, что не часто.
➢ 89% опрошенных школьников верят в лечебные свойства Святой воды, тогда как 11% в этом сомневаются.
➢ Подавляющее большинство (85%) школьников утверждают, что качество воды заметно ухудшилось, 10% не знают, что на это ответить.
➢ Выяснилось, что 53 % опрошенных используют для очищения во
➢ Выяснилось, что 53 % опрошенных используют для очищения воды фильтры. В анкетах были указаны фильтры следующих марок: «Аквафор», «Барьер». Остальные ученики не используют никаких способов для очищения воды, кроме кипячения.
Как мы видим, результаты опроса противоречивы. Опасения вызывает употребление некипяченой воды большинством опрошенных детей. Конечно, в малых количествах некипяченая вода даже может быть полезна, но только в том случае, если она не имеет вредных примесей. А в Котельниче, как мы знаем, хлорки не избежать. Да и по всей России, тоже!
Исследовательская работа
«Сколько же воды мы пьем?».
Тезисы.
В России, которая не испытывает проблем с водными ресурсами, эта проблема может показаться надуманной. Но для многих стран и для планеты в целом проблема пресной и питьевой воды является одной из важнейших. Эксперты не исключают, что через 50 лет из-за воды на Земле, в особенности в Африке, будут бушевать войны, как они разгораются из-за нефти. Уже сейчас треть населения планеты проживает в условиях острого дефицита воды. Россияне сегодня в среднем тратят по 380 литров воды в сутки на человека. Это огромная цифра. Для сравнения, в Германии на каждого немца приходится всего по 120 литров воды в сутки.
Исследование.
❖ Исследуемое явление: количественная доля потребления воды в сутки на ребенка нашей школы, среднее значение данных.
❖ Цель исследования: сравнение показателей, полученных в целом по России и показатель опроса учеников школы № 5 города Котельнича.
❖ Методы исследования: анкетирование с элементами интервьюирования.
❖ Оборудование: листы с анкетами, программы для обработки графических данных.
❖ Предполагаемый результат: показатели в городе Котельниче будут во много раз меньше показателей общероссийских
❖ Описание исследования.
После проведения опроса среди учащихся школы передо мной была поставлена задача анализирования и преобразования данных. Нужно учесть, что дети не учитывали в своих ответах, сколько воды тратиться на стирку и мытье посуды каждодневно. Только на свои нужды.
❖ Результат исследования.
Выяснилось, что в среднем Котельничский ученик тратит в сутки примерно 20 литров воды. Класс в 20 человек потребляет в сутки примерно 214 литров воды. Графическое представление данных вы можете увидеть в Приложении, график №6.
❖ Вывод по работе.
Показатели потребления воды в городе Котельнич в 16 раз!!! меньше показателей общероссийских. Следовательно, это прекрасно! Правда погрешность в полученных данных может быть весьма велика.
❖ В данной работе техническими объектами можно считать: анкетные листки, программы «Microsoft Excel» и «Microsoft Word».
❖ Объекты природы: вода.
Исследовательская работа
«Изучение процесса диффузии в воде».
Исследование.
❖ Исследуемое явление: процесс диффузии в жидкости (вода).
❖ Цель исследования: изучение одного из основополагающих свойств воды.
❖ Методы исследования: эксперимент, наблюдение.
❖ Оборудование: стакан (200 мл), чай, сахар, вода (кипяченая), вода (холодная), секундомер.
❖ Предполагаемый результат: Процесс диффузии в горячей воде будет происходить быстрее, чем в холодной, существует определенная зависимость скорости процесса диффузии от наличия в воде примесей.
❖ Описание исследования и его результат.
Я взяла стакан с горячей и холодной водой, добавила в каждый из них чайную ложку чая. Включила секундомер. Вода в стакане с горячей водой окрасилась полностью через 35 секунд от начала отсчета, тогда как процесс диффузии в стакане с холодной водой вовсе не наблюдался (2 минуты – далее эксперимент не проводился).
В третий стакан с горячей водой добавила чайную ложку сахара (до полного растворения), затем положила в него чайную ложку чая. Вода в стакане окрасилась полностью через 15 секунд.
❖ Вывод по работе.
Выдвинутая мной гипотеза оказалась правдой, хотя эксперимент и носит бытовой характер.
❖ В данной работе техническими объектами можно считать: стакан, секундомер.
❖ Объекты природы: вода, чай, сахар.
1. Работа над данным проектом проведена в соответствии с планом:
1. Проведен анализ физических, химических и биологических свойств воды.
2. Экспериментальные исследования заложены и анализированы.
3. Систематизированы полученные данные.
2. Получены начальные навыки работы в исследовательском проекте.
3. Возможности исследования воды не ограничены, работа может быть продолжена, причем по любой из данных тем.
Нельзя сказать, что все, задуманное в начале, удалось воплотить в жизнь. Но, что могу сказать точно, это то, что я нисколько не жалею о выборе данной темы. Надеюсь и в дальнейшем продолжать работу в этом направлении.
www.hintfox.com
Газообразное состояние воды - свойства, примеры
Вода - это самое удивительное вещество на Земле. Именно ей мы обязаны жизнью, так как она участвует во всех процессах жизнедеятельности. Вода обладает самыми необычными свойствами, и еще не все из них ученым удалось объяснить. Например, выяснилось, что она обладает памятью и может реагировать на разные слова. А самое известное свойство воды - это то, что она - единственное вещество, которое может находиться во всех трех агрегатных состояниях. Жидкое - это, собственно, вода, твердое - это лед. Газообразное состояние воды мы можем наблюдать постоянно в виде пара, тумана или облаков. Обычный человек не задумывается о том, что это все вода, он привык называть этим словом только жидкость. Многие даже не знают, как называется газообразное состояние воды. Но именно эта ее особенность обеспечивает жизнь на Земле.
Значение воды
Эта удивительная влага занимает около 70% поверхности Земли. Кроме того, ее можно встретить на огромной глубине - в толще земной коры и высоко в атмосфере. Вся масса воды в виде жидкости, льда и пара называется гидросферой. Она жизненно важна для всех форм жизни на Земле. Именно под влиянием воды формируется климат и погода во всем мире. А существование жизни зависит от ее способности переходить из одного агрегатного состояния в другое. Эта ее особенность обеспечивает круговорот воды в природе. Особое значение имеет вода в газообразном состоянии. Это ее свойство помогает перенести большие массы влаги на огромные расстояния. Ученые подсчитали, что Солнце испаряет за минуту с поверхности Земли миллиард тонн воды, которая в виде облаков переносится на другое место, а потом проливается дождем.
Газообразное состояние воды
Особенностью воды является то, что ее молекулы способны при колебании температуры изменять характер связи друг с другом. Основные свойства ее при этом не меняются. Если нагревать воду, ее молекулы начинают двигаться быстрее. Те, которые соприкасаются с воздухом, разрывают свои связи и смешиваются с его молекулами. Вода в газообразном состоянии сохраняет все свои качества, но приобретает также свойства газа. Ее частицы находятся на большом расстоянии друг от друга и интенсивно двигаются. Чаще всего такое состояние называют водяным паром. Это бесцветный прозрачный газ, который при определенных условиях опять превратится в воду. Он повсеместно распространен на Земле, но чаще всего его не видно. Примеры воды в газообразном состоянии - это облака, туман или водяной пар, образующийся при кипении жидкости. Кроме того, она везде находится в составе воздуха. Ученые заметили, что при его увлажнении дышать становится легче.
Каким бывает пар?
Чаще всего вода переходит в газообразное состояние при изменении температуры. Обычный пар, который всем знаком, образуется при кипении. Именно это беловатое горячее облако мы и называем водяным паром. Когда жидкость при нагревании достигает точки кипения, а при обычном давлении это происходит при 100°, молекулы ее начинают интенсивно испаряться. Попадая на более холодные предметы, они конденсируются в виде капелек воды. Если нагревается большое количество жидкости, то в воздухе образуется насыщенный пар. Это состояние, когда газ и вода сосуществуют, потому что скорость испарения и конденсации одинакова. В том случае, когда в воздухе присутствует много водяного пара, говорят о его повышенной влажности. При понижении температуры такой воздух интенсивно конденсирует влагу в виде капелек росы или тумана. Но для образования тумана мало особых условий температуры и влажности. Нужно, чтобы в воздухе находилось определенное количество пылинок, вокруг которых и конденсируется влага. Поэтому в городах туманы из-за пыли образуются чаще.
Переход воды из одного состояния в другое
Процесс образования пара называется парообразованием. Его наблюдает каждая женщина при приготовлении пищи. Но существует и обратный процесс, когда газ превращается обратно в воду, оседая на предметах в виде мельчайших капелек. Это называется конденсацией. Каким же образом чаще всего происходит парообразование? В естественных условиях этот процесс называется испарением. Вода испаряется постоянно под воздействием солнечного тепла или ветра. Искусственно образование пара можно вызвать с помощью кипения воды.
Испарение
Это процесс, когда получается газообразное состояние воды. Он может быть естественным или ускоренным с помощью различных приспособлений. Испаряется вода постоянно. Это ее свойство люди издавна использовали для просушки белья, посуды, дров или зерна. Любой мокрый предмет постепенно высыхает благодаря испарению влаги с его поверхности. Молекулы воды в своем движении одна за другой отрываются и смешиваются с молекулами воздуха. Путем наблюдений люди поняли, как можно ускорить этот процесс. Для этого даже были созданы различные приспособления и приборы.
Как ускорить испарение?
1. Люди заметили, что быстрее этот процесс протекает при высокой температуре. Например, летом мокрая дорога высыхает моментально, чего не скажешь об осени. Поэтому сушат предметы люди в более теплых местах, а в последнее время созданы специальные сушилки с подогревом. А в морозную погоду испарение тоже происходит, но очень медленно. Это свойство используют для просушки ценныхдревних книг и рукописей, помещая их в специальные морозильные камеры.
2. Испарение происходит быстрее, если площадь соприкосновения с воздухом большая, например из тарелки вода исчезнет быстрее, чем из банки. Это свойство используют при сушке овощей и фруктов, нарезая их тонкими ломтиками.
3. Еще люди заметили, что высыхают предметы быстрее под воздействием ветра. Это происходит потому, что потоком воздуха уносятся молекулы воды, и они не имеют возможности опять конденсироваться на этом предмете. Эта особенность была использована при создании фена и воздушных сушилок для рук.
Свойства воды в газообразном состоянии
Водяной пар в большинстве случаев невидим. Но при высокой температуре, когда воды испаряется сразу много, его можно заметить в виде белого облака. То же самое происходит и в холодном воздухе, когда молекулы воды конденсируются в виде мельчайших капелек, которые мы и замечаем.
Вода в газообразном состоянии может растворяться в воздухе. Тогда говорят, что повысилась его влажность. Существует предельно возможная концентрация водяного пара, которую называют «точкой росы». Выше этого предела происходит конденсация ее в виде тумана, облаков или капелек росы.
Молекулы воды в газообразном состоянии двигаются очень быстро, занимая большой объем. Особенно это заметно при высокой температуре. Поэтому можно наблюдать, как при кипении у чайника прыгает крышка. Это же свойство приводит к тому, что при горении дров слышен треск. Это испаряющаяся вода разрывает волокна древесины.
Водяной пар обладает упругостью. Он способен сжиматься и расширяться при изменении температуры.
Применение свойств водяного пара
Все эти свойства давно изучены людьми и используются для бытовых и промышленных нужд.
- Впервые газообразное состояние воды применили в паровом двигателе. Много лет это была единственная возможность приводить в движение транспорт и машины в промышленности. Паровые турбины используются и сейчас, а в транспортных средствах бензиновый двигатель уже давно вытеснил паровой. И теперь паровоз можно увидеть только в музеях.
- Повсеместно и давно пар применяют в кулинарии. Приготовление мяса или рыбы на пару делает их нежными и полезными для всех.
- Горячий пар используется также для обогрева домов и процессов в промышленности. Паровое отопление очень эффективно и быстро завоевало популярность у населения.
- Газообразное состояние воды используется сейчас в огнетушителях специальной конструкции, которые применяются для тушения нефтепродуктов и других горючих жидкостей. Нагретый пар перекрывает доступ воздуха к очагу возгорания, прекращая горение.
- В последние годы стали использовать газообразное состояние воды для ухода за одеждой. Специальные отпариватели не только разгладят деликатные вещи, но и выведут некоторые пятна.
- Очень эффективно использование водяного пара для стерилизации предметов и медицинских инструментов.
Когда водяной пар вреден?
Есть на Земле и такие места, где вода в газообразном состоянии находится почти всегда. Это долины гейзеров и окрестности действующих вулканов. Находиться человеку в такой атмосфере невозможно. Там тяжело дышать, а повышенная влажность препятствует испарению влаги с кожи, что может привести к перегреву. Также можно сильно обжечься тем паром, который образуется при кипении воды. А туманы могут снижать видимость, приводя к авариям. Но во всех остальных случаях свойство воды переходить в газообразное состояние используется человеком себе на благо.
fb.ru