7.6. Структура и уникальные свойства воды. 7 свойств воды
7 полезных свойств воды
 Мы начинаем публикацию серии статей о пользе воды для здоровья, ее роли в нашем организме и советов, сколько необходимо выпивать воды в день. Мы уже упоминали о пользе воды на страницах нашего сайта a2news.ru для поддержания метаболизма и для ускорения метаболизма.
Мы начинаем публикацию серии статей о пользе воды для здоровья, ее роли в нашем организме и советов, сколько необходимо выпивать воды в день. Мы уже упоминали о пользе воды на страницах нашего сайта a2news.ru для поддержания метаболизма и для ускорения метаболизма.
Будь стройнее с водой
Пытаетесь сбросить вес? Вода ускоряет метаболизм и помогает чувствовать себя сытым. Замените свои калорийные напитки водой, и выпивайте стакан воды (некоторые советуют 2 стакана, прим. a2news) перед едой, чтоб не чувствовать голода.
Выпивая большее количество воды, Вы тем самым ускоряете свой метаболизм - особенно, если вода ледяная. Ваше тело должно работать, чтоб нагреть воду, сжигая при этом несколько дополнительных калорий.
Вода увеличивает Вашу энергию
Если Вы ощущаете истощенность, вода прибавит сил. Обезвоживание отбирает силы. Вы ощущаете себя усталым.
Вода помогает крови перемещать кислород и другие необходимые питательные вещества к вашим клеткам.
Если вы получаете достаточно воды, вашему сердцу также легче перекачивать кровь по всему телу.
Уменьшить напряжение водой
Ткань Вашего мозга состоит на 70-80% из воды. Если Вы обезвожены, тело и мозг испытывают напряжение.
Если Вы ощущаете жажду, ваш организмуже обезвожен.
Для того, чтобы уменьшить напряжение, держите стакан с водой у себя на столе, или носите с собой бутылку с водой ирегулярно пейте.
Вода поможет повысить мышечный тонус
Употребление достаточного количества воды поможет предотвратить мышечные спазмы и смазать суставы в теле.
Когда вы употребляете достаточное количество воды, вы можете заниматься дольше и сильнее.
Напоите свою кожу
Ищете новейшие модели игровых автоматов. Хотите ощутить на собственном опыте всю полноту эмоций, которые способны передать 3D аппараты и получить в придачу крупную сумму? Да, тогда специально для вас созданы слоты на деньги от знаменитого клуба Вулкан. Видео эмуляторы оснащены удобным механизмом управления, высокочувствительной графикой, приятным музыкальным сопровождением. Конкуренция растет, поэтому разработчики аппаратов современного образца создают интригующие бонусные уровни с новыми заданиями.Тонкие линии и морщины глубже когда вы обезвожены. ботокс недорого здесь Вода это природный крем красоты.
Употребление воды наполняет клетки кожи, округляя их, делая ваше лицо моложе.
Вода также выводит загрязнение и улучшает циркуляцию крови, оставляя ваше лицо чистым, светлым и сияющим.
Регулярно пейте воду
Вместе с клетчаткой, вода необходима для хорошего пищеварения. Вода помогает растворять частицы отходов, что, в свою очередь, способствует более легкому передвижению отходов через пищеварительный тракт. Если Вы обезвожены, ваше тело впитывает всю воду, оставляя ваш кишечник сухой, что затрудняет продвижение отходов.
Вода уменьшает почечные камни
Количество людей с болезненными почечными камнями увеличивается постоянно, потому что люди, включая детей, не выпивают достаточно воды.
Вода разжижает соли и минералы в вашей моче, которые формируют кристаллы, из таких кристаллов постепенно вырастают почечные камни.
Почечные камни не могут быть сформированы в разжиженной моче, так что вы можете уменьшить риск возникновения почечных камней обильным питьем воды.
Достаточно ли воды вы употребляете?
Обычно, западные диетологи советуют руководствоваться “правилом 8х8”. Выпивайте восемь стаканов с водой объемом 8-мь унций ( 1 унция = 30 мл, 8 унций = 240 мл ). Т.е. это скорее 8-мь чашек с водой, а не стаканов. За день это выходит почти 2 литра.
Если же вы занимаетесь физическими упражнениями или обильно потеете, необходимо пить еще больше.
Вам необходимо меньше воды, если вы пьете часто другие напитки, но a2news.ru все же советует воздержаться от калорийных и сладких напитков.
Комментарии
www.a2news.ru
7.6. Структура и уникальные свойства воды
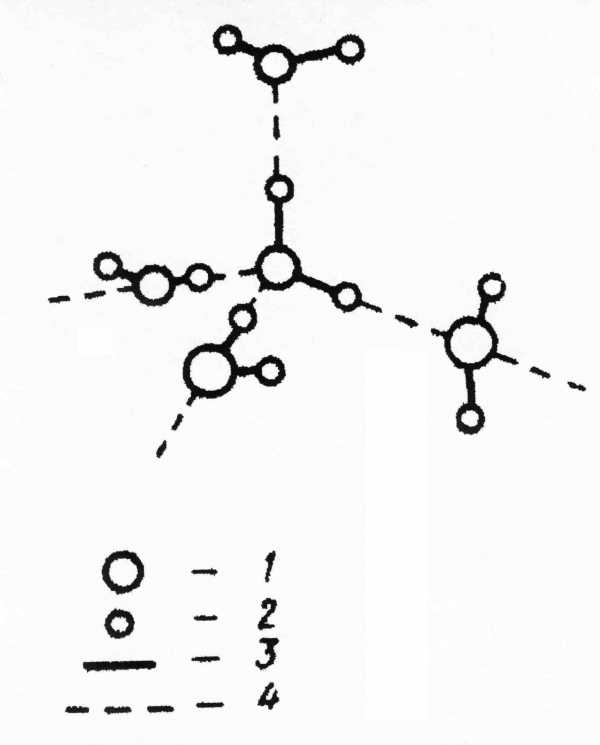
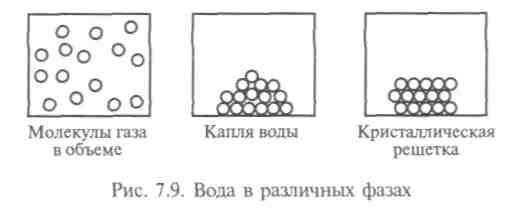
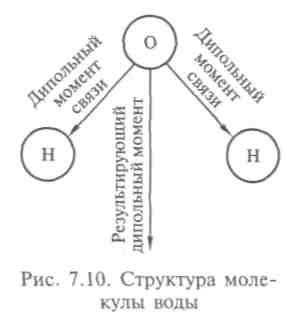
Одно из самых распространенных веществ на Земле — вода. Вода покрывает большую часть поверхности нашей планеты, из нее в основном состоят почти все живые существа. Свойства воды настолько важны для живых организмов, что известная нам форма жизни без нее вообще невозможна (рис. 7.9). Уникальные свойства воды объясняются структурой ее молекул: атом кислорода связан ковалентно с двумя атомами водорода, молекула изогнута под углом, в вершине которого и находится кислород. Из-за того, что кислород притягивает электроны сильнее, чем водород, молекула воды всегда полярна: кислород частично заряжен отрицательно, водород — положительно, поэтому молекула воды удерживается водородными связями. Когда вода находится в жидкой фазе, эти слабые связи легко рвутся и разрушаются при столкно-
275
вениях молекул, тем не менее водородные связи играют большую роль, обеспечивая особое значение воды для жизни (рис. 7.10).
Тепловые свойства воды уникальны для обеспечения жизни. Испарение требует значительной траты энергии, так как температура кипения воды достаточно высока. Скрытая теплота испарения (количество теплоты, необходимой для превращения воды в пар или преодоления сил молекулярного сцепления в воде, обусловленных водородными связями) необычайно велика относительно других веществ. Ее приходится брать из среды, и испарение воды сопровождается охлаждением.
Пример — потоотделение у животных или тепловая одышка у млекопитающих или рептилий (сидят на солнцепеке с разинутым ртом). Относительно большая энергия требуется воде и при плавлении (таянии льда). И наоборот, при замерзании вода должна отдать большое количество тепловой энергии. Это уменьшает вероятность замерзания и клеток, и их окружения. Кристаллизация воды в клетках губительна для жизни, и большая теплота плавления обеспечивает стабильность внешних условий, т.е. жизнедеятельности.
Плотность воды в жидком состоянии больше, чем в твердом, и лед не тонет в ней. Кроме воды таким свойством обладают лишь висмут и чугун. Так как плотность воды при температуре от 4 до 0 °С понижается, лед образуется сначала у поверхности воды и
только под конец — около дна. Это обеспечивает сохранение жизни в водоемах: лед покрывает толщу воды, как одеяло, и тает быстрее, находясь на поверхности. Слои воды при температуре, меньшей 4°С, поднимаются вверх, перемешиваются и переносят питательные вещества по всей толще, что позволяет распространяться живому на больших диапазонах глубин. Высокая теплопроводность воды, достаточно высокие температуры кипения и замерзания, понижение температуры тел при испа-
276
рении воды с их поверхности — все это важно для стабильности условий жизни. Даже тот факт, что плотность воды максимальна при температуре 4 °С, что несколько выше точки ее замерзания (т.е. при охлаждении от 4 до О °С вода расширяется), и лед легче жидкой воды, играет важную роль — предотвращает образование кристаллов в клетках и не повреждает ткани. Низкая плотность льда спасает водных животных — лед плавает на поверхности и не допускает холодный воздух вглубь, где находятся живые организмы. Поэтому вода является вместе с растворенными в ней солями необходимой средой для химических процессов, составляющих жизнь.
Из-за большой теплоемкости воды требуется большое количество энергии даже для небольшого повышения ее температуры. Объясняется это тем, что энергия расходуется на разрыв водородных связей, обеспечивающих ее «клейкость». Поэтому биохимические процессы протекают в меньшем интервале температур, с более постоянной скоростью. Вода служит стабильной средой обитания для многих клеток и организмов, обеспечивая значительное постоянство внешних условий.
Она обладает большим поверхностным натяжением, поскольку ее молекулы слипаются друг с другом (когезия) посредством водородных связей. Полярные молекулы притягиваются любой поверхностью, несущей электрический заряд, отсюда ее способность подниматься по тонкой трубке или порам, называемая капиллярностью (адгезия). Кроме того, у воды самое большое поверхностное натяжение по сравнению с другими жидкостями — сильное сцепление между молекулами. Многие мелкие организмы поэтому могут скользить по водяной поверхности. Это уникальное свойство играет важную роль в живых клетках и при движении воды по сосудам ксилемы у растений.
Вода — активный участник процессов метаболизма. При фотосинтезе она — источник водорода, участвует в реакциях гидролиза. Вода — наиболее важный по объему компонент тканей животных и растений: она является средой, в которой происходят все биохимические реакции, и одновременно их участником. Было установлено, что фазовые переходы в воде могут управлять скоростью протекания биохимических реакций. После открытия По-лингом (1961) взаимосвязи между явлением наркоза и кристаллизацией гидратов наркотических веществ прояснилась роль перестроек связанной воды в явлениях наркоза, а в последнее время — и в возникновении важнейших свойств гидратированных веществ: глины, гипса, цемента, некоторых типов сегнетоэлектриков.
Вода имеет огромное значение при естественном отборе и видообразовании в живой природе. Все наземные организмы приспособились к добыванию и сбереганию воды, даже в пустынях. Не вызывает сомнения тот факт, что жизнь зародилась на Земле в водной среде.
277
studfiles.net
7. Аномалии воды. Вода как реагент и как среда для химического процесса (аномальные свойства воды)
Похожие главы из других работ:
Вода известная и неизвестная. Память воды
4. Свойства воды
...
Вода известная и неизвестная. Память воды
5. Память воды
...
Вода как реагент и как среда для химического процесса (аномальные свойства воды)
4. Виды воды
Бромная вода -- насыщенный раствор Br2 в воде (3,5% по массе Br2). Бромовая вода -- окислитель, бромирующий агент в аналитической химии. Аммиачная вода -- образуется при контакте сырого коксового газа с водой...
Вода как реагент и как среда для химического процесса (аномальные свойства воды)
8. Применение воды
Роль воды в нынешней науке и технике очень велика. Вот только часть областей применения воды. 1. В сельском хозяйстве для полива растений и питания животных 2. В химической промышленности для получения кислот, оснований, органических веществ. 3...
Вода, дарующая жизнь
1.2 Химическая природа воды и ее память (структура, свойства, состав воды)
Вода представляет собой важнейшее химическое соединение, определяющее возможность существования жизни на Земле. Ежедневное потребление человеком питьевой воды составляет в среднем около 2 л...
Водород - топливо будущего
ОТВОД ВОДЫ
Следующей проблемой, где невесомость вновь заявила о себе, стала проблема отвода образующейся в топливном элементе воды. Если ее не удалять, она покроет электрод пленкой и затруднит к нему доступ для газа...
Информационно-структурная память воды
1.1 Структура воды
Молекула воды представляет собой маленький диполь, содержащий положительный и отрицательный заряды на полюсах. Так как масса и заряд ядра кислорода больше чем у ядер водорода, то электронное облако стягивается в сторону кислородного ядра...
Определение жесткости воды комплексонометрическим методом
1.3 Жесткость воды
Ввиду широкой распространенности кальция, соли его почти всегда содержатся в природной воде. Из природных солей кальция только гипс несколько растворим в воде, однако, если вода содержит диоксид углерода...
Расчет и подбор выпарной установки
6.1.1. Расход охлаждающей воды Gв.
Gв определяют из теплового баланса конденсатора: Gв=W3(hбк-cвtк)/cв(tk-tн), где hбк - энтальпия паров в барометрическом конденсаторе; tн = 200С - начальная температура охлаждающей воды; Cв =4...
Расчет и проектирование двухкорпусной выпарной установки
4.1 Расход охлаждающей воды
Расход охлаждающей воды GВ определяют из теплового баланса конденсатора: , где IБК - энтальпия паров в барометрическом конденсаторе, Дж ?кг; tн - начальная температура охлаждающей воды, 0С...
Сорбционная очистка воды
1. Качество воды
В производстве устанавливается в зависимости от требований технологического процесса. Вода, используемая в производстве...
Сорбционная очистка воды
5.1 Очистка воды
Для предупреждения развития бактериальных биологических обрастаний в теплообменных аппаратах, а также в трубопроводах рекомендуется периодически 3-4 раза в сутки применять хлорирование воды, продолжительностью каждого периода 40-60 минут...
Сорбционная очистка воды
5.3 Умягчение воды
Одним из наиболее распространенных видов кондицирования воды является её умягчение. Первым промышленным способом устранения солей жесткости был содово-известковый...
Сульфат кальция, кристаллогидрат и безводная соль
1.4 Жёсткость воды
Содержание в воде CaSO4 наряду с MgCl2, MgSO4 придаёт воде постоянную жёсткость. Избавиться от жёсткости воды можно с помощью умягчения воды. Химическое умягчение воды основано на введении в воду реагентов, обогащающих её анионами CO3 2- и ОН-...
Удивительное вещество - вода
ИССЛЕДОВАНИЯ ВОДЫ
Гидроломгия -- наука, изучающая природные воды, их взаимодействие с атмосферой и литосферой, а также явления и процессы, в них протекающие (испарение, замерзание и т. п.). Предметом изучения гидрологии являются все виды вод гидросферы в океанах...
him.bobrodobro.ru
7. Физические свойства воды
Вода в нормальных атмосферных условиях сохраняет жидкое агрегатное состояние, тогда как аналогичные водородные соединения являются газами. Это объясняется особыми характеристиками слагающих молекулы атомов и присутствием связей между ними. Атомы водорода присоединены к атому кислорода, образуя угол 104,45°, и эта конфигурация строго сохраняется. Из-за большой разности электроотрицательностейатомовводородаикислородаэлектронные облакасильно смещены в сторону кислорода. По этой причине молекула воды является активным диполем, где кислородная сторона отрицательна, а водородная положительна. В результате молекулы воды притягиваются своими противоположными полюсами и образуют полярные связи, на разрыв которых требуется много энергии[9]. В составе каждой молекулыионводорода (протон) не имеет внутренних электронных слоев и обладает малыми размерами, в результате чего он может проникать в электронную оболочку отрицательно поляризованного атома кислорода соседней молекулы, образуя водородную связь с другой молекулой. Каждая молекула связана с четырьмя другими посредством водородных связей — две из них образует атом кислорода и две атомы водорода[9]. Комбинация этих связей между молекулами воды — полярной и водородной и определяет очень высокую температуру её кипения и удельную теплоты парообразования[9]. В результате этих связей в водной среде возникает давление в 15-20 тыс. атмосфер, которое и объясняет причину трудносжимаемости воды, так при увеличении атмосферного давления на 1бар, вода сжимается на 0,00005 доли её начального объёма[9][В каких пределах изменения давления корректна эта оценка?].
Структуры воды и льда между собой очень похожи[9]. В воде, как и во льду, молекулы стараются расположиться в определённом порядке — образовать структуру, однако тепловое движение этому препятствует. При температуре перехода в твёрдое состояние тепловое движение молекул более не препятствует образованию структуры, и молекулы воды упорядочиваются, в процессе этого объёмы пустот между молекулами увеличиваются и общая плотность воды падает, что и объясняет причину меньшей плотности воды в фазе льда. При испарении, напротив, рвутся все связи. Разрыв связей требует много энергии, отчего у воды самая большаяудельная теплоёмкостьсреди прочих жидкостей и твёрдых веществ. Для того чтобы нагреть один литр воды на один градус, требуется затратить 4,1868кДжэнергии. Благодаря этому свойству вода нередко используется кактеплоноситель. Однако удельная теплоёмкость воды, в отличие от других веществ непостоянна: при нагреве от 0 до 35градусов Цельсияеёудельная теплоёмкостьпадает, в то время как у других веществ она постоянна при изменении температуры. Помимо большой удельной теплоёмкости, вода также имеет большие значенияудельной теплоты плавления(0 °C и 333,55 кДж/кг) ипарообразования(2250 кДж/кг).
Вода обладает также высоким поверхностным натяжением среди жидкостей, уступая в этом только ртути[10][11][12][13]. Относительно высокая вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
По сходным причинам вода является хорошим растворителемполярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде[14]. Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Вода обладает отрицательным электрическим потенциаломповерхности.
Чистая вода— хорошийизолятор. При нормальных условиях вода слабо диссоциирована и концентрацияпротонов(точнее, ионовгидроксонияh4O+) игидроксильных ионовHO− составляет 0,1 мкмоль/л.[источник не указан 48 дней] Но поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные соли, то есть в воде присутствуют положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.
Вода имеет показатель преломленияn=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественнымпарниковым газом, отвечающим более чем за 60 % парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чём основан принцип действиямикроволновой печи.
Агрегатные состояния
По состояниюразличают:
Твёрдое — лёд
Жидкое — вода
Газообразное — водяной пар
При нормальном атмосферном давлении(760мм рт. ст., 101 325Па) вода переходит в твердое состояние при температуре в 0 °C икипит (превращается в водяной пар)при температуре 100 °C (температура 0 °C и 100 °C были специально выбраны как температура таяния льда и кипения воды при созданиитемпературной шкалы «по Цельсию» в системе СИ). При снижении давления температура таяния (плавления) льда медленно растёт, а температура кипения воды — падает. При давлении в 611,73 Па (около 0,006атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такое давление и температура называютсятройной точкойводы. При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар. Температуравозгонки (сублимации)льда падает со снижением давления. При высоком давлении существуют модификациильдас температурами плавления выше комнатной.
При росте давления плотность водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064МПа(218атм) вода проходиткритическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении нет разницы между жидкой водой и водяным паром, следовательно, нет и кипения или испарения.
Так же возможны метастабильные состояния—пересыщенный пар,перегретая жидкость,переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, нетрудно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Чистая вода способна как переохлаждаться не замерзая до температуры −33 °C, так и быть перегрета до +200 °C. За это её свойство она получила применение в промышленности (например в паровых турбинах).
Существует тип воды, которая имеет плотность на 40 % выше нормальной и закипает при температуре +300°С. Эта разновидность воды была открыта советским учёнымБ. В. Дерягинымна поверхности кристаллов кварца[9].
studfiles.net
7.6. Структура и уникальные свойства воды
Янко Слава (Библиотека Fort/Da) || [email protected] | 158 |
Земле, в земной коре углерода всего 0,055 %, в то время как кислорода 60,50, кремния 20,45 и даже титана 0,27 %. В атмосфере двуокиси углерода содержится 0,03 %, т.е. углерода всего 0,008 %. Все биологически функциональные вещества (белки, жиры, углеводы, гормоны, витамины), кроме нескольких солей и воды, содержат углерод. Число соединений углерода огромно. Они называются органическими соединениями, поскольку когда-тосчиталось, что такие молекулы могут образовываться только в живых организмах.
Соединениями углерода занимается органическая химия — одна из важнейших областей химии. Органика разлагается, горит при не очень высокой температуре, при сгорании в воздухе углерод окисляется до СO2. Большинство органических соединений содержат водород, который окисляется до воды. Чистый углерод встречается в природе в виде графита и алмаза. До 1829 г. сторонники витализма считали, что без участия живого нельзя получить органические соединения, только «жизненная сила» способна изготовить уксусную кислоту или спирт. Немецкий химик Ф. Велер доказал ложность этого учения. Он получил мочевину выпариванием растворацианово-кислогоаммония Nh5NCO — соли, которую можно изготовить из простых веществ, не связанных с жизнедеятельностью организмов. Этот синтез был первым примером искусственного получения органики.
Сегодня синтезированы сложнейшие вещества, которых нет в природе. Углерод занимает все большее место в технике: природные и синтетические волокна, природный и синтетический кау-
278
чук, пластмассы, нефтепродукты, бумага, красители, чугун, медикаменты.
Идею о четырехатомности углерода высказал Купер (1858), его поддержал Кекуле в статье «О строении и превращениях химических соединений и химической природе углерода». У Кекуле формула С6Н6 превратилась в структурную формулу бензола, знаменитое «бензольное кольцо», наглядно отражающее четырехвалентность углерода. Без этого невозможно было понять строение сложных углеводородов, их соединений и производных. Правда, структурные формулы Кекуле были двухмерными и не могли отразить такое свойство молекул, как изомерия. Бутлеров сформулировал определение понятия химического строения как способа связей в молекуле. С помощью структурной теории развивалась систематика органических соединений. Структурные формулы наглядно отражали связь формулы со свойствами вещества, объяснили изомерию и предсказали свойства неизвестных еще соединений.
Атомный номер углерода — 6, ядро содержит 6 протонов и 6 нейтронов, вокруг ядра вращаются 6 электронов, масса атома равна 12. При химических реакциях углерод способен присоединить 4 электрона и образовать устойчивую оболочку из 8 электронов, т. е. имеет валентность, равную четырем, и способен к прочной ковалентной (присоединением электронов) связи. Например, эмпирическая формула одного из таких прочных соединений, метана, — СН4, а в структурном изображении — это тетраэдр (четыре симметричные связи углерода).
Зная валентность углерода, можно достаточно просто изобразить положение всех недостающих водородных атомов, что позволяет сосредоточить внимание на наиболее важных связях и химических группах. Такие прочные ковалентные связи углерод может образовывать и с атомами других элементов (Н, О, Р, N, S), и с углеродными (С—С-связь).Внутреннее отличие органики от большинства неорганических соединений выражается в том, что химические связи, как правило, в органических соединениях валентные, а ионные связи — очень редки.
Уникальным свойством углерода является его способность образовывать стабильные цепи и кольца (рис. 7.11), которые обеспечивают разнообразие органических соединений, и эти связи могут быть кратными.
Октан — это восемь атомов углерода в окружении атомов водорода, образующих цепочку, в которой атомы лежат не на прямой, а зигзагообразно, свободно вращаясь в местах сочленения. Октан и его изомеры, состоящие из того же числа атомов, но имеющие разветвленную структуру из-забоковых углеводородных групп, входят в состав бензина. Маленькая капелька этой жидкости имеет больше молекул, чем Галактика звезд. Некоторые молекулы свернуты в клубок, некоторые вытянуты в
279
studfiles.net