Определение нитратов в питьевой и природных водах. Определение нитратов в воде питьевой
Определение нитратов и нитритов в воде
Предельно допустимая концентрация (ПДК) нитритов (NO2–) в питьевой воде водоемов 3,3 мг/л, нитратов (NO3–) - 45 мг/л.
Качественное определение нитратов и нитритов. На часовое или предметное стекло поместите 3 капли раствора дифениламина, приготовленного на концентрированной серной кислоте (Осторожно!),и 1-2 капли исследуемой воды. В присутствии нитрат- и нитрит-ионов появляется синее окрашивание, интенсивность которого зависит от их концентрации.
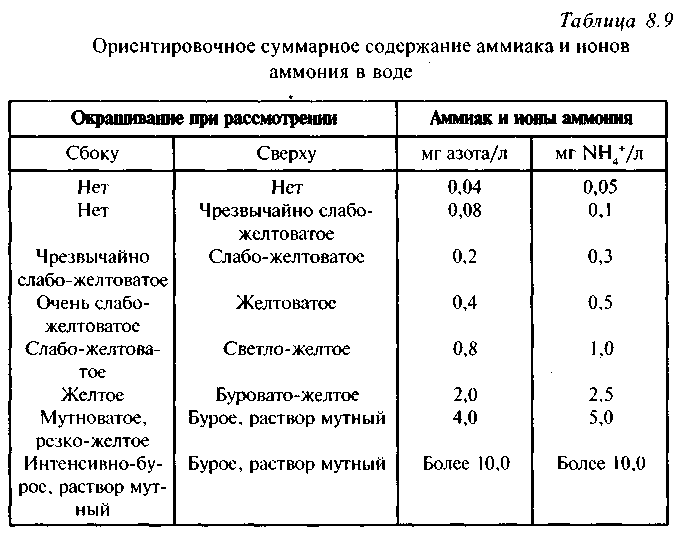
Раздельное определение нитратов и нитритов следует начинать с обнаружения нитритов, которые мешают определению нитратов.
Определение нитритов. К 5 мл исследуемой воды прибавить 0,5 мл реактива Грисса (Осторожно! Реактив содержит вредные вещества. Работать в вытяжном шкафу, используя пипетку с грушей) и нагреть до 70-80° С на водяной бане (в качестве бани можно использовать химический стакан на электроплитке). Появление розового окрашивания той или иной интенсивности свидетельствует о наличии нитрит-ионов в пробе.
 Определение нитратов. Если в воде были обнаружены нитриты, то их предварительно нужно удалить. Для этого в пробирку берут 5 мл анализируемой воды, прибавляют несколько кристалликов хлорида аммония и нагревают над газовой горелкой в течение 10-15 минут.
Определение нитратов. Если в воде были обнаружены нитриты, то их предварительно нужно удалить. Для этого в пробирку берут 5 мл анализируемой воды, прибавляют несколько кристалликов хлорида аммония и нагревают над газовой горелкой в течение 10-15 минут.
После этого присутствие нитратов можно определить раствором дифениламина, как описано выше, либо следующим способом.
К 3 мл исследуемого раствора прилить 2 мл 20%-ного раствора щелочи, добавить 10-15 мг цинковой пыли, смесь осторожно нагреть (можно на водяной бане). Нитраты восстанавливаются до аммиака, который обнаруживается по покраснению фенолфталеиновой бумаги или по посинению красной лакмусовой, смоченной дистиллированной водой и внесенной в пары исследуемого раствора.
Качественное определение нитрит-ионов с приближенной количественной оценкой. В пробирку диаметром 13-14 мм наливают 10 мл исследуемой воды, прибавляют 1 мл реактива Грисса (ТБ!) и нагревают до 70-80° С на водяной бане. Через 10 мин. появившуюся окраску сравнивают со шкалой (табл. 8.10).

Количественное определение нитритов. Для приготовления шкалы готовят основной стандартный раствор (0,15 г нитрита натрия растворяют в 100 мл дистиллированной воды), содержащий 1 мг нитрит-ионов в мл раствора; рабочий раствор готовят разбавлением основного раствора в 1000 раз. С целью повышения точности эту операцию целесообразно выполнить в два приема - сначала разбавить раствор в 50 раз, а затем еще в 20 раз. Для этого 2 мл основного стандартного раствора переносят пипеткой в мерную колбу на 100 мл, доводят объем до метки дистиллированной водой, перемешивают. Затем из полученного раствора берут 5 мл в другую мерную колбу на 100 мл, так же доводят объем до метки и перемешивают. 1 мл полученного раствора содержит 1 мкг нитрит-ионов. В 10 мерных колб на 50 мл вносят рабочий раствор в соответствии с табл. 8.11 и доводят объем до метки дистиллированной водой.
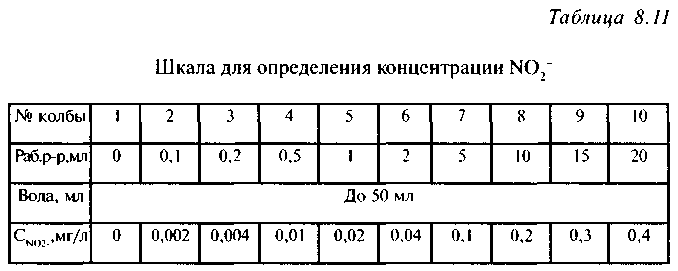
Из каждой колбы взять по 5 мл раствора в 10 пронумерованных пробирок, в 11-ю - 5 мл исследуемой воды, добавить в каждую по 0,5 мл реактива Грисса (ТБ!), перемешать и нагреть на водяной бане при 50-60°С. Через 10-15 минут интенсивность появившейся розовой окраски пробы сравнить со шкалой стандартных растворов.
Количественное определение суммарного содержания нитратов и нитритов. Определение проводят с реактивом Грисса (ТБ!) по вышеописанной методике, предварительно переведя нитраты в нитриты цинковой пылью в кислой среде при рН=3. Для перевода нитратов в нитриты к 10 мл исследуемой воды прибавляют 10-15 мг цинковой пыли и добавляют по каплям 0,1 н. раствор серной кислоты, доводя рН до 3, контролируя его значение по универсальной индикаторной бумаге. Через 10-15 минут отобрать пипеткой 5 мл прозрачного раствора в пробирку и провести анализ.
Количественное определение нитратов. В фарфоровую чашку помещают 10 мл исследуемой воды, прибавляют 1 мл 0,5% раствора салицилата натрия или салициловой кислоты и выпаривают досуха на водяной бане. После охлаждения сухой остаток увлажняют 1 мл концентрированной серной кислоты, тщательно растирают стеклянной палочкой и оставляют на 10 мин. Затем добавляют 5-10 мл дистиллированной воды и количественно переносят в мерную колбу на 50 мл, прибавляют 7 мл 10М гидроксида натрия (Осторожно!), доводят объем дистиллированной водой до метки и перемешивают.
5 мл раствора наливают в пробирку и сравнивают его окраску с контрольной шкалой. За результат анализа следует принимать значение концентрации нитрат-анионов (в мг/л) того образца шкалы, который более всего соответствует окраске полученного раствора.
Если в лаборатории имеется фотоколориметр, раствор помещают в кювету, измеряют его оптическую плотность, значение концентрации нитрат-анионов определяют по предварительно построенному градуировочному графику.
Если окраска содержимого пробирки окажется интенсивнее крайнего образца шкалы (5 мг/л) или значение оптической плотности выходит за пределы градуировочного графика, анализируемую воду разбавляют в 5 раз дистиллированной водой и определение повторяют. При вычислении результатов учитывают степень разбавления пробы.
Для приготовления шкалы готовят основной стандартный раствор, растворяя дистиллированной водой 0,032 г нитрата калия в мерной колбе на 200 мл (0,1 мг нитратов/мл), и рабочий раствор разведением основного в 10 раз (0,01 мг/мл). Затем в фарфоровые чашки вносят 0,1, 2, 5, 10, 15,20 и 25 мл рабочего раствора (что соответствует содержанию нитратов 0; 0,2; 0,4; 1,0; 2,0; 3,0; 4,0 и 5,0 мг/л), добавляют по 1 мл раствора салицилата натрия, выпаривают досуха. Далее проводят те же операции, что и с исследуемой пробой.
Определение нитратов и нитритов в воде по методу АЛ.Рычкова.
Для определения нитратов и нитритов по этому методу необходимы следующие медицинские препараты (их можно приобрести в аптеке): риванол (этакридина лактат), антипирин, оксафенамид, стрептоцид, гидрокарбонат натрия (питьевая сода), физиологический раствор (0,9% раствор хлорида натрия в дистиллированной воде), а также соляная кислота и дихромат калия.
В питьевой воде должно содержаться не более 3,3 мг/л нитрит- и 45 мг/л нитрат-ионов.
Определение нитритов. Для контроля нитритов можно воспользоваться одним из трех методов, пределы обнаружения у которых составляют 1,3; 1,6 и 2 мг/л нитрит-ионов.
Риванольная реакция. К 1 мл исследуемой воды прибавляют 1 мл физиологического раствора и смешивают с 1 мл риванольного раствора (таблетку растворяют при нагревании в 200 мл 8%-ной соляной кислоты). Если появится бледная розовая окраска, значит, уровень нитритов в питьевой воде недопустим.
Антипириновая реакция. 1 мл питьевой воды смешивают с 1 мл физиологического раствора (концентрация нитритов при таком разведении падает вдвое), 1 мл раствора антипирина (одна таблетка в 50 мл 8%-ной соляной кислоты) и быстро прибавляют две капли 1%-ного раствора дихромата калия. Смесь нагревают до появления признаков кипения. Если в течение 5 мин. раствор становится бледно-розовым, то значит, что в нем содержится более 1,6 мг/л нитрит-ионов, а в пробе питьевой воды соответственно вдвое больше (выше 3,2 мг/л). В этом случае содержание нитрит-ионов превышает предельно допустимую концентрацию.
Домашняя модификация метода Грисса. Метод Грисса довольно трудоемок, но этот метод санитарно-гигиенического контроля можно вполне повторить на кухне, не используя быстроокисляющиеся реактивы и специальную аппаратуру
К 1 мл солянокислого раствора стрептоцида (таблетка 0,5 г в 50 мл 8%-ной соляной кислоты) прибавляют 1 мл анализируемой воды, предварительно разбавленной вдвое дистиллированной водой или физраствором, и ставят на 2 мин. в холодильник. Затем в смесь понемногу присыпают гидрокарбонат натрия, пока не перестанут выделяться пузырьки газа. Здесь главное не переборщить с содой, так как ее избыток мешает цветной реакции. Поэтому следует добавлять ее по крупинкам. После того, как кислота нейтрализована, остается прибавить 1 мл холодного раствора оксафенамида в 10%-ный раствор гидрокарбоната натрия (в 100 мл физраствора растворяют 20 таблеток по 0,5 г гидрокарбоната натрия и 1 таблетку оксафенамида). Если в течение 5 мин. смесь приобретает бледно-желтую окраску, вода не пригодна к употреблению.
Определение нитратов (риванольная реакция). К 1 мл исследуемой воды прибавляют 2,2 мл физиологического раствора. Затем отбирают 2 мл приготовленного раствора, добавляют 1 мл солянокислого раствора риванола и немного порошка цинка (на кончике ножа). Если в течение 3-5 мин. желтая окраска риванола исчезнет и раствор окрасится в бледно-розовый цвет, то содержание нитратов в питьевой воде превышает ПДК.
8.2.3.7. Хлориды [37, 38]
Концентрация хлоридов в водоемах-источниках водоснабжения допускается до 350 мг/л.
В поверхностных водах количество хлоридов зависит от характера пород, слагающих бассейны, и варьирует в значительных пределах - от десятых долей до тысячи миллиграммов на литр. В реках северной части России хлоридов обычно немного, не более 10 мг/л, в южных районах эта величина повышается до десятков и сотен мг/л. Много хлоридов попадает в водоемы со сбросами хозяйственно-бытовых и промышленных сточных вод. Этот показатель весьма важен при оценке санитарного состояния водоема.
Качественное определение с приближенной количественной оценкой. В пробирку отбирают 5 мл исследуемой воды и добавляют 3 капли 10%-ного раствора нитрата серебра. Приблизительное содержание хлоридов определяют по осадку или помутнению (табл. 8.12).

Количественное определение хлоридов. Хлориды определяют титрованием пробы анализируемой воды нитратом серебра в присутствии хромата калия как индикатора. Нитрат серебра дает с хлорид-ионами белый осадок, а с хроматом калия - кирпично-красный осадок хромата серебра. Из образовавшихся осадков меньшей растворимостью обладает хлорид серебра. Поэтому лишь после того, как хлорид-ионы будут связаны, начинается образование красного хромата серебра. Появление слабо-оранжевой окраски свидетельствует о конце реакции. Титрование можно проводить в нейтральной или слабощелочной среде. Кислую анализируемую воду нейтрализуют гидрокарбонатом натрия.
В коническую колбу помещают 100 мл исследуемой воды, прибавляют 1 мл 5%-ного раствора хромата калия и титруют 0,05 н. раствором нитрата серебра при постоянном взбалтывании до появления слабо-красного окрашивания.
Содержание хлоридов (X) в мг/л вычисляют по формуле:
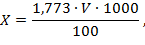
где 1,773 - масса хлорид-ионов (мг), эквивалентная 1 мл точно 0,05 н. раствора нитрата серебра;
V - объем раствора нитрата серебра, затраченного на титрование, мл. Техника безопасности! После работы обязательно вымыть руки.
8.2.3.8. Сульфаты [37, 38]
 Концентрация сульфатов в воде водоемов-источников водоснабжения допускается до 500 мг/л.
Концентрация сульфатов в воде водоемов-источников водоснабжения допускается до 500 мг/л.
Содержание сульфатов в природных, поверхностных и подземных водах обусловлено выщелачиванием горных пород, биохимическими процессами и др. В северных водоемах сульфатов обычно не много; в южных районах, где воды более минерализованы, содержание содержание сульфатов увеличивается. Сульфаты попадают в водоемы также со сбросами сточных вод.
Качественное определение с приближенной количественной оценкой. В пробирку вносят 10 мл исследуемой воды, 0,5 мл раствора соляной кислоты (1:5) и 2 мл 5%-ного раствора хлорида бария, перемешивают. По характеру выпавшего осадка определяют ориентировочное содержание сульфатов: при отсутствии мути - концентрация сульфат-ионов менее 5 мг/л; при слабой мути, появляющейся не сразу, а через несколько мин.. -5-10 мг/л; при слабой мути, появляющейся сразу после добавления хлорида бария, - 10-100 мг/л; сильная, быстро оседающая муть свидетельствует о достаточно высоком содержании сульфат-ионов (более 100 мг/л).
Количественные методы определения сульфат-ионов
1. Турбидиметрическое определение - определение сульфат-ионов в виде сульфата бария в кислой среде с помощью стабилизирующего реактива, в качестве которого можно использовать 0,5%-раствор желатина.
Сначала готовят шкалу стандартных растворов. Для этого в 12 пронумерованных колб на 50 мл отбирают пипеткой определенные объемы основного стандартного раствора в соответствии с табл. 8.13, доводят объем в каждой из колб до 50 мл дистиллированной водой и перемешивают.

Затем в 12 пронумерованных пробирок отбирают по 5 мл раствора из соответствующей колбы, а в 13-ю - 5 мл исследуемой воды. Во все пробирки прибавляют по 2 капли соляной кислоты 1:1, по 3 мл раствора желатина и тщательно перемешивают. Пробирки просматривают сверху на черном фоне и определяют концентрацию сульфат-ионов, сравнивая интенсивность помутнения пробы и шкалы стандартных растворов (табл. 8.14).
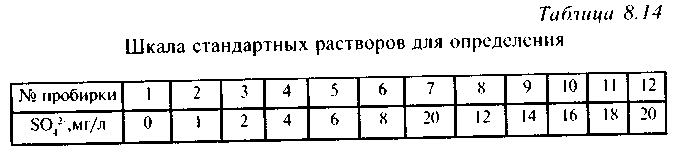
Приготовление основного стандартного раствора
0,091 г безводного сульфата калия растворяют в дистиллированной воде в мерной колбе на 100 мл (в 1 мл содержится 0,5 мг сульфатов).
2. Гравиметрическое определение - осаждение сульфатов в кислой среде хлоридом бария в виде сульфата бария. Метод применим в широком диапазоне концентраций.
200 мл исследуемой воды помещают в химический стакан, прибавляют 2-3 капли индикатора метилового оранжевого и соляную кислоту до розовой окраски раствора. Смесь нагревают до кипения и упаривают до 50 мл. В горячий раствор при помешивании вносят 10 мл горячего 5%-ного раствора хлорида бария. После осветления раствора проверяют полноту осаждения, прибавляя 1-2 капли 5%-ного раствора хлорида бария (отсутствие мути свидетельствует о полном осаждении сульфатов), и оставляют на сутки для «созревания» (при созревании происходит укрупнение кристаллов сульфата бария, что необходимо для уменьшения потерь при фильтровании). Затем приступают к отделению осадка от раствора. Для этого лучше использовать мелкопористый обеззоленный фильтр «синяя лента». Фильтр складывают вчетверо, вставляют в сухую и чистую воронку, расправляют, плотно прижимают к стенкам воронки и смачивают дистиллированной водой. Затем воронку с фильтром помещают в кольцо штатива и, подставив под воронку чистый стакан, декантируют (сливают) по стеклянной палочке жидкость на фильтр, стараясь не взмучивать раствор. Когда жидкость над осадком будет отделена, приступают к промыванию осадка. Для этого осадок в стакане промывают декантацией 2-3 раза небольшими порциями (15-20 мл) промывной жидкости (100 мл дистиллированной воды, подкисленной 2 мл серной кислоты 1:3). Затем новыми порциями промывной жидкости переносят осадок на фильтр. Осадок на фильтре промывают 1%-ным раствором нитрата аммония до отрицательной реакции на хлорид-ион в промывной воде (по нитрату серебра).
После этого воронку вместе с фильтром помещают в сушильный шкаф для высушивания (не следует пересушивать, иначе фильтр будет ломаться). Подсушенный осадок вместе с фильтром помещают в предварительно прокаленный и взвешенный тигель, ставят его в фарфоровый треугольник и небольшим пламенем горелки обугливают фильтр, не допуская воспламенения. Затем тигель при помощи тигельных щипцов переносят в муфельную печь и прокаливают при 700-800° С в течение часа, охлаждают в эксикаторе и взвешивают.
Расчет проводят по формуле:
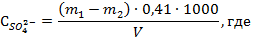
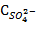 – концентрация сульфат-иона, мг/л;
– концентрация сульфат-иона, мг/л;
m1 - масса тигля с осадком, г;
m2 - масса пустого тигля, г;
V - объем воды, взятой для анализа, мл;
0,41 - коэффициент для пересчета сульфата бария на сульфат-ион.
8.2.3.9. Исследование качества воды водоемов методом автографии на фотобумаге [27]
Окислительно-восстановительные условия в почвах и илах оказывают заметное влияние на развитие растительного и животного населения этих субстратов.
В окислительной (аэробной) среде, достаточно увлажненной и содержащей свободный кислород, процессы минерализации органических остатков протекают быстро. При этом образуются полностью окисленные соединения, служащие пищей для растений, например нитраты, фосфаты, анионы многих других микроэлементов.
При малом содержании кислорода в субстрате развиваются восстановительные (анаэробные) процессы. В этих условиях разложение остатков замедляется; в среде накапливаются восстановители, отрицательно влияющие на развитие растений. Однако временное состояние восстановленности в почвах имеет и полезную сторону. Становятся подвижными многие ранее не доступные растениям элементы - железо, марганец, а также ионы многих других микроэлементов. Происходит накопление аммонийных солей в почве, повышается активность многих почвенных ферментов (дегидрогеназ, пероксидаз и др.).
Таким образом, чередование аэро- и анаэробиозных условий в почве необходимо для нормального существования организмов, использующих почву как среду обитания. Длительный же анаэробиоз (как и аэробиоз) для них нежелателен.
Разложение органических остатков в почвах и илах происходит в основном благодаря деятельности микроорганизмов, групповой состав которых зависит от уровня окисленности среды. В связи с этим микроорганизмы могут служить биоиндикаторами окислительно-восстановительных условий в указанных субстратах.
В окисленных средах преобладают аэробы, для развития которых необходим кислород. В средах, где кислорода мало и содержатся восстановители (молекулярный водород, сероводород, закисные формы металлов), преимущественно развиваются анаэробы, для которых присутствие кислорода не обязательно или даже вредно. Анаэробы активны по отношению к среде, потому что продукты их жизнедеятельности содержат восстановители, накопление которых делает среду все более восстановленной.
Количественное определение аэробов и анаэробов в субстратах возможно, но методически довольно сложно и выполняется, как правило, в специальных микробиологических лабораториях. Для оценки уровня окисленности (восстановленности) среды имеются более доступные методы. В частности, уровень восстановленности почвы, донных отложений и других субстратов можно ориентировочно определять с помощью аппликационного метода - автографии на фотобумаге.
Методика
Метод основан на восстановлении бромистого серебра, находящегося в эмульсии засвеченной фотобумаги, восстановленными веществами изучаемого субстрата. При этом в эмульсионном слое фотобумаги образуется множество частиц металлического серебра в виде черных и бурых пятен. Интенсивность окраски пятен тем больше, чем выше восстановленность среды в местах соприкосновения фотоэмульсии с почвой.
Поскольку восстановительные условия в придонных субстратах создаются во многом благодаря деятельности анаэробов, фотобумага тем самым регистрирует уровень активности этих микроорганизмов в грунте. Аэробы цвета фотобумаги не изменяют, она остается практически белой.
Таким образом, одновременно определяется и уровень восстановленности среды, и уровень активности анаэробных микроорганизмов в исследуемом субстрате.
Восстановленные и окисленные участки на фотобумаге четко различаются по цвету. Более темные пятна свидетельствуют о высокой концентрации восстановленных веществ - продуктов жизнедеятельности анаэробов. Слабоокрашенная поверхность на фотобумаге соответствует тем местам субстрата, где преобладают окислительные условия.
На отпечатках, называемых аппликациями, или автографиями, и получаемых при исследовании почв, распределение окисленных и восстановленных зон носит в основном очаговый характер. Черные восстановленные участки фотобумаги, как правило, соответствуют скоплениям продуктов жизнедеятельности микроорганизмов вокруг мертвых органических остатков (например, соломы), где условия для развития анаэробов оказались благоприятными. Автографии илов обычно окрашены более равномерно.
Следует отметить, что исследования на искусственных средах с чистыми культурами анаэробных микроорганизмов показали, что различные их экологические группы создают разный уровень восстановленности среды. Так, сульфатредуцирующие бактерии, основу выделений которых составляет сероводород, окрашивают фотобумагу в черный или густокоричневый цвет. Менее густая коричневая окраска пятен наблюдается в культурах клостридий, выделяющих метан, водород, ацетон и др. Еще слабее окраска фотобумаги в культурах плектридий.
Эти факты можно объяснить большой активностью сероводорода как восстановителя благодаря его хорошей растворимости (по сравнению, например, с молекулярным водородом или метаном) в воде.
Разумеется, в природных образцах почвы или ила потемнение фотобумаги есть суммарный результат деятельности всех групп анаэробов, живущих в них.
Аппликационный метод дает хорошие результаты при экологической диагностике почв техногенных территорий и при изучении состояния водоемов по донным отложениям.
Промышленные выбросы в большинстве своем ядовиты для почвенных микроорганизмов. Так, например, выбросы, содержащие соединения азота, угнетающе действуют на процессы аммонификации и нитрификации, способствуют созданию в почвах анаэробных условий, которые можно выявить с помощью фотоаппликаций.
В загрязненных прудах, озерах и реках, потерявших способность к самоочищению, вода обеднена кислородом, а донные отложения представляют собой ядовитый, сильно восстановленный субстрат, непригодный для жизни донных животных (например, червей, личинок комаров, поденок, ручейников).
При обследовании водоема аппликационный метод дает возможность выявить наиболее загрязненные его участки и выяснить причины загрязнения.
Перед отбором проб необходимо провести визуальное изучение объекта исследования (участка реки, пруда и т. п.), определить и отметить на карте-схеме объекта наиболее загрязненные участки (выходы стоков заводов и ферм, отстойники и т. п.), относительно чистые и чистые (прозрачная вода без запаха и пленок и т. п.).
Изучается водная и прибрежная растительность; при необходимости делается их гербарий. Отмечая на карте-схеме участки отбора, надо помнить одно правило: от частоты точек отбора зависят точность исследования и объективность оценки экологического состояния объекта. Из одной намеченной точки отбора рекомендуется брать не менее 2-3 образцов на расстоянии 20-30 см друг от друга.
Усредненный образец ила помещается в целый плотный полиэтиленовый пакет, в который заливается около 100 мл воды из обследуемого водоема. Пакет с образцом перевязывается, к нему прикрепляется этикетка (ее можно вложить в верхнюю часть пакета выше завязки), в которой указываются: дата и место отбора пробы, примерная глубина взятия образца, а также фамилия исследователя.
Пробы ила в зависимости от целей и задач исследования отбирают черпаком из поверхностного слоя непосредственно с берега или с лодки.
Техника определения уровня восстановленности субстрата с помощью автографии на фотобумаге состоит в следующем.
1. Образцы ила или почвы, взятые накануне, но не более чем за сутки до начала опыта, помещают в литровые или пол-литровые химические стаканы (или банки). Образцы почвы заливают дистиллированной водой, а илов - водой из исследуемого водоема до их полного насыщения. Для заполнения водой всех пор субстрата образцам дают выдержку около одного часа. Донные отложения должны быть покрыты примерно сантиметровым слоем воды.
2. Фотобумагу (глянцевую, тонкую, нормальную) нарезают в виде полос размером 4x9 см и после нумерации в соответствии с номерами образцов помещают вертикально во влажные образцы. Для этого торцом металлической линейки или ножом с широким лезвием делают в образце щель глубиной около 8,5 см и шириной 4-5 см, опускают в нее полоску фотобумаги, а затем ножом или линейкой прижимают субстрат к фотобумаге. Не рекомендуется держать фотобумагу на свету более 15-20 минут. Этого времени вполне хватит для се нарезки, маркировки и установки в изучаемый субстрат.
3. После 72-часовой экспозиции фотобумагу извлекают из субстрата, быстро промывают в обычной, а затем дистиллированной воде, закрепляют в течение 5 минут в 25%-ном растворе гипосульфита и снова промывают.
4. Высушивают полоски на фильтровальной бумаге так, чтобы эмульсионный слой был сверху.
Чтобы результаты эксперимента с разными образцами можно было сравнивать, желательно пользоваться фотобумагой из одной и той же партии и закладывать ее в образцы на одно и то же время. Если образцы почвы или донных отложений взяты без нарушения их структуры, фотобумага покажет кроме уровня восстановленности (густота окраски) еще и распределение восстановленных зон в образце.
8.2.4. Дополнительные методы
8.2.4.1. Вкус и привкус воды [37]
Вкус и привкус воды, обнаруживаемые непосредственно в воде (или для водоемов хозяйственно-питьевого назначения после хлорирования), не должны превышать 2 баллов.
Вкус и привкусы оценивают как качественно, так и количественно по интенсивности в баллах. Различают четыре вида вкуса: соленый, горький, сладкий и кислый. Остальные вкусовые ощущения называют привкусами: хлорный, рыбный, металлический и т.п. Интенсивность вкуса и привкуса определяют по 5-балльной шкале так же, как и запах.
Вкус и привкус определяют в сырой воде при комнатной температуре и 60°С. В воде открытых водоемов и источников сомнительных в санитарном отношении вкус воды устанавливают только после ее кипячения.
При исследовании в рот набирают 10-15 мл воды, держат несколько минут (не проглатывать!) и определяют характер и интенсивность привкуса.
8.2.4.2. Осадок [37]
Осадок характеризуют по следующим параметрам: нет, незначительный, заметный, большой. При очень большом осадке указывают толщину слоя в мм. По качеству осадок определяют как хлопьевидный, илистый, песчаный и т.п. с указанием цвета - серый, бурый, черный и др. Осадок в воде водоемов отмечают через 1 ч. после взбалтывания пробы, в воде подземных источников - через 24 ч.
В период выпадения осадка качественно описывают осветление - незаметное, слабое, сильное, вода прозрачна.
8.2.4.3. Щелочность [37]
Под щелочностью понимают способность некоторых компонентов, содержащихся в воде, связывать эквивалентное количество сильной кислоты. Щелочность создают все катионы, которые в воде были уравновешены гидроксид-ионами, анионами слабых кислот (например, карбонаты, гидрокарбонаты). Щелочность определяется количеством сильной кислоты, необходимой для замещения этих ионов. Расход кислоты эквивалентен их общему содержанию в воде и выражает общую щелочность воды.
В обычных природных водах щелочность зависит в основном от присутствия гидрокарбонатов щелочноземельных металлов, в меньшей степени щелочных. В этом случае значение рН воды не превышает 8,3. Растворимые карбонаты и гидрокарбонаты повышают значение рН более 8,3.
Титриметрическое определение щелочности основано на титровании воды сильной кислотой. Количество раствора, необходимое для достижения рН 8,3, эквивалентно свободной щелочности, а для достижения рН 4,5 - общей щелочности. При рН меньше 4,5 ее щелочность равна нулю.
Конечную точку при титровании находят визуально. Щелочность, особенно свободную, следует определять не позднее чем через 24 ч. после отбора пробы. Результаты выражают в ммолях эквивалентов на 1 л, что соответствует числу миллилитров 0,1 М раствора соляной кислоты, израсходованной на титрование 100 мл исследуемой воды.
При визуальном определении мешает интенсивная окраска воды. Ее устраняют, прибавляя активированный уголь и фильтруя пробы. Мутные воды фильтруют через бумажный мелкопористый фильтр. Для более точного определения щелочности предварительно вытесняют свободный углекислый газ, продувая воздух, так как высокие концентрации диоксида углерода мешают обнаружить переход окраски при титровании.
Для анализа потребуется:
1. Раствор соляной кислоты (0,1 M), который можно приготовить не из фиксанала, а из приблизительной концентрации с последующим определением поправочного коэффициента к 0,1 М раствору НС1 по карбонату натрия. Поправочный коэффициент К рассчитывают по формуле:

где V - объем 0,1 н. раствора соляной кислоты, израсходованной на титрование 20 мл 0,1 н. раствора карбоната натрия.
2. Фенолфталеин, 0,5% раствор. В 50 мл 96%-ного этилового спирта растворяют 0.5 г фенолфталеина и разбавляют 50 мл дистиллированной воды, добавляют по каплям 0,01 М раствор гидроксида натрия до появления заметной розовой окраски.
3. Метиловый оранжевый, 0,05% водный раствор.
Свободная щелочность. Ход определения. Отмеряют 100 мл исследуемой воды (при высокой щелочности берут меньший объем и разбавляют до 100 мл прокипяченной и охлажденной дистиллированной водой), прибавляют 2 капли 0,5% фенолфталеина и титруют на белом фоне 0,1 М раствором соляной кислоты до полного обесцвечивания.
Общая щелочность. Отмеривают 100 мл пробы, прибавляют 2 капли метилоранжа, затем продувают воздух в течение 2-3 мин. и титруют 0,1 М раствором соляной кислоты на белом фоне до начала перехода окраски метилового оранжевого из желтой в оранжевую. Вновь продувают воздух 2-3 мин., и если возвращается первоначальная окраска, то дотитровывают. Титрование считают законченным, если после продувания воздуха окраска раствора не меняется.
Расчет свободной (С) и общей (Об) щелочности (ммоль эквивалентов в литре) производят по формулам:
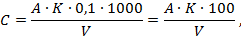
где А - объем 0,1 М раствора соляной кислоты, израсходованной на титрование по фенолфталеину, мл;
К - поправочный коэффициент к 0,1 М раствору НСl;
V - объем пробы воды, взятый для анализа, мл.
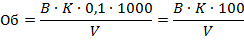
где В - объем 0,1 М раствора соляной кислоты, израсходованной на титрование по метиловому оранжевому, мл;
К - поправочный коэффициент к 0,1 М раствору НСl;
V - объем пробы воды, взятый для анализа, мл.
Общая и свободная щелочность находятся в зависимости от количественного соотношения гидрокарбонат-, карбонат- и гидроксид-ионов. По величине свободной и общей щелочности можно косвенно вычислить количество этих ионов.
Расчет основан на предположении, что щелочность вызывается в основном ионными формами диоксида углерода и в меньшей степени гидроксид-ионами. Расчет дает приблизительные результаты. В зависимости от соотношения свободной (С) и общей (Об) щелочности возможны следующие случаи расчета.
Величина свободной щелочности равна концентрации карбонат-ионов (ммоль-экв./л). Умножая значение свободной щелочности на 30 (эквивалент карбонат-иона), получаем содержание карбонат-ионов (мг/л).
Величина общей щелочности равна величине концентрации гидрокарбонат-ионов (ммоль-экв./л). Умножая значение общей щелочности на 61 (эквивалент гидрокарбонат-иона), получаем содержание гидрокарбонат-ионов (мг/л) (табл.8.15).

8.2.4.4. Кислотность[37, 38]
Кислотностью называется содержание в воде веществ, вступающих в реакцию с гидроксид-ионами. Расход гидроксида выражает общую кислотность воды. В обычных природных водах кислотность в большинстве случаев зависит только от содержания свободного углекислого газа. Естественную часть кислотности создают также гуминовые и другие слабые органические кислоты. В этих случаях рН воды не бывает ниже 4,5.
В загрязненных водоемах может содержаться большое количество сильных кислот или солей за счет сброса промышленных сточных вод. В этих случаях рН может быть ниже 4,5. Часть общей кислотности, снижающей рН ниже 4,5, называется свободной.
Кислотность воды определяют титрованием раствором сильной щелочи. Количество титрованного раствора, израсходованного до получения рН 4,5, соответствует свободной кислотности; количество же, израсходованное до получения рН 8,3, - общей. Если рН > 8,3, то се кислотность равна 0. Для определения кислотности воду титруют 0,1 М раствором NaOH. Конец титрования определяют визуально. Кислотность выражают в ммоль эквивалентов на 1 л. Определению мешает свободный хлор. Его устраняют добавлением тиосульфата натрия.
Свободная кислотность. Она определяется, если рН пробы < 4,5 (кислая реакция по метиловому оранжевому), т.е. проба содержит свободную кислоту. К 100 мл пробы добавляют 2 капли раствора метилового оранжевого и титруют на белом фоне 0,1 н. раствором NaOH до появления желтой окраски индикатора.
В загрязненных водоемах может содержаться большое количество сильных кислот или солей за счет сброса промышленных сточных вод. В этих случаях рН может быть ниже 4,5. Часть общей кислотности, снижающей рН ниже 4,5, называется свободной.
Кислотность воды определяют титрованием раствором сильной щелочи. Количество титрованного раствора, израсходованного до получения рН 4,5, соответствует свободной кислотности; количество же, израсходованное до получения рН 8,3, - общей. Если рН > 8,3, то ее кислотность равна 0. Для определения кислотности воду титруют 0,1 М раствором NaOH. Конец титрования определяют визуально. Кислотность выражают в ммоль эквивалентов на 1 л. Определению мешает свободный хлор. Его устраняют добавлением тиосульфата натрия.
Свободная кислотность. Она определяется, если рН пробы < 4,5 (кислая реакция по метиловому оранжевому), т.е. проба содержит свободную кислоту. К 100 мл пробы добавляют 2 капли раствора метилового оранжевого и титруют на белом фоне 0,1 н. раствором NaOH до появления желтой окраски индикатора.
Общая кислотность. Пробу объемом 100 мл титруют в присутствии 3 капель раствора фенолфталеина 0,1 М раствором едкого натра до появления розовой окраски индикатора, не исчезающей в течение 1 мин.
Расчет свободной (С) и общей (Об) кислотности (ммоль-экв./л) проводят по формулам:

где А - объем 0,1 М раствора NaOH, израсходованного на титрование по метиловому оранжевому, мл;
В - то же по фенолфталеину, мл;
V - объем пробы воды, взятый для определения, мл.
К - поправочный коэффициент к 0,1 М раствору NaOH, определяемый по формуле:

где V - объем 0,1 н. раствора соляной кислоты (из фиксанала), израсходованной на титрование 20 мл 0,1 н. раствора гидроксида натрия, мл.
8.2.4.5. Свинец[37, 40]
Свинец является одним из основных загрязнителей окружающей среды. Он обладает способностью поражать центральную и периферическую нервную систему, костный мозг и кровь, сосуды, генетический аппарат, нарушает синтез белка, вызывает малокровие и параличи. Большая концентрация свинца тормозит биологическую очистку сточных вод. Основными источниками загрязнения свинцом являются выхлопные газы автотранспорта и сточные воды различных производств.
Допустимая концентрация свинца в воде - 0,03 мг/л.
Обнаружение ионов свинца
Качественное определение с родизонатом натрия. На лист фильтровальной бумаги нанести несколько капель исследуемого раствора и добавить 1 каплю свежеприготовленного 0,2% раствора родизоната натрия. В присутствии ионов свинца образуется синее пятно или кольцо. При добавлении 1 капли буферного раствора синий цвет превращается в красный. Реакция очень чувствительна: обнаруживаемый минимум 0,1 мкг.
Количе
lektsia.com
Определение нитратов в воде - Справочник химика 21
Метод применяют для определения нитрат-ионов в концентрациях от 0,005 до 0,5 мг/л. Более концентрированные по содержанию нитратов сточные воды предварительно разбавляют. [c.188]ДЕВАРДА СПЛАВ — сплав 50% Си, 45% А1 и 5% Zn. Легко растирается в порошок, вытесняет водород из воды даже на холоду. Д. с. применяется в аналитической химии для количественного определения нитратов и нитритов, восстанавливающихся до аммиака, потом улавливают его и титруют. [c.83]
Вода питьевая. Методы определения нитратов [c.533]ОПРЕДЕЛЕНИЕ НИТРАТОВ В ВОДЕ [c.153]
Чистые, прозрачные воды перед определением нитратов фильт ровать не следует. При небольшом содержании в воде взвешенных веществ перед определением нитратов воде дают отстояться. Воды мутные и содержащие значительное количество взвешенных, веществ необходимо перед анализом профильтровать, отбросив первые 100 мл фильтрата. Если вода окрашена, ее следует перед определением обесцветить, обработав гидроокисью алюминия. Метод обработки описан на стр. 117. [c.58]
Предлагаемый метод определения нитратов основан на осаждении Ba(NOa)2, который, как известно, хорошо растворим в воде, но малорастворим в среде безводной уксусной кислоты. [c.439]
Качество воды. Определение нитратов. Часть 2. Спектрометрический метод с 4-фторфенолом после дистилляции [c.528]
Качество воды. Определение удельной электрической проводимости Качество воды. Определение нитратов. Часть 1. Спектрометрический метод с 2,6-диметилфенолом [c.528]
N раствором щелочи [2428, 2893]. Такой способ предложен для определения нитрата калия в черном порохе. 10 г измельченного пороха несколько раз промывают горячей во дой. Фильтрат или его аликвотную часть пропускают через колонку с катионитом в Н-форме и затем промывают колонку водой. Азотную кислоту в фильтрате титруют 0,1—0,05 N раствором едкой щелочи в присутствии метилового красного [24311. Колонку промывают затем избытком соляной кислоты, полученный раствор выпаривают, остаток хлорида калия высушивают и взвешивают [2431]. [c.124]
Методика определения нитратов еще окончательно не разработана. На основании опыта можно сказать, что для анализа питьевых, поверхностных и очищенных сточных вод, содержащих 0,5—50 мг/л нитратов, наиболее пригоден колориметрический метод с фенолдисульфоновой кислотой. Хорошие результаты дает и колориметрический метод с салицилатом натрия. Этим методом определяются 0,1—20 мг/л нитратов. [c.137]
Воды минеральные питьевые лечебные, лечебностоловые и природные столовые ГОСТ 23268.8-78. Воды минеральные питьевые лечебные, лечебно-столовые и природные столовые. Методы определения нитрат-ионов. Унифицированные методы анализа качества вод. Т. 1.4. 1. Методы химического анализа вод. М. СЭВ, 1987. МСХП РФ. МУ по определению хлоридов, нитратов и аммония в водах. (Утв. 14.04.1994 г). М. ЦИНАО, 1996. (Ионометрическое определение нитратов С, 10-14). РД 52.24.8-83 [c.831]
ГОСТ 18826-73 Вода питьевая. Методы определения нитратов [c.6]
ГОСТ 23268.9-78 Воды минеральные питьевые лечебные, лечебно-столовые и природные столовые. Методы определения нитрат-ионов [c.7]
ОПРЕДЕЛЕНИЕ НИТРАТОВ В СТОЧНЫХ ВОДАХ [c.154]
ИСО 7890-1-86 Качество воды. Определение нитратов. Часть 1. Спектрометрический метод с 2,6-диметилфенолом [c.10]
Определение нитрата в свежей дождевой воде. Концентрирование пробы ионным обменом [2858]. [c.242]
Определение нитратов в свежей дождевой воде. Концентрирование проб ионообменной методикой [1469]. [c.293]
О наличии отдельных соединений азота в водах говорится в разделах, посвященных определению нитратов, нитритов, аммиака и органического азота. В материальных балансах водоемов и очистных сооружений учитываются соотношения между содержанием различных соединений азота. За основную величину в этих расчетах принимается суммарное содержание всех присутствующих соединений азота, выражаемое величиной общего содержания азота. Содержание азота можно определить расчетом или непосредственно после перевода всех соединений азота в аммиак. Если общий азот не может быть определен в день отбора, то пробу консервируют прибавлением 1 мл концентрированной серной кислоты или 2—4 мл хлороформа на 1 л пробы. [c.110]
Большое количество нитратов указывает иногда на загрязнение в прошлом фекальными водами. Определение нитратов в грунтовых водах служит оценкой характера процессов минерализации при фильтровании воды через почвенные слои. При исследовании поверхностных вод по содержанию нитратов можно судить о протекающих процессах самоочистки, а при биологической очистке сточных вод — о процессе нитрификации. Некоторые промышленные сточные воды содержат значительные количества нитратов., [c.137]
О наличии отдельных видов азота в воде говорится в разделах, посвященных определению нитратов, нитритов, аммиака и органического азота. В материальном балансе азотистых соединений на сооружениях биохимической очистки учитывается суммарное содержание всех присутствующих соединений азота как в очищенной воде, так и в активном иле, выражаемое величиной общего азота или суммарными аналитическими данными, полученными для отдельных видов азота. Если общий азот не определен в день отбора, то пробу консервируют прибавлением 1 мл концентрированной серной кислоты или [c.36]
Сульфат стрихнина применяют для определения нитрата после восстановления в солянокислом растворе амальгамированным цинком [52, 109], чистым цинком [97, 139] или магнием [155]. В оптимальных условиях чувствительность определения нитрата приближается к 0,02 мг л [68]. Основным недостатком реагента является необходимость соблюдения большой осторожности при восстановлении с целью обеспечить в последующем получение воспроизводимой окраски. Реагент находит некоторое применение при определении нитрата в морской воде [46, 139, 144, 203]. [c.152]
Некоторые бактерии способны значительно изменять азотный баланс пробы. В этом отношении особенно вредно влияют нитрифицирующие бактерии. Влияние активности микроорганизмов можно уменьшить, выполняя определение нитрата немедленно после отбора пробы. Биологические процессы можно несколько ограничить при хранении пробы при температуре, близкой к температуре замерзания, или добавлении на 1 л воды 0,8 мл концентрированной серной кислоты. [c.153]
Для равномерного смачивания целлюлозы нитрующую смесь берут с большим избытком. Степень замещения гидроксильных групп целлюлозы нитратными группами регулируется введением в нитрующую смесь определенного количества воды. Глубоко про-нитрованная целлюлоза представляет собой взрывчатое вещество— так называемый пироксилин. Для получения менее нитрованной целлюлозы—коллоксилинов, применяемых в производстве нитролаков, пленок, целлулоида, подбирают такие условия процесса, чтобы происходило неполное замещение гидроксильных групн (на 70—80%). При этом в нитрующую смесь вводят 18—20% воды, а нитрование проводят при низкой температуре 15—20 °С в течение 30 мин. Нитрат целлюлозы, нерастворимый в нитрующей смеси, отжимают и тщательно промывают водой. Основное количество воды затем снова отжимают, остаток воды вытесняют этиловым спиртом. Сушить нитрат целлюлозы при повышенной температуре опасно. [c.433]
Примечания. 1. При небольшом содержании взвешенных частиц перед определением нитратов воде дают отстояться. Воды, мутные и содержащие значительное количество взвешенных веществ, необходимо профильтровать nepe, t анализом, отбросив первые 100 лм фильтрата. [c.30]
Сколько вещества растворяется в определенном количестве воды Представьте, что вы готовите раствор нитрата калия (КЫО,). Вы наливаете воду в стакан и добавляете полную ложку твердых, белых кристаллов нитрата калия. После того как вы перемешаете воду, твердые кристаллы растворятся. Жидкость останется бесцветной и прозрачной. В полученном растворе вода — растворитель, а нитрат калия — растворенное веществи. [c.52]
Применяют для фотометрического определения нитратов. Готовят два раствора 1) 0,1 г 1-нафтиламина х. ч. растворят в 100 мл воды при кипячении. К охлаждаемому раствору прибавляют 5 мл ледяной уксусной кислоты (или 6 мл 80%-ной или 10 мл 50%-ной). 1-нафтиламин — белое кристаллическое вещество с неприятным запахом (l- xoH,NHa, мол. вес. 143,19). [c.291]
Качество воды. Определение нитратов. Часть 3. Спектрометрический метод с использо-вангаем сульфосалициловой кислоты [c.528]
Определение нитратов в продуктах растенмеводства. В последнее время из-за повышенного содержания нитратов в почвах, питьевой воде и продуктах растениеводства возникла необходимость контроля [c.159]
Вода питьевая Воды грунтовые и поливные МСХП РФ. МУ по ионометрическому определению катионно-анионного состава грунтовых и поливных вод. (Утв. 14.04.1994 г.). М. ЦИНАО, 1995. (Ионометрическое определение нитратов С. 48-52) Методические указания по определению pH, нитратов, хлоридов и фторидов на многоканальном поточном измерителе с использованием ионселективных электродов. М. ЦИНАО, 2000 [c.831]
Способы приготовления и хранения раствора. 0,1 н. раствор нитратй серебра получают растворением рассчитанного количества химически чистого кристаллического AgNOg в определенном объеме воды (от 0,5 до 1 л) или растворением определенной навески химически чистого серебра в химически чистой азотной кислоте. [c.243]
Для некоторых газов между А Г и содержанием влаги (в пре делах от О до 0,1%) соблюдается линейное соотношение. Од нако наклоны линий будут несколько различаться для газов с раз личной теплоемкостью. Для калибровки прибора были использо ваны газовые смеси, содержащие 7% водорода 1,0% кислорода 0,7% этилена 0,6% диоксида углерода и 0,5% (об.) бутана Показано, что этим методом может быть определено даже 0,0005% (об.) БОДЫ (5 млн" ). Энгельбрехт и Дрекслер [28] применили этот метод для прямого определения свободной воды в нитрате аммония, который распыляли в токе сухого азота при комнатной температуре. Количество влаги, удаляемой азотом, определяли путем поглощения пентоксидом фосфора и сравнивали с общим содержанием воды, найденным методом Фишера оказалось, что при распылении нитрата аммония влага удаляется не полностью. Тем не менее, между содержанием влаги, найденным методом Фишера, и разностью сопротивлений термисторов выполняется линейное соотношение. Описанным методом можно достаточно надежно определить менее 0,1% воды. Энгельбрехт и Дрекслер [28] сделали заключение, что описанная техника измерений применима для определения содержания свободной воды во многих мелкораздробленных твердых материалах. Десорбция влаги потоком сухого газа может быть использована в сочетании с другими методами определения воды—абсорбционными, электрическими и физическими. [c.208]
Для определения очень малых количеств аммиака или нитратов, как, например, в питьевой воде, применяют колориметрические методы метод Несслера для определепия аммиака и фенолдисульфановый метод для определения нитратов. [c.869]
Ионообменное определение концентрации солей основано на пропускании анализируемого раствора через колонку Н-катионита с последующим промыванием водой и титрованием кислого фильтрата раствором щелочи. Оно наиболее целесообразно при определении таких анионов, содержание которых трудно определить другими меох>-дами. Например, рекомендовано ионообменное определение нитратов в селитрах (натриевой, калийной, кальциевой и аммонийной). [c.445]
Для измерения pH воды широко применяются как лабораторные, так и промышленные рН-метры со стеклянными электродами (см. п. 9.14.5.1). В отдельных случаях могут использоваться металлаоксидные электроды, например сурьмяный, молибденовый и др. Имеются также стеклянные электроды для определения содержания в растворе натрия и калия обычно концентрацию их определяют на пламенном фотометре. Изготовляются электроды с ион-селективными мембранами для определения в воде фтора, хлора, брома, иода, сульфидов, сульфатов. Разработаны также электродные системы для измерения концентрации ионов кальция, магния, нитратов и др. Следует, однако, отметить, что с помощью электродов определяется лишь активная концентрация ионов (см. п. 2,14.4). [c.181]
Полученную кислоту можно оттитровать стандартным раствором основания. Колонку регенерируют путем промывания ее 3—4 н. соляной кислотой и водой. Этот способ применим для определения суммарной концентрации солей, поскольку НА можно вымыть из колонки и оттитровать. Самуэльсон 2 применил этот метод к определению нитратов, точность метода оказалась равной 0,2%. Аналогичным образом можно определить отдельно содержание в растворе сульфатов, перхлоратов, ацетатов, галогенидов и пр. Этот метод позволяет просто определять концентрацию растворов солей, точную навеску которых трудно взять вследствие их гигроскопичности или неопределенного содержания в них воды. Другое применение метода заключается в приготовлении титрованных растворов кислот путем взятия навесок соответствующих солей (HNO3 из AgNOs, H l из Na I и т. д.). [c.571]
В очень селективных индикаторных электродах другого типа используются жидкие ионообмепники. В этих электродах внутренний серебряный электрод погружается в жидкий ионообменник, заряженный в форме ионов, которые нужно определять. Например, кальциевый электрод заполнен фосфорорганическим соединением, содержащим кальций. Ячейка с этим веществом прикрепляется к нижней части электрода при помощи диска из спеченного стекла или пластмассовой мембраны. Основное назначение диска или мембраны — предохранить ионообменник от растворения в анализируемом растворе. Было показано, что действие такого электрода подчиняется уравнению Нернста до концентрации кальция М и что электрод достаточно избирательно реагирует на изменение концентрации ионов кальция. Электроды такого типа были разработаны для определения хлорида, нитрата, перхлората, тетрафторбората, кальция, меди, а также для определения жесткости воды (выраженной в концентрации двухвалентных катионов). [c.416]
Существует несколько методов определения нитратов в природных и очищенных водах 1) с фенолдисульфоновой кислотой при содержании NO3 0,5—50 мг/л 2) колориметрический метод с салицилатом натрия при содержании NO3 0,1—20 мг/л 3) при анализе вод с содержанием NO3 5—-10 мг/л может применяться полярографический метод 4) метод восстановления сплавом Деварда до аммиака с последующей перегонкой используется для анализа сточных вод, содержащих нитраты более 5 мг/л 5) колориметрический метод с восстановлением нитратов до нитритов гидразином применим для концентраций NO3 0,01—2 мг/л. В этом методе, если в растворе присутствуют нитриты, содержание нитратов находят по разности. [c.29]
Метод основан на измерении э.д.с. гальванического элемента, составленного из соответствующих ионселективных электродов и электрода сравнения. Методики (прямой метод и метод добавок) предназначены для определения концентрации ионов аммония и нитрат-ионов в водах. Диапазон определяемых концентраций 1,5—2000 мг/л NHI Определению ионов аммония не мещает присутствие ионов К Определению нитрат-ионов в диапазоне концентраций —10 М не мещает присутствие в анализируемой пробе ионов 1 , F , НСОзТ СНзСОО , SOI при превышении их концентрации в 100, 1000, 500, 500 и 1000 раз соответственно. [c.116]
В табл. 2 представлены результаты определения нитрата фенолдисульфокислотным, ксиленоловым [81, 199] и бруциновым методами в одинаковых пробах поверхностной и грунтовой воды. Как правило, ксиленоловый метод дает более низкие значения, чем два других метода. Анализируемые пробы воды не содержали нитрита, а хлорид осаждался сульфатом серебра. В пробе 6 во время определений нитрата происходило развитие водорослей. Как показывает метод добавок, наличие водорослей всегда приводит к заниженным результатам для нитрата, получаемым всеми методами. Вообще же наиболее точные результаты для нитрата дает фенолдисульфокислотный метод. [c.150]
См. Унифицированные методы анализа вод. М., Хиния, 1973, где описаны полярографические методы определения в водах нитрат-, иодид-ионов, медн цинка, кадмия, свинца и никеля, основанные на трудах аналитиков Чехословакии., [c.18]
chem21.info
Определение нитратов в питьевой и природных водах — КиберПедия
Метод основан на измерении эдс (разности потенциалов) гальванического элемента, состоящего из нитратселективного и хлоридсеребряного электродов. Для создания постоянной ионной силы измеряемых растворов используется раствор алюмокалиевых квасцов.
Аппаратура и реактивы
Иономер с фторидселективным и хлоридсеребряным электродами.
Пипетка градуированная вместимостью 5 мл.
Колбы мерные вместимостью 50 мл – 6 шт.
Химические стаканы вместимостью 150 мл – 2 шт.
Стандартный раствор нитрата калия, 1 М (готовят растворением навес-
ки 101,1 г нитрата калия в 1 л 1 %-ного раствора алюмокалиевых квасцов).
Алюмокалиевые квасцы 1% и 10 %-ные растворы.
Построение градуировочного графика
В колбах вместимостью 50 мл путем последовательного разбавления каждого предыдущего раствора в 10 раз 1 %-ным раствором алюмокалиевых квасцов готовят растворы KNO3 с концентрацией 10-1, 10-2, 10-3, 10-4, 10-5 моль/л.
Растворы тщательно перемешивают, поочередно переносят в химический стакан, опускают электроды и через 2 мин измеряют разность потенциалов (Е, мВ). Начинать измерения необходимо с раствора с наименьшей концентрацией. По полученным данным строят градуировочный график в координатах Е, мВ – рNO3-, (рNO3- = -lg а (NO3-).
Ход анализа
В мерную колбу вместимостью 50 мл приливают 5 мл 10 %-ного раствора алюмокалиевых квасцов и анализируемой воды до метки. Содержимое колбы тщательно перемешивают, переносят в химический стакан и измеряют разность потенциалов как при построении градуировочного графика. По градуировочному графику определяют рNO3- в анализируемой воде и рассчитывают содержание нитрат-ионов, мг/л.
Определение сульфат-ионов в питьевой и природных водах и атмосферных осадках
В природных водах сульфаты содержатся от нескольких миллиграммов в кубическом метре до сотен миллиграммов в литре, в дождевых водах содержание сульфатов от 1 до 20 мг/л, в снежном покрове – от 1 до 20 мг/л.
В природные водоемы сульфаты могут поступать со сточными водами химических, металлургических, машиностроительных, текстильных, пищевых, стекольных, целлюлозно-бумажных, мыловаренных и других производств.
Сульфаты малотоксичны для человека и теплокровных животных. Смертельная доза для человека – 45 г, смертельная концентрация для крупного рогатого скота – 2000 мг/л. Концентрация сульфатов в питьевой воде 1000 – 2000 мг/л вызывает у человека расстройства желудочно-кишечного тракта. Токсическое действие на детей оказывают сульфаты при длительном употреблении воды с содержанием их 600 – 1000 мг/л.
Для гидробионтов сульфаты так же малотоксичны. Средняя смертельная концентрация через 96 часов составляет для дафний 630 мг/л ( длярыб – 869 мг/кг (К2SO4) или 100 мг/л (Na2SO4). Предельно допустимые концентрации сульфатов представлен в табл. 3.4.
Таблица 3.4
ПДК сульфатов в водных объектах
| Водный объект | ПДК, мл/г |
| Питьевая вода | |
| Водоемы рыбохозяйственные | |
| Водоемы хозяйственно-питьевого и культурно-бытового значения | |
| Вода для орошения растений | |
| Сточные воды при сбросе в канализацию и водоемы |
В воде для технологических нужд производств рекомендованы следующие ПДК сульфатов (табл. 3.5).
Таблица 3.5
ПДК сульфатов в воде для технических нужд
| Производство | ПДК, мл/г |
| Сахарные, консервные, морозильные, молочные | |
| Пивоваренные | |
| Прохладительных напитков | |
| Текстильные | |
| Цементные |
Фототурбидиметрическое определение сульфат-ионов
Метод основан на измерении поглощения света суспензией сульфата бария. Для стабилизации суспензии используют гликоль, введенный в реакционную смесь при осаждении сульфата бария по уравнению:
K2SO4 + BaCl2→BaSO4 + 2 KCl
Произведение растворимости сульфата бария ПР(BaSO4) = 10–10. Для обеспечения избирательности определения сульфатов относительно карбонатов, фосфатов и хроматов реакцию проводят в кислой среде. Чувствительность метода – 2 мг/л SO42-.
Аппаратура и реактивы
Фотоэлектроколориметр.
Мерные колбы вместимостью 100 мл – 10 шт.
Градуированные пипетки вместимостью 1, 2, 5 и 10 мл.
Стандартный раствор K2SO4, содержащий 0,5 мг/мл SO42- -ионов. (Готовят растворением 0,9071 г K2SO4 в воде в мерной колбе вместимостью 1 л).
Гликолевый реагент: раствор хлористого бария в смеси этиленгликоля (глицерина) и этанола. Для приготовления этого раствора смешивают один объем 5 %-ного водного раствора BaCl2 с тремя объемами глицерина или этиленгликоля и тремя объемами этилового спирта. Смесь тщательно перемешивают, подкисляют HCl до рН 2,5 – 2,8.
Кислота соляная, раствор 1:1.
Построение градуировочного графика
Для построения градуировочного графика готовят рабочий стандартный раствор с концентрацией 0,05 мг/мл. Для этого 10 мл основного стандартного раствора переносят в мерную колбу на 100 мл, разбавляют дистиллированной водой до метки и тщательно перемешивают.
В мерные колбы вместимостью 100 мл вносят 0, 1, 2, 4, 6, 8, 10, 12, 20 мл рабочего стандартного раствора и разбавляют до метки дистиллированной водой. Концентрация сульфат-ионов в полученных растворах соответственно равна: 0; 0,05; 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; и 1,0 мг/100 мл.
В каждую колбу прибавляют по две капли раствора HCl (1:1) и 5 мл гликолевого реагента. Содержимое колб тщательно перемешивают, выдерживают 20 мин и фотометрируют в кюветах с рабочей длиной 20 мм при длине волны 364 нм (синий светофильтр). По результатам измерений строят градуировочный график.
Ход анализа
В мерную колбу вместимостью 100 мл переносят 100 мл исследуемой воды, добавляют 2 капли HCl (1:1), 5 мл гликолевого реагента и тщательно перемешивают. Через 20 мин измеряют оптическую плотность полученной суспензии и рассчитывают концентрацию сульфат-ионов в исследуемой воде, мг/л.
cyberpedia.su
Нитратов определение в питьевой воде
Применяется также титрование раствором нитрата торня или нитрата циркония ири точном определении фторидов, которые оказывают на человека очень сильное физиологическое действие. Этим методом определяют фториды в питьевой воде и пищевых продуктах. [c.329]Чуйко В. Т. О выборе метода колориметрического определения нитратов в питьевых и технических водах. Зав. лаб., 1946, 12, № 2. с. 171—173. Библ. 11 назв. 6186 Чуйко В. Т. Методы концентрирования при определении следов никеля. Сообщ. 1. ЖАХ, 1947, 2, вып. 6, с. 328—333. Библ. [c.235]
При анализе питьевой воды помехи маловероятны. Магний, цинк, кальций, натрий, калий, фосфаты, сульфаты и нитраты не препятствуют определению. Марганец, цирконий, хром, титан, медь, ванадий, алюминий, бериллий и железо не позволяют провести анализ с высокой точностью. Помехи, вызванные окрашиванием пробы, наличием гуминовых кислот и/или нерастворенными веществами могут быть устранены известными приемами (обесцвечиванием, фильтрованием через фильтр с активированным углем и т.п.). [c.189]ИСО 13395 устанавливает метод определения нитритов, нитратов или их суммарного содержания в различных типах вод — грунтовых, поверхностных, сточных, а также в питьевой воде при содержании нитритов в пределах 0,01—1 мг/л и нитратов в пределах 0,2—20 мг/л (в пересчете на азот). Пределы обнаружения могут быть изменены путем варьирования условий определения на установке проточного анализа. Система также может быть адаптирована для анализа проб морской воды. [c.256]
Нитратов определение в питьевой воде. Содержание нитрат-ионов в питьевой воде не должно превышать допустимого уровня. Концентрацию нитрат-ионов устанавливают, используя нитратный электрод 93-07 и электрод сравнения 90-02. [c.79]
Обзор методов контроля качества углей на основе стандартов ФРГ и ЧССР на выпускаемые в этих странах активные угли дан в монографии [11]. Согласно этим документам, химические свойства углей характеризуются содержанием золы, влаги, железа, свинца, хлоридов, показателем pH, а для активных углей, применяемых в медицине, — содержанием цианидов, сульфидов, хлоридов и нитратов. Для характеристики углей по физико-механическим свойствам контролируют фракционный состав, механическую прочность (сопротивление удару), насыпную плотность, теплоту смачивания. Сорбционные свойства углей контролируют адсорбцией по бензолу, определением времени защитного действия (для противогазовых углей), обесцвечивающей способностью по мелассе и определением полувысоты слоя дехлорирования (для углей, применяемых для обработки питьевой воды). Свойства углей, используемых в медицине, должны контролироваться в соответствии с испытаниями, предписанными фармакопеей или соответствующими стандартами стран [11]. [c.86]
Активационный анализ был использован при определении стронция в питьевой воде [236] и биологических материалах [237—239]. После облучения в реакторе (16 час.) золу органического вещества растворяют в кислоте, добавляют соль неактивного стронция и выделяют Sr в виде нитрата Ш8]. После отделения р.з.э. осаждением с гидроокисью железа (П1) п дополнительной очистки измеряют гамма-излучение образовавшегося Sr (Т./, = 2,8 часа). Чувствительность определения 0,01 мкг Sr [237] область определяемых концентраций 1—50 мгк Sr [238]. [c.116]
Настоящий стандарт распространяется на питьевую воду и устанавливает методы определения содержания нитратов. [c.173]
Анализ вод разного типа чаще всего включает определение анионов. Например, в случае подземных высокоминерализованных вод, употребляемых как лечебные или столовые напитки, обычная аналитическая задача — определение сульфата, хлорида, карбоната и ряда других анионов. В питьевых водах водопроводов определяют хлорид, нитрат, сульфат, а также фторид и другие неорганические компоненты анионной природы. Более сложная задача — контроль анионного состава сточных вод состав этот может быть самым разнообразным. [c.104]
Токсичные соединения. К числу токсичных веществ, присутствие которых в питьевой воде строго лимитируется, отнесены бериллий, молибден, мышьяк, свинец, селен, стронций, нитраты. Определение их в воде, как правило, производится в случаях, когда предполагается наличие этих веществ в воде водоисточника. Кроме того, установлены ПДК алюминия и полиакриламида, добавляемых к воде в процессе обработки. [c.98]
Вода питьевая. Методы определения нитратов [c.533]
ГОСТ 18826-73 Вода питьевая. Методы определения нитратов [c.6]
ГОСТ 23268.9-78 Воды минеральные питьевые лечебные, лечебно-столовые и природные столовые. Методы определения нитрат-ионов [c.7]
Методами ионной хроматографии определяют очень многие анионы в питьевой и технической воде, в продуктах технологической переработки в пищевой, фармацевтической и других отраслях промышленности. Известны методики определения галогенидов, нитрата, нитрита, сульфата, ацетата и т. д., всего свыше 70 анионов неорганических и органических кислот. Число катионов значительно меньше. Методами ионной хроматографии определяют главным образом катионы щелочных и щелочно-земельных металлов, а также органические катионы замещенных солей аммония. Определение многих других катионов оказывается ненадежным, так как они выпадают в осадок в компенсационной колонке с сильноосновной смолой. Ионная хроматография успешно применяется в анализе объектов окружающей среды (атмосферы, воды и т. д.), в клинических исследованиях и многих отраслях промышленности. [c.359]
Иоффе Л. М. Результаты применения спектрального анализа в практике завода. Изв. АН СССР. Серия фнз., 1941, 5, № 2-3, с. 335—342. Резюме на англ. яз. 4045 Иохольсон Д. Б. Новый микрометод количественного определения нитратов в питьевых водах. Лабор. практика, 1941, № 4, с. 19—20. Библ. 10 назв. 4046 [c.162]
Нитрат — один из са.мы.х распространенных анионов. Избыточное содержание нитратов в питьевой воде связано с источниками загрязнения промышленного и сельскохозяйственного происхождения. Загрязнение атмосферы оксидами азота связано с выхлопными газами автомобилей их определение часто проводят после переве- [c.118]
Подземные воды крайне важны для человека, поскольку это основной источник питьевой воды. Например, в США более 50% населения использует подземные воды как источник питьевой воды. Поэтому качество грунтовых вод становится очень важным фактором, и в большинстве развитых стран вода для потребления человеком должна соответствовать определенным стандартам. Грунтовые воды могуг не соответствовать стандартам качества воды, поскольку содержат растворенные составляющие, появляющиеся как из природных, так и антропогенных источников. Типичные механизмы антропогенного загрязнения подземных вод приведены на рис. 3.32. В США основную угрозу для подземных вод составляет утечка из подземных цистерн, сток отходов из септиктенков, сток с сельскохозяйственных полей, мест захоронения городских отходов, а также заброшенных хранилищ вредных отходов. К наиболее часто упоминаемым загрязнителям, поступающим из этих источников, относятся нитраты, пестициды, летучие органические соединения, бензо-Продукты, металлы и синтетические органические химикаты. [c.145]
Вода питьевая Воды грунтовые и поливные МСХП РФ. МУ по ионометрическому определению катионно-анионного состава грунтовых и поливных вод. (Утв. 14.04.1994 г.). М. ЦИНАО, 1995. (Ионометрическое определение нитратов С. 48-52) Методические указания по определению pH, нитратов, хлоридов и фторидов на многоканальном поточном измерителе с использованием ионселективных электродов. М. ЦИНАО, 2000 [c.831]
Определение нитратов в продуктах растенмеводства. В последнее время из-за повышенного содержания нитратов в почвах, питьевой воде и продуктах растениеводства возникла необходимость контроля [c.159]
Органически связанный азот в аминокислотах, пептидах, белках и в ряде других естественных и синтетических органических соединениях определяется суммарно одним определением. В поверхностных водах органически связанный азот появляется как продукт биологических процессов или попадает в них со сбрасываемыми бытовыми и некоторыми промышленными сточными водами. Его содержание указывает на степень загрязненности водоемов. При сопоставлении с результатами определения аммиака, нитритов и нитратов результат определения органического азота указывает на самоочищающую способность водоема. При биологической очистке сточных вод по содержанию азота следят за технологическим процессом и оценивают эффективность установки. В питьевых водах содержание органического азота обычно не определяется. [c.35]
Специфика анализа по определению азотосодеожаших соединений в природных или сточных водах зависит от целей исследования. При анализе питьевой воды можно в ряде случаев ограничиться только определением содержания нитрата, тогда как основная цель при исследовании загрязнения водоема может заключаться в определении аммонийного азота. Общая концентрация азота в воде равна сумме концентраций органического и аммонийного азота и азота в форме нитритов и нитратов. Все результаты испытаний на азот выражаются в мг азота на 1 л. [c.39]
Для определения очень малых количеств аммиака или нитратов, как, например, в питьевой воде, применяют колориметрические методы метод Несслера для определепия аммиака и фенолдисульфановый метод для определения нитратов. [c.869]
Спектрометрический метод ощ>еделения нитратов с использованием суль-фосалицЕловой кислоты устанавливается международным стандартом ИСО 7890 — 3. Метод пригоден для анализа сточной и питьевой воды с диапазоном определения хфи объеме пробы 25 см от (0,003 — 0,013) до 0,2 мг/дм нитратного азота. [c.173]
Спектрометрический метод определения нитратов с использованием сульфосалициловой кислоты устанавливает международный стандарт ИСО 7890—3. Метод пригоден для анализа сточной и питьевой воды с диапазоном определения при объеме пробы 25 мл от 0,003—0,013 до [c.249]
I28, 1287] по определению нитратов в природных водах [1137] по полярографическим методам определения нитратов в природных и сточных водах [480] по методам определения нитратов в питьевой и столовых водах [535]. [c.217]
Настоящий стандарт распространяется на питьевую воду и устанавливает фотометрические методы определения массовых концентращ1Й минеральных азотосодержаших веществ аммиака и ионов аммония (суммарно), нитритов, нитратов. [c.45]
Воды минеральные питьевые лечебные, лечебностоловые и природные столовые ГОСТ 23268.8-78. Воды минеральные питьевые лечебные, лечебно-столовые и природные столовые. Методы определения нитрат-ионов. Унифицированные методы анализа качества вод. Т. 1.4. 1. Методы химического анализа вод. М. СЭВ, 1987. МСХП РФ. МУ по определению хлоридов, нитратов и аммония в водах. (Утв. 14.04.1994 г). М. ЦИНАО, 1996. (Ионометрическое определение нитратов С, 10-14). РД 52.24.8-83 [c.831]
Методика определения нитратов еще окончательно не разработана. На основании опыта можно сказать, что для анализа питьевых, поверхностных и очищенных сточных вод, содержащих 0,5—50 мг/л нитратов, наиболее пригоден колориметрический метод с фенолдисульфоновой кислотой. Хорошие результаты дает и колориметрический метод с салицилатом натрия. Этим методом определяются 0,1—20 мг/л нитратов. [c.137]
Нитраты встречаются почти во всех видах вод. В поверхностных и подземных водах количество их обычно незначительно, однако в некоторых типах подземных вод концентрация нитратоа может быть высока. При концентрациях нитратов 0,6—50 мг/л в питьевых и поверхностных водах наиболее удобным является кело-риметрический метод определения с фенолдисульфоновой кислотой. Хорошие результаты дает и колориметрический метод с салицилз-том натрия при концентрациях 0,1— 20 мг/л. [c.176]
МЕТОД ОПРЕДЕЛЕНИЯ С ДЙМЕТИЛФЕНОЛОМ Метод прямого анализа питьевой и природной воды на содержание нитратов установлен в первой части международного стандарта ИСО 7890. Данньш методом можно определять концентрацию нитратного азота в исследуемой пробе от 0,06 до 25 мг/л. [c.242]
Природные поверхностные воды (как и подземные воды зоны активного водообмена) но своему составу, как правило, вполне пригодны непосредственно для питьевых целей. Улучшение органолептических свойств легко достигается на водопроводных станциях процессами коагуляции, фильтрации и окисления, вследствие чего для незагрязненных природных водоисточников объем аналитического контроля мог бы ограничиваться определением мутности (прозрачности) и цветности воды. Требования к качеству воды со стороны промышленных водопользователей зависят от особенностей технологического использования воды, которые и определяют минимально необходимый аналитический контроль исходной воды. Наиболее типично определение состава и качества воды [3]. В водо определяют жесткость, кислотность, мутность, pH, цветность, ш елочность, удельную электропроводность, масла, а также содержание бора, фтора, железа, кальция, натрия, магния, марганца, никеля, меди, свинца, цинка, хрома(VI), орто- и полифосфатов, нитрат-, нитрит-, сульфат-, сульфид-, сульфит-, хлорид-ионов, кремневой кислоты, аммиака, углекислого газа, растворенного кислорода, гидразина, тапнина, лигнина кроме того, определяют вес сухого остатка — до и после фильтрования. [c.8]
Амперометрический метод позволяет определять активный хлор в питьевой и сточной водах, используя в качестве титранта Hg2(NO )2. Относительная ошибка определения активного хлора в интервале концентраций 0,009—3,4 мг 1—2%. Такого же порядка ошибка наблюдается при амперометрическом определении хлорид-иона. В [47] дана методика определенпя хлорид-ионов в сточных водах нефтеперерабатывающих заводов, основанная на использовании в качестве титранта раствора нитрата серебра на фоне смеси нзоамплового и этилового спиртов (15 1), содержащей добавки Mg(NOз)2, СНзСООН и желатина вращаю- [c.160]
Для определения химических форм элементов используют все инструментальные методы, обеспечивающие необходимые пределы обнаружения элементов. Для ряда элементов, главным образом, неметаллов, разработаны и применяются в практике анализа для оценки качества природных, питьевых и сточных вод методы определения как суммарных содержаний, так и различных молекулярных и ионных форм. Панример, для серы предусматривается раздельное определение сульфат-, сульфид-, сульфит- и тиосульфат-ионов [9 - 10]. При оценке содержания фосфора также раздельно определяют полифосфаты, эфиры фосфорной кислоты и растворенные ортофосфаты [9 - 10]. Содержание азота в водах характеризуется главным образом концентрацией свободного аммиака и ионов аммония, а также нитрит- и нитрат-ионов, аналогичная ситуация для пары хлорид-свободный хлор [9 - 10]. Для раздельного определения химических форм азота, фосфора, серы, хлора и других широко применяют спек-трофото-метрические методы анализа, а также различные варианты хроматографии ионной, жидкостной, газовой [9 - 10]. Определение химических форм металлов - более сложная задача, для решения которой требуются высокочувствительные инструментальные методы, обеспечивающие возможность онределения на более низком уровне концентраций, чем их реальные содержания в водах, т.е. на уровне от 1 мкг/л до 1 нг/л. В сочетании с хроматографическими методами разделения эти методы выполняют роль детекторов. Наиболее предпочтителен вариант элемент-селективного детектора, к которым и относятся большинство современных инструментальных методов (ААС, АЭС, МС), в отличие от снектро-фотометрического и электрохимических. [c.25]
chem21.info
Методы определения количества нитратов и нитритов в питьевой воде
Реактивы:
Аммиак, 25% водный раствор
Квасцы алюмокалиевые или квасцы алюмоаммонийные
Кислота сульфаниловая
Кислота уксусная
Нитрат натрия
Реактив Грисса
Хлороформ
Вода дистиллированная
Все реактивы должны быть квалифицированы х.ч. или ч.д.а.
Подготовка к анализу
Приготовление основного стандартного раствора.
1,497 г нитрита натрия NaNO2, взвешенного с погрешностью не более 0,0005 г, растворяют в мерной колбе вместимостью 1 л в небольшом количестве дистиллированной воды и доводят этой водой до метки. В 1 мл раствора содержится 1 мг нитритов. Раствор консервируют добавлением 1 мл хлороформа, хранят в склянке из темного стекла в течение нескольких месяцев, если нет помутнения, хлопьев, осадка.
Приготовление рабочего стандартного раствора.
1 мл основного стандартного раствора помещают в мерную колбу вместимостью 1 л и доводят до метки дистиллированной водой. В 1 мл этого раствора содержится 0,001 мг нитритов. Раствор применяют свежеприготовленным.
Приготовление реактива Грисса, раствора в уксусной кислоте.
10 г сухого реактива Грисса, взвешенного с погрешностью не более 0,1 г, растворяют в 100 мл 12%-ного раствора уксусной кислоты.
Приготовление уксусной кислоты, 12%-ного раствора.
25 мл ледяной уксусной кислоты разбавляют дистиллированной водой
до 200 мл.
Приготовление суспензии гидроксида алюминия.
125 г алюмокалиевых квасцов AlK(SO4)2×12h3O, взвешенных с погрешностью не более 0,5 г, растворяют в 1 л дистиллированной воды, нагревают до 60°С и постепенно прибавляют 55 мл 25%-ного раствора аммиака при постоянном перемешивании. После отстаивания осадок переносят в большой стакан и промывают декантацией сначала дистиллированной водой, а затем безаммиачной дистиллированной водой до отсутствия реакции на аммиак.
Ход анализа
К 50 мл исследуемой или осветленной пробы (или к меньшему объему, содержащему не более 0,3 мг нитритов, разбавленному дистиллированной водой до 50 мл) прибавляют 2 мл раствора реактива Грисса, перемешивают. Через 40 минут (или через 10 минут при помещении пробы в водяную баню при температуре 50-60°С) фотометрируют при длине волны 520 нм по отношению к раствору сравнения (дистиллированной воде, в которую добавлен реактив). Массовую концентрацию нитритов находят по калибровочному графику.
Построение калибровочного графика
В мерные колбы вместимостью 50 мл вносят 0; 0,1; 0,2; 0,5; 1,0; 2,0; 5,0; 10,0; 15,0 мл рабочего стандартного раствора и доводят объем до метки дистиллированной водой. Получают растворы с содержанием 0; 0,002; 0,004; 0,01; 0,02; 0,04; 0,10; 0,20; 0,30 мг/л нитритов. Далее проводят анализ и фотометрируют, как при исследовании пробы. По полученным результатам рассчитывают уравнение регрессии и строят калибровочный график, откладывая по оси абсцисс массовые концентрации нитритов в мг/л, а по оси ординат соответствующие им значения оптической плотности (см. приложение 2). График должен быть прямолинейным.
Обработка результатов
Массовую концентрацию нитритов (Х1) в мг/л вычисляют по формуле:
Х1 = С*50/V, где:
С- массовая концентрация, найденная по калибровочному графику или рассчитанная по уравнению регрессии, мг/л нитритов;
V- объем пробы, взятый для анализа, мл;
50- объем стандартного раствора, мл.
За окончательный результат анализа принимают среднее арифметическое результатов двух параллельных определений, допускаемые расхождения между которыми не должны превышать 10%.
Построение калибровочного графика
Оптическая плотность окрашенных растворов измерялась на фотоэлектроколориметре при длине волны 490 нм. В таблице 5 приведены данные для построения калибровочного графика по определению содержания нитритов.
Таблица 5
Данные для калибровочного графика по определению содержания нитритов
Vстанд. раствора, мл | 0,1 | 0,2 | 0,5 | 1,0 | 2,0 | 5,0 | 10,0 | 15,0 | 15,0 | 20,0 | 30,0 |
Снитратов, мг/л | 0,005 | 0,007 | 0,010 | 0,020 | 0,040 | 0,100 | 0,200 | 0,300 | 0,150 | 0,200 | 0,300 |
Dсред. | 0,003 | 0,006 | 0,010 | 0,028 | 0,060 | 0,153 | 0,300 | 0,460 | 0,700 | 0,850 | 0,980 |
По полученным результатам построили калибровочный график, откладывая по оси абсцисс массовые концентрации нитрит-ионов в мг/л, а по оси ординат – соответствующие значения оптической плотности.
II.2. Результаты и их обсуждение
Отбор проб проводился в осенний – 2005 года; весенний, летний и осенний – 2006 года; зимний и весенний – 2007 года периоды из пяти источников питьевого водоснабжения разных микрорайонов г. Кирова (р-н пл. им. Лепсе, р-н центрального рынка, р-н Центральной гост-цы, р-н Филейки, р-н Чижи). Места отбора проб были выбраны таким образом, чтобы охватить практически всю площадь города. Кроме того, на всю охваченную территорию вода поступает с Корчемкинского водозабора.
В ходе проведения анализа на содержание в питьевой воде нитратов получились следующие результаты, представленные в таблице 6.
Таблица 6
Содержание нитратов в питьевой воде в период
с осени 2005 года по весну 2007 года
Время года | Район отбора пробы | D | Содержание нитратов, мг/л | Средняя С(NO3-) по точке отбора, мг/л | Средняя С(NO3-) по сезонам года, мг/л | ||||
1 | 2 | 3 | 1 | 2 | 3 | ||||
Осень 2005 | Чижи Рынок Филейка Гостиница Лепсе | 0,065 0,050 0,060 0,045 0,075 | 0,060 0,050 0,060 0,050 0,070 | 0,055 0,045 0,055 0,040 0,075 | 0,050 0,035 0,045 0,035 0,060 | 0,045 0,035 0,045 0,035 0,055 | 0,040 0,030 0,040 0,030 0,060 | 0,045 0,033 0,043 0,033 0,058 |
0,042 ± 0,009 |
Весна 2006 | Чижи Рынок Филейка Гостиница Лепсе | 0,150 0,150 0,110 0,100 0,130 | 0,150 0,130 0,130 0,150 0,130 | 0,140 0,150 0,150 0,130 0,140 | 0,125 0,125 0,085 0,085 0,110 | 0,125 0,110 0,110 0,125 0,110 | 0,115 0,125 0,125 0,110 0,115 | 0,122 0,120 0,107 0,107 0,112 |
0,114 ± 0,006 |
Лето 2006 | Чижи Рынок Филейка Гостиница Лепсе | 0,030 0,025 0,030 0,040 0,030 | 0,045 0,040 0,040 0,040 0,035 | 0,040 0,030 0,035 0,040 0,035 | 0,025 0,020 0,025 0,030 0,025 | 0,035 0,030 0,030 0,030 0,025 | 0,030 0,025 0,025 0,030 0,025 | 0,030 0,025 0,027 0,030 0,025 |
0,025 ± 0,002 |
Осень 2006 | Чижи Рынок Филейка Гостиница Лепсе | 0,065 0,060 0,075 0,110 0,035 | 0,070 0,055 0,055 0,150 0,040 | 0,065 0,060 0,050 0,130 0,040 | 0,050 0,045 0,055 0,085 0,025 | 0,055 0,040 0,040 0,115 0,030 | 0,050 0,045 0,035 0,100 0,030 | 0,052 0,043 0,043 0,100 0,028 |
0,053 ± 0,025 |
Зима 2007 | Чижи Рынок Филейка Гостиница Лепсе | 0,075 0,070 0,040 0,010 0,020 | 0,070 0,060 0,030 0,010 0,020 | 0,075 0,070 0,040 0,020 0,020 | 0,055 0,055 0,030 0,008 0,015 | 0,055 0,050 0,025 0,008 0,015 | 0,055 0,055 0,030 0,015 0,015 | 0,056 0,053 0,028 0,010 0,015 |
0,032 ± 0,020 |
Весна 2007 | Чижи Рынок Филейка Гостиница Лепсе | 0,130 0,200 0,150 0,200 0,085 | 0,100 0,200 0,110 0,170 0,095 | 0,110 0,170 0,140 0,170 0,095 | 0,103 0,158 0,118 0,158 0,068 | 0,079 0,158 0,087 0,134 0,075 | 0,087 0,134 0,110 0,134 0,075 | 0,090 0,150 0,115 0,150 0,070 |
0,115 ± 0,032 |
Проанализировав полученные результаты, следует отметить, что содержание нитратов в питьевой воде не превышает, а даже составляет в 300 и более раз значения меньшие, чем установленная ПДК (45 мг/л). Незначительная разница в концентрациях нитрат-ионов между пробами различных точек одного сезона может быть объяснена особенностями водопроводной сети (внутренние поверхности поражены коррозией, покрыты ржавчиной, загрязнение внутренней поверхности из-за проведения ремонтных работ, наличие в водопроводе организмов, приводящих к трансформации нитрат-ионов и др.).
При проведении исследования воды на содержание в ней нитрит-ионов получились следующие результаты, которые представлены в таблице 7.
Таблица 7
Содержание нитритов в питьевой воде в период
с осени 2005 года по весну 2007 года
|
Время года | Район Отбора пробы | D | Содержание нитритов, мг/л | Средняя С(NO2-) по точке отбора, мг/л | Средняя С(NO2-) по сезонам года, мг/л | ||||
1 | 2 | 3 | 1 | 2 | 3 | ||||
|
Осень 2005 | Чижи Рынок Филейка Гостиница Лепсе | 0,020 0,020 0,020 0,018 0,013 | 0,018 0,018 0,018 0,020 0,011 | 0,020 0,023 0,023 0,023 0,012 | 0,014 0,014 0,014 0,013 0,009 | 0,013 0,012 0,013 0,014 0,007 | 0,014 0,015 0,015 0,015 0,008 | 0,014 0,014 0,014 0,014 0,008 |
0,013 ± 0,003 |
|
Весна 2006 | Чижи Рынок Филейка Гостиница Лепсе | 0,017 0,015 0,011 0,012 0,013 | 0,018 0,017 0,015 0,013 0,013 | 0,018 0,016 0,013 0,013 0,013 | 0,011 0,010 0,007 0,008 0,009 | 0,012 0,011 0,010 0,009 0,009 | 0,012 0,011 0,009 0,009 0,009 | 0,012 0,011 0,009 0,009 0,009 |
0,010 ± 0,001 |
|
Лето 2006 | Чижи Рынок Филейка Гостиница Лепсе | 0,030 0,085 0,030 0,025 0,040 | 0,030 0,090 0,032 0,025 0,045 | 0,030 0,090 0,030 0,025 0,045 | 0,020 0,057 0,020 0,017 0,027 | 0,020 0,060 0,021 0,017 0,030 | 0,020 0,060 0,020 0,017 0,030 | 0,020 0,059 0,020 0,017 0,029 |
0,028 ± 0,010 |
|
Осень 2006 | Чижи Рынок Филейка Гостиница Лепсе | 0,020 0,016 0,020 0,015 0,010 | 0,023 0,015 0,010 0,010 0,010 | 0,020 0,016 0,010 0,012 0,011 | 0,014 0,011 0,014 0,010 0,007 | 0,015 0,010 0,007 0,007 0,007 | 0,014 0,011 0,007 0,009 0,008 | 0,014 0,011 0,009 0,009 0,007 |
0,010 ± 0,003 |
|
Зима 2007 | Чижи Рынок Филейка Гостиница Лепсе | 0,055 0,020 0,010 0,010 0,005 | 0,050 0,015 0,012 0,007 0,006 | 0,050 0,011 0,009 0,007 0,004 | 0,037 0,014 0,007 0,007 0,003 | 0,034 0,010 0,008 0,005 0,004 | 0,034 0,007 0,006 0,005 0,003 | 0,035 0,010 0,007 0,006 0,003 |
0,012 ± 0,013 (0,006 ± 0,003)* |
|
Весна 2007 | Чижи Рынок Филейка Гостиница Лепсе | 0,010 0,025 0,015 0,023 0,009 | 0,015 0,030 0,010 0,020 0,007 | 0,010 0,025 0,010 0,020 0,008 | 0,007 0,017 0,010 0,015 0,006 | 0,010 0,020 0,007 0,014 0,005 | 0,007 0,017 0,007 0,014 0,006 | 0,008 0,018 0,008 0,014 0,006 |
0,011 ± 0,005 |
* - данные результаты приведены без учета содержания нитрит-ионов в водопроводной воде Чижей, так как именно в этой пробе их количество намного больше, чем в остальных.
Проанализировав полученные результаты, следует отметить, что содержание нитритов в питьевой воде за исследуемый период не превышает установленной ПДК (3,3 мг/л) и даже, в 200 и более раз меньше этого значения. Незначительная разница в концентрациях может быть объяснена так же, как и в случае с нитратами – особенностями водопроводной сети.
Динамика содержания нитратов и нитритов в питьевой воде по сезонам года
Анализ полученных результатов позволяет отметить, что содержание в воде нитратов и нитритов подвержено сезонным колебаниям. Выяснено, что на водозаборе Корчемкино не принимается никаких мер по урегулированию концентрации данных ионов в питьевой воде, если они не превышают уровня ПДК, вода поступает в неизмененном состоянии. Это дает основания предполагать, что колебания содержания нитрат- и нитрит-ионов в водопроводной сети могут зависеть от природных процессов, от деятельности хозяйств, расположенных выше по течению, состояния водопроводной системы и некоторых других обстоятельств. Четкая сезонная динамика, повторяющаяся из года в год, скорее всего, отражает природные процессы, а резкое отклонение от нее может быть следствием антропогенной деятельности.
Содержание нитратов в питьевой воде в динамике изображено на рисунке 1:
Рис. 1
Как видно из рис. 1, содержание нитратов колеблется в разные сезоны года. Наблюдается следующая закономерность: количество нитрат-ионов в воде максимально в весенний период и минимально в летний. Вероятно, это связано с тем, что весной происходит интенсивная миграция нитратов с поверхностными стоками талых вод в р. Вятку, а также при минимальном потреблении азота происходит разложение органических веществ и переход азота из органических форм в минеральные. Количество нитратов в питьевой воде в весенний период 2006 и 2007 годов находится примерно на одном уровне и превышает содержание нитратов в другие сезоны годы. Минимальное содержание нитратов летом. В этот период растения интенсивно усваивают нитраты, преобразуя их в белок своего тела. Наблюдается обратная картина перехода азота – из минеральной формы - в органическую. Поступление в воду реки минимально. Это согласуется с литературными данными.
Динамика содержания нитритов в питьевой воде по сезонам года представлена на рисунке 2:
Рис. 2
Как видно из рис. 2, концентрация нитритов в воде также не постоянна и подвержена сезонным колебаниям. Здесь наблюдается следующая картина: максимальное содержание нитритов выявлено летом 2006 года, а между остальными периодами четкой разницы не обнаружено. По литературным данным известно, что для проточных водоемов не характерно сильное колебание в значениях концентраций нитрит-ионов, так как они не устойчивы и быстро переходят в другие соединения. Резкое повышение содержания нитрит-ионов может указывать на их антропогенное поступление. Такое небольшое повышение наблюдалось летом 2006 года, хотя даже при таком увеличении концентраций нитритов намного меньше значения ПДК.
Выводы
1. В работе дан обзор свойств нитратов и нитритов, указаны антропогенные и естественные источники их поступления в окружающую среду, биологическое действие, место в круговороте азота.
2. Сделан обзор методов количественного и качественного определения нитрат- и нитрит-ионов.
3. Экспериментально исследованы пробы водопроводной воды, отобранной в различные сезоны года в период с осени 2005 года по весну 2007 года, на территории пяти районов города Кирова. Выявлено содержание нитратов и нитритов и установлена сезонная динамика. И на основании полученных данных оценено качество питьевой воды, прошедшей через систему водоснабжения.
4. Следует отметить, что содержание нитратов за исследуемый период в питьевой воде не превышает, а даже составляет в 300 и более раз значения меньшие, чем установленная ПДК. Содержание нитритов в питьевой воде не превышает установленной ПДК и даже, в 200 и более раз меньше этого значения. Незначительная разница в концентрациях определяемых ионов в пробах воды одного сезона может быть объяснена особенностями водопроводной сети.
5. По нитратам наблюдается следующая закономерность: количество нитрат-ионов в воде максимально в весенний период и минимально в летний. По нитритам наблюдается следующая картина: максимальное содержание нитритов выявлено летом 2006 года, а между остальными периодами четкой разницы не обнаружено. Особенности выявленной динамики подтверждаются литературными данными.
Литература
- Агроэкология./ Черников В. А. М.: Колос, 2000. – 536 с.
- Алексеев В. Н. Курс качественного химического полумикроанализа. М: «Химия», 1973. – 584 с.
- Аринушкина Е. В. Руководство по химическому анализу почв. М.: Изд-во Моск. ун-та, 1970. – 487 с.
- Ахметов Н. С. Общая и неорганическая химия: Учебник для вузов. – М.: Высш. школа, 1981. – 679 с.
- Безносов А. И. О нитратах – для всех: справочник. Ижевск: «Удмуртия», 1991. – 40 с.
- Большая Советская Энциклопедия: В 30 т.: т. 18 / Гл. ред. А. М. Прохоров. Изд. 3-е. – М.: «Советская энциклопедия», 1974. – 632 с.
- Возбуцкая А. Е. Химия почвы. М: «Высшая школа», 1968. – 427 с.
- Глинка Н. Л. Общая химия. Издательство «Химия», 1972. – 712 с.
- ГОСТ 18826 – 73. Вода питьевая. Методы определения содержания нитратов.
- ГОСТ 4192 – 82. Вода питьевая. Методы определения минеральных азотсодержащих веществ.
- Дорохова Е. Н., Прохорова Г. В. Аналитическая химия. Физико-химические методы анализа: Учеб. Для почвенно-агрохим. спец. ун-тов и вузов. – М.: Высш. шк., 1991. – 256 с.
- Евдокимова Т. А. Накопление нитратов в растениях на почвах с повышенным содержанием тяжелых металлов.// Почвоведение, 1993. №8 – с. 104 – 107.
- Злотников Э. Г., Эстрин Э. Р. Химико-экологический анализ различных природных сред: Эксперимент. материал для факультатив. и кружковых занятий в сред. школах. – К.: ВГПУ, 1996. – 111 с.
- Коробкин В. И., Передельский Л. В. Экология. Изд. 4-е, доп. и переработ. – Ростов н/Д: изд-во «Феникс», 2003. – 576 с.
- Крамаренко В. Ф. Токсикологическая химия. – К.: Вища шк., 1989. – 447 с.
- Лабораторный практикум по курсу «Экология» / Сост. Е. П. Кремлев и др.; Под общ. ред. Е. П. Кремлева. – Гродно: ГрГУ, 2002. – 159 с.
- Логинов Н. Л., Воскресенский А. Г., Солодкин И. С. Аналитическая химия. – М.: Просвещение, 1979. – 480 с.
- Мониторинг природных сред и объектов (Исследовательский практикум для школьников и студентов)./Под ред. профессора Т. Я. Ашихминой – Киров: «Старая Вятка», 2006. – 252 с.
- Михалева М. В., Мартыненко Б. В., Изилянова Э. М. Экспресс-анализ овощей на содержание нитратов. // Химия в школе. – 2003. - № 1. – с. 54.
- Новиков Ю. В. Экология, окружающая среда и человек: Учеб. пособие для вузов, а также учащихся средних школ и колледжей. – М.: ФАИР – ПРЕСС, 1999. – 320 с.
- Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для вузов / Ю. А. Ершов, В. А. Попков, А. С. Берменд и др.; Под ред. Ю. А. Ершова. – 5-е изд., стер., - М.: Высш. шк., 2005. – 560 с.
- Основы аналитической химии. Практическое руководство: Учеб. пособие для вузов / В. И. Фадеева, Т. Н. Шеховцева, В. М. Иванов и др.; Под ред. Ю. А. Золотова. – М.: Высш. шк. 2001. – 463 с.
- Петербургский А. В. Практикум по агрономической химии, 1968. – 382 с.
- Пругар Я., Пругарова А. Избыточный азот в овощах / Пер. со словацк. И. Ф. Бугаенко. М.: Агропромиздат, 1991. – 127 с.
- Райзер Г. И. Определение нитрат-ионов в воде.// Химия в школе. – 1993. – №6. – с. 54.
- Рубенчик Б. Л. Биохимия канцерогенеза. К.: Здоров´я, 1977. – 185 с.
- Рубенчик Б. Л., Костюковский Я. Л., Меламед Д. Б. Профилактика загрязнения пищевых продуктов канцерогенными веществами. – К.: Здоров´я, 1983. – 160 с.
- Скурихин И. М. Нечаев А. П. Все о пище с точки зрения химика: Справ. издание. – М.: Высш. шк. 1991. – 288 с.
- Соколов О. А. Нитраты в окружающей среде. М.: Просвещение, 1990. – 436 с.
- Спицин В. И., Мартыненко Л. И. Неорганическая химия. Ч. 1.: Учебник. – М.: Издательство МГУ, 1991. – 476 с.
- Сударкина А. А., Евсеева И. И., Орлова А. Н. Химия в сельском хозяйстве. М.: Просвещение, 1986. – 143 с.
- Уильямс У. Дж. Определение анионов. М.: Химия, 1982. – 624 с.
- Фадеев Г. Н. Пятая вертикаль периодической системы. М.: Просвещение, 1973. – 192 с.
- Химическая энциклопедия: В 5 т.: т. 3: Меди – Полимерные / Редкол.: Кнунянц И. Л. и др. – М.: Большая Российская энцикл., 1992. – 639 с.
- Хурса Р. В. Современная пища: еда, яды и противоядия / Р. В. Хурса. – Мн.: Беларусь, - 2003. – 168 с.
- Чернобаев И. П. Химия окружающей среды: Учеб. пособие. – К.: Выща шк., 1990. – 191 с.
- Шарло Г. Методы аналитической химии. Количественный анализ неорганических соединений. Ч. 2., М.: Химия, 1969. – 1204 с.
- Экологический мониторинг: учебно-методическое пособие / Под ред. Т. Я. Ашихминой. М.: Академический проэкт, 2005. – 416 с. – («Gaudeamus»).
- Экология родного края./ Под ред. Т. А. Ашихминой. – Киров: Вятка, 1996. – 720 с.
- Эстрин Э. Р. Пособие по основам агрохимии: Материалы к лаборат. занятиям для студентов пед. вузов. Ч. I. – Киров: ВГПУ, 1998. – 56 с.
freepapers.ru









