Характеристика методов исследования и результаты оценки питьевой воды. Исследование питьевой воды
Исследование качество питьевой воды в домашних условиях
Региональная научно-практическая конференция «Шаг в будущее»
Исследовательская работа
Исследование качество питьевой воды в домашних условиях
Работу выполнила:
Иванова Анжелика Максимовна
МКОУ АСОШ Оймяконского района
Руководитель:
Иванова Татьяна Кирилловна,
учитель математики МКОУ АСОШ
2015
Актуальность
Вода источник жизни на Земле. Она необходима для жизни всех без исключения живых существ на планете. Всем известна, что питьевая вода должна быть чистой и полезной. Для хорошего здоровья необходимо пить чистую воду. А какая вода именно является качественной, полезной и пригодной для употребления? Это и стала целью моей исследовательской работы. Чтобы разрешить этот вопрос мы поставили перед собой следующую задачу: определить основные методы проверки качества воды в домашних условиях и применять их для исследования воды нескольких видов.
Для исследования качества питьевой воды мы определили доступные способы проверки воды в домашних условиях:
Мы взяли разные образцы воды: бутилированную, фильтрованную, талую и водопроводную.
. 
Проверяли воду на:
Вкус воды определяют, прокипятив её пять минут и охладив до 20-25 градусов. Если ощущается гнилостный вкус, значит, в воде есть продукты распада животных или растительных организмов, соленый вкус укажет на присутствие соли (поваренной или какой-либо другой щелочной), горький вкус придают соли магния, вяжущий – говорит о наличии солей железа, гипса придает сладковатый привкус.

Вывод: по вкусу определили, что образец №3 (талая вода) самая вкусная.
Прозрачность. Для определения степени прозрачности воду слоем 20 см наливают в прозрачный стакан. Попробуйте прочитать текст на бумаге, глядя через стакан с водой. Если это сделать легко - вода прозрачная.




Вывод: во всех образцах можно прочитать текст. Отсюда следует, что все образцы у нас прозрачные.
В домашних условиях намыливанием можно определить жесткость воды, если в воде плохо пенится мыло - вода жесткая. То же самое можно сказать и о воде образующей осадок при кипячении. Мягкая вода полезней для организма.


Вывод: образец №1(бутилированная вода «Монатырская») и №4 (вода из крана) они плохо пенятся, а образцы №2 (фильтрованная вода) и №3 (талая вода) хорошо пенятся. Отсюда следует, что №2 и №3 мягкие.
На стекло или зеркало надо было нанести небольшую каплю воды. Подождать, пока жидкость испарится. После этого посмотреть на поверхность: если она осталась чистой - вода также чистая. Если на стекле образовались какие-то пятна - это признак низкого качества воды.

Вывод: на образцах №1 и №3 остались следы. А на образцах №2 и №4 следов нет.
Марганцовка – один из самых «универсальных» домашних индикаторов. Для того чтобы определить наличие железа светло-розовый раствор перманганата калия смешивают с образцами пробы. В случае положительной реакции цвет среды меняется на желтовато-бурый.

Вывод: все образцы цвет не поменяли.
Отстаивание. Набираем в трехлитровую банку воду и на 3-4 дня помещаем ее в темное место. По истечению указанного времени извлекаем емкость с водой на свет и внимательно рассматриваем. зеленый налет на стенках банки прямо укажет на наличие в воде простейших водорослей, осадок на дне банки будет свидетельствовать о присутствии в жидкости органических веществ, а масляная пленка на поверхности воды безошибочно выдаст наличие в воде посторонних химических соединений

Вывод: все образцы дали положительный результат.
вкус
прозрачность
Отстаивание. Наличие других веществ
Определение железа
Определение жесткости
Соли и примеси с помощью капли воды
№1
+
+
+
№2
+
+
+
+
+
№3
+
+
+
+
+
№4
+
+
+
+
Как видно из таблицы, самыми качественными и пригодными оказались воды под №2и №3. Таким образом, «талая вода» и «фильтрованная вода», которая используется в поселке Артык, соответствует всем нормам для питья.
infourok.ru
Научно-исследовательская работа "ХИМИЧЕСКИЙ АНАЛИЗ КАЧЕСТВА ПИТЬЕВОЙ ВОДЫ"
VII Региональная научная конференция учащихсяСекция «Химия»
Научно-исследовательская работа
ХИМИЧЕСКИЙ АНАЛИЗ КАЧЕСТВА ПИТЬЕВОЙ ВОДЫ
Куринов Эмиль
г. Нижнекамск МБОУ «Гимназия №32» , 10 класс
Руководитель: Давлетшина Вероника Васильевна
учитель биологии
Валеева Елена Николаевна
учитель химии
г. Нижнекамск , 2014 г.
Содержание
Введение………………………………………………………………………...3
Глава 1. Методы анализа воды
Лабораторные методы анализа воды…………………………………...5
Требования САНПиН и Европейских стандартов к питьевой воде….5
Глава 2. Результаты исследования
2.1. Социологический опрос…………………………………………………7
2.2. Исследование качества питьевой воды………………………………...9
2.2.1. Определение рН воды………………………………………………….9
2.2.2. Определение общей минерализации воды…………………………..11
2.2.3. Электролиз воды………………………………………………………12
2.2.4. Определение массы осадка после электролиза воды………………..14
2.2.5. Сравнительные показатели проб воды …………………….………...15
Заключение…………………………………………………………………….16
Литература…………………………………………………………………….17
Приложения……………………………………………………………………18
Введение
Пить или не пить воду - такого вопроса для человека не существует. Сомнение в другом: какую воду пить? Из-под крана или только ту, что продаётся в бутылках? Та, что бежит по стальным трубам, может насыщаться вредными для человека тяжелыми металлами. А применение хлора, как главного обеззараживающего компонента, представляет серьёзную опасность для здоровья.
Питьевая вода – важнейший фактор здоровья человека, но практически все ее источники сегодня подвергаются антропогенному и техногенному воздействию разной интенсивности. Проблема качества питьевой воды затрагивает очень многие стороны жизни человеческого общества. В настоящее время питьевая вода – это проблема социальная, политическая, медицинская, географическая, а также инженерная и экономическая.
Мы на 80% состоим из воды, и наше здоровье зависит от той воды, которую мы пьем.Сегодня как никогда нашему организму очень важно получать чистую питьевую воду со сбалансированным минеральным составом. Чистая питьевая вода повышает защиту организма от стресса, обеспечивает работу внутренних органов. Вода необходима для поддержания всех обменных процессов, она принимает участие в усвоении питательных веществ клетками. Вода является теплоносителем и терморегулятором.
Основными источниками воды в городах служат близлежащие реки и озера. После очистки на станции, вода, с помощью насосов, закачивается в трубы, в которых находится практически все то от чего воду очищали. По данным лаборатории питьевого водоснабжения НИИ экологии человека и окружающей среды РАМН, 90% водопроводных сетей подают в дома воду, не отвечающую санитарным нормам.
Цель работы: выявить степень качества очистки питьевой воды
Задачи:
Рассмотреть альтернативные способы очистки воды;
Определить рН исследуемого раствора;
Определить общую минерализацию воды в РРМ с помощью прибора TDS;
Выявление химических примесей методом электролиза;
Определение количественного состава химических примесей методом фильтрации.
Объект исследования - питьевая вода.
Предмет исследования - химические примеси.
Гипотеза: Любая питьевая вода пригодна для употребления.
Материалы и оборудование: прибор TDS для определения общей минерализации жидкости, индикатор для определения рН, PR-2 прибор для электролиза воды, ОВП метр ORP-169B прибор для измерения потенциала воды.
Глава 1. Методы анализа воды
Лабораторные методы анализа воды
Лабораторные методы анализа воды основываются на химических и физических исследованиях образца. Выбор способа определения загрязнителя зависит от исходного объема пробы и характера предполагаемых примесей.
Все существующие методы исследования воды можно разделить на несколько групп (Табл.1).
Таблица 1. Методы анализа воды
| Типы исследований | Методы анализа |
| Химические | Весовой; Объемный. |
| Электрохимические | Потенциометрический; Полярографический. |
| Оптические | Фотометрический; Спектрометрический; Люминесцентный. |
| Хроматографические | Жидкостная колоночная хроматография; Тонкослойная хроматография; Высокоэффективная жидкостная хромтография. |
Требования САНПиН и Европейских стандартов к питьевой воде
Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества» утверждены и введены в действие постановлением Главного государственного санитарного врача Российской Федерации Онищенко Г. Г. с 26 сентября 2001 года. СанПиН 2.1.4.1074-01 является обновленным изданием СанПиН 2.1.4.559-96, который был принят в 1997 году.
СанПиН нормирует содержание вредных химических веществ, наиболее часто встречающихся в природных водах, а также поступающих в источники водоснабжения в результате хозяйственной деятельности человека. Устанавливает гигиенические требования к питьевой воде, определяет органолептические и некоторые физико-химические параметры питьевой воды.
Гигиенические требования и нормативы качества питьевой воды:
Питьевая вода должна быть безопасна в эпидемическом и радиационном отношении, безвредна по химическому составу и иметь благоприятные органолептические свойства.
Качество питьевой воды должно соответствовать гигиеническим нормативам перед ее поступлением в распределительную сеть, а также в точках водоразбора наружной и внутренней водопроводной сети.
Безопасность питьевой воды в эпидемическом отношении определяется ее соответствием нормативам по микробиологическим и паразитологическим показателям.
Таблица 2. Общие физико-химические показатели:
| Показатели | Единицы измерения | Нормативы (предельно допустимые концентрации) (ПДК), не более |
| Водородный показатель | Единицы рН | в пределах 6-9 |
| Общая минерализация (сухой остаток) | мг/л | 1000 (1500)2) |
| Жесткость общая | мг-экв./л | 7,0 (10)2) |
| Окисляемость перманганатная | мг/л | 5,0 |
| Поверхностно-активные вещества (ПАВ), анионоактивные | мг/л | 0,5 |
Глава 2. Результаты исследования
2.1. Социологический опрос
Для оценки информированности учащихся и учителей гимназии №32 о качестве питьевой воды было опрошено 171 человек. Были выделены и опрошены следующие группы: учащиеся гимназии (с 9 по 11 классы)- (123 ч-ка) - 72%; учителя и администрация гимназии- (58 ч-к) 28%.
Результаты анкетирования о качестве питьевой воды представлены на рисунках 1-4:
Какие способы очистки воды вы знаете?
Какую воду вы употребляете дома?
Устраивает ли вас качество употребляемой воды?
Связываете ли вы качество употребляемой воды со своим здоровьем?
Вывод:
В ходе опроса выяснили, что 59% опрошенных как способ очистки воды выбрали кипячение, все же как альтернативный вариант 53% опрошенных предпочитают дома употреблять бутилированную воду, 30% - фильтрованную воду и 17% - водопроводную. Так же в ходе опроса выяснили, что 61% опрошенных не довольны качеством употребляемой воды и 93% опрошенных связывают качество употребляемой воды с своим здоровьем.
2.2.Исследование качества питьевой воды
Исследования качества питьевой воды проводились последующим показателям:
1. Определение рН воды
2. Определение общей минерализации воды
3. Определение химических примесей путем электролиза воды
4. Определение массы осадка после электролиза воды.
Для исследования качества питьевой воды мы взяли следующие пробы:
Водопроводная вода из крана
Кипяченая вода
Вода «Хрустальный колодец»
Вода «Олероли»
Фильтрованная вода из школьной столовой
Вода, пропущенная через BlueFilters
Вода, пропущенная через аквафор Лаки фильтр-кувшин
Техническая вода
2.2.1. Определение рН воды.
Водородный показатель характеризует концентрацию свободных ионов водорода в воде. В зависимости от величины pH может изменяться скорость протекания химических реакций, степень коррозионной агрессивности воды, токсичность загрязняющих веществ и т.д. Контроль за уровнем рН особенно важен на всех стадиях водоочистки, так как его отклонения в ту или иную сторону могут не только существенно сказаться на запахе, привкусе и внешнем виде воды, но и повлиять на эффективность водоочистных мероприятий. Для питьевой и хозяйственно-бытовой воды оптимальным считается уровень рН в диапазоне от 5 до 9 (СанПиН).
Ход работы:
Налить в чистую пробирку из набора проб 5 мл воды.
Добавить к воде в пробирке 4 капли раствора индикатора из флакона.
Закрыть пробирку пробкой и встряхнуть пробирку несколько раз до полного перемешивания раствора.
Определение рН должно производиться в хорошо освещенном месте. Приложить пробирку к белой бумаге и сравнить цвет раствора с приложенной цветной таблицей. Число, находящееся в квадрате, цвет которого совпадает с цветом раствора в пробирке, равно рН воды в пробе.
Таблица 3. Результаты исследования проб воды на рН:
| № | проба | рН среды |
| 1. | Водопроводная вода из крана | 6 |
| 2. | Кипяченая вода | 9 |
| 3. | Вода «Хрустальный колодец» | 6 |
| 4. | Вода «Олероли» | 6 |
| 5. | Фильтрованная вода из школьной столовой | 6 |
| 6. | Вода, пропущенная через BlueFilters | 5 |
| 7. | Вода, пропущенная через аквафор Лаки фильтр-кувшин | 5 |
| 8. | Техническая вода | 6 |

Вывод: результаты исследования проб воды на рН показали, что Водородный показатель всех проб в пределах нормы и соответствует требованиям СанПиН.
2.2.2. Определение общей минерализации воды
Для определения общей минерализации воды я использовала прибор TDS (см. приложение 1).
Принцип работы прибора основан на электропроводности воды. Электропроводность – это способность среды проводить электрический ток. Чем выше минерализация (насыщение солями) жидкости, тем выше ее электропроводность, тем выше будут показания прибора.
Определение общей минерализации воды проводилось с помощью цифрового измерителя солей в воде tds-3.
Ход работы :
1. Снять защитный колпачок.
2. Включить прибор нажатием кнопки ON/OFF.
3. Опустить в жидкость до максимального уровня (5см).
4. Слегка помешивать для избавления от воздушных пузырьков.
5. Дождаться стабилизации показаний (прим. 10 секунд), нажать кнопку HOLD для запоминания результатов.
Таблица 4. Результаты исследования проб воды на общую минерализацию:
| № | проба | Общая минерализация (ppm ) |
| 1. | Водопроводная вода из крана | 0,159 |
| 2. | Кипяченая вода | 0,187 |
| 3. | Вода «Хрустальный колодец» | 0,152 |
| 4. | Вода «Олероли» | 0,111 |
| 5. | Фильтрованная вода из школьной столовой | 0,161 |
| 6. | Вода, пропущенная через BlueFilters | 0,019 |
| 7. | Вода, пропущенная через аквафор Лаки фильтр-кувшин | 0,162 |
| 8. | Техническая вода | 0,192 |
Вывод: в ходе исследования выяснили, что высокий показатель минерализации воды у пробы №8- техническая вода и пробы №2 холодная кипяченая вода, самый маленький показатель- проба 6- вода, пропущенная через блюфильтр (см. приложение 2 ).
2.2.3. Электролиз воды
Для визуального определения качества воды провели электролиз отобранных проб, который позволяет судить об уровне очистки воды. В работе прибора применен принцип электролиза воды. Действие прибора основано на свойстве алюминия связывать растворенные в воде химические примеси в нерастворимые осадки. В процессе электролиза растворенные в воде химические примеси вступают в реакцию, образуя осадки различного цвета. По цветам образовавшихся осадков можно приблизительно определить, какие и в каком количестве вещества присутствуют в воде:
Чёрными хлопьями выпадают тяжелые металлы;
Cиний цвет дают нитраты, нитриты и пестициды;
Рыжий цвет говорит об избытке железа в воде;
Зеленый указывает на избыток органических веществ
Для проведения электролиза используется прибор «электролизер», имеющий две пары контактов для двух ёмкостей.
Прибор включается в сеть 220В, и через воду в ёмкостях проводится электричество. Под воздействием электричества все примеси, растворённые в воде, всплывают на поверхность или выпадают в осадок. Длительность этого эксперимента 60 секунд (см. приложение 3).
Таблица 5. Результаты исследования проб воды на наличие химических примесей:
| номер пробы | результат | Номер пробы | результат |
| 1 |
| 5 |
|
| 2 |
| 6 |
|
| 3 |
| 7 |
|
| 4 |
| 8 |
|
Вывод: результаты электролиза воды показали, что в пробе воды № 1, №3, №5, №7, №8 (цвет раствора грязно-зеленая) содержатся аммиак, сероводород, органические и нефтеорганические загрязнения; в пробе воды № 2 (цвет раствора синий) содержатся нитраты, нитриты и пестециды; в пробе воды № 4 (цвет раствора желто рыжий) содержится избыток железа; в пробе воды №6 минимальное содержание примесей.
2.2.4. Определение массы осадка после электролиза воды
Растворы после электролиза профильтровали. Для определения массы химических примесей в пробах воды, фильтры с полученными осадками высушили и взвесили. Масса фильтровальной бумаги составляет 0,6 грамм. Для определения массы осадка мы из полученного результата вычли массу чистой фильтровальной бумаги.
Таблица 6. Результаты исследования проб воды на определение массы осадка после электролиза воды:
| № | проба | масса фильтра | масса осадка |
| 1. | Водопроводная вода из крана | 1,0 | 0,4 |
| 2. | Кипяченая вода | 1,0 | 0,4 |
| 3. | Вода «Хрустальный колодец» | 0,9 | 0,3 |
| 4. | Вода «Олероли» | 0,8 | 0,2 |
| 5. | Фильтрованная вода из школьной столовой | 1,0 | 0,4 |
| 6. | Вода, пропущенная через BlueFilters | 0,7 | 0,1 |
| 7. | Вода, пропущенная через аквафор Лаки фильтр-кувшин | 1,0 | 0,4 |
| 8. | Техническая вода | 1,1 | 0,5 |
 Вывод: по результатам исследования выяснили, что наибольшее количество осадков образовалось в технической воде, наименьшее в воде, пропущенной через BlueFilters.
Вывод: по результатам исследования выяснили, что наибольшее количество осадков образовалось в технической воде, наименьшее в воде, пропущенной через BlueFilters.
2.2.5. Сравнительные показатели проб воды
| Номер пробы | Название воды | рН | электропроводность | масса осадка после электролиза | место |
| 1 | Водопроводная вода | 6 | 0,159 | 0,4 | |
| 2 | Кипяченая вода | 9 | 0,187 | 0,4 | |
| 3 | Вода «Хрустальный колодец» | 6 | 0,152 | 0,3 | 3 |
| 4 | Вода «Олероли» | 6 | 0,111 | 0,2 | 2 |
| 5 | Фильтрованная вода в школьной столовой | 5,5 | 0,161 | 0,4 | |
| 6 | Вода, пропущенная через BlueFilters | 5 | 0,019 | 0,1 | 1 |
| 7 | Вода, пропущенная через аквафор Лаки фильтр-кувшин | 5 | 0,162 | 0,4 | |
| 8 | Техническая вода | 6 | 0,192 | 0,5 |
Вывод: по данным таблицы видно, что по всем показателям 1 место по качеству воды занимает вода, пропущенная через BlueFilters, 2 место – вода «Олероли» , 3 место - вода «Хрустальный колодец».
Заключение
Анализ и обобщение результатов исследований по сравнительной оценке качества очистки питьевой воды позволили заключить следующее:
результаты исследования проб воды на рН показали, что водородный показатель всех проб в пределах нормы и соответствует требованиям СанПиН.
высокий показатель минерализации воды у пробы №8- техническая вода и пробы №2 холодная кипяченая вода, самый маленький показатель- проба 6- вода, пропущенная через блюфильтр.
результаты электролиза воды показали, что в пробе воды № 1, №3, №5, №7, №8 (цвет раствора грязно-зеленая) содержатся аммиак, сероводород, органические и нефтеорганические загрязнения; в пробе воды № 2 (цвет раствора синий) содержатся нитраты, нитриты и пестициды; в пробе воды № 4 (цвет раствора желто рыжий) содержится избыток железа; в пробе воды №6 минимальное содержание примесей.
при определении массы химических примесей в пробах воды выяснили, что наибольшее количество осадков образовалось в технической воде, наименьшее в воде, пропущенной через BlueFilters.
Литература
Боголюбов А.С. Экосистема. - М., 2001.
Газета "Биология". Издательский дом "Первое сентября". №23, 2008
Газета "Иваново-Пресс". №41 от 11.10.2007
Попова Т.А. Экология в школе. - М., 2005. - 64 с.
Сайт: www-chemistry.univer.kharkov.ua. Раздел: файлы, лекция 5 по экологии.
Сайт: www.ijkh.ivanovo.ru. Раздел МУП "Водоканал".
Сайт: www.prechist-ecologia.narod.ru. Раздел "Водная гладь".
Федорос Е.И. Нечаева Г.А. Экология в экспериментах. -М, 2006. - 384 с.
Приложение 1
Прибор TDS

Приложение 2
Показатель общей минерализации воды, пропущенной через BlueFilters.

Приложение 3
Прибор «электролизер»

15
kopilkaurokov.ru
Характеристика методов исследования и результаты оценки питьевой воды
Одним из важных процессов производства пищевой продукции является контроль качества воды. В статье представлены основные методы исследований питьевой воды. Проанализированы результаты оценки питьевой воды.
Ключевые слова: безопасность, питьевая вода, исследования.
Одним из важных процессов производства продукции и питьевой воды является контроль качества. Расширение ассортимента выпускаемой продукции, изменение экологической ситуации в регионе, формирование основ биотехнологий обуславливает необходимость обзора применяемых методов исследования сырья и продукции, включая питьевую воду [1–16].
Качество питьевой воды должно соответствовать требованиям действующих санитарных правил и норм, утвержденных в установленном порядке. Исследуемая проба была доставлена в аккредитованную лабораторию. Отбор пробы был произведен по ГОСТ ГОСТ Р 51232 «Вода питьевая. Общие требования к организации и методам контроля качества». Анализ проводили по основным физико-химическим и органолептическим показателям питьевой воды. Для анализа использовали следующие показатели и методы.
Определение запаха. Питьевая вода должна иметь благоприятные органолептические свойства, безвредна по химическому составу, быть безопасна в эпидемическом и paдиационном отношении.
Определение привкуса. Органолептическим методом определяли характер и интенсивность вкуса.
Цветность воды определяли фотометрическим путем сравнения проб испытуемой жидкости с растворами, имитирующими цвет природной воды.
Мутность воды определяли фотометрическим методом.
рН воды определяли потенциометрическим методом с использованием pH-метра со стеклянным электродом. Изменение рН воды свидетельствует о загрязнении ее продуктам распада органических соединений, стоками химических заводов и другими веществами.
Для определения общей жесткости воду титровали раствором трилона Б в присутствии индикатора (кислотный хромтемносиний или эриохромчерный Т). В точке эквивалентности при титровании индикатор изменяет окраску розовую (в присутствии ионов жесткости — Са2+ и Mg2+) на синюю (в отсутствии этих ионов).
Комплексонометрический метод сульфатов дает наиболее надежные результаты. Сущность этого метода состоит в том, в исследуемую воду вводят ионы Ba2+(раствор BaCl2), которые связывают ионы SO42- в трудно растворимые соединения, выпадающие в осадок:
Массовую концентрацию аммиака и ионов аммония определяли методом, основанном на способности аммиака и ионов аммония образовывать окрашенное в желто-коричневый цвет соединение с реактивом Несслера. Интенсивность окраски раствора, пропорциональная массовой концентрации аммиака и ионов аммония, измеряется на фотоколориметре при длине волны 400–425 нм.
Определение массовой концентрации нитритов. Метод основан на способности нитритов диазотировать сульфаниловую кислоту и на образовании красно-фиолетового красителя диазосоединения с 1-нафтиламином. Интенсивность окраски, пропорциональная содержанию нитритов, измеряется на фотоколориметре при длине волны 520 нм.
Нитраты определяли методом, основанном на реакции между нитратами и фенолдисульфоновой кислотой с образованием нитропроизводных фенола, которые со щелочами образуют соединения, окрашенные в желтый цвет.
Кремний определяли фотометрическим методом, основанном на взаимодействии кремнекислоты с молибдатом аммония в кислой среде с образованием желтой кремнемолибденовой гетерополикислоты. Оптическую плотность растворов определяют при l = 410 нм.
Также представляет интерес показатель перманганатной окисляемости воды. Данная величина служит для оценки содержания легкоокисляемой органики. Перманганатный индекс воды — общая концентрация кислорода, соответствующая количеству иона перманганата, потребляемому при обработке данным окислителем в данных условиях конкретной пробы воды.
Сущность метода определения перманганатной окисляемости воды заключается в использовании перманганата калия в качестве сильного окислителя для разложения органических загрязнителей в исследуемой воде. Проба воды кипятится с заданным, заведомо избыточным объемом KMnO4, после чего его избыток оттитровывается щавелевой кислотой.
Реакция окисления примесей перманганатом калия проводится в кислой среде и протекает следующим образом:
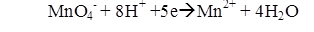
В щелочной или нейтральной среде ион Mn2+ переходит в Mn4+, образуя окись марганца — бурый осадок:
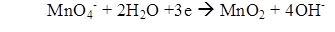
Избыток перманганата калия реагирует с вводимой в раствор щавелевой кислотой:
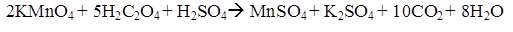
В результате проведенных исследований получили данные, представленные в таблице 1.
Таблица 1
Результаты оценки питьевой воды
|
Показатель |
Исследуемая проба |
ПДК |
|
Привкус |
1 |
2 балла |
|
Мутность |
Менее 0,1 |
1,5мг/дм³ |
|
Запах, баллы |
1 |
2 балла |
|
Цветность, градусы |
1.5 |
20 ° |
|
Водородный показатель (рН) |
7,55 |
6–9 еДрН |
|
Нитриты |
Менее 0,003 |
3,0 мг/дм³ |
|
Жёсткость, мг-экв/л |
2,9 |
7,0 |
|
Нитраты |
2,7 |
45,0 мг/дм³ |
|
Фториды |
0,064 |
1,5 мг/дм³ |
|
Аммиак |
Менее 0,05 |
1,5 мг/дм³ |
|
Кремний |
7,5 |
10 мг/дм³ |
|
Сульфаты |
16,3 |
500,0 мг/дм³ |
Как видно из таблицы 1, питьевая вода соответствует всем требованиям СанПиН 2.1.4.1074–01. На основании всех проведенных анализов пробы воды, выдаётся протокол с заключением, заверенный печатью и подписями.
Литература:
1. Белокаменская А. М., Ребезов М. Б., Ребезов Я. М., Максимюк Н. Н. Исследование проб воды на содержание йода методом инверсионной вольтамперометрии. Инновационные технологии в пищевой промышленности: наука, образование и производство: материалы конференции. 2013. С. 736–740.
2. Белокаменская А. М., Ребезов М. Б., Ребезов Я. М., Максимюк Н. Н. Исследование проб воды на содержание селена методом инверсионной вольтамперометрии. Инновационные технологии в пищевой промышленности: наука, образование и производство: материалы конференции. 2013. С. С. 741–744.
3. Белокаменская А. М., Зинина О. В., Наумова Н. Л., Максимюк Н. Н., Соловьева А. А., Солнцева А. А., Ребезов М. Б. Контроль качества результатов исследований продовольственного сырья и пищевых продуктов на содержание свинца. Известия вузов. Прикладная химия и биотехнология. 2012. № 1. Т. 2. С. 157–162.
4. Белокаменская А. М., Максимюк Н. Н., Наумова Н. Л., Зинина О. В. Оценка методов инверсионной вольтамерометрии, атомно-абсорбционного и фотометрического анализа токсичных элементов в продовольственном сырье и пищевых продуктах. Челябинск: ИЦ ЮУрГУ, 2012. 94 с.
5. Белокаменская А. М., Ребезов М. Б., Мазаев А. Н., Ребезов Я. М., Зинина О. В. Применение физико-химических методов исследований в лабораториях Челябинской области. Молодой ученый. 2013. № 4. С. 48–53.
6. Белокаменская А. М., Ребезов М. Б., Мазаев А. Н., Ребезов Я. М., Максимюк Н. Н., Асенова Б. К. Исследование пищевых продуктов и продовольственного сырья на содержание ртути атомно-абсорбционным методом. Молодой ученый. 2013. № 10. С. 98–101.
7. Белокаменская А. М., Ребезов М. Б., Мухамеджанова Э. К. Подбор современного оборудования для определения токсичных элементов с целью обеспечения качества испытаний. Торгово-экономические проблемы регионального бизнес-пространства. 2013. № 1. С. 292–296.
8. Боган В. И., Ребезов М. Б. Совершенствование потенциометрического метода определения токсичных элементов на примере определения свинца, кадмия и меди. Вестник Южно-Уральского государственного университета. Серия: Пищевые и биотехнологии. 2014. Т. 2. № 3. С. 53–60.
9. Боган В. И., Ребезов М. Б., Гайсина А. Р., Максимюк Н. Н., Асенова Б. К. Совершенствование методов контроля качества продовольственного сырья и пищевой продукции. Молодой ученый. 2013. № 10. С. 101–105.
10. Ребезов М. Б., Зыкова И. В., Белокаменская А. М., Ребезов Я. М. Контроль качества результата анализа при реализации методик фотоэлектрической фотометрии и инверсионной вольтамперометрии в исследовании проб пищевых продуктов на содержание мышьяка. Вестник Новгородского государственного университета имени Ярослава Мудрого. 2013. № 71. Т. 2. С. 43–48.
11. Ребезов М. Б., Наумова Н. Л., Альхамова Г. К., Лукин А. А., Хайруллин М. Ф. Экология и питание. Проблемы и пути решения. Фундаментальные исследования. 2011. № 8–2. С. 393–396.
12. Прохасько Л. С., Ребезов М. Б., Асенова Б. К., Зинина О. В., Залилов Р. В., Ярмаркин Д. А. Применение гидродинамических кавитационных устройств для дезинтеграции пищевых сред. Сборник научных трудов SWorld. 2013. Том 7. № 2. С. 62–67.
13. Прохасько Л. С. Технология кавитационной дезинтеграции пищевых сред. В сборнике: Наука. Южно-Уральский государственный университет. Материалы 65–1 Научной конференции. 2013. С. 32–35.
14. Ярмаркин Д. А., Прохасько Л. С., Мазаев А. Н., Асенова Б. К., Зинина О. В., Залилов Р. В. Кавитационные технологии в пищевой промышленности. Молодой ученый. 2014. № 8. С. 312–315.
15. Прохасько Л. С., Ярмаркин Д. А. Использование гидродинамической кавитации в пищевой промышленности.Сборник научных трудов Sworld. 2014. Т. 7. № 3. С. 27–31.
16. Ярмакин Д. А., Прохасько Л. С., Мазаев А. Н., Переходова Е. А., Асенова Б. К., Залилов Р. В. Перспективные направления кавитационной дезинтеграции. Молодой ученый. 2014. № 9 (68). С. 241–244.
moluch.ru
















