Исследовательские проекты лицея 22 г.Иваново. Хпк питьевой воды
зачем нужен этот показатель и какие факторы влияют
 В контексте темы заботы об окружающей среде часто обсуждается вопрос поддержки рек и других водоемов чистыми. Сейчас это крайне сложно делать, ведь сточные воды, которые сбрасываются в водоемы, сильно загрязнены.
В контексте темы заботы об окружающей среде часто обсуждается вопрос поддержки рек и других водоемов чистыми. Сейчас это крайне сложно делать, ведь сточные воды, которые сбрасываются в водоемы, сильно загрязнены.
После активного участия в том или ином процессе промышленного толка сточная вода накапливает огромное количество вредных элементов, которые, при попадании в открытый водоем, приводят к гибели водных обитателей и растений, а также к другим неприятным последствиям.
Для измерения степени загрязненности стоков берут за основу некоторые показатели, один из которых – это ХПК. Что такое ХПК, и как снизить этот показатель, мы и расскажем в данном материале.
Зачем нужны показатели степени загрязненности стоков?
Объем загрязнения сточных вод можно выявить по ряду показателей, наиболее распространенные среди них – это:
- ХПК либо химическое потребление кислорода;
- БПК – это биохимическое его потребление.
Измерение такого показателя, как ХПК нужно затем, чтобы проанализировать качество сточной воды или жидкости в водоеме либо с целью исследования состояния вод в целом. ХПК – это количественный показатель, он относится к наиболее информативным и подробным.
В качестве загрязнителей сточных вод выступают такие вещества, как:
- растворенные;
- взвешенные.
 Метод исследования состояния жидкости с учетом ХПК заключается в том, что определяется количество кислорода, который был потрачен на окисление органики и минералов с содержанием углерода. ХПК также называют единицей химической окисляемости воды, поскольку органические вещества окисляются под действием кислорода. Ведь он, в свою очередь, относится к наиболее сильным окислителям.
Метод исследования состояния жидкости с учетом ХПК заключается в том, что определяется количество кислорода, который был потрачен на окисление органики и минералов с содержанием углерода. ХПК также называют единицей химической окисляемости воды, поскольку органические вещества окисляются под действием кислорода. Ведь он, в свою очередь, относится к наиболее сильным окислителям.
Окисляемость в зависимости от происхождения окислителей, бывает таких видов:
- йодатной;
- бихроматной;
- цериевой;
- перманганатной.
Самые точные показатели определяются путем применения бихроматного или йодатного метода. Окисляемость выражается в соотношении объема кислорода, который был потрачен на окисление минеральных и органических веществ. Она выражается в миллиграммах из расчета на 1 кв. дм. жидкости.
Очищать сточные воды необходимо с целью сокращения концентрации вредных веществ до нормальных показателей, которые утверждены в нормативных документах.
Очистка проводится на специальных очистных сооружениях или станциях. Их компоновка зависит от количества и качества сточной воды, а также уровня ее загрязнения. Однако схема обработки стоков будет одинаковой и главная цель работы – сократить показатели ХПК и БПК.
ХПК и БПК в качестве критериев загрязнений вод
Значение ХПК включает в себя суммарное содержание в жидкости органических веществ в объеме израсходованного связанного кислорода на их окисление. ХПК – это общий показатель загрязнений промышленных и природных вод.
А вот такой показатель, как БПК определяет количество растворенного кислорода, который потрачен на окисление бактериями органических веществ в нужном объеме жидкости.
Для одинаковых проб по величине ХПК будет выше показателя БПК, поскольку больше веществ подвергается химическому окислению.
Какие факторы влияют на ХПК
 Факторов, способных повлиять на состав вредных веществ и на показатель кислотности жидкости, есть масса. Один из ключевых факторов – это совокупность биохимических процессов, происходящих в самом водоеме. Вследствие этих процессов вещества вступают в реакции друг с другом и образовывают новые, которые по структуре могут отличаться от предыдущих и иметь другой химический состав.
Факторов, способных повлиять на состав вредных веществ и на показатель кислотности жидкости, есть масса. Один из ключевых факторов – это совокупность биохимических процессов, происходящих в самом водоеме. Вследствие этих процессов вещества вступают в реакции друг с другом и образовывают новые, которые по структуре могут отличаться от предыдущих и иметь другой химический состав.
Эти вещества могут поступать в водоем следующим образом:
- вместе с атмосферными осадками;
- вместе с бытовыми или хозяйственными сточными водами;
- с подземными и поверхностными сточными водами.
Их структура и состав могут быть очень разными, в частности, которые из них могут быть устойчивыми по отношению к окислителям. В зависимости от этого фактора нужно выбирать наиболее эффективный окислитель для тех или иных веществ.
В поверхностных водах органические вещества могут иметь взвешенный, растворенный или коллоидный вид. Окисляемость отличается для фильтрованных и нефильтрованных проб. Природные же воды менее подвержены загрязнению органикой естественного происхождения.
Поверхностные воды имеют более высокую степень окисляемости по сравнению с такими типами вод, как:
- подземные;
- грунтовые и прочие.
Например, горные реки и озера имеют окисление в районе 2–3 мг на кубический дециметр, реки с болотным питанием – 20 мг/куб. дм и равнинные водоемы – от 5 до 12 соответственно.
Существенный фактор, который влияет на окисляемость – это сезонные изменения, происходящие в гидробиологическом и гидрологическом режимах.
Также окисляемость водоема может меняться под воздействием человеческой деятельности, в зависимости от сферы деятельности людей в водоем поступают загрязнения того или иного вида.
Требования к показателю ХПК согласно норме

По нормативу показатели ХПК должны колебаться в пределах от 15 до 30 мг/ куб. дм. Степени загрязнения сточных вод согласно показателям ХПК выглядят так:
- очень чистые – до 2 мг/куб. дм;
- относительно чистые – 3 мг/куб. дм;
- средней загрязненности – 4 мг/куб. дм;
- загрязненные – 15 мг/куб дм. и выше.
Стадии очистки сточных вод и снижения показателей их загрязненности
Очистка сточных вод включает в себя такие стадии:
- первичная очистка – это удаление масляных пленок, крупных частей грязи и численных загрязнений, которые легко удаляются. Данная стадия предусматривает очистку физико-механическим способом;
- вторичная очистка. На данном этапе отделяют взвешенные части и загрязнители, которые содержатся даже в растворенном виде. Некоторые загрязнители имеют органическое происхождение и их нужно удалять с помощью биологического окисления. Данная стадия подразумевает биологический метод очистки сточных вод;
- третичная очистка – это удаление всех оставшихся мелких частиц и загрязнителей, включая соли металлов. Очистка осуществляется методом осмоса, электродиализа, фильтрования через адсорбент и т. д.;
- четвертая стадия – на данном этапе идет обезвоживание шлама, что сводит его объем и вес к минимуму.
Уровень ХПК и БПК постепенно сокращается до тех или иных значений на каждой из стадии, объем их сокращения зависит от особенностей сточных вод.
Далеко не всегда сточные воды очищаются во все четыре стадии. Очень часто очистные сооружения сбрасывают сточные воды в коллектор уже после первой стадии очистки, и это приводит показатели ХПК в норму. В некоторых странах очистка осуществляется только в два этапа, третий этап применяется лишь в крайнем случае.
Отличие бытовых сточных вод от промышленных
Сточные воды могут иметь промышленное или бытовое происхождение, природа загрязнений в них тоже отличается. Так, как правило, бытовые стоки загрязнены такими вещами, как:
- мусор;
- органические остатки;
- моющие вещества.
А вот промышленные стоки наполняются отходами производства, если это пищевая промышленность, то там больше всего будет взвешенных веществ и жиров. Значения ХПК и БПК в промышленных стоках будут выше, чем в бытовых.
Иногда стоки объединяются, вследствие чего органика из бытовых сточных вод становится питательной средой для активного ила биоочистки.
Диапазоны соотношения критериев для разных вод
Анализ такого показателя, как ХПК проводят, чтобы определить, сколько всего содержится эквивалентного бихромату кислорода, который пошел на окисление всех находящихся в пробе органических и неорганических веществ.
Как уже упоминалось ранее, такая величина, как ХПК, которая оценивает восстановительную активность химических веществ, будет больше БПК, значение которого зависит исключительно от количества органики, подверженной биохимическому разложению. Соотношение между этими двумя показателями отражает полноту биохимического окисления веществ, которые содержатся в сточных водах. Чем больше разница между этими показателями, тем больше прирост биологически активных масс. В частности, по этому соотношению можно определить, насколько пригодны сточные воды для биологической очистки.
 Если веществ, подверженных биохимическому окислению будет мало, то лучше всего для исследований применять физико-химические методики, которые смогут привести соотношение показателей к требуемой цифре.
Если веществ, подверженных биохимическому окислению будет мало, то лучше всего для исследований применять физико-химические методики, которые смогут привести соотношение показателей к требуемой цифре.
Оптимальный диапазон соотношения БПК и ХПК – это от 0,4 и до 0, 75 единиц. Оптимальное значение для соотношения между химической и биологической потребностью в кислороде – это 0,7, при нем процесс биологической очистке сможет проходить полноценно и в полном объеме.
После того, когда сточные воды разделены гравитационным способом, из них удаляют преимущественно те вещества, которые трудно окислить. После этой стадии соотношение показателей увеличивается.
Затем следует стадия биологической очистки, вследствие которой соотношение показателей снижается на 0,2, поскольку в сточных водах исчезают органические вещества, подвергающиеся биохимическому окислению.
Также с целью оценки наличия в водах биологически разлагаемых частиц можно применять и обратное соотношение показателей. Например, согласно санитарным требованиям, которые подразумевают, что ХПК для сточных вод, пригодных к биоочистке, этот показатель не должен превышать показатель БПК более чем в полтора раза.
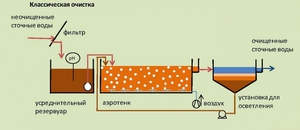 Если говорить о сооружениях для биологической очистки, которые очищают смеси домашних и производственных сточных вод, то в них, как правило, соотношение обоих параметров в поступающей жидкости на очистку составляет где-то в районе от 1,5 до 2,5. Когда сточная вода смешивается с промышленными отходами, этот показатель увеличивается и до 3,5, а при стоке вод с некоторых производственных мощностей он может доходить и до 8.
Если говорить о сооружениях для биологической очистки, которые очищают смеси домашних и производственных сточных вод, то в них, как правило, соотношение обоих параметров в поступающей жидкости на очистку составляет где-то в районе от 1,5 до 2,5. Когда сточная вода смешивается с промышленными отходами, этот показатель увеличивается и до 3,5, а при стоке вод с некоторых производственных мощностей он может доходить и до 8.
Как видите, значение ХПК позволит проанализировать состояние жидкости в водоемах и даст возможность выяснить, насколько эта она пригодна к очистке и в какой степени. Подробные исследования этого и прочих значений позволят сделать окружающую нас среду гораздо чище.
stoki.guru
ГОСТ 31859-2012 Вода. Метод определения химического потребления кислорода
ГОСТ 31859-2012
МКС 13.060.50ТН ВЭД 220100000220110000
Дата введения 2014-01-01
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены".Сведения о стандарте
1 ПОДГОТОВЛЕН Обществом с ограниченной ответственностью "Протектор" совместно с группой компаний "Люмэкс"
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии (Техническим комитетом по стандартизации ТК 343 "Качество воды")
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 15 ноября 2012 г. N 42)За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по МК (ИСО 3166) 004-97 | Сокращенное наименование национального органа по стандартизации |
Армения | AM | Агентство "Армстандарт" |
Казахстан | KZ | Госстандарт Республики Казахстан |
Беларусь | BY | Госстандарт Республики Беларусь |
Киргизия | KG | Кыргызстандарт |
Молдова | MD | Молдова-стандарт |
Россия | RU | Росстандарт |
Узбекистан | UZ | Узстандарт |
4 Настоящий стандарт соответствует международному стандарту ISO 15705:2002* Water quality - Determination of the chemical oxygen demand index (ST-COD) - Small-scale sealed-tube method (Качество воды. Определение индекса химического потребления кислорода. Маломасштабный метод герметичных пробирок)________________* Доступ к международным и зарубежным документам, упомянутым здесь и далее по тексту, можно получить, перейдя по ссылке на сайт http://shop.cntd.ru. - Примечание изготовителя базы данных. Степень соответствия - неэквивалентная (NEQ).Настоящий стандарт подготовлен на основе применения ГОСТ Р 52708-2007 "Вода. Метод определения химического потребления кислорода"
5 Приказом Федерального агентства по техническому регулированию и метрологии от 29 ноября 2012 года N 1618-ст межгосударственный стандарт ГОСТ 31859-2012 введен в действие в качестве национального стандарта Российской Федерации с 1 января 2014 года.
6 ВВЕДЕН ВПЕРВЫЕИнформация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
1 Область применения
Настоящий стандарт устанавливает метод определения химического потребления кислорода (далее - ХПК) в воде с использованием фотометрии. Метод распространяется на все типы воды (питьевые, природные, сточные) в диапазоне значений ХПК от 10 до 800 мгО/дм


2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие межгосударственные стандарты:ГОСТ 17.1.5.05-85 Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных осадковГОСТ 1770-74 (ИСО 1042-83, ИСО 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условияГОСТ 4204-77 Реактивы. Кислота серная. Технические условияГОСТ 4220-75 Реактивы. Калий двухромовокислый. Технические условияГОСТ ИСО 5725-6-2003 Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности на практике*________________* В Российской Федерации действует ГОСТ Р ИСО 5725-6-2002 "Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности на практике".ГОСТ 6709-72 Вода дистиллированная. Технические условияГОСТ 12026-76 Бумага фильтровальная лабораторная. Технические условияГОСТ ИСО/МЭК 17025-2009 Общие требования к компетентности испытательных и калибровочных лабораторийГОСТ 24104-2001 Весы лабораторные. Общие технические требования*________________* В Российской Федерации действует ГОСТ Р 53228-2008 "Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания".ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размерыГОСТ 29169-91 (ИСО 648-77) Посуда лабораторная стеклянная. Пипетки с одной отметкойГОСТ 29227-91 (ИСО 835-1-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требованияГОСТ 30813-2002 Вода и водоподготовка. Термины и определенияГОСТ 31861-2012 Вода. Общие требования к отбору пробГОСТ 31862-2012 Вода питьевая. Отбор пробПримечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя "Национальные стандарты" за текущий год. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены термины по ГОСТ 30813 и следующий термин с соответствующим определением:
3.1
химическое потребление кислорода; ХПК: Количество кислорода, потребляемое при химическом окислении содержащихся в воде органических и неорганических веществ под действием различных окислителей.[ГОСТ 27065-86, статья 29] |
4 Сущность метода
Сущность метода заключается в обработке пробы воды серной кислотой и бихроматом калия при заданной температуре в присутствии сульфата серебра - катализатора окисления, и сульфата ртути (II), используемого для снижения влияния хлоридов, и определении значений ХПК в заданном диапазоне концентраций путем измерения оптической плотности исследуемого раствора при заданном значении длины волны с использованием градуировочной зависимости оптической плотности раствора от значения ХПК.Значения ХПК в диапазоне от 10 до 160 мгО/дм


5 Средства измерений, вспомогательное оборудование, реактивы, материалы
Фотометр, спектрофотометр или фотометрический анализатор (далее - анализатор), снабженный адаптером для измерений оптической плотности воды и водных растворов, непосредственно находящихся в реакционных сосудах, в диапазоне длин волн от 400 до 700 нм.Реакционные сосуды из термостойкого стекла (пробирки с завинчивающимися крышками вместимостью от 10 до 15 см


6 Отбор проб
Пробы воды отбирают по ГОСТ 31861, ГОСТ 31862, ГОСТ 17.1.5.05.Для отбора, транспортирования и хранения проб воды используют емкости из стекла или полимерных материалов с навинчивающейся или пришлифованной пробкой. Емкости из полимерных материалов используют только для хранения замороженных проб воды при температуре минус 20 °С. Объем отбираемой пробы воды - не менее 100 см


7 Порядок подготовки к проведению измерений
7.1 Подготовку анализатора к работе проводят в соответствии с руководством (инструкцией) по эксплуатации.
7.2 Подготовка реакционных сосудовИз новой партии реакционных сосудов отбирают методом случайной выборки от 5% до 10% всего количества реакционных сосудов, но не менее трех штук. В каждый сосуд помещают по 5 см
7.3 Приготовление вспомогательных растворов
7.3.1 Раствор бихромата калия для измерения значений ХПК в диапазоне от 10 до 160 мгО/дм


7.3.2 Раствор бихромата калия для измерения значений ХПК в диапазоне от 80 до 800 мгО/дм


7.3.3 Раствор серной кислоты молярной концентрации 4 моль/дм



7.3.4 Раствор серной кислоты молярной концентрации 1,8 моль/дм



7.3.5 Раствор сульфата ртути (II) в серной кислотеРастворяют в стеклянной емкости 50 г сульфата ртути (II) в 200 см
7.3.6 Раствор сульфата серебра в серной кислотеРастворяют в стеклянной емкости 3,25 г сульфата серебра в 250 см
7.3.7 Реагент для заполнения реакционных сосудов при измерении значений ХПК в диапазоне от 10 до 160 мгО/дм



7.3.8 Реагент для заполнения реакционных сосудов при измерении значений ХПК в диапазоне от 80 до 800 мгО/дм
7.3.9 При использовании реагентов (см. 7.3.7 и 7.3.8) допускается увеличивать объемы растворов бихромата калия и сульфата серебра в 2 раза при одновременном увеличении объема аликвотной порции пробы воды до 4 см
7.4 Приготовление градуировочных растворов
7.4.1 Приготовление основного раствора со значением ХПК 1000 мгО/дм



7.4.2 Приготовление градуировочных растворов для диапазона значений ХПК от 10 до 160 мгО/дм



7.4.3 Приготовление градуировочных растворов для диапазона значений ХПК от 80 до 800 мгО/дм



7.5 Градуировка анализатораГрадуировку анализатора проводят в соответствии с руководством (инструкцией) по эксплуатации с использованием градуировочных растворов (см. 7.4.2 и 7.4.3) в зависимости от диапазона измеряемых значений ХПК. В качестве нулевой пробы используют дистиллированную воду. Градуировочные растворы и нулевую пробу воды подготавливают к измерениям аналогично анализируемым пробам (см. 8.5-8.7), измеряют значения оптической плотности растворов в реакционных сосудах при длинах волн (см. раздел 4) и устанавливают градуировочную зависимость оптической плотности растворов от значения ХПК (градуировочная характеристика), используя программное обеспечение к анализатору и/или программное обеспечение, предназначенное для обработки градуировочных зависимостей. Градуировочную характеристику признают стабильной, если абсолютное значение коэффициента корреляции, установленное программным обеспечением, не менее 0,98. Если коэффициент корреляции менее 0,98, градуировку анализатора повторяют.Контроль стабильности градуировочной характеристики проводят не реже одного раза в три месяца в соответствии с периодичностью, установленной в Руководстве по качеству лаборатории, с использованием не менее двух заново приготовленных градуировочных растворов с различными значениями ХПК (см. 7.4.2 и 7.4.3). Контроль стабильности градуировочной характеристики проводят также при смене партии реагента.
8 Порядок проведения измерений
8.1 Одновременно анализируют не менее двух аликвотных порций пробы воды (параллельные пробы). Объем отбираемой аликвотной порции пробы воды - 2 см

8.2 Заполняют реакционные сосуды реагентом (см. 7.3.7 или 7.3.8).Если предполагаемое значение ХПК находится в диапазоне от 80 до 160 мгО/дм
8.3 Проводят визуальный осмотр реакционных сосудов и их содержимого. При обнаружении в сосуде трещин, повреждений любого типа или признаков зеленой окраски раствора, реакционный сосуд не используют.
8.4 Включают нагревательный блок, нагревают его до 150 °С и выдерживают при этой температуре не менее 10 мин.
8.5 Снимают крышку с реакционного сосуда и сразу же вносят в него дозатором или мерной пипеткой пробу воды, при необходимости предварительно тщательно перемешанной (см. раздел 6).Примечание - Рекомендуется отбирать аликвотную порцию пробы воды, содержащей взвешенные вещества, после перемешивания, градуированной пипеткой вместимостью 5 см
8.6 На реакционный сосуд плотно навинчивают крышку и перемешивают его содержимое, осторожно переворачивая несколько раз. Вытирают внешнюю поверхность реакционного сосуда фильтровальной бумагой. Помещают реакционный сосуд в нагревательный блок и выдерживают в течение (120±10) мин.
8.7 Осторожно, например специальными захватами, вынимают реакционные сосуды из нагревательного блока и охлаждают при комнатной температуре до температуры не выше 60 °С. Перемешивают содержимое, переворачивая реакционные сосуды. Затем охлаждают реакционные сосуды до комнатной температуры. Реакционные сосуды, в которых произошло визуально заметное уменьшение объема содержимого, для измерений не используют. Анализ пробы воды в этом случае повторяют (см. 8.1-8.6).
8.8 Если раствор после охлаждения прозрачен, то измеряют оптическую плотность пробы воды при рабочей длине волны 440 нм, используя реагент (см. 7.3.7), или при 600 нм, используя реагент (см. 7.3.8).Если раствор мутный, то ему дают отстояться, затем измеряют его оптическую плотность как описано выше. Если после отстаивания раствор остается мутным, то анализ пробы воды повторяют, предварительно разбавив ее дистиллированной водой.
9 Правила обработки результатов измерений
9.1 По значению оптической плотности раствора, измеренному по 8.8, для каждой аликвотной порции пробы воды (см. 8.1), используя градуировочную зависимость (см. 7.5), определяют значение ХПК.Если значение ХПК выходит за пределы диапазона построения градуировочной зависимости, то испытания по разделу 8 повторяют либо разбавив пробу дистиллированной водой, либо используя реагент для работы с другим диапазоном значений ХПК.Если проба воды подвергалась в процессе измерений разбавлению, то полученное значение ХПК умножают на коэффициент разбавления пробы воды 

где 



9.2 За результат измерения принимают среднеарифметическое значение не менее двух параллельных определений ХПК пробы воды 


где 




Диапазон измеряемых значений ХПК, мгО/дм | Предел повторяемости (относительное значение допускаемого расхождения между двумя результатами параллельных определений при | Предел воспроизводимости (относительное значение допускаемого расхождения между двумя результатами определений, полученными в условиях воспроизводимости при | Показатель точности (границы* допускаемой относительной погрешности при вероятности |
От 10 до 50 включ. | 25 | 36 | 30 |
Св. 50 " 200 " | 17 | 28 | 20 |
" 200 | 14 | 19 | 15 |
* Установленные численные значения границ допускаемой относительной погрешности соответствуют численным значениям расширенной неопределенности | |||
9.3 При невыполнении условия (2) методы проверки приемлемости результатов параллельных определений и установления окончательного результата измерений осуществляют в соответствии с требованиями ГОСТ ИСО 5725-6 (пункт 5.2).
10 Метрологические характеристики
Метод обеспечивает получение результатов измерения с метрологическими характеристиками, не превышающими значений, приведенных в таблице 1, при доверительной вероятности 
11 Правила оформления результатов измерений
Результаты измерений регистрируют в протоколе испытаний согласно ГОСТ ИСО/МЭК 17025. Результат измерения представляют в виде


где 






где 







12 Контроль показателей качества результатов измерений
12.1 Контроль стабильности результатов измерений в лаборатории предусматривает контроль стабильности среднеквадратического отклонения повторяемости, контроль стабильности стандартного отклонения промежуточной прецизионности и контроль стабильности показателей правильности рутинного анализа по ГОСТ ИСО 5725-6 (раздел 6) с использованием ГСО бихроматной окисляемости.
12.2 Проверку совместимости результатов измерений, полученных в двух лабораториях, проводят по ГОСТ ИСО 5725-6 (пункт 5.3). Результаты считают совместимыми при выполнении условия

где 






ПРИЛОЖЕНИЕ А (обязательное). Требования безопасности
ПРИЛОЖЕНИЕ А(обязательное)
А.1 Метод настоящего стандарта предусматривает использование горячих концентрированных растворов серной кислоты и бихромата калия. Персонал должен пройти инструктаж по технике безопасности при работе с кислотой и использовать защитную одежду и теплоизолирующие перчатки. Перед нагревательным блоком устанавливают защитный экран.
А.2 При подготовке проб возможно выделение токсичных газов (сероводород, циановодород). Все операции необходимо проводить в вытяжном шкафу.
А.3 Содержимое реакционных сосудов включает токсичные сульфаты ртути (II) и серебра, а также бихромат калия. Утилизацию содержимого реакционных сосудов проводят с соблюдением правил обращения с токсичными отходами.
А.4 Реакционные сосуды, в которых полностью израсходован бихромат калия, могут содержать пары ртути. Такие сосуды следует открывать только в вытяжном шкафу.
А.5 В закрытых крышками реакционных сосудах в процессе нагревания повышается давление, поэтому они должны быть тщательно осмотрены перед использованием. Во избежание взрывов сосуды, имеющие трещины, сколы и другие дефекты, не используют.
А.6 До полного охлаждения содержимого реакционных сосудов до комнатной температуры запрещается отвинчивать крышки сосудов во избежание выброса содержимого.
Библиография
_____________________________________________________________________________________УДК 663.6:006.354 МКС 13.060.50 ТН ВЭД 220100000 NEQ
220110000
Ключевые слова: вода, качество воды, химическое потребление кислорода, бихроматная окисляемость, метод фотометрии_____________________________________________________________________________________
Электронный текст документаподготовлен ЗАО "Кодекс" и сверен по:официальное изданиеМ.: Стандартинформ, 2014
docs.cntd.ru
ХПК сточных вод это химическое потребление кислорода БПК5
Частное хозяйство и промышленность формируют большое количество сточных вод на планете. Именно поэтому так важны очистительные сооружения для полученных стоков. Благодаря современным методам обработки и дезинфекции загрязненной воды удается снизить уровень угрозы для окружающей среды, который, так или иначе, есть ввиду сброса грязной жидкой среды в водоёмы.
Основными показателями загрязненности вод, в соответствии с которыми подбирается методология очистки, являются расчет и проведение анализа на ХПК (химическое потребление кислорода) и расчет количества БПК (биологическое потребление кислорода) воды. Именно по этим параметрам определяют уровень загрязненности жидкости и стремятся снизить его до регламентируемых СНиП нормативов специально подобранными способами обеззараживания.
Важно: если в сточных водах промышленного или частного хозяйства уровень ХПК и БПК превышен в разы, значит, вода представляет серьезную угрозу для окружающей среды. А поэтому неприятностей с экологической службой не избежать, если не очистить стоки перед сбросом. При этом если даже при обеззараживании воды уровни показателей ХПК и БПК при расчете и проведении анализа не падают, значит, нарушена технология обработки жидкой среды.
ХПК и БПК: определение и формирование
 При природном самоочищении воды происходят кислородные реакции, которые позволяют окислять органические примеси в воде
При природном самоочищении воды происходят кислородные реакции, которые позволяют окислять органические примеси в водеПри природном самоочищении воды происходят кислородные реакции, которые позволяют окислять органические примеси в воде. Таким образом, происходит их частичный или полный распад. ХПК — это показатель затратности кислорода на окисление различных примесей в составе воды, а БПК — является показателем потребления кислорода на окисление примесей при взаимодействии с бактериальными аэробными препаратами в очистных сооружениях.
Таким образом, повышенный уровень ХПК и БПК при проведении анализа в стоках говорит о том, что воде требуется много кислорода для окисления вредных примесей. А значит, количество этих самых примесей также велико. То есть вода слишком грязная.
Уровни ХПК и БПК измеряют посредством взятия воды на анализ. При этом воду исследуют при определенных температурных показателях в течение конкретного периода времени.
При окислении посредством кислорода в воде уничтожаются такие элементы как сера, водород, углерод, фосфор и прочие химические составляющие, исключая азот, до состояния СО2, Н2О, P2O5, SО3. Кроме того, при участии в окислении кислорода азот преобразуется в аммонийную соль. Стоит отметить, что во время реакции окисления кислород напрямую участвует в реакции, в то время как водород лишь отдает на каждый окисляемый атом вещества по три своих атома. Особенно это касается окисления азота и образования соли аммония.
Важно: Анализ на БПК в воде проводится более длительно от 5 до 20 суток, а анализ на определение ХПК выполняется от 0,3 до 1,4 суток.
Снижение уровней ХПК и БПК
 Химические и биологические уровни потребления кислорода в грязной воде снижаются в специальных очистных сооружениях
Химические и биологические уровни потребления кислорода в грязной воде снижаются в специальных очистных сооружениях Химические и биологические уровни потребления кислорода в грязной воде снижаются в специальных очистных сооружениях. Принцип очистки воды приблизительно одинаков. Различаются лишь метода воздействия на патогенные микроорганизмы с целью максимального их уничтожения. При этом очистные станции могут различаться по конструкции и размерам в зависимости от количества перерабатываемых стоков и их первичного образования.
Для снижения уровней химического и биологического (биохимического) показателей кислорода в жидкости применяют от 1 до 4 стадий обработки. Таковыми являются:
- Первичная стадия. Подразумевает под собой механическое отделение крупных частиц мусора и жировых пленок методом фильтрования или отстаивания. Такие способы являются физико-механическими.
- На вторичной стадии обеззараживания жидкости используют биологические препараты для окисления более мелких, иногда растворенных в воде органических примесей.
- При третичной обработке воды происходит нейтрализация и удаление солей металлов и других оставшихся мелких частичек примесей. Здесь чаще всего используют химические и физико-химические методы обработки, такие как обратный осмос, электродиализ, адсорбция, флотация и пр.
- Четвертая стадия обработки воды не является методом снижения уровней ХПК и БПК, однако направлена на выделение (обезвоживание) оставшегося в воде шла а и его последующую утилизацию.
Важно: чаще всего при очистке стоков применяют первые две стадии обработки воды. После этого вода содержит нормальные показатели биологического и химического потребления кислорода. В Европе иногда используют третью стадию очистки жидкости, но исключительно по необходимости.
Отличия между промышленными и бытовыми сточными водами по уровню ХПК и БПК
 Стоки делят по типу образования на промышленные и бытовые
Стоки делят по типу образования на промышленные и бытовые Стоки делят по типу образования на промышленные и бытовые. Соответственно, первые содержат больше загрязнителей и химических примесей, которые требуют большого количества химического или биологического поглощения кислорода для их очистки. В свою очередь бытовые загрязняются преимущественно органикой, что формирует в разы низший уровень ХПК и БПК в сравнении с промышленной грязной водой.
Важно: если каким-то образом бытовые сточные воды попадают к промышленным, то они являются активаторами биологического и биохимического поглощения кислорода для очистки жидкости одним из биохимических методов. То есть, качество и скорость очистки воды возрастает в разы.
И наоборот, если в бытовые стоки попадают агрессивные вещества типа хлора или же в воду подмешиваются промышленные стоки, то это может показывать высокий уровень ХПК и БПК для бытовой воды.
Важно: химическое потребление кислорода в стоках измеряется в мг/литр. При этом при проведении анализа уровень ХПК всегда будет выше, чем уровень БПК. Поскольку химическое окисление в воде требует больше кислорода, нежели биологическое.
vodakanazer.ru
Химическое потребление кислорода
В начало
Величина, характеризующая содержание в воде органических и минеральных веществ, окисляемых одним из сильных химических окислителей при определенных условиях, называется окисляемостью. Существует несколько видов окисляемости воды: перманганатная, бихроматная, иодатная, цериевая. Наиболее высокая степень окисления достигается методами бихроматной и иодатной окисляемости воды.
Окисляемость выражается в миллиграммах кислорода, пошедшего на окисление органических веществ, содержащихся в 1 дм3 воды.
Состав органических веществ в природных водах формируется под влиянием многих факторов. К числу важнейших относятся внутриводоемные биохимические процессы продуцирования и трансформации, поступления из других водных объектов, с поверхностными и подземными стоками, с атмосферными осадками, с промышленными и хозяйственно-бытовыми сточными водами. Образующиеся в водоеме и поступающие в него извне органические вещества весьма разнообразны по своей природе и химическим свойствам, в том числе по устойчивости к действию разных окислителей. Соотношение содержащихся в воде легко- и трудноокисляемых веществ в значительной мере влияет на окисляемость воды в условиях того или иного метода ее определения.
В поверхностных водах органические вещества находятся в растворенном, взвешенном и коллоидном состояниях. Последние при обычном анализе отдельно не учитываются, поэтому различают окисляемость фильтрованных (растворенное органическое вещество) и нефильтрованных (общее содержание органических веществ) проб.
Величины окисляемости природных вод изменяются в пределах от долей миллиграммов до десятков миллиграммов в литре в зависимости от общей биологической продуктивности водоемов, степени загрязненности органическими веществами и соединениями биогенных элементов, а также от влияния органических веществ естественного происхождения, поступающих из болот, торфяников и т.п. Поверхностные воды имеют более высокую окисляемость по сравнению с подземными (десятые и сотые доли миллиграмма на 1 дм3), исключение составляют воды нефтяных месторождений и грунтовые воды, питающиеся за счет болот. Горные реки и озера характеризуются окисляемостью 2–3 мг О/дм3, реки равнинные – 5–12 мг О/дм3, реки с болотным питанием – десятки миллиграммов на 1 дм3.
Окисляемость подвержена закономерным сезонным колебаниям. Их характер определяется, с одной стороны, гидрологическим режимом и зависящим от него поступлением органических веществ с водосбора, с другой – гидробиологическим режимом.
В водоемах и водотоках, подверженных сильному воздействию хозяйственной деятельности человека, изменение окисляемости выступает как характеристика, отражающая режим поступления сточных вод. Для природных малозагрязненных вод рекомендовано определять перманганатную окисляемость; в более загрязненных водах определяют, как правило, бихроматную окисляемость (ХПК).
В соответствии с требованиями к составу и свойствам воды водоемов у пунктов питьевого водопользования величина ХПК не должна превышать 15 мг О/дм3; в зонах рекреации в водных объектах допускается величина ХПК до 30 мг О/дм3.
В программах мониторинга ХПК используется в качестве меры содержания органического вещества в пробе, которое подвержено окислению сильным химическим окислителем. ХПК применяют для характеристики состояния водотоков и водоемов, поступления бытовых и промышленных сточных вод (в том числе, и степени их очистки), а также поверхностного стока.
Для вычисления концентрации углерода, содержащегося в органических веществах, значение ХПК (мг О/дм3) умножается на 0,375 (коэффициент, равный отношению количества вещества – эквивалента углерода к количеству вещества – эквивалента кислорода).
Таблица. Величины ХПК в водоемах с различной степенью загрязненности
|
Степень загрязнения (классы водоемов) |
ХПК, мг О/дм3 |
|
Очень чистые |
1 |
|
Чистые |
2 |
|
Умеренно загрязненные |
3 |
|
Загрязненные |
4 |
|
Грязные |
5–15 |
|
Очень грязные |
>15 |
Присутствующие в воде органические соединения могут претерпевать не только аэробное биохимическое окисление в результате жизнедеятельности бактерий, используемое при определении БПК. При наличии в пробе воды сильных окислителей и соответствующих условий протекают химические реакции окисления органических веществ, причем характеристикой процесса химического окисления, а также мерой содержания в пробе органических веществ является потребление в реакции кислорода, химически связанного в окислителях. Показатель, характеризующий суммарное содержание в воде органических веществ по количеству израсходованного на окисление химически связанного кислорода, называется химическим потреблением кислорода (ХПК).
Являясь интегральным (суммарным) показателем, ХПК в настоящее время считается одним из наиболее информативных показателей антропогенного загрязнения вод. Этот показатель, в том или ином варианте, используется повсеместно при контроле качества природных вод, исследовании сточных вод и др. Результаты определения окисляемости выражаются в миллиграммах потребленного кислорода на 1 л воды (мгО/л).
Однако не все органические вещества в равной степени участвуют в реакции химического окисления. Так же, как и при биохимическом окислении, при химическом окислении можно выделить группы легко, нормально и тяжело окисляющихся органических веществ. Поэтому всегда существует разница между теоретически возможным и практически достигаемым значениями ХПК.
Теоретическим значение ХПК (ХПКтеор) называют количество кислорода (или окислителя в пересчете на кислород) в мг/л, необходимое для полного окисления содержащихся в пробе органических веществ, т.е. всех способных окисляться элементов из состава органического соединения. При таком окислении углерод теоретически количественно окисляется до СО2, а сера и фосфор (если они присутствуют в соединении) – до SО3 и Р2О5. Азот превращается в аммонийную соль; кислород, входивший в состав окисляемых органических молекул, является «строительным материалом» для образующихся продуктов окисления, а водород переходит в структуру Н2О или аммонийной соли.
Например, при окислении синильной кислоты и гликоля протекают реакции:
НСN+Н2О+О=NН3+СО2;
Н2NСН2СООН+ЗО=NН3+2СО2+Н2О.
Практически используемые методы определения ХПК дают результаты, близкие к ХПКтеор, но всегда отклоняющиеся в ту или иную сторону. При наличии трудно окисляющихся органических веществ их окисление за время реакции проходит не полностью, и это приводит к занижению результата. В то же время, при наличии в пробе неорганических восстановителей, также потребляющих кислород на собственное окисление, результат получается завышенный. Совместное действие обоих факторов и вызывает отклонение реального ХПК от ХПКтеор.
Таким образом, окисляемость, или ХПК, характеризует общее количество содержащихся в воде восстановителей (органических и неорганических), реагирующих с сильными окислителями. В качестве таких окислителей обычно используют бихромат- и перманганат-анионы, и соответственно называются основные методы определения ХПК – бихроматный и перманганатный. Следует отметить, что результаты определения окисляемости одной и той же воды с помощью разных окислителей обычно неоднозначны из-за неодинаковой степени окисления веществ, присутствующих в воде. Результаты зависят также от свойств окислителя, его концентрации, температуры, рН, продолжительности окисления и др. Получаемые результаты сопоставимы только в том случае, когда точно соблюдены все условия проведения анализа.
Бихроматная окисляемость позволяет получить значение ХПК, наиболее приближенное к ХПКтеор, т.е. наиболее полное окисление достигается бихроматом калия. Поэтому определение бихроматной окисляемости является основным методом определения ХПК. Именно бихроматную окисляемость часто называют «химическим потреблением кислорода». В условиях этого метода большинство органических соединений окисляется на 95 % и более, однако окисляются не все соединения (толуол, бензол, пиридин, парафин и др. практически не окисляются). Катализатором окисления является сульфат серебра, который добавляется в аналитическую рецептуру для ускорения реакции и повышения полноты окисления органических веществ. Избыток бихромата оттитровывается раствором соли Мора. Реакцию проводят в жестких условиях – в 50 %-ной (разбавление 1:1) серной кислоте при кипячении. Содержание неорганических восстановителей в пробе определяют отдельно специальными методами и вычитают из ХПК пробы.
Бихромат при этом восстанавливается согласно уравнению:
Сг2О72-+ 14Н++6е-=2Сг3++7Н2О.
В таких условиях получаемый результат обычно составляет 95-98 % от ХПКтеор.
На примере окисления фталата калия бихроматом реакцию можно записать следующим образом:
2KС8Н5О4+10К2Сг2О7+41Н2SО4=16СО2 +46Н2О+10Сг2(SО4)3+11К2SО4
Из уравнения реакции следует, что на окисление 2 молекул фталата калия расходуется 16 молекул кислорода, связанного в бихромате. В весовом отношении ХПКтеор для 1 мг фталата калия составляет 1,175 мгО.
Значения ХПКтеор (в мг кислорода на 1 мг вещества) для разных соединений, по данным [26], приведены ниже.
Таблица. Значения ХПКтеор для разных соединений
|
Соединение |
ХПКтеор, мгО/л |
|
Щавелевая кислота |
0,18 |
|
Синильная кислота |
0,59 |
|
Гликоль |
0,64 |
|
Глюкоза |
1,07 |
|
Уксусная кислота |
1,07 |
|
Сахароза |
1,12 |
|
Масляная кислота |
1,82 |
|
Этанол |
2,09 |
|
Додецилбензоат натрия |
2,34 |
|
Фенол |
2,38 |
|
Бутанол |
2,59 |
Бихроматная окисляемость определяется методом титрования. Соответствующие методики, с незначительными различиями, регламентированы как отечественными руководящими документами, так и международным стандартом ИСО 6060. Согласно методу титрования, избыток бихромата калия после операции окисления (уравнение реакции см. выше) оттитровывают солью Мора в присутствии индикатора, в качестве которого обычно используется ферроин – комплекс 1,10-фенатролина с сульфатом железа (II) (в качестве индикатора может быть также использована М-фенилантраниловая кислота). При этом катион Fе2+ в титранте реагирует с катионом хрома:
3Fе2+ + Сгб+= 3Fе3+ + Сг3+
Индикатор образует интенсивно окрашенное соединение с Fе2+ и бесцветное – с Fе3+. По этой причине, когда восстановление Сгб+ до Сг3+ завершено, Fе2+ реагирует с индикатором с образованием ферроинового комплекса. При этом окраска раствора отчетливо изменяется от синевато-зеленой до красно-коричневой, что указывает момент окончания титрования. Момент окончания титрования может быть установлен также потенциометрически.
Для определения ХПК, наряду с окислением бихроматом, проводят также окисление перманганатом. Соответствующий показатель называется перманганатной окисляемостыо (за рубежом также используют термин «перманганатный индекс»). Перманганатная окисляемость является мерой загрязнения воды окисляемыми органическими и неорганическими веществами, способными к окислению в условиях анализа, и такими условиями являются окисление 0,01 н. раствором перманганата калия в сернокислой среде или кипячении в течение 10 мин.
Уравнение реакции при окислении пробы перманганатом можно записать следующим образом:
МпО4-+8Н++3е- = Мп4++4Н2О
Для определения перманганатной окисляемости используется более простой метод, чем для бихроматной окисляемости, однако он имеет ограниченное применение. Так, определение перманганатной окисляемости может быть рекомендовано (и широко используется) лишь при анализе природных вод для контроля за динамикой содержания легкоокисляющихся веществ природного происхождения (например, гуминовых кислот). И это понятно, т.к. "жестко" окисляющиеся органические загрязнители, часто присутствующие в сточных водах, в природной воде практически не встречаются. Следует отметить также, что именно перманганатная окисляемость является единственным показателем ХПК, регламентирующим качество питьевой воды согласно СанПиН 2.1.4.559-96 (норматив составляет 5,0 мгО/л).
Определение перманганатной окисляемости может давать некорректные результаты при анализе сточных вод по следующим причинам:
1) перманганат – недостаточно сильный окислитель, поэтому окисление многих веществ проходит неполно или совсем не проходит;
2) при кипячении растворов, содержащих перманганат, последний разлагается до диоксида марганца и кислорода (как в кислой, так и в щелочной средах). Выпадающий диоксид марганца каталитически ускоряет процесс, однако в холостой пробе или относительно чистой воде этого не происходит. Процесс осложняется тем, что количество выпадающего диоксида марганца зависит от условий и состава анализируемой пробы.
Следует отметить, что в природных водах содержание трудно окисляющихся органических веществ обычно крайне мало, и результаты, получаемые при анализе природных вод бихроматным и перманганатным методами, практически достаточно близки.
Перманганатную окисляемость используют для оценки качества питьевой, водопроводной воды, природной воды источников водоснабжения и др. Ее определение предусмотрено ГОСТ 2761 при обследовании источников хозяйственно-питьевого водоснабжения. Более загрязненные поверхностные и сточные воды также, с известным приближением, можно анализировать этим методом, однако их необходимо разбавлять. Перманганатную окисляемость нельзя рассматривать как меру теоретического потребления кислорода или общего содержания органических веществ в воде, т.к. ряд органических соединений в условиях этого метода окисляется лишь частично.
Таким образом, для характеристики ХПК как показателя химической активности пробы, традиционно используются методы «мокрой» химии. Тем не менее, ХПК определяют также и «сухимии» приборными методами. Например, методами сжигания органических веществ пробы в токе кислорода или СО2. Эти методы также позволяют получить результаты, близкие ХПКтеор, однако требуют приборного оснащения, а приборы – соответствующего обслуживания, поверки и т.п.
Мешают точному определению ХПК в первую очередь, хлорид-анионы, как правило, содержащиеся в природных и, особенно, в сточных водах. Хлориды окисляются в условиях анализа до элементарного хлора, поэтому при содержании в пробе в концентрации свыше 300 мг/л их влияние устраняется (или минимизируется) путем добавления сульфата ртути (II) в количестве 22,2 мг Н2SО4 на 1 мг С1. Образующийся малодиссоциированный хлорид ртути (II) устойчив в присутствии большой концентрации серной кислоты и бихромата.
Определению также мешают нитриты, часто присутствующие в водах, прошедших биохимическую очистку. Для их устранения в пробу вводят по 10 мг сульфаминовой кислоты на 3 мг NО2- . При кипячении раствора нитрит-анионы удаляются в виде азота, а избыток сульфаминовой кислоты переходит в сульфат аммония:
Н2NSО2ОН+НNО2=N2+Н2SО4+Н2О,
Н2NSО2ОН +Н2О=Nh5НSО4.
Помимо хлоридов и нитритов, определению мешают сульфиды, сероводород и железо. Все указанные соединения, при их присутствии в пробе, могут быть определены индивидуально, и результат анализа на окисляемость, в таком случае, уменьшают на величину потребления кислорода этими соединениями. В частности, 1 мг Н2S соответствует 0,47 мг О; 1 мг NО2 – – 0,35 мг O; 1 мг Fе2+ – 0,14 мг О.
Нормативы на ХПК в воде водоемов: для питьевой воды – 5,0 мгО/л (для перманганатной окисляемости), ХПК – 15 мгО/л.
icolog.ru
Органические вещества, БПК и ХПК
Органические вещества. В воде источников водоснабжения обнаружено несколько тысяч органических веществ разных химических классов и групп. Органические соединения природного происхождения — гуминовые вещества, различные амины и др. — способны изменять органолептические свойства воды, и по этой причине мала вероятность проявления их токсических свойств в питьевой воде централизованных систем питьевого водоснабжения, так как они должны быть удалены в процессе водоподготовки.
Несомненно, что органические вещества техногенного происхождения при поступлении их с питьевой водой могут неблагоприятно действовать на организм. Аналитический контроль их содержания в питьевой воде затруднен не только ввиду громадного их числа, но и вследствие того, что многие из них весьма неустойчивы и в воде происходит их непрерывная трансформация. Поэтому при аналитическом контроле невозможно идентифицировать все органические соединения, присутствующие в питьевой воде. Однако многие органические вещества обладают выраженными органолептическими свойствами (запахом, вкусом, цветом, способностью к пенообразованию), что позволяет их выявить и ограничить их содержание в питьевой воде. Примерами таких веществ являются: синтетические поверхностно-активные вещества (СПАВ), в незначительных (нетоксических) концентрациях образующие пену; фенолы, придающие воде специфический запах; многие фосфорорганические соединения. В природной воде водоемов всегда присутствуют органические вещества. Их концентрации могут быть иногда очень малы (например, в родниковых и талых водах). Природными источниками органических веществ являются разрушающиеся останки организмов растительного и животного происхождения, как живших в воде, так и попавших в водоем с листвы, по воздуху, с берегов и т.п. Кроме природных, существуют также техногенные источники органических веществ: транспортные предприятия (нефтепродукты), целлюлознобумажные и лесоперерабатывающие комбинаты (лигнины), мясокомбинаты (белковые соединения), сельскохозяйственные и фекальные стоки и т.д. Органические загрязнения попадают в водоем разными путями, главным образом со сточными водами и дождевыми поверхностными смывами с почвы. Содержание органических веществ оценивается показателям БПК и ХПК. Биохимическое и химическое потребление кислорода — БПК и ХПК — принятые в гигиене, гидрохимии и экологии, интегральные показатели, характеризующие содержание в воде нестабильных ( неконсервативных) органических веществ, трансформирующихся в воде путем гидролиза, окисления и других процессов. Содержание таких веществ выражается через количество кислорода, необходимое для их окисления в резко кислой среде перманганатом (БПК) или бихроматом (ХПК). К таким веществам относят алифатические кислоты, некоторые эфиры, амины, спирты. Таким образом, аналитический контроль питьевой воды должен быть направлен на определение достаточно стабильных (консервативных) веществ, не обладающих выраженными органолептическими свойствами, но представляющих высокую опасность для здоровья в силу выраженной токсичности, кумулятивности или способности вызывать отдаленные эффекты, неблагоприятные для здоровья индивидуума или последующих поколений (мутагенные — изменяющие наследственные структуры, канцерогенные, эмбриотоксические, гонадотоксические). Среди таких соединений большое гигиеническое значение имеют следующие группы: сельскохозяйственные пестициды, полиароматические углеводороды, тригалометаны. Последнее время в литературе широко обсуждается гигиеническое значение диоксинов, дибензофуранов и бифенилов — техногенных продуктов.
В естественных условиях находящиеся в воде органические вещества разрушаются бактериями, претерпевая аэробное биохимическое окисление с образованием двуокиси углерода. При этом на окисление потребляется растворенный в воде кислород. В водоемах с большим содержанием органических веществ большая часть РК потребляется на биохимическое окисление, лишая, таким образом, кислорода другие организмы. Поэтому увеличивается количество организмов, более устойчивых к низкому содержанию РК, исчезают кислородолюбивые виды и появляются виды, терпимые к дефициту кислорода. Таким образом, в процессе биохимического окисления органических веществ в воде происходит уменьшение концентрации РК, и эта убыль косвенно является мерой содержания в воде органических веществ. Соответствующий показатель качества воды, характеризующий суммарное содержание в воде органических веществ, называется биохимическим потреблением кислорода (БПК).
БПК - это количество кислорода в (мг), требуемое для окисления находящихся в 1 л воды органических вещества в аэробных условиях, без доступа света, при 20 °С, за определенный период в результате протекающих в воде биохимических процессов. Определение БПК основано на измерении концентрации РК в пробе воды непосредственно после отбора, а также после инкубации пробы. Инкубацию пробы проводят без доступа воздуха в кислородной склянке (т.е. в той же посуде, где определяется значение РК) в течение времени, необходимого для протекания реакции биохимического окисления. Так как скорость биохимической реакции зависит от температуры, инкубацию проводят в режиме постоянной температуры (20±1) °С, причем от точности поддержания значения температуры зависит точность выполнения анализа на БПК. Обычно определяют БПК за 5 суток инкубации (БПК5). Может определяться также БПК10 за 10 суток и БПКполн за 20 суток (при этом окисляется около 90 и 99 % органических веществ соответственно). Ориентировочно принимают, что БПК5 составляет около 70 % БПКПОЛН., но может составлять от 10 до 90 % в зависимости от окисляющегося вещества. Погрешность в определении БПК может внести также освещение пробы, влияющее на жизнедеятельность микроорганизмов и способное в некоторых случаях вызывать фотохимическое окисление. Поэтому инкубацию пробы проводят без доступа света ( в темном месте).
Особенностью биохимического окисления органических веществ в воде является сопутствующий ему процесс нитрификации, искажающий характер потребления РК. В то время как, и природные, и хозяйственно-бытовые сточные воды содержат большое количество микроорганизмов, способных развиваться за счет содержащихся в воде органических веществ, многие виды промышленных сточных вод стерильны, или содержат микроорганизмы, которые не способны к аэробной переработке органических веществ. Однанако микробы можно адаптировать (приспособить) к присутствию различных соединений, в том числе токсичных. Поэтому при анализе таких сточных вод (для них характерно, как правило, повышенное содержание органических веществ) обычно применяют разбавление водой, насыщенной кислородом и содержащей добавки адаптированных микроорганизмов.При определении БПКПОЛН промышленных сточных вод предварительная адаптация микрофлоры имеет решающее значение для получения правильных результатов анализа, т.к. в состав таких вод часто входят вещества, которые сильно замедляют процесс биохимического окисления, а иногда оказывают токсическое действие на бактериальную микрофлору.
vseokraskah.net
Окисляемость или химическое потребление кислорода (ХПК) - Общие и суммарные показатели - Методики исследования
Окисляемость или химическое потребление кислорода (ХПК)
Присутствующие в воде органические соединения могут претерпевать не только аэробное биохимическое окисление в результате жизнедеятельности бактерий, используемое при определении БПК. При наличии в пробе воды сильных окислителей и соответствующих условий протекают химические реакции окисления органических веществ, причем характеристикой процесса химического окисления, а также мерой содержания в пробе органических веществ является потребление в реакции кислорода, химически связанного в окислителях. Показатель, характеризующий суммарное содержание в воде органических веществ по количеству израсходованного на окисление химически связанного кислорода, называется химическим потреблением кислорода (ХПК). Являясь интегральным (суммарным) показателем, ХПК в настоящее время считается одним из наиболее информативных показателей антропогенного загрязнения вод. Этот показатель, в том или ином варианте, используется повсеместно при контроле качества природных вод, исследовании сточных вод и др. Результаты определения окисляемости выражаются в миллиграммах потребленного кислорода на 1 л воды (мгО/л).
Однако не все органические вещества в равной степени участвуют в реакции химического окисления. Так же, как и при биохимическом окислении, при химическом окислении можно выделить группы легко, нормально и тяжело окисляющихся органических веществ. Поэтому всегда существует разница между теоретически возможным и практически достигаемым значениями ХПК.
Теоретическим значением ХПК (ХПКтеор) называют количество кислорода (или окислителя в пересчете на кислород) в мг/л, необходимое для полного окисления содержащихся в пробе органических веществ, т.е. всех способных окисляться элементов из состава органического соединения. При таком окислении углерод теоретически количественно окисляется до CO2, а сера и фосфор (если они присутствуют в соединении) – до SO3 и P2O5. Азот превращается в аммонийную соль; кислород, входивший в состав окисляемых органических молекул, является «строительным материалом» для образующихся продуктов окисления, а водород переходит в структуру h3O или аммонийной соли.
Например, при окислении синильной кислоты и гликоколя протекают реакции:
Практически используемые методы определения ХПК дают результаты, близкие к ХПКтеор, но всегда отклоняющиеся в ту или иную сторону. При наличии трудно окисляющихся органических веществ их окисление за время реакции проходит неполностью, и это приводит к занижению результата. В то же время, при наличии в пробе неорганических восстановителей, также потребляющих кислород на собственное окисление, результат получается завышенный. Совместное действие обоих факторов и вызывает отклонение реального ХПК от ХПКтеор.
Таким образом, окисляемость, или ХПК, характеризует общее количество содержащихся в воде восстановителей (органических и неорганических), реагирующих с сильными окислителями. В качестве таких окислителей обычно используют бихромат- и перманганат-анионы, и соответственно называются основные методы определения ХПК – бихроматный и перманганатный. Следует отметить, что результаты определения окисляемости одной и той же воды с помощью разных окислителей обычно неоднозначны из-за неодинаковой степени окисления веществ, присутствующих в воде. Результаты зависят также от свойств окислителя, его концентрации, температуры, рН, продолжительности окисления и др. Получаемые результаты сопоставимы только в том случае, когда точно соблюдены все условия проведения анализа.
Бихроматная окисляемость позволяет получить значение ХПК, наиболее приближенное к ХПКтеор, т.е. наиболее полное окисление достигается бихроматом калия. Поэтому определение бихроматной окисляемости является основным методом определения ХПК. Именно бихроматную окисляемость часто называют «химическим потреблением кислорода». В условиях этого метода большинство органических соединений окисляется на 95% и более, однако окисляются не все соединения (толуол, бензол, пиридин, парафин и др. практически не окисляются). Катализатором окисления является сульфат серебра, который добавляется в аналитическую рецептуру для ускорения реакции и повышения полноты окисления органических веществ. Избыток бихромата оттитровывается раствором соли Мора. Реакцию проводят в жестких условиях – в 50%-ной (18-нормальной, разбавление 1:1) серной кислоте при кипячении. Содержание неорганических восстановителей в пробе определяют отдельно специальными методами и вычитают из ХПК пробы.
Бихромат при этом восстанавливается согласно уравнению:
В таких условиях получаемый результат обычно составляет 95–98% от ХПКтеор.
На примере окисления фталата калия бихроматом реакцию можно записать следующим образом:
Из уравнения реакции следует, что на окисление 2 молекул фталата калия расходуется 16 молекул кислорода, связанного в бихромате. В весовом отношении ХПКтеор для 1 мг фталата калия составляет 1,175 мгО.
Значения ХПКтеор (в мг кислорода на 1 мг вещества) для разных соединений по данным [12] приведены в табл. 14.
Таблица 14
Значения ХПКтеор для разных соединений
| Соединение | ХПКтеор , мгО/л |
| Щавелевая кислота | 0,18 |
| Синильная кислота | 0,59 |
| Гликоколь | 0,64 |
| Глюкоза | 1,07 |
| Уксусная кислота | 1,07 |
| Сахароза | 1,12 |
| Масляная кислота | 1,82 |
| Этанол | 2,09 |
| Додецилбензоат натрия | 2,34 |
| Фенол | 2,38 |
| Бутанол | 2,59 |
Бихроматная окисляемость определяется методом титрования. Соответствующие методики, с незначительными различиями, регламентированы как отечественными руководящими документами, так и международным стандартом ИСО 6060. Согласно методу титрования, избыток бихромата калия после операции окисления (уравнение реакции см. выше) оттитровывают солью Мора в присутствии индикатора, в качестве которого обычно используется ферроин – комплекс 1,10-фенатролина с сульфатом железа (II) (в качестве индикатора может быть также использована N-фенилантраниловая кислота). При этом катион Fe2+ в титранте реагирует с катионом хрома:
Индикатор образует интенсивно окрашенное соединение с Fe2+, и бесцветное – с Fe3+. По этой причине, когда восстановление Cr6+ до Cr3+ завершено, Fe2+ реагирует с индикатором с образованием ферроинового комплекса. При этом окраска раствора отчетливо изменяется от синевато-зеленой до красно-коричневой, что указывает момент окончания титрования. Момент окончания титрования может быть установлен также потенциометрически.
Для определения ХПК, наряду с окислением бихроматом, проводят также окисление перманганатом. Соответствующий показатель называется перманганатной окисляемостью (за рубежом также используют термин «перманганатный индекс»). Перманганатная окисляемость является мерой загрязнения воды окисляемыми органическими и неорганическими веществами, способными к окислению в условиях анализа, и такими условиями являются окисление 0,01 ммоль/л экв. раствором перманганата калия в сернокислой среде или кипячение в течении 10 мин.
Уравнение реакции при окислении пробы перманганатом можно записать следующим образом:
Для определения перманганатной окисляемости используется более простой метод, чем для бихроматной окисляемости, однако он имеет ограниченное применение. Так, определение перманганатной окисляемости может быть рекомендовано (и широко используется) лишь при анализе природных вод для контроля за динамикой содержания легкоокисляющихся веществ природного происхождения (например, гуминовых кислот). И это понятно, т.к. «жестко» окисляющиеся органические загрязнители, часто присутствующие в сточных водах, в природной воде практически не встречаются. Следует отметить также, что именно перманганатная окисляемость является единственным показателем ХПК, регламентирующим качество питьевой воды согласно СанПиН 2.1.4.559-96 (норматив составляет 5,0 мгО/л).
Перманганатная окисляемость может давать некорректные результаты при анализе сточных вод по следующим причинам:
перманганат – недостаточно сильный окислитель, поэтому окисление многих веществ проходит неполно или совсем не проходит;
при кипячении растворов, содержащих перманганат, последний разлагается до диоксида марганца и кислорода (как в кислой, так и в щелочной средах). Выпадающий диоксид марганца каталитически ускоряет процесс, однако в холостой пробе или относительно чистой воде этого не происходит. Процесс осложняется тем, что количество выпадающего диоксида марганца зависит от условий и состава анализируемой пробы.
Как уже отмечалось, в природных водах содержание трудно окисляющихся органических веществ обычно крайне мало, и результаты, получаемые при анализе природных вод бихроматным и перманганатным методами, практически достаточно близки.
Перманганатную окисляемость используют для оценки качества питьевой, водопроводной воды, природной воды источников водоснабжения и др. Ее определение предусмотрено ГОСТом 2761 при обследовании источников хозяйственно-питьевого водоснабжения. Более загрязненные поверхностные и сточные воды** также, с известным приближением, можно анализировать этим методом, однако их необходимо разбавлять. Перманганатную окисляемость нельзя рассматривать как меру теоретического потребления кислорода или общего содержания органических веществ в воде, т.к. ряд органических соединений в условиях этого метода окисляются лишь частично.
Таким образом, для характеристики ХПК как показателя химической активности пробы, традиционно используются методы «мокрой» химии. Тем не менее ХПК определяют также и «сухими» приборными методами. Например, методами сжигания органических веществ пробы в токе кислорода или СО2. Эти методы также позволяют получить результаты, близкие ХПКтеор, однако требуют приборного оснащения, а приборы – соответствующего обслуживания, поверки и т.п.
Мешающее влияние при определении ХПК оказывают, в первую очередь, хлорид-анионы, как правило, содержащиеся в природных и, особенно, в сточных водах. Хлориды окисляются в условиях анализа до элементарного хлора, поэтому при содержании в пробе в концентрации свыше 300 мг/л их влияние устраняется (или минимизируется) путем добавления сульфата ртути (II) в количестве 22,2 мг HgSO4 на 1 мг Cl–. Образующийся малодиссоциированный хлорид ртути (II) устойчив в присутствии большой концентрации серной кислоты и бихромата.
Определению также мешают нитриты, часто присутствующие в водах, прошедших биохимическую очистку. Для их устранения в пробу вводят по 10 мг сульфаминовой кислоты на 3 мг NO2–. При кипячении раствора нитрит-анионы удаляются в виде азота, а избыток сульфаминовой кислоты переходит в сульфат аммония:
Помимо хлоридов и нитритов, определению мешают сульфиды, сероводород и железо (2). Все указанные соединения, при их присутствии в пробе, могут быть определены индивидуально, и результат анализа на окисляемость в таком случае уменьшают на величину потребления кислорода этими соединениями. В частности, 1 мгh3S соответствует 0,47 мгО, 1 мг NO2– – 0,35 мгО, 1 мг Fe2+ – 0,14 мгО.
Нормативы на ХПК в воде водоемов: для питьевой воды – 5,0 мгО/л (для перманганатной окисляемости), ХПН – 15 мгО/л; КБН – 30 мгО/л (для бихроматной окисляемости).
proekt22.ucoz.ru

 , %
, % (в относительных единицах) при коэффициенте охвата
(в относительных единицах) при коэффициенте охвата  2.
2.







