Вода: электропроводность и теплопроводность. Единицы измерения электропроводности воды. Электропроводность воды питьевой
электропроводность и теплопроводность. Единицы измерения электропроводности воды
Кто знает формулу воды еще со времен школьной поры? Конечно же, все. Вероятно, что из всего курса химии у многих, кто потом не изучает ее специализированно, только и остается знание того, что обозначает формула h3O. Но сейчас мы максимально подробно и глубоко постараемся разобраться, что такое вода? Какие ее главные свойства и почему именно без нее жизнь на планете Земля невозможна.

Вода как вещество
Молекула воды, как мы знаем, состоит из одного атома кислорода и двух атомов водорода. Ее формула записывается так: h3O. Данное вещество может иметь три состояния: твердое - в виде льда, газообразное - в виде пара, и жидкое - как субстанция без цвета, вкуса и запаха. Кстати, это единственное вещество на планете, которое может существовать во всех трех состояниях одновременно в естественных условиях. Например: на полюсах Земли - лед, в океанах - вода, а испарения под солнечными лучами - это пар. В этом смысле вода аномальна.
Еще вода - это самое распространенное вещество на нашей планете. Она покрывает поверхность планеты Земля почти на семьдесят процентов - это и океаны, и многочисленные реки с озерами, и ледники. Большая часть воды на планете соленая. Она непригодна для питья и для ведения сельского хозяйства. Пресная вода составляет всего два с половиной процента от всего количества воды на планете.
Вода - это очень сильный и качественный растворитель. Благодаря этому химические реакции в воде проходят с огромной скоростью. Это же ее свойство влияет на обмен веществ в человеческом организме. Общеизвестный факт, что тело взрослого человека на семьдесят процентов состоит из воды. У ребенка этот процент еще выше. К старости этот показатель падает с семидесяти до шестидесяти процентов. Кстати, эта особенность воды наглядно демонстрирует, что основой жизни человека есть именно она. Чем воды в организме больше - тем он здоровее, активнее и моложе. Потому ученые и медики всех стран неустанно твердят, что пить нужно много. Именно воду в чистом виде, а не заменители в виде чая, кофе или других напитков.
Вода формирует климат на планете, и это не преувеличение. Теплые течения в океане обогревают целые континенты. Это происходит за счет того, что вода поглощает очень много солнечного тепла, а потом отдает его, когда начинает остывать. Так она регулирует температуру на планете. Многие ученые говорят, что Земля давно бы остыла и стала камнем, если бы не наличие такого количества воды на зеленой планете.

Свойства воды
У воды есть много очень интересных свойств.
Например, вода - это самое подвижное вещество после воздуха. Из школьного курса многие, наверняка, помнят такое понятие, как круговорот воды в природе. Например: ручеек испаряется под воздействием прямых солнечных лучей, превращается в водяной пар. Далее, этот пар посредством ветра, переносится куда-либо, собирается в облака, а то и в грозовые тучи и выпадает в горах в виде снега, града или дождя. Далее, с гор ручеек вновь сбегает вниз, частично испаряясь. И так - по кругу - цикл повторяется миллионы раз.
Также у воды очень высокая теплоемкость. Именно из-за этого водоемы, тем более океаны, очень медленно остывают при переходе от теплого сезона или времени суток к холодному. И наоборот, при повышении температуры воздуха вода очень медленно нагревается. За счет этого, как и упоминалось выше, вода стабилизирует температуру воздуха на всей нашей планете.
После ртути вода обладает самым высоким значением поверхностного натяжения. Нельзя не заметить, что случайно пролитая на ровной поверхности капля иногда становится внушительным пятнышком. В этом проявляется тягучесть воды. Еще одно свойство проявляется у нее при понижении температуры до четырех градусов. Как только вода остывает до этой отметки, она становится легче. Поэтому лед всегда плавает на поверхности воды и застывает корочкой, покрывая собой реки и озера. Благодаря этому в водоемах, замерзающих зимой, не вымерзает рыба.
Вода, как проводник электроэнергии
Вначале стоит узнать о том, что такое электропроводность (воды в том числе). Электропроводность - это способность какого-либо вещества проводить через себя электрический ток. Соответственно, электропроводность воды - это возможность воды проводить ток. Эта способность непосредственно зависит от количества солей и иных примесей в жидкости. Например, электропроводность дистиллированной воды почти сведена к минимуму из-за того, что такая вода очищена от различных добавок, которые так нужны для хорошей электропроводности. Отличный проводник тока - это вода морская, где концентрация солей очень велика. Еще электропроводность зависит от температуры воды. Чем значение температуры выше - тем большая электропроводность у воды. Эта закономерность выявлена благодаря множественным опытам ученых-физиков.

Измерение электропроводности воды
Есть такой термин - кондуктометрия. Так называют один из методов электрохимического анализа, основанного на электрической проводимости растворов. Применяют этот метод для определения концентрации в растворах солей или кислот, а также для контроля состава некоторых промышленных растворов. Вода обладает амфотерными свойствами. То есть в зависимости от условий она способна проявлять как кислотные, так и основные свойства - выступать и в роли кислоты, и в роли основания.
Прибор, который используют для этого анализа, имеет очень сходное название - кондуктометр. С помощью кондуктометра измеряется электропроводность электролитов, находящихся в растворе, анализ которого ведется. Пожалуй, стоит объяснить еще один термин - электролит. Это вещество, которое при растворении или плавлении распадается на ионы, за счет чего впоследствии проводится электрический ток. Ион - это электрически заряженная частица. Собственно, кондуктометр, взяв за основу определенные единицы электропроводности воды, определяет ее удельную электропроводность. То есть он определяет электропроводность конкретного объема воды, взятого за начальную единицу.
Еще до начала семидесятых годов прошлого столетия для обозначения проводимости электричества использовали единицу измерения "мо", это была производная от другой величины - Ома, являющейся основной единицей сопротивления. Электропроводимость - это величина, обратно пропорциональная сопротивлению. Сейчас же она измеряется в Сименсах. Получила свое название данная величина в честь ученого-физика из Германии - Вернера фон Сименса.
Сименс
Сименс (обозначаться может как См, так и S) - это величина, обратная Ому, являющаяся единицей измерения электрической проводимости. Один См равен электрической проводимости любого проводника, сопротивление которого равно 1 Ом. Выражается Сименс через формулу:
- 1 См = 1 : Ом = А : В = кг−1·м−2·с³А², где А - ампер,В - вольт.

Теплопроводность воды
Теперь поговорим о том, что такое теплопроводность. Теплопроводность - это способность какого-либо вещества переносить тепловую энергию. Суть явления заключается в том, что кинетическая энергия атомов и молекул, что определяют температуру данного тела или вещества, передается другому телу или веществу при их взаимодействии. Иначе говоря, теплопроводность - это теплообмен между телами, веществами, а также между телом и веществом.
Теплопроводность у воды также очень высока. Люди ежедневно используют это свойство воды, сами того не замечая. Например, наливая холодную воду в тару и остужая в ней напитки или продукты. Холодная вода забирает тепло у бутылки, контейнера, взамен отдавая холод, возможна и обратная реакция.
Теперь это же явление легко можно представить в масштабе планеты. Океан нагревается в течение лета, а потом - с наступлением холодов, медленно остывает и отдает свое тепло воздуху, тем самым обогревая материки. Остыв за зиму, океан начинает очень медленно нагреваться по сравнению с землей и отдает свою прохладу изнывающим от летнего солнца материкам.

Плотность воды
Выше рассказывалось о том, что рыба живет зимой в водоеме благодаря тому, что вода застывает корочкой по всей их поверхности. Мы знаем, что в лед вода начинает превращаться при температуре в ноль градусов. Из-за того, что плотность воды больше, чем плотность льда, лед всплывает и застывает по поверхности.
Что такое окислительно-восстановительные свойства воды
Также вода при разных условиях способна быть и окислителем, и восстановителем. То есть вода, отдавая свои электроны, заряжается положительно и окисляется. Или же приобретает электроны и заряжается отрицательно, значит, восстанавливается. В первом случае вода окисляется и называется мертвой. Она обладает очень мощными бактерицидными свойствами, только вот пить ее не надо. Во втором случае вода живая. Она бодрит, стимулирует организм на восстановление, несет энергию клеткам. Разница между этими двумя свойствами воды выражается в термине "окислительно-восстановительный потенциал".

С чем вода способна реагировать
Вода способна реагировать почти со всеми веществами, которые существуют на Земле. Единственное, что для возникновения этих реакций нужно обеспечить подходящую температуру и микроклимат.
Например, при комнатной температуре вода отлично реагирует с такими металлами, как натрий, калий, барий - их называют активными. С галогенами - это фтор, хлор. При нагревании вода отлично реагирует с железом, магнием, углем, метаном.
При помощи различных катализаторов вода вступает в реакцию с амидами, эфирами карбоновых кислот. Катализатор - это вещество, словно бы подталкивающее компоненты к взаимной реакции, ускоряющее ее.
Есть ли вода где-либо еще, кроме Земли?
Пока ни на одной планете Солнечной системы, кроме Земли, воды не обнаружено. Да, предполагают о ее присутствии на спутниках таких планет-гигантов, как Юпитер, Сатурн, Нептун и Уран, но пока точных данных у ученых нет. Существует еще одна гипотеза, пока не проверенная окончательно, о подземных водах на планете Марс и на спутнике Земли - Луне. Касательно Марса вообще выдвинуто ряд теорий о том, что когда-то на этой планете был океан, и его возможная модель даже проектировалась учеными.

Вне Солнечной системы существует множество больших и малых планет, где, по догадкам ученых, может быть вода. Но пока нет ни малейшей возможности убедиться в этом наверняка.
Как используют тепло- и электропроводность воды в практических целях
Ввиду того, что вода обладает высоким значением теплоемкости, ее используют в теплотрассах в качестве теплоносителя. Она обеспечивает передачу тепла от производителя к потребителю. Как отличный теплоноситель воду используют и многие атомные электростанции.
В медицине лед используют для охлаждения, а пар - для дезинфекции. Так же лед используют в системе общественного питания.
Во многих ядерных реакторах воду используют как замедлитель, для успешного протекания цепной ядерной реакции.
Воду под давлением используют для раскалывания, проламывания и даже для резки горных пород. Это активно используется при строительстве туннелей, подземных помещений, складов, метро.
Заключение
Из статьи следует, что вода по своим свойствам и функциям - самое незаменимое и поразительное вещество на Земле. Зависит ли жизнь человека или любого другого живого существа на Земле от воды? Безусловно, да. Способствует ли это вещество ведению научной деятельности человеком? Да. Обладает ли вода электропроводностью, теплопроводностью и иными полезными свойствами? Ответ тоже "да". Иное дело, что воды на Земле, а тем более воды чистой, все меньше и меньше. И наша задача - сохранить и обезопасить ее (а значит, и всех нас) от исчезновения.
fb.ru
Электропроводность воды при приготовлении рабочих растворов пестицидов
Я агроном по защите растений в крупном плодовом хозяйстве "Сад-Гигант", Краснодарский край. Меня интересует вопрос электропроводности воды при приготовлении рабочих растворов пестицидов (влияет ли электропроводность на эффективность пестицидов, какие показатели элктропроводности должны быть, каким методом ее изменять)? Спасибо.
Электропроводность - это способность водного раствора проводить электрический ток. Электрическая проводимость природной воды зависит в основном от степени минерализации (концентрации растворенных минеральных солей) и температуры. Благодаря этой зависимости, по величине электропроводности воды можно с определенной степенью погрешности судить о минерализации воды. Такой принцип измерения используется, в частности, в довольно распространенных приборах оперативного измерения общего солесодержания.
Электропроводность природной воды зависит от степени минерализации (концентрации растворенных минеральных солей) и температуры. Поэтому по величине электрической проводимости воды можно судить о степени минерализации воды. Благодаря этой зависимости, по величине электропроводности воды можно с определенной степенью погрешности судить о минерализации воды. В измерителях общего солесодержания (TDS – метрах) используется именно этот принцип.
Природные воды представляют собой растворы смесей сильных и слабых электролитов. Минеральную часть воды составляют преимущественно ионы натрия (Na+), калия (K+), кальция (Ca2+), хлора (Cl-), сульфата (SO42-), гидрокарбоната (HCO3-). Этими ионами и обуславливается в основном электропроводность природных вод. Присутствие же других ионов, например трехвалентного и двухвалентного железа (Fe3+ и Fe2+), марганца (Mn2+), алюминия (Al3+), нитрата (NO3-), HPO4-, h3PO4- и т.п. не столь сильно влияет на электропроводность (при условии, что эти ионы не содержатся в воде в значительных количествах, как например, это может быть в производственных или хозяйственно-бытовых сточных водах).
"УДЕЛЬНАЯ ЭЛЕКТРОПРОВОДНОСТЬ ВОДЫ – инструментально определяемая косвенная характеристика минерализации пресной воды (солености морской воды) (см. электропроводность воды). У.э.в. измеряется при помощи платиновых или стальных электродов, погружаемых в воду, через которые пропускается переменный ток частотой от 50 Гц (в маломинерализованной воде) до 2000 Гц и более (в соленой воде), путем измерения электрического сопротивления. Для исключения влияния температуры измерения производятся при постоянной температуре 15оС (в океанологии), 18оС (в России, но в некоторых зарубежных странах — при 20о или 25оС), либо приводятся к ней с использованием эмпирических формул. Расчет У.э.в. ведется по формуле k = C{K} T / R, где C — капацитет датчика прибора, зависящий от материала и размеров электродов и имеющий размерность см–1, определяется при тарировке прибора по растворам хлористого калия с известной величиной У.э.в.; K T — температурный коэффициент для приведения измеренной величины при любой температуре к принятому постоянному ее значению; R — измеренное электрическое сопротивление воды прибором, в Омах. У.э.в. соленой воды принято выражать в См/м (См — Сименс, величина, обратная Ому), пресной воды — в микросименсах (мкСм/см). У.э.в. дистиллированной воды равна 2—5 мкСм/см, атмосферных осадков — от 6 до 30 мкСм/см и более, в районах с сильно загрязненной воздушной средой, речных и пресных озерных вод 20—800 мкСм/см."
Нормируемые величины минерализации приблизительно соответствуют удельной электропроводности 2 мСм/см (1000 мг/дм3) и 3 мСм/см (1500 мг/дм3) в случае как хлоридной (в пересчете на NaCl), так и карбонатной (в пересчете на CaCO3) минерализации.
Чистая вода в результате ее собственной диссоциации имеет удельную электрическую проводимость при 25 С равную 5,483 мкСм/м.
Электропроводность зависит от следующих факторов:
- концентрации ионов;
- природы ионов;
- температуры раствора;
- вязкости раствора;
От этих основных факторов и зависит электропроводность растворов. Но больше от концентрации растворенных минеральных солей и ионов Na+, K+, Ca2+, Cl-, SO42-, HCO3-и температуры. Присутствие других ионов, например, Fe3+, Fe2+, Mn2+, Al3+, NO3-, HPO4-, h3PO4не сильно влияет на электропроводность, если эти ионы не содержатся в воде в значительных количествах.
Относительно электропроводности пестицидов, то некоторые из них, например, ДДТ содержат в своём составе хлор и другие галогены, которые при диссоциации в воде , вероятно, смогут влиять на электропроводность раствора, несколько увеличивая показатель удельной электропроводности. Но на достоверность оценки содержания минеральных солей по удельной электропроводности в большой степени влияют температура и неодинаковая электропроводимость различных солей.
На эффективность агрохимикатов электропроводность оказывает большое влияние. Электропроводность воды зависит в большей степени от уровня растворённых солей и ионов Na+, K+, Ca2+, Cl-, SO42-, HCO3-. Очень соленая вода может вызвать затруднения при растворении кристаллических агрохимикатов, а так же является более устойчивой к изменениям рН.
Многие пестициды проходят процесс щелочного гидролиза и восприимчивы к щелочному гидролизу (разрушение в щелочной среде) и солям жесткости. Этот процесс вызывает распад активных ингредиентов, который может снизить их эффективность. Это одна из причин, по которой не следует оставлять рабочие смеси для опрыскивания даже на одну ночь. Высоко-кислотная вода также может повлиять на стабильность и физические свойства некоторых агрохимикатов.
Некоторые гербициды также могут быть зависимы от рН уровня. Низкий уровень pH усиливает активность некоторых ингредиентов гербицидов, делая их более эффективными. Кроме того, сегодня многие хозяйства совмещают обработки средствами защиты растений с листовыми подкормками. Оптимальный уровень рН рабочего раствора обеспечивающий максимальную эффективность листовых подкормок и усвоение элементов минерального питания находится в пределах рН от 5,0 до 6,5.
Поэтому вода для приготовления растворов должна быть чистой, соответствовать всем нормам СанПина и иметь оптимальные для обработки физико-химические характеристики – рН, жёсткость и др. Вода плохого качества может снизить эффективность обработок агрохимикатами и повредить оборудование для внесения. Неудовлетворительные результаты пестицидных обработок и листовых подкормок могут быть напрямую связаны с плохим качеством воды.
Показатель электропроводности воды, используемой для приготовления агрохимикатов должен быть в пределах 0,3 - 0,7 mS/cm.
Электропроводность воды измеряется с помощью специального прибора - кондуктометра. Определять электропроводность следует при 200 С, поскольку значение электропроводности и результат измерений зависят от температуры, как только температура повышается хотя бы на 10 С, измеряемая величина электропроводности тоже увеличивается приблизительно на 2 %. Чаще всего ее пересчитывают по отношению к 200 С.
Если измерение электропроводности надо провести в условиях, где нет возможности довести воду до заданной температуры, то надо задать действительную температуру и пересчитать результат измерения с использованием коэффициента пересчёта.
| Температура воды в 0 С при измерении | Коэффициент температуры по отношению к 20 0 С | Температура воды в 0 С при измерении | Коэффициент температуры по отношению к 20 0 С |
| 15 | 1,132 | 23 | 0,937 |
| 16 | 1,095 | 24 | 0,919 |
| 17 | 1,071 | 25 | 0,901 |
| 18 | 1,046 | 26 | 0,840 |
| 19 | 1,023 | 27 | 0,810 |
| 20 | 1,000 | 28 | 0,790 |
| 21 | 0,979 | 29 | 0,770 |
| 22 | 0,958 | 30 | 0,750 |
Погрешности же измерения возникают из - за неодинаковой удельной электропроводимости растворов различных солей, а также из-за повышения электропроводимости с увеличением температуры.
С уважением,
К.х.н. О.В. Мосин
www.o8ode.ru
| Электропроводность - это численное выражение способности водного раствора проводить электрический ток. Электрическая проводимость природной воды зависит в основном от концентрации растворенных минеральных солей и температуры. Природные воды представляют в основном растворы смесей сильных электролитов. Минеральную часть воды составляют ионы Na+, K+, Ca2+, Cl-, SO42-, HCO3-. Этими ионами и обуславливается электропроводность природных вод. Присутствие других ионов, например, Fe3+, Fe2+, Mn2+, Al3+, NO3-, HPO4-, h3PO4- не сильно влияет на электропроводность, если эти ионы не содержатся в воде в значительных количествах. На достоверность оценки содержания минеральных солей по удельной электропроводности в большой степени влияют температура и неодинаковая электропроводимость различных солей.Нормируемые величины минерализации приблизительно соответствуют удельной электропроводности 2 мСм/см (1000 мг/дм3) и 3 мСм/см (1500 мг/дм3) в случае как хлоридной (в пересчете на NaCl), так и карбонатной (в пересчете на CaCO3) минерализации. "Значение S измеряется в Сименсах (См), миллиСименсах (мСм) или микроСименсах (мкСм), а λ - в мкСм/см (микроСименсы на сантиметр). Для приблизительной оценки минерализации можно придерживаться такого эмпирически найденного соотношения: Содержание солей (мг/л) = 0.65 мкСм/cм То есть, для определения содержания солей измеренную величину проводимости умножают на коэффициент 0,65. Вообще-то величина этого коэффициента колеблется в зависимости от типа вод в диапазоне 0.55-0.75. Растворы хлористого натрия проводят ток лучше: Содержание NaCl (мг/л) = 0.53 мкСм/cм или 1 мг/л NaCl обеспечивает электропроводность в 1.9 мкСм/cм. " УДЕЛЬНАЯ ЭЛЕКТРОПРОВОДНОСТЬ ВОДЫ – инструментально определяемая косвенная характеристика минерализации пресной воды (солености морской воды) (см. электропроводность воды). У.э.в. измеряется при помощи платиновых или стальных электродов, погружаемых в воду, через которые пропускается переменный ток частотой от 50 Гц (в маломинерализованной воде) до 2000 Гц и более (в соленой воде), путем измерения электрического сопротивления. Для исключения влияния температуры измерения производятся при постоянной температуре 15оС (в океанологии), 18оС (в России, но в некоторых зарубежных странах — при 20о или 25оС), либо приводятся к ней с использованием эмпирических формул. Расчет У.э.в. ведется по формуле k = C{K} T / R, где C — капацитет датчика прибора, зависящий от материала и размеров электродов и имеющий размерность см–1, определяется при тарировке прибора по растворам хлористого калия с известной величиной У.э.в.; K T — температурный коэффициент для приведения измеренной величины при любой температуре к принятому постоянному ее значению; R — измеренное электрическое сопротивление воды прибором, в Омах. У.э.в. соленой воды принято выражать в См/м (См — Сименс, величина, обратная Ому), пресной воды — в микросименсах (мкСм/см). У.э.в. дистиллированной воды равна 2—5 мкСм/см, атмосферных осадков — от 6 до 30 мкСм/см и более, в районах с сильно загрязненной воздушной средой, речных и пресных озерных вод 20—800 мкСм/см." Способность одного кубического сантиметра вещества проводить определенный электрический заряд называется удельной электрической проводимостью, или удельной электропроводностью, этого вещества. Электропроводность — явление обратное электрическому сопротивлению и измеряется единицами, называемыми мо. (Это слово представляет собой обратное написание единицы сопротивления ом.) Поскольку мо — слишком большая единица для измерения электропроводности пресной воды и подземных вод, для этой цели используют миллионные доли мо, микромо.
Рис. 3.7. Диаграмма Стиффа для изображения состава воды в продольных координатах. Оконтуренные площади помогают быстро сравнивать результаты анализов. На диаграмме а приведены результаты анализа, показанные на рис. 3.4, а.
Рис. 3.8. График с двумя координатными осями, показывающий общую минерализацию и содержание хлоридов в подземных водах. Представлены результаты 100 анализов, взятых из различных работ. Видно, что по мере увеличения минерализации большинства подземных вод содержание NaCl в них увеличивается.
Рис. 3.9. Трехлинейная диаграмма, предложенная Пайпером. Показана химическая характеристика морской воды (А) и питьевой подземной воды (В) в процент-эквивалентах. Результаты каждого анализа представлены тремя точками: двумя на треугольных полях и одной на суммирующем поле-ромбе.
Удельная электрическая проводимость воды зависит от температуры, характера ионов и их концентрации (рис. 3.10). Обычно удельная электрическая проводимость воды дается для 25° С, так что она зависит только от концентрации и характера растворенных компонентов. Поскольку удельная электрическая проводимость измеряется очень быстро, по ней можно легко определить химический состав воды. Среди распространенных типов природных вод при данной общей минерализации воды, содержащие бикарбонат и сульфат кальция, обычно имеют самую низкую проводимость, а воды, содержащие хлористый натрий, обладают наибольшей проводимостью. Общую минерализацию пресной воды в частях на миллион можно приблизительно определить, если величину ее удельной электрической проводимости в микромо умножить на 0,7. Однако наблюдается более точная зависимость между формой выражения минерализации воды в экв/млн и ее электропроводностью, выраженной в микромо. Для почти чистой воды, если разделить величину удельной электрической проводимости на 100, получим общую минерализацию воды в эквивалентах на 1 млн. с точностью до 5%. Для воды с минерализацией от 1 до 10 экв/млн точность полученной величины составляет около 15%. Логан считает, что обшая минерализация воды В, выраженная в эквивалентах на 1 млн., и ее удельная электрическая проводимость С связаны следующими эмпирическими зависимостями: С = 100 В, (3.2) когда В С= 12,27 + 86,38 В + 0,835 В2, (3.3) когда В = 1 — 3; C = B(95,5-5,54 lg B), (3.4) когда В = 3 — 10; С = 90 В, (3.5) когда В > 10 с преобладанием аниона НСО-3; С = 123 В, 0,939 (3.6) когда В>10 с пресблгданием анисна Сl-; С = 101 В, 0,949 (3.7) когда В > 10 с преобладанием аниона SO2-4
Рис. 3.10. Удельная электрическая проводимость водных растворов различных соединений. Влияние температуры на удельную электрическую проводимость воды особенно видно на примере, содержания NaCl.
Поскольку сумма эквивалентов анионов обычно несколько отличается от суммы эквивалентов катионов, величина В принимается как средняя из этих сумм. Приведенные зависимости верны только для значений В менее 1000 экв/млн. Чистая вода имеет удельную электрическую проводимость 0,055 микромо при 25° G, лабораторная дистиллированная вода — от 0,5 до 5, дождевая обычно — от 5 до 30, подземная вода, годная для питья,— от 30 до 2000, океаническая — от 45 000 до 55 000, рассолы нефтяных месторождений — более 100 000 микромо. Электрические свойства воды.
Вода — самое распространенное на Земле вещество. Почти 3/4 поверхности земного шара покрыты водой, образующей реки и озера, океаны, моря. Много воды находится в газообразном состоянии в виде паров в атмосфере; в виде огромных масс снега и льда лежит она круглый год на вершинах высоких гор и в полярных странах. В недрах земли также находится вода, пропитывающая почву и горные породы. Природная вода не бывает совершенно чистой. Наиболее чистой является дождевая вода, но и она содержит незначительные количества различных примесей, которые захватывает из воздуха. Количество примесей в пресных водах обычно лежит в пределах от 0,01 до 0,1%. Морская вода содержит 3,5% растворенных веществ, главную массу которых составляет хлорид натрия. Вода, содержащая большое количество солей кальция и магния, называется жесткой и в отличие от мягкой воды, к примеру, дождевой, жесткая вода дает мало пены с мылом, а на стенках котлов после кипячения образует накипь. Водная среда включает поверхностные и подземные воды. Поверхностные воды в основном сосредоточены в океане, содержанием 1 млрд. 375 млн. км3 — около 98 % всей воды на Земле. Поверхность океана (акватория) составляет 361 млн. квадратных километров. Она примерно в 2,4 раза больше площади суши территории, занимающей 149 млн. км2. Вода в океане соленая, причем большая ее часть (более 1 млрд. км3) сохраняет постоянную соленость около 3,5 % и температуру, примерно равную 3,7 °С. Заметные различия в солености и температуре наблюдаются почти исключительно в поверхностном слое воды, а также в окраинных и особенно в средиземных морях. Содержание растворенного кислорода в воде существенно уменьшается на глубине 50—60 м. Можно сказать, что все живое состоит из воды и органических веществ. Без воды человек, например, мог бы прожить не более 2—3 дней, без питательных же веществ он может жить несколько недель. Для обеспечения нормального существования человек должен вводить в организм воды примерно в 2 раза больше по весу, чем питательных веществ. Потеря организмом человека более 10 % воды может привести к смерти. В среднем в организме растений и животных содержится более 50 % воды, в теле медузы ее до 96, в водорослях 95...99, в спорах и семенах от 7 до 15 %, В почве находится не менее 20 % воды, в организме же человека вода составляет около 65 % (в теле новорожденного до 75, у взрослого 60 %). Разные части человеческого организма содержат неодинаковое количество воды: стекловидное тело глаза состоит из воды на 99 %, в крови ее содержится 83, в жировой ткани 29, в скелете 22 и даже в зубной эмали 0,2 %. Молекула воды состоит из двух атомов водорода и одного атома кислорода. В составе обычной воды Н2О имеется небольшое количество тяжелой воды D2O и совсем небольшое количество сверхтяжелой воды Т2О. В молекулу тяжелой воды вместо обыкновенного водорода Н — протия – входит его тяжелый изотоп D — дейтерий, в состав молекулы сверхтяжелой воды входит еще более тяжелый изотоп водорода Т — тритий. В природной воде на 1 000 молекул Н2О приходится две молекулы D2O и на одну молекулу Т2О —1019 молекул Н2О. Тяжелая вода D2O бесцветна, не имеет ни запаха, ни вкуса и живыми организмами не усваивается. Температура ее замерзания 3,8 °С, температура кипения 101,42 °С и температура наибольшей плотности 11,6 °С. По гигроскопичности тяжелая вода близка к серной кислоте. Ее плотность на 10 % больше плотности природной воды, а вязкость превышает вязкость природной воды на 20 %. Растворимость солей в тяжелой воде примерно на 10 % меньше, чем в обычной воде. Поскольку D2O испаряется медленнее легкой воды, в тропических морях и озерах ее больше, чем в водоемах полярных широт. В природе существует шесть изотопов кислорода. Три из них радиоактивны. Стабильными изотопами являются О16, О17 и О18. При испарении в водяной пар в основном переходит изотоп О16, неиспарившаяся же вода обогащается изотопами О17 и О18. В водах морей и океанов отношение О18 к О16 больше, чем в водах рек. В раковинах животных тяжелые изотопы кислорода встречаются чаще, чем в воде. Содержание изотопа О18 в атмосферном воздухе зависит от температуры. Чем выше температура воздуха, тем больше воды испаряется и тем большее количество O18 переходит в атмосферу. В период оледенений планеты содержание изотопа О18 в атмосфере было минимальным. Всего можно получить 36 разновидностей воды. В природе чаще встречаются молекулы воды, построенные из наиболее распространенных изотопов. Молекул Н2О16 в природной воде содержится 99,73 %, молекул Н2О18 - 0,2 % и молекул Н2О17 - 0,04 %. При электролизе обычной воды, содержащей наряду с молекулами Н2О также небольшое количество молекул D2O, образованных тяжелым изотопом водорода, разложению подвергаются преимущественно молекулы Н2О. Поэтому при длительном электролизе воды остаток постепенно обогащается молекулами D2O. Из такого остатка после многократного повторения электролиза в 1933 г. впервые удалось выделить небольшое количество воды, состоящей почти на 100 % из молекул D20 и получившей название тяжелой воды. По своим свойствам тяжелая вода заметно отличается от обычной воды. Реакции с тяжелой водой протекают медленнее, чем с обычной. Тяжелую воду применяют в качестве замедлителя нейтронов в ядерных реакторах. Зная физические свойства воды и льда, человек давно использует их в своей практической деятельности. Так, например, иногда применяется прокладка голых электрических проводов прямо по льду, так как электропроводность сухого льда и снега весьма мала. Она во много раз меньше электропроводности воды. Различные примеси оказывают большое влияние на электропроводность воды и почти не изменяют электропроводности льда. Электропроводность химически чистой воды обусловлена частичной диссоциацией молекулы воды на ионы Н+ и ОН–. Основное значение для электропроводности и воды и льда имеют перемещения ионов Н+ («протонные перескоки»). Электропроводность химически чистой воды при 18°С равна 3,8 -10–8 Ом-1см–1 а электропроводность морской воды около 5-10–2 Ом-1см–1. Электропроводность пресной природной воды может быть 1 000 раз меньше, чем морской. Это объясняется тем, что в воде морей и океанов растворено большее количество солей, чем в речной воде. Существенную характеристику электрических свойств вещества дает относительная диэлектрическая проницаемость. У воды она имеет величину в пределах 79. ..81, у льда 3,26, у водяного пара 1,00705.
|
|
Способность одного кубического сантиметра вещества проводить определенный электрический заряд называется удельной электрической проводимостью, или удельной электропроводностью, этого вещества. Электропроводность — явление обратное электрическому сопротивлению и измеряется единицами, называемыми мо. (Это слово представляет собой обратное написание единицы сопротивления ом.) Поскольку мо — слишком большая единица для измерения электропроводности пресной воды и подземных вод, для этой цели используют миллионные доли мо, микромо.  Рис. 3.7. Диаграмма Стиффа для изображения состава воды в продольных координатах. Оконтуренные площади помогают быстро сравнивать результаты анализов. На диаграмме а приведены результаты анализа, показанные на рис. 3.4, а.  Рис. 3.8. График с двумя координатными осями, показывающий общую минерализацию и содержание хлоридов в подземных водах. Представлены результаты 100 анализов, взятых из различных работ. Видно, что по мере увеличения минерализации большинства подземных вод содержание NaCl в них увеличивается.
 Рис. 3.9. Трехлинейная диаграмма, предложенная Пайпером. Показана химическая характеристика морской воды (А) и питьевой подземной воды (В) в процент-эквивалентах. Результаты каждого анализа представлены тремя точками: двумя на треугольных полях и одной на суммирующем поле-ромбе.
Удельная электрическая проводимость воды зависит от температуры, характера ионов и их концентрации (рис. 3.10). Обычно удельная электрическая проводимость воды дается для 25° С, так что она зависит только от концентрации и характера растворенных компонентов. Поскольку удельная электрическая проводимость измеряется очень быстро, по ней можно легко определить химический состав воды. Среди распространенных типов природных вод при данной общей минерализации воды, содержащие бикарбонат и сульфат кальция, обычно имеют самую низкую проводимость, а воды, содержащие хлористый натрий, обладают наибольшей проводимостью. Общую минерализацию пресной воды в частях на миллион можно приблизительно определить, если величину ее удельной электрической проводимости в микромо умножить на 0,7. Однако наблюдается более точная зависимость между формой выражения минерализации воды в экв/млн и ее электропроводностью, выраженной в микромо. Для почти чистой воды, если разделить величину удельной электрической проводимости на 100, получим общую минерализацию воды в эквивалентах на 1 млн. с точностью до 5%. Для воды с минерализацией от 1 до 10 экв/млн точность полученной величины составляет около 15%. Логан считает, что обшая минерализация воды В, выраженная в эквивалентах на 1 млн., и ее удельная электрическая проводимость С связаны следующими эмпирическими зависимостями: С = 100 В, (3.2) когда В < 1; С= 12,27 + 86,38 В + 0,835 В2, (3.3) когда В = 1 — 3; C = B(95,5-5,54 lg B), (3.4) когда В = 3 — 10; С = 90 В, (3.5) когда В > 10 с преобладанием аниона НСО-3; С = 123 В, 0,939 (3.6) когда В>10 с пресблгданием анисна Сl-; С = 101 В, 0,949 (3.7) когда В > 10 с преобладанием аниона SO2-4  Рис. 3.10. Удельная электрическая проводимость водных растворов различных соединений. Влияние температуры на удельную электрическую проводимость воды особенно видно на примере, содержания NaCl.
Поскольку сумма эквивалентов анионов обычно несколько отличается от суммы эквивалентов катионов, величина В принимается как средняя из этих сумм. Приведенные зависимости верны только для значений В менее 1000 экв/млн. Чистая вода имеет удельную электрическую проводимость 0,055 микромо при 25° G, лабораторная дистиллированная вода — от 0,5 до 5, дождевая обычно — от 5 до 30, подземная вода, годная для питья,— от 30 до 2000, океаническая — от 45 000 до 55 000, рассолы нефтяных месторождений — более 100 000 микромо. |
Технология воды: Удельная электропроводность воды
Удельная электрическая проводимость (удельная электропроводность) - количественная характеристика способности воды проводить электрический ток.Эта способность непосредственно связана с концентрацией ионов в воде. Проводящие ионы поступают из растворенных солей и неорганических материалов, таких как щелочи, хлориды, сульфиды и карбонатные соединения и др. Чем больше ионов присутствует, тем выше проводимость воды.
Ионы проводят электричество из-за их положительных и отрицательных зарядов. Когда вещества растворяются в воде, они расщепляются на положительно заряженные (катионные) и отрицательно заряженные (анионные) частицы. Когда растворенные вещества расщепляются в воде, концентрации каждого положительного и отрицательного заряда остаются равными. Это означает, что, хотя проводимость воды увеличивается с добавленными ионами, она остается электрически нейтральной
В большинстве случаев удельная электрическая проводимость поверхностных вод суши является приблизительной характеристикой концентрации в воде неорганических электролитов - катионов Na+, K+, Са2+, Mg2+ и анионов Сlˉ, SO42-, HCO3-. Присутствие других ионов, например Fe(II), Fe(III), Mn(II), NO3-, НРО42- обычно мало сказывается на величине удельной электрической проводимости, так как эти ионы редко встречаются в воде в значительных количествах. Водородные и гидроксильные ионы в диапазоне их обычных концентраций в поверхностных водах суши на удельную электрическую проводимость практически не влияют. Столь же мало и влияние растворенных газов.
Проводимость может быть измерена путем приложения переменного электрического тока (I) к двум электродам, погруженным в раствор, и измерению результирующего напряжения (V). Во время этого процесса катионы мигрируют на отрицательный электрод, анионы на положительный электрод и раствор действуют как электрический проводник. Напряжение используется для измерения сопротивления воды, которое затем преобразуется в проводимость. Проводимость является обратной величине сопротивления и измеряется в количестве проводимости на определенном расстоянии.
Единица удельной электрической проводимости - Сименс на 1 м (См/м). Для воды в качестве единицы измерения используют производные величины - миллиСимменс на 1 м (мСм/м) или микроСименс на 1 см (мкСм/см). Для очень чистой воды величиной проводимости оперировать неудобно, поэтому чаще применяют термин удельное сопротивление, измеряемое в Ом/м (КОм/см или МОм/см). Так, например, проводимость рек может составляет от 50 до 1500 мкСм/см, дистиллированная вода имеет проводимость в диапазоне от 0,5 до 5 мкСм/см, ультрачистая деионизованная вода 10-18 МОм/см.
Проводимость в ручьях и реках в первую очередь зависит от геологии области, через которую течет вода. Потоки, протекающие через районы с гранитной породой, имеют тенденцию к снижению проводимости, поскольку гранит состоит из более инертных материалов, которые не ионизируются (растворяются в ионных компонентах) при промывании в воде. С другой стороны, потоки, протекающие через области с глинистыми почвами, имеют тенденцию к большей проводимости из-за наличия материалов, которые ионизируются при промывке в воде. Притоки грунтовых вод могут оказывать одинаковые эффекты в зависимости от того, через которую они протекают. Сбросы в реки могут изменять проводимость в зависимости от их состава. Неисправная канализационная система повысит проводимость из-за присутствия хлорида, фосфата и нитрата; разлив нефти снизит проводимость.
Проводимость воды должна быть точно измерена с помощью откалиброванного прибора - кондуктометра. На проводимость непосредственно влияют геометрические свойства электродов; то есть проводимость обратно пропорциональна расстоянию между электродами и пропорциональна площади электродов. Это геометрическое соотношение известно как постоянная ячейки. Постоянная ячейка и измерение сопротивления, которое необходимо проверять и при необходимости регулировать.
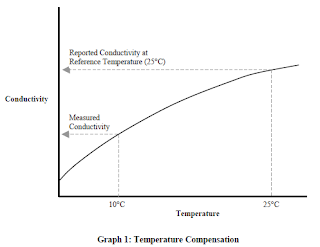 Кроме геометрических свойств электрода в приборе на проводимость также влияет температура: чем теплее вода, тем выше проводимость. По этой причине электропроводность сообщается как проводимость при 25 градусах по Цельсию (25 ° C). Повышение температуры раствора приведет к уменьшению его вязкости и увеличению подвижности ионов в растворе. Повышение температуры также может привести к увеличению числа ионов в растворе из-за диссоциации молекул. Поскольку проводимость раствора зависит от этих факторов, то увеличение температуры раствора приведет к увеличению его проводимости. Зная эту зависимость многие приборы автоматически корректируют фактическое показание, чтобы отобразить значение, которое теоретически будет наблюдаться при номинальной температуре 25 °. Обычно это делается с использованием датчика температуры, встроенного в датчик проводимости, и программного алгоритма, встроенного в кондуктометр. Однако для линейной температурной компенсации предполагается, что температурный коэффициент вариации имеет одинаковое значение для всех температур измерения. Это предположение неверно; но для многих измерений это не приводит к существенному вкладу в суммарную неопределенность измерения сообщенного результата. http://www.iwinst.org/wp-content/uploads/2012/04/Conductivity-what-is-it.pdfhttps://hmc.usp.org/sites/default/files/documents/HMC/GCs-Pdfs/c645.pdfhttps://www.google.ru/urlsa=t&rct=j&q=&esrc=s&source=web&cd=3&ved=0ahUKEwjR9Kautv_WAhVFP5oKHRb4D3MQFgg7MAI&url=http%3A%2F%2Fwww.fondriest.com%2Fenvironmental-measurements%2Fparameters%2Fwater-quality%2Fconductivity-salinity-tds%2F&usg=AOvVaw31-HAReIg1Tn1CDOmaAVimThe Clean Water Team Guidance Compendium for Watershed Monitoring and Assessment State Water Resources Control Board FS-3.1.3.0(EC)V2e 4/27/2004https://www.reagecon.com/pdf/technicalpapers/Effect_of_Temperature_TSP-07_Issue3.pdfРД 52.24.495-2005 Водородный показатель и удельная электрическая проводимость вод. Методика выполнения измерений электрометрическим методом
Кроме геометрических свойств электрода в приборе на проводимость также влияет температура: чем теплее вода, тем выше проводимость. По этой причине электропроводность сообщается как проводимость при 25 градусах по Цельсию (25 ° C). Повышение температуры раствора приведет к уменьшению его вязкости и увеличению подвижности ионов в растворе. Повышение температуры также может привести к увеличению числа ионов в растворе из-за диссоциации молекул. Поскольку проводимость раствора зависит от этих факторов, то увеличение температуры раствора приведет к увеличению его проводимости. Зная эту зависимость многие приборы автоматически корректируют фактическое показание, чтобы отобразить значение, которое теоретически будет наблюдаться при номинальной температуре 25 °. Обычно это делается с использованием датчика температуры, встроенного в датчик проводимости, и программного алгоритма, встроенного в кондуктометр. Однако для линейной температурной компенсации предполагается, что температурный коэффициент вариации имеет одинаковое значение для всех температур измерения. Это предположение неверно; но для многих измерений это не приводит к существенному вкладу в суммарную неопределенность измерения сообщенного результата. http://www.iwinst.org/wp-content/uploads/2012/04/Conductivity-what-is-it.pdfhttps://hmc.usp.org/sites/default/files/documents/HMC/GCs-Pdfs/c645.pdfhttps://www.google.ru/urlsa=t&rct=j&q=&esrc=s&source=web&cd=3&ved=0ahUKEwjR9Kautv_WAhVFP5oKHRb4D3MQFgg7MAI&url=http%3A%2F%2Fwww.fondriest.com%2Fenvironmental-measurements%2Fparameters%2Fwater-quality%2Fconductivity-salinity-tds%2F&usg=AOvVaw31-HAReIg1Tn1CDOmaAVimThe Clean Water Team Guidance Compendium for Watershed Monitoring and Assessment State Water Resources Control Board FS-3.1.3.0(EC)V2e 4/27/2004https://www.reagecon.com/pdf/technicalpapers/Effect_of_Temperature_TSP-07_Issue3.pdfРД 52.24.495-2005 Водородный показатель и удельная электрическая проводимость вод. Методика выполнения измерений электрометрическим методом technologywater.blogspot.ru
Электропроводность воды; отличие ТДС-метра и кондуктометра - Полезная информация - Каталог статей
В предыдущих статьях уже говорилось о том, что определение электропроводности и результат измерений зависят от температуры. Как только температура повышается хотя бы на 1° С, измеряемая величина тоже увеличивается приблизительно на 2 %. Чаще всего ее пересчитывают по отношению к 20° С. Как это делается, вы можете понять из таблицы.
| Температура воды в °С при измерении | Коэффициент температуры по отношению к 20° С |
| 15 | 1,132 |
| 16 | 1,095 |
| 17 | 1,071 |
| 18 | 1,046 |
| 19 | 1,023 |
| 20 | 1,000 |
| 21 | 0,979 |
| 22 | 0,958 |
| 23 | 0,937 |
| 24 | 0,919 |
| 25 | 0,901 |
| 26 | 0,840 |
| 27 | 0,810 |
| 28 | 0,790 |
| 29 | 0,770 |
| 30 | 0,750 |
Для приблизительной оценки солёности воды можно придерживаться такого эмпирически найденного соотношения:
Содержание солей (мг/л) = 0.65 мкСм/cм
То есть, для определения содержания солей измеренную величину проводимости умножают на коэффициент 0,65. При этом величина этого коэффициента колеблется в зависимости от типа вод в диапазоне 0.55-0.75.
Растворы хлористого натрия проводят ток лучше:
Содержание NaCl (мг/л) = 0.53 мкСм/cм
или 1 мг/л NaCl обеспечивает электропроводность в 1.9 мкСм/cм.
Вопросы и ответы
TDS метры и кондуктометры (EC)
Что такое TDS?
Прибор TDS-метр предназначен для измерения уровня общей минерализации (солесодержания) воды.Минерализация представляет собой суммарный количественный показатель содержания растворенных в воде веществ (TDS – total dissolved solids). Этот параметр также называют содержанием растворимых твердых веществ или общим солесодержанием, так как растворенные в воде вещества находятся именно в виде солей. К числу наиболее распространенных относятся неорганические соли (в основном бикарбонаты, хлориды и сульфаты кальция, магния, калия и натрия) и небольшое количество органических веществ, растворимых в воде. Уровень солесодержания в воде обусловлен качеством воды в природных источниках (которые существенно варьируются в разных геологических регионах вследствие различной растворимости минералов). Кроме природных факторов, на общую минерализацию воды большое влияние оказывают промышленные сточные воды, городские ливневые стоки (особенно когда соль используется для борьбы с обледенением дорог) и т.п.Принцип действия TDS метра основан на прямой зависимости электропроводности раствора (силы тока в постоянном электрическом поле, создаваемом электродами прибора) от количества растворенных в воде веществ.
Какой должен быть уровень TDS?
Нет определенного уровня, также, как и нет правильного или неправильного ответа на этот вопрос. Вообще говоря, для питьевой воды, низкий уровень TDS (чистая вода) является предпочтительным. US EPA, все штаты США, Всемирная организация здравоохранения (ВОЗ) и большинство стран предлагают максимально ограничить уровень TDS в питьевой воде. Максимальное ограничение, как правило, 500 или 1000 ppm (мг/л).Кроме того, уровень TDS является специфическим для каждого применения и особенности использования питьевой воды. Хотя люди предпочитают более чистую воду, для рыб и растений, например, требуется вода с самыми разными уровнями TDS, большинство из которых выше, чем требуется для человека.
Как ухаживать за TDS метром?
Все приборы откалиброваны на заводе (на 342 ppm или 1413 мкСм в зависимости от прибора) и готовы к использованию "из коробки". Однако, после длительного использования требуется повторная калибровка с использованием стандартных коммерческих NaCl-растворов.Примечание: TDS метры и кондуктометры калибруются в заводских условиях на значения 342 PPM NaCl или 1413 мкСм соответственно.
Почему различные показания TDS в той же воде с тем же прибором?
Причины разнообразны и включают в себя:
Ионы:
Природа заряженных положительных ионов (при измерении TDS метром) такова, что они всегда находятся в движении. Таким образом, всегда есть разница в электропроводности воды в разные моменты времени и различные показания.
Температура:
Даже при работе АТС (автоматической температурной компенсации) изменения температуры могут увеличивать или уменьшать электропроводность. Кроме того, температурный коэффициент (при работе АТС) меняется незначительно в зависимости от диапазона измерения ppm.
Пузырьки воздуха:
Даже небольшой пузырек воздуха на электроде может потенциально повлиять на электропроводность и показания прибора.
Статическое электричество:
Статический заряд от пальцев рук, одежды и т.д. также влияют на показания прибора.
Свойства материала:
Пластиковая посуда хранит электрический заряд дольше, чем стекло. Если коснуться стенки сосуда из стекла или пластика, он может забрать небольшой заряд из воды.
Изменение объема:
Количество воды в измеряемом сосуде могут повлиять на электропроводность. При различных объемах вода может иметь различные уровни электропроводности.
Позиция электрода:
Глубина и положение электрода в сосуде с раствором также может повлиять на электропроводность. Например, если TDS метр погрузить в воду, удалить, а затем погрузить в воду снова, но в другом месте, показания прибора можут измениться.
Как улучшить показания TDS метра?
Размешивание:
Всегда размешивайте воду перед погружением в нее прибора.После погружения прибора в воду слегка коснитесь им стенки сосуда для снятия статического электричества и помешайте прибором воду для удаления пузырьков воздуха на электроде.
Позиция:
При проведении измерний всегда держите прибор вертикально. Электрод должен быть размещен как можно ближе к центру сосуда с измеряемым раствором или водой.
Время:
Чем дольше прибор находится в воде, тем более точные показания будут отображены на дисплее.
Температура:
25 градусов Цельсия - идеальная температура для проведения измерений, даже если прибор оборудован ATC.
Промывка:
При измерении различных жидкостей с большим и маленьким значениями ppm всегда промывайте электрод дистиллированной водой.
TDS метры и кондуктометры - одно и то же?
Да. Хотя ЕС и TDS часто используются как синонимы, есть некоторые важные различия. ЕС, в применении к воде, относится к измерениям электрических зарядов воды. TDS ссылается на общую сумму растворенных солей в воде. Единственно верный метод измерения TDS является метод испарения воды и взвешивания сухого остатка. Так как это практически невозможно сделать для обычного пользователя, можно оценить уровень TDS путем измерения ЕС воды. Каждый прибор для измерения TDS является по сути кондуктометром (ЕС).
Все растворы имеют электрический заряд. Таким образом, можно оценить количество TDS путем определения ЕС воды. Однако, различные растворы имеют различные заряды, поэтому необходимо преобразовать ЕС в TDS с использованием пересчета, который имитирует заряд. Ниже приведены наиболее распространенные образцы воды, каждый имеет свой собственный коэффициент преобразования:
KCl:
Хлорид калия является международным стандартом для калибровки приборов, которые измеряют электропроводность. В заводских условиях приборы калибруются на значение 1413 мкСМ. Коэффициент пересчета по KCl равен 0.5 - 0.57.
442TM:
Разработано Myron L Company, 442TM имитирует свойства природной воды (реки, озера, колодцы, питьевая вода и т. д.) с сочетанием 40% бикарбонат натрия, 40% сульфата натрия и 20% хлорида. Коэффициент пересчета 442 равен 0,65 - 0,85.
NaCl:
Хлорид натрия применяется для воды, в которой преобладают ионы NaCl или свойства которой похожи на NaCl, таких как: морская и соленая воды. Коэффициент пересчета по NaCl равен 0,47 - 0,5.
Измерения в ЕС (мкСм) не имеют коэффициента пересчета, но требует правильной настройки температурного коэффициента.
Большинство TDS метров используют коэффициент пересчета NaCl (в среднем 0,5).
Всегда ли нужна высокая точность при измерении TDS метром или кондуктометром?
Обычно нет. Для большинства отраслей промышленности, которые требуют измерения параметров TDS, таких как питьевая вода, аквакультура, гидропоника и т.д. Более важно для уровня TDS, чтобы он находился в пределах определенного диапазона. Есть несколько отраслей, которые требуют точного уровня ppm, но этот уровень почти всегда равен нулю.
Как перевести единицы измерения EC (µS) в TDS (ppm)?
Лучшее, что можно сделать, это использовать TDS метр, который будет автоматически делать преобразования. Для перевода единиц измерения мкСм в TDS необходимо определить, какой коэффициент пересчета вы хотите использовать (NaCl, 442 или KCl) и сделать пересчет. Большинство измерительных приборов используют фактор пересчета по NaCl, который составляет в среднем 0,5. Поэтому, если вы используете кондуктометр с фактором преобразования NaCl, умножьте измеренное значение на коэффициент 0.5, вы получите значение уровня TDS.
Как перевести единицы измерения TDS (ppm) в EC (µS)?
Если вы знаете, какой коэффициент пересчета используется, вы самостоятельно можете сделать пересчет единиц измерения. Большинство измерительных приборов используют фактор пересчета по NaCl, который составляет в среднем 0,5. Поэтому, если вы используете TDS метр с фактором преобразования NaCl, умножьте измеренное значение на коэффициент 2, вы получите значение уровня ЕС.
moemfasad.at.ua













