Биотестирование как интегральный метод оценки качества воды. Биотестирование питьевой воды
Биотестирование как интегральный метод оценки качества воды
Значительное время контроль за загрязнением окружающей среды осуществлялся только физико-химическими методами, путем определения концентраций загрязнителей и соблюдением соответствия величин измеренных концентраций нормированных показателей предельно-допустимым концентрациям (ПДК). С развитием химической промышленности, синтезом новых соединений и их использованием в производстве перечень контролируемых загрязнителей в составе сточных вод увеличивается с каждым днем. Сегодня много загрязняющих веществ по разным причинам не контролируется: для одних не разработаны ПДК, для других отсутствуют утвержденные методики определения, а их воздействие испытывает окружающая среда. В результате поучается так, что широкий спектр соединений, токсичных веществ в водной, воздушной и почвенной средах не контролируется. Но и в случае контроля полного спектра соединений в среде на уровне ПДК нельзя утверждать об отсутствии вредного воздействия на окружающую среду. Так как информация физико-химических показателей не позволяет в принципе сделать вывод о совокупном воздействии загрязняющих веществ различной природы на живые организмы и степени их опасности.
Заполнить информационный аналитический вакуум о комбинационном воздействии загрязнителей признаны методы биотестирования. Особенность информации, получаемой с помощью методов биотестирования состоит в интегральном характере отражения всей совокупности свойств испытуемой среды с позиции восприятия ее живых объектом. И в отличии от физико-химических методов, посредством которых определяется валовое содержание того или иного загрязнителя, биотестовые методы анализа качества воды позволяют обнаружить физиологически активные формы соединений, влияющие на организм. Так, например, нет возможности разрабатывать ПДК веществ под различные значения рН среды, а именно изменение рН среды влечет за собой образование иных форм соединений, возможно более токсичных. Или же токсическое действие токсикантов усиливается в мягкой воде нежели чем в жесткой. А комплексное воздействие загрязнителей совсем непредсказуемо.
Изучено и выделены несколько вариантов воздействия токсикантов.
1. Антагонистическое воздействие токсикантов - возможно такое сочетание ионов в комбинации которых эффект токсичности будет меньше.
2. Аддитивный эффект - эффект токсичности суммы токискантов равен сумме эффектов токсичности.
3. Синергический эффект - неполное суммирование эффектов токсичности.
4. Сеисибилизационный эффект - комбинация токсикантов усиливает эффект токсичности.
Сегодня биотестовые методы, как необходимое дополнение к химическому анализу включены в стандарт по контролю качества вод различного назначения.
Принцип биотестирования сводится к регистрации изменения биомассы, выживаемости, плодовитости, а также физиологических или биохимических показателей тест-объекта в испытуемой среде.
В настоящее время в мире используется большое разнообразие тест-объектов: от одноклеточных водорослей, мхов и лишайников, бактерий и простейших микроорганизмов до высших растений, рыб и теплокровных животных.
В России в органах государственного аналитического контроля за качеством воды дафниевый тест рекомендован в качестве основного для контроля токсичности сточных вод и перспективного для оценки уровня токсического загрязнения природных вод. Дафниевый тест обязателен при установлении ПДК отдельных веществ в воде рыбохозяйственных водоемов.
Выбор тест-объекта определен следующим: 1) этот род ветвистоусых рачков распространен повсеместно в пресных водоемах, является важной составной частью зоопланктона, служит источником пищи молоди рыб; 2) легко культивируется в лабораторных условиях - испытания загрязняющих веществ можно проводить в течении года; 3) определяющая особенность -это то, что по характеру питания они являются фильтраторами и прокачивают большие объемы воды, отфильтровывая в качестве пищи бактерий и микроводоросли, поэтому, если в воде присутствует токсикант даже маленькой концентрации из-за объема отфильтрованной воды чувствительность тест-объекта высокая.
Дафниевый метод биотестирования основан на определении изменений выживаемости и плодовитости дафний при воздействии токсических веществ, содержащихся в тестируемой воде по сравнению с контролем.
Выделяют кратковременное биотестирование - до 96 час. Позволяет определить острое токсическое действие испытуемой воды на дафний по их выживаемости. Показателем выживаемости служит среднее количество особей, выживших в тестируемой воде или в контрольной за определенное время. Критерием токсичности является гибель 50% и более дафний за период времени до 96 час. в тестируемой воде по сравнению с контролем.
Длительное биотестирование - 20 и более суток - позволяет определить хроническое токсическое действие испытуемой воды на дафний по снижению их выживаемости и плодовитости. Показателем выживаемости служит среднее количество исходных самок-дафний, выживших в течение биотестирования, показателем плодовитости - среднее количество молоди, выметанной в течение биотестирования, в пересчете на одну выжившую исходную самку. Критерием токсичности является достоверное отличие от контроля показателя выживаемости или плодовитости дафний.
Выше было упомянуто о большом количестве тест-объектов, использующих в биотестировании и это неслучайно. Дело в том, что различные организмы по разному реагируют на загрязнители. И задача природоохранных органов правильно оценить ситуацию и выбрать более чувствительный тест-объект.
Пример. Результаты биотеетироваиия сточных вод завода,синтезирущего биологические активные соединения гербицидногонаправления, могут быть различными в зависимости от выбранного тест-обьекта. Дафниевый тест может показать отсутствие токсическоговоздействия, а культура водорослей может почувствовать токсикант.Почему? Дело в том, что предполагаемый токсикант, синтезируемыегербициды являются ингибиторами процессов фотосинтеза у растений иводорослей. Поэтому дафнии могут в кратковременном опыте зафиксироватьотсутствие острого токсического воздействия, а водоросли в случаенарушения работы фотосинтетической цепи оперативно отреагируют назагрязненность.
Поэтому в системе контроля за качеством сточных вод также рекомендованы водоросли: хлорелла и сцепедесмус. Критерием токсичности при биотестирозании с использованием водорослей служит достоверное снижение количества клеток в испытуемой воде по сравнению с контролем.
С целью быстрого получения информации о качестве воды используются экспресс методы биотестирования.
В Москве разработан и выпускается мелкими .партиями прибор "Биотоке". Устройство Биотоке - это портативный биолюминометр,
позволяет с помощью биосенсора "Эколюм", светящиеся бактерии, производить быстрое и объективное определение индекса обшей токсичности водных образцов, включая металлы, препараты бытовой химии и т.д. Результаты токсичности пробы воды получают через 10 мин.
В Санкт-Петербурге выпускается прибор Биотестер. В качестве тест-объекта используют одноклеточные микроорганизмы - инфузории туфелька. Этот метод основан на хемотаксической реакции организмов в ответ на загрязнитель, т.е. движение культуры в благоприятную зону. Данная тест-реакция - хемотаксис, является очень чувствительной к токсикантам определенной группы.
В России биотестирование проводят аналитические лаборатории органов природоохраны для определения токсичности сточной воды (происходят ли патологические изменения или гибель организмов, обусловленные присутствием в ней токсических веществ) на сбросе в водный объект, воды в контрольном и других створах водопользования с целью проверки соответствия качества воды нормативным требованиям:
- сточная вода на сбросе в водный объект не должна оказывать острого токсического действия, а вода в контрольном и других створах водопользования - хронического токсического действия на тест-объекты.
В соответствии с "Методическим руководством по биотестированию воды РД 118-02-90", биотестирование является дополнительным экспериментальным приемом для проверки необходимости корректировки величин ПДС по интегральному показателю "токсичность воды", который позволяет учесть ряд существенных факторов: наличие в сточной воде токсических веществ, неучтенных при установлении ПДС, вновь образованных соединений, метаболитов, различные виды взаимодействия химических веществ. Необходимость корректировки величин ПДС возникает в том случае, если при биотестировании воды из контрольного створа водного объекта установлено несоответствие ее качества требуемому нормативу: вода в контрольном створе водного объекта не должна оказывать хронического токсического действия на тест-объекты (дафний и цероидафний).
Для оценки бактериального загрязнения используются санитарно-бактериологические и гидробиологические показатели.
Микронаселение природных вод чрезвычайно разнообразно. Его качественный и количественный состав определяется в первую очередь составом воды. Для глубоко залегающих, очень чистых артезианских вод характерно почти полное отсутствие бактерий вследствие защищенности водоносного слоя от контакта с лежащими выше горизонтами.
Особенностью состава воды открытых водоемов является изменение его по сезонам года: сопровождающееся изменениями в количестве и видовом разнообразии микронаселения. Бактериальная загрязненность поверхностных источников обусловлена, главным образом, поступлением в водоемы поверхностного стока, содержащего органические, минеральные вещества и микроорганизмы, смываемые с площади водосбора, и сточных вод.
С позиций санитарной микробиологии оценка качества воды проводитсяс целью определения ее санитарно-эпидемиологической опасности илибезопасности для здоровья-человека. Вода играет важную роль в передачевозбудителей многих инфекций; главным образом кишечных. Т.к. через водуполучают распространение брюшной тиф, дизентерия, холера,инфекционный гепатит и т.д.
Прямое количественное определение возбудителей всех инфекций для контроля за качеством воды неосуществимо в связи с многообразием их видов и трудоемкостью анализа. В практической санитарной микробиологии поэтому прибегают к косвенным методам, позволяющим определить потенциальную возможность заражения воды патогенными микроорганизмами.
Санитарно-бактериологическая оценка качества воды основана на определении двух основных показателей; микробного числа и числа бактерий группы СоН.
Первый показатель даст представление об общей обсемененности воды аэробными сапрофитами, поэтому часто называется общим счетом аэробных сапрофитов или (кратко) общим счетом. Микробное число определяют методом посева на стандартную среду - мясопептонный агар (МПЛ).
Аэробные сапрофиты составляют только часть общего числа микробов в воде, но являются важным санитарным показателем качества воды, так как между степенью загрязнения ее органическими веществами и микробным числом существует прямая зависимость. Кроме того, полагают, что чем выше микробное число, тем больше вероятность присутствия в воде патогенных микроорганизмов. Микробное число водопроводной воды не должно превышать 100. В природных водах этот показатель изменяется в очень широких пределах для разных водоемов и по сезонам года для одного и того же водоема. В чистых водоемах число аэробных сапрофитов может исчисляться десятками или сотнями, а в загрязненных и грязных водоемах составлять десятки тысяч и миллионы.
По второму показателю - числу бактерий группы СоН (кишечная палочка) оценивают возможное присутствие в воде патогенных микроорганизмов.
Бактерии группы СоН относятся к семейству энтеробактерий. Это неспороносные палочки, факультативные анаэробы, сбраживающие лактозу и глюкозу при температуре 37°С с образованием кислоты и газа и не обладающие оксидазной активностью. Они являются постоянными сожителями кишечника человека и животных: постоянно и в большом числе выделяются во внешнюю среду; дольше, чем патогенные микроорганизмы, сохраняют жизнеспособность в этой среде; более устойчивы к хлору, чем возбудители большинства инфекций. Именно эти свойства бактерий группы СоИ обусловили возможность их использования в качестве санитарно-показательных микроорганизмов. Наличие коли-форм в воде говорит о ее фекальном загрязнении, а их число позволяет судить о степени этого загрязнения. Для количественного определения коли-форм применяют фуксин-сульфитный агар (среда Эндо).
Анализ водопроводной и чистой природной воды проводят после предварительного концентрирования воды на мембранных фильтрах.
Результаты выражают в виде коли-индекса - числа бактерий в 1 л воды.
Иногда делают пересчет, определяя коли-титр - наименьший объем воды (в мл), содержащий одну кишечную палочку. Коли-титр = 1000/коли-индекс.
Коли-индекс водопроводной воды должен быть не более 3. Допустимый коли-индекс воды источников водоснабжения зависит от предполагаемого способа очистки. Если намечается только хлорирование воды, то коли-индекс воды в источнике не должен превышать 1000 при полной очистке воды - 10000.
В особых условиях по санитарно-эпидемиологическим показателям прибегают к определению в воде - энтерококков, энтеровирусов сальмонелл и проводят исследования воды на патогенную микрофлору.
Поверхностные источники водоснабжения помимо санитарно-бактериологических тестов характеризуются также данными гидробиологических наблюдений. Микроскопированием пробы воды определяется число клеток фито- и зоопланктона. Эти показатели существенно изменяются по сезонам - как по количеству организмов, так и по их видовому разнообразию.
В весенне-летний период интенсивного развития водорослей (цветения водоема) содержание фитопланктона в поверхностных водах может достичь 50 тыс. клеток в 1 мл. Летом зоопланктон отличается большим разнообразием и представлен низшими ракообразными, коловратками, личинками моллюсков. В воде могут оказаться и бентосные организмы: черви, личинки насекомых. В зимний период в воде встречаются, в основном, низшие ракообразные. Число организмов зоопланктона обычно выражают числом экземпляров в 1 м3 воды. В воде источников встречаются также организмы, видимые невооруженным глазом. Их число оценивают числом экземпляров в 1 м3. Для рек средней полосы европейской части нашей страны концентрация зоопланктона составляет 100- 10000 экз. в 1 м воды. Обычно их в несколько раз меньше, чем организмов зоопланктона.
В питьевой воде планктонные организмы, так же как организмы видимые невооруженным глазом, должны отсутствовать.
ekologyprom.ru
Биотестирование воды в домашних условиях, часть I
О том, почему биотестирование в принципе небесполезно уже написано. Теперь перейдем к решению проблемы выбора подходящего тест-организма. А заодно и составим представление об общей токсичности воды в аквариуме.
 | Что можно узнать просто понаблюдав за улитками, без постановки специальных опытов? |
Оказывается можно оценить общую токсичность воды в аквариуме просто понаблюдав за улитками.
Сама по себе это очень простая и не плохая идея – посадить какой-нибудь живущий в воде организм в испытуемую пробу и посмотреть, что с ним будет. А затем решить хороша ли эта вода или плоха? Реализовать такую идею - значит провести биотест. Осталось только ответить на 2 вопроса:1. Какой организм (он будет называться тест-организмом) выбрать?
2. Что собственно с ним должно произойти, или на основании каких явлений можно судить о токсичности?
Однако, если теоретические основы биотестирования вас не волнуют, и вы просто хотите узнать, как с помощью улиток ампулярий можно определить токсичность воды, то можно пропустить часть изложенного ниже материала и сразу перейти к практическим рекомендациям.
Какой тест организм выбрать?
К настоящему времени предложено некоторое количество тест-организмов. (Тест-организм – это и есть то несчастное существо, по реакциям которого мы будем судить о токсичности воды). Разработаны строгие, официально принятые министерством Природных Ресурсов Российской Федерации биотесты. Наиболее популярными тест-организмами оказались дафнии и инфузории. Тесты построены на количественной оценке их смерности. По количеству умерших делается вывод о токсичности. Казалось бы, все это понятно, легко и просто, но на практике оказалось не очень-то информативно. Если подопытные мрут, то понятно, что вода оказывает токсическое действие, но есть ли разница в степени токсичности, когда в одном случае, к примеру, умерло 40% дафний, а в другом 60%? Ну, вроде бы там где 60% - вода токсичнее, но ведь и 40% цифра немалая. Может просто группы тест-организмов были не слишком однородны в плане устойчивости отдельных особей к вредным воздействиям, отсюда и разница в проценте смертности, а токсичность проб одинакова? В общем вопрос статистической достоверности результатов биотестирования сразу же выходит на первый план. Верить или не верить результатам биотестирования во многом зависит именно от статистической корректности постановки эксперимента. Но не только. В не меньшей степени многое зависит и от выбора самого тест-организма, как биологического вида. Тут нельзя не учитывать особенности его биологии и физиологии. Возьмем опять ту же дафнию. Где она живет в природе? Ну, прямо скажем, не в очень-то чистых водоёмах. Аквариумисты-рыбоводы ездят ее ловить на отстойники водоочистных сооружений. Дискусы (да и не только они) жить в такой воде не станут, а мы не будем пить такую воду – запах и вкус не понравятся. Но дафнии там живут и бурно размножаются, инфузории тоже. Так можно ли на основании их реакций судить о токсичности воды применительно к нам с вами (людям то есть) и аквариумным рыбкам? Сильно подозреваю, что все же нельзя, как бы многие авторы ни пытались доказать обратное. Я не буду далее углубляться в научные и наукообразные дебри споров вокруг биотестирования, а приступлю к описанию того тест-организма, который мы с вами будем использовать в биотесте. Итак, мы будем оценивать токсичность воды по поведению (именно в первую очередь по поведению, не по смертности) улиток ампулярий. О самих этих улитках можно прочитать вот тут. Чем замечательны ампулярии? Да целым рядом важных особенностей!
1. Улитки ампулярии теплолюбивы и обладают высоким уровнем обмена веществ.
При температуре воды 25-30°С, биохимические реакции в организме ампулярий идут замечательно быстро. Они много едят, много гадят и энергично растут. А это означает, что наличие токсических веществ в воде быстро окажет влияние на обменные процессы в их организме и это будет видно. Ведь суть действия токсических веществ в том и состоит, что они нарушают нормальный ход биохимических реакций. Токсическое воздействие можно будет обнаружить быстро. Под словом "быстро" подразумевается срок от нескольких часов до двух суток.
 | Фото 1. Перед вами молодые улитки ампулярии. В качестве тест-организмов они хороши благодаря интенсивному обмену веществ. Фотография наглядно демонстрирует этот тезис. Стрелочкой показаны выросты мантии, выходящие за края раковины. Возможно они увеличивают площадь контакта мантии с водой и облегчают кожное дыхание. А возможно они как-то связаны с быстрым ростом края раковины. Во всяком случае, когда эти выступы хорошо заметны у молодых улиток, последние увеличиваются в размерах чрезвычайно быстро. |
2. Высокая чувствительность и одновременно резистентность ампулярий к токсическим воздействиям.
Ампулярии обладают двумя важными для тест-организма качествами. Они чувствительны к действию токсических веществ (почему, я объяснил пунктом выше), и одновременно резистентны (устойчивы) к ним (только соли меди убивают их уже в невысоких концентрациях). Резистентны – это значит, что не мрут сразу. Кстати именно поэтому они очень хороши при запуске аквариума в качестве "животных-первопроходцев". При токсическом воздействии на организм они начинают меньше есть, медленнее ползать, нуждаться в большем или, наоборот, меньшем количестве кислорода, запираться в своей раковине крышечкой, отгораживаясь от вредного действия грязной воды. То есть поведение отравленных улиток отличается от поведения нормальных. Улитки включают все свои защитные механизмы, отвечая стрессовой реакцией на наличие токсического вещества в воде и долго остаются живыми, либо даже приспосабливаются к постоянному присутствию яда в воде (см. также токсичность). Все это можно зарегистрировать и на основании этих поведенческих реакций судить о токсичности. Ну, а когда улиткам станет совсем плохо (это случается при превышении предельно допустимых концентраций в воде в 20-100 раз или даже более) – они умирают. Таким образом нарушения в поведении ампулярий можно обнаружить уже при очень низких содержаниях токсических веществ в воде (примерно 0.01-0.1 от предельно допустимой концентрации), а умирают эти улитки только при многократных передозировках. Это означает, что биотест с их использованием будет работать в очень широком диапазоне токсичности. Важность этого обстоятельства можно пояснить на следующем примере. Главный недостаток теста на дафниях – это очень узкий диапазон. Они живут без заметных отклонений от нормы даже при значительных концентрациях токсического вещества (несколько ПДК, о том, что это такое написано в первой статье про биотестирование), не выявляя его, но сразу умирают при совсем незначительном дальнейшем повышении его концентрации.
3. Высокий уровень организации ампулярий.
Ампулярии довольно сложноорганизованные существа (в отличие от, например, инфузорий). Они обладают практически теми же анатомо-физиологическими системами, что и мы с вами: нервной, двигательной, пищеварительной, выделительной, дыхательной, половой, гуморальной (системой гормональной регуляции функций организма). Их организм в ответ на различные вредоносные внешнее воздействия отвечает неспецифической стрессовой реакцией с участием всех систем. На основании этой реакции можно судить об общей токсичности воды, которая может определяться не каким-то одним токсическим веществом, а суммарным действием многих имеющихся в воде загрязнителей.
4. Поведение ампулярий включает в себя разнообразные поведенческие реакции.
Как я уже писал, поведение ампулярий достаточно разнообразно. Это позволяет судить о токсичности среды их обитания по отклонению этих поведенческих реакций от нормы.
| Видео 1. Это одна из поведенческих реакций улиток - вентиляция легких, которая осуществляется ритмичными прокачивающими движениями.
|
У ампулярий есть и легкие, и жабры. В воде, окисляемость которой невелика, кислорода много и улитки дышат в основном при помощи жабры. На поверхность для вентиляции легких поднимаются редко - не чаще чем один раз в 5-10 минут, а то и реже, сохраняя при этом высокую двигательную активность. В хороших условиях ампулярии довольно подвижны и могут буквально "летать" по аквариуму, особенно если они голодны. Если моллюск попадает в токсичную среду, то его организм отвечает на это генерализованной стрессовой реакцией. В первые часы потребность улитки в кислороде резко возрастает. Она все чаще начинает подниматься к поверхности за свежим воздухом. Иной раз интервалы между отдельными "проветриваниями" легких начинают составлять лишь несколько десятков секунд. В отдельных случаях моллюск так и остается у поверхности выставив сифон наружу. А двигательная активность улитки заметно падает: она меньше ползает и ползает медленнее обычного. Такие симптомы наблюдаются, например, при попадании в воду поверхностно активных веществ (моющие средства). Аквариумисту бывает не вредно периодически присматриваться, как там дела с дыхательной и двигательной активностью его ампулярий? Если после подмены воды в аквариуме дыхательная активность вдруг резко возросла, то есть повод встревожиться и измерить содержание в воде аммиака и нитритов. Эти вещества тоже могут вызывать повышение дыхательной активности. А может быть вы вспомните, что мыли с мылом грот, а потом не очень тщательно его прополоскали под сильной струей воды? При все продолжающемся токсическом воздействии обмен веществ улитки начинает замедляться. Она очень мало или очень медленно ползает, ее тело почти полностью втянуто в раковину и она не вентилирует лёгкие часами - такие наблюдения должны вызвать у аквариумиста особую тревогу. В наиболее тяжелых случаях улитки лежат на дне или плавают у поверхности с закрытой крышечкой раковиной. Для лучшей изоляции от токсического воздействия внешней среды улитка может выделить изрядное количество слизи, изолирующей щель между раковиной и крышечкой. Когда моллюск умирает, крышечка приоткрывается и тело моллюска вываливается наружу. Это вводит в заблуждение неопытных аквариумистов. Они думают,что улитки живые. На самом деле уж скорее еще жива улитка с плотно закрытой раковиной, чем с сильно приоткрытой.
| Видео 2. Улитки могут подниматься к поверхности воды и даже ползать по ней. Прудовики вообще обожают это делать без какого-либо разумного повода - они так путешествуют по водоему. Ампулярии с помощью воронок собирают разбросанную по поверхности воды еду.
|
Если вы кормите рыбок плавающим кормом, то и улитки, если, конечно, они хорошо себя чувствуют, стремятся поучаствовать в общем пиршестве. Плавающий корм они собирают с помощью показанных выше воронок. Но вот если ампулярии упорно поднимаются к поверхности и образуют воронки, хотя кормления не было, то это должно насторожить. Как правило, это говорит о слишком высоком содержании в воде растворенных органических веществ, которые улитки чувствуют по запаху и вкусу (соответствующие рецепторы расположены на усах и губных щупальцах). Учуяв запах яств, положение которых локализовать невозможно (запах повсюду), ампулярии справедливо полагают, что они рассеяны по поверхности воды и ползут делать воронки дабы их собрать. На эту особенность улиточного поведения надо обращать внимание при тестировании воды из дачных колодцев. Высокое содержание органики в них не редкость. Оказавшись в такой воде улитки собираются у поверхности и складывают ногу в воронку. Тут сразу понятно, что тестируемая вода не слишком хороша. В аквариуме с помощью этой поведенческой реакции улитки собирают с поверхности воды бактериальную пленку и остатки корма. Это очень полезная деятельность. Но задайтесь вопросом, почему эта пленка упорно появляются вновь? Быть может вы слишком много кормите рыб, или недостаточна фильтрация с аэрацией?
 |
| Фото 2. Ампулярия с помощью "воронки" собирает корм с поверхности воды. |
Я рассказал о двух поведенческих реакциях ампулярий, позволяющих сделать некоторые выводы относительно качества воды. Но это еще не биотестирование как таковое. Биотест - это заранее спланированный опыт поставленный в соответствии с разработанным для данного метода биотестирования регламентом, который позволяет получить статистически достоверные результаты. О таком методе будет рассказано в продолжении. Но об этих поведенческих реакциях я упомянул не зря. В практическом плане они сами по себе достаточно информативны. Кроме того, улитки нередко демонстрируют их и по ходу проведения биотеста и экспериментатору полезно понимать, что происходит. А в завершении этого материала, остановимся на еще одной особенности ампулярий. Как я уже говорил, молодые улитки очень быстро строят свою раковину. Этот процесс нарушается при сильном токсическом воздействии воды. Посмотрим на фотографию в самом начале статьи. Раковина этой бедной улитки разрезана глубокой продольной щелью. Это очень характерное нарушение формирования раковины. Если у ваших улиток то же самое - знайте, что жить в вашем аквариуме очень и очень трудно. Отрицательное воздействие среды на организм таково, что оно уже не может быть скомпенсировано защитными реакциями организма и приводит к морфологическим нарушениям. Благодаря высокой резистентности ампулярия живет, но дается ей это нелегко. В аквариумах, где живут улитки с такими раковинами часто наблюдается "беспричинная" гибель рыб. Кроме того, рыбы часто болеют.
 |
| Фото 3. В отличие от фото в начале статьи, здесь продольный разрез раковины "зажил". Мы видим всего лишь "шрам". |
Если своевременно (когда еще продольная щель не слишком велика) улучшить условия существования в аквариуме: не применять по любому поводу, а то и без повода лекарства, содержащие медь и формалин, наладить биофильтрацию и почаще менять воду, то ампулярия успешно восстанавливает целостность раковины. Но рубец останется навсегда как память о пережитых некогда тяжелых временах.
Подробно о конкретной методике биотестирования можно прочитать в статье Биотестирование в домашних условиях, часть II (методика биотеста).

aquariumok.ru
Биотестирование
Биотестирование ныне является основным приемом в разработке ПДК химических веществ в воде. При этом определяют такие параметры, характеризующие токсичность, как: ЛК50 (летальная концентрация для 50% тест-организмов), ЭК50 (эффективная концентрация для 50% тест-организмов), МНК (максимально недействующая концентрация), ОБУВ (ориентировочно безопасный уровень воздействия), ОТД (острое токсическое действие), ХТД (хроническое токсическое действие) и ЛВ50 (время гибели 50% тест — организмов).[ ...]
Биотестирование водоемов основано на том, что отдельные группы гидробионтов могут жить при определенной степени загрязнения водоема органическими веществами. Способность гидробионтов выживать в загрязненной органикой среде называется сапробностъю.[ ...]
Биотестирование проведено также с использованием клеточного тест-объекта - гранулированной спермы быка, т.е. путем анализа зависимости показателя подвижности суспензии сперматазоидов от времени и определения степени подавления их подвижности (сокращения среднего времени подвижности) под воздействием содержащихся в воде токсикантов, в соответствии с [140]. Реализация метода осуществляется с применением автоматической аналитической системы, обеспечивающей сравнительную оценку показателя подвижности суспензии сперматозоидов в опытных пробах воды и в контрольных средах, определение процедур расчетов и выдачу результатов в виде соответствующих индексов токсичности. Оценка показателя подвижности осуществляется путем автоматического подсчета числа флуктуации интенсивности рассеянного излучения, вызванного прохождением клеток через оптический зонд.[ ...]
Биотестирование сточных вод, идущих на повторное использование, показало, что сточная вода в неочищенном виде подавляет прорастание семян и рост проростков на 22%, после очистных сооружений - на 12%, а разбавленная в соотношении 1:1 или 1:2 - на 9%. Контроль во всех случаях - отстоянная водопроводная вода.[ ...]
БИОТЕСТИРОВАНИЕ - оценка состояния окружающей среды по живым организмам. См. Биологические индикаторы. БИОТИЧЕСКАЯ ТРАНСФОРМАЦИЯ СРЕДЫ (Б.т.с.) - изменение абиотических условий под влиянием жизнедеятельности организмов. В.И. Вернадский рассматривал живые организмы как геохимический фактор, который создал биосферу. Благодаря живым организмам в атмосфере появился кислород, сформировались почвы, образовались толщи осадочных пород на дне океанов. В результате Б.т.с. создаются запасы детрита в виде торфа и сапропеля.[ ...]
Для биотестирования используются самые различные организмы (водные растения, водоросли, ракообразные, моллюски и рыбы). Однако наиболее чувствительным к загрязняющим веществам различной природы является пресноводный рачок дафния магна.[ ...]
Под биотестированием понимают приемы исследования, с помощью которых о качестве среды, факторах, действующих самостоятельно или в сочетании с другими, судят о выживаемости, состоянию и поведению специально помещенных в эту среду организмов — тест-обьектов. Рост особей, их продуктивность, выживаемость служат показателями для биотестирования качества среды. Для целей мониторинга природных и сточных вод предприятий оказались удобными фитопланктон и дафнии.[ ...]
Методы биотестирования основаны на оценке физиологического состояния и адаптационного стресса организмов, адаптированных к чистой среде и на время эксперимента помещенных в испытуемую среду. Эти методы также дают информацию об интегральном экологическом качестве среды. Цели прогноза обычно связаны с экстраполяцией результатов опытов на качество жизни человека и на изменения показателей биоразнообразия в экосистемах. Оценка среды по системе биотестирования и биоиндикации в каждой точке территории должна базироваться на анализе комплекса видов. Для наземных экосистем -это травянистые и древесные растения, беспозвоночные животные (например, моллюски и членистоногие) и позвоночные животные (земноводные, рептилии, птицы, млекопитающие). Оценка состояния каждого вида базируется на результатах использования системы методов: морфологических (например, регистрации признаков асимметрии внешнего строения), генетических (тесты на мутагенную активность), физиологических (тесты на интенсивность энергетического обмена), биохимических (оценка окислительного стресса у животных и фотосинтеза у растений), иммунологических (тесты на иммунную потенцию).[ ...]
Длительное биотестирование (3=20 сут.) позволяет определить хроническое токсическое действие воды на дафний по снижению их выживаемости и плодовитости. Показателем выживаемости служит среднее число исходных самок дафний, выживших в течение биотестирования, показателем плодовитости -среднее число молоди, выметанной в течение биотестирования, в пересчете на одну выжившую исходную самку. Критерием токсичности является достоверное отличие от контроля показателя выживаемости и плодовитости дафний.[ ...]
Субстрат для биотестирования собран в районе Среднеуральского медеплавильного завода (Свердловская обл., г. Ревда, Средний Урал, южная тайга). Главные ингредиенты выбросов - 802 и полиметаллическая пыль (в основном соединения Си, РЬ, Cd, 2п, Аь). Многолетнее загрязнение (начиная с 1940 г.) привело к значительному подкислению лесной подстилки и увеличению содержания в ней металлов (табл. 1). Закономерности техногенной трансформации лесных экосистем района исследований описаны ранее (Воробейчик и др., 1994).[ ...]
Таким образом, биотестирование воды представляет собой оценку качества воды по ответным реакциям водных организмов, которые являются в этих случаях тест — объектами (табл. 15.2).[ ...]
К достоинствам биотестирования можно отнести также возможность его использования с помощью портативных приборов при полевых исследованиях, а также простоту сбора и анализа проб. Так, с помощью этих методов по функциональному состоянию (поведению) тест - объектов (ракообразные - дафнии, водоросли - хлорелла, рыбы - гуппии и др.) можно оценивать качество вод и осуществлять ранжирование их по классам состояний. Таким образом появляется возможность использования этих вод для питьевых или иных целей. Наиболее информативные критерии оценки состояния поверхностных и сточных вод (по состоянию тест - объектов) приведены в табл. 42.[ ...]
Удачно дополняет метод биотестирования на дафниях биоте-стовый анализ с помощью простейших микроорганизмов - инфузорий-туфелек (Paramecium caudatum). Метод биотестового анализа водных проб основан на способности инфузорий избегать неблагоприятных и опасных для жизнедеятельности зон и активно перемещаться по градиентам концентраций химических веществ в благоприятные зоны. Метод позволяет оперативно определять острую токсичность водных проб и предназначен для контроля токсичности природных, сточных, питьевых вод, водных вытяжек из различных материалов и пищевых продуктов.[ ...]
Методические указания по биотестированию сточных вод с использованием рачка дафния магна. — М.: в/о Союзводпроект ОМПР и ВП, 1986. - 27 с.[ ...]
При использовании методов биотестирования оперируют рядом понятий и определений: под тест-объектом понимают живой организм, используемый в биотестировании; тест-реакция - изменение какого-либо показателя тест-объекта под воздействием токсичных веществ, содержащихся в воде; тест-параметр - количественное выражение тест-реакции; критерий токсичности -значение тест-параметра или правило, на основании которого делают вывод о токсичности воды.[ ...]
Особенно перспективными в биотестировании окружающей среды являются простейшие - инфузории. Их используют в экотоксикологическом тестировании вод и почв, в биотестировании химических веществ и материалов биологического происхождения .[ ...]
Методическое руководство по биотестированию [68] включает методики определения токсичности с использованием в качестве тест-объектов дафний, водорослей и рыб. Помимо обязательных тестов (на дафниях) допускается использование других рекомендованных методов биотестирования.[ ...]
В табл. 21 представлены результаты биотестирования пяти рецептур антисептика, содержащего алкил бензил аммонийхлорид (¿)), тринатрийфосфат (к2), карбонат натрия (к3) и борную кислоту (¿4).[ ...]
Гудимов A.B., Петров B.C., Гудимова Е.Н. Биотестирование на донных беспозвоночных как средство предупреждения и минимизации загрязнения акваторий в районах разработки месторождений нефти и газа на шельфе Арктики// Морские и арктические нефтегазовые месторождения и экология. М.: ВНИИГАЗ, 1996.[ ...]
В качестве критерия токсичности речных вод использовали выживаемость тестируемых организмов.[ ...]
| Поэтапная схема комплексных исследований по биотестированию предприятия | 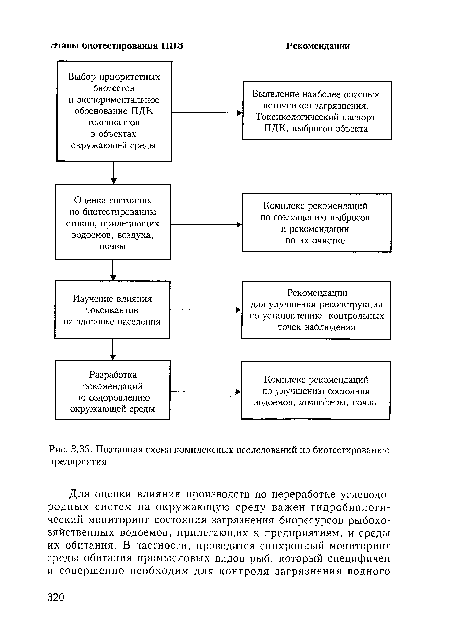 |
На практике для контроля токсичности воды наряду с известными методами биотестирования широко применяют биохимико-физиологи-ческие испытания, основанные на сравнении параметров, характеризующих нормальное поведение организма или биокультуры, с теми же параметрами, наблюдаемыми под воздействием загрязненной воды [4 ]. Как правило, контролируемыми параметрами являются изменение концентрации органического кислорода, количество поглощенного кислорода или выделившегося углекислого газа и др. Все эти методики впервые стандартизуются сразу на международном уровне.[ ...]
Другой возможностью интегральной оценки уровня загрязнения атмосферы является биотестирование токсичности вод снежного покрова города, накопившего в себе за зимний период выбросы промышленных предприятий и автотранспорта. Для этих целей нами разработаны и аттестованы оперативная методика и комплект аппаратуры для биотестирования вод по воздействию загрязнителей на рост водоросли хлореллы. Эта разработка позволяет одновременно оценивать токсичность многих проб талого снега, а также других природных и сточных вод. Проведенные исследования показали высокую эффективность данного методического подхода в определении загрязнения окружающей среды.[ ...]
На основе результатов экспериментальных исследований предлагается использовать биотестирование как метод прогнозной оценки загрязнения акваториальных вод при освоении морских нефтегазовых месторождений. Изложены преимущества рассматриваемого метода по сравнению с общепринятой системой мониторинга.[ ...]
Нами развиты, доработаны и адаптированы к производственным условиям экспресс-методы биотестирования водных объектов с помощью таких тест-организмов, как ракообразные -Daphnia magna Straus (cladocera, crustacea), далее для краткости -Daphnia magna, а также простейшие - Paramecium caudatum (рис. 3.4).[ ...]
Для оценки биологической значимости выявленных изменений структурных особенностей воды проводили ее биотестирование в соответствии с рекомендациями «Методы биотестирования вод» [73]. Использовали гид-робионты различных трофических уровней (3-х систематических групп): простейшие - инфузории Tetrahimena pyriformis, беспозвоночные - пресноводный рачок Daphnia magna и рыбы-мальки гуппи Poecilia reticulata peters.[ ...]
В настоящее время наиболее информативным и достоверным методом оценки качества ОПС и поступающих в нее веществ является биотестирование. В бурении этим способом проводится оценка токсичности промывочных жидкостей и технологических отходов бурения. Следует отметить, что биотестирование буровых сточных вод (БСВ) выполняется корректно, по утвержденной методике для сточных вод. Однако для бурового шлама и буровых технологических жидкостей, по составу и свойствам существенно отличающихся от БСВ, научно обоснованной методики биотестирования, которая учитывала бы их специфику, нет. Поэтому условия проведения исследований, например, кратность разбавления исходного вещества, не унифицированы. Соответственно, результаты исследований разных авторов зачастую несопоставимы, а в ряде случаев их достоверность сомнительна. Так, при разбавлении промывочных жидкостей их дисперсная фаза выпадает в осадок и ее токсикологический эффект фактически не учитывается. Между тем используемая в составе БПЖ глина обладает высокой адсорбирующей способностью. Поэтому в водную среду попадает не исходная глина, использованная для приготовления промывочной жидкости, а модифицированная в процессе циркуляции через скважину. Кроме того, в БПЖ попадают глинистые частицы из выбуренной породы.[ ...]
К сожалению, при использовании приведенных оценочных шкал необходимо учитывать методический аспект. Известно, что результаты биотестирования очень зависят от методики определения. И даже малейшие отклонения, незаметные для неопытного экспериментатора, приводят к значительному искажению результата.[ ...]
На протяжении ряда последних лет сформировалось самостоятельное направление биологического контроля состояния среды путем биоиндикации и биотестирования [Захаров, 1993; Шуберт (ред.), 1988; Мелехова и др., 1988, 2000; Смуров, 2000].[ ...]
| 3 |  |
Одним из методов интегральной оценки качества воды, имеющей контакт с устройством очистки, для выявления возможного негативного влияния конструкционных материалов на качество питьевой воды является биотестирование с помощью гидробионтов различных трофических уровней.[ ...]
Организмы донной фауны являются не только удобными объектами для акваториального содержания, но и прекрасными мониторами хроничекого загрязнения. Анализ их физиологических и поведенческих реакций при биотестировании позволяет достоверно определить пороговые, переносимые и летальные нагрузки, вызываемые тем или иным видом загрязнения. Биотесгирование на Мурмане пока еще не получило должного развития, хотя насущность его очевидна, а результаты нельзя заменить мониторингом. Начавшиеся в нашем институте исследования по биотестированию буровых растворов и их компонентов показали его успешность, в частности, на таких объектах, как голотурия Cucumaria frondosa, гидроид Dynamena pumita, амфипода Gammarus oceanicus, двустворки - мидия (Mytilus edulis L.) и Modiolus (рис. 1-3). Эксперименты показали, что моллюски-фильтраторы, прекрасно адаптирующиеся к лабораторным условиям, сочетают в себе одновременно высокую общую резистентность при достаточной чувствительности отдельных физиологических и поведенческих реакций по отношению к различного рода загрязнениям. Кроме того, по поведенческим актам и росту мидий, например, можно осуществлять не только тестирование загрязнителей, но и проводить непрерывный контроль за качеством природных вод, особенно в прибрежье (губа Териберка, Кольский залив), - в местах выхода подводных трубопроводов и перетранспортировки газоконденсата, нефти и газа.[ ...]
Дафния магна - мелкое ракообразное, постоянный обитатель стоячих и слабопроточных водоемов. По способу питания - активный фильтратор, размер самок достигает 3 мм, самцы в 1,5-2 раза меньше. Дафнии используются для биотестирования водоемов.[ ...]
Разработанная методика позволит осуществлять анализ фактической экологической опасности веществ. При этом процедура анализа экологического риска нетоварных веществ будет основана на сопоставлении измеренного показателя биотестирования со шкалой уровня техногенного воздействия. Таким образом, вместо утверждаемых в настоящее время эколого-рыбохозяйственных нормативов для всех используемых нетоварных веществ необходимо утвердить только методику биотестирования и несколько шкал уровня техногенного воздействия на окружающую природную среду.[ ...]
Во Франции оценка качества водной среды по токсикологическим показателям является обязательной в “Системе контроля качества пресных вод”. Производственный токсикологический контроль сточных вод проводят более чем на 150 предприятиях. Для биотестирования применяют стандартный набор биотестов на острую токсичность с использованием бактерий, водорослей, дафний и рыб .[ ...]
При обсуждении результатов биотестового анализа водных объектов возникает вопрос о критерии токсичности, т.е. о выборе значений индекса токсичности, при которых вода оказывает или не оказывает токсическое воздействие на живые организмы. Методы биотестирования апробированы нами на модельных растворах с известным содержанием токсичных веществ и реальных водных объектах [9, 72, 73].[ ...]
Величины ДФ или АФ/Фт, полученные при построении световых кривых, характеризуют удельную фотосинтетическую и общую физиологическую активность водорослей и могут использоваться в качестве самостоятельного показателя их состояния, в частности при биоиндикации и биотестирования качества воды.[ ...]
Современное загрязнение почти всегда подразумевает наличие в окружающей среде целого комплекса факторов, совместное действие которых может приводить к неожиданным эффектам. Так, специалисты в области экотоксикологии отмечают факты несогласованности результатов биотестирования (токсичность) и химического анализа («благополучные» данные). В качестве одной из возможных причин могут быть комбинированные эффекты. В частности, было обнаружено, что накопление в почве мышьяка приводит к возникновению специфических микробных сообществ. Химическое загрязнение стимулирует развитие фитопатогенных микроорганизмов. Например, при повышенной концентрации мышьяка формируются фузариозно-нематодные комплексы, представляющие двойную опасность для высших растений (Вараксина и др., 2004).[ ...]
При создании новых рецептур многокомпонентных антисептиков на основе явления синергизма главной задачей является подбор оптимального соотношения составных ингредиентов. Рецептуры антисептиков с улучшенными эксплуатационными и экологическими свойствами создают на основе биотестирования по методике "Лаборатории защиты древесины ЦНИИМОД" [49], описанной выше (1).[ ...]
Под биотестом понимают оценку (испытание) в строго определенных условиях действия вещества или комплекса веществ на водные организмы путем регистрации изменений того или иного биологического (или физиолого-биохимического) показателя исследуемого объекта, сравниваемого с контрольным. Подопытные организмы именуются тест-объектами (тест-организмами), а процесс проведения испытаний—биотестированием [97].[ ...]
Весьма информативными при экологических оценках водных экосистем являются характеристики состояния и развития всех экологических групп водного сообщества. При выделении зон чрезвычайной экологической ситуации и экологического бедствия используются показатели по бактериопланкто-ну, фитопланктону, зоопланктону и ихтиофауне. Определение степени токсичности вод проводится также на основе биотестирования преимущественно на низших ракообразных. При этом уровень токсичности водной массы должен определяться на всех основных фазах гидрологического цикла. Параметры предложенных показателей должны наблюдаться на данной территории постоянно на протяжении достаточно длительного времени с минимальным периодом не менее 3 лет.[ ...]
Приводятся данные по изменению физико-химических свойств буровых растворов в забойных условиях. Показано, что прогнозирование токсичности отходов бурения при бурении скважин становится невозможным. На примере многочисленных экологических исследований отходов бурения установлено, что наиболее уязвимым звеном экосистемы рыбохозяйственного водоема являются дафнии. В связи с этим обосновывается целесообразность применения метода биотестирования буровых растворов на стадии разработки и отходов бурения в процессе строительства скважин.[ ...]
Между тем многие из перечисленных трудностей удается преодолеть, если в традиционную схему экологического контроля ввести методы биомониторинга. Эти методы основаны на регистрации суммарного токсического действия на специальные тест-организмы сразу всех или многих из компонентов загрязнения и, таким образом, позволяют быстро и с минимальными затратами оценить, является ли анализируемая проба загрязненной или нет. После достаточно масштабной, но малозатратной процедуры биотестирования дорогостоящему химическому анализу подвергаются лишь те образцы, которые вызывают сомнения относительно их экологической безопасности. Биоиндикационный анализ качества среды, основанный на определении состояния организмов, живущих на обследуемой территории, позволяет оценить воздействие на них всех загрязнителей в течение длительного времени, что дает возможность получить интегральный показатель уровня загрязнения среды. К сожалению, из-за недостаточной научно-методической, технической и нормативно-правовой проработки биологические методы пока лишь ограниченно используются в системе экологического мониторинга.[ ...]
Индикационные критерии оценки. В последние годы б ио индикация получила достаточно широкое распространение при оценках качества поверхностных вод. Она по функциональному состоянию (поведению) тест-объектов (ракообразные — дафнии, водоросли — хлорелла, рыбы — гуппи) позволяет ранжировать воды по классам состояний (нормы, риска, кризиса, бедствия) и, по существу, дает интегральную оценку их качества и определяет возможность использования воды для питьевых целей. Лимитирующим фактором использования метода биотестирования является продолжительный срок проведения анализа (не менее 96 ч) и отсутствие информации о химическом составе воды. Пример использования биотестов для определения качества воды приводится в табл. 21.[ ...]
В качестве биотеста можно использовать одинаковые проростки гороха, фасоли, которые отбирают из партии после их прорастания. У горошин срезают половинки обеих семядолей, чтобы у них было ровное ложе. Фильтровальную бумагу, лежащую на дне химического стакана емкостью 200-250 мл смачивают 5 мл опытного раствора, на дно помещают по 5 подготовленных горошин, закрывают крышкой от чашки Петри. После того, как горошины вырастут на высоту 5-7 см и более (до крышки стакана), производят их измерение. Контроль - горошины на дистиллированной воде. Подсчет проводится так же, как и при биотестировании по прорастанию семян.[ ...]
В целях определения экологического состояния водоемов используют результаты гидробиологических наблюдений, которые дают наиболее полную информацию. Биоиндикация загрязнения водоемов включает большой набор показателей, охватывающих основные трофические уровни водной экосистемы: фитопланктон, зоопланктон, бентос и другие. При этом суммирующими (интегральными) показателями, которые способны охарактеризовать общий уровень загрязнения вод всем комплексом токсичных веществ и, следовательно, опасность водной среды для гидробионтов, являются битестовые (токсикологические) показатели. Соответствующий токсикологический анализ проводится с помощью приемов и методов биотестирования токсичности.[ ...]
К этой же группе методов следует отнести мониторинг — периодическое или непрерывное слежение за состоянием экологических объектов и за качеством среды. Большое практическое значение имеет регистрация состава и количества вредных примесей в воде, воздухе, почве, растениях в зонах антропогенного загрязнения, а также исследования переноса загрязнителей в разных средах. В настоящее время техника экологического мониторинга быстро развивается, используя новейшие методы физико-химического экспресс-анализа, дистанционного зондирования, телеметрии и компьютерной обработки данных. Важным средством экологического мониторинга, позволяющим получить интегральную оценку качества среды, являются биоиндикация и биотестирование — использование для контроля состояния среды некоторых организмов, особо чувствительных к изменениям среды и к появлению в ней вредных примесей.[ ...]
Оценена пространственная вариабельность (в пределах участка 100x100 м) загрязненности лесной подстилки тяжелыми металлами (Си, Сё, РЬ, 2п), ее кислотности и фитотоксичности (по корневому тесту на проростках из генетически однородной выборки одуванчика лекарственного). Подстилка собрана в трех зонах с разным уровнем токсической нагрузки на территории, подверженной многолетнему полиметаллическому загрязнению выбросами медеплавильного завода на Среднем Урале. Разброс фитотоксичности максимален на участке со средним уровнем загрязнения, где отмечены как очень высокие, так и очень низкие значения, что приводит к возникновению существенной нелинейности в дозовой зависимости. Фитотоксичность подстилки в первую очередь определяют обменные формы металлов. Обнаружен резко выраженный антагонизм между тяжелыми металлами и кислотностью при биотестировании образцов с максимально загрязненного участка.[ ...]
В связи с этим представляют интерес результаты исследований по ряду ключевых вопросов безопасного обращения с веществами и материалами в бурении. В общем случае используемые и образующиеся в бурении вещества можно разделить на две категории - товарные (промышленная продукция) и нетоварные (буровые технологические жидкости и технологические отходы бурения и испытания скважины). Принципиальные отличия между этими категориями веществ являются веским основанием для того, чтобы по-разному подходить к оценке их экологичности. Однако в нормативных документах федерального уровня эта специфика не учитывается и предусматривается единый подход к оценке экологической опасности веществ путем определения значения их предельно допустимой концентрации в компонентах окружающей природной среды. Применительно к нетоварным веществам целесообразно перейти от нормирования содержания вещества в окружающей среде к нормированию его воздействия. Эта задача может быть решена путем комплексного биотестирования нетоварных веществ. В целях отработки методики таких исследований проведено изучение отработанного бурового раствора и шлама с использованием различных тест-объектов, результаты которого изложены в настоящем обзоре.[ ...]
ru-ecology.info
Биотестирование сточных вод методом Daphnia
Проблемы чистой воды и охраны гидросферы становятся все более острыми по мере развития научно-технического прогресса. Уже сейчас во многих районах земного шара наблюдаются большие трудности в обеспечении водопотребления и водопользования вследствие количественного и качественного истощения водных ресурсов. В первую очередь это связано с загрязнением водоемов и забором из них больших объемов воды (зарегулирование, переброска части стока рек и др. ), ведущегося в интересах энергетики, орошения земель, навигации и в других целях.
Настоящая работа была выполнена по заданию Воронежского Областного Комитета по экологии и охране природных ресурсов. В его штате отсутствуют гидробиологи, однако результаты гидробиологического тестирования сточных вод очень важны и интересуют Комитет. Пробы для тестирования были предоставлены лабораторией Комитета, а небольшое количество дафний для разведения и дальнейшего использования в опытах – кафедрой зоологии беспозвоночных Воронежского государственного университета.
Для тестирования были взяты стоки вод в прудах-отстойниках шести сахарных заводов области.
Результаты экспериментов переданы в Областной Комитет по экологии и охране природных ресурсов.
Современное состояние проблемы загрязнения водоемов и очистки сточных вод
Загрязнение водоемов в наибольшей степени связано со сбросом в них промышленных, сельскохозяйственных и бытовых стоков, с попаданием загрязняющих веществ из атмосферы и в результате деятельности человека на самих водоемах. Во многих водоемах загрязнение настолько велико, что привело к полной деградации их экосистемы, потере их хозяйственной и ландшафтной ценности.
Под загрязнением водоемов понимается ухудшение их экономического значения и биосферных функций в результате антропогенного поступления в них вредных веществ.
Из загрязняющих веществ наибольшее значение для водных экосистем имеет нефть и продукты ее переработки, пестициды, соединения тяжелых металлов, детергенты, антисептики. Чрезвычайно опасным стало загрязнение водоемов радионуклидами. Значительную роль в загрязнении водоемов играют бытовые стоки, лесосплав, отходя деревообрабатывающих предприятий и многие другие загрязнения, не относящиеся к токсическим, но ухудшающие среду гидробионтов.
Сточные воды – это воды, использованные на бытовые, производственные и другие нужды и загрязненные различными примесями, изменившими их первоначальный химический состав и физические свойства, а также воды, стекающие с территории населенных пунктов и промышленных предприятий в результате выпадения атмосферных осадков или поливки улиц.
В зависимости от происхождения, вида и состава сточные воды подразделяются на три основные категории:
1. Бытовые (от туалетных комнат, кухонь, столовых, больниц. Они поступают от жилых и общественных зданий, а также от бытовых помещений промышленных предприятий)
2. Производственные (воды, использованные в технических процессах, не отвечающие более требованиям, предъявляемым к их качеству)
3. Атмосферные (дождевые и талые, вместе с атмосферными отводятся воды от полива улиц, от фонтанов и дренажей)
Сточные воды представляют собой сложные гетерогенные смеси, содержащие примеси органического и минерального происхождения, которые находятся в нерастворенном, коллоидном и растворенном состоянии. Степень загрязнения сточных вод оценивается концентрацией, т. е. массой примесей в единице объема (мг/л). Наиболее сложны по составу сточные воды промышленных предприятий. На формирование производственных сточных вод влияют перерабатываемое сырье, технический процесс производства, применяемые реагенты, промежуточные изделия и продукты, состав исходной воды, местные условия и др.
Эти воды могут различаться по концентрации загрязняющих веществ, по степени агрессивности и т. д.
Водоемы загрязняются в основном в результате спуска в них сточных вод от промышленных предприятий и населенных пунктов. В результате сброса сточных вод изменяются физические свойства воды (повышается температура, уменьшается прозрачность, появляются привкусы, окраска, запахи), на поверхности водоемов появляются плавающие вещества, а на дне образуются осадки, изменяется химический состав воды (увеличивается содержание органических и неорганических веществ, появляются токсические вещества, уменьшается содержание кислорода, изменяется активная реакция среды и др. ), изменяется качественные и количественные бактериальный состав, появляются болезнетворные бактерии. Загрязненные водоемы становятся непригодными для питьевого и технического водоснабжения, теряют рыбохозяйственное значение.
Первые шаги к усовершенствованию процесса очистки сточных вод связано с прямым использованием природного самоочищения и фильтрационной способности почвы. Уже в 19 столетии вокруг крупных промышленных центров были выделены специальные земельные участки, которые служили для очистки сточных вод. Они получили название полей фильтрации и полей орошения. Но длительность срока очистки и большие земельные площади делают эти способы малоэкономичными при быстро развивающемся производстве. При таком способе очистки возникают так же определенные санитарно-эпидемиологические трудности.
Следующим этапом развития способов очистки сточных вод было использование биологических прудов. Процесс очистки воды в них проходит по принципу естественного очищения обычного для водоемов и только отчасти регулируется человеком. Так очищаются стоки мясокомбинатов, молочных и сахарных заводов, кондитерских и других предприятий. Нередко такие пруды обеспечиваются принудительной аэрацией и циркуляцией воды. Отрицательным моментом работы биопрудов является длительность процесса очистки, который продолжается до 30 суток. Процесс очистки считается окончательным при следах азота аммонийного в воде.
Технический прогресс и все усиливающийся процесс индустриализации привели уже в начале 20 века к необходимости изыскать более быстрые и экономичные методы очистки сточных вод.
Методы искусственной биологической очистки, основанные на активной деятельности живых организмов, остаются в настоящее время основными экономичными и эффективными, обеспечивающие наиболее полное разложение загрязнений по сравнению со всеми иными индустриальными методами.
3. Методы анализа и тестирования сточных вод
Среди методов гидробиологического анализа поверхностных вод сапробиологический анализ занимает одно из важнейших мест. Разработанный еще в начале 20 века ботаником Кольквитцем и зоологом Марссоном сапробиологический анализ продолжает успешно применяться в повседневной практике гидробиологического контроля качества поверхностных вод.
Первоначально под сапробностью понималась способность организмов развиваться при большем или меньшем содержании в воде органических загрязнений. Затем экспериментально было доказано, что сапробность организма обусловливается как его потребностью в органическом питании, так и резистентностью по отношению к вредным продуктам распада и дефициту кислорода в загрязненных водах.
Теперь установлено, что в ряду организмов олигосапробы-мезосапробы-полисапробы возрастает не только специфическая стойкость к органическим загрязнителям и к таким их последствиям, как дефицит кислорода, но и их неспецифическая способность существовать при резко различных условиях среды. Это положение значительно расширяет возможности использования сапробиологического анализа не только в случае загрязнения вод бытовыми стоками, но и при их промышленном загрязнении.
В классической системе показательные организмы разделяются на три группы:
1. организмы сильно загрязненных вод – полисапробионты, или полисапробы;
2. организмы умеренно загрязненных вод – мезосапробионты, или мезосапробы;
3. организмы слабо загрязненных вод – олигосапробионты, или олигосапробы.
Полисапробные воды характеризуются бедностью кислорода и большим содержанием углекислоты и высокомолекулярных легко разлагающихся органических веществ – белков, углеводов. Население полисапробных вод обладает малым видовым разнообразием, но отдельные виды могут достигать большой численности. Здесь особенно распространены бесцветные жгутиконосцы и бактерии.
Мезасапробные воды характеризуются энергичным самоочищением. Большой численностью обладают грибы, бактерии и водоросли. В этих водах обитают беспозвоночные организмы, а также нетребовательные к кислороду виды рыб. Деревенские пруды, рвы и канавы на полях орошения обычно содержат мазосапробные воды.
В олигосапробных водах процессы самоочищения протекают менее интенсивно, чем в мезосапробных. В них доминируют окислительные процессы, нередко наблюдается пресыщение кислородом, преобладают такие продукты как аммонийные соединения, нитриты и нитраты. В этих водах разнообразно представлены животные и растительные организмы.
Олигосапробные воды – это практические чистые воды больших озер. Если такие воды произошли путем минерализации из загрязненных вод, то для них характерна почти полная минерализация органических веществ.
Дафния является мезосапробным организмом. С ее помощью можно определить достаточно хорошую степень очистки сточных вод. Так как она очень чувствительна к изменениям водной среды мы можем определить и недостаточную степень очистки воды. Поэтому мы проводили биотестирование сточных вод методом Дафния.
4. Биотестирование сточных вод методом Daphnia
К настоящему времени апробированы и используются на практике большое количество предельно допустимых концентраций различных веществ, успешно внедряются в практику народного хозяйства также нормы предельно допустимых стоков.
При избыточном поступлении стоков с высокими концентрациями вредных веществ нарушаются природные качества воды, и она становится непригодной для выполнения биологических функций организма. Это отрицательно сказывается на состоянии и развитии всех водных организмов и приводит к негативным состояниям стабилизированных экосистем, структура которых в большинстве случаев упрощается.
Часть ее компонентов, в первую очередь полезных человеку, частично вымирает, а ограниченное число отдельных представителей флоры и фауны может интенсивно развиваться и способствовать ухудшению природных качеств вод.
Задача настоящей работы заключается в контроле качества сточных вод, выбрасываемых сахарными заводами области. Контроль производится одним из самых допустимых биологических методов на ветвистоусом рачке Daphnia magna из отряда листоногие раки.
Для проведения данной работы требуются следующие материалы и оборудование:
Микроскоп МБС, лупы, гидробиологический сачок для отлова дафний, сачки для переноса дафний в сосуд для биотестирования, аквариум-отсадник объемом 5 л, цилиндры мерные объемом 0,5-2 л, пипетки мерные на 1,2,10 мл, стаканы химические объемом 200,100,50 мл, воронки стеклянные, чашки Петри, фильтровальная бумага
5. Характеристика тест-объектов
Род Daphniaвключает 50 видов и имеет повсеместное распространение. В пресных водоемах нашей области широко распространены 5 видов дафний.
Рачки вида Daphnia magna имеют более крупные размеры и их применение в токсикологических экспериментах предпочтительнее. Они обитают в стоячий водоемах и слабопроточных водах, особенно часто во временных пересыхающих водоемах, лужах. На территории нашей страны распространены повсеместно, кроме Заполярья и Дальнего Востока. Являются типичными мезосапробами, переносят осоление до 6%.
Короткий биологический цикл развития позволяет проследить рост и развитие дафний на всех жизненных стадиях. В течение жизни дафнии выделяют ряд стадий, сопровождающихся линьками: первые 3 следуют через 20-24-36 часов, четвертая – созревание яиц в яичнике и пятая – откладка яиц в выводковую камеру следуют с интервалами 1 -1,5 суток. Начиная с шестой стадии, каждая линька сопровождается откладыванием яиц. Растет дафния наиболее интенсивно в первые дни после рождения, после наступления половозрелости рост замедляется. Новорожденная молодь имеет размеры 0,7-0,9 мм в длину, к моменту половозрелости самки достигают 2,2 – 2,4 мм, а самцы – 2,0 – 2,1 мм. Максимальная длина тела самок может достигать 6,0 мм.
При благоприятных условиях и в лаборатории дафнии большую часть года размножаются без оплодотворения – партеногенетически, производят потомство, состоящее из самок. При недостатке пищи, перенаселении, изменении температурных условий и уменьшения светового дня в популяции дафний появляются самцы, и дафнии переходят к половому размножению, откладывая после оплодотворения «зимние яйца» (1-2) в эфиппиум, образованный из части створок раковины самок.
Период созревания рачков при оптимальной температуре 20-220С с хорошим питанием – 5 -8 дней. Длительность эмбрионального развития обычно 3-4 дня, а при повышении температуры до 25-46 часов. По истечении этого времени происходит вымет молоди. Партеногенетические поколения следуют одно за другим каждые 3-4 дня. Формирование яиц в кладке прекращается за 2-3 дня до смерти. В природе дафнии живут в среднем 20-25 дней, а в лаборатории при оптимальном режиме 3-4 месяца и более. При температурах свыше 250С продолжительность жизни дафний может сократиться до 25 дней.
Источником питания дафний в природных водоемах являются бактерии, одноклеточные водоросли, детрит, растворенные органические вещества. Интенсивность потребления корма зависит от его характера, концентрации в среде, температуры и возраста рачков. Процесс питания дафний непосредственно связан с движением грудных ножек, направляющих ток воды во внутрь раковины. Пищевые частицы, отфильтрованные на «сите», поступают в продольный желоб и передаются ко рту рачка.
Функции грудных ножек связаны с процессами дыхания. В жабрах (овальные выросты ножек) происходит газообмен. Дафния устойчива к изменению кислородного режима (от 2 мг О2/л), что связано со способностью синтезировать гемоглобин. В условиях пониженной концентрации растворенного кислорода дафнии приобретают красноватый цвет, а при благоприятных условиях – розовато-желтый цвет.
В лабораторных условиях мы использовали дрожжевой корм, который готовили следующим образом: 1 г свежих или 0,3 г воздушно-сухих дрожжей заливали 100 мл дистиллированной воды. После набухания дрожжи тщательно перемешиваются. Отстаивают 30 минут. Добавляют надосадочную жидкость в сосуды с рачками в количестве 3 мл на 1 л воды.
Подготовка дафний к биотестированию проходила по следующей схеме: 30-40 рачков с выводковыми камерами полными яиц или зародышей на 3-4 суток до тестирования пересаживают в 1-2-хлитровые емкости (стаканы) с аквариумной водой, в которую перед посадкой дафний вносят корм. После появления молоди (каждая самка может выметать от 10 до 40 молодых дафний) взрослых особей удаляют с помощью стеклянной трубки, а одно-двухдневную молодь используют для биотестирования. Необходимое для тестирование количество дафний определяется числом контрольных проб воды и их разбавлений. Так, для тестирования одной пробы с одним повтором, в трехкратной повторности, потребуется 60 дафний (в каждый сосуд для тестирования помещают по 10 рачков)
6. Тесты токсичности на Daphnia
Существуют несколько тестов-методов определения токсичности природных и сточных вод на Daphnia, разработанных разными авторами. Мы пользовались тестом Министерства мелиорации и водного хозяйства СССР 1986 года «Биотестирование сточных вод с использованием Daphnia»
При биотестировании определяют острое и хроническое токсическое воздействие вредных веществ на животных. За острое принимается действие, оказываемое сточной водой на Daphnia в течение от 10 минут до 96 часов и проявляющееся в их обездвижении или гибели. Перед биотестированием проводились подготовительные работы, включающие получение исходного материала для лабораторной культуры и ее выращивания. Для биотестирования отбирали пробу сточной воды из прудов отстойников шести сахарных заводов области. Для сравнения с фоном отбирали пробу воды вне зоны влияния сточных вод.
Пробы помещали в стеклянные емкости, которые заполняли под крышку, чтобы исключить доступ воздуха. Не допускается замораживание и консервирование отобранных проб. Биотестирование проводили сразу после отбора проб и доставки их в лабораторию. Запас воды для биотестирования хранили в холодильнике. Температура тестируемой воды +18-240С.
Биотестирование установившихся сбросов сточных вод производится для выявления и последующего осуществления контроля источников ЭВЗ (экстемально высокого загрязнения). Определяется острое действие тестируемых проб на дафний. Критерием острого токсического действия является выживаемость рачков, показатель выживаемости – количество выживших дафний за период тестирования. Тестируют сточную воду без разбавления и воду контрольную.
По 100 мл аквариумной и соответствующих проб воды наливают в сосуды для тестирования. В каждый помещают по 10 особей молоди дафний. Их вносят в сосуды для тестирования с помощью сачка диаметром 3-4 см из планктонного газа или пипеткой с резиновой грушей. Повторность трехкратная. Сосуды оставляют при рассеянном свете. Дафний в течение всего периода биотестирования не кормят. Подсчитывают количество погибших и обездвиженных дафний, последних включают в число погибших. Обездвиженным считается опустившийся на дно рачок, не поднимающийся в толщу воды через 10-30 секунд после встряхивания сосуда. Определяют количество выживших дафний. Учет проводят каждый час в течение первых 8 часов наблюдений, затем через 12 и 24 часа от начала тестирования, в последующем – в начале и конце рабочего дня.
7. Обработка и оценка результатов
Определяют среднюю арифметическую величину выживаемости дафний в тестируемой воде по сравнению с контролем и высчитывают процент отклонения от контроля. Тестируемая вода оказывает острое токсическое действие на дафний в том случае, если процент отклонения от контрольного показателя выживаемости дафний в течение 96 часов составляет менее 10. Результаты биотестирования выражают в баллах
В случае получения 0 баллов ситуация считается благополучной и не требует применения дополнительных водоохранных мер. При получении оценочного балла 1 ситуация считается неблагополучной и принимаются меры по улучшению работы имеющихся водоохранных сооружений. При оценочном балле 2 необходимо провести биотестирование соответсвующих проб воды для определения хронического токсического действия. Результаты биотестирования, выражающиеся в баллах 3,4,5 свидетельствуют о ситуации, которая может нанести существенный ущерб водному объекту и требуют принятия мер по организации дополнительных водоохранных мероприятий. Предприятия, на которых тестируемые пробы воды из контрольного створа водного объекта оценены баллом 3 и выше, включаются в перечень потенциальных источников ЭВЗ водных объектов и подлежат токсикологическому контролю
8. Выводы и предложения
В результате проведенных анализов были получены следующие результаты:
Без разбавления: Два сахарных завода (Эртильский и Грибановский) проводят сброс гипертоксических вод (5 баллов) в пруды-отстойники. Садовский сахарный завод проводит сброс высокотоксичных вод (4 балла), а три сахарных завода (Елань-Коленовский, Нижнее-Кисляйский и Перелешинский) проводят сброс среднетоксичных вод (3 балла) в пруды-отстойники.
При разбавлении 1:10: токсичность с гипертоксичной снижается до высокотоксичной.
При разбавлении 1:100: Гипертоксичность снижается, вода становится среднетоксичной.
Данные экспериментов были переданы в Областной Комитет по экологии и охране природных ресурсов. Все заводы занесены в перечень потенциальных источников ЭВЗ ввозных объектов и подлежат токсикологическому контролю.
Проведенная работа показала, что методика биотестирования проста и доступна. Ее можно рекомендовать для широкого применения в практике как специалистам гидробиологам природоохранных организаций и вузов, так и студентам вузов, техникумов и учащимся технических училищ и школ.
www.hintfox.com
Биотестирование | aquariumok.ru
Что такое биотестирование?Зачем нужно заниматься битестированием?Можно ли дома провести биотест?
БИОТЕСТИРОВАНИЕ - это определение с помощью реакций живого организма степени токсичности окружающей этот организм среды.
Часто бывает необходимо узнать о токсичности воды. Но не только аквариумной, а, например, водопроводной, ключевой, либо колодезной воды. Живой организм, по реакциям которого судят о токсичности воды, называют тест-организмом. Правильный выбор тест-организма для биотестирования на 50% определяет успех этого дела, еще на 50% этот успех зависит от используемой методики. В давние времена я работал в Ленинградском Университете и занимался биотестированием профессионально*, даже новый биотест изобрел. Теперь, работаю с аквариумными рыбами. Первая проблема, которую мне пришлось решить на этом новом поприще - надлежащая очистка нашей питерской водопроводной воды, и надежная оценка того, очищена вода или нет? Тут опыт биотестирования мне очень пригодился. И здесь мы уже подошли к ответу на второй вопрос. Итак, зачем надо проводить биотесты? Ведь есть же простые и понятные аквариумные тесты и, кроме того, приличная организация может заказать полный анализ воды, благо в Санкт-Петербурге есть куда с этим обратиться. А дело вот в чем. Используя аквариумные тесты узнаешь очень немного. С помощью лабораторного анализа - много больше: содержание сотни-другой веществ можно определить. Но будут ли эти данные что-либо говорить о токсичности? Не всегда! Конечно же, могут быть очевидные случаи. Например, если какое-либо вещество в воде по своему содержанию значительно превышает предельно-допустимые концентрации, то можно уверенно сказать, что вода токсична. Но вот какая незадача: эти самые ПДК для гигиенических нужд (то есть разработанные для нашей водопроводной воды, так называемые санитарно-гигиенические ПДК) и ПДК рыбоводные, те, что используются для оценки качества воды в рыбоводных хозяйствах, зачастую отличаются друг от друга в 10 или даже в 100 раз. Угадайте, какие из них более строгие? Более строгие, те, что разработаны для разведения и выращивания рыб! И это понятно: рыбоводам надо получить реальный результат, если вода будет токсичной, то рыба сдохнет, либо биомассу не наберет, вот и нормы у них те, что отражают реальное положение вещей - природу-то не обманешь!** Другое дело человека обмануть - это можно и запросто. К тому же возможности его органов вкуса и обоняния, которые должны предупреждать об опасности (если запах и вкус противные, так не пейте каку), оставляют желать много лучшего. Мы почти ничего не чувствуем и УЖАСНО ЖИВУЧИ!!! Сначала долго и упорно болеем и умираем только потом, поди докажи, что от воды. Вот и нормы для людей зачастую построены на порогах человеческой чувствительности. Если уже не чувствуем, то можно… Предвижу строгие замечания со стороны гигиенистов: "Мы же испытывали на мышах! Они потом даже еще полгода прожили здоровенькими…. И нечего нас …". Но это совсем другая история. Полезность бытовых фильтров доочистки питьевой воды очевидна для тех, кто ими пользуется. Да, ПДК вредных веществ в водопроводной воде почти никогда не превышаются и формально вода пригодна для питья, но пропущенная через хорошей фильтр, она делается совсем другой. Это можно понять не только по своему самочувствию. Заварите чай или кофе (кто что больше любит) в воде прямо из под крана и профильтрованной и почувствуйте разницу! Но всегда надо помнить о том, что мы не чувствуем плавных ухудшений. А ресурсы бытовых фильтров в технической документации к ним обычно завышены в несколько раз! Они теряют свою эффективность не сразу, а постепенно. Как правило, гораздо раньше чем обещано в инструкции, наступает момент, когда фильтр уже ничего не чистит (хорошо, если не портит), а мы все продолжаем пользоваться им. Узнать "умер" ваш фильтр или нет, можно поставив биотест на себе, продегустировав по-разному заваренные напитки (в воде из-под крана и из-под фильтра), это ведь тоже биотест, а тест-организм в этом опыте - вы сами. А можно и оценить это дело с помощью настоящего биотеста, который я опишу далее. Во втором случае, полученная информация будет куда более ценной, так как чувствительность того тест-организма, что мы будем использовать значительно выше человеческой, а процедура тестирования такова, что позволяет получать статистически достоверные, а не субъективные результаты. Вы даже сможете количественно оценить насколько ухудшился ваш фильтр! Подведем итог. Нормы содержания в водопроводной воде загрязнителей практически не превышаются, а тем не менее очищать воду несомненно имеет смысл, причем в силу нескольких причин: не всегда можно верить ПДК, а кроме того, только ничтожно малое число загрязнителей из всех возможных нормировано и проверяется. Так, для водопровода норматив предусматривает определение только 17 загрязнителей (ГОСТ 2874-82), а для водоемов хозяйственно-питьевого назначения - 1272***. Сделать анализ на содержание стольких веществ (даже если мы поверим в истинность ПДК для них) нереально. Но даже если было бы реально, то это не привело бы к решению проблемы, так как на самом деле возможными токсичными загрязнителями вод могут быть многие десятки тысяч различных веществ! Есть еще одно печальное обстоятельство, которое также говорит в пользу необходимости биотестирования. Что если загрязнители содержатся в анализируемой воде в количествах сильно меньших чем ПДК, но их сразу много, что тогда? Как узнать, токсичен этот коктейль или нет? Ведь многие вещества усиливают токсичность друг друга, а другие наоборот ее ослабляют. Тут без биотестирования, которое является обобщающим (интегральным) показателем совместного действия многих веществ не обойтись. С помощью биотеста аквариумисты могут решать и чисто аквариумные задачи. Например, никак не удается наладить нормальную жизнь в новом аквариуме. Вы уже имеете опыт запуска аквариума, все делаете правильно, но почему-то все идет наперекосяк. Причина может быть в токсичном силиконе, коим данный аквариум склеен. Другой пример: вы установили в аквариуме новый красивый пластиковый фон (задник) или корягу новую утопили и рыбы стали чувствовать себя явно хуже. Причин тому может быть несколько, и не обязательно внесенные в аквариум предметы должны оказаться токсичными, но проверить это стоит. Проще всего это сделать с помощью биотеста. Наверное, в общих чертах я ответил на второй вопрос, а если что-то осталось неясным - спрашивайте на форуме. Теперь же ответ на третий. Да аквариумист может относительно просто провести дома довольно точный и информативный биотест. Тест-организмом будет всеми нами любимая аквариумная улитка ампуллярия. Так вот какая, оказывается, от нее польза! А то я заинтриговал аквариумную общественность, разместив в разделе "Другие твари" анонс статьи "Что толку от улиток?". Каждый, кто с ними имел дело, знает - толку-то почти нет. Но есть он, оказывается, только надо знать какой?! Можно также прочитать краткую информацию о других аквариумных улитках, полезных и бесполезных. А о том, как в домашних условиях выполнить биотест с помощью ампуллярий рассказано в следующих статьях: Биотестирование в домашних условиях, часть I. Биотестирование в домашних условиях, часть II (методика биотеста).
* Вот список некоторых научных публикаций:
1. Зайцева О.В., Ковалев В.В., Шувалова Н.Е. Современное биотестирование вод, требования к тест-организмам и тест-функциям с позиций сравнительной физиологии и физиологии адаптационных процессов. // Ж. эвол. биохим. и физиол. 1994, т.30, N 4, с.575 - 592. 2. Зайцева О.В., Ковалев В.В., Шувалова Н.Е. Экспресс-способ биотестирования пресных вод "Бегущая улитка". // Заявка на патент, № гос. рег. 92001891 от 19.10.92.3. Зайцева О.В., Ковалев В.В., Шувалова Н.Е. Исследование специфики нарушений процессов хеморецепции в поисковых поведенческих реакциях модельных объектов при действии различных доз основных классов токсикантов. // Сенсорные системы, 1993, т. 7, с. 78-82.4. Ковалев В.В., Кузнецова Е.Л., Шварц А.А., Шувалова Н.Е. Комплексная оценка качества подземных вод, используемых для питьевого водоснабжения. // Вестник СПбГУ, сер.7, 1997, вып.1, №7, с.28-36.5. Щербо А.П., Белкин А.С., Королькова С.В., Киселев А.В., Алейник С.Н., Ковалев В.В., Шувалова Н.Е., Витенберк А.Г., Новикайте Н.В. Новые подходы к оценке эффективности установок для автономной доочистки питьевой воды. // Эфферентная терапия, 1997, т.3, №1, с. 66 - 72. ".К тексту.
** Очень показателен случай с ПДК для ионов меди. В водопроводнойводе их может быть до 1 мг в литре. А в воде для выращивания рыбы только 0.001 + природный естественный фон. На практике это означает, что "водопроводный" ПДК по крайней мере раз в 10 выше рыбоводного. Пример с ионами меди я не случайно привел. Ведь медный купорос широко применяется для лечения аквариумных рыб. Он входит в целый ряд "лекарств", скажем, в ДИПРОВАН. Я сам никогда не рекомендую лечить рыбок медьсодержащими препаратами, так как результаты получаются очень нестабильные. Если в вашей местности природный фон ионов меди низкий, то вы отравите рыбу, даже если будете действовать строго по прописи. Но даже если сразу после лечения покажется, что все хорошо, то это только ПОКАЖЕТСЯ! В дальнейшем у этих рыб почти наверняка будет поражена печень. Улитки и гидры очень чувствительны к ионам меди и, как видно, неспроста. К тексту.
*** Сведения из "Нормативные данные по предельно допустимым уровням загрязнения вредными веществами объектов окружающей среды", Санкт-Петербург, 1994 г. К тексту.

aquariumok.ru
Биотестирование качества воды рек
Лазерная автодинная интерферометрия динамических параметров биообъектов
Для оценки степени загрязнения окружающей среды широкое применение могут найти методы, основанные на оценке физиологических параметров биологических тест-объектов. В качестве тест-объектов для контроля состояния водной среды используются пресноводные рачки дафнии (Daphnia magna Strauss). В работах показана сильная зависимость периода биений сердца дафнии от концентрации гидрохинона в водном растворе и установлено влияние концентрации фенола на частоту дыхания дафнии. Однако низкая чувствительность фотоэлектрических методов, используемых в отмеченных выше работах, и невозможность их использования при регистрации прошедшего через биообъект излучения не позволяли провести комплексные исследования изменения физиологических параметров тестируемых биообъектов.
С целью увеличения числа информативных параметров, характеризующих поведение дафний в токсичной среде, разработана методика, основанная на использовании эффекта автодинного детектирования в полупроводниковом лазере.
В основу метода регистрации динамического состояния тест - объектов положен принцип формирования сигнала внешнего автодетектирования при возвращении части отраженного от контролируемого объекта излучения в резонатор полупроводникового лазера. Для реализации метода использовалась установка (схема 1). Излучение полупроводникового лазера 7 (ИЛПН - 206), стабилизированного источником тока 8, фокусировалось линзой 6 в область сердца дафнии 4, помещенной в канал 3 на прозрачном столике 5. Для визуализации инфракрасного излучения полупроводникового лазера и его фокусировки в область сердца использовался прибор ночного видения 1. Часть излучения, отраженного от сердца дафнии, возвращалась в резонатор полупроводникового лазера, изменение выходной мощности которого регистрировалось фотодетектором 9. Сигнал с фотодетектора поступал через усилитель 10 и аналого-цифровой преобразователь 11 в компьютер 12. После вычисления спектра продетектированного сигнала с помощью метода быстрого преобразования Фурье определялся период колебаний сердца дафнии.

Схема 1. Экспериментальная установка для измерения частоты биений сердца дафнии
Частота сердцебиения дафний в контрольных условиях изменяется незначительно и стабилизируется после пятиминутной адаптации. Уменьшение частоты биений сердца дафнии регистрировалось для концентраций фенола, превышающих величину 1,2 тg/l. Наибольшее уменьшение частоты биений сердца дафнии наблюдалось для концентраций фенола 10 mg/l. При этом частота становилась равной 200 ударов в минуту в конце периода экспозиции.
Другими параметрами, которые могут быть зарегистрированы в схеме лазерной автодинной системы, являются амплитуда и форма про детектированного сигнала. Частота сердцебиения дафнии определялась по гармонике с максимальной амплитудой в заданном диапазоне изменений частоты вибраций биообъекта, а амплитуда колебаний - по набору спектральных гармоник. При наличии фенола в водной среде амплитуда биений сердца дафнии составила 0.2 μm, что существенно меньше амплитуды биений сердца дафнии в отсутствие фенола (0.4 μm).
Выживаемость и поведенческая активность Daphnia magna как критерий качества р. Протвы в районе г. Обнинска
Оценка качества воды в р. Протвы проводилась в рекреационной зоне г. Обнинска и санитарно-защитной зоне ФЭИ по выживаемости и поведенческой активности дафний . В качестве показателей в остром опыте учитывались поведенческие реакции. Оценка этого показателя может проводиться по балльной системе. Контролем служили показатели выживаемости дафний, помещенных в дехлорированную отстоянную водопроводную воду по 10 штук в стаканчики на 100 мл. Если гибель контрольных дафний в период испытаний превысила 10%, то опыт повторялся заново. Выживаемость и поведенческая активность дафний в исследуемой и контрольной воде в точках пробоотбора регистрировались через 15, 30, 45, 60 (1ч), 150, 1440 (1сут) минут.
По выживаемости и поведенческой активности дафний, по которым сделано заключение о классе качества воды р. Протвы.
Результаты показали, что сильно токсична вода в районе первого промканализационного сброса ФЭИ, а также в районе сброса городских сточных вод и плотины. Наблюдается тенденция к угнетению жизнедеятельности дафний за вторым промканализационным стоком ФЭИ. Пробы воды в районе промканализационных сбросов ФЭИ относятся ко второму классу загрязнённости воды, несмотря на то, что выживаемость дафний в этих точка 100%-ная, наблюдается угнетение активности, особи держатся в придонном слое, часть совсем теряет активность, наблюдаются случаи «вертячки». Не исключено, что загрязнение может вноситься в реку несанкционированными способами, например, объектом загрязнения на данном участки р. Протвы может оказаться д. Потресово, с ее выпасами скота, мытьем машин в реке, стиркой белья, сливом отработанной воды с огородов.
В районе первого сброса ГНЦ РФ ФЭИ, где идет строительство, хорошо коррелируют данные по выживаемости и поведению дафний (гибель 80%, случаи вертячки). Гибель дафний в пробах, отнесённых ко второму классу загрязнённости воды, не велика или практически отсутствует, зато повышение активности сменяется угнетением, дафнии периодически залегают на дно.
Экспериментальное биотестирование качества воды реки Днепр
В работе с использованием Daphnia magna Straus определена токсичность сточной воды сбрасываемой в р. Днепр водопользователями и воды самого водотока. Для опытов и использовали сточную воду, сбрасываемую в зимнее время с очистных сооружений г. Орши, Могилева, Речицы и речную воду с 9 створов, расположенных в районе выше указанных промышленных городов (выше городов – 5–12 км, ниже сброса с очистных сооружений – 0,5 км, ниже сброса с очистных сооружений – 4–5 км). Поставлено 14 хронических опытов с двукратной повторностью. Дня опытов использовали четырехдневную молодь дафний. Продолжительность опытов составляла 35 суток.
Определение степени токсичности воды р. Днепр и сточных вод, сбрасываемых водопользователями, проведенное в хронических опытах с дафниями и оцененное по 3-х бальной системе, показало токсичность сточной воды сбрасываемой г. Речица, где на 35 сутки отмечена 100% гибель рачков. Вредность воды для гидробионтов установлена и для сточной воды г. Могилева и створа 6, расположенного на расстоянии 4–5 км от сброса сточных вод. Выживаемость рачков на этих створах составила от 10 до 90% (табл. 2). На всех остальных створах, а также в сточной воде с очистных сооружений г. Орши, выживаемость рачков составила 100%, что согласно 3-х бальной системе оценки вода на этом участке чистая.
Таблица 2
Результаты биотестирования при определении хронического токсического действия воды р. Днепр на дафний
|
Створ, № |
Объем тестируемой воды, мл |
Исходное количество дафний, экз. |
Количество дафний в конце опыта |
% погибших |
Количество отродившейся молоди, экз |
| 1 | 300 | 5 | 5 | 0 | 535,5 |
| Сточная вода | 300 | 5 | 5 | 0 | 454,5 |
| 2 | 300 | 5 | 5 | 0 | 475,0 |
| 3 | 300 | 5 | 5 | 0 | 527,5 |
| 4 | 300 | 5 | 5 | 0 | 532,5 |
| Сточная вода | 300 | 5 | 4,5 | 10 | 686,5 |
| 5 | 300 | 5 | 5 | 0 | 662,5 |
| 6 | 300 | 5 | 4 | 20 | 499,5 |
| 7 | 300 | 5 | 5 | 0 | 489,5 |
| Сточная вода | 300 | 5 | 0 | 100 | 563,0 |
| 8 | 300 | 5 | 5 | 0 | 515,0 |
| 9 | 300 | 5 | 5 | 0 | 547,0 |
Загрязнение воды не оказывало отрицательного действия на плодовитость рачков. Средняя плодовитость дафний на загрязненных створах была более высокой, чем на чистых. В среднем плодовитость дафний составила на относительно чистых створах р. Днепр 95,0-107,0 экз./особь, что загрязненных – 103,0–140,8 экз./особь, что позволяет говорить, как об устойчивости крупных ракообразных к длительному воздействию малых доз токсических веществ, так и об антропогенном эвтрофировании воли тока, приводящее к увеличению численности гидробионтов.
Под влиянием антропогенного воздействия усиливается эвтрофирование водотока, проявляющееся в накоплении в воде биогенов (азота и фосфора), что способствует усилению продуцирования гидробионтов в реке.
По данным областного комитета охраны природных ресурсов, в Белгородской области накопилось огромное количество забракованных и неиспользованных пестицидов и химических удобрений, которые в силу различных объективных причин утратили свою ценность для сельского хозяйства, таких, как «Берием» - 11800 кг, «ДДТ» - 3700 кг, «Зеопас» - 1940 кг; «Гексатиурам» - 5027 кг, бочки с неизвестными ядами – 11400 кг, неизвестные сыпучие пестициды – 37000 кг, и др.. Для подтверждения гипотезы о возможности проникновения пестицидов из мини – контейнеров в окружающую водную среду было проведено биотестирование.
Методика эксперимента основана на определении изменений выживаемости тест – объектов – Daphnia Magna при воздействии токсических веществ, содержащихся в тестируемой воде по сравнению с контролем. Кратковременное тестирование до 96 часов позволяет определить острое токсическое воздействие воды на дафний по их выживаемости.
В ходе эксперимента было установлено, что уже через 1 час с момента посадки дафний во всех пробах, кроме контрольной, наступила 100% гибель дафний. В контрольном растворе все дафнии были живы в течение всего эксперимента, т.е. 96 часов.
Полученные результаты подтвердили предположение о вероятности проникновения пестицидов через бетонный барьер. С учётом малой толщины стенки мини – контейнеров в производственных условиях при толщине стенок 0,2 м процессы проникновения токсикантов и биокоррозии строительных материалов растянутся на годы, но опасность загрязнения окружающей среды захороненными пестицидами имеет высокую долю вероятности.
Оценка качества реки Волга методом биотестирования
Методом биотестирования было исследовано место сброса недостаточно очищенных сточных вод первых очистных сооружений (ОС) г. Волжска, в прибрежной зоне р. Волги, где находятся участки как с замедленным водообменом, так и с высокой скоростью течения. Были выбраны следующие точки отбора проб:

Рис. 5. Карта-схема района сброса сточных вод с городских сооружений г. Волжска.
В ходе эксперимента велась регистрация следующих показателей: выживаемость, плодовитость и физиологическое состояние дафний.
Выживаемость дафний в % в течение опыта.
| Дата наблюдения | 18.окт | 20.окт | 22.окт | 24.окт |
| Контроль | 100+0 | 100+0 | 100+0 | 100+0 |
| проба №1 | 100+0 | 94,43+6,8 | 88,89+13, | 83,3+11,7 |
| проба №2 | 100+0 | 88,87+6,8 | 88,87+6,8 | 83,3+0 |
| проба №3 | 100+0 | 100+0 | 100+0 | 94,4+6,82 |
| проба №4 | 100+0 | 94,43+6,8 | 88,9+13,6 | 88,9+13,6 |
| проба №5 | 100+0 | 100+0 | 94,43+6,8 | 88,87+6,8 |
| проба №6 | 100+0 | 94,4+6,82 | 94,4+6,82 | 94,4+6,82 |
| проба №7 | 100+0 | 94,4+6,8 | 94,43+6,8 | 94,43+6,8 |

Рис.6. Плодовитость дафний в исследуемых пробах воды.
Наибольшее количество органических и взвешенных веществ наблюдалось в пробе воды №4, где отмечалась самая высокая плодовитость дафний и самая низкая выживаемость. Всплеск рождаемости дафний в пробе № 4 объясняется тем, что повышенное содержание органических веществ стимулирует рождаемость дафний.
В месте сброса сточных вод (проба №5) ВЭМЗа вода относится к мезосапробной зоне по определительной таблице Л. С. Лесникова, выживаемость дафний на конец опыта составила 77%.
Исследования выявили значительную роль микрофитов (Chlorella vulgaris), прижизненных выделений макрофитов (рогоза узколистного Typha latifolia), совокупности природного планктона в регуляции выживаемости, репродуктивных процессов, токсикорезистентности водных ракообразных Daphnia magna в условиях пиретроидного загрязнения.
Наиболее высокое антитоксическое влияние на дафний проявили: сухое вещество хлореллы, совокупность живого природного планктона, полученная за счет его концентрирования с учетом средних значений объемов, процеживаемых дафниями за определенный промежуток времени, его сухого вещества, а также прижизненные выделения макрофитов (вода отбиралась из проточных зарослей). Коэффициенты выживаемости (КВ) на фоне дециса (1 мкг/л) достигали соответственно, 1.0, 0.79, 0.76, 0.59. В условиях традиционного биотестирования на отстоянной водопроводной воде на фоне дециса к концу эксперимента (15 суток) выживаемость дафний составляла 10% (КВ = 0.2). В более ранние (1 декада июня) и поздние (3 декада августа) сроки выявленная тенденция сохранялась, но была менее выражена, особенно в августе.
biofile.ru
Исследование бутилированных питьевых и минеральных вод методом биотестирования
Исследование бутилированных питьевых и минеральных вод
методом биотестирования
ВВЕДЕНИЕ
Человечество потребляет на свои нужды огромное количество пресной воды. Основными ее потребителями являются промышленность и сельское хозяйство.
В настоящее время оценка загрязнения окружающей среды (воды, почвы, воздуха) производится главным образом на основе результатов химического анализа. Однако из-за огромного числа видов самих загрязняющих веществ, источников и выбросов, а также сложности и высокой стоимости химических анализов организовать эффективный экологический мониторинг средствами аналитической химии практически нельзя. Это невозможно еще и потому, что химико-аналитический контроль не учитывает комбинированный характер действия загрязнителей, когда влияние каждого из них может дополнять, усиливать и подавлять друг друга.
Между тем, многие из перечисленных трудностей удается преодолеть, если в традиционную схему экологического контроля ввести методы биологического анализа. Эти методы основаны на регистрации суммарного действия на объект компонентов загрязнения, оценке экологических условий с помощью биологических индикаторов. Индикаторами является группа особей одного вида или сообщество, по наличию или состоянию, поведению которых судят о естественных или антропогенных изменениях в среде, в том числе о присутствии и концентрации загрязнителей. Таким образом, биоиндикаторы позволяют быстро и с минимальными затратами оценить, является ли анализируемая проба загрязненной или нет. Практически все современные технологии очистки воды, как правило, предназначены для удаления из воды как можно большего количества примесей. Одна из наиболее трудных проблем при проектировании системы очистки возникает при столкновении с микробиологическими загрязнениями, присутствующими либо в исходной воде, либо вносимых в очищенную воду в процессах ее дальнейшей обработки. Можно привести тысячи примеров, когда недооценка микробиологической опасности приводила к выходу из строя оборудования очистки воды.
Нами в качестве индикатора выбран кресс-салат (Lepidium sativum). Побеги и корни этого растения под действием загрязнителей подвергаются заметным морфологическим изменениям. Как биоиндикатор удобен ещё и тем, что действие стрессоров можно изучать одновременно на большом числе растений при небольшой площади рабочего стола. Привлекательны также весьма короткие сроки эксперимента. Семена кресс-салата прорастают уже на 3-4 день, и на большинство вопросов эксперимента можно получить ответ в течение 7 - 10 суток.
Целью работы явилось освоение методики биоиндикации и биотестирования.
Для достижения цели были поставлены задачи:
Освоить методы биотестирования по Lepidium sativum L
Провести оценку качества питьевых и минеральных вод для определения эффективности метода биотестирования с использованием Lepidium sativum L.
ОСНОВНАЯ ЧАСТЬ
Методика определения качества воды по показателям кресс-салата (Lepidium sativum L.)
В последнее время предлагается метод прорастания тест-растений в исследуемых водных средах. Широко используются семена кресс-салата. Сроки прорастания, интенсивность роста корешков и проростков легко определить визуально, что делает этот биотест удобным.
Оборудование и реактивы: семена кресс-салата (одинаковые по размеру, одного урожая), чашки Петри, пробы воды, линейка, бумага фильтровальная. Биотестирование проводят в чашках Петри по три повторности на каждую пробу. На дно вырезаются диски из фильтровальной бумаги, которые будут являться своеобразным субстратом. В каждую чашку на поверхность субстрата укладывают по 30 семян кресс- салата. Расстояние между соседними семенами должно быть по возможности одинаковым.
Семена покрывают такими же дисками из фильтровальной бумаги, какие были на дне чашки. Фильтровальную бумагу во всех чашках увлажняют исследуемой неразбавленной водой или талым снегом до появления признаков насыщения. Одна из проб с дистиллированной водой, не содержащая токсических соединений, является контрольной, по морфометрическим показателям кресс-салата, пророщенного в данной пробе, проводят сравнительный анализ с показателями фитотеста других исследуемых проб.
Чашки Петри этикетируют, закрывают и проращивают семена в термостатическом шкафу. В течение 7-10 дней следят за прорастанием семян, периодически увлажняя дистиллированной водой. Избыток воды удаляются ватой. Проращивание ведут в помещении при температуре 20-25˚С. Нормой считается прорастание 90-95 % семян в течение 3-4 суток. Процент проросших семян от числа посеянных называется всхожестью.
По истечению опыта измеряют показатели фитотеста: длину главного корня, длину побега, средний сухой вес, всхожесть, энергию прорастания, дружность прорастания (ПНД Ф Т 14.1:2:4.19-2013).
Результаты биотестирования бутилированных питьевых и минеральных вод
Мы сравнивали параметры развития Lepidium sativum L., при поливе бутилированными питьевыми водами «Горячий ключ», «Кубай», минеральными водами «Ессентукки -3», «Меркурий» и дистиллированной водой (контроль).
Бутилированная питьевая вода - пищевой продукт, представляющий собой воду, разлитую в стеклянные или пластиковые бутылки для розничного распространения. Главным отличием от минеральных вод является пониженное содержание солей (сухого остатка), а так же наличие действующих стандартов на общий состав и свойства (СанПин 2.1.4.1074-01 - для централизованных систем водоснабжения и СанПин 2.1.4.1116-02 - для вод расфасованных в емкости).
Для исследования была выбрана методика определения качества вод по измерению показателей всхожести семян, средней длины и среднего сухого веса проростков кресс-салата. Результатами практической работы мы стремились подтвердить возможность оценки качества питьевых и минеральных вод с помощью методов биотестирования с кресс-салатом.
Все исследования по теме проводились в дневное время, при сочетании искусственного и естественного освещения в стандартных, оптимальных для тест-растений условиях.
Таблица 1.
Измеряемые параметры Lepidium sativum L., сформировавшиеся под воздействием питьевых и минеральных вод
Наименование водыПараметры фитотеста
Длина главного корня, мм
Длина побега, мм
Вес, г
Количество листьев
Всхо-жесть, на 5 день,%
Энергия прорастания,%
Дружность прорастания,%
Горячий ключ
18,9 ± 0,94
5,7± 0,80
0,39± 0,19
3,4±0,16
48 ± 2,42
26 ± 1,29
26 ± 1,29
Кубай
24,5 ± 1,23
8,4± 0,43
0,43± 0,02
4,2±0,21
59 ± 2,95
25 ± 1,55
31 ± 1,55
Ессентукки
31,0± 1,55
12,2±0,47
0,41± 0,02
3,5±0,17
41±2,05
28 ± 1,32
28 ± 1,32
Меркурий
30,8±1,19
11,4±0,52
0,39±0,02
4±0,21
63±3,16
29 ± 1,43
29 ± 1,43
Дистиллированная вода (контроль)
28,3 ± 1,46
10±0,49
0,38± 0,02
3,9±0,19
63 ± 3,16
24 ± 1,21
24 ± 1,21
Согласно полученным данным длина корня и длина побега достигают максимума при использовании дистиллированной воды, а вес и количество листьев - при поливе минеральными. Это свидетельствует об эффективности используемой методики для первоначального мониторинга воздействия воды из различных источников.
Анализируя полученные результаты можно отметить высокие значения морфометрических параметров и параметров всхожести кресс-салата, проросшего на минеральных водах, что обуславливается относительно низким содержанием магния и хлора в составе комплекса основных ионов. Данные минеральные воды по ГОСТ Р 54316-2011 относятся к слабоминерализованным и маломинерализованным группам, чем также можно объяснить высокие средние значения длины главного корня, длины побега, веса и других параметров.
ВЫВОДЫ
Кресс-салат может быть с успехом использован для биотестирования питьевых и минеральных вод.
Возможно расширить изучаемые питьевые и минеральные воды. Рассмотреть питьевые и минеральные воды разных производителей.
Приложение
График 1. Параметры длины главного корня Lepidium sativum L., сформировавшиеся под воздействием питьевых минеральных вод
График 2. Параметры длины побега Lepidium sativum L., сформировавшиеся под воздействием питьевых и минеральных вод
График 3. Параметры веса семян Lepidium sativum L., сформировавшиеся под воздействием питьевых и минеральных вод
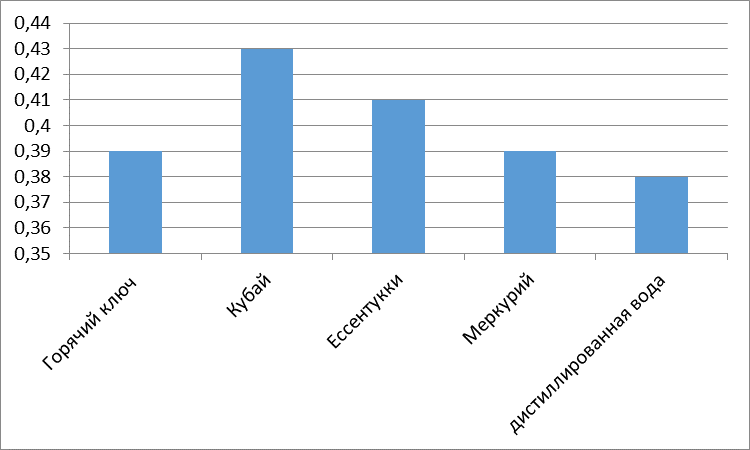
График 4. Количество листьев Lepidium sativum L., сформировавшиеся под воздействием питьевых и минеральных вод
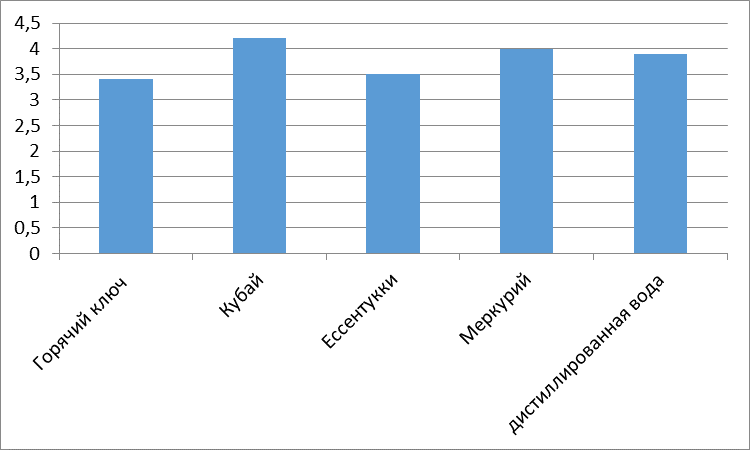
График 5. Параметр всхожести Lepidium sativum L., сформировавшийся под воздействием питьевых и минеральных вод
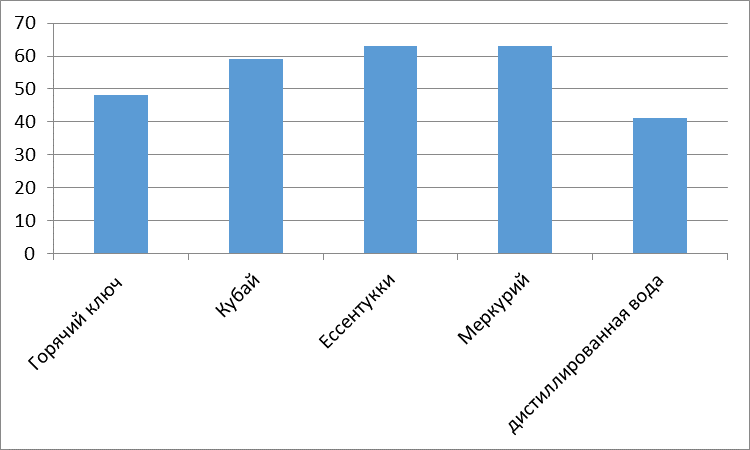
График 6. Параметр энергии прорастания Lepidium sativum L., сформировавшийся под воздействием питьевых и минеральных вод
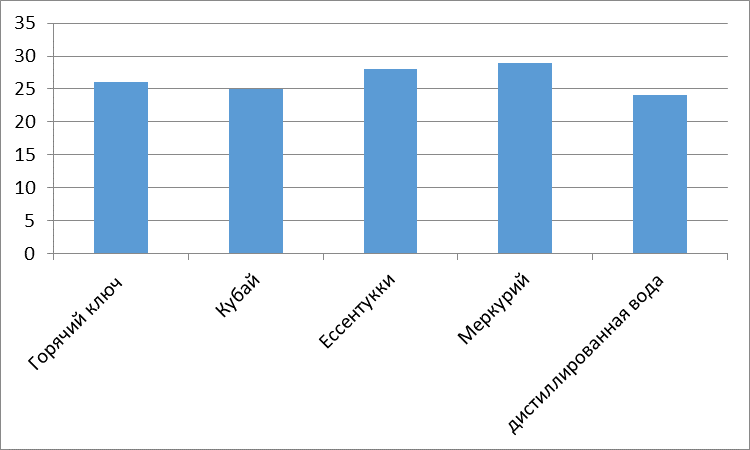
График 7. Параметр дружности прорастания Lepidium sativum L., сформировавшийся под воздействием питьевых и минеральных вод

infourok.ru











