Экология СПРАВОЧНИК. Химический потенциал чистой воды
Водный потенциал
Величину водного потенциала по найденной опытным путем неизменившейся концентрации рассчитывают по формуле (см. работу 10).[ ...]
Химический потенциал чистой воды всегда выше химического потенциала воды в клетке, поэтому значение водного потенциала всегда отрицательно. По величине водного потенциала определяют сосущую силу клетки, т. е. ее способность поглощать воду в каждый конкретный момент времени. Сосущая сила клетки меняется в зависимости от степени насыщения клетки водой — ее тургора.[ ...]
Вводные пояснения. Водный потенциал характеризует сосущую силу растительной ткани. Его определяют для того, чтобы вовремя уловить признаки обезвоживания растений и правильно вы брать .время полива.[ ...]
Следовательно, водпый потенциал — это п есть сила, которая вызывает поступление воды в клетку при данных условиях, со величине он равен сосущей силе, ио противоположен ей со зпаку. В етой связи направление движения воды определяется нарастанием сосущей силы шш увеличением отрицательного водного потенциала.[ ...]
Засоление приводит к созданию в дочве низкого водного потенциала, поэтому поступление воды в растение сильно затруднено. Важнейшей стороной вредного влияния солей является также нарушение процессов обмена. Работами советского физиолога Б. П. Строганова показано, что под влиянием солей в растениях нарушается азотный обмен, накапливается аммиак и другие резко ядовитые продукты. На фоне сульфатного засоления накапливаются продукты окисления серосодержащих аминокислот (сульфоксиды и сульфопы), которые также являются ядовитыми для растений. Повышенная концентрация солей, особенно хлористых, может действовать как разобщитель процессов окисления и фосфорилировапия о тем самым нарушать снабжение растепий макроэргическими фосфорными соединениями. Под влиянием солей происходят нарушения ультраструктуры клеток, в частности изменения в структуре хлоро-пластов. Особенно это проявляется при хлоридпоы засолении. Вредное влияние высокой концентрации солей связаио с повреждением поверхностных слоев цитоплазмы, вследствие чего возрастает ее проницаемость, теряется способность к избирательному накоплению веществ. Поскольку в бвлынинстве случаев засоленные почвы располагаются в районах, характерпзующвхся высокой летней температурой, интенсивность транспирации у растений очень высокая. В результате солей поступает много в ето усиливает повреждение растений.[ ...]
На каждом временном шаге в модели рассчитываются профили влажности и водного потенциала почвы по глубине, потоки между слоями почвенного, горизонта И количество свободной влаги на поверхности почвы, которая образуется при интенсивных осадках и поливах. При выпадении осадков часть влаги задерживается лиственным пологом. В результате этого в растительном покрове образуется дисперсно распределенная влага, которая значительно влияет на процессы энерго- и массообме-на и в конечном счете на фотосинтетическую активность посева. Поэтому процесс перехвата осадков также учитывается в модели.[ ...]
Поглощение воды корневой системой идет благодаря работе двух концевых двигателей водного тока: верхнего концевого двигателя, или присасывающей силы исларения (транспирации), и нижнего концевого двигателя, или корневого давления. Основной силой, вызывающей поступление и передвижение воды в растении, является присасывающая сила транспирации, в результате которой возникает градиент водного потенциала (с. 51). Водный потенциал—это мера энергии, используемой водой двя передвижения. Водный потенциал и сосущая сила одинаковы по абоолютпому значению, по противоположны по знаку. Чем меньше насыщенность водой данной системы, тем меньше (более отрицателен) ее водный потенциал. При потере воды растением в процессе транспирации создается ненасыщенность клеток листа водой, как следствие, возникает сосущая сила (водный потенциал падает). Поступление воды идет в сторону большей сосущей силы, или меньшего водного потенциала.[ ...]
Как уже упоминалось с термодинамической точки зрелая, направление движения воды определяется величиной водного потенциала (фв). Когда даыпая система (клетка) паходится в равновесии с частой водой, то ее водный потенциал (ф„) будет равен 0.[ ...]
Иногда говорят, что корни реагируют на различное содержание почвенной влаги и растут в сторону большего .водного потенциала. Это явление назвали гидротропизмом. Однако прямых данных, свидетельствующих об истинном гидротропизме у растений, пока нет. Другими словами, маловероятно, что корни способны обнаруживать и проявлять тропическую реакцию на градиент водного потенциала в окружающих их условиях.[ ...]
Таким образом, энергетическое состояние воды, способность совершать работу и ее подвижность определяются водным потенциалом. Водный потенциал чистой воды приравнивается к пулю. Всякое присутствие растворенных веществ в клеточпом соке уменьшает способность воды производить работу. При этом вода передвигается в сторопу меньшего (более отрицательного) водного потенциала. Тур горное дааленне увеличивает водпый потенциал внутри клетке и при максимальном растяжении клеточной оболочки делает его равным нулю (как в чистой воде), вода перестает поступать в клетку.[ ...]
Метод полосок основан на подборе наружного раствора такой концентрации, при погружении в который длина полоски растительной ткани не меняется. Если осмотический потенциал наружного раствора превышает водный потенциал ткани, то раствор отнимает воду от клеток, в результате их объем и длина полоски уменьшаются. Если осмотический потенциал раствора меньше водного потенциала ткани, то клетки, всасывая воду из раствора, увеличиваются в объеме и длина полоски возрастает. В растворе, где осмотический потенциал равен водному потенциалу ткани, длина полоски не изменяется.[ ...]
Когда растения попадают в условия засухи и содержание воды в них падает, наблюдается заметное и быстрое увеличение концентрации АВК в его побегах (рис. 5.30). Это накопление АБК в подвергнутых водному стрессу тканях скорее всего происходит в результате ее усиленного синтеза de novo из мевало-новой кислоты, а не в результате высвобождения АБК из ее эфира с глюкозой. По-видимому, не существует какого-то общего критического порогового уровня потери воды, после которого начинается синтез АВК, но обычно она начинает накапливаться, когда ВОДНЫЙ потенциал листьев (Элиста) снижается вдвое по сравнению с нормальным для дневного периода Жлиста. Как только водный стресс снимается (например, в результате полива), содержание АБК начинает уменьшаться главным образом за счет ее метаболического превращения в фа-зеевую и дигидрофазеевую кислоты, хотя часть АБК может образовать эфир с глюкозой (с. 114). Чем сильнее возрастает содержание АБК за время сухого периода, тем больше времени занимает возвращение ее содержания к исходному уровню.[ ...]
Таким образом, поступление воды в раствор через полупроницаемую перегородку обусловливается разностью между свободной анергией чистой воды п раствора и происходит по градиенту свободной гнергии воды или по градиенту водного потенциала. Движение молекул воды в раствор моншо приостановить, приложив к раствору определенное внешнее давление. Осмотическое давление раствора равно тому даелепшо, которое падо приложить к системе, чтобы предотвратить поступление в нее воды.[ ...]
Большое значение имеет содержание воды в почве, а также концентрация почвенного раствора. Естественно, вода поступает в корень только тогда, когда сосущая сила корпя больше сосущей силы почвы, иначе говоря, когда йодный потенциал корпя ниже водного потенциала почвы. Всякое уменьшение влажности почвы снижает поступление воды. Чем меньше воды в почве, тем с большей силой она удерживается и тем меньше ее водный потепциал. Для того чтобы в растение поступила водаа должен существовать градиент водного потенциала в системе почва — растение — атмосфера. Надо также учитывать, что уменьшение содержания воды в корне затрудняет ее дальнейшее продвижение к сосудам ксилемы. Это объясняется тем, что при уменьшении содержания воды сопротивление ее передвижению но клеткам корня растет. Подсыхающие клеточные оболочки оказывают значительное сопротивление аередвижешпо воды. Сопротивление корневой системы передвижению воды нри ее недостатке настолько велико, что, по мпениго Н. А. Максимова, это может снижать транспирацию, т. е. служит средством для ее регуляции.[ ...]
Блок, моделирующий движение воды в растении, служит для расчета скорости поглощения воды корнями и динамики функционирования усть-ичного аппарата. Поглощение воды корнями является в основном пассивным процессом, происходящим в результате внутренного водного дефицита, вызванного транспирацией. Наиболее важным факторами, регулирующими поглощение воды, является доступная почвенная влага, аэрация почвы, температура почвы и градиент водного потенциала на границе почва — корень.[ ...]
Иногда мелких ответвлении жплоп листа так много, что они подводят воду сочти к каждой клетке. Вся вода в клетке находится в раввовеспом состоянии. Иначе говоря, в смысле насыщенности водой, имеется равповесие между вакуолью, цитоплазмой и клеточной оболочкой, их водные потенциалы равны. В связи с этим, как только в силу процесса транспирации возникает ненасыщенпость водой клеточных степок паренхимных клеток, она сейчас же передается внутрь клетки, -водный потенциал падает, сосущая сила возрастает. Вода передвигается от клетки к клетке благодаря градиенту сосущей силы. По-видимому, передвижение воды от клетки к клетке в листовой паренхиме идет пе по симпласту, а в основпом по клеточным стенкам, где сопротивление значительно меньше.[ ...]
На призму рефрактометра стеклянной палочкой наносят по две капли сначала исходного, а потом соответствующего опытного растворов. Палочку и призму перед каждым новым определением протирают фильтровальной бумагой. Находят раствор, концентрация которого не изменилась после пребывания в нем опытных объектов. Если водный потенциал клеток листа больше осмотического потенциала одного раствора, но меньше другого, для расчета берут среднюю концентрацию этих двух растворов. Величину водного потенциала Ч-Гш рассчитывают по формуле (ом. работу 10).[ ...]
Было обнаружено, что воздействие различного рода стрессовых ситуаций, таких, как засуха, затопление корней или высокая засоленность почвы, приводит к быстрым и значительным изменениям в содержании эндогенных гормонов в растениях. Примерно за последние 10—15 лет удалось выяснить, что« фитогормоны вовлечены в регуляцию водного потенциала клеток и проницаемости клеточных мембран и, следовательно, регулируют содержание воды в тканях и фотосинтез. Такое открытие было довольно неожиданным, но если мы узнаем, каким образом фитогормоны регулируют содержание воды в растениях, то это найдет очень широкое применение в сельском хозяйстве и садоводстве, поскольку недостаток воды для культурных растений, по-видимому, служит основным ограничением в мировом производстве пищи.[ ...]
Работа верхнего концевого двигателя обусловлена испарением воды с поверхности листа (транспирацией). Присасывающее действие транспирации передается корням в форме гидродинамического натяжения, связывающего работу обоих двигателей. Работа верхнего концевого двигателя, основанная на использовании в качестве источника энергии солнечной радиации, регулируется автоматически (усиление потери влаги снижает водный потенциал испаряющих клеток, что ведет к усилению поступления в них воды). У хорошо облиственных растений присасывают...л сила транспирации во много раз превосходит силу корневого давления.[ ...]
Наибольшей сосущей силой клетка обладает при полном отсутствии тургора. В этот момент способность клетки насасывать воду определяется ее потенциальным осмотическим давлением. Тургорное давление — это сила, с которой насыщенное водой содержимое клетки давит на ее стенки. В состоянии полного насыщения клетки водой тургорное давление полностью уравновешивает осмотическое, и клетка перестает поглощать воду. Водный потенциал в этот момент равен нулю.[ ...]
Как известно, при температуре выше абсолютного 0°С все молекулы находятся в постоянном беспорядочном движении. Это показывает, что оки обладают определенной кинетической энергией. Благодаря постоянному движению при смешении двух жидкостей или двух газов их молекулы равномерно распределяются по всему доступному объему. Диффузия — это процесс, ведущий к равномерному распределению молекул растворенного вещества и растворителя. Диффузия всегда папраалепа от большей концентрации даппого вещества к меньшей, от системы, обладающей большей свободной энергией, к системе с меньшей свободной анергией. Свободной энергией называется часть внутренней энергии системы, которая может быть превращена в работу. Свободная энергия, отнесенная к 1 моль вещества, посит название химического потенциала. Таким образом, химический потенциан — это мера энергии, которую данное вещество использует па реакции или движение. Чем выше концентрация данного вещества, тем выше его активность и его химический потенциал. Вследствие отого передвижение вещества идет от большего к меньшему химиче-слому потенциалу. Наибольший химический потенциал у чистой воды. Добавление к воде молекул растворенного вещества уменьшает ее активность, се свободную эпергпю, ее химический потенциал. Для воды вводится понятие водного аотенциала. Водный потенциал ( ])) — вто способность воды в данной системе (в клетке) совершать работу но сравнению с той работой, которую совершана бы чистая вода. Когда система или клетка находится в равновесии с чистой водой, ее водный потенциал равен 0.[ ...]
Обострение экологических проблем при добыче нефти связывается в первую очередь с интенсификацией разработки месторождений. Так, в результате строительства обширного фонда скважин без учета требований по охране земель было осуществлено отчуждение значительных сельскохозяйственных площадей, а отсутствие мощностей по переработке попутного газа привело к необходимости его утилизации на факелах с выбросом значительных объемов загрязняющих веществ в атмосферу. Отрицательный экологический эффект имели также и некоторые технические и технологические решения, как, например, использование облегченных цементов (гель-цементов), крепление лишь продуктивных интервалов в разрезе скважин и др. В результате в регионе произошли загрязнение атмосферы и масштабные изменения качества поверхностных и подземных вод. Кроме того, большие объемы пресных поверхностных вод стали использовать в системе поддержания пластовых давлений, что привело не только к снижению водного потенциала республики, но и к исчезновению многих водотоков. Закачка пресных поверхностных вод, обогащенных кислородом, вызвала рост концентрации сероводорода в продуктивных горизонтах, что сказалось на агрессивных свойствах добываемых смесей.[ ...]
ru-ecology.info
| Термодинамические показатели водного режима: активность воды, химический и водный потенциалы. Методы определения водного потенциала.Энергетический уровень молекул данного вещества, который выражается в скорости их диффузии наз-ют химическим потенциалом этого вещества(ψ). Хим потенциал чистой воды называют водным потенциалом. (ψh3o) Он характеризует способность воды диффундировать, испаряться или поглощаться и выражается в Паскалях. Наивысшая величина водного потенциала – у хим. Чистой воды, эта величина принята за нуль. Поэтому водный потенциал любого раствора и биологической жидкости имеет отрицательное значение. Водный потенциал складывается из осмотического потенциала ψs, потенциала давления ψp, гравитационного потенциала ψg, потенциала набухания биоколлоидов. Для оценки степени участия воды в различных химических, биохимических и микробиологических реакциях широко применяют показатель активность воды aw, определяемый как отношение парциального давления паров воды над продуктом к парциальному давлению пара над чистой водой. Показатель «активность воды» был предложен У. Скоттом в 1953 г. и в настоящее время широко применяется на практике. Методы определения водного потенциала: Метод Шардакова основан на подборе раствора, удельный вес, а соответственно и концентрация которого не изменяется после пребывания в нем растительных тканей в течении 20 минут. В этом случае величина осмотического потенциала раствора равна по модулю потенциалу растения.
Силу с которой вода входит в клетку, называют сосущей силой S. Она тождественна водному потенциалу клетки(ψh3o). Величина сосущей силы определяется осмотическим давлением П* клеточного сока и тургорным (гидростатическим) давлением в клетке(Р), которое равно противодавлению клеточной стенки, возникающему при ее эластическом растяжении. S=П*-Р При замене этих обозначений соответствующими термодинамическими величинами уравнение приобретает следующий вид: -ψh3o=-ψп-ψр В условиях разной оводненности соотношения между всеми компонентами этого уравнения меняются. Когда клетка полностью насыщена водой(полностью тургесцентна), ее сосущая сила равна нулю, а тургорное давление равно потенциальному осмотическому: S=0, П*=Р. Состояние полного тургора наблюдается в клетке при достаточной влажности почвы и воздуха. Если подача воды к клетке уменьшается (при усилении ветра, при недостатке влаги в почве и т.д.), то вначале возникает водный дефицит в клеточной стенке, водный потенциал которых становится ниже, чем в вакуолях, и вода начинает перемещаться в клеточные стенки. Отток воды из вакуолей снижает тургорное давление в клетке и следовательно увеличивает их сосущую силу. При длительном недостатке влаги большинство клеток теряет тургор и растение повядает. В этих условиях Р=0, S=П*. Метод определения сосущей силы: Определение методом полосок (по Лилиенштерн) Принцип метода основан на подборе такой концентрации наружного раствора, при которой погруженные в раствор полоски растительной ткани не меняют своей длины, так как в поступлении воды наступает динамическое равновесие и объем клеток остается неизменным. При более высокой концентрации раствора длина полосок уменьшается. Если осмотическое давление меньше величины сосущей силы клетки, то клетка всасывает воду из раствора, увеличивается в объеме и длина полосок становится больше.
В растворах содержащих ионы структура воды существенно меняется. В разбавленных растворах ( В белках гидратация обусловлена взаимодействиями молекул воды с гидрофильными (ионными и электронейтральными) и гидрофобными (неполярными) группами и ее иммобилизацией в замкнутых пространствах внутри макромолекул при их конформационных перестройках. При ионной гидратации(взаимодействие с -Nh4, -СОО группами) и электронейтральной(с -СООН, -ОН, -СО, -NH) молекулы воды электростатически связываются и образуется мономолекулярный слой первичной гидратации. Число ионнизированных групп в белке зависит от рН среды. Наименее гидратирован белок в его изоэлектрической точке, при которой отмечается также самая низкая растворимость белков. Иммобилизованная вода, оказавшаяся замкнутой внутри макромолекул, может участвовать в образовании слоя первичной гидратации, а остальная ее часть сохраняет свойства обычной воды, но с ограниченной подвижностью Свободная вода легко передвигается по растению и испаряется. Она находится в основном в межклетниках, т. е. в свободном пространстве. Связанная вода испаряется и передвигается с трудом. Она находится преимущественно внутри клетки — в цитоплазме и вакуоли. Разделяется на осмотически и коллоидно связанную. Первая соединена с растворенными в ней веществами и находится в вакуоли. Эта связь не очень прочная, и осмотически связанная вода может выходить из клетки, например, при плазмолизе. Свойства коллоидно связанной воды обусловлены наличием белков — коллоидов цитоплазмы, где она и находится. Такая связь большей частью очень прочная, и коллоидно связанная вода выходит из клетки только при очень сильном обезвоживании (продол. засухе).
Роль этого органа прежде всего заключается в том, что благодаря огромной поверхности обеспечивается поступление воды в растение из почвы. Сформировавшаяся корневая система представляет собой сложный орган с хорошо дифференцированной внешней и внутренней структурой. Корневой чехлик служит защитой для точки роста. Клетки корневого чехлика слущиваются, что уменьшает трение и способствует проникновению корня в глубь почвы. Под корневым чехликом расположена меристематическая зона. Меристема состоит из многочисленных мелких, усиленно делящихся, плотно упакованных клеток, почти целиком заполненных цитоплазмой. Следующая зона — зона растяжения. Здесь клетки увеличиваются в объеме (растягиваются). Затем следует зона корневых волосков. При дальнейшем увеличении возраста клеток, а также расстояния от кончика корня, корневые волоски исчезают, начинается кутинизация и опробковение клеточных оболочек. Поглощение воды происходит главным образом клетками зоны растяжения и зоны корневых волосков. Некоторое количество воды может поступать и через опробковевшую зону корня. Это главным образом наблюдается у деревьев. В этом случае вода проникает через чечевички. Строение корня в зоне корневых волосков. Поверхность корня в этой зоне покрыта ризодермой. Это однослойная ткань с двумя видами клеток, формирующими и не формирующими корневые волоски. В настоящее время показано, что клетки, формирующие корневые волоски, отличаются особым типом обмена веществ. Кора состоит из нескольких слоев паренхимных клеток. Важной особенностью коры является развитие системы крупных межклетников. На границе коры и центрального цилиндра развивается один слой плотно прилегающих друг к другу клеток — эндодерма, для которой характерно наличие поясков Каспари. Цитоплазма в клетках эндодермы плотно прилегает к клеточным оболочкам. По мере старения вся внутренняя поверхность клеток эндодермы, за исключением пропускных клеток, пропитывается суберином, что не позволяет передвигаться воде и растворенным в ней веществам. Поступление воды и растворенных веществ в корни через биологические мембраны осуществляется благодаря таким процессам как осмос, диффузия и активный транспорт. Осмос – диффузия воды через мембрану. Диффузия – проникновение веществ через мембрану по градиенту концентрации (из области где их концентрация выше, в область, где их концентрация ниже). Диффузный транспорт веществ воды и ионов осуществляется при участии белков мембраны, в которой имеются молекулярные поры, либо при участии жирорастворимых веществ. Активный транспорт – перенос веществ против их градиента концентрации, связанный с затратами энергии. Он осуществляется специальными белками-переносчиками, которые образуют ионные насосы. Из клеток с корневыми волосками водный раствор просачивается в клеточные поры корня и далее из клетки в клетку попадает в сосуды. По сосудам корня вода с растворенными веществами поднимается в стебель, а по сосудам стебля – почкам, листьям, цветкам. В почве вода находится в разных физических состояниях: жидком, газообразном (водяной пар), твердом (лед), химически и физико-химически связанном с другими веществами и твердыми минеральными, органическими и органо-минеральными частицами. Зависимости от физического состояния и характера связей воды в почвенном среде различают категории, формы и виды грунтовой воды. В почве выделяют следующие категории воды: • химически связанная вода, входящая в состав других веществ (например, гипса) и недоступна для использования растениями; • жесткая вода (лед) - находится в этом состоянии по низкой (отрицательной) температуры и недоступна для растений, однако становится доступной после таяния; • водяной пар, содержащийся в почвенном воздухе и после конденсации становится доступной для растений; • прочно связанная вода, которая содержится адсорбционными силами на поверхности частиц почвы в виде пленки толщиной в два-три диаметра молекул воды, находится в газообразном состоянии (водяной пар) и недоступна для растений; • непрочно связанная вода, которая представляет собой пленки влаги вокруг частичек грунта толщиной до 10 диаметров молекул воды, перемещается между грунтовыми частицами под воздействием сорбционных сил и является труднодоступной для растений; • свободная вода, которая не связана молекулярными силами с частицами почвы, поэтому свободно или под влиянием менисковых сил движется в грунтовых порах и доступна для растений.
Плач растений. — Под этим названием известно выделение водянистого сока из древесины растений при поранении их, напр., при просверливании отверстий в стволе или при отрезании ветвей или целого стебля. «Плач» находится в связи с током почвенной воды, поднимающимся по древесине. Особенно энергично П. происходит весною, до распускания почек; (так наз. весенний П.). В это время с пробуждением жизни в растении начинается поднятие воды, а между тем, при отсутствии листьев испарение ее еще очень слабо. Растение наливается поэтому водою, и если в это время просверлить в стволе, напр., березы или клена, отверстие, то из него в изобилии будет выделяться водянистый сок — пасока. Выделение ее происходит со значительною силою, различною, смотря по растению и условиям. По химическому составу пасока представляет водный раствор различных органических (плодовый или тростниковый сахар, белки, органические кислоты) и минеральных веществ. Присутствие этих веществ объясняется тем, что на зиму древесные породы наполняются питательными запасами, которые весною подвергаются растворению и вместе с почвенною водою, всасываемою корнями, передвигаются по древесине в развивающиеся почки. Если же удалить всю облиственную (испаряющую) часть растения, срезав его под корень, то пенек сначала всасывает воду, но через некоторое время, если почва достаточно влажна, начинает выделять ее. Это так назыв. летний П. Летняя пасока не содержит уже органических веществ и представляет чистый раствор почвенных минеральных солей. Гуттациявыделение листьями растений капельножидкой воды. Происходит, когда корнями поглощается водыбольше, чем испаряется листьями. Г. наблюдается большей частью ночью, рано утром или при помещениирастений во влажную атмосферу; часто отмечается у молодых проростков, например злаков, развитиекорневой системы у которых обгоняет развитие испаряющей поверхности листьев. Капельки водывыделяются через Водяные устьица под воздействием корневого давления, с силойнагнетающего воду в стебли и листья. Г. -физиологический процесс, связанный с жизнедеятельностьюрастения: если проростки пшеницы поместить под колпак, внутри которого находятся пары хлороформа, тоГ. прекращается. Выделения при Г. всегда содержат ряд минеральных веществ. Очевидно, Г. освобождаетрастение от избытка солей, главным образом кальция. Выделение жидкости идет через специальные водные устьица – гидаторы.
Кутикулярная транспирация Снаружи листья имеют однослойный эпидермис, внешние стенки клеток которого покрыты кутикулой и воском, образующие эффективный барьер на пути движения воды. На поверхности листьев часто развиты волоски, которые также влияют на водный режим листа, так как снижают скорость движения воздуха над его поверхностью и рассеивают свет и тем самым уменьшают потери воды за счет транспирации.Интенсивность кутикулярной транспирации варьирует у разных видов растений. У молодых листьев с тонкой кутикулой она может составлять около половины всей транспирации. У зрелых листьев с более мощной кутикулой кутикулярная транспирация равна 1/10 общей транспирации. В стареющих листьях из-за повреждения кутикулы она может возрастать. Таким образом, кутикулярная транспирация регулируется главным образом толщиной и целостностью кутикулы и других защитных покровных слоев на поверхности листьев. Кутикулярная транспирация обычно составляет около 10% от общей потери воды листом. Устьичная транспирация Основная часть воды испаряется через устьица. Устьица играют важную роль в газообмене между листом и атмосферой, так как являются основным путем для водяного пара, углекислого газа и кислорода. Устьица находятся на обеих сторонах листа. Есть виды растений, у которых устьица располагаются только на нижней стороне листа. В среднем число устьиц колеблется от 50 до 500 на 1 мм². Транспирация через устьица идет почти с такой же скоростью, как и с поверхности чистой воды. Это объясняется законом И. Стефана: через малые отверстия скорость диффузии газов пропорциональна не площади отверстия, а диаметру или длине окружности. Поэтому, хотя площадь устьичных отверстий мала по отношению к площади всего листа (0,5-2 %), испарение воды через устьица идет очень интенсивно Количественные показатели транспирации: Интенсивность транспирации – это количество, г, воды, испаряемой растением в единицу времени (ч) с единицы поверхности (дм 2 ). При определении продукционных характеристик рассчитывают ко- личество воды, израсходованной растением за весь вегетационный период, и относят его к сухой массе всего растения. Транспирационный коэффициент – это количество воды (г), расходуе- мой растением на образование 1 г сухого вещества. Сутчный ход транспирации. У всех растений наблюдается периодичность суточного хода транспирации. У деревьев, теневых растений злаков (гидростабильные виды) испарение воды достигает максимума до наступления максимума дневной температуры. В полуденные часы транспирация падает. Вечером, при снижении дневных температур транспирация снова увеличивается. Такой ход транспирации приводит к незначительным изменениям осмотического давления и содержания воды в клетках в течение дня. У видов, способных переносить резкие изменения содержания воды в клетках в течение дня, транспирация повышается в полдень и падает ночью (гидролабильные виды) Закрывание устьиц в полдень может быть вызвано увеличением уровня углекислого газа в листьях при повышении температуры воздуха (усиление дыхания и фотодыхания), а также возможным водным дефицитом, возникающим в тканях при высоких температурах и низкой влажности воздуха. Это приводит к повышению концентрации АБК и закрыванию устьиц. На поступление воды в растение оказывают влияние внешние условия. 1. Температура. Поступление воды в растение зависит от температуры. С понижением температуры скорость поступления воды сокращается. Это может происходить в результате следующих причин: а) повышается вязкость воды и снижается ее подвижность; б) Тормозится рост корней; в) Уменьшается скорость метаболических процессов; 2. Снижение аэрации почвы (повышение углекислого газа) Повышение концентрации углекислого газа приводит к повышению вязкости воды и снижает проницаемость цитоплазмы. 3. Содержание воды в почве, концентрация почвенного раствора. Вода поступает в корень, если водный потенциал корня ниже, чем водный потенциал почвы. На засоленных почвах или на почвах, где концентрация почвенного раствора очень высокая, водный потенциал почвы ниже. Поэтому вода начнет выделяться из корня. У растений, произрастающих на этих почвах - галофитах, в процессе эволюции выработался такой приспособительный признак как высокая концентрация клеточного сока. Это обуславливает более низкий водный потенциал клеточного сока, вследствие чего вода из почвенного раствора поступает в корни. |
Химический потенциал
Химический потенциал чистой воды всегда выше химического потенциала воды в клетке, поэтому значение водного потенциала всегда отрицательно. По величине водного потенциала определяют сосущую силу клетки, т. е. ее способность поглощать воду в каждый конкретный момент времени. Сосущая сила клетки меняется в зависимости от степени насыщения клетки водой — ее тургора.[ ...]
В процессе обмена веществ химическая энергия пищи и кЛ еточных веществ трансформируется таким образом, чтобы клетки и органы могли выполнять свою функцию, проявлять свою работоспособность. При этом в процессе трансформации происходит падение химического потенциала свободной энергии (суммарное).[ ...]
Согласно Гинзбурга-Ландау, по мере повышения потенциала в сверхпроводящей нити появляется электрическое поле Е=-УФ и нормальный ток П=Е. При этом растет разность фаз сверхпроводящего упорядочения между точками нити х1 и х2, что приводит к сгущению витков, изображенных на рис. 4.4, а градиент фазы определяет скорость сверхтекучего движения электронов, которая не должна превышать критическую. Уменьшение числа витков достигается при обращении модуля параметра порядка в нуль. В этот момент происходит сброс фазы на 2л. Данное состояние получило название центров проскальзывания фазы (ЦПФ). Численный анализ, проведенный в работе [6], показывает, что при достаточно малых значениях транспортного тока решения уравнения Гинзбурга-Ландау для нестационарного случая начинают зависеть от времени, При этом все параметры сверхпроводника, в том числе сверхтекучий импульс О, химический потенциал ш, плотность нормальных электронов п, сверхтекучих электронов и др. испытывают колебания во времени вблизи ЦПФ.[ ...]
| Пространственное распределение неравновесного химического потенциала и сверхтекучего импульса в моменты времени обращения сверхпроводящего тока в нормальное значение (1 - минимальное значение 2 - момент, когда ^ =0; 3,5,6 - моменты, соответствующие обращению ^ в нуль, причем в момент 5 ^ —>+0, а в момент 6 ^ ->-0. В момент времени 5 значение 0=+°°, а в момент 6 значение (2=-°°, в эти моменты |1 принимает значение ±°° | 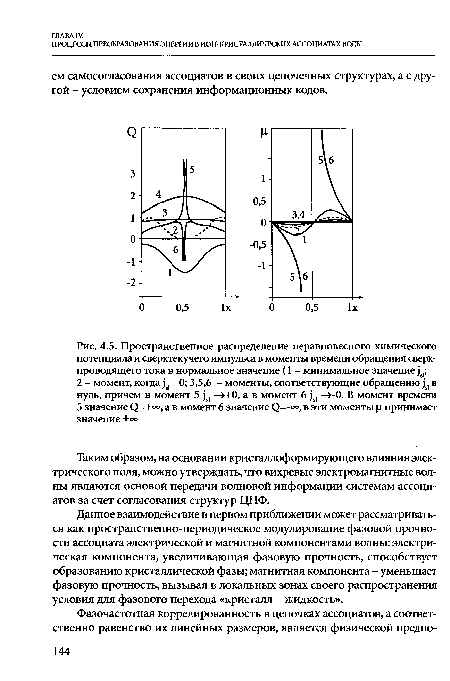 |
Массовлагообменные характеристики: форма, вид и энергия связи влаги, химический потенциал переноса влаги, наличие и свойства связующего, коэффициент массовлагопереноса, массоемкость (влагоемкость), растворимость, гигроскопичность, смачиваемость.[ ...]
Движущей силой процесса сорбции из водных растворов является градиент химического потенциала сорбата. По достижении равенства химических потенциалов последнего в объеме раствора и в сорбенте наступает химическое равновесие. Лимитирующее влияние на скорость сорбции оказывают подвод сорбируемого вещества к зерну сорбента (внешний массоперенос) и перемещение его молекул внутри зерна пористого сорбента (внутренняя диффузия). Обычно во всех аппаратах и сооружениях сорбционной очистки воды путем турбулизации потоков и интенсивного подвода новых порций воды снимаются внешнедиффузионные ограничения, а единственной стадией, лимитирующей кинетику, является перенос вещества в транспортных порах, равномерно распределенных по всему объему зерна сорбента. Собственно акт сорбции — заполнение микропор — происходит столь быстро, что не влияет на кинетику процесса в целом [44, с. 36].[ ...]
Как видно из изложенного, условием выделения новой фазы является кроме превышения химического потенциала выделяющегося вещества в старой фазе его химического потенциала в новой фазе преодоление сил поверхностной энергии. Поэтому, несмотря на наличие пересыщенной среды, для образования новой фазы необходимо, чтобы из-за флюктуаций произошло скопление достаточно большого числа молекул новой фазы.[ ...]
Окисление иодид-иона до иода вызывается не только хлором. В зависимости от концентрации и химического потенциала окисление вызывают все окислители. Точность метода (данные только метода прямого титрования) Лаборатория мониторинга и защиты окружающей среды США оценила метод иодометрического титрования, используя оксид фениларси-на в качестве стандартного восстановителя тиосульфата натрия.[ ...]
В отличие от этого процесс активного транспорта протекает в направлении, обратном градиенту химического потенциала соответствующего вещества, и поэтому требует затрат энергии. АТФ-аза активируется двухвалентными катионами, одновалентные ионы могут способствовать дальнейшей активации ферментов.[ ...]
Нижняя зона включает водоносные горизонты и комплексы, содержащие напорные воды. Гидрогеохимические сорбционные системы ’’вода — порода” этой зоны находятся в условиях относительно постоянных градиентов химического потенциала, они обычно являются равновесными, для них характерно отсутствие источников возобновляемых сорбентов, старение колоидов, заполнение сорбционной емкости поглощающего комплекса. Ионообменные процессы в этой зоне приобретают геохимическое значение только в тех случаях, когда в системе ’’вода — порода” возникают новые градиенты химического потенциала, вызываемые изменениями химического состава подземных вод и их скоростей фильтрации. Такая ситуация, например, возникает при внедрении подземных вод НС03-Са состава в водоносные горизонты краевых прогибов и межгор-ных впадин, сложенные мелкодисперсными породами морского происхождения, в поглощающем комплексе которого преобладает натрий. В этом случае осуществляются реакции катионного обмена 2На+Порода + + Са2з0да = 2Ыавода + Са2города- В итоге формируются подземные воды НСОз-Ыа состава. Аналогичная геохимическая ситуация может возникать при промывке солончаковых почв, в поглощающем комплексе которых преобладает натрий, водами НС03-Са состава.[ ...]
Наконец, имеется мпекие, что наряду с осмотическим давлелпем и давлением пабухаиия существует еще активное поступление воды в клетки.[ ...]
Верхняя зона включает кору выветривания, где происходит постоянное обновление и образование новых сорбентов с высокими сорбционными емкостями (различные глины, гидроксиды железа и марганца, карбонаты у кальция и пр.). Сорбционные системы этой зоны формируются в условиях изменяющихся градиентов химического потенциала в системе ’’вода — порода”, вызываемых вариациями химического состава подземных вод и скоростей их движения. Эти системы являются неравновесными, неупорядоченными, с постоянно обновляющимися возможностями для сорбции и ионного обмена. В этой зоне геохимическое влияние сорбционных процессов на формирование химического состава подземных вод (особенно его микрокомпонентной части) является значительным.[ ...]
Взаимодействие адсорбированных молекул на поверхности раздела фаз, приводящее к их ассоциации, — явление широко распространенное. Ассоциация ионов или молекул ПАВ в присутствии воды имеет существенные особенности по сравнению с ассоциацией газов и паров. Ассоциация ПАВ обусловлена увеличением химического потенциала, выражающего тенденцию выхода компонента из водного окружения в жидкую «нсевдофазу». Стремление к уменьшению свободной энергии приводит к определенной ориентации ассоциированных молекул, уменьшающей разность полярностей, в результате чего ассоциат покрыт оболочкой из гидрофильных групп и имеет определенный конечный фактор ассоциации. Эго одна из существенных особенностей ассоциации ПАВ. Вторая заключается в том, что ассоциация наступает при определенной критической концентрации раствора. Эти особенности позволяют построить следующую модель строения адсорбционного слоя ПАВ с учетом ассоциации.[ ...]
Поглощение питательных веществ клеткой может быть пассивным и активным. Пассивное поглощение — это поглощение, не требующее затраты энергии. Оно связапо с процессом диффузии и идет по градиенту концентрации данного вещества. Как уже рассматривалось выше см. с. 46), с термодинамической точки зрения направление диффузии определяется химическим потенциалом вещества. Чем выше концентрация вещества, тем выше его химический потенциал. Передвижение идет в сторону меньшего химического потенциала. Необходимо отметить, что направление движения ионов определяется пе только химическим, но также электрическим потенциалом. Иопы, обладающие разноименным зарядом, могут диффундировать через мембрану с разпой скоростью. Благодаря этому создается разность потенциалов, которая, в свою очередь, может служить движущей силой поступления противоположно заряженного иоиа. Электрический потенциал может также возникать в результате неравномерного распределения зарядов в самой мембране. Таким образом, пассивное передвижение иопов может идти по градиенту химического и электрического потенциала.[ ...]
Подвижность, как правило, характеризуют интенсивным и экстенсивным показателями. Интенсивным показателем подвижности тяжелого элемента или соединения служит концентрация или активность элемента в почвенном растворе или в близкой ему по составу водной вытяжке из почв и грунта. В качестве интенсивного показателя используется также изменение свободной энергии Гиб-бса или химический потенциал компонента. Экстенсивным показателем является содержание тех соединений в твердой фазе почвы, которые обеспечивают данную концентрацию элемента в почвенном растворе. В некоторых случаях в качестве показателя подвижности используется потенциальная буферная способность почв по отношению к изучаемому элементу. Она характеризует способность почвы и грунта противостоять изменению подвижности ТМ [33].[ ...]
Термодинамические свойства веществ, находящихся в растворе, отличаются от соответствующих характеристик вещества в чистом состоянии. Для характеристики поведения такого вещества в растворе вводят парциальные молярные величины. Молярной долей i компонента в растворе Ni называют отношение числа молей этого компонента к сумме молей всех компонентов раствора, включая /. К важнейшим для термодинамических расчетов парциальным молярным величинам относится парциальная молярная энергия (Gi). Эту величину часто называют химическим потенциалом. Величина химического потенциала отражает тенденцию данного вещества покинуть фазу, в которой оно находится. Изменение свободной энергии или химического потенциала при переходе какого-либо компонента в раствор определяется через его термодинамическую активность (ш).[ ...]
Более значимыми факторами, влияющими на соответствие расчетных и реальных распределений компонентов в подземных водах, являются внешние условия формирования подземных вод, такие, как скорость их фильтрации и величина Т:Ж в системе ’’вода — порода”. Важность зтих условий состоит в том, что они определяют степень приближения отдельных частиц гидрогеохимических систем к состояниям частичного равновесия. Установлено [7], что чем меньше скорость фильтрации подземных вод и чем больше величина Т:Ж, тем большее число частных гидрогеохимических систем оказываются приближенными к состояниям химического равновесия. Причина заключается в том, что изменения этих факторов в указанных направлениях ведут к выравниванию градиента химического потенциала в системе ’’вода — порода”. Соответственно увеличивается и степень сходимости расчетных и реальных распределений компонентов. При этом каждая частная гидрогеохимическая система имеет свои оптимальные геохимические и гидродинамические условия приближения к равновесным состояниям. Следовательно, возможности прогноза изменения химического состава подземных вод, основанного на методах равновесной химической термодинамики, ограничены только определенными геохимическими и гидродинамическими условиями, различными для разных частных гидрогеохимических систем.[ ...]
Рассмотрим влияние изменения растворимости от температуры на адсорбцию. Поскольку адсорбция — экзотермический процесс, повышение температуры должно вызывать уменьшение адсорбции. Это действительно всегда наблюдается при адсорбции газов и паров. При адсорбции из растворов, однако, не меньшую роль играет и то, как температура влияет на растворимость вещества. Если растворимость адсорбтива с повышением температуры увеличивается, адсорбция должна уменьшаться. При падении растворимости с нагреванием раствора адсорбция будет увеличиваться. Наложение этих двух факторов (экзотермичности процесса адсорбции и изменения химического потенциала раствора с изменением растворимости избирательно адсорбирующегося компонента) определяет суммарное влияние температуры на равновесие при адсорбции из растворов.[ ...]
Как известно, при температуре выше абсолютного 0°С все молекулы находятся в постоянном беспорядочном движении. Это показывает, что оки обладают определенной кинетической энергией. Благодаря постоянному движению при смешении двух жидкостей или двух газов их молекулы равномерно распределяются по всему доступному объему. Диффузия — это процесс, ведущий к равномерному распределению молекул растворенного вещества и растворителя. Диффузия всегда папраалепа от большей концентрации даппого вещества к меньшей, от системы, обладающей большей свободной энергией, к системе с меньшей свободной анергией. Свободной энергией называется часть внутренней энергии системы, которая может быть превращена в работу. Свободная энергия, отнесенная к 1 моль вещества, посит название химического потенциала. Таким образом, химический потенциан — это мера энергии, которую данное вещество использует па реакции или движение. Чем выше концентрация данного вещества, тем выше его активность и его химический потенциал. Вследствие отого передвижение вещества идет от большего к меньшему химиче-слому потенциалу. Наибольший химический потенциал у чистой воды. Добавление к воде молекул растворенного вещества уменьшает ее активность, се свободную эпергпю, ее химический потенциал. Для воды вводится понятие водного аотенциала. Водный потенциал ( ])) — вто способность воды в данной системе (в клетке) совершать работу но сравнению с той работой, которую совершана бы чистая вода. Когда система или клетка находится в равновесии с чистой водой, ее водный потенциал равен 0.[ ...]
ru-ecology.info
| Как известно, при температуре выше абсолютного нуля все молекулы находятся в постоянном беспорядочном движении. Это показывает, что они обладают определенной кинетической энергией. Благодаря постоянному движению при смешении двух жидкостей или двух газов их молекулы равномерно распределяются по всему доступному объему. Диффузия — это процесс, ведущий к равномерному распределению молекул растворенного вещества и растворителя. Как всякое движение, диффузия требует энергии. Диффузия всегда направлена от большей концентрации данного вещества к меньшей, от системы, обладающей большей свободной энергией, к системе с меньшей свободной энергией. Свободной энергией называется часть внутренней энергии системы, которая может быть превращена в работу. Свободная энергия, отнесенная к 1 молю вещества, носит название химического потенциала. Таким образом, химический потенциал — это мера энергии, которую данное вещество использует на реакции или движение. Химический потенциал — функция концентрации. Скорость диффузии зависит от температуры, природы вещества и разности концентраций. Чем выше концентрация данного вещества, тем выше его активность и его химический потенциал. Диффузионное передвижение вещества всегда идет от большего к меньшему химическому потенциалу. Наибольший химический потенциал у чистой воды. Добавление к воде молекул растворенного вещества приводит к возникновению связи между молекулами воды и растворенного вещества, что уменьшает ее активность, ее свободную энергию, ее химический потенциал. В том случае, если диффундирующие вещества встречают на своем пути мембрану, движение замедляется, а в некоторых случаях прекращается. Диффузия воды по направлению от своего большего к меньшему химическому потенциалу через мембрану носит название осмоса. Иначе говоря, осмос — это диффузия воды или другого растворителя через полупроницаемую перепонку, вызванная разностью концентраций или разностью химических потенциалов. Осмос — результат неравенства химических потенциалов воды по разные стороны мембраны. Идеальная полупроницаемая мембрана пропускает молекулы воды и не пропускает молекулы растворенного вещества. В 1877 г. немецкий физиолог В. Пфеффер приготовил искусственную полупроницаемую мембрану. Для этого в пористый фарфоровый сосуд наливали раствор медного купороса и помещали в другой сосуд, заполненный раствором ферроцианида калия. В порах первого фарфорового сосуда растворы соприкасались и реагировали друг с другом. В результате в порах образовалась пленка из ферроцианида меди Cu2[Fe (CN)6], которая обладала полупроницаемостью. Таким образом, была создана как бы модель клетки: полупроницаемая пленка имитировала мембрану, а стенки сосуда — пектоцеллюлозную оболочку. Сосуд, в порах которого образовалась полупроницаемая мембрана, заполненный раствором сахарозы, помещали в воду. Такой прибор получил название осмометра. Химический потенциал воды во внутреннем сосуде будет тем меньше, чем выше концентрация сахарозы. Таким образом, поступление воды в раствор через полупроницаемую перегородку обусловливается разностью между свободной энергией чистой воды и раствора, происходит самопроизвольно по градиенту свободной энергии воды. В осмометре при наличии полупроницаемой мембраны вода будет поступать в раствор, что приведет к его разбавлению, и движение воды будет замедляться. Если к осмометру присоединить трубку, раствор будет подниматься по ней. Наконец давление столба жидкости уравновесит силу, с которой молекулы воды поступают в осмометр. Таким образом, энергия молекул воды, которая уменьшилась благодаря введению растворенного вещества, восполнится давлением столба жидкости. Это давление повышает химический потенциал раствора (Iр), делая его равным химическому потенциалу чистой воды (Iв). Согласно закону термодинамики самопроизвольно идут только процессы, сопровождающиеся выделением энергии. В большинстве случаев измерить свободную энергию в абсолютном выражении не представляется возможным. Однако можно измерить разность между конечным (g2) и начальным энергетическим состоянием (g1). Поскольку g1 > g2, то изменение Δg будет иметь отрицательное значение. В нашем случае g1 — это химический потенциал чистой воды, a g2 — химический потенциал воды после добавления растворенного вещества. Δg будет равно, но противоположно по знаку тому давлению, которое надо приложить к системе, чтобы предотвратить поступление в него воды через полупроницаемую мембрану. Δg и будет осмотический потенциал Ψосм раствора. Таким образом, осмотический потенциал равен разности между химическим потенциалом раствора и химическим потенциалом чистой воды и всегда отрицателен. Осмотический потенциал показывает недостаток энергии в растворе по сравнению с чистой водой, вызванный взаимодействием вода — растворенное вещество. Иначе говоря, осмотический потенциал показывает, насколько прибавление растворенного вещества снижает активность воды. Осмотический потенциал относится к так называемым коллигативным свойствам раствора, таким, как понижение точки замерзания или повышение точки кипения. Все эти показатели зависят от молярной концентрации. 1 моль раствора любого недиссоциированного вещества имеет осмотический потенциал -22,7 бара (-22,4 атм). Поскольку уменьшение химического потенциала, или активности воды, пропорционально числу частиц, то при растворении диссоциированных веществ абсолютное значение осмотического потенциала будет больше, для чего вводится соответствующий (изотонический) коэффициент. Надо учесть, что осмотический потенциал любого раствора проявляется только в условиях осмотический системы: раствор — полупроницаемая мембрана — растворитель. Сказанное дает возможность измерить осмотический потенциал раствора (Ψ). Присоединив манометр, можно измерить давление, которое надо приложить к системе, чтобы предотвратить поступление воды в раствор. Оно будет по абсолютной величине равно, но противоположно по знаку осмотическому потенциалу раствора. |
Водный потенциал - Справочник химика 21
Водный потенциал — один из фундаментальных показателей термодинамического состояния воды. Ее молекулы обладают кинетической энергией, поскольку и в жидкости, и в газе (водяном паре) быстро и беспорядочно движутся. Чем выше концентрация этих молекул в системе, тем больше их общая кинетическая энергия и выше водный потенциал. Таким образом, у чистой воды он максимален. Если две системы, содержащие воду (например, почва и атмосфера или клетка и окружающий ее раствор), вступают в контакт, то беспорядочное движение ее молекул приведет к их результирующему движению туда, где их меньше, — из области с более высоким водным потенциалом (с более высокой энергией) туда, где он ниже (ниже энергия), пока их концентрации в обеих системах не уравновесятся. [c.99]В цитоплазме имеются также две сократительные вакуоли, местоположение которых в клетке строго фиксировано (рис. 2.32). Эти вакуоли отвечают за осморегуляцию, т. е. поддерживают в клетке определенный водный потенциал (гл. 20). Жизнь в пресной воде осложняется тем, что в клетку постоянно поступает вода в результате осмоса эта вода должна непрерывно выводиться из клетки, чтобы предотвратить ее разрыв. Происходит это с помощью процесса активного транспорта, требующего затраты энергии. Вокруг каждой сократительной вакуоли расположен ряд расходящихся лучами каналов, собирающих воду, перед тем как высвободить ее в центральную вакуоль. [c.54]
Ножом или скальпелем сделайте срез толшиной около 2 мм из середины большой картофелины или свеклы и вырежьте из него 12 прямоугольных полосок толщиной 2 мм, шириной 5 мм и максимально возможной длиной (порядка 5 см). Работать надо быстро, чтобы избежать потери воды в результате испарения, так как это понизит водный потенциал ткани. [c.106]
Накапливающаяся молочная кислота снижает водный потенциал, поэтому вода выходит из трахеол в ткани вместо нее в них поступает воздух. [c.362]В биологии водный потенциал обычно измеряют единицами давления (например, паскалями). У чистой воды он максимален, но условно принят за нулевой. [c.99]
По этому графику определите осмотический потенциал раствора, при котором длина полосок не меняется. Водный потенциал растительной ткани определяется следующим соотношением [c.106]
Преимущество использования понятия водный потенциал [c.100]
Каков средний водный потенциал клеток свеклы по данным табл. 13.6 [c.107]
Водный потенциал отражает тенденцию молекул воды двигаться в определенном направлении. Чем он выше (чем менее отрицателен), тем больше у молекул шансов покинуть данную систему. Если две системы (не обязательно разделенные мембраной) контактируют друг с другом, то вода будет переходить из системы с более высоким водным потенциалом в систему с более низким водным потенциалом. [c.100]
Таким образом, понятие водный потенциал позволяет определить направление движения воды между любыми двумя системами — не только из одной клетки растения в другую, но, например, из почвы в корень, из листа в атмосферу и т. п. Можно сказать, что вода движется через растение по градиенту водного потенциала из почвы в воздух. Чем круче этот градиент, тем быстрее поток воды. [c.100]
Низкий водный потенциал [c.109]
При растворении в воде другого вешества, концентрация ее молекул, а, следовательно, и водный потенциал, снижаются. Таким образом, у всех растворов водный потенциал ниже, чем у чистой воды. Количественно это понижение выражают величиной, называемой осмотическим потенциалом ( Го). Иными словами, осмотический потенциал — это мера снижения водного потенциала системы в результате присутствия в ней неводных молекул. Осмотический потенциал водного раствора всегда отрицателен. Чем больше в растворе молекул растворенного [c.100]Если к чистой воде или раствору приложить давление, то водный потенциал возрастает, поскольку у жидкости возникает тенденция переместиться в другое место. Такая ситуация возможна в живой клетке. Например, когда за счет осмоса в нее поступает вода, клетка набухает, и внутри нее повышается давление, называемое тургорным (разд, 13.1.7). Сходным образом водный потенциал плазмы крови повышается до положительной отметки кровяным давлением в почечных клубочках. Гидростатический потенциал обычно положителен, но в некоторых случаях, например когда столб воды, висящий в ксилеме, растягивается, он может стать отрицательным (возникает отрицательное давление). [c.100]
На водный потенциал влияет как концентрация растворенного в воде вещества, так и давление, поэтому можно выразить его в виде уравнения [c.100]
Опыт 13.3. Определение водного потенциала растительной ткани [c.106]
Водный потенциал отражает тенденцию молекул воды перемещаться из одного места в другое. Принцип опыта состоит в подборе раствора с известным водным потенциалом, в котором исследуемая ткань не будет ни поглощать, ни терять воду. Препараты ткани помещают для уравновешивания в растворы различной концентрации. Ткань будет иметь тот же водный потенциал, что и раствор, в котором ни объем, ни масса ткани не изменятся. Описанная ниже методика основана на регистрации изменений объема, а не массы. [c.106]
Вода в растении находится в непосредственном контакте с водой в почве и водяным паром в окружающем воздухе. Как уже говорилось, она движется по градиенту водного потенциала от более высокого к более низкому. В растении этот потенциал снижается в направлении от почвы к воздуху (рис. 13.7). Водный потенциал умеренно сухого воздуха значительно ниже, чем растительных тканей, следовательно, вода будет стремиться перейти из них в атмосферу. [c.108]
Иногда создается неверное представление, что вода движется в листе по градиенту осмотического потенциала. Однако, хотя градиент водного потенциала существует, данных, которые позволили бы предположить, что осмотический потенциал в соответствующих клетках сильно различается, нет. Транспирационный ток поддерживается прежде всего за счет разности гидростатических потенциалов потеря клеткой даже небольшого количества воды гораздо сильнее влияет на тургорное давление, чем на концентрацию растворенных веществ. То же самое можно сказать о корне (разд. 13.5), в котором есть градиенты водного и гидростатического потенциалов, но не всегда существуют градиенты осмотического потенциала. [c.112]
Все три пути переноса воды завершаются ее испарением в воздушные пространства листа, т. е. в межклетники. Отсюда пары воды диффундируют через устьица по пути наименьшего сопротивления от более высокого водного потенциала внутри листа к более низкому за его пределами. У двудольных устьица располагаются либо только на нижней поверхности листа, либо они там преобладают. Регуляция процессов открывания и закрывания устьиц рассматривается в разд. 13.3.9. [c.112]
Самое сильное влияние на транспирацию оказывает температура. Чем она выше, тем быстрее вода испаряется клетками мезофилла и тем насыщеннее водяным паром воздух внутри листа. Одновременно повышение температуры приводит к снижению относительной влажности воздуха, окружающего растение. Эти два явления повышают крутизну градиента молекул воды между воздухом в межклетниках и окружающей атмосферой. Чем круче этот градиент, тем выше скорость диффузии. Можно сказать иначе водный потенциал внутри листа возрастает, а вне его — падает. [c.115]
Низкая влажность воздуха около листа способствует транспирации, поскольку диффузионный градиент водяного пара (градиент водного потенциала) между межклетниками и окружающей атмосферой становится круче. С повышением [c.115]
В темноте калий (К+) выходит из замыкающих клеток в окружающие эпидермальные клетки. В результате водный потенциал замыкающих клеток растет, и вода из них устремляется туда, где он ниже. Тургор замыкающих клеток падает, они изменяют форму, и устьичная щель закрывается. [c.120]
Удовлетворительное объяснение этим фактам дает теория сцепления (когезии), или теория натяжения. Согласно этой теории, подъем воды от корней обусловлен ее испарением клетками листа. Как мы уже говорили в разд. 13.3, испарение снижает водный потенциал клеток мезофилла, прилежащих к ксилеме, и вода поступает в эти клетки из ксилемного сока, водный потенциал которого выше при этом она проходит через влажные клеточные стенки у концов жилок, как показано на рис. 13.8. [c.121]
Вторая сила, обеспечивающая движение воды по ксилеме, — корневое давление. Его можно обнаружить и измерить в тот момент, когда срезают крону, а штамб с корнями некоторое время продолжает вьщелять сок из сосудов ксилемы. Этот процесс подавляется ингибиторами дыхания, например цианидом, и прекращается при недостатке кислорода и понижении температуры. Работа такого механизма, по-видимому, обусловлена активной секрецией солей и других водорастворимых веществ в ксилемный сок. В результате его водный потенциал падает, и вода поступает в ксилему из соседних клеток корня путем осмоса. [c.123]
Если растительная клетка контактирует с раствором, водный потенциал которого ниже, чем у ее содержимого (например, с концентрированным сахарным сиропом см. опыт 13.1), то вода будет выходить из нее за счет осмоса через плазмалемму (рис. 13.2). Сначала воды станет меньше в цитоплазме, а затем и в вакуоле, откуда она выйдет сквозь тонотшаст. Протопласт, т. е. живое содержимое растительной клетки, окруженное клеточной стенкой, спадется и отойдет от этой стенки, как бы сжавшись внутри нее. Этот процесс называется плазмолизом, а клетка в таком состоянии — плазмолизироваппой. Момент, когда протопласт еще прилегает к клеточной стенке, но уже перестал оказывать на нее давление, называется начальным плазмолизом. В этот момент клетка теряет тургор, т. е. становится вялой. Вода будет покидать протопласт до тех пор, пока его содержимое по водному потенциалу не сравняется с окружающим раствором. Тогда установится равновесное состояние, и спадение протопласта прекратится. [c.101]
Когда водный потенциал окружающего клетку раствора уравновесится ее возросшим гидростатическим потенциалом, внутрь будет проникать столько же водньк молекул, сколько выходить наружу за то же время. Несмотря на продолжающееся их движение через мембрану, изменения системы в целом прекратятся. Такое равновесие со средой назьшается динамическим. Осмотический потенциал клеточного содержимого останется скорее всего ниже, чем снаружи, поскольку для роста тургорного давления нужно не так много воды — меньше, чем для существенного разбавления внутреннего раствора. Однако эта разница компенсируется более высоким, чем снаружи, гидростатическим потенциалом клетки. Суммарные же водные потенциалы с обеих сторон клеточной стенки сравняются. [c.102]
Вода испаряется с поверхности мезофилль-ных клеток в межклетники, главным образом в относительно обширные дыхательные полости под устьицами. Если взять в качестве примера клетку 1 на рис. 13.8, А, то потеря ею воды приведет к падению ее гидростатического и, следовательно, водного потенциалов. (Для простоты допустим, что сначала вся система была в состоянии равновесия, т. е. этот потенциал бьш повсюду одинаков.) Теперь же у клетки 2 он станет относительно выше, и вода устремится из нее по градиенту в клетку 1. Это приведет к снижению водного потенциала клетки [c.112]
Линиями показаны области одинаковой концентрации молекул воды (одинакового водного потенциала) чем круч градиент водного потенциала, тем ближе друг к другу на схем расположены эти линии и тем выше скорость диффузиц Поэтому наибольшей будет скорость диффузии у краев устьичной щели. [c.113]
Оценки прочности на разрьш столба ксилемного сока варьировали от 3000 доЗО ООО кПа, причем более низкие значения получены позднее. В листьях зарегистрирован водный потенциал порядка -4000 кПа, и прочность столба ксилемного сока, вероятно, достаточна, чтобы вьщержать создающееся натяжение. Не исключено, конечно, что столб воды может иногда разрьшаться, особенно в сосудах большого диаметра. [c.123]
На рис. 13.18, А схематично показаны пути движения воды по корню. В корне существует градиент водного потенциала — от более высокого в клетках, образующих корневые волоски, к более низкому в клетках, примьжающих к ксилеме. Этот градиент поддерживается двумя способами [c.126]
chem21.info
Потенциал воды
Химический потенциал чистой воды всегда выше химического потенциала воды в клетке, поэтому значение водного потенциала всегда отрицательно. По величине водного потенциала определяют сосущую силу клетки, т. е. ее способность поглощать воду в каждый конкретный момент времени. Сосущая сила клетки меняется в зависимости от степени насыщения клетки водой — ее тургора.[ ...]
Сравнение динамики изменения потенциала днепровской и деснянской воды с логарифмом концентрации содержащихся в ней органических веществ показало отсутствие прямой зависимости между этими величинами (табл. 12). Следовательно, колебания потенциала воды объясняются в первую очередь изменением электрохимических свойств органических веществ, поступающих в реки, тем более, что имеющие место в данном случае изменения концентрации этих соединений вообще не могли бы существенно изменить величину потенциала.[ ...]
Изучение переноса электронов в воде под действием электромагнитных полей проводился по оценке изменения окислительно-восстановительного потенциала воды, находящейся под действием генератора, и кинетики хемилюминесценции раствора люминола.[ ...]
Если окислительно-восстановительный потенциал Е, измеренный в исходной воде после упрощенной аэрации, будет выше, чем подсчитанный по формуле (1.83), то двухвалентное железо, растворенное в воде, будет окисляться до трехвалентного. Аэрация приводит к обогащению воды кислородом и соответствующему увеличению окислительно-восстановительного потенциала воды Е, а также к удалению части свободной двуокиси углерода и вследствие этого повышению значения pH.[ ...]
Как было показано, для обезжелезивапия воды окислением двухвалентного железа до трехвалентного необходимо или повысить окислительно-восстановитель-ный потенциал воды (ввести окислители), или увеличить pH (подщелачиванием, аэрацией), или одновременно аэрацией увеличить pH путем удаления части свободной двуокиси углерода и увеличить окислительно-восстановительный потенциал воды путем обогащения ее кислородом воздуха (см. п. 6 гл.I).[ ...]
| З. Зависимость равновесного водородного потенциала воды от напряженности электрического поля для различных значений |  |
| З. Зависимость равновесного водородного потенциала воды от напряженности электрического поля для различных значений |  |
Способ был принят к промышленной эксплуатации для очистки сточных вод Балхашского горнометаллургического комбината, содержащих ионы металлов в количестве 0,2-0,3 мг/дм3. Б отстойном пруду хвостохранилища было произведено скашивание тростника в количестве 320 т, что привело к снижению окислительно-восстановительного потенциала воды. Эта мера вызвала интенсивное развитие сульфатредуцирующих бактерий, в результате жизнедеятельности которых содержание вредных примесей в сточных водах снизилось независимо от сезонов года в среднем: меди на 79, мышьяка на 86 и молибдена на 44%.[ ...]
За указанный период наблюдений суммарная минерализация подземных вод колебалась от 0,28 до 6,43 г/л (среднее значение составило 1,03 г/л, табл. 3), то есть, по классификации В.И. Вернадского, они относятся к пресным и солоноватым. По величине окислительно-восстановительного потенциала воды характеризуются в интервале от нейтральных до слабощелочных. По компонентному составу воды относятся к гидрокарбонатному, хлоридному, а по катионам к кальциевому и натриевому типам.[ ...]
Транспорт фосфора и освобождение его связаны с циклом железа и зависят от редокс-потенциала воды и глубины. При высоких значениях ре Fe [III] химически взаимодействует с фосфатом, образуя нерастворимые соединения. При низком значении ре[2] и восстановлении Fe(III) в Fe(II) эти вещества становятся растворимыми.[ ...]
Для обоснования и уточнения оптимизации процесса электрокоагуляционной очистки водопроводной воды в установке «Водолей-50» при изменении напряженности постоянного электрического поля от 30 до 60 В/см, проведены исследования по изучению процессов изменения равновесного водородного потенциала воды (Дф).[ ...]
Сезонное различие гумусовых веществ в исследуемых реках подтверждалось также данными изменения окислительного потенциала воды.[ ...]
Роль органических соединений как потенциалзадаицих систем также очень велика, но ввиду большого различия органических ве-щест в природных водах можно лишь отметить, что многие из них обладают восстановительными свойствами и могут снижать окислительно-восстановительный потенциал воды до очень низких значений (-250, -350 мв).[ ...]
Наиболее мощный современный фактор воздействия на химический режим малых рек - жизнедеятельность речного бобра. Средняя бобровая семья в течение года выделяет в воду не менее 500 кг метаболитов (моча и экскременты), которые обогащают воду различными минеральными и органическими веществами (Ставровский и др., 1986). Метаболиты бобра незначительно (на 0.1-0.5 pH) изменяют водородный показатель, повышают окис-ляемость и снижают окислительно-восстановительный потенциал вод (Легейда, Сергиенко, 1981). В небольших водоемах до 15% годового бюджета поступлений азота может происходить за счет экскрементов бобров (Dodds, Castenholz, 1988).[ ...]
Наконец, возможности метода можно расширить, используя двухступенчатые фильтры, но это не настолько эффективно, как осветление с использованием полной коагуляции, флокуляции, отстаивания и фильтрования. Если слабо загрязненная вода имеет большую цветность или содержит большое количество железа или марганца, то можно использовать частичную коагуляцию и фильтрование при условии, что им предшествовал процесс озонирования. В этом процессе озон действует как окислитель, а не как коагулянт; как показывает опыт, озон не изменяет дзета-потенциал воды. Использование двухслойного фильтра обычно удовлетворяет требованиям данного способа очистки.[ ...]
Почва обладает объемной и поверхностной проводимостью: объемная влагопроводность связана с транзитной системой капиллярных пор, поверхностная—обусловлена толщиной водных пленок Я. Объемная проводимость выше поверхностной вследствие того, что вода, находящаяся в сфере действия поверхностных сил почвенных частиц, обладает некоторыми другими свойствами — имеет большую вязкость, потенциал в пленке ниже потенциала воды в капилляре и др.[ ...]
В профилактических целях комплексный газогеохимический метод оценки загазованности поверхностных отложений и окружающей воздушной среды осуществляется на многих территориях месторождений и ПХГ с периодичностью 1—2 раза в год. Среди прочих методов контроля перспективен геохимический метод, основанный на определении содержания углеводородов в пробах воздуха, отобранных на территории хранилищ и прилегающих участках в сочетании с определением окислительно-восстановительного потенциала вод и интенсивности развития в них углеводородоокисляющих бактерий.[ ...]
ru-ecology.info
Химический потенциал чистой жидкости - Справочник химика 21
В растворах твердых веществ в жидкостях для растворителя целесообразно сохранить в качестве стандартного состояние чистого вещества. Однако для растворенного вещества такой выбор стандартного состояния неудобен, так как твердые вещества ограниченно растворимы и при раствор не существует. Так же неудобно принимать состояние бесконечно разбавленного раствора в качестве стандартного. В таком растворе 72- , но так как Л 2 0, то химический потенциал обращается в отрицательную бесконечность и становится неопределимым. [c.35] Для чистых веществ и смесей можно определить минимальный размер пузырька, устойчивого в данной пересыщенной жидкости-При термодинамическом равновесии необходимо , чтобы химические потенциалы во всех сосуществующих фазах были равны. Химический потенциал компонента в жидкой фазе при любом давлении может быть выражен через химический потенциал этого же компонента в условиях равновесия с какой-либо другой фазой (для той же температуры и поверхности раздела фаз с бесконечным радиусом) при помощи следующего выражения [c.226]Рнс. 8.3. Химический потенциал чистой жидкости в равновесии с паром (а) л смеси жидкостей в равновесии с их парами (б). [c.236]
Как обычно, мы предполагаем, что пар ведет себя идеально. Если имеется только один компонент (компонент А), то химический потенциал чистой жидкости будет [c.236]
Эти уравненпе выражает химический потенциал яа жидкости в смеси через химический потенциал чистой жидкости pA п давлепие пара для обоих случаев. [c.237]
Здесь р, — парциальное давление пара г-го компонента, а" — химический потенциал чистой жидкости, — химический потенциал пара при давлении 1, А — газовая постоянная. [c.128]
Таким образом, мы получили выражение для химического потенциала компонента раствора через химический потенциал чистой жидкости и давление насыщенных паров для каждого компонента. Если учесть изменение давления, которым мы пренебрегли при выводе соотношения (4.27), то вместо него получим [c.209]
Реагирующее вещество — чистая твердая фаза или жидкость. Химический потенциал чистого твердого вещества или жидкости при постоянном давлении и температуре будет постоянным [c.65]
Химические потенциалы г-того компонента в паре и растворе равны, однако стандартные значения химических потенциалов для этих фаз различны, что необходимо учитывать при переходе от выражения для химического потенциала компо-. нента в газовой фазе к аналогичному выражению для раствора. Зависимость между Т) и а (Р, Т) может быть получена следующим путем. Сначала найдем связь между значением химического потенциала чистого жидкого г-того компонента и величиной стандартного химического потенциала г-того компонента в газовой фазе при условии существования равновесия между жидкостью и ее паром. [c.123]
Таким образом, стандартный химический потенциал растворенного вещества — это химический потенциал гипотетической чистой жидкости (дг2 = 1), в которой компонент 2 обладает теми же парциальными молярными энергетическими характеристиками, что и в предельно разбавленном растворе. При произвольной концентрации [c.244]
В любом растворе химический потенциал растворителя ниже, чем в чистой жидкости, поскольку в растворе мольные доли всегда меньше единицы [c.93]
Физическая причина снижения химического потенциала не может быть обусловлена изменением межмолекулярных снл, так как оно происходит даже в случае идеальных растворов. Если это не энтальпийный эффект, то он должен быть энтропийным. В отсутствие растворенного вещества чистый жидкий растворитель имеет некоторую энтропию (отражающую степень его разупорядоченности) и некоторую энтальпию. Давление пара возникает нз-за тенденции вселенной к приобретению максимальной энтропии, и испарение жидкости, при котором образуется более разупорядоченный газ, является одним из положительных вкладов в энтропию. В при- [c.242]
Если реагирующее вещество — чистая твердая фаза или жидкость, то химический потенциал такого компонента при постоянном давлении и температуре будет постоянным. Если реагирующее вещество — газ, парциальное давление которого равно Р], то химический потенциал выражается уравнением [c.33]
Прямое подтверждение того, что молекулы движутся, можно получить при наблюдении за двумя чистыми веществами, соприкасающимися друг с другом. По истечении некоторого времени эти вещества проникают друг в друга. Результаты такой диффузии можно увидеть в камнях с прожилками, а также при помещении кристалла в жидкость (например, перманганата калия в воду), но особенно легко и быстро удается наблюдать диффузию, если привести в соприкосновение бесцветный и окрещенный газы (рис. 6.12). Объем, давление, температура и число молей в такой системе остаются постоянными не происходит образования новых молекул, и все же газы перемешиваются вследствие изменения при этом химического потенциала. Мы настолько часто наблюдаем такое перемешивание веществ, что редко задумываемся над его причинами, и все же удивляемся, когда узнаем, что диффузия веществ не требует изменения энергии. [c.240]
Изменение энергии Гиббса, даваемое соотношением (II. 18), не относится ни к какому реальному процессу [ср. с (II. 6)] и его можно интерпретировать лишь как эффект переноса 1 моль неэлектролита из состояния чистой жидкости в гипотетическое состояние, получаемое продолжением линии закона Генри до х = = 1. Энергию А(35 можно выразить также через предельное значение симметричного коэффициента активности или избыточного химического потенциала ДОх = РГ 1п уг °° = ц °°. [c.26]
Вычислим теперь химический потенциал или летучесть чистой жидкости, находящейся под давлением Р, отличным от давления насыщенного пара Рнас- Для этого интегрируем уравнение (ХП, 101) в пределах от Рнас ДО Р [c.334]
Очень часто химический потенциал вещества, находящегося в жидкой (твердой) фазе, отсчитывают не от состояния идеализированного газа, а от другого стандартного состояния. В качестве нового стандартного состояния выбирают состояние чистой жидкости (чистого кристалла), находящейся под давлением в одну атмосферу (не под давлением насыщенного пара жидкости ) и при данной температуре Т. Интегрируем уравнение (XII, 101) в пределах от Р = 1 до данного Р [c.335]
Для вычисления химического потенциала или летучести чистой жидкости, находящейся под давлением Р, отличным от давления насыщенного пара Рнас.проинтегрировать уравнение XII, 101) в пределах от до Р [c.330]
Таким образом, ( г л — химический потенциал, соответствующий активности г-го компонента, равной единице. Активность — величина не абсолютная, а отнесенная к некоторому стандартному произвольно выбранному состоянию с единичной активностью. Можно выбрать любое подходящее состояние, независимое от экспериментальных трудностей. Практически используют два стандартных состояния. Для твердых веществ, жидкостей или газов, а также для смесей, в которых растворенное вещество полностью смешивается с растворителем, в качестве стандартного выбирают обычно само чистое вещество. В случае разбавленных растворов стандартное состояние выражают тремя различными способами, зависящими от способа выражения концентрации растворенного вещества. Последняя может быть задана числом молей г-го компонента на 1000 г растворителя (т,-, моляльность), [c.33]
Поскольку /1 и Хх равны единице при бесконечном разбавлении, т. е. для чистого растворителя, то из уравнения (II) следует, что химический потенциал чистой жидкости равняется и, таким образом, имеет постоянное значенке при данных температуре и давлении. Рассматривая равновесие между твердым веществом и его паром, легко показать, что тот же йывод относится и к чистому твердому веществу. [c.194]
В соответствии с (4.3) молярный химический потенциал чистой жидкости (твердого тела) Сжидк Т, р) [Ствер Т, р)] должен быть равен химическому потенциалу насыщенного пара (при давлении р) [c.208]
Следует определить, насколько необходим в связи с этим yiier изменения относительной летучести п процессе перегонки. Р.сли записать выражения для химического потенциала чистого компонента Ц2-2 и гипотетической жидкости, соотпетствуюн1ей предельно разбавленному раствору, то поставленный во- [c.236]
Таким образом, когда химический потенциал адсорбата при адсорбции изменяется, общее изменение свободной энергии Гельмгольца при адсорбции не определяется только изменением поверхностного натяжения, а превышает его на величину ГгАцг- Значение Др,2 можно получить, зная давление насыщенного пара адсорбата ps в исходном состоянии над чистой жидкостью и давлением пара адсорбата р, находящегося в равновесии с адсорбционным слоем при величине адсорбции Гг. Согласно (VI.57) имеем [c.351]
В системе, имеющей форму тора, раствор келету-чего вещества (правое колено) и чистый растворитель (левое колено) разделены внизу мембраной, проницаемой только для растворителя, и сообщаются через паровую фазу вверху (см. рисунок). В результате осмотического давления в поле сил тяжести возникает разность уровней жидкостей. Система термо-статирована. Химический потенциал растворителя выше для жидкости в [c.83]
Для растворителя стандартное состояние, как и в предыдущем случае— чистая жидкость р." = р., и а химический потенциал И1 представляется выражением (V. 67). Для растворенного вещества при дса О Да = ДС2, так что выражение (V.64) обращается в (V.56) и1НТ, р) = (1 (7 , р). Величина ц подчиняется соотношению (У. 57). [c.244]
Таким образом, для идеального газа при постоянной температуре мольный изобарный потенциал, или химический потенциал, полностью определяется давлением. Если газ (пар) находится в равновесии с жидкостью, то химический потенциал пара равен химическому потенциалу жидкости. Поэтому давление насыщенного пара будет характеризовать свойства жидкости, а именно стремление вещества покинуть жидкую фазу. Если поместить сосуды с двумя жидкостями (чистой и ее раствором) в общую камеру, то поскольку давление пара над чистой кидкостьго всегда больше, чем над раствором, то вещество будет переходить из чистой жидкости в раствор. [c.66]
Равновесие твердое вещество — жидкость—газ. В некоторой точке твердая, жилкая и газовая фазы могут сосуществовать в равновесии. Эта точка определяется значениями р и Т, при которых все три химических потенциала равны. Геометрически она находится па пересечении трех граничных кривых (рис. 7.5), ее называют тройной точкой. Очень важно заметить, что положением тройной точки чистого вещества мы абсолютно не можем управлять. Она находится при строго определенных давлении и температуре. Например, в случае воды ее положение соответствует температуре 273,1600 К (на 0,0098 К выше точкп льда при 1 атм) и давлению 4,58 мм рт. ст. Ни при какой другой комбинации давления п температуры три фазы не сосуществуют. [c.204]
Борна—Грина, ПО существу совпадающего с уравнением Боголюбова для более прсютого случая однокомпонентной, т. е. химически чистой жидкости, были выполнены Кирквудом и сотрудниками [6]. Расчет был выполнен при условии, что энергия взаимодействия между молекулами жидкости может быть выражена при помощи модифицированного потенциала Леннард— Джонса [c.38]
Активность и коэффициент активности [2]. Когда чистая жидкость или смесь находится в равновесии со своим паром, химический потенциал каждого компонента в жидкости должен равняться химическому потенциалу этого компонента в паре. Это является следствием требования термодинамики, согласно которому при небольшом изменении состава системы, находящейся в равновесии при постоянных температуре и давлении, свободная энергия должна оставаться неизменной, т. е. дО)г, р = 0. Таким образом, если можно считать пар идеальным, те химический потенциал -то компонента в растворе можно написать в такой же форме, как уравнение (7), причем в этом случае р,- представляет собой парциальное давление данного компонента в паре, который находится в равновесии с раствором. В случае неидеального пара парциальное давление надо заменить идеальным давлением или летучестью-, оста навливаться на этой поправке более подробно нет необходимости. Согласно закону Рауля, парцйальное давление пара любого компонента идеального раствора пропорционально его молярной доле XI в растворе, следовательно, химический потенциал этого компонента жидкой фазы составляет [c.193]
Для получения правильных количественных результатов особое значение имеет способ определения численных значений ПП. Действительно, заранее ясны недостатки потенциала (12,6) для реальных систем частиц, к тому же сферически несимметричных. В связи с этим в лучшем случае можно претендовать на эффективный смысл потенциала с подогнанными значениями его параметров. Расчет ПП необходимо вести в достаточно узком интервале температур для интересуюш,его нас агрегатного состояния и по свойствам, которые близки по физическому смыслу к тем, которые предполагается рассчитывать. В нашем случае наиболее близким свойством по отношению к коэффициенту распределения будет давление пара чистой жидкости. Действительно, все величины, характеризуюш ие равновесие фаз, определяются, как и давление пара, из условия равенства химических потенциалов. Искомое равенство можно найти, если воспользоваться уравнением для ра так же как и уравнением (7), полученным по методу МК [7] [c.75]
Критические явления при равновесии между двумя жидки-ви фазами открыты Д. Н. Абашевым (1857 г.) фундаментальный вклад в их исследование внес А. Ф. Алексеев (1872 г.). Для понимания критических явлений в растворах важны работы Д. П. Коновалова (1884 г.). В них содержится обширный опытный материал, впервые подтвердивший основные уравнения критической фазы бинарного раствора. Д. П. Коновалов первым, независимо от Гиббса, объединил переход расслаивающихся растворов в однородные (с изменением температуры) и критические явления при испарении чистых жидкостей. Он раньше других связал факт незначительной зависимости химического потенциала компонента раствора от его состава с медленностью диффузии вблизи критической точки. Д. П. Коновалов предсказал на примере системы палладий— водород (1909 г.) существование критических явлений в твердых растворах. [c.43]
chem21.info













