36. Оксиды фосфора и фосфорные кислоты. Вода p2o5
Урок №35. Оксид фосфора(V). Ортофосфорная кислота и ее соли. Минеральные удобрения.
Оксид фосфора (V) – фосфорный ангидрид
Физические свойства: Оксид фосфора (V) Р2О5 — белый гигроскопичный порошок (поглощает воду), следует хранить в плотно закрытых сосудах.
Получение: Получается при горении фосфора в избытке воздуха или кислорода
4P + 5O2 = 2P2O5
Применение: Оксид фосфора (V) очень энергично соединяется с водой, а также отнимает воду от других соединений. Применяется как осушитель газов и жидкостей.
Химические свойства: Оксид фосфора (V) – это кислотный оксид, взаимодействует, подобно другим кислотным оксидам с водой, основными оксидами и основаниями.
Фосфорный ангидрид особым образом взаимодействует с водой, взаимодействуя с водой при обычных условиях (без нагревания), образует в первую очередь метафосфорную кислоту НРО3:
P2O5 + h3O = HPO3
при нагревании образуется ортофосфорная кислота h4PO4:
P2O5 + 3h3O = 2h4PO4 (t˚C)
При нагревании h4PO4 можно получить пирофосфорную кислоту h5P2O7:
2h4PO4 = h3O + h5P2O7 (t˚C)
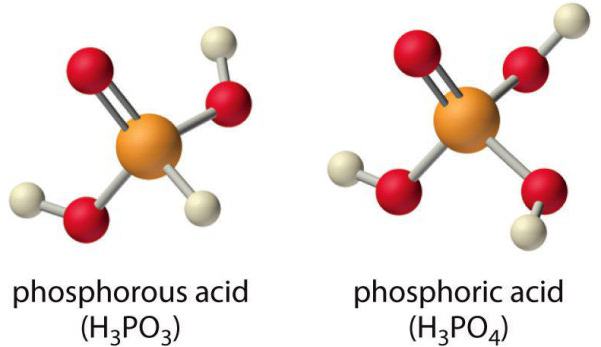
Ортофосфорная кислота
Наибольшее практическое значение имеет ортофосфорная кислота Н3РO4.
Строение молекулы: В молекуле фосфорной кислоты атомы водорода соединены с атомами кислорода:

Физические свойства: Фосфорная кислота представляет собой бесцветное, гигроскопичное твердое вещество, хорошо растворимое в воде.
Получение:
1) Взаимодействие оксида фосфора (V) с водой при нагревании:
P2O5 + 3h3O = 2h4PO4 (t˚C)
2) Взаимодействие природной соли – ортофосфата кальция с серной кислотой при нагревании:
Сa3(PO4)2 + 3h3SO4 = 3CaSO4 + 2h4PO4 (t˚C)
3) При взаимодействии фосфора с концентрированной азотной кислотой
3P + 5HNO3+ 2h3O = 3h4PO4+ 5NO
Химические свойства:
| Свойства, общие с другими кислотами | Специфические свойства |
| 1. Водный раствор кислоты изменяет окраску индикаторов на красный: Ортофосфорная кислота диссоциирует ступенчато: h4PO4 ↔ H+ + h3PO4- (дигидроортофосфат-ион) h3PO4- ↔ H+ + HPO42- (гидроортофосфат-ион) HPO42- ↔ H+ + PO43- (ортофосфат-ион) 2. Взаимодействует с металлами в ряду активности до (Н2): металл+ h4PO4=соль+Н2↑ 3. Взаимодействует с основными оксидами: оксид металла + h4PO4 = соль + Н2О 4. Взаимодействует с основаниями Ме(ОН)n: основание + h4PO4 = соль + Н2О если кислота в избытке, то образуется кислая соль: h4PO4(изб) + NaOH = Nah3PO4 + h3O или h4PO4(изб) + 2NaOH = Na2HPO4 + 2h3O 5. Реагирует с аммиаком (по донорно-акцепторному механизму), если в избытке кислота, образуются кислые соли: h4PO4 + Nh4 = Nh4h3PO4 h4PO4 + 2Nh4 = (Nh4)2HPO4 h4PO4 + 3Nh4 = (Nh4)3PO4 6. Реагирует с солями слабых кислот: 2h4PO4+3Na2CO3 = 2Na3PO4 + 3h3O + 3CO2↑ | 1. При нагревании ортофосфорная кислота постепенно превращается в метафосфорную кислоту: 2h4PO4 (t˚C) → h3O + h5P2O7 h5P2O7 (t˚C)→ h3O + 2HPO3 2. Качественная реакция на PO43- - фосфат ион. Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра — образуется жёлтый осадок: Н3РО4 + 3AgNO3 = Ag3PO4↓+ 3HNO3 3. Играет большую роль в жизнедеятельности животных и растений. Её остатки входят в состав АТФ. При разложении АТФ выделяется большое количество энергии, что очень важно для живых организмов.
|
Применение:
В основном для производства минеральных удобрений.
А также, используется при пайке, для очищения от ржавчины металлических поверхностей. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество. Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках.
ТРЕНАЖЁРЫ
Тренажёр №1. "Свойства фосфора и его соединений"Тренажёр №2. Тестовые задания по теме: "Азот и фосфор, их соединения"ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Составьте уравнения реакций оксида фосфора (V) с1. Na2O2. NaOh4. h3O при нагревании4. h3O без нагреванияДля 2 реакции запишите полное и краткое ионное уравнение.№2. Составьте молекулярные и ионные уравнения реакций ортофосфорной кислоты с:1. калием2. оксидом калия3. гидроксидом калия4. сульфитом калия№3. Осуществите превращения по схеме:Сa3(PO4)2 -> P -> Ph4 -> P2O5 -> h4PO4 -> Ca3(PO4)2Назовите вещества№4.
Вычислите (в %), какое из фосфорных удобрений: двойной суперфосфат или преципитат богаче фосфором? Химические формулы удобрений найдите в схеме самостоятельно.sites.google.com
Кислородные соединения фосфора
Оксиды фосфора
Р2О3 - оксид фосфора (III)
При обычной температуре - белая воскообразная масса с т. пл. 23,5'С. Очень легко испаряется, имеет неприятный запах, очень ядовит. Существует в виде димеров Р4О6.
Способ получения
Р2О3 образуется при медленном окислении фосфора или при его горении в недостатке кислорода:
4Р + 3О2 = 2Р2О3
Химические свойства
Как кислотный оксид при взаимодействии с водой образует фосфористую кислоту:
Р2О3 + ЗН2О =2h4PO3
Но при растворении в горячей воде происходит очень бурная реакция диспропорционирования Р2О3:
2Р2О3 + 6Н2О = РН3 + Зh4PO4
Взаимодействие Р2О3 со щелочами приводит к образованию солей фосфористой кислоты:
Р2О3 + 4NaOH = 2Na2HPO3 + Н2О
1. Окисление кислородом воздуха:
Р2О3 + О2 = Р2О5
2. Окисление галогенами:
Р2О3 + 2Cl2 + 5Н2О = 4HCl + 2h4PO4
Р2О5 - оксид фосфора (V)
При обычной температуре - белая снегоподобная масса, не имеет запаха, существует в виде димеров Р4О10. При соприкосновении с воздухом расплывается в сиропообразную жидкость (НРO3). Р2О5 - самое эффективное осушающее средство и водоотнимающий агент. Применяется для осушения нелетучих веществ и газов.
Способ получения
Фосфорный ангидрид образуется в результате сжигания фосфора в избытке воздуха:
4Р + 5О2 = 2Р2О5
Химические свойства
Как кислотный оксид Р2О5 взаимодействует:
а) с водой, образуя при этом различные кислоты
Р2О5 + Н2О = 2HPO3 метафосфорная
Р2О5 + 2Н2О = Н4Р2О7 пирофосфориая (дифосфорная)
Р2О5 + ЗН2О = 2h4PO4 ортофосфорная
б) с основными оксидами, образуя фосфаты Р2О5 + ЗВаО = Ва3(PO4)2
в) со щелочами, образуя средние и кислые соли
Р2О5 + 6NaOH = 2Na3PO4 + ЗН2О
Р2О5 + 4NaOH = 2Na2HPO4 + Н2О
Р2О5 + 2NaOH = 2Nah3PO4 + Н2О
Фосфорный ангидрид отнимает у других веществ не только гигроскопическую влагу, но и химически связанную воду. Он способен даже дегидратировать оксокислоты:
Р2О5 + 2HNО3 = 2HPO3 + N2О5
Р2О5 + 2НСlО4 = 2HPO3 + Сl2О7
Это используется для получения ангидридов кислот.
Фосфорные кислоты
Фосфор образует только 2 устойчивых оксида, но большое число кислот, в которых он находится в степенях окисления +5, +4, +3, +1. Строение наиболее известных кислот выражается следующими формулами

Как видно из этих формул, фосфор во всех случаях образует пять ковалентных связей, т.е. имеет валентность, равную V. В то же время степени окисления фосфора и основность кислот различаются.
Наибольшее практическое значение имеют ортофосфорная (фосфорная) и ортофосфористая (фосфористая) кислоты.
h4PO4 - фосфористая кислота
Важная особенность фосфористой кислоты обусловлена строением ее молекул. Один из 3-х атомов водорода связан непосредственно с атомом фосфора, поэтому не способен к замещению атомами металла, вследствие чего эта кислота является двухосновной. Формулу фосфористой кислоты записывают с учетом этого факта следующим образом: Н2[НРО3]
Является слабой кислотой.
Способы получения
1. Растворение Р2О3 в воде (см. выше).
2. Гидролиз галогенидов фосфора (III): PCl3 + ЗН2О = Н2[НРО3] + 3HCl
3. Окисление белого фосфора хлором: 2Р + 3Cl2 + 6Н2О = 2Н2[НРО3] + 6HCl
Физические свойства
При обычной температуре h4PO3 - бесцветные кристаллы с т. пл. 74°С, хорошо растворимые в воде.
Химические свойства
Фосфористая кислота проявляет все свойства, характерные для класса кислот: взаимодействует с металлами с выделением Н2; с оксидами металлов и со щелочами. При этом образуются одно - и двухзамещенные фосфиты, например:
Н2[НРО3] + NaOH = NaH[HРО3] + Н2О
Н2[НРО3] + 2NaOH = Na2[HРО3] + 2Н2О
Кислота и ее соли - очень сильные восстановители; они вступают в окислительно-восстановительные реакции как с сильными окислителями (галогены, h3SО4 конц., К2Сr2O2), так и с достаточно слабыми (например, восстанавливают Au, Ag, Pt, Pd из растворов их солей). Фосфористая кислота при этом превращается в фосфорную.
Примеры реакций:
h4PO3 + 2AgNO3 + Н2О = h4PO4 + 2Ag↓ + 2HNO3
h4PO3 + Cl2 + Н2О = h4PO4 + 2HCl
При нагревании в воде Н3РO3 окисляется до h4PO4 с выделением водорода:
h4PO3 + Н2О = h4PO4 + Н2
Реакция диспропорционирования
При нагревании безводной кислоты происходит диспропорционирование: 4Н3РO3 = ЗН3РO4 + РН3
Фосфиты - соли фосфористой кислоты
Двухосновная фосфористая кислота образует два типа солей:
а) однозамещенные фосфиты (кислые соли), в молекулах которых атомы металлов связаны с анионами Н2Р03.
Примеры: Nah3PO3, Са(h3PO3)
б) двухзамещенные фосфиты (средние соли), в молекулах которых атомы металлов связаны с 2- 1 анионами HPO3.
Примеры: Na2HPO3, СаHPO3.
Большинство фосфитов плохо растворимы в во-де, хорошо растворяются только фосфиты щелочных металлов и кальция.
Н3РO4 - ортофосфорная кислота
3-основная кислота средней силы. Диссоциация протекает в основном по 1-й ступени:
Н3РO4 → Н+ + Н2РO4-
По 2-й и 3-й ступеням диссоциация протекает в ничтожно малой степени:
Н2РO4- → Н+ + НРO42-
НРO42- → Н+ + РO43-
Физические свойства
При обычной температуре безводная Н3РO4 представляет собой прозрачное кристаллическое вещество, очень гигроскопичное и легкоплавкое (т. пл. 42°'С). Смешивается с водой в любых соотношениях.
Способы получения
Исходным сырьем для промышленного получения Н3РO4 служит природный фосфат Са3(РO4)2:
I. 3-стадийный синтез:
Са3(РO4)2 → Р → Р2O5 → Н3РO4
II. Обменное разложение фосфорита серной кислотой
Са3(РO4)2 + 3h3SO4 = 2Н3РO4 + 3CaSO4↓
Получаемая по этому способу кислота загрязнена сульфатом кальция.
III. Окисление фосфора азотной кислотой (лабораторный способ):
ЗР + 5HNO3 + 2Н2О = ЗН3РO4 + 5NO↑
Химические свойства
Н3РO4 проявляет все общие свойства кислот - взаимодействует с активными металлами, с основными оксидами и основаниями, образует соли аммония.
Примеры реакций:
2Н3РO4 + 6Na = 2Na3РO4 + 3h3t
2Н3РO4 + ЗСаО = Са3(РO4)2 + ЗН2О
в) со щелочами, образуя средние и кислые соли
Н3РO4 + 3NaOH = Na3PO4 + ЗН2О
Н3РO4 + 2NaOH = Na2HPO4 + 2Н2О
Н3РO4 + NaOH = Nah3PO4 + Н2О
Н3РO4 + Nh4 = Nh5h3PO4
Н3РO4 + 2Nh4 = (Nh5)2HPO4
В отличие от аниона NO3- в азотной кислоте, анион РO43- окисляющим действием не обладает.
Реактивом для обнаружения анионов РO43- (а также НРO42- , Н2РO4-) является раствор AgNO3, при добавлении которого образуется нерастворимый желтый фосфат серебра:
ЗАg+ + РO43- = Аg3РO4↓
Сложные эфиры нуклеозидов и фосфорной кислоты являются структурными фрагментами природных биополимеров - нуклеиновых кислот.
Фосфатные группы входят также в состав ферментов и витаминов.
Фосфаты. Фосфорные удобрения.
Н3РO4 как 3-основная кислота образует 3 типа солей, которые имеют большое практическое значение.
Название | Анион соли | Растворимость в воде | Примеры солей |
Фосфаты | PO43- | большинство нерастворимо (кроме фосфатов щелочных Me и аммония) | Na3РO4; Са3(РO4)2 |
Гидрофосфаты | HPO42- | растворимы | Na2НРO4; СаНРО4 |
Дигидрофосфаты | Н2РO4- | очень хорошо растворимы | Nah3PO4; Са(Н2РO4)2 |
Растворимые соли фосфорной кислоты в водных растворах подвергаются гидролизу.
Фосфаты и гидрофосфаты кальция и аммония используются в качестве фосфорных удобрений.
1. Фосфоритная мука - тонкоизмельченный природный фосфат кальция Са3(РO4)2
2. Простой суперфосфат - Са3(РO4)2 + 2h3SO4 = Са(Н2РO4)2 + 2CaSO4
3. Двойной суперфосфат - Са3(РO4)2 + 4Н3РO4 = ЗСа(Н2РO4)2
4. Преципитат - Са(ОН)2 + Н3РO4 = СаНРO4 + 2Н2О
5. Аммофос - Nh4 + Н3РO4 = Nh5Н2РO4;
2Nh4 + Н3РO4 = (Nh5)2HРO4
6. Аммофоска - Аммофос + KNO3
examchemistry.com
получение и взаимодействие :: SYL.ru
Оксид фосфора и кислоты, возникающие при его растворении в воде, — ценное сырье для химической промышленности. Простое вещество горит в кислороде с образованием белого дыма — так получают оксид в лаборатории. Продукт реакции используется в современных отраслях производственной деятельности как сырье для получения термическим методом различных фосфорных кислот. Затем эти вещества используются при выпуске комплексных и сложных минеральных удобрений (туков).
Элемент № 15
Фосфор — элемент 15-й группы длинного варианта периодической таблицы. Прежняя классификация отводила ему место в главной подгруппе пятой группы. Химический знак — Р — это первая буква латинского названия Phosphorus. Другие важные характеристики:
- относительная атомная масса — 31;
- заряд ядра — +15;
- электронов — 15;
- валентных электронов — 5;
- неметаллический элемент.
Фосфору требуется 3 электрона для завершения внешней электронной оболочки, ее октета. В химических реакциях с металлами элемент принимает электроны и достраивает свой валентный слой. В этом случае он восстанавливается, является окислителем. При взаимодействии с более сильными неметаллами фосфор отдает несколько или все валентные электроны, тоже получая завершенное строение внешнего уровня. Эти изменения связаны с активными восстановительно-окислительными свойствами элемента. Например, атомы в составе простого вещества окисляются при горении на воздухе или в кислороде. Могут получиться два рода соединений — оксид фосфора трех- или пятивалентного. Какой продукт будет преобладать, зависит от условий проведения реакции. Типичная валентность, проявляемая фосфором в его соединениях, составляет III(-), III(+), V(+).
 «Элемент жизни и мысли»
«Элемент жизни и мысли»
Выдающийся российский геохимик Е. Ферсман одним из первых обратил внимание на богатое содержание в организме человека атомов фосфора. Они входят в состав важнейших органов, клеточных структур и веществ: костной системы, зубов, нервной ткани, белков и аденозинтрифосфорной кислоты (АТФ). Признанием «заслуг» в живой природе стала знаменитая фраза академика Ферсмана, что Phosphorus — «элемент жизни и мысли».
Фосфор также широко распространен в составе земной коры. В свободном виде атомы Р не встречаются, ведь они легко окисляются — вступают во взаимодействие с кислородом, в результате чего получается оксид фосфора (Р2О5). Существует несколько аллотропных видоизменений элемента, которые объединяются в три группы — белый, красный и черный. Кристаллическая решетка белого фосфора образована молекулами Р4. Лабораторные опыты в образовательных учреждениях обычно проводят с красной модификацией. Она неядовитая, в отличие от белой разновидности.

Получение и свойства трехвалентного оксида фосфора
Если сжигание простого вещества производится при недостатке воздуха, то получается фосфористый ангидрид (Р2О3 — его формула). Оксид фосфора (III) — так звучит современное название вещества. Это белый кристаллический порошок, который плавится уже при 24 °С, то есть является неустойчивым при нагревании. При низких температурах составу трехвалентного оксида соответствует формула Р4О6. Соединение медленно растворяется в воде с образованием фосфористой кислоты Н3РО3. Она тоже является менее стойкой, чем соединения пятивалентного фосфора.
Название «ангидрид фосфористой кислоты» отражает химическое свойство — способность оксида при гидратации давать начало молекулам кислоты. Теряя электроны, атомы Р в составе трехвалентных соединений окисляются до устойчивого пятивалентного состояния. Фосфористый ангидрид и соответствующая ему кислота являются сильными восстановителями (отдают валентные электроны).
Оксид фосфора (V). Лабораторный способ получения
Образование фосфорного ангидрида происходит при сгорании (окислении) красного или белого фосфора. Реакцию можно проводить в чистом кислороде либо сжигать реагент в воздухе. После прекращения процесса горения, проходящего с выделением белого дыма, в осадке получаем рыхлую белую массу. Это оксид фосфора. Получение его следует проводить под вытяжкой, потому что частички раздражают слизистые покровы органов дыхания.
Можно набрать красный фосфор в ложечку для сжигания веществ, закрепленную в резиновой пробке с отверстием. Вещество следует зажечь, а когда начнется горение — опустить в стекляную термостойкую колбу. Емкость, закрытая пробкой, наполнится клубами дыма, состоящими из молекул димера фосфорного ангидрида (Р4О10 — его формула). Оксид фосфора (V) — название этого вещества. Когда весь кислород в емкости израсходуется, горение прекратится, и белый дым осядет.
Взаимодействие оксида фосфора с водой. Получение фосфорных кислот
Обычно состав пентаоксида фосфора записывают в таком виде: Р2О5. Можно при его получении налить в колбу немного воды и взболтать. Белый дым растворится с образованием кислоты. Для того чтобы доказать ее присутствие, надо опустить в раствор бумажную полоску универсального индикатора, ее цвет изменится с желтого на красный, что характерно для кислых жидкостей. В колбе взаимодействуют вода и оксид фосфора. Реакции получения кислот сопровождаются их диссоциацией в водном растворе на кислотные остатки, а также ионы водорода, точнее, гидроксония.
- При сгорании фосфора идет реакция соединения: 4Р + 5О2 = Р4О10.
- Растворение полученного ангидрида в холодной воде происходит с образованием метафосфорной кислоты: Р2О5 + Н2О = 2НРО3.
- Кипячение раствора приводит к появлению в нем ортофосфорной кислоты: НРО3 + Н2О = Н3РО4.
Диссоциация кислоты идет в водном растворе ступенчато: легче всего отрывается один протон, и возникает дегидрофосфат-анион Н2РО4–. Фосфорному ангидриду соответствует не одна только ортофосфорная кислота. Оксид фосфора (V) при растворении в воде дает смесь кислот.

Реакции с оксидами металлов
С веществом Р2О5 вступает в реакцию оксид натрия. Оксид фосфора также взаимодействует с аналогичными соединениями при нагревании (сплавлении). Состав получаемых фосфатов зависит от реагентов и условий протекания реакции. 3Na2O + Р2О5 = 2Na3PO4 — ортофосфат натрия (средняя соль). Взаимодействие исследуемого вещества со щелочами идет с образованием соли и воды.
Промышленный способ получения фосфорного ангидрида
Производят Р2О5 при сжигании технического фосфора. Это гигроскопичное вещество, поэтому предварительно его осушают. В специальной камере при высокой температуре происходит реакция окисления фосфора до разных форм Р4О10. Эту белую парообразную массу очищают и применяют как водоотнимающее вещество для осушения различных промышленных газов. Из фосфорного ангидрида получают ортофосфорную кислоту. Метод заключается в восстановлении природного сырья до молекулярного фосфора, его сжигании и растворении в воде продукта горения.

Фосфорные удобрения
«Элемент жизни» играет важную роль в образовании АТФ и белков в клетках, энергетическом обмене в организме растений. Но ежегодно с урожаем из почвы выносится значительная часть элементов питания. Для их восполнения вносят минеральные и органические удобрения. Фосфор — один из трех макроэлементов, кроме него к этой группе относятся азот и калий.
Фосфорные удобрения — суперфосфаты — получают из горных пород и минералов при обработке их кислотами. В последние годы основные усилия туковой отрасли направлены на выпуск сложных и комплексных удобрений. Они содержат несколько элементов питания, что делает их применение экономически более выгодным.
www.syl.ru
36. Оксиды фосфора и фосфорные кислоты
Элемент фосфор образует ряд оксидов, наиболее важными из них являются оксид фосфора (III) P2O3 и оксид фосфора (V) P2O5 .
Оксид фосфора (III), или фосфористый ангидрид (P2O3) получают при медленном окислении фосфора, сжигая его в недостатке кислорода. Представляет собой воскообразную кристаллическую белую массу с температурой плавления 22,5 °C. Ядовит.
Химические свойства:
1) вступает в реакцию с холодной водой, образуя при этом фосфористую кислоту h4PO3;
2) взаимодействуя с щелочами, образует соли – фосфиты;
3) является сильным восстановителем.
Взаимодействуя с кислородом, окисляется до оксида фосфора (V) P2O5.
Оксид фосфора (V), или фосфорный ангидрид (P2O5) получают при горении фосфора на воздухе или в кислороде. Представляет собой белый кристаллический порошок, с температурой плавления 36 °C.
Химические свойства:
1) взаимодействуя с водой, образует орто-фосфорную кислоту h4PO4;
2) имея свойства кислотного оксида, вступает в реакции с основными оксидами и гидроксидами;
3) способен к поглощению паров воды.
Фосфорные кислоты.
Фосфорному ангидриду соответствует несколько кислот. Главная из них – ортофосфорная кислота h4PO4 . Фосфорная кислота обезвоженная представлена в виде бесцветных прозрачных кристаллов, имеющих температуру плавления 42,35 °C и хорошо растворяющихся в воде.
Образует три вида солей:
1) средние соли – ортофосфаты;
2) кислые соли с одним атомом водорода;
3) кислые соли с двумя атомами водорода.
Получение фосфорной кислоты:
1) в лаборатории: 3P + 5HNO3 + 2h3O = 3h4PO4 +5NO?;
2) в промышленности: а) термический метод; б) экстракционный метод: Ca3(PO4)2 + 3h3SO4 = CaSO4? + 2 h4PO4.
Природные фосфаты восстанавливают до свободного фосфора, который сжигают на воздухе, либо в кислороде. Продукт реакции растворяют в воде.
Остальные фосфорные кислоты в зависимости от способа соединения групп PO4 образуют 2 вида кислот: полифосфорные кислоты, которые состоят из цепочек – PO3—О—PO3—... и метафосфорные кислоты, которые состоят из колец, образованных PO4.
Применение: ортофосфорную кислоту используют при производстве удобрений, химических реактивов, органических соединений, для приготовления защитных покрытий на металлах. Фосфаты используют в производстве эмалей и фармацевтике. Метафосфаты входят в состав моющих средств.
– Nh5h3PO4 или (Nh5)2h3PO4.
Нитрофоска получается при сплавлении гидрофосфата аммония, нитрата аммония и хлорида (сульфата) натрия.
38. Углерод и его свойства
Углерод (С) – типичный неметалл; в периодической системе находится в 2-м периоде IV группе, главной подгруппе. Порядковый номер 6, Ar = 12,011 а.е.м., заряд ядра +6. Физические свойства: углерод образует множество аллотропных модификаций: алмаз – одно из самых твердых веществ, графит, уголь, сажа .
Химические свойства: электронная конфигурация: 1s22 s22p2 . На электронной оболочке атома – 6 электронов; на внешнем валентном уровне – 4 электрона. Наиболее характерные степени окисления: +4, +2 – в неорганических соединениях, – 4, -2 – в органических. Углерод в любом гибридном состоянии способен использовать все свои валентные электроны и орбитали. У 4-валентного углерода нет неподеленных электронных пар и нет свободных орбиталей – углерод химически относительно устойчив. Характерно несколько типов гибридизации: sp, sp2 , s p3. При низких температурах углерод инертен, но при нагревании его активность возрастает. Углерод – хороший восстановитель, но соединяясь с металлами и образуя карбиды , он выступает окислителем:
Углерод (кокс) вступает в реакции с оксидами металлов:
Таким образом выплавляют металл из руды. При очень высоких температурах углерод реагирует со многими неметаллами. Огромное количество органических соединений он образует с водородом – углеводороды. В присутствии никеля (Ni) углерод, реагируя с водородом, образует предельный углеводород – метан: С + Н2 = СН4.
При взаимодействии с серой образует сероуглерод: С + 2S2 = СS2.
При температуре электрической дуги углерод соединяется с азотом, образуя ядовитый газ дициан : 2С + N2 = С2N2?.
В соединении с водородом дициан образует синильную кислоту – НСN. С галогенами углерод реагирует в зависимости от их химической активности, образуя галогениды. На холоде реагирует со фтором: С + 2F2 = СF2.
При 2000 °C в электропечи углерод соединяется с кремнием, образуя карборунд: Si + C = SiC.
Нахождение в природе: свободный углерод встречается в виде алмаза и графита. В виде соединений углерод находится в составе минералов: мела, мрамора, известняка – СаСО3, доломита – MgCO3?CaCO3; гидрокарбонатов – Mg(НCO3)2 и Са(НCO3)2, СО2 входит в состав воздуха; углерод является главной составной частью природных органических соединений – газа, нефти, каменного угля, торфа, входит в состав органических веществ, белков, жиров, углеводов, аминокислот, входящих в состав живых организмов.
studfiles.net
Оксид фосфора(V) - это... Что такое Оксид фосфора(V)?
Пентаокс́ид фосфора (фо́сфорный ангидрид, пятиокись фосфора, оксид фосфора(V)) — P2O5, кислотный оксид.
Строение
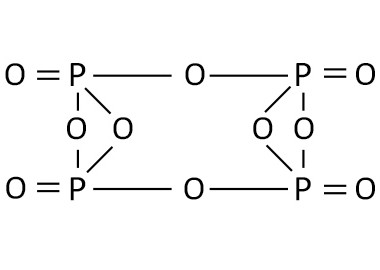
Пары оксида фосфора(V) имеют состав P4O10. Твердый оксид склонен к полиморфизму. Существует в аморфном стекловидном состоянии и кристаллическом. Для кристаллического состояния известны две метастабильные модификации пентаоксида фосфора — гексагональная Н-форма (а = 0,744 нм, = 87°, пространств, гр. R3С) и орторомбическая О-форма (а = 0,923 нм, b — 0,718 нм, с = 0,494 нм, пространств, гр. Рпат), а также одна стабильная орторомбическая О-форма (а =1,63 нм, b= 0,814 нм, с =0,526 нм, пространств. гр. Fdd2). Молекулы P2O5 (Н-форма) построены из 4 групп PO4 в виде тетраэдра, вершины которого занимают атомы фосфора, 6 атомов кислорода располагаются вдоль ребер, а 4 — по оси третьего порядка тетраэдра. Эта модификация легко возгоняется (360оС) и активно взаимодействует с водой. Другие модификации имеют слоистую полимерную структуру из тетраэдров PO4, объединенные в 10-членные (О-форма) и 6-членные (О'-форма) кольца. Эти модификации имеют более высокую температуру возгонки (~580оС) и менее химически активны. H-форма переходит в О-форму при 300—360оC.
Свойства
P4O10 очень активно взаимодействует с водой (H-форма поглощает воду даже со взрывом), образуя смеси фосфорных кислот, состав которых зависит от количества воды и других условий:

Он также способен извлекать воду из других соединений, представляя собой сильное дегидратирующее средство:


Оксид фосфора(V) широко применяется в органическом синтезе. Он реагирует с амидами, превращая их в нитрилы:

Карбоновые кислоты переводит в соответствующие ангидриды:

Оксид фосфора(V) также взаимодействует со спиртами, эфирами, фенолами и другими органическими соединениями. При этом происходит разрыв связей P—О—P и образуются фосфорорганические соединения. Реагирует с Nh4 и с галогеноводородами, образуя фосфаты аммония и оксигалогениды фосфора:

При сплавлении P4O10 с основными оксидами образует различные твердые фосфаты, природа которых зависит от условий реакции.
Получение
Оксид фосфора(V) получают сжиганием фосфора. Технологический процесс происходит в камере сжигания и включает в себя окисление элементарного P предварительно осушенным воздухом, осаждение P4O10 и очистку отходящих газов. Очищают полученный пентаоксид возгонкой.

Технический продукт имеет вид белой снегообразной массы, состоящей из смеси разных форм P4O10.
Применение
P4O10 применяют как осушитель газов и жидкостей. Также он является промежуточным продуктом в производстве ортофосфорной кислоты h4PO4 термическим способом.
Широко используется в органическом синтезе в реакциях дегидратации и конденсации.
Литература
- Ахметов Н. С. «Общая и неорганическая химия» М.: Высшая школа, 2001
- Реми Г. «Курс неорганической химии» М.: Иностранная литература, 1963
- Ф. Коттон, Дж. Уилкинсон «Современная неорганическая химия» М.: Мир, 1969
- Зефиров Н.С. и др. т.5 Три-Ятр // Химическая энциклопедия. — М.: Большая Российская Энциклопедия, 1998. — 783 с. — ISBN 5-85270-310-9
dic.academic.ru



















