Адсорбция воды на цеолитах типа ZSM-5. Адсорбция воды
Адсорбция - вода - Большая Энциклопедия Нефти и Газа, статья, страница 4
Адсорбция - вода
Cтраница 4
Теплота адсорбции воды на платине вычислена из теплоты адсорбции кислорода на металле и теплоты реакции водорода с адсорбированным кислородом; она оказалась равной 5500 кал. Теплоты для необратимой адсорбции кислорода на угле были найдены значительно большими, чем для обратимой адсорбции. Гарнер [50] считает это случайным, потому что для осуществления необратимого химического процесса не требуется очень большой теплоты реакции. [46]
Измерения адсорбции воды на этих образцах подтверждают этот вывод. Полученные результаты могут быть объяснены, во-первых, неоптим. Во-вторых, возможно проявление влияния остающихся на поверхности широкопористого стекла неотмывающихся ионов натрия, изменяющих полярность и адсорбционный потенциал сорбента. [48]
Изотерма адсорбции воды на образце аэросила, откачанном при 400 С, в результате небольшой хемосорбции на уже имеющихся дегидроксилированных местах поверхности кремнезема-необратима, и после десорбции при 25 С на поверхности удерживается 2 3 мкмоль / м2 адсорбированной воды. Как следует из рис. 52, количество свободных гидроксильных групп, вовлеченных в специфическое взаимодействие с водой после откачки при 600 С, меньше, чем после откачки при 400 С. [49]
Способность адсорбции воды глинами по существу определяется равновесиями адсорбции ионов в этих системах. Натриевые глины наименее проницаемы для воды; однако, как показали Грехэм и Салливан63, кальциевые и водородные глины обладают гораздо лучшей проницаемостью. [50]
Изотермы адсорбции воды, бензола и гексана на цеолите ЦВК. [51]
Определение адсорбции воды позволяет установить, что удельная поверхность геля равна примерно 5 5X10 6 см2 / смг, или около 2 млн. см2 / г. Для сравнения напомним, что удельная поверхность негид-ратированного цемента находится в пределах 2000 - 5000 см2 / г. В связи с рассмотрением пористой структуры уместно заметить, что цементный камень, полученный при автоклавной обработке при высоком давлении, имеет удельную поверхность лишь около 70000 см2 / г. Это указывает на совершенно различный размер частиц продуктов гидратации при высоком давлении и высокой температуре. Представляется, что пропаривание приводит к образованию почти полностью микрокристаллического вещества. [52]
Изотерма адсорбции воды из минерального масла ХФ 22 - 24 также линейна. Для более гигроскопичного синтетического масла ХФ 22С - 16 изотерма адсорбции воды выпукла ( рис. 30) по отношению к оси концентрации. [54]
Изотерма адсорбции воды из раствора в метиловом спирте не имеет линейного участка; следовательно, метиловый спирт не вытесняется полностью из адсорбционного объема во всем интервале концентраций. [55]
Теплота адсорбции воды на неорганических солях соответствует значениям, приведенным в табл. 4 1, или даже несколько выше [103], поэтому значения энтропии адсорбции должны быть на том же уровне. В связи с этим малая подвижность сорбированных молекул воды является вполне обоснованной. [57]
Из-за очень малой адсорбции воды на графоне не удается надежно рассчитать термодинамические характеристики из изотерм -, измеренных при двух температурах. [58]
Хотя адсорбцию воды и спирта на А1203 и Zr02 можно рассматривать как ван-дер-ваальсову адсорбцию ( взаимодействие иона с постоянным диполем), тем не менее она столь близка к хемоеорбции, что значительная доля специфичности не слишком удивительна. Это особенно справедливо и в отношении адсорбции воды. Вода является веществом, полярность которого особенно сильно проявляется при адсорбции. Действительно, абсолютные значения величин дипольных моментов многих других молекул больше, чем для воды, но вода обладает самым большим диполем на единицу поверхности. Если разделить дипольный момент на площадь, которую занимает молекула на поверхности адсорбента ( принимая упаковку аналогичную жидкости), то для воды получается величина большая, чем для каких-либо других молекул, за исключением р-ни-троанилина. Дипольный момент воды в расчете на единицу поверхности почти вдвое больше, чем у метилового спирта, и почти в два с половиной раза больше, чем у этилового спирта; он больше чем в полтора раза превышает момент аммиака и более чем в два раза - сернистого газа. Таким образом, адсорбция воды на ионных адсорбентах занимает до некоторой степени обособленное место в ван-дер-ваальсовой адсорбции. [59]
Хотя адсорбцию воды и спирта на А1203 и Zr02 можно рассматривать как ван-дер-ваальсову адсорбцию ( взаимодействие иона с постоянным диполем), тем не менее она столь близка к хемосорбции, что значительная доля специфичности не слишком удивительна. Это особенно справедливо и в отношении адсорбции воды. Вода является веществом, полярность которого особенно сильно проявляется при адсорбции. Действительно, абсолютные значения величин дипольных моментов многих других молекул больше, чем для воды, но вода обладает самым большим диполем на единицу поверхности. Если разделить дипольный момент на площадь, которую занимает молекула на поверхности адсорбента ( принимая упаковку аналогичную жидкости), то для воды получается величина большая, чем для каких-либо других молекул, за исключением JD-НИ-троанилина. Имеется несколько других соединений, обладающих такими же величинами, как и вода, это - нитроэтан, нитрометан, / - нитрофенол и ацетонитрил, но ни одно из этих соединений не применялось широко в качестве адсорбируемого вещества. Дипольный момент воды в расчете на единицу поверхности почти вдвое больше, чем у метилового спирта, и почти в два с половиной раза больше, чем у этилового спирта; он больше чем в полтора раза превышает момент аммиака и более чем в два раза - сернистого газа. Таким образом, адсорбция воды на ионных адсорбентах занимает до некоторой степени обособленное место в ван-дер-ваальсовой адсорбции. [60]
Страницы: 1 2 3 4
www.ngpedia.ru
Лекция 4. Адсорбция
4
Адсорбция
Адсорбция является универсальным методом, позволяющим практически полностью извлечь примесь из газовой или жидкой среды. В химической промышленности, в частности в ТНВ, адсорбционный метод широко используется для гладкой очистки и осушки технологических потоков, улучшения качества сырья и продуктов и является одним из методов защиты окружающей среды.
Адсорбция – это концентрирование веществ на поверхности или в объеме твердого тела. В процессе адсорбции участвуют как минимум два компонента. Твердое вещество, на поверхности или в объеме которого происходит концентрирование поглощаемого вещества, называется адсорбентом. Поглощаемое вещество, находящееся в газовой или жидкой фазе называется адсорбтивом, а после того, как оно перешло в адсорбированное состояние – адсорбатом. Любое твердое вещество обладает поверхностью, и следовательно, потенциально является адсорбентом. Однако, в технике используют твердые адсорбенты с развитой внутренней поверхностью. Развитие внутренней поверхности в твердом теле достигается путем создания специальных условий в процессе его синтеза или в результате дополнительной обработки.
С термодинамической точки зрения адсорбция проявляется с уменьшением свободной энергии Гиббса (G). Как и все процессы, сопровождающие уменьшением энергии Гиббса, адсорбция является самопроизвольным процессом. Переход вещества из газовой или жидкой фазы в адсорбированное состояние связан с потерей по меньшей мере одной степени свободы, (трехмерная объемная газовая или жидкая фаза двухмерная поверхностная фаза), что ведет к уменьшению энтропии системы (S). Поскольку энтальпия (Н) связана с энергией Гиббса и энтропией уравнением Н = G + TS, то в процессе адсорбции она убывает, и следовательно, адсорбция – процесс экзотермический.
Адсорбционные явления делят на два основных типа: физическую адсорбцию и хемосорбцию (сорбцию, основанную на силах химического взаимодействия). Физическая адсорбция вызывается силами молекулярного взаимодействия: дисперсионными и электростатическими. Дисперсионные силы вносят основной вклад в энергию взаимодействия молекул. Так, молекулы любого адсорбтива обладают флуктуирующими диполями и квадруполями, вызывающими мгновенные отклонения распределения электронной плотности от среднего распределения. При сближении молекул адсорбтива с атомами или молекулами адсорбента движение флуктуирующих диполей приобретает систематический и строго упорядоченный характер, что приводит к возникновению притяжения между ними. В ряде случаев дисперсионные силы усиливаются электростатическими силами – ориентационными и индукционными. Ориентационные силы возникают при взаимодействии полярных молекул с поверхностью, содержащей, электростатические заряды (ионы, диполи), а индукционные – вызываются изменением электронной структуры молекул адсорбтива и адсорбента под действием друг друга.
В отличие от физической адсорбции, при хемосорбции не сохраняется индивидуальность адсорбтива и адсорбента. При сближении молекул адсорбтива с поверхностью адсорбента происходит перераспределение электронов взаимодействующих компонентов с образованием химической связи. Если физическую адсорбцию можно сравниь с конденсацией, то хемосорбция рассматривается как химический процесс, протекающий на поверхности раздела фаз.
Физическую адсорбцию и хемосорбцию можно отличить на основании численного значения теплоты адсорбции. Теплота адсорбции компонентов промышленных газов соизмерима с теплотой их конденсации и не превышает 85-125 кДж/моль. Теплота хемосорбции одного моля вещества достигает нескольких сотен кДж. Хемосорбция, как правило, протекает с небольшой скоростью, это обстоятельство часто используется для ее распознания. Кроме того, хемосорбция может протекать при высоких температурах, когда физическая адсорбция пренебрежимо мала. При хемоморбции характерным является резкое, скачкообразное изменение поглотительной способности по извлекаемому компоненту при переходе от адсорбента одной химической природы к адсорбенту другой природы. При хемосорбции адсорбированные молекулы не могут перемещаться по поверхности адсорбента, их положение фиксировано, и такая адсорбция называется локализованной. Физическая адсорбция может быть как локализованной, так и не локализованной. Обычно, при повышении температуры молекулы приобретают подвижность и характер процесса изменяется: локализованная адсорбция переходит в нелокализованную.
Структура и применение промышленных адсорбентов
Большинство промышленных адсорбентов отличается «ажурной» внутренней структурой, включающей поры различного размера. При этом решающее влияние на адсорбционную способность и скорость поглощения оказывает содержание мелких пор в единице объема или массы адсорбента. В зависимости от размеров поры подразделяют на три типа: микро-, мезо- (переходные) и макропоры.
Микропоры – наиболее мелкие поры, имеют размеры, соизмеримые с размерами адсорбируемых молекул. Их эффективные радиусы находятся в интервале от 5 до 15А. Суммарный объем промышленных адсорбентов обычно не превышает 0,5 см3/г. Характерной чертой адсорбции в микропорах является существенное повышение энергии адсорбции по сравнению с адсорбцией в более крупных порах. Например, при одинаковом количестве поглощенного n-гексана активным углем с микропорами и макропористой активной сажей энергия адсорбции в первом случае в 1,6 раза больше, чем во втором. В случае поглощения паров (или газов) повышение энергии адсорбции в микропорах приводит к резкому возрастанию адсорбционной способности в области малых равновесных давлений. В таких промышленных адсорбентах, как активные угли или синтетические цеолиты, размеры микропор соизмеримы с размерами промежутков между порами, образованных веществом адсорбента. Это приводит к тому, что все атомы или молекулы вещества адсорбента находятся во взаимодействии с молекулами адсорбата в микропорах, то есть во всем пространстве микропор существует поле адсорбционных сил. В этом заключается основное отличие адсорбции в микропорах от адсорбции в более крупных порах. Адсорбция в микропорах сводится к объемному заполнению адсорбционного пространства микропор адсорбируемыми молекулами. Основными параметрами микропор являются их объем и обобщенная характеристика их размеров.
Переходные поры. Эффективные радиусы мезопор гораздо больше размеров адсорбируемых молекул и колеблются от 15 до 1000-2000 А. Стенки таких пор образованы очень большим числом атомов или молекул вещества адсорбента. Для этого случая приобретает физический смысл понятие о поверхности раздела фаз, то есть о поверхности пор адсорбента. Обычно поверхность адсорбента относят к единице его массы и пользуются понятием удельной поверхности. Для мезопор действие адсорбционных сил проявляется не во всем их объеме, а только на небольшом расстоянии от стенок. Поэтому на поверхности пор происходит мономолекулярная или полимолекулярная адсорбция паров, то есть образование последовательных адсорбционных слоев, завершающееся заполнением пор по механизму капиллярной конденсации. Основными параметрами переходных пор являются удельная поверхность, объем пор и функция распределения объема пор по размерам. В зависимости от количества пор и их радиусов удельные поверхности мезопористых адсорбентов могут находится в интервале от 10 до 500 м2/г. С помощью переходных пор осуществляется подвод вещества к микропорам, и их еще называют транспортными порами.
Макропоры имеют эффективные радиусы больше 1000-2000 А. Их удельная поверхность очень мала от 0,5 до 2 м2/г, вследствие чего адсорбцией на поверхности этих пор можно пренебречь. Объем макропор у активных углей составляет от 0,2 до 0,8 см3/г.
Все адсорбенты в соответствии с преобладающим размером пор делят на три класса: макропористые, мезопористые и микропористые. Некоторые макропористые адсорбенты применяются в хроматографии, где адсорбируются органические вещества, имеющие молекулы большого размера. К переходнопористым адсорбентам принадлежит большое число силикагелей, алюмогелей, алюмосиликатных катализаторов, а также многие виды природных глин, применяемых для удаления относительно крупных молекул из различных жидких сред, например, при очистке масел. Типичными представителями микропористых адсорбентов являются дегидратированные кристаллические алюмосиликаты – цеолиты и некоторые типы активных углей. Подавляющее большинство промышленных адсорбентов, применяемых для очистки газов и рекуперации паров, например, активные угли и силикагели, содержат широкую гамму пор различного размера и относятся к смешанным структурным типам.
Адсорбционные равновесия. Типы изотерм адсорбции.
Всякий технологический адсорбционный процесс, независимо от того, по какой схеме он осуществляется – периодической или непрерывной, включает ряд обязательных стадий, в первую очередь, стадию адсорбции и десорбции. Только комплексное рассмотрение равновесных и кинетических закономерностей позволяет выявить оптимальные условия осуществления процесса в целом. Большинство промышленных адсорбционных процессов основано на избирательном поглощении отдельных компонентов парогазовой смеси из потока газа-носителя. Адсорбционная способность при поглощении пара или газа зависит от типа адсорбента, его пористой структуры, природы поглощаемого вещества, его парциального давления и температуры.
При равновесии для выбранной системы адсорбент - адсорбтив количество поглощенного газа или пара является функцией парциального давления поглощаемого вещества и температуры:
а = f (p, T),
это уравнение является термическим, то есть оно справедливо в любых заданных температурных условиях процесса. В качестве характеристики адсорбционных свойств пористых тел используют зависимость адсорбционной способности от давления при постоянной температуре (изотерму адсорбции)
а = f (p) при Т=const.
Изотерма адсорбции является источником информации о структуре адсорбента, тепловом эффекте адсорбции и ряде других физико-химических и технологических характеристик. Брунауэр выделил пять основных типов изотерм адсорбции
Рис. 1. Основные типы изотерм адсорбции
В случае технических адсорбентов тип I характерен для микропористых адсорбентов, практически не содержащих переходных пор. Начальные выпуклые участки изотерм типов II и IV указывают на присутствие существенного объема микропор наряду с макро и мезопорами. Менее крутой начальный подъем кривых характерен для переходнопористых адсорбентов, где осуществляется моно- и полимолекулярная адсорбция. Вогнутые начальные участки редко встречающихся изотерм типов III и V характерны для систем, где взаимодействие молекул адсорбата с адсорбентом намного меньше межмолекулярного взаимодействия молекул адсорбата, например, вызванного проявлением водородных связей. Основное отличие изотерм II от IV и III от V типов заключается в том, что объем переходных пор (IV и V типы) в результате капиллярной конденсации заполняется адсорбатом раньше, чем относительное давление приблизится к единице. В результате этого на изотермах появляется верхний, почти горизонтальный участок. При описании адсорбционного равновесия количества поглощенного вещества обычно выражают в молях на грамм адсорбента, граммах на 100 г адсорбента ( то есть в массовых %), а иногда в граммах на см3 адсорбента.
Кинетика адсорбции
Кинетика адсорбции рассматривает вопросы диффузии в единичных гранулах адсорбента и скорость отработки адсорбционной емкости этих гранул. Кинетику адсорбции в потоке газа изучают, используя единичные гранулы адсорбента и слой толщиной в одну гранулу. На экспериментальных установках получают первичную информацию о скорости адсорбции, то есть о скорости насыщения гранулы адсорбатом. Обычно в качестве основной кинетической зависимости принимают изменение адсорбционной емкости во времени в потоке газа-адсорбтива а = f () или степени отработки адсорбционной емкости от времени
= а/а = f (), а - равновесная адсорбционная емкость.
Ч тобы провести опыт в чисто внутридиффузионной области и исключить фактор влияния скорости подвода вещества к внешней поверхности гранулы, предварительно проводят серию опытов при разных последовательно увеличивающихся скоростях потока. При этом выбирают такую минимальную скорость потока, выше которой дальнейшее увеличение скорости уже не приводит к изменению формы кинетической кривой. Обычно влияние фактора подвода вещества на скорость отработки адсорбционной емкости гранул практически исключается при линейной скорости потока 0,25 м/с и объемной скорости 1,5 л/см3 мин и выше.
тобы провести опыт в чисто внутридиффузионной области и исключить фактор влияния скорости подвода вещества к внешней поверхности гранулы, предварительно проводят серию опытов при разных последовательно увеличивающихся скоростях потока. При этом выбирают такую минимальную скорость потока, выше которой дальнейшее увеличение скорости уже не приводит к изменению формы кинетической кривой. Обычно влияние фактора подвода вещества на скорость отработки адсорбционной емкости гранул практически исключается при линейной скорости потока 0,25 м/с и объемной скорости 1,5 л/см3 мин и выше.
Коэффициент диффузии
Проникновение адсорбата внутрь зерна адсорбента процесс диффузионный, и следовательно, характеризуется коэффициентом диффузии. Под коэффициентом диффузии понимают количество вещества, диффундирующего в единицу времени через квадратный см поверхности при градиенте концентрации, равном единице. В технической адсорбции D определяют по приближенной зависимости
D = kr2/20,5,
где r – радиус гранулы; k - коэффициент, зависящий от формы гранул; - время полуотработки адсорбционной емкости, то есть промежуток времени, прошедший от начала опыта до того момента, когда количество адсорбированного вещества достигнет 50% от равновесной адсорбционной емкости. Для шара k = 0,308. Для цилиндра значение k зависит от соотношения длины гранулы к радиусу. Численное значение коэффициента диффузии, как правило находится в интервале (1-20)10-5 см2/г
Виды переноса вещества в пористом теле
Поскольку промышленные адсорбенты отличаются разнообразием пористой структуры, то это и определяет особенности механизма переноса в пористом теле.
1) В крупных порах, когда диаметр пор больше средней длины свободного пробега молекул адсорбента, преимущественным видом переноса является нормальная или объемная диффузия.
Основным уравнением кинетики диффузионных процессов в гомогенной среде являются законы Фика. При стационарной адсорбции диффузия происходит в направлении выравнивания концентрации поглощаемого вещества, причем градиент концентрации постоянен во времени. В этом случае скорость адсорбции выражается первым законом Фика: (1)
где G - количество диффундирующего вещества; dG/d - скорость диффузии или диффузионный поток; D - коэффициент диффузии (знак минус указывает на уменьшение концентрации адсорбтива в направлении потока; S - поверхность, перпендикулярная направлению потока; c - концентрация адсорбтива в газовой фазе; х - координата длины; dc/dx - градиент концентрации.
Уравнение (1) используют в работах теоретического плана - при изучении механизма переноса адсорбтива в транспортных порах на специальных установках, в которых обеспечивается постоянство градиента концентрации.
Для практических целей больший интерес представляет изучение нестационарной диффузии. Нестационарная диффузия сопровождается адсорбцией, когда концентрация адсорбата в твердой фазе изменяется и градиент концентрации непостоянен. Для описания нестационарной адсорбции пользуются вторым законом Фика:
( 2)
2)
где а - концентрация адсорбата в адсорбированном состоянии.
Скорость нормальной диффузии определяется числом столкновений молекул газа друг с другом. Коэффициент диффузии в этом случае зависит от средней длины тепловой скорости молекул и средней длины свободного пробега молекул : D = 1/3 . (3)
Величины и , а следовательно, и коэффициент диффузии возрастают при повышении температуры. В приближенных расчетах принимают:
D ~ T1,75 (4)
2) При малом размере пор, когда длина свободного пробега молекул намного больше радиуса пор, фактором, определяющим скорость диффузии, становится частота соударений со стенками пор. Такая диффузия называется молекулярной или кнудсеновской. При столкновении адсорбирующихся молекул с поверхностью они некоторый интервал времени фиксируются на активных центрах адсорбента, а после этого, благодаря тепловому движению, удаляются в газовую фазу. коэффициент молекулярной диффузии определяется средней тепловой скоростью движения молекул и диаметром поры dп:
D = 1/3 dп. (5)
В то же время:

(6)
где М - относительная молекулярная масса газа.
Следовательно, коэффициент молекулярной диффузии и температура связаны следующей зависимостью:
D ~ T 0,5 (7)
3) Если поры по размерам соизмеримы с поглощаемыми молекулами, адсорбционный процесс приобретает активированный характер. По аналогии с представлениями Аррениуса, развитыми для химической реакции, при активированной адсорбции не все молекулы могут проникнуть в поры и быть там поглощенными, а лишь те, которые обладают некоторым избыточным запасом энергии. Этот избыток называют энергией активации.
Коэффициент диффузии связан с энергией активации Еа следующей зависимостью:
D=D0 exp-(Ea/RT) (8)
где D0 - предэкспоненциальный множитель.
Величина предэкспоненциального множителя зависит от природы, как адсорбента, так и адсорбтива. Например, предадсорбция полярных веществ на цеолите приводит к частичной блокировке входных окон и, как следствие, понижению скорости сорбции и уменьшению величины D0.
Связь между энергией активации и коэффициентом диффузии (уравнение 8) используют для вычисления энергии активации на основе экспериментальных данных. Для этого исследуют кинетические кривые адсорбции конкретного вещества при двух температурах Т1 и Т2. Соответствующие им коэффициенты диффузии могут быть определены по уравнениям:
D1 = D0 exp-(Ea1/RT1) (9)
D2 = D0 exp-(Ea2/RT2) (10)
Энергия активации практически постоянна, если интервал исследуемых температур Т1-Т2 невелик. СледовательноЕа1 Еа2 = Еа
Отсюда:
(11)(12)(13)
Соотношение коэффициентов диффузии может быть заменено на соотношение времен отработки их адсорбционной емкости до любой степени, например 50 %:
(14)
Энергия активации увеличивается по мере приближения диаметра входного окна поры к диаметру молекул адсорбтива. Например, при переходе от цеолита NaA к КА разница между определяющим размером пор и критическим диаметром молекул становится меньше одного ангстрема, при этом наблюдается резкий рост энергии активации. Таким образом, энергию активации можно рассматривать как молекулярно ситовую характеристику цеолитов.
Зависимость энергии активации от диаметра входного окна d0 описывается уравнением
Еа = Е0 ехр (A dкр/d0)
где Е0 - предэкспоненциальный множитель, А - постоянная величина для каждого адсорбтива, dкр - критический диаметр молекул адсорбата.
Энергия активации зависит также от размера катиона, входящего в состав цеолита. Здесь играют роль два противоположных фактора: с одной стороны, чем меньше катион, тем больше диаметр входного окна и легче проникновение молекул адсорбата в адсорбционную полость, с другой стороны, крупные катионы легче деформируются, способствуя проникновению адсорбируемых молекул.
4
 ) Интенсивность переноса вещества в гранулах промышленных адсорбентов усиливается благодаря миграции молекул по поверхности пор. Этот вид переноса получил названиеповерхностной диффузии. Движение молекул по поверхности происходит скачкообразно. Если длину скачка обозначить через , а время пребывания молекулы в адсорбированном состоянии через , то коэффициент поверхностной диффузии определится из соотношения
) Интенсивность переноса вещества в гранулах промышленных адсорбентов усиливается благодаря миграции молекул по поверхности пор. Этот вид переноса получил названиеповерхностной диффузии. Движение молекул по поверхности происходит скачкообразно. Если длину скачка обозначить через , а время пребывания молекулы в адсорбированном состоянии через , то коэффициент поверхностной диффузии определится из соотношения
D = 2/4 (15)
= 2/4 (15)
В то же время:  = 0 ехр (Е0/RT) (16)
= 0 ехр (Е0/RT) (16)
где 0 - период колебания атомов в структуре адсорбента, приблизительно равный 10-13 с.
Тогда:
( 17)В этой формулеD0 - коэффициент диффузии двухмерного газа на идеально однородной поверхности, при Т или Еа=0.
17)В этой формулеD0 - коэффициент диффузии двухмерного газа на идеально однородной поверхности, при Т или Еа=0.
Коэффициент поверхностной диффузии связан с температурой следующей зависимостью: D Tn e-Ea/RT (18)
где n может изменяться от 0,5 до 1,5.
При повышении температуры уменьшается адсорбционная способность и градиент концентрации в адсорбированной фазе. Поэтому роль поверхностной диффузии в общей скорости переноса вещества падает.
studfiles.net
адсорбция воды - это... Что такое адсорбция воды?
адсорбция водыEcology: water adsorption
Универсальный русско-английский словарь. Академик.ру. 2011.
- адсорбция влаги
- адсорбция газа
Смотреть что такое "адсорбция воды" в других словарях:
АДСОРБЦИЯ — (от лат. ad на при и sorbeo поглощаю), поглощение газов, паров или жидкостей поверхностным слоем твердого тела (адсорбента) или жидкости. Адсорбенты обычно имеют большую удельную поверхность до нескольких сотен м²/г. Физическая адсорбция… … Большой Энциклопедический словарь
АДСОРБЦИЯ — (от латинского ad на, при и sorbeo поглощаю), поглощение газов, паров или жидкостей поверхностным слоем твердого тела (адсорбента) или жидкости. В промышленности адсорбцию осуществляют в аппаратах адсорберах. На адсорбции основаны осушка газов,… … Современная энциклопедия
Адсорбция — (от латинского ad на, при и sorbeo поглощаю), поглощение газов, паров или жидкостей поверхностным слоем твердого тела (адсорбента) или жидкости. В промышленности адсорбцию осуществляют в аппаратах адсорберах. На адсорбции основаны осушка газов,… … Иллюстрированный энциклопедический словарь
адсорбция — и; ж. [от лат. ad к и sorbere поглощать, всасывать]. Поглощение вещества из газа или раствора поверхностным слоем жидкого или твёрдого адсорбента (используется в химии, технике и т.п. для разделения и очистки веществ). ◁ Адсорбционный, ая, ое. *… … Энциклопедический словарь
АДСОРБЦИЯ — (от лат. ad на, при и sorbeo поглощаю), изменение (обычно повышение) концентрации в ва вблизи пов сти раздела фаз ( поглощение на пов сти ). В общем случае причина А. нескомпенсированность межмол. сил вблизи этой пов сти, т. е. наличие адсорбц.… … Химическая энциклопедия
АДСОРБЦИЯ — (от лат. ad на, при и sorbeo поглощаю) поглощение (.сорбция) веществ из р ров или газов на поверхности твёрдого тела или жидкости. Адсорбируемое в во наз. адсорбатом, а тело, на к ром происходит А., адсорбенте м. Адсорбентами служат синтетич. и… … Большой энциклопедический политехнический словарь
АДСОРБЦИЯ — (от лат. ad на, при и sorbeo поглощаю), поглощение газов, паров или жидкостей поверхностным слоем тв. тела (адсорбента) или жидкости. Адсорбенты обычно имеют большую удельную поверхность до неск. сотен м2/г. Физ. А. результат действия дисперс.… … Естествознание. Энциклопедический словарь
Фильтр воды — для домашнего применения. Фильтр для воды устройство для очистки воды от механических, нерастворимых частиц, примесей, хлора и его производных, а так же от вирусов, бактерий, тяжелых металлов и т.д. Бытовые фильтры используемые для… … Википедия
Фильтр для воды — Фильтр воды для домашнего применения … Википедия
Сточные воды — … Википедия
ГОСТ произвощдство*: Производство бумаги и картона. Термины и определения — Терминология ГОСТ произвощдство*: Производство бумаги и картона. Термины и определения: 67. Абразивность бумаги (картона) Свойство поверхности бумаги (картона) нарушать при контакте гладкость поверхности другого тела Определения термина из разных … Словарь-справочник терминов нормативно-технической документации
Книги
- Адсорбция, Ягодовский Виктор Дмитриевич. В учебном пособии, написанном профессором РУДН, излагаются теоретические основы адсорбции - сложного явления на границе раздела фаз газ-твердое тело, газ-жидкость, жидкость-твердое тело,… Подробнее Купить за 567 руб
- Адсорбция, В. Д. Ягодовский. В учебном пособии, написанном профессором РУДН, излагаются теоретические основы адсорбции - сложного явления на границе раздела фаз газ-твердое тело, газ-жидкость, жидкость-твердое тело,… Подробнее Купить за 498 руб
- Адсорбция, Ягодовский Виктор Дмитриевич. В учебном пособии, написанном профессором РУДН, излагаются теоретические основы адсорбции - сложного явления на границе раздела фаз «газ-твердое тело», «газ-жидкость», «жидкость-твердое… Подробнее Купить за 474 руб
universal_ru_en.academic.ru
Адсорбция.
Коллоидная химия
Адсорбция.
Сорбция
Сорбцией (от латинского sorbeo – поглощаю, втягиваю) называют любой процесс поглощения одного вещества (сорбтива) другим (сорбентом), независимо от механизма поглощения.
В зависимости от механизма сорбции различают адсорбцию, абсорбцию, хемосорбцию и капилярную конденсацию.
Адсорбция
Адсорбция это процесс, происходящий на границе раздела фаз. Он затрагиваетолько поверхностные слои, взаимодействующих фаз, и не распространяется на глубинные слои этих фаз.
Адсорбцией называют явление накопления одного вещества на поверхности другого. В общем случае, адсорбцией называют изменение концентрации вещества на границе раздела фаз.
Абсорбция
Абсорбция, в отличии от адсорбции, это процесс захватывающий не только поверхность раздела фаз, но распространяющийся на весь объём сорбента.
Примером процесса абсорбции является растворение газов в жидкости.
Хемосорбция
Хемосорбцией называется поглощение одного вещества другим, сопровождающееся их химическим взаимодействием.
Капилярная конденсация
Капиллярная конденсация — сжижение пара в капиллярах, щелях или порах в твердых телах.
Явление конденсации отлично от физической адсорбции.
Таким образом, сорбционные процессы различны по их механизму. Однако, любой сорбционный процесс начинается с адсорбции на границе соприкасающихся фаз, которые могут быть жидкими, газообразными или твёрдыми.
Адсорбция
Напомним, что адсорбцией называют явление накопления одного вещества на поверхности другого. В общем случае, адсорбцией называют изменение концентрации вещества на границе раздела фаз.
Адсорбция происходит на любых межфазовых поверхностях и адсорбироваться могут любые вещества.
Адсорбционное равновесие, т.е. равновесное распределение вещества между пограничным слоем и граничащими фазами является динамическим равновесием и быстро устанавливается.
Адсорбция понижается с понижением температуры.
Поглощаемое вещество, ещё находящееся в объёме фазы, называют адсорбтивом, поглощённое — адсорбатом. Вещество, на поверхности которого происходит адсорбция – адсорбентом.
Адсорбция представляет собой обратимый процесс. Процесс, обратный адсорбции, называется десорбцией.
Удаление адсорбированных веществ с адсорбентов при помощи растворителей называют элюцией.
Различают молекулярную и ионную адсорбцию. Это различение происходит в зависимости от того, что адсорбируется – молекулы или ионы вещества.
Адсорбция на поверхности жидкостей
На поверхности жидкостей могут адсорбироваться частицы веществ, растворённых в жидкостях. Адсорбция сопровождает процесс растворения, влияя на распределение частичек растворённого вещества между поверхностным слоем растворителя и внутренним его объёмом.

В соответствии со вторым началом термодинамики поверхностная энергия жидкостей стремится к минимуму. В чистых растворителях уменьшение этой энергии происходит путём сокращения поверхности.
В растворах поверхностная энергия может понижаться или увеличиваться за счёт изменения концентрации частиц в поверхностном слое жидкости.
Гиббсом было установлено, что распределение растворяемого в жидкости вещества происходит так, чтобы достигалось максимальное уменьшение поверхностного натяжения.
Он же предложил уравнение, определяющее величину адсорбции Г, т.е избытка вещества, накапливающегося в 1 см2 поверхностного слоя, имеющего толщину примерно в одну молекулу, по сравнению с содержанием этого вещества в таком же объёме внутри жидкости.

Где Δσ - изменение поверхностного натяжения, соответствующее изменению концентрации ΔС. Величина Δσ/ΔС называется поверхностной активностью.
Следовательно, адсорбция Г зависит от величины поверхностной активности и концентрации вещества С.
Если при этом поверхностное натяжение уменьшается, то адсорбция Г имеет положительное значение.
Положительная адсорбция. Поверхностно-активные вещества.
Чем сильнее вещество понижает поверхностное натяжение, тем больше оно будет накапливаться в поверхностном слое.
Концентрация растворённого вещества в поверхностном слое станет значительно выше, чем в остальном объёме жидкости. Возникающая разность концентраций неизбежно вызовет диффузию, которая будет направлена из поверхностного слоя внутрь жидкости и явится препятствием для полного перехода всех растворённых частиц в поверхностный слой. Установится подвижное адсорбционное равновесие между растворённым веществом в поверхностном слое и остальном объёме жидкости.
Адсорбцию, сопровождающуюся накоплением вещества в поверхностном слое, называют положительной. Пределом её служит полное насыщение поверхностного слоя адсорбируемым веществом.
Положительно адсорбирующиеся вещества называют также поверхностно-активными веществами (ПАВ). В водных растворах роль ПАВов будут играть вещества с жирной и дифильной природой (жиры, большинство жирных кислот, кетоны, спирты, холестерин и др.).
Отрицательная адсорбция. Поверхностно-инактивные вещества.
Если растворённое вещество увеличивает поверхностное натяжение, то оно будет выталкиваться из поверхностного слоя внутрь адсорбента. Такую адсорбцию называют отрицательной.
Пределом отрицательной адсорбции является полное вытеснение адсорбтива из поверхностного слоя внутрь адсорбента (растворителя).
В результате разности концентраций возникнет диффузия, которая будет направлена в поверхностный слой. Поэтому в поверхностном слое всегда окажется некоторое количество адсорбтива.
Вещества, резко повышающие поверхностное натяжение, почти не содержатся в поверхностном слое разбавленных растворов. Лишь значительное увеличение концентрации подобных растворов приводит к перемещению в поверхностный слой заметных количеств растворённого вещества, что сопровождается увеличением поверхностного натяжения.
Отрицательно адсорбирующиеся вещества называются поверхностно-инактивными.
Адсорбция и поверхносное натяжение биологических жидкостей
Отрицательная и положительная адсорбция различных веществ в крови и протоплазме клеток имеет большое значение для обмена веществ в живых организмах.
Поверхностное натяжение биологических жидкостей значительно ниже, чем воды. Поэтому гидрофобные вещества, например кислоты жирного ряда, стероиды, будут накапливаться у стенок сосудов, клеточных мембран, что облегчает их проникновение сквозь эти мембраны.
Ртуть | 430,0 |
Вода | 72,7 |
Глицерин | 65,0 |
Сыворотка крови человека (при 38 С) | 46 - 47 |
Этиловый спирт | 22,0 |
Эфир | 16 |
Цитоплазма амёб (на границе с маслом) | 0,5 - 1,5 |
Для адсорбции из водных растворов большое значение имеет наличие у молекул полярных (гидрофильных) и неполярных (гидрофобных) групп.
Так, в молекуле масляной кислоты имеется полярная группа СООН и гидрофобная углеводородная цепь:

Молекулы обладающие одновременно обеими видами групп, называются дифильными.
У дифильной молекулы с короткой гидрофобной цепью преобладают гидрофильные свойства, поэтому такие молекулы хорошо растворяются в воде, адсорбируясь отрицательно.
С удлинением углеводородной цепи усиливаются гидрофобные свойства молекул и понижается их растворимость в воде.
Следовательно, к поверхностно-активным веществам принадлежат вещества дифильной структуры, имеющие меньшее, чем растворитель, поверхностное натяжение, и растворение которых приводит к положительной адсорбции, вызывая понижение поверхностного натяжения.
Поверхностно-инактивные вещества обладают противоположными свойствами.
Одновременно с увеличением гидрофобных свойств молекул повышается их поверхностная активность. Так удлинение цепи в гомологическом ряду жирных кислот, спиртов, аминов и др. на радикал –СН2– увеличивает их способность к положительной адсорбции в разбавленных растворах в 3,2 раза (правило Траубе-Дюкло).
Поверхностные плёнки
Молекулы веществ с преобладанием гидрофобных свойств (жирные кислоты с большим молекулярным весом и др.) располагаются в основном на поверхности воды, образуя поверхностные плёнки.
При небольшом количестве таких молекул поверхностной плёнки не образуется. Если же молекул много, то они располагаются упорядоченно, одна рядом с другой, причём их гидрофобные части выступают над водной поверхностью, образуя так называемый частокол Лэнгмюра.

1 - беспорядочное расположение дифильных молекул; 2 - частокол Лэнгмюра; 3 - избыток молекул; 4 - гидрофильная часть молекул; 5 - гидрофобная часть молекул;
Поверхностная плёнка образуется мономолекулярным слоем молекул, каждая из которых занимает на поверхности воды определённую площадь. Толщину слоя и площадь, занимаемую каждой молекулой, можно расчитать.
Так, молекулы жирных кислот, имеющие по одной полярной группе (масляная, валериановая, каприновая кислоты и т.п.) занимают на поверхности воды площадь 21 · 10-16 см2, независимо от длины углеводородной цепи.
Жирные кислоты с двумя полярными группами (например, олеиновая кислота) занимает площадь, вдвое большую, а молекулы с тремя полярными группами (например, тристеарин) – втрое большую площадь и т.д.
При избытке вещества с преимущественно гидрофобными свойствами его молекулы располагаются над молекулярной плёнкой.
Кессонная болезнь
Образование поверхностных плёнок нередко затрудняет процесс фильтрации.
На границе раздела воздух–вода в пузырьках воздуха, находящихся в растворе, может адсорбироваться поверхностно-активное вещество. Плёнка этого вещества образует как-бы оболочку вокруг пузырька. Такой пузырёк при продавливании через узкие поры в фильтре не способен резко деформироваться и поэтому может закупорить более крупные отверстия в фильтре, чем пузырёк без плёнки.
У водолазов, работающих на больших глубинах, иногда возникает, так называемая, кесонная болезнь. В их скафандры воздух подаётся под давлением и, следовательно, в крови водолазов растворяется повышенное количество газов.
При слишком быстром поднятии на поверхность давление в скафандрах резко понижается, и значительная часть газов крови выделяется в виде пузырьков, на которых образуется поверхностная плёнка из содержащихся в крови поверхностно-активных веществ.
Пузырьки газов закупоривают мелкие сосуды в различных тканях и органах, что приводит к тяжёлому заболеванию или даже гибели человека.
Подобная же паталогия может возникнуть и в результате резкого падения атмосферного давления при разгерметизации скафандров лётчиков и кабин самолётов при высотных полётах.
Для лечения кессонной болезни больного помещают в барокамеру, где создают большое давление. Пузырьки газов вновь растворяются в крови. В течении нескольких суток давление в барокамере медленно снижают. За это время избыточный газ из крови столь же медленно удаляется через лёгкие, не создавая закупорок.
Адсорбция твёрдыми телами
Твёрдыми телами могут адсорбироваться газы и пары, а также молекулы и ионы растворённых веществ.
Природа сил, вызывающих адсорбцию
Адсорбция на твёрдых телах может быть объяснена наличием силовых полей притяжения, возникающих за счёт неуравновешенных связей в кристалической решётке.
На выступающих участках твёрдого адсорбента (на активных центрах) адсорбция идёт особенно сильно. Так выступы на частичке угля в 4,5 раза интенсивнее адсорбируют кислород, чем углубления на его поверхности.
Адсорбционные силы слагаются из валентных сил взаимодействия (химических) и более слабых ван-дер-ваальсовых (физических). Роль тех и других при разных случаях адсорбции различна. Так, в самом начале адсорбции большинства газов, когда их давление мало, наблюдается химическая адсорбция. С увеличением давления она уступает место физической, которая в основном определяет адсорбцию газов.
Адсорбционные силы могут быть достаточно велики. Так, для полного удаления со стекла адсорбированных молекул воды его необходимо сильно нагревать в вакууме.
Адсорбенты, обладающие мощными силовыми полями, оказываются сплошь покрытыми адсорбированными частицами. При незначительных же адсорбционных силах только более активные центры покрываеются адсорбируемыми частицами.
На адсорбцию влияет не только природа адсорбента, но и адсорбтива. Так, на твёрдых адсорбентах сильнее адсорбируются те газы, которые легче сжижаются, т.е. критическая температура которых выше.
Обратимость адсорбции
Адсорбция представляет собой обратимый процесс. Адсорбированные частицы не остаются не остаются неподвижными. Они удерживаются на адсорбенте всего сотые и тысячные доли секунды и, десорбируясь, замещаются на новые частицы. К тому же они не являются строго фиксированными на адсорбенте, а могут перемещаться по его поверхности. В итоге устанавливается динамическое адсорбционное равновесие между свободными и адсорбированными частицами.
Скорость адсорбции
Скорость адсорбции имеет большое значение для практического использования различных адсорбентов.
Например, в противогазе проходящий через коробку воздух должен очень быстро очищаться от примесей отравляющих веществ, что возможно лишь при высоких скоростях адсорбционных процессов.
Необходимо указать, что активированный уголь в противогазе играет роль не только адсорбента ряда отравляющих веществ, но и катализатора реакций разложения некоторых из них.
В частности, активированный уголь катализирует гидролиз фосгена:
COCl2 + h3O = HCl + CO2.
Повышение температуры понижает физическую адсорбцию адсорбцию, так как при этом усиливается движение молекул в адсорбционном слое, нарушается ориентация адсорбированных молекул, т.е. увеличивается десорбция.
С другой стороны увеличение температуры увеличивает энергию адсорбированных частиц, что усиливает химическую адсорбцию.
Следовательно, в одних случаях повышение температуры усиливает десорбцию, в других – увеличивает адсорбцию.
Так, для большинства газов повышение температуры уменьшает адсорбцию. В то же время увеличение температуры от –185 до +20°С в 10 раз увеличивает адсорбцию кислорода платиной, так как при этом возрастает химическая адсорбция.
Повышение давления газов и паров увеличивает адсорбцию.
Капилярная конденсация
При адсорбции паров наблюдают так называемую капилярную конденсацию, протекающую на угле и других пористых адсорбентах.
Сконденсировавшаяся в капилярах жидкость образует вогнутый мениск, над которым пар оказывается насыщенным при более низком давлении, чем над плоской поверхностью. Это повышает конденсацию паров в капилярах адсорбента.
Капилярная конденсация особенно выражена у легко сжижаемых газов.
Хемосорбция
При хемосорбции вещество вступает с адсорбентом в химическую реакцию, например:
O2 + 2Cu = 2CuO.
Если вновь образующиеся при хемосорбции молекулы диффундируют в глубь вещества адсорбента, то достижение сорбционного равновесия наступает медленнее, так как оно зависит от скорости диффузии.
Если же при хемосорбции на поверхности сорбента возникают недиффундирующие молекулы, т.е. образуется плёнка, то она тормозит и со временем останавливает процесс хемосорбции.
Так, пластинка алюминия, сорбируя кислород, покрывается плёнкой из оксида оалюминия, что быстро прекращает процесс хемосорбции:
4Al + 3O2 = 2Al2O3.
Хемосорбция, как и всякая химическая реакция, может быть экзо- или эндотермической. Следовательно повышение температуры усиливает одни хемосорбционные процессы и ослабляет другие.
Полностью разграничить адсорбцию и хемосорбцию нельзя. Обычно эти два процесса протекают совместно.
xn----7sbb4aandjwsmn3a8g6b.xn--p1ai
Адсорбция воды на цеолитах типа ZSM-5
Библиографическое описание:
Очилов Л. И. Адсорбция воды на цеолитах типа ZSM-5 // Молодой ученый. 2016. №12. С. 358-360. URL https://moluch.ru/archive/116/30947/ (дата обращения: 07.05.2018).
Для решения поставленной задачи применяли адсорбционно-калориметрический метод исследования, дающий непосредственно количественную и качественную характеристики природы и сил адсорбционного взаимодействия.
Адсорбционные измерения и дозировку адсорбата проводили с помощью универсальной адсорбционной установки, в рабочей части которой использовались исключительно ртутные затворы, заменяющие краны со смазкой. Установка позволяет осуществлять дозировку адсорбата как газо-объемным, так и объемно-жидкостным методами.
Теплоты адсорбции измеряли дифференциальным микрокалориметром ДАК-1–1, записывающим в функции времени тепловые мощности медленно протекающих процессов. Дифференциальные теплоты адсорбции оценивалась точностью от 1 до 3 %.
Обменные катионы играют главную роль в адсорбции воды и других малых полярных молекул на цеолитах. Энергетически однородные центры (катионы) в однотипных кристаллографических позициях определяются с помощью измерения дифференциальных теплота адсорбции таких пробных молекул как вода, метанол и аммиак [1]. Чистокремнеземные цеолиты, такие как силикалит, показывают гидрофобность, т. е. адсорбция воды на этих цеолитах очень мала [2].
Начальная теплота адсорбции паров воды на CsZSM-5 (без учета адсорбции на примерном центре) равна 61,5 кДж/моль (рис.1). Количество сильно адсорбированной воды соответствует схеме 2Н2О:Cs+. Теплота линейно снижается до 49 кДж/моль. Адсорбция последующих трех молекул протекает с постоянной теплотой 49 кДж/моль. Образуя ступеньку, адсорбция шестой молекулы воды сопровождается понижением теплоты до уровня конденсации 43,5 кДж/моль. Еще одна молекула воды адсорбируется с теплотой, равной теплоте конденсации.
Комплексы Cs+ с шестью молекулами воды располагаются в перекрестьях прямых и зигзагообразных каналов. Полная адсорбция составляет 7 молекул воды в пересчете на катион.
Изотерма адсорбции воды (рис.2) на CsZSM-5 вогнутая при низких давлениях, что указывает на существование сильновзаимодействующих адсорбционных центров. Далее изотерма круто поднимается вверх при больших давлениях и она доведена до 7,38 N/M при P/Ps=0,68. Изотерма адсорбции воды на CsZSM-5 полностью описывается трехчленным уравнением ТОЗМ [3]:
a=0,851exp [-(A/18,22)2]+1,63exp [-(A/6,3)2]+1,748exp [-(A/2,094)2]
где а — величины адсорбции в ммоль/г, А=RTlnPs/P — работа адсорбции в кДж/моль.
Параметры с индексами 1, 2 и 3 являются характеристиками взаимодействия на катионах. Параметры с индексом 1 характеризуют адсорбцию молекулы воды при сильном взаимодействии на катионах, с индексом 2 — при менее сильном взаимодействии на катионах, а с индексом 3 — при слабом взаимодействии на катионах.
На рис.2 представлена соответствующая изотерма адсорбции воды на цеолите CsZSM-5 в полулогарифмических координатах, где — экспериментальные точки, а — рассчитанные на основе уравнения ТОЗМ. Из рис.2 видно, что расчетные данные хорошо согласуются с экспериментальными.
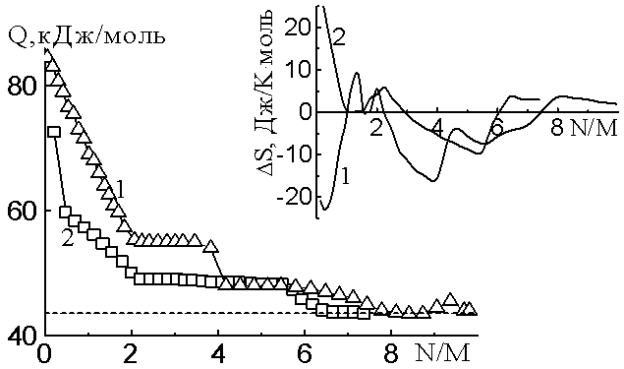
Рис.1. Дифференциальные теплоты и нтропии (вверху) адсорбции воды а цеолитах: 1-LiZSM-5, 2-CsZSM-5
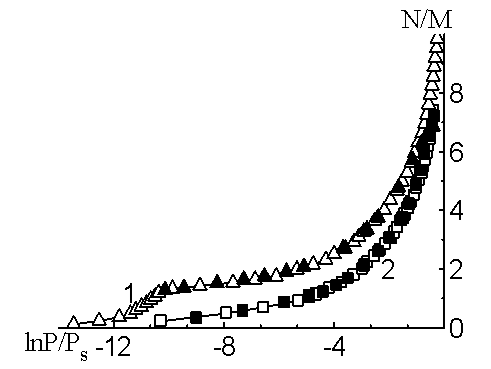
Рис. 2. Изотермы адсорбции воды на цеолитах: 1-LiZSM-5, 2-CsZSM-5
Энтропия (рис.1) адсорбции воды линейно снижается с максимального значения (25 Дж/Кмоль) до нулевой линии, которая принята за энтропию жидкой воды при адсорбции одна молекула воды на Cs+. Далее энтропия волнообразно меняется. В целом подвижность молекул воды, ассоциированных с катионами Cs+, близка к подвижности жидкой воды.
Время установления адсорбционного равновесия до полного формирования молекула/катион комплекса в соотношении Н2О:Cs+-1:1 замедлено. В целом процесс адсорбции завершается примерно за 50 минут. Исключением является область, где формируется четырехмерный комплекс, когда наблюдается замедление процесса адсорбции и кривая проходит через максимум.
Начальные теплоты адсорбции воды на LiZSM-5 около 86 кДж/моль (рис.1). Количество сильно адсорбированной воды соответствует схеме 2Н2О:Li+. Линейное падение теплот указывает на извлечение водой катионов лития из их экранированной позиции за пределами основных каналов. Адсорбция третьей и четвертой молекулы идет с постоянной теплотой 55 кДж/моль, которая при завершении резко падает до 49 кДж/моль. Эти две молекулы воды завершают образование тетраэдрического ион-дипольного комплекса.
Такой комплекс локализуется в перекрестьях прямых и зигзагообразных каналов. Потом идет заполнение второй координационной сферы. Еще 4 молекулы адсорбируются с теплотой, превышающей теплоту конденсации. Дальнейшая адсорбция идет уже с теплотой, равной теплоте конденсации, демонстрируя адсорбцию воды на предадсорбированной воде посредством водородной связи. Полная адсорбция составляет 10 молекул воды в пересчете на катион.
Изотерма адсорбции воды на LiZSM-5 доведена до 10 N/M при P/Ps=0,8 (рис.2). В соответствии с дифференциальными теплотами адсорбции область прочной адсорбции отмечена линейным подъемом кривой. При дальнейшей адсорбции изотерма вогнутая, а затем линейно поднимается до насыщения. Полная адсорбция составляет около 2,8 молекул на одно перекрестье каналов.
Изотерма адсорбции также подтверждает формирование высоко энергетического одномерного комплекса. Изотерма адсорбции воды на LiZSM-5 удовлетворительно описывается трехчленным уравнением ТОЗМ при заполнениях от двух до семи молекул/катион:
a=1,203exp [-(A/36,65)2]+1,531exp [-(A/8,26)2]+1,333exp [-(A/3,77)2]
где а — величины адсорбции в ммоль/г, А=RTlnPs/P — работа адсорбции в кДж/моль.
Энтропия адсорбции воды на LiZSM-5 в целом расположена ниже энтропии жидкой воды, что указывает на ограничение подвижности молекул воды в цеолите. Sа имеет отрицательное значение за исключением начальной области до одной молекулы воды на катион, что указывает на сильное взаимодействие h3O на Li+.
Интересен ход кривой зависимости времени установления адсорбционного равновесия от заполнения. До соотношения 1 N/M процесс установления равновесия замедляется. При более высоких заполнениях резко ускоряется. Этот факт указывает на диффузию катионов в решетке цеолита, что приводит к такому резкому замедлению процесса сорбции. Ступеньки при адсорбции 4 N/M и 8 N/M коррелируют со ступеньками на кривых дифференциальных теплота при тех же заполнениях и подтверждают образование тетраэдрического ион-дипольного комплекса в первой координационной сфере и адсорбцию четырех молекул воды во второй координационной сфере.
Литература:- Rakhmatkariev G. U., Isirikyan A. A. Crustallochemical structure of zeolite micropores and adsorption-energetical characteristics //Studies in Surface Science and Catalysis. –1991. -v.62. -P.525–529.
- Flanigen E. M., Bennet J. M., Grose R. W., Cohen J. P., Patton R. L., Kirdiner R. M. Silicalite a new hydrophobic crystalline silics molecular sieve //Nature. -1978. -v.271. -P.512–516.
- Рахматкариев Г. У., Исирикян А. А. Полное описание изотермы адсорбции уравнениями теории объемного заполнения микропор //Изв.АН СССР, Сер.хим. -1988. -№ 11. -С.2644–2645.
Основные термины (генерируются автоматически): адсорбции воды, Изотерма адсорбции воды, молекул воды, молекулы воды, теплоты адсорбции, величины адсорбции, работа адсорбции, теплота адсорбции, жидкой воды, адсорбции паров воды, изотерма адсорбции воды, теплоты адсорбции воды, Изотермы адсорбции воды, Дифференциальные теплоты адсорбции, Энтропия адсорбции воды, дифференциальных теплота адсорбции, молекула воды, Теплоты адсорбции, адсорбированной воды, учета адсорбции.
moluch.ru
Адсорбция воды - Справочник химика 21
В большинстве газовых реакций, кажущихся гомогенными, в действительности принимает участие материал стенок сосуда следовательно, такие реакции являются гетерогенно-каталитическими. Так, например, известно, что вода проявляет в некоторых случаях отрицательный каталитический эффект, но оказалось, что это обусловлено адсорбцией воды и отравлением катализатора-материала стенок сосуда. Несколько гомогенно-каталитических реакций в действительности представляют собой цепные реакции. Вещества, которые инициируют цепные реакции, иногда называют сенсибилизаторами, а не катализаторами. В качестве примера можно назвать разложение озона, которое само по себе протекает очень медленно, но сильно ускоряется в присутствии хлора согласно цепному механизму [c.81] В табл. 2.1 приведены значения чистых интегральных теп-лот адсорбции воды в межслоевых промежутках монтмориллонита и вермикулита. Их анализ позволяет сделать вывод о необходимости учета тепла, выделяющегося при связывании не только первого, но и последующих двух-трех слоев воды. Теплоты адсорбции зависят от типа минерала и рода обменны> катионов. При завершении формирования первого слоя адсорбированной воды выделяется 55—70% тепла от суммарной интегральной теплоты смачивания. [c.32]При изучении причин разрушения катализатора на промышленных установках обычно наибольшее внимание уделяют узлу, в котором частицы испытывают максимальные динамические нагрузки, — системе пневмотранспорта. Однако даже при нормальной работе транспорта расход катализатора может колебаться в больших пределах. Так, при переработке тяжелого сырья он обычно в 1,5—3 раза больше, чем в случае крекинга атмосферного газойля. Очевидно причиной является снижение прочности частиц под влиянием факторов технологического процесса. Прочность шаровидных глобул катализатора определяется числом единичных контактов этих глобул, приходящимся на единицу площади сечения частицы катализатора, а также прочностью единичного контакта [98]. Этим объясняется известный факт снижения прочности алюмосиликатного катализатора при его увлажнении [99]. В результате адсорбции воды уменьшается свободная поверхностная энергия, в связи с чем на образование новой поверхности при разрушении катализатора требуется затратить меньшую работу. Особенно сильно уменьшается поверхностная энергия при образовании монослоя адсорбированного вещества. Поэтому первые порции воды наиболее сильно снижают прочность. [c.82]
При сужении пор адсорбционные силы сближающихся стенок пор складываются, причем потенциал дисперсионных сил всегда увеличивается. Это приводит к увеличению энергии адсорбции, в особенности для молекул с большой поляризуемостью, например больших по размерам молекул углеводородов и их производных. Энергия адсорбции паров гексана и бензола на силикагеле заметно увеличивается при сужении его пор до 50—40 Л- При адсорбции малых по размерам молекул, таких, как молекулы азота и метанола, энергия адсорбции заметно изменяется лишь при сужении пор до размеров, меньших 30 А. В случае адсорбции воды на силикагеле сужение пор до 25 А на энергии адсорбции практически еще не сказывается. [c.517]
Правило А. В. Думанского (Р/Л й 6050 Дж/моль) применимо лишь для тех веществ, с которыми молекулы воды взаимодействуют с помощью водородных связей (целлюлоза, крахмал, дегидратированный при 110°С палыгорскит). Если основными центрами адсорбции воды являются не гидроксильные группы или атомы кислорода, а обменные катионы (как в случае цеолитов, вермикулита и др.) или координационно ненасыщенные ионы (как в случае палыгорскита, дегидратированного при 180—250°С), то правило А. В. Думанского становится неприменимым [66]. [c.32]
Процесс а имел времена релаксации примерно на 2 порядка меньшие, чем процесс Ъ. Времена релаксации ть существенно уменьшались при переходе от цеолита NaA к NaX. Этот процесс, вероятно, связан со скачками катионов, а в гидратированном цеолите — и с релаксацией адсорбированных молекул воды. Поляризация, связанная с этими процессами, менялась при гидратации цеолита (рис. 16.4). Изменение фоь при адсорбции воды могло быть связано с двумя действующими в противоположных направлениях процессами. С одной стороны, увеличение гидратации вело к увеличению подвижности катионов и уменьшению ть (см. рис. 16.4). Поскольку время поляризации при каждой данной температуре оставалось неизменным, уменьшалось число катионов, еще обладавших достаточно большими временами релаксации, чтобы дать вклад в процесс Ь. С другой стороны с ростом гидратации увеличивался вклад в величину поляризации со стороны полярных молекул воды. Все это приводило к появлению излома в зависи- [c.258]
Пример УП1-8. Активированный глинозем в виде гранул со средним диаметром 0,117 мм применяется для адсорбции воды из воздуха, содержащего 0,01 кг воды/кг сухого воздуха прн 24 °С и давлении 1,03-10 н/м (1,05 ат). Полнота адсорбции должна быть 99,9%. Массовая скорость воздуха 771 кг-м- .ч-К [c.285]
Адсорбция воды ведет к появлению нового максимума D и изменяет ионные максимумы и С (рис. 16.6). Максимум возрастает приблизительно линейно при увеличении содержания воды до 2—3 молекул на полость. Величина поляризации при этом оказывается примерно пропорциональной количеству адсорбированной воды и пропорциональной напряженности электрического поля. Изменение знака поляризующего напряжения не приводит к изменению положения максимума или связанной с ним величины поляризации. [c.261]
Адсорбционно связанная влага. Влажность обусловлена адсорбцией воды на наружной поверхности материала и на поверхности его пор. Осмотически связанная влага находится внутри структур-ного скелета материала и удерживается осмотическими силами. [c.406]
Малые количества воды (менее 1 молекулы на полость) должны перераспределяться еще более медленно. Для ускорения этого процесса образец прогревали. Если температура прогревания была не слишком высокой (370 К), то наблюдался такой же эффект, что и при длительной выдержке образца при комнатной температуре. При этом имели место рост максимума D и некоторое смещение к высоким температурам максимума С [701]. Иной результат наблюдался при прогревании другого образца цеолита NaA с таким же содержанием воды при температуре 620 К. В этом случае наблюдалось уменьшение максимума D, а В я С смещались к низким температурам. Полученный результат нельзя объяснить дегидратацией, так как ячейка с образцом была герметически закрыта, причем от окончания прогревания до момента измерения проходило время, достаточное для повторной адсорбции воды (более 10 ч). Наблюдаемое явление можно объяснить появлением дефектов в кристаллической решетке, которые могут захватывать молекулы воды. Не исключена также возможность диссоциации адсорбированных молекул воды [702]. [c.263]
Опыт эксплуатации установок адсорбционной осушки показал, что если осушенный газ предназначен для транспортировки по магистральным газопроводам, то цикл адсорбции целесообразно заканчивать после проскока влаги. Во время адсорбции вода вытесняет из пор адсорбента поглощенные тяжелые углеводороды по всему слою. Такая десорбция углеводородов при низкой тем- [c.251]
Адсорбция воды приводит к появлению трех максимумов /, II, III, которым соответствуют, как и в случае льда [696], процессы с временами релаксации 10 —10 с (рис. 16.8 и 16.9). Однако, в отличие от льда, максимумы наблюдались при более высоких температурах. Максимум I наиболее слабый и проявляется при наиболее низких температурах. Зачастую он не виден на фоне более значительного максимума II. Близость температур проявления максимума / и максимумов, связанных с адсорбцией воды на Na-цеолитах [683] и полимерах [681, 682], [c.263]
Таким образом, метод токов ТСД позволяет исследовать процессы ионной релаксации и влияние на эти процессы адсорбированной воды, а также кинетические явления в адсорбенте. Результаты, полученные для оксидов алюминия, показывают, что этот метод применим к изучению процессов в гетерогенных системах при адсорбции воды. [c.266]На рис. 162, в представлена схема распределения поглощаемых компонентов в слое адсорбента. На рисунке показан момент, когда передний фронт адсорбционной зоны бутана достиг конца слоя, а фронт адсорбции воды только что сформировался. [c.242]
Для извлечения углеводородов из природных газов применяется процесс КЦА. Механизм извлечения углеводородов в этом процессе подобен механизму извлечения воды в процессе осушки, однако он более сложен, так как в слое адсорбента имеется несколько адсорбционных зон. Скорость перемещения и длина каждой зоны зависят от размеров других зон, расположенных до и после нее. При рассмотрении процесса КЦА необходимо проводить анализ всех этих зон. Некоторые закономерности, рассмотренные ранее в процессе адсорбционной осушки, можно использовать и для анализа процесса КЦА, однако полное отождествление адсорбции углеводородов и адсорбции воды может привести к крупным ошибкам. [c.257]
Адсорбция молекул, имеющих диполи, квадруполи и л-связи, весьма чувствительна к удалению с поверхности гидроксильных групп. При дегидратации поверхности силикагелей адсорбция воды, спиртов, эфира и других полярных веществ и также азота (молекула азота обладает большим квадрупольным моментом), непредельных и ароматических углеводородов резко уменьшается. На рис. ХУН1, 7 показано уменьшение адсорбции азота и постоянство адсорбции аргона, а также уменьшение теплоты адсорбции пара бензола при дегидратации поверхности силикагеля. [c.500]
Адсорбция воды может быть как физической, так и химической [c.49]
Поверхность твердого вещества всегда заряжена, хотя часто по совершенно разным причинам благодаря тому, что она образована ионами, входящими в состав твердого вещества, вследствие ориентированной адсорбции дипольных молекул или ионов, или же, наоборот, вследствие, ухода с нее ионов одного знака в окружающую среду (раствор), или, наконец, в результате эмиссии или присоединения электронов под влиянием тех или иных условий, включая все виды воздействий, вызывающих появление статического электричества. Чистая поверхность слюды, например, заряжена положительно, так как она образована ионами К+, а поверхность каолинита, построенная из ионов кислорода или гидроксила — отрицательно. Адсорбция противоположно заряженных ионов может нейтрализовать заряд поверхности или изменить его знак. При адсорбции кислорода на металлах образуется полярная связь М — О, причем кислородная поверхность приобретает отрицательный заряд, а примыкающий слой атомов металла — положительный. Адсорбция воды на металлах вызывает противоположный эффект на поверхности образуется двойной электрический слой, обращенный к окружающей среде слоем не отрицательных, а положительных зарядов. [c.113]
При использовании этого метода для очистки минерализованных сточных вод нефтепромыслов имеет место адсорбция водой кислорода воздуха, вследствие чего коррозионные свойства ее в необходимой степени не устраняются. [c.97]
Приведенные данные об изменении удельной поверхности совпадают с результатами определения динамики адсорбции воды, приведенными ранее (см. стр. 153), что обусловлено одними и теми же причинами, связанными с изменением поровой структуры нефтяных коксов. [c.164]
Выше было сказано об уменьшении упругости пара от воды, растворенной детергентом, вследствие чего степень адсорбции воды тканью ограничена таким ее количеством, которое было бы при одинаковой относительной влажности адсорбировано из воздушной среды. Благодаря этому предотвращаются вызываемые водой усадка и другие повреждения ткани, погруженной в раствор, применяемый для химической чистки. Поддерживание относительной влажности растворителя на достаточно высоком уровне имеет еще и ту хорошую сторону, что оно препятствует аккумуляции статического электричества на очищаемых предметах одежды [c.186]
Первичное действие полярных групп несколько смягчается, однако побочным действием, вызываемым физическим строением волокон. У всех волокон имеются высокоорганизованные зоны, в которых молекулы обычно расположены параллельно. Таким зонам присвоено название мицеллярных или кристаллических. В этих зонах адсорбция воды происходит в довольно слабой степени по двум причинам во-первых, по причинам пространственного характера, во-вторых, по причине настолько близкого расположения полярных групп друг к другу, что их побочные валентности оказываются взаимно насыщенными. В результате этого притягательная сила в отношении молекул воды отсутствует. [c.214]
Остальные зоны у волокон неорганизованны. Здесь молекулы проявляют стремление к случайному расположению. В этих зонах адсорбция воды высока, с одной стороны, вследствие их широкой доступности для молекул воды, с другой — благодаря притяжению [c.214]
Степень кристалличности волокон, обладающих одинаковой молекулярной структурой, колеблется в довольно значительных пределах, что находит соответствующее отражение на их способности к адсорбции воды. Так, например, хлопок и вискоза принадлежат к целлюлозным волокнам. Однако волокно хлопка обладает большей кристалличностью и соответствующей способностью адсорбировать воду. Разница в способности к адсорбции воды названными волокнами существует несмотря на то, что волокно хлопка обладает пористым мелким строением, в которое свободно проникает вода, в то время, как волокно вискозы отличается плотной структурой, похожей ца гель. [c.215]
Впоследствии близкие взгляды были высказаны и другими исследователями, например Конвеем и Бокрисом, Впджем, Трассати и др. Этими и некоторыми другими авторами была отмечена необходимость учета конкурентной адсорбции воды и водорода. Свободная энергия адсорбции воды точно неизвестна по ориентировочным подсчетам Бокриса она для металлов первой группы близка к 100 кДж-моль . Выяснилось также, что для ряда металлов, адсорбирующих водород, перенапряжение не уменьшается, а растет с увеличением энергии связи М—Н (Рютчи, Делахей, Парсонс). Эти металлы образуют подгруппу второй группы, по классификации Антропова, в которой преобладающим оказывается эффект увеличения энергии активации рекомбинации или электрохимической десорбции с ростом эшфгии связи М—Н. Минимальное [c.412]
Характерная особенность адсорбции воды волокнами текстиля, а также веществами, подобными им по своей структуре, — это явление гистерезиса. При любой данной температуре влажности эти волокна обнаруживают два вида равновесного влагосодержания, зависящего от того, образуется ли оно с сухой или с мокрой стороны. Например равновесное влагосодержание вискозы составляет— при 25° С и 65% относительной влажности — с мокрой стороны 15,4%, а с сухой— 13,1%. В кругах, причастных к торговле, принято определять равновесие с сухой стороны и называть полученную таким способом величину равновесного влагосодержания равновесной влагой. [c.216]
По данным измерений изотерм адсорбции воды (С2Г)п, отношение гидрофильной площади к общей площади составляет всего 0,2%. [c.393]
Совпадение уравнений (11.65) и (11.73), полученных с использованием различных исходных величин, вряд ли может рассматриваться как случайность. Из табл, 11.5 следует, что расхождение между расчетными и опытными значениями нулевых точек лежит в пределах ошибок экспериментального определения S и ы Независимость разностей нулег.ых точек от природы растворителя наблюдается для водных растворов и расплавов солей, в то же время этот вывод не находит полного подтверждения при сопротивлении ряда водных и неводных (органических сред). Точно так же некоторые металлы, папример галлий, резко выпадают из общей закономерности. Такой резул],тат представляется естественным, поскольку расчетные уравнения были выведены на основе упрощающих допущений и отвечают, в лучшем случае, лищь первому приближению теории нулевых точек, не учитывающему многие усложняющие факторы. Одним из наиболее важных факторов является различная адсорбируемость воды (или другого растворителя) на разных металлах, т. е. различная гидрофильность металлов. Это приводит к тому, что в нулевой точке на поверхности разных металлов образуются в неодинаковой степени ориентированные слои молекул воды, создающие добавочный скачок потенциала и смещающие положение нулевой точки. Помимо эффекта такой ориентированной адсорбции воды, подробно рассмотренного Фрумкиным и Дамаскииым, следует, по-вндимому, считаться и с более глу- [c.258]
Причиной молекулярной ассоциации в водных растворах и многих жидкостях часто является возникновение водородной связи между соприкасающимися полярными частями молекул, содержащих, например, гидроксильные группы (см. стр. 164). Такая ассоциация проявляется также и при адсорбции на адсорбентах, содержащих на поверхности гидроксильные группы, например при адсорбции воды, спиртов, аммиака, аминов и т. п. на поверхностях гидроокисей, т. е. на гидроксплированных поверхностях силикагелей, алюмогелен, алюмосил икатных катализаторов и т. п. адсорбентов. Поверхность силикагеля покрыта гидроксильными группами, связанными с атомами кремния кремнекислородного остова. Вследствие того что электронная -оболочка атома кремния не заполнена, распределение электронной плотности в гидроксильных группах поверхности кремнезема таково, что отрицательный заряд сильно смеш.ен к атому кислорода, так что образуется диполь с центром положительного заряда у атома водорода, размеры которого невелики. Часто молекулы адсорбата, обладающие резко смеш,енной к периферии электронной плотностью или неподеленными электронными парами (например, атомы кислорода в молекулах воды, спиртов или эфиров), образуют дополнительно к рассмотренным выше взаимодействиям водородные [c.496]
Правда, доказано, что доминирующими центрами адсорбции воды в монтмориллоните и вермикулите являютск поверхностные атомы кислорода и обменные катионы — компенсаторы отрицательного заряда, а саму адсорбцию воды предложено рассматривать как образование аквакомплексов [Ме(Н20) ]+0 , где Ме+ — обменные катионы, 0 — поверхностные атомы кислорода [66]. Тем не менее метод ИК-спектроскопии позволяет выделить в минералах монтмориллонитовой группы четыре вида молекул прочно связанной воды [66, 92, 93] [c.36]
В связи с приведенными термодинамическими результатами следует заметить, что на любой гидрофильной поверхности молекулы воды адсорбируются локализованно. Постулируемая в работе [98] нелокализованная модель адсорбции воды в межслоевых промежутках монтмориллонита объясняется [85] некорректностью использования обычного термодинамического подхода для анализа состояния связанной набухающими сорбентами воды. [c.37]
Для силикатных пород нет точной информации о снижении о под действием воды. Обзор сведений по кварцу содержится в книге [257] и в работе [258], из которых видно, насколько велик разброс литературных данных. Однако можно считать, что свободная энергия негидратированной силоксановой поверхности кварца, обнажающейся при образовании ступеньки, вряд ли успевает сильно снизиться при физической адсорбции воды или при смачивании, а термоактивируемая химическая модификация поверхности с образованием силанольных связей требует большего времени. В то же время известно, что движение дислокаций в кварце может значительно облегчаться под действием воды. По схеме, разработанной Григгсом [259], в результате диффузии воды вдоль дислокаций образуются силанольные мостики =51—ОН. .. НО—51 =, которые легко рвутся в самом слабом месте (по водородной связи). Сопротивление движению дислокаций уменьшается, и поэтому диффузия ОН-групп (или, возможно, ионов Н+ или НзО+) контролирует подвижность дислокаций и, следовательно, скорость деформации. По сути, здесь мы имеем дело с явлением, близким к адсорбционному пластифицированию, только облегчение разрыва межатомных связей происходит в другом координационном окружении — не на поверхности, а в объеме. По-видимому, такой механизм возможен и в случае многих других силикатных минералов (оливин [260] и др.). [c.89]
Адсорбция воды приводит также к изменению токов ТСД в области ионных максимумов. Как видно из рис. 16.6, максимум В уменьшается с ростом гидратации, а максимум С растет. Такая зависимость может быть объяснена тем, что с увеличением содержания воды увеличивается электропроводность цеолита [697] и ионы, разморозившиеся первыми, экранируют ионы, еще остающиеся замороженными в области В. Другая причина уменьшения максимума с ростом гидратации может заключаться в шунтирующем действии образца, когда его сопротивление становится соизмеримым с сопротивлением электрометра. Эти причины являются более вероятными, чем сделанное первоначально [698] предположение о выключении из процесса В релаксаторов в результате их взаимодо.йствия с водой. [c.262]
В случае 7-AI2O3 были проведены измерения с образцом, дегидратированным при 473 и 673 К. Сравнение полученных результатов показывает, что при повышении температуры термовакуумной обработки происходит смещение зависимости температуры максимумов и силы тока в максимумах от степени гидратации (рис. 16.10). В результате прогрева уменьшается величина поляризации (сравнение проведено при адсорбции воды, равной 5,4 мг/г). Эти явления можно объяснить уменьшением числа молекул воды, обеспечивающих процесс //, для образца, дегидратированного при 673 К- При этом часть молекул воды, переставшая участвовать в процессе //, становится невидимой для метода токов ТСД. Доля таких молекул, определенная по величине температурного смещения максимумов, их высоте и уменьшению поляризации (рис. 16.10), составила, соответственно, 0,11 0,12 0,08 числа молекул в монослое Ош. Все это можно объяснить восстановлением частью адсорбированных молекул воды гидроксильного покрова, который частично был разрушен при прогревании -(-АЬОз до 673 К [703—705]. Можно предположить, как это сделано в работах [703, 704], что первые порции адсорбированных молекул взаимодействуют с [c.265]
| Рис. 5.22. Изобары адсорбции воды при давлении 1333 Па1 J цеолит АА, 2 силикагель 3 окись алюмниия. |  |
Текстильные волокна обладают самой разнообразной способностью к адсорбции воды, начиная с адсорбции воды виньоном равной почти нулю, и кончая шерстью и вискозой, жадно адсорбирующими воду. Средней способностью к адсорбции воды отличается ацетатное волокно и найлон. Главный фактор, способствующий адсорбции воды, — это присутствие в молекулярной структуре волокна полярных групп, которые могут быть гидроксильными, карбоксильными, карбонильными или же аминогруппами и др. Наличие таких групп характерно для всех сильно гидрофильных волокон, как-то вискозы, шерсти, хлопка и шелка. Они отсутствуют в волокнах, которые фактически не адсорбируют воду, например, в виньоне, динеле и дакроне В ограниченном количестве они присутствуют в волокнах, котбрые проявляют умеренную тенденцию к адсорбции, а именно в ацетатном волокне, найлоне и орлоне [c.214]
Poyen и Блэйн (см. ссылку 183) опубликовали недавно соответствующие пока затели для шелка. Необходимо, однако, иметь в виду, что данными, относящимися к белковым волокнам (шелку, шерсти, викаре и т. д.), следует пользоваться с большой осторожностью, так как равновесная влага этих волокон в значительной мере зависит от индивидуального состояния, в котором образец поступил на исследование. Установлено, что наличие на образце, например, шерсти других адсорбированных веществ существенно снижает способность к адсорбции воды (см. ссылку 184). Такое же действие производят красящие вещества (см. ссылку 185). В последнем случае наблюдается состязание между водой и красящим веществом за овладение одной и той же стороной адсорбирующей способности, свойственной шерсти. [c.216]
Спикмэн (см. ссылку 187), исследуя изотерму адсорбции воды шерстью, следовал способу Пирса. Полученные на основании его уравнения величины замечательно совпадали с экспериментальными данными, но только в пределах до 80%-ной относительной влажности. Отклонения, наблюдаемые при превышении указан- [c.217]
Рассмотрим в качестве примера адсорбцию воды иа угле [39е] и временно допустим, что ядсорбироваиные молекулы воды сохранили свое вращательиое движение. При N 10 =-= 10 =-слг2 и Т = 300° К [c.100]
Предполагается, что в связи с гидрофильностью железа, адсорбция ингибиторов происходит не на чистой её поверхности, а на поверхности, покрытой слоем гидроксид-радикалов, образующихся в ходе диссоциативной адсорбции воды. Доказывается два типа адсорбции воды Ме - ОН (А) и Ме -НО (В). В слу гае А адсорбция ингибитора за счет неподеленной пары электронов азота приводит к вытеснению ОНад . В случае В адсорбция предполагается за счет активного атома водорода, образующего связь с кислородом поверхностного гидроксида. Вытеснение адсорбированной воды при адсорбции аминов может происходить и другим путем. Амин, адсорбирующийся за счет электронной пары азота, образует связь типа водородной с молекулами воды. Такой ассоциат достаточно лабилен и покидает поверхность. На освободившемся месте поверхности адсорбируется амин, который и играет роль ингибитора. Водовьгтесюиощая способность аминов и их защитные свойства связаны здесь [c.115]
Третьей причиной гигроскопичности может быть адсорбция воды на поверхности частиц вещества и в тонких капиллярах высушенных или прокаленных гелей. С подобными процессами связана гигроскопичность окиси алю мииия, силикагеля и других веществ. [c.87]
chem21.info
Адсорбция - вода - Большая Энциклопедия Нефти и Газа, статья, страница 3
Адсорбция - вода
Cтраница 3
Адсорбция воды весьма чувствительна к химии поверхности полимера. Модифицирование этого сополимера аминами повышает адсорбцию пара воды. [31]
Адсорбция воды из растворов в этиловом и метиловом спиртах относится ко второму случаю, когда оба компонента проникают в адсорбционный объем. Полученные изотермы показывают, что адсорбция воды положительна во всей области концентраций. Изотерма адсорбции воды из раствора в этиловом спирте близка к линейной в интервале у 0.5 - 1, что говорит о более или менее полном вытеснении спирта из адсорбционного объема при высокой концентрации воды. [33]
Адсорбция воды, аммиака, низших спиртов и др. полярных низкомолекулярных в-в при небольших давлениях паров невелика; она сильно увеличивается при окислении поверхности угля. [34]
Адсорбция воды сопровождается выделением тепла в зоне активной адсорбции. При осушке газа под высоким давлением ( выше 35 am) единица веса воды содержится в большом количестве газа и в результате отвода тепла температура повышается лишь незначительно - всего на 1 - 2 град. При осушке газа или воздуха под низким давлением количество газа на единицу веса водяного пара значительно меньше и повышение температуры может быть гораздо больше. Практически тепло выделяется внутри зерен адсорбента в результате конденсации воды и смачивания адсорбента. Если охлаждающие змеевики в слое отсутствуют, выделяющееся тепло передается газовому потоку в зоне активной адсорбции. [35]
Адсорбция воды внутри обменного слоя вызывает эффективное набухание глинистой структуры, так как молекулы воды оттесняют слои до тех пор, пока в пространстве, в котором ранее содержался только один слой атомов натрия или кальция, не окажется четыре и более слоев молекул воды. Для натриевого бентонита это расстояние ( базальное) может увеличиваться от 9 8 А до гидратации до 40 А после гидратации. Для кальциевого бентонита увеличение базального расстояния составляет ( 12 7 - 17) А. [36]
Обратный адсорбции воды и набуханию процесс - удаление воды и усадка целлюлозы. Чзсть воды удаляется, и целлюлозные поверхности сближаются. Этот процесс продолжается до тех пор, пока между двумя целлюлозными поверхностями не останется мономолекулярный слой воды. Тогда происходит разрыв Н - связей между ОН-группами воды и целлюлозы и образуются водородные связи между макромолекулами целлюлозы на поверхностях волокон. [37]
При адсорбции воды на твердых поверхностях возникают высокополярные адсорбционные пленки, которые ухудшают смачиваемость поверхностей битумами. Поэтому влажные угольные порошки при низких температурах совсем не смачиваются битумами. [38]
Кроме адсорбции воды из раствора при внесении в него кристаллов на эффект повышения концентрации оказывает влияние теплота смачивания. Выделяясь при внесении кристаллов в раствор, теплота смачивания повышает температуру раствора. [39]
При адсорбции воды на цеолите NaHA полоса деформационных колебаний совпадает с полосой координационно-сорбированной воды на цеолите NaA. Так как термическая стабильность этих полос также оказалась сравнимой, мы полагаем одинаковый вид адсорбционных центров, что, конечно, предполагает перемещение остаточных ионов натрия в цеолите. [40]
При адсорбции воды эта реакция, вероятно, также имеет место ( диссоциативно сорбированная вода), однако равновесие в реакции определяемое уравнением ( 4), сдвинуто далеко влево. [42]
При адсорбции воды на различных типах цеолитов ( NaA, NaX и 0 6 MgO l КН4КаА) обнаружены релаксационные процессы типа / с близкими свойствами. При замене, например, большей части ионов Na HaHOHbiMg2 ( образец для исследования был получен от И. Е. Неймарка) при сравнимых условиях времена релаксации для процесса типа / увеличиваются приблизительно вдвое. Все эти факты свидетельствуют о том, что релаксация / есть релаксация молекул воды, первичными центрами адсорбции которой являются компенсирующие ионы цеолитного кристалла. Можно даже предположить в соответствии с представлениями О. Я. Самойлова, что адсорбированная вода в цеолите образует своеобразную гидратную оболочку этих ионов. [43]
При адсорбции воды на различных типах цеолитов ( NaA, NaX и 0 6 MgO l Nh5NaA) обнаружены релаксационные процессы типа / с близкими свойствами. При замене, например, большей части ионов Na aanoHbiMg2 1 ( образец для исследования был получен от И. Е. Неймарка) при сравнимых условиях времена релаксации для процесса типа / увеличиваются приблизительно вдвое. Все эти факты свидетельствуют о том, что релаксация / есть релаксация молекул воды, первичными центрами адсорбции которой являются компенсирующие ионы цеолитного кристалла. Можно даже предположить в соответствии с представлениями О. Я. Самойлова, что адсорбированная вода в цеолите образует своеобразную гидратную оболочку этих ионов. [44]
После адсорбции воды дегидратированным при 400 С цеолитом восстанавливается исходный спектр гидратированных катионов Си2, В работе [74] найдено, что восстановление исходного спектра ионов Си2 цеолита СиА, дегидратированного при 500 С, ускоряется при прогреве образца в атмосфере пара воды при 50 С. [45]
Страницы: 1 2 3 4
www.ngpedia.ru


















