Содержание
Основные оксиды – список с химическими свойствами
4.6
Средняя оценка: 4.6
Всего получено оценок: 2154.
4.6
Средняя оценка: 4.6
Всего получено оценок: 2154.
Оксиды – сложные вещества, состоящие из двух элементов, одним из которых является кислород. Оксиды могут быть солеобразующими и несолеобразующими: одним из видов солеобразующих оксидов являются основные оксиды. Чем они отличаются от других видов, и каковы их химические свойства?
Классификация оксидов
Солеобразующие оксиды подразделяются на основные, кислотные и амфотерные оксиды. Если основным оксидам соответствуют основания, то кислотным – кислоты, а амфотерным оксидам соответствуют амфотерные образования. Амфотерными оксидами называют такие соединения, которые в зависимости от условий могут проявлять либо основные, либо кислотные свойства.
Рис. 1. Классификация оксидов.
Физические свойства оксидов очень разнообразны. Они могут быть как газами (CO2), так и твердыми (Fe2O3) или жидкими веществами (H2O).
При этом большинство основных оксидов является твердыми веществами различных цветов.
оксиды, в которых элементы проявляют свою высшую активность называются высшими оксидами. Порядок возрастания кислотных свойств высших оксидов соответствующих элементов в периодах слева направо объясняется постепенным возрастанием положительного заряда ионов этих элементов.
Химические свойства основных оксидов
Основными оксидами называются оксиды, которым соответствуют основания. Например, основным оксидам K2O, СaO соответствуют основания KOH, Ca(OH)2 .
Рис. 2. Основные оксиды и соответствующие им основания.
Основные оксиды образуются типичными металлами, а также металлами переменной валентности в низшей степени окисления (например, CaO, FeO), реагируют с кислотами и кислотными оксидами, образуя при этом соли:
CaO (основной оксид)+CO2 (кислотный оксид)=СaCO3 (соль)
FeO (основной оксид)+H2 SO4 (кислота)=FeSO4 (соль)+2H2O (вода)
Основные оксиды также взаимодействуют с амфотерными оксидами, в результате чего происходит образование соли, например:
CaO+ZnO=CaZnO2
С водой реагируют только оксиды щелочных и щелочно-земельных металлов:
BaO (основной оксид)+H2O (вода)=Ba(OH)2 (основание щелочнозем. металла)
металла)
Многие основные оксиды имеют характер восстанавливаться до веществ, состоящих из атомов одного химического элемента:
3CuO+2NH3 =3Cu+3H2 O+N2
При нагревании разлагаются только оксиды ртути и благородных металлов:
2AU2O=4Au+O2
2HgO=2Hg+O2
Рис. 3. Оксид ртути.
Список основных оксидов:
| Название оксида | Химическая формула | Свойства |
| Оксид кальция | CaO | негашенная известь, белое кристаллическое вещество |
| Оксид магния | MgO | белое вещество, малорастворимое в воде |
| Оксид бария | BaO | бесцветные кристаллы с кубической решеткой |
| Оксид меди II | CuO | вещество черного цвета практически нерастворимое в воде |
| Оксид ртути II | HgO | твердое вещество красного или желто-оранжевого цвета |
| Оксид калия | K2O | бесцветное или бледно-желтое вещество |
| Оксид натрия | Na2O | вещество, состоящее из бесцветных кристаллов |
| Оксид лития | Li2 O | вещество, состоящее из бесцветных кристаллов, которые имеют строение кубической решетки |
В главных подгруппах периодической системы при переходе от одного элемента к другому сверху вниз наблюдается усиление основных свойств оксидов
Что мы узнали?
При образовании основных оксидов одним из обязательных элементов является кислород. Основные оксиды обладают рядом физических и химических свойств, таких как взаимодействие с водой, кислотами и другими оксидами.
Основные оксиды обладают рядом физических и химических свойств, таких как взаимодействие с водой, кислотами и другими оксидами.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 2154.
А какая ваша оценка?
Взаимодействие воды с оксидами — Учебник по Химии. 7 класс. Григорович
Учебник по Химии. 7 класс. Григорович — Новая программа
Вспомните, как составлять формулы оксидов по § 13.
Понятие о кислотах и основаниях
Многие оксиды способны вступать в химические реакции с водой. Обычно эти реакции являются реакциями соединения, в результате которых образуются продукты присоединения воды к оксидам. Вещества, образующиеся путем соединения воды с другими веществами, называют гидратами.
В зависимости от того, с каким оксидом взаимодействует вода, может образоваться два типа гидратов: кислоты и основания. Кислоты состоят из атомов Гидрогена и кислотного остатка (H2SO4, Н2СO3), а в формулах оснований на первое место записывают металлический элемент, с которым соединяется гидроксильная группа — ОН (КОН, Ва(ОН)2). В зависимости от гидрата, соответствующему определенному оксиду, среди оксидов выделяют две группы: кислотные оксиды и основные оксиды.
Кислоты состоят из атомов Гидрогена и кислотного остатка (H2SO4, Н2СO3), а в формулах оснований на первое место записывают металлический элемент, с которым соединяется гидроксильная группа — ОН (КОН, Ва(ОН)2). В зависимости от гидрата, соответствующему определенному оксиду, среди оксидов выделяют две группы: кислотные оксиды и основные оксиды.
Кислотные оксиды
Все кислотные оксиды, за исключением силиций(ІV) оксида SiO2, в обычных условиях вступают в реакции соединения с водой с образованием кислот:
SO3 + Н2O = H2SO4 (сульфатная кислота)
СO2 + Н2O = Н2СO3 (карбонатная кислота)
Р2O5 + 3Н2O = 2Н3РO4 (ортофосфатная кислота)
Оксиды, гидраты которых являются кислотами, называют кислотными оксидами.
Большинство кислотных оксидов — это оксиды неметаллических элементов. Но кислотные оксиды могут образовывать и металлические элементы, если эти элементы могут проявлять высокие валентности, выше четырех. Так, к кислотным оксидам относится хром(VI) оксид CrO3 и манган(VII) оксид Mn2O7.
Но кислотные оксиды могут образовывать и металлические элементы, если эти элементы могут проявлять высокие валентности, выше четырех. Так, к кислотным оксидам относится хром(VI) оксид CrO3 и манган(VII) оксид Mn2O7.
Формулы наиболее употребляемых кислотных оксидов и соответствующих им кислот приведены в таблице 5.
Таблица 5. Кислотные оксиды и соответствующие им кислоты
Кислотный оксид | Кислота (гидрат кислотного оксида) |
SiO2 | Силикатная H2SiO3 |
SO2 | Сульфитная H2SO3 |
P2O5 | Ортофосфатная Н5РO4 |
N2O3 | Нитритная HNO2 |
CrO3 | Хроматная Н2CrO4 |
Mn2O7 | Перманганатная HMnO4 |
Основные оксиды
Продукты реакции оксидов с водой (гидраты) могут проявлять основные свойства. Если гидрат оксида является основанием, то такой оксид — основный.
Если гидрат оксида является основанием, то такой оксид — основный.
Оксиды, гидраты которых являются основаниями, называют основными оксидами.
К основным оксидам относятся оксиды металлических элементов. Это, как правило, оксиды одно-, дву-, а иногда трехвалентных металлических элементов (табл. 6).
Таблица 6. Основные оксиды и соответствующие им основания
Основные оксиды | Взаимодействие с водой | Основания |
Na2O | Взаимодействуют | Натрий гидроксид NaOH |
к2о | Калий гидроксид КОН | |
Li2O | Литий гидроксид LiOH | |
SrO | Стронций гидроксид Sr(OH)2 | |
BaО | Барий гидроксид Ва(ОН)2 | |
Ag2O | Не взаимодействуют | Аргентум гидроксид AgOH |
CuO | Купрум(II) гидроксид Cu(ОН)2 | |
FeO | Феррум(II) гидроксид Fe(OH)2 |
Большинство основных оксидов с водой не взаимодействуют.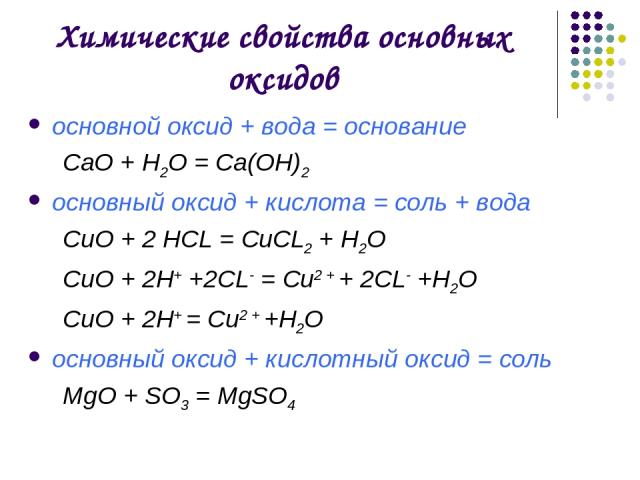 В реакцию с водой вступают лишь оксиды, гидраты которых растворяются в воде (см. табл. 6, с. 161). Такие гидраты называют щелочами:
В реакцию с водой вступают лишь оксиды, гидраты которых растворяются в воде (см. табл. 6, с. 161). Такие гидраты называют щелочами:
Na2O + Н2O = 2NaOH
CaO + Н2O = Са(ОН)2
Узнайте больше
• Единственный кислотный оксид, который в обычных условиях не взаимодействует с водой,— это силиций(IV) оксид SiO2, которому соответствует силикатная кислота H2SiO3. Он широко распространен в природе в составе минерала кварца. Обычный кварцевый песок на берегах морей и рек — это и есть силиций(IV) оксид.
• При взаимодействии кальций оксида (негашеной извести) с водой образуется кальций гидроксид (гашеная известь). Во время этой реакции выделяется так много теплоты, что вода может закипеть. Эту реакцию используют в так называемых химических грелках для разогревания завтраков или напитков в одноразовых пакетах.
Выявление кислот и оснований в растворах
Большинство оксидов и соответствующих им гидратов — бесцветные соединения, поэтому выявить их наличие или различить кислоты и основания без «посторонней помощи» невозможно. Для выявления кислот и оснований в растворах используют индикаторы — сложные органические соединения, которые изменяют свою окраску в зависимости от наличия кислоты или основания в растворе (рис. 114). Наиболее употребляемые индикаторы и их цвет при наличии кислот и оснований приведены в таблице 7.
Для выявления кислот и оснований в растворах используют индикаторы — сложные органические соединения, которые изменяют свою окраску в зависимости от наличия кислоты или основания в растворе (рис. 114). Наиболее употребляемые индикаторы и их цвет при наличии кислот и оснований приведены в таблице 7.
Таблица 7. Цвет некоторых индикаторов при наличии кислот, оснований и в воде
Индикатор | Цвет | ||
в растворах кислот | в растворах оснований | в чистой воде | |
Лакмус | Красный | Синий | Фиолетовый |
Метилоранж | Красный | Желтый | Оранжевый |
Фенолфталеин | Бесцветный | Малиновый | Бесцветный |
Чаще всего индикаторы используют в виде растворов — в воде или спирте. Удобнее использовать индикаторную бумагу — обычную бумагу, пропитанную раствором индикатора (рис. 115).
Удобнее использовать индикаторную бумагу — обычную бумагу, пропитанную раствором индикатора (рис. 115).
Рис. 114. Цвет лакмуса при наличии: а — кислот; б — оснований
Рис. 115. Раствор индикатора и индикаторная бумага
ГДЗ к учебнику можно найти тут.
Попередня
Сторінка
Наступна
Сторінка
Зміст
Цей контент створено завдяки Міністерству освіти і науки України
Оксиды — Мини-химия — Изучайте химию онлайн
от Mini Chemistry
Показать/Скрыть подтемы (Кислоты, основания и соли | Уровень O)
Элементы реагируют с кислородом (например, горят в кислороде ) в атмосфере с образованием оксидов .
Оксиды классифицируются как:
- Кислотные
- Базовый
- Амфотерный
- Нейтральный
Кислотные оксиды
Кислотные оксиды реагируют с водой с образованием кислот .
- Отзыв: Растворы этих кислот в воде имеют значение pH менее 7.
Кислотные оксиды представляют собой оксиды неметаллов , которые также известны как оксиды неметаллов . Примеры:
- $\text{Углерод} + \text{кислород} \rightarrow \text{углекислый газ}$ $$\text{C} (\text{s}) + \text{O}_{2} (\text{g}) \rightarrow \text{CO}_{2} (\text{g})$$
- $\text{Сера} + \text{кислород} \rightarrow \text{ диоксид серы}$ $$\text{S} (\text{s}) + \text{O}_{2} (\text{ ж}) \rightarrow \text{SO}_{2} (\text{g})$$
Примеры кислотных оксидов приведены в таблице ниже:
| Кислотные оксиды | Формула | Кислота, полученная из воды |
|---|---|---|
| Двуокись серы | $\text{SO}_{2}$ | Сернистая кислота $\text{H}_{2}\text{SO}_{3}$ |
| Триоксид серы | $\text{SO}_{3}$ | Серная кислота $\text{H}_{2}\text{SO}_{4}$ |
| Двуокись углерода | $\text{CO}_{2}$ | Угольная кислота $\text{H}_{2}\text{CO}_{3}$ |
| Оксид фосфора(V) | $\text{P}_{4}\text{O}_{10}$ | Фосфорная кислота $\text{H}_{3}\text{PO}_{4}$ |
Основные оксиды
Основные оксиды реагируют с кислотой с образованием только соли и воды.
- Обратите внимание, что это реакция нейтрализации .
- Следовательно, основные оксиды нейтрализуют кислот.
Основные оксиды, растворимые в воде, называются щелочами .
- Отзыв: Растворы этих щелочей в воде имеют значение рН более 7.
Основные оксиды представляют собой оксиды металлов , также известный как оксиды металлов . Примеры:
- $\text{Натрий} + \text{кислород} \rightarrow \text{ оксид натрия}$ $$\text{Na} (\text{s}) + \text{O}_{2} (\text{g}) \rightarrow 2\text{Na}_{2}\text{O} (\text{s})$$
- $\text{Медь} + \text{кислород} \rightarrow \text{ оксид меди(II)}$ $$\text{Cu} (\text{s}) + \text{O}_{2} ( \text{g}) \rightarrow 2\text{CuO} (\text{s})$$
Примеры основных оксидов приведены в таблице ниже:
| Основные оксиды | Формула |
|---|---|
| Оксид натрия | $\text{Na}_{2}\text{O}$ |
| Оксид магния | $\text{MgO}$ |
| Оксид кальция | $\text{CaO}$ |
| Оксид меди | $\text{CuO}$ |
| Оксид железа (III) | $\text{Fe}_{2}\text{O}_{3}$ |
Оксиды амфотерные
Амфотерные оксиды ведут себя как кислотные оксиды или как основные оксиды.
- Амфотерные оксиды проявляют как кислотные, так и основные свойства.
- Амфотерные оксиды могут реагировать как с кислотами, так и со щелочами с образованием солей и воды. (Напоминаем: реакция нейтрализации)
Примеры амфотерных оксидов приведены в таблице ниже:
| Амфотерные оксиды | Формула |
|---|---|
| Оксид алюминия | $\text{Al}_{2}\text{O}_{3}$ |
| Оксид цинка | $\text{ZnO}$ |
| Оксид свинца(II) | $\text{PbO}$ |
Реакции амфотерных оксидов с кислотами :
- Оксид алюминия с соляной кислотой $$\text{Al}_{2}\text{O}_{3} + 6 \text{HCl} \rightarrow 2\text{AlCl}_{3} + 3\text{H}_{2}\text{O}$$
- Оксид цинка с серной кислотой $$\text{ZnO} + \text{H}_{2}\text{SO}_{4} \rightarrow \text{ZnSO}_{4} + \text{H}_ {2}\text{О}$$
- Оксид свинца(II) с азотной кислотой $$\text{PbO} + 2 \text{HNO}_{3} \rightarrow \text{Pb}\left( \text{NO}_{3} \right)_ {2} + \text{H}_{2}\text{O}$$
Реакции амфотерных оксидов с основаниями :
- Оксид алюминия с гидроксидом натрия с образованием алюмината натрия $$\text{Al}_{2}\text{O}_{3} + 2 \text{NaOH} \rightarrow 2\text{NaAlO}_{2} + 3\text{H}_{2}\text{O}$$
- Оксид цинка с гидроксидом натрия с образованием цинката натрия $$\text{ZnO} + 2 \text{NaOH} \rightarrow \text{Na}_{2}\text{ZnO}_{2} + \text{H} _{2}\text{O}$$
- Оксид свинца(II) с гидроксидом натрия с образованием плюмбата натрия(II) $$\text{PbO} + 2 \text{NaOH} \rightarrow \text{Na}_{2}\text{PbO}_{2} + \text{H}_{2}\text{O}$$
Нейтральный оксид
Нейтральный оксид не имеет кислотных или основных свойств. Примеры:
Примеры:
- Вода
- Окись углерода
Совместное использование означает заботу:
Категории Кислоты Основания и соли, Уровень O Теги
фактов, которые вы должны знать — Lambda Geeks
Основные оксиды — это оксиды, которые являются основными по своей природе и содержат один или несколько атомов кислорода, либо они реагируют с водой с образованием основания, либо реагируют с кислотой с образованием соли. В периодической таблице элементы 1-й группы — щелочные, элементы 2-й группы — щелочноземельные металлы, элемент 13-й группы — Tl2O, и элемент 15-й группы — Bi 2 O 3 образуют основные оксиды. Примеры основных оксидов включают
- Оксид лития ( LI 2 O)
- Оксид натрия ( NA 2 O)
- Оксид калия ( K
- 00
- 87878887878788788888788888787878787878787878787878787878888788887888888888888888888888888887878
- 9
- .
 Rb 2 O)
Rb 2 O) - Cesium oxide ( Cs 2 O)
- Magnesium oxide (MgO)
- Calcium oxide ( CaO )
- Strontium Оксид (SRO)
- Оксид бария ( BAO)
- Thallium (I) Оксид ( TL 2 O)
- BISMATHUTH (Iι) OXIDE (BISIDE (BISID )
1.
Оксид лития:
Химическая формула оксида лития: Li 2 O. Это белое твердое вещество, образующееся при сжигании металлического лития с кислородом в воздухе и соединении температура выше 100 °C
4Li + O 2 → 2Li 2 O.
При сжигании металлического лития образуется оксид лития из Википедии
Оксид лития реагирует с водой и паром и образует гидроксид лития. Используется в керамической промышленности и барьерных покрытиях.
Используется в керамической промышленности и барьерных покрытиях.
2. Оксид натрия:
Химическая формула оксида натрия: Na 2 O. Это белое твердое вещество, которое образуется в результате реакции f натрия с следует:
2NaOH + 2Na → 2Na 2 O + H 2
Реакция оксида натрия с водой дает гидроксид натрия, который является основанием. Реакция приведена ниже. Реакция представлена как
Na 2 O + 2HCl → 2NaCl + H 2 O
В различных материалах, таких как керамика и стекло, в качестве компонента используется оксид натрия.
3.
Оксид калия:
Химическая формула оксида калия K 2 O. Это бледно-желтое твердое вещество, обладающее высокой реакционной способностью. Оксид калия получают реакцией пероксида с калием.
K 2 O 2 +2K→ 2K 2 O
4.
 Оксид рубидия:
Оксид рубидия:
Химическая формула Оксид рубидия Rb 2 O. Это твердое вещество желтого цвета, которое играет важную роль в применении топливных элементов. Он реагирует с водой с образованием гидроксида рубидия, который дается как
Rb 2 O + H 2 O → 2 RbOH
Оксид рубидия реагирует с водородом с образованием гидрида рубидия и гидроксида рубидия. Реакция протекает следующим образом:
Rb 2 O + H 2 → RbOH + RbH
5.
Оксид цезия:
Химическая формула Оксид цезия Cs 2 O. Это кристалл желто-оранжевого цвета, который используется в фотокатодах телевизионных камер. Оксид цезия реагирует с водой с образованием гидроксида цезия.
Cs 2 O (т) + H 2 O (ж) → 2CsOH (водн.)
6.
Оксид магния:
2 9 0. Оксид магния: оксид магния MgO Это белое гигроскопичное твердое вещество, состоящее из Mg 9.0505 2+ и O 2- ионы удерживаются вместе за счет ионной связи. Оксид магния реагирует с водой с образованием гидроксида магния Реакция представлена в виде
Оксид магния: оксид магния MgO Это белое гигроскопичное твердое вещество, состоящее из Mg 9.0505 2+ и O 2- ионы удерживаются вместе за счет ионной связи. Оксид магния реагирует с водой с образованием гидроксида магния Реакция представлена в виде
MgO + 2 HCl → MgCl 2 + H 2 O
Одним из физических свойств оксида магния является то, что он является хорошим теплопроводником и электрическим изолятором, который широко используется в теплоизоляции и огнеупорный кирпич. Оксид магния используется в медицине, пищевых добавках, изоляторах, удобрениях для растений и кормах для животных.
7.
Оксид кальция:
Химическая формула оксида кальция: CaO. Ее еще называют негашеной или известью. Оксид кальция реагирует с водой и образует основание, называемое гидроксидом кальция.
CaO +H 2 O → Ca (OH) 2
Оксид кальция широко используется в сталелитейной промышленности, при очистке воды.
8.
Оксид стронция:
Химическая формула Оксид стронция SrO. это белого цвета, а растворим в гидроксиде калия. Смесь оксида стронция и нитрида стронция образуется при сжигании стронция на воздухе . Оксид стронция играет важную роль в электронно-лучевых трубках и блокирует рентгеновское излучение.
9. Оксид бария:
Химическая формула Оксид бария – BaO. Это негорючее соединение белого цвета. Его получают нагреванием карбоната бария при высокой температуре.
BaCO 3 → BaO + CO 2
Оксид бария используется в качестве компонента кронового стекла, электронно-лучевых трубок и катализаторов.
10. Оксид таллия (I):
Химическая формула Оксид таллия (I): Tl 2 O, где таллий находится в степени окисления +1. Это элемент группы 13, который имеет черный цвет и меняет цвет на желтый при растворении в воде с образованием гидроксида таллия (I).
Оксид таллия (I) реагирует с водой с образованием гидроксида таллия (I). Реакция приведена ниже
Tl 2 O (s) + H 2 O (l) → 2 TlOH (aq)
Он используется в качестве важного компонента в высокотемпературных сверхпроводниках и в стекле с высоким индексом.
11. Оксид висмута (IΙΙ):
Химическая формула Оксид висмута (IΙΙ) Bi 2 O 3. Висмут относится к элементу 15 группы в периодической таблице и имеет желтый цвет.
Оксид висмута (IΙΙ) из Википедии
Оксид висмута (IΙΙ) реагирует с водой с образованием гидроксида висмута (III).
Bi 2 O 3 (т) + 3 H 2 O (л) → 2 Bi(OH) 3 (водн.)
Bi 2 O 3 используется в твердом оксидные топливные элементы, стоматологические материалы и гидравлические силикатные цементы.
Заключение:
Основные оксиды являются основными по своей природе, реагируют ли они с водой или кислотой.

 Rb 2 O)
Rb 2 O)