Содержание
Химические свойства амфотерных оксидов | CHEMEGE.RU
Перед изучением этого раздела рекомендую изучить следующие темы:
Классификация неорганических веществ
Классификация оксидов, способы их получения
Химические свойства основных оксидов
Химические свойства кислотных оксидов
Амфотерные оксиды проявляют свойства и основных, и кислотных. От основных отличаются только тем, что могут взаимодействовать с растворами и расплавами щелочей и с расплавами основных оксидов, которым соответствуют щелочи.
1. Амфотерные оксиды взаимодействуют с кислотами и кислотными оксидами.
При этом амфотерные оксиды взаимодействуют, как правило, с сильными и средними кислотами и их оксидами.
Например, оксид алюминия взаимодействует с соляной кислотой, оксидом серы (VI), но не взаимодействует с углекислым газом и кремниевой кислотой:
амфотерный оксид + кислота = соль + вода
Al2O3 + 6HCl = 2AlCl3 + 3H2O
амфотерный оксид + кислотный оксид = соль
Al2O3 + 3SO3 = Al2(SO4)3
Al2O3 + CO2 ≠
Al2O3 + H2SiO3 ≠
2. Амфотерные оксиды не взаимодействуют с водой.
Амфотерные оксиды не взаимодействуют с водой.
Оксиды взаимодействуют с водой, только когда им соответствуют растворимые гидроксиды, а все амфотерные гидроксиды — нерастворимые.
амфотерный оксид + вода ≠
3. Амфотерные оксиды взаимодействуют с щелочами.
При этом механизм реакции и продукты различаются в зависимости от условий проведения процесса — в растворе или расплаве.
В растворе образуются комплексные соли, в расплаве — обычные соли.
Формулы комплексных гидроксосолей составляем по схеме:
- Сначала записываем центральный атом-комплекообразователь (это, как правило, амфотерный металл).
- Затем дописываем к центральному атому лиганды — гидроксогруппы. Число лигандов в 2 раза больше степени окисления центрального атома (исключение — комплекс алюминия, у него, как правило, 4 лиганда-гидроксогруппы).
- Заключаем центральный атом и его лиганды в квадратные скобки, рассчитываем суммарный заряд комплексного иона.

- Дописываем необходимое количество внешних ионов. В случае гидроксокомплексов это — ионы основного металла.
Основные продукты взаимодействия соединений амфотерных металлов со щелочами сведем в таблицу.
| Металлы | В расплаве щелочи | В растворе щелочи |
Степень окисле-ния +2 (Zn, Sn, Be) | Соль состава X2YO2*. Например: Na2ZnO2 | Комплексная соль состава Х2[Y(OH)4]*. Например: Na2[Zn(OH)4] |
| Степень окисле-ния +3 (Al, Cr, Fe) | Соль состава XYO2 (мета-форма) или X3YO3 (орто-форма). Например: NaAlO2 или Na3AlO3 | Na3[Al(OH)6] или Na[Al(OH)4 Комплексная соль состава Х3[Y(OH)6]* или реже Х[Y(OH)4].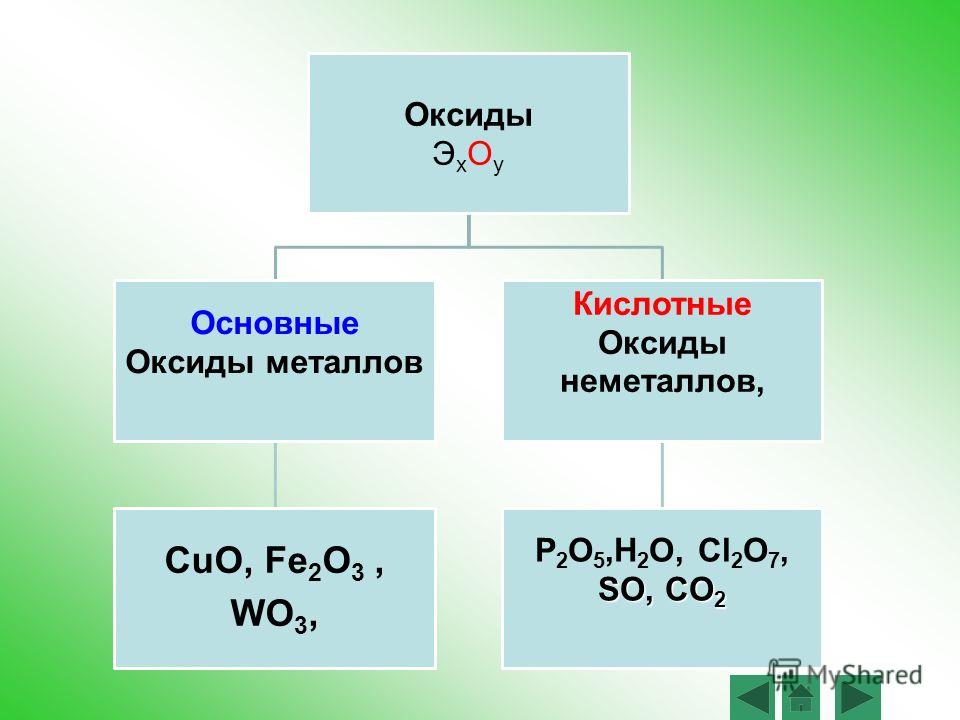 Например: Na[Al(OH)4] Например: Na[Al(OH)4] |
* здесь Х — щелочной металл, Y — амфотерный металл.
Исключение — железо не образует гидроксокомплексы в растворе щелочи!
Например:
амфотерный оксид + щелочь (расплав) = соль + вода
Al2O3 + 2NaOH = 2NaAlO2 + H2O
амфотерный оксид + щелочь (раствор) = комплексная соль
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
4. Амфотерные оксиды взаимодействуют с основными оксидами.
При этом взаимодействие возможно только с основными оксидами, которым соответствуют щелочи и только в расплаве. В растворе основные оксиды взаимодействуют с водой с образованием щелочей.
амфотерный оксид + основный оксид = соль + вода
Al2O3 + Na2O = 2NaAlO2
5. Окислительные и восстановительные свойства.
Окислительные и восстановительные свойства.
Амфотерные оксиды способны выступать и как окислители, и как восстановители и подчиняются тем же закономерностям, что и основные оксиды. Окислительно-восстановительные свойства амфотерных оксидов подробно рассмотрены в статье про основные оксиды.
6. Амфотерные оксиды взаимодействуют с солями летучих кислот.
При этом действует правило: в расплаве менее летучие кислоты и их оксиды вытесняют более летучие кислоты и их оксиды из их солей.
Например, твердый оксид алюминия Al2O3 вытеснит более летучий углекислый газ из карбоната натрия при сплавлении:
Na2CO3 + Al2O3 = 2NaAlO2 + CO2
Понравилось это:
Нравится Загрузка…
Химические свойства оксидов для ЕГЭ 2022 / Блог / Справочник :: Бингоскул
добавить в закладки удалить из закладок
Классификация оксидов:
1 группа — несолеобразующие — N2O, NO, CO, SiO.
2 группа — солеобразующие:
- Основные — это такие оксиды, которым соответствуют основания. Оксиды металлов, степень окисления которых +1, +2 : Na2O, CaO, CuO, FeO, CrO. Реагируют с избытком кислоты с образованием соли и воды. Основным оксидам соответствуют основания: 1) щелочные металлы; 2) щелочноземельные металлы; 3) некоторые — CrO, MnO, FeO. Типичные реакции основных оксидов:
- Основный оксид + кислота → соль + вода (реакция обмена).
- Основный оксид + кислотный оксид → соль (реакция соединения)
- Основный оксид + вода → щелочь (реакция соединения).
- Кислотные —— это такие оксиды, которым соответствуют кислоты. Оксиды неметаллов. Оксиды металлов, степень окисления которых > +5: SO2, SO3, P2O5, CrO3, Mn2O7.
 Реагируют с избытком щелочи с образованием соли и воды. Типичные реакции кислотных оксидов:
Реагируют с избытком щелочи с образованием соли и воды. Типичные реакции кислотных оксидов: - Кислотный оксид + основание → соль + вода (реакция обмена).
- Кислотный оксид + основный оксид → соль (реакция соединения).
- Кислотный оксид + вода → кислота (реакция соединения)
- Амфотерные — это оксиды, которые в зависимости от условий проявляют основные или кислотные свойства. Оксиды металлов, степень окисления которых +2, +3, +4: BeO, ZnO, Al2O3, Cr2O3, MnO2. Взаимодействуют как с кислотами так и с основаниями. Реагируют с основными и кислотными оксидами. Амфотерные оксиды с водой непосредственно не соединяются. Типичные реакции амфотерных оксидов:
- Амфотерный оксид + кислота → соль + вода (реакция обмена).
- Амфотерный оксид + основание → соль + вода или комплексное соединение.
Оксид углерода 2 и 4
Оксид углерода(II) в химическом отношении – инертное вещество. Не реагирует с водой, однако при нагревании с расплавленными щелочами образует соли муравьиной кислоты: CO + NaOH = HCOONa.
Не реагирует с водой, однако при нагревании с расплавленными щелочами образует соли муравьиной кислоты: CO + NaOH = HCOONa.
Взаимодействие с кислородом
При нагревании в кислороде сгорает красивым синим пламенем: 2СО + О2 = 2СО2.
Взаимодействие с водородом: СО + Н2 = С + Н2О.
Взаимодействие с другими неметаллами. При облучении и в присутствии катализатора взаимодействует с галогенами: СО + Cl2 = COCl2 (фосген). и серой СО + S = COS (карбонилсульфид).
Восстановительные свойства
СО – энергичный восстановитель. Восстанавливает многие металлы из их оксидов:
C+2O + CuO = Сu + C+4O2.
Взаимодействие с переходными металлами
С переходными металлами образует карбонилы:
- Ni + 4CO = Ni(CO)4;
- Fe + 5CO = Fe(CO)5.

Оксид углерода (IV) (углекислый газ, диоксид углерода, двуокись углерода,угольный ангидрид) — CO2, бесцветный газ (в нормальных условиях), без запаха, со слегка кисловатым вкусом. Химически оксид углерода (IV) инертен.
Окислительные свойства
С сильными восстановителями при высоких температурах проявляет окислительные свойства. Углем восстанавливается до угарного газа: С + СО2 = 2СО.
Магний, зажженный на воздухе, продолжает гореть и в атмосфере углекислого газа: 2Mg + CO2 = 2MgO + C.
Свойства кислотного оксида
Типичный кислотный оксид. Реагирует с основными оксидами и основаниями, образуя соли угольной кислоты:
- Na2O + CO2 = Na2CO3,
- 2NaOH + CO2 = Na2CO3 + H2O,
- NaOH + CO2 = NaHCO3.
Качественна реакция — для обнаружения углекислого газа является помутнение известковой воды:
Ca(OH)2 + CO2 = CaCO3↓ + H2O.
В начале реакции образуется белый осадок, который исчезает при длительном пропускании CO2 через известковую воду, т.к. нерастворимый карбонат кальция переходит в растворимый гидрокарбонат: CaCO3 + H2O + CO2 = Сa(HCO3)2.
Изучай химические свойства
- кислот,
- металлов и неметаллов,
- солей,
- оснований и амфотерных гидроксидов.
Решай с ответами:
- задание 5 по химии
- задание 7 по химии
- задание 10 по химии
Поделитесь в социальных сетях:
21 марта 2018, 10:44
Could not load xLike class!
Амфотерные оксиды – идентификация, примеры, периодическая таблица и применение
Амфотерные оксиды представляют собой оксиды, которые ведут себя как основные, так и кислотные оксиды. Амфотерные оксиды также обладают свойствами кислотных и основных оксидов, которые нейтрализуют как кислоты, так и основания. Это значение простых амфотерных оксидов. Амфотерные оксиды растворяются в воде с образованием щелочных растворов. Щелочные растворы содержат ионы гидроксида. Таким образом, оксид алюминия (который представляет собой Al 2 O 3 ) реагирует с соляной кислотой с образованием воды и хлорида алюминия. Оксид алюминия является амфотерным оксидом. С раствором гидроксида натрия он производит воду и алюминат натрия (NaAlO 2 ).
Это значение простых амфотерных оксидов. Амфотерные оксиды растворяются в воде с образованием щелочных растворов. Щелочные растворы содержат ионы гидроксида. Таким образом, оксид алюминия (который представляет собой Al 2 O 3 ) реагирует с соляной кислотой с образованием воды и хлорида алюминия. Оксид алюминия является амфотерным оксидом. С раствором гидроксида натрия он производит воду и алюминат натрия (NaAlO 2 ).
Другие распространенные примеры амфотерных оксидов включают SnO, ZnO и PbO. Al 2 O 3 представляет собой амфотерный оксид. Формула амфотерного оксида: Al 2 O 3 .
Идентификация амфотерных оксидов
Оксиды представляют собой соединения металлов или неметаллов с кислородом. Существует четыре типа оксидов. Амфотерные оксиды классифицируются как оксиды металлов, которые реагируют как с кислотами, так и с основаниями, а также с образованием воды и солей. Амфотерные оксиды, среди некоторых других, включают оксид цинка и оксид свинца. Примеры включают белки и аминокислоты, которые относятся к классам карбоновых кислот, аминов и молекул, которые могут самоионизироваться, например вода. Амфотерные оксиды представляют собой соединения кислорода, которые проявляют как основные, так и кислотные характеристики. Эти оксиды подвергаются реакции нейтрализации с образованием воды и соли при взаимодействии с кислотой. Это описывает важные свойства соединений.
Амфотерные оксиды, среди некоторых других, включают оксид цинка и оксид свинца. Примеры включают белки и аминокислоты, которые относятся к классам карбоновых кислот, аминов и молекул, которые могут самоионизироваться, например вода. Амфотерные оксиды представляют собой соединения кислорода, которые проявляют как основные, так и кислотные характеристики. Эти оксиды подвергаются реакции нейтрализации с образованием воды и соли при взаимодействии с кислотой. Это описывает важные свойства соединений.
Точно так же щелочь реагирует на образование как соли, так и воды, проявляя кислотное свойство. Примером является оксид алюминия. Все оксиды могут быть образованы при нагревании элемента в кислороде. Реакция водных растворов тригалогенидов металлов с гидроксидом приводит к образованию оксидов в гидратированной форме. Спускаясь вниз по группе, происходит переход от кислых оксидов через амфотерные к основным из-за усиливающегося металлического характера рассматриваемых элементов. Формула амфотерного оксида: Al 9.0003 2 О 3 .
Формула амфотерного оксида: Al 9.0003 2 О 3 .
Oxides of the Group 13 Elements
Oxides | Properties |
Al 2 O 3 | Amphoteric |
B Слабокислотный0042 | Weakly base |
Ga 2 O 3 | Amphoteric |
Tl 2 O 3 | Oxidizing, Basic |
Амфотерные оксиды Примеры
Термин «амфотерный» означает как основание, так и кислоту. Амфотерные оксиды обладают как кислотными, так и основными свойствами. Оксиды цинка и алюминия являются примерами. Когда они реагируют с кислотами, они образуют соли. Кроме того, они реагируют со щелочами с образованием сложных солей.
Когда они реагируют с кислотами, они образуют соли. Кроме того, они реагируют со щелочами с образованием сложных солей.
Примеры амфотерных оксидов. Давайте посмотрим на некоторые из примеров амфотерных оксидов или список амфотерных оксидов ниже:
ZnO(s) + 2NaOH(aq) → Na l)
ZnO(т) + 2HNO 3(водн.) → Zn(NO 3 ) 2(водн.) + H 2 O(л)
Al 3 O 900s ) + 2NaOH(водн.) → 2NaAlO 2(водн.) + H 2 O(л)
Al 2 O 3(т) + 6HCl(водн.) → 2AlCl 3(aq) + 3H 2 O(l)
Это список некоторых амфотерных оксидов. Алюминаты и цинкаты имеют окончание -ate, означающее, что их ионы представляют собой составные ионы, содержащие кислород, подобно карбонатам, нитратам и сульфатам, указывая на то, что ионы ZnO 2 2-, а ионы алюмината — AlO 2 2-. Ионы могут быть записаны как Al(OH) 4 4- и Zn(OH) 4 2-. Следует отметить, что алюминат и цинкат натрия растворимы в воде.
Следует отметить, что алюминат и цинкат натрия растворимы в воде.
Амфотерные оксиды в периодической таблице В данный период оксиды развиваются от сильно основных через слабоосновные оксиды, амфотерные и слабокислые к сильнокислым оксидам. Некоторые примеры: MgO, Na 2 O, P 4 O 10 , Al 2 O 3 , Cl 2 O 7 и SO
3 4
. Кроме того, кислотность увеличивается с увеличением степени окисления. Например, MnO < Mn 2 O 3 < Mn 2 O 7 .В периодической таблице существует тенденция изменения кислотности оксидов. В целом тренд по периоду — основной → амфотерный → кислый. The below table represents the trend in oxide acidity for period 3.
Na 2 O | Al 2 O 3 | MgO | P 4 O 18 | SiO 2 | Cl 2 O 7 | SO 2 |
Strongly basic | Amphoteric | Basic | Кислотный | Слабо кислый | сильно кислый | Кислотный |
Наиболее базовые оксиды могут быть обнаружены вблизи дно и II и II. группа. Следовательно, для группы-V кислотность оксидов равна Р 2 O 3 (кислая), NO 2 (кислая), As 2 O 3 (амфотерная). Bi 2 O 3 (основные), Sb 2 O 3 (амфотерные). В первичных группах амфотерных элементов основность оксидов увеличивается с увеличением атомного номера вниз по группе, например, BeO < MgO < CaO < SrO < BaO (BeO амфотерен), хотя в более поздних переходных группах амфотерных элементов тенденция обратная.
группа. Следовательно, для группы-V кислотность оксидов равна Р 2 O 3 (кислая), NO 2 (кислая), As 2 O 3 (амфотерная). Bi 2 O 3 (основные), Sb 2 O 3 (амфотерные). В первичных группах амфотерных элементов основность оксидов увеличивается с увеличением атомного номера вниз по группе, например, BeO < MgO < CaO < SrO < BaO (BeO амфотерен), хотя в более поздних переходных группах амфотерных элементов тенденция обратная.
Некоторые амфотерные оксиды и их химическая основа
Химическая причина проста. Чтобы вещество вело себя в растворе как основание, оно должно каким-то образом разорвать связь Н-ОН, чтобы высвободить ионы ОН-, реагируя с протоном, образующимся при диссоциации. Например, оксид калия (K 2 O) образует ионы 2K+ (которые не могут гидролизовать молекулы воды из-за их низкого положительного заряда) и ион O2-, который может разрывать связь H-OH, притягивая атом H молекулы H 2 O и выделение ионов ОН- в раствор. Таким образом, это основной оксид. Теперь, поскольку калий содержит только заряд +1, он не сильно притягивается к ОН- воды, и, следовательно, мы видим только реакцию кислорода с водой. Но если мы возьмем пример амфотерного оксида, скажем, оксида алюминия, мы увидим, что алюминий несет очень высокий положительный заряд +3, что заставляет его притягиваться к гидроксильной группе воды. Следовательно, он может реагировать с водой с высвобождением протонов вместо гидроксильных групп.
Таким образом, это основной оксид. Теперь, поскольку калий содержит только заряд +1, он не сильно притягивается к ОН- воды, и, следовательно, мы видим только реакцию кислорода с водой. Но если мы возьмем пример амфотерного оксида, скажем, оксида алюминия, мы увидим, что алюминий несет очень высокий положительный заряд +3, что заставляет его притягиваться к гидроксильной группе воды. Следовательно, он может реагировать с водой с высвобождением протонов вместо гидроксильных групп.
То же самое и с хромом, железом, включая все другие металлы, образующие амфотерные оксиды. Если металл несет высокий положительный заряд, он будет действовать как кислота и реагировать с гидроксильной группой воды в растворе. Поэтому, в основном, AlO3 может принимать OH- из-за присутствия H+ и Al3+ из-за присутствия O2- Следовательно, он может действовать и как кислота, и как основание. Если раствор задан как щелочной, Al3+ реагирует с OH- (или с неподеленной парой, если мы придерживаемся концепции кислот и оснований Льюиса), действуя как кислотный оксид. Если раствор кислый, O2- будет реагировать с протонами в растворе, а также действовать как основной оксид. Следовательно, мы называем Al 2 O 3 амфотерный оксид. Несколько других примеров приведены как Fe 3 O 4 , Fe 2 O 3 , PbO, ZnO, CrO 3 , PbO 2 и т. д. но не все) амфотерные оксиды относятся к d-блоку периодической таблицы. Al2O3 — амфотерный оксид.
Если раствор кислый, O2- будет реагировать с протонами в растворе, а также действовать как основной оксид. Следовательно, мы называем Al 2 O 3 амфотерный оксид. Несколько других примеров приведены как Fe 3 O 4 , Fe 2 O 3 , PbO, ZnO, CrO 3 , PbO 2 и т. д. но не все) амфотерные оксиды относятся к d-блоку периодической таблицы. Al2O3 — амфотерный оксид.
Причина амфотерности алюминия
Алюминий имеет электроотрицательность 1,5. В точке, где оксиды амфотерных элементов начинают становиться кислыми. Оксиды элементов с электроотрицательностью до 1,5 легко отдают свой кислород в воде, чтобы захватить водород, содержащийся в воде, образуя гидроксид-ионы. Часто это связано с тем, что связь является ионной; таким образом, связь между кислородом и элементом легко рвется в воде. Однако, если он превышает 1,5, элемент будет сильно удерживать кислород и вместо этого будет образовывать кислоты, ковалентно связываясь с большим количеством кислорода с образованием кислотных анионов.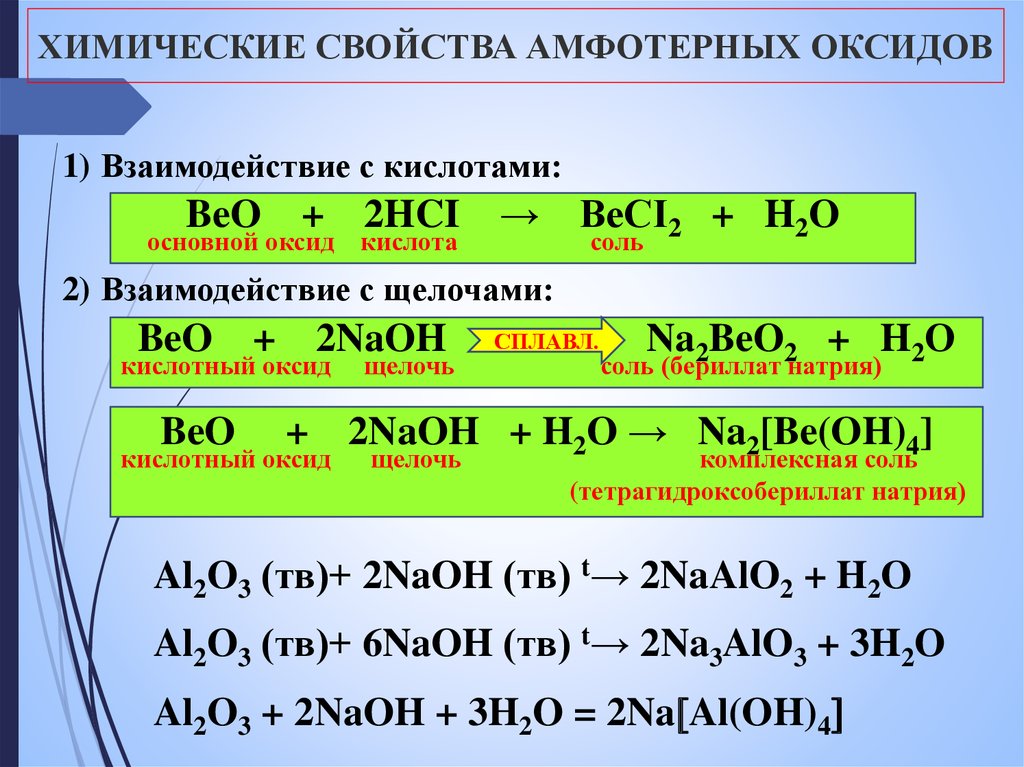
В атомах кислорода будет существовать отрицательный заряд. Al2O3, равный 1,5, с одинаковой вероятностью либо отдаст, либо захватит кислород из-за фактической ионно-ковалентной природы его связей. Принимая во внимание, что в кислых условиях протоны, присутствующие в растворе, будут протонировать кислород, образуя воду и соответствующую соль алюминия. Однако в определенных основных условиях гидроксид-ионы способствуют образованию большего количества гидроксид-ионов из атомов кислорода Al за счет образования воды и гидратированного алюминатного комплекса. Здесь реакция намного сложнее по сравнению с обычной кислотно-щелочной реакцией.
Являются ли оксиды металлов амфотерными?
Нет. Амфотеризм описывается как характерное выражение неметаллической природы металла, поскольку он относится к его способности каким-либо образом проявлять неметаллические свойства. Другими словами, чтобы объяснить амфотерность некоторых оксидов, вероятно, связана со способностью самого металла поляризовать оксидные ионы, с которыми он связан, так что в связь может быть введен значительный процент ковалентного характера. Вот почему типичными амфотерными оксидами металлов (как и гидроксидами) являются те, которые происходят из «пограничного» металла:
Вот почему типичными амфотерными оксидами металлов (как и гидроксидами) являются те, которые происходят из «пограничного» металла:
Al, — формы Al 2 O 3 и Al(OH) 3 ;
Zn, — формы ZnO и Zn(OH) 2 ;
Be, — формы BeO и Be(OH) 2 ;
Sn, — формы SnO и Sn(OH) 2 ;
Ga, — формы Ga 2 O 3 и Ga(OH) 3 .
Другими словами, оксиды металлов, таких как металлы 1 и 2 групп (за исключением Be), не проявляют амфотеризма. Кроме того, степень окисления также играет существенную роль: хотя четкой тенденции не существует, как правило, амфотерное поведение катиона металла увеличивается с увеличением степени окисления, что очень заметно, скажем, при переходе оксиды металлов. Чтобы сохранить это по-другому, подобно тому, как переходные металлы имеют катионы металлов с различным зарядом, а кислотность катиона увеличивается по мере увеличения его заряда, некоторые переходные металлы действительно образуют оксиды, которые могут быть кислотными, основными или амфотерными.
Некоторые распространенные применения солей амфотерных оксидов
Ниже приведены некоторые из наиболее распространенных применений солей амфотерных оксидов: Оксид цинка (ZnO) может использоваться в качестве добавки в ряде продуктов и материалов, включая пластмассы, каучуки. , стекло, керамика, смазочные материалы, цемент, мази, краски, герметики, клеи, пищевые продукты, пигменты, антипирены, батареи и ленты для оказания первой помощи — все это ферриты (соединения, содержащие Fe 2 O 3 ). Оксид алюминия (Al 2 O 3 ) также используется в производстве алюминия.
Кроме того, будучи достаточно химически белым и инертным, этот оксид является предпочтительным наполнителем для пластмасс. Это распространенный ингредиент солнцезащитного крема, а иногда он присутствует в косметических средствах, таких как губная помада, лак для ногтей и румяна. Иногда оксид алюминия используется в качестве ингредиента нескольких стеклообразователей. Его можно использовать в качестве катализатора дегидратации спирта до алкенов и процесса Клауса. Оксид алюминия называют амфотерным оксидом. Оксид свинца (PbO) широко используется в производстве стекла. В зависимости от типа стекла преимущество использования PbO в стекле может заключаться в снижении вязкости стекла, увеличении показателя преломления стекла, увеличении способности стекла и увеличении удельного электрического сопротивления стекла поглощать рентгеновские лучи. . Добавление PbO в промышленную керамику (и стекло) делает их электрически и магнитно инертными (повышает температуру Кюри) и обычно используется для этих целей.
Его можно использовать в качестве катализатора дегидратации спирта до алкенов и процесса Клауса. Оксид алюминия называют амфотерным оксидом. Оксид свинца (PbO) широко используется в производстве стекла. В зависимости от типа стекла преимущество использования PbO в стекле может заключаться в снижении вязкости стекла, увеличении показателя преломления стекла, увеличении способности стекла и увеличении удельного электрического сопротивления стекла поглощать рентгеновские лучи. . Добавление PbO в промышленную керамику (и стекло) делает их электрически и магнитно инертными (повышает температуру Кюри) и обычно используется для этих целей.
Амфотерные оксиды – синтез, свойства, идентификация
Термин «амфотерный» происходит от греческого слова amphoteroi (ἀμφότεροι) , что означает «оба». Амфотерные оксиды — это оксиды элементов (обычно металлов), проявляющие амфотерное поведение.
Амфотерность или амфотерность – это свойство соединения действовать и как кислота, и как основание . В зависимости от реагентов и других условий реакции соединение ведет себя либо как кислота, либо как основание.
В зависимости от реагентов и других условий реакции соединение ведет себя либо как кислота, либо как основание.
Пример амфотерных оксидов: Оксид алюминия Al 2 O 3 является амфотерным оксидом, поскольку он может нейтрализовать как HCl, так и NaOH.
Другими элементами, образующими амфотерные оксиды, являются галлий, индий, скандий, титан, цирконий, ванадий, хром, олово, железо, кобальт, медь, цинк, свинец, серебро, золото, германий, сурьма, висмут, бериллий и теллур.
Синтез
Так как амфотерные оксиды являются оксидами определенных элементов, то они являются прямым результатом сжигания этих элементов на воздухе. Например, оксид цинка(II) образуется в результате прямого сжигания Zn в большом количестве приточного воздуха:
2Zn(т) + O 2 (г) -> 2ZnO(т)
Аналогично,
4Al(т) + 3O 2 (г) -> 2Al 2 O 3 90s )
Оксид свинца (II) получают путем нагревания Нитрат свинца (II):
2Pb(NO 3 ) 2 -> \(\Delta\) 2PbO(s) + 4NO 2 0 + 3 O 9003 2 (g)
Оксид олова(II), также известный как Оксид олова , может быть получен путем нагревания оксида олова(II) в инертной среде. Оксид олова (II) образуется, когда соли олова реагируют со щелочью, такой как гидроксид натрия.
Оксид олова (II) образуется, когда соли олова реагируют со щелочью, такой как гидроксид натрия.
SNCL 2 +2NAOH -> SN (OH) 2 +2NACL
SN (OH) 2 -> \ (\ Delta \) SNO +H 2 O
АМФОТЕРИИ В ПЕРИОДИКИ Таблица
Оксиды в периодической таблице (Источник)
- В данный период периодической таблицы оксиды из основных в амфотерные и, наконец, в кислые. Например, рассмотрим 3 rd элементов периода: Na 2 O и MgO являются основными, Al 2 O 3 является амфотерным, SIO 2 является слабо кислым, стр. 2 O 5 , P 2 O 3 , SO 2 , SO 3 , CL 2 O и CL 2 O 7 являются кислыми.
- Вниз по группам основность увеличивается с увеличением атомного номера.
Рассмотрим оксиды группы 15:
NO 2 и P 2 O 3 являются кислотными, As 2 O 3 и Sb 2 O3 являются бифотиковыми0003 2
O 3 является основным.

- Кислотность также увеличивается с увеличением степени окисления одного и того же оксида элемента. Пример: серия кислотности для оксидов марганца составляет
мн. 2 O 7 > MN 2 O 3 > MNO
Аналогично, для арсеника и сурьмы,
AS 2 O 5 > AS 2 4 2 4 2 4 2 4 2 4 2 4 2 4 2 4 2 4 2 4 2 4 2 4 2 4 2 4 2 . O 3
и
Sb 2 O 5 > Sb 2 O 3
Физические свойства амфотерных оксидов
Амфотерные оксиды обычно имеют очень высокие температуры плавления и кипения. Они имеют гигантские ковалентные структуры, для разрыва которых требуется много энергии.
Амфотерные оксиды нерастворимы в воде.
Химические свойства амфотерных оксидов
Амфотерные оксиды реагируют как с кислотами, так и с основаниями.
Основная природа
Основная природа амфотерных оксидов выявляется их реакцией с кислотами. Амфотерные оксиды реагируют с обычными неорганическими кислотами с образованием соли металла и воды.
ZnO(т) + 2HNO 3 (водн.) -> Zn(NO 3 ) 2 (водн.) + H 2 O(л)
Al 2 O ) + 6HCl(водн.) -> 2AlCl 3 (водн.) + 3H 2 O(ж)
SnO(т) + 2HCl(водн.) -> SnCl 2 (водн.) + H 2 O (l)
PbO(s) + 2HNO 3 (водн.) -> Pb(NO 3 ) 2 (водн.) + H 2 O(l)
As
3 O 90
(с) + 6HCl (водн.) -> 2AsCl (водн.) + 3H 2 O(l)
Кислотная природа
Кислотная природа амфотерных оксидов выявляется их реакцией с основаниями. Амфотерные оксиды реагируют с обычными неорганическими основаниями с образованием сложных солей металлов и воды.
ZnO(s) + 2NaOH(aq) -> Na 2 ZnO 2 (aq) + H 2 O(l)
Обратите внимание, что Na 2 ZnO 2
4 2 смешивается с водой реальность.

Таким образом, более точное уравнение:
ZnO(s) + 2NaOH(aq) + H 2 O(l) -> Na 2 [Zn(OH) 4 ](водн.)
где Na 2 [Zn(OH) 4 ] представляет собой гидрат цинката натрия, а анион представляет собой [ Zn(OH) 4 ] +2 .
AL 2 O 3 (S) + 2NAOH (AQ) -> 2NAALO 2 (AQ) + H 2 O (L)
или
AL 2 O 3 ( s) + 2NaOH(водн.) + 3H 2 O(ж) -> 2Na[Al(OH) 4 ](водн.)
где Na[Al(OH) 4 ] представляет собой гидратированный алюминат натрия, а [Al(OH) 4 ] +1 представляет собой анион.
PbO(s) + 2NaOH(aq) + H 2 O(l) -> Na 2 [Pb(OH) 4 ](aq)
SnO(s) + 4NaOH(aq) + H 2 O(l) <=> Na 4 [Sn(OH) 6 ](водн.)
Идентификация амфотерных оксидов
база . Таким образом, чтобы определить, является ли соединение амфотерным, необходимо наблюдать за его реакцией с кислотой, такой как HCl, и реакцией с основанием, таким как NaOH.
Таким образом, чтобы определить, является ли соединение амфотерным, необходимо наблюдать за его реакцией с кислотой, такой как HCl, и реакцией с основанием, таким как NaOH.
После подтверждения того, что данное вещество является амфотерным, нам необходимо выяснить, является ли данное вещество оксидом или нет. Проводятся тесты на другие анионы, такие как сульфат, нитрат, нитрит, хлорид и т. д. Если все тесты показывают отрицательный результат, данное соединение является оксидом.
Использование и применение
Обычное применение некоторых амфотерных оксидов:
- Оксид свинца(II): Добавление PbO в стекло увеличивает его электрическое сопротивление, показатель преломления и способность поглощать рентгеновские лучи. В то же время он снижает вязкость стекла. Следовательно, PbO необходим для стекольной промышленности.
PbO также используется в керамической промышленности для изготовления керамических изделий, обладающих магнитной и электрической инертностью.
- Оксид цинка: Оксид цинка широко используется в цементной и косметической промышленности. Он также используется для изготовления сухих элементов и других типов постоянных элементов.
- Оксид алюминия: Руды оксида алюминия, такие как бокситы, присутствуют в земной коре. Сначала эти руды концентрируются с образованием чистого оксида алюминия. Этот оксид алюминия затем используется в процессе Холла-Эру для получения чистого металлического алюминия.
Часто задаваемые вопросы
Что такое амфотерные оксиды?
Амфотерные оксиды — это оксиды элементов (обычно металлов), проявляющие амфотерные свойства. Амфотеризм или амфотерное поведение — это свойство соединения действовать как кислота и как основание. В зависимости от реагентов и других условий реакции соединение ведет себя либо как кислота, либо как основание.
Как идентифицировать амфотерные оксиды?
Амфотерный оксид может нейтрализовать как кислоту, так и основание.


 Реагируют с избытком щелочи с образованием соли и воды. Типичные реакции кислотных оксидов:
Реагируют с избытком щелочи с образованием соли и воды. Типичные реакции кислотных оксидов: 

