Состав воды: контроль качества и допустимые нормы. Состав воды
|
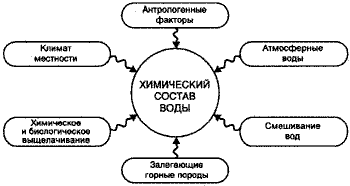
Вода, согласно ее формуле - h3O, должна состоять лишь из смеси двух газов – водорода и кислорода, однако это лишь не более чем лабораторный стандарт. На самом же деле она представляет собой смесь самых различных веществ, находящихся в самых разных физических и химических состояниях. Химический состав природной воды весьма и весьма разнообразен. Факторы, влияющие на формирование химического состава
Произведенный в лаборатории химический анализ воды позволяет определить состав всех примесей органического и минерального происхождения, которые находятся в жидкости в форме молекул, ионов, суспензий, коллоидов и эмульсий. На химический состав как поверхностных, так и подземных вод существенно оказывают влияние географическое расположение, геологическое строение и климатические условия местности, в которой они находятся. Кратко рассмотрим химический состав природной воды, представляющей собой довольно сложную дисперсионную систему, где вода – дисперсная среда, а органические, минеральные вещества, газы и живые микроорганизмы – дисперсная фаза. Около 90 - 95 процентов компонентов, содержащихся в растворенном виде в воде, составляют соли, которые существуют там в виде ионов. В природной воде всегда присутствует «набор» из трех анионов и четырех катионов (HCO3-, SO42 -, Cl-, Ca2+, Mg2+, Na+ , K+), которые принято называть главными ионами. Одни из них безвкусны, другие же придают жидкости горький и селеный вкус. Поступают они в воду, главным образом, из почвы, горных пород и минералов. Часть из этих ионов имеет происхождение от производственной деятельности человека. Содержатся эти макрокомпоненты в воде в самых различных концентрациях.
Природная вода, кроме главных ионов, содержит в своем составе еще и различные газы, разумеется, в растворенном виде. Одним из важнейших является кислород, который придает жидкости свежий вкус. Этого газа в воде может содержаться разное количество, все зависит от природных условий. Помимо кислорода, в воде содержатся такие газы, как азот и метан, не имеющие ни вкуса, ни запаха, а так же токсичный сероводород, который придает жидкости крайне неприятный запах. Концентрация этих газов в воде определяется главным образом ее температурой. Помимо этого, в воде содержатся биогенные вещества, которые составляют большую часть всех существующих живых организмов. К ним в основном относятся соединения фосфора и азота. Что касается азота, то он в природной воде может содержаться как в органической форме, так и неорганической. Концентрация биогенных веществ в такой жидкости может быть в самых различный пределах – от всего лишь следов до 10-ти миллиграммов на литр. Основные источники этих веществ – атмосферные осадки, поступления с поверхностными стоками, а так же сельскохозяйственными, промышленными и бытовыми сточными водами. Неотъемлемыми составляющими воды являются и микроэлементы, которых содержится в жидкости менее одного миллиграмма на литр. К ним относятся, практически, все известные металлы, за исключением железа и главных ионов и некоторые из неметаллов. Очень важными из них являются фтор и йод, обеспечивающие организму человека нормальное функционирование. Помимо прочего, в воде присутствуют и растворенные органические вещества. Это, по сути, органические формы упомянутых выше биогенных веществ. К ним относятся: углеводы, органические кислоты, фенолы, альдегиды, спирты, ароматические соединения, эфиры и так далее. В химический состав воды, помимо перечисленных, входят еще и токсичные соединения и вещества – нефтепродукты, тяжелые металлы, СПАВ, хлорорганические пестициды, фенолы и так далее. Природная вода ввиду присутствия в ней большого числа пузырьков газа и различных взвешенных частиц, считается негомогенной средой.
|
Новости Среда, 02 Май 2018 Среда, 02 Май 2018 Среда, 02 Май 2018 Среда, 02 Май 2018 Среда, 02 Май 2018
Технология не позволяет бурить скважины в мороз ниже -200
|
контроль качества и допустимые нормы
Вода - это самое распространенное на Земле неорганическое соединение, которое является основой атмосферных явлений, химических реакциях, физиологических процессов. Ее роль сложно переоценить, ведь существование жизни и окружающей нас природы было бы невозможно без ее участия.
Вода и ее роль в природе
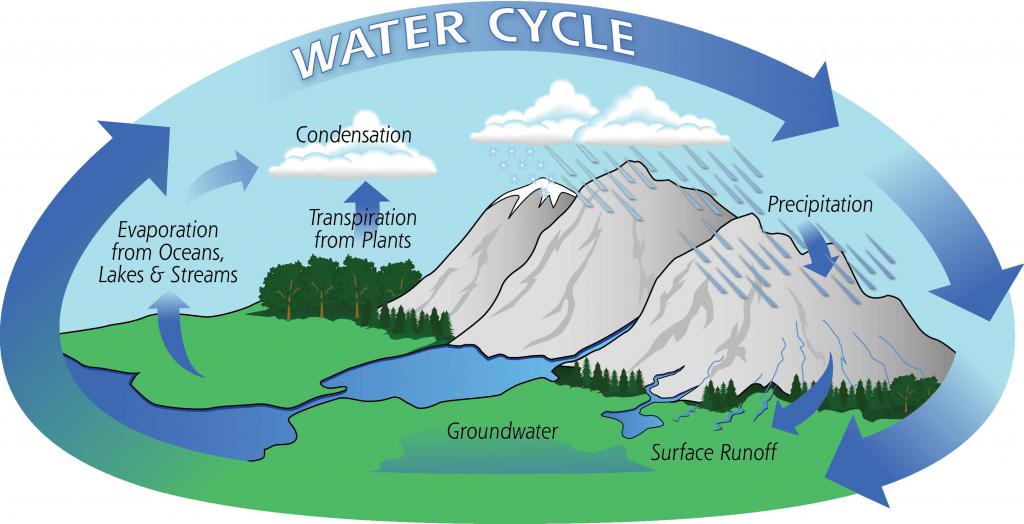
Круговорот воды в природе обеспечивает создание нормальных условий для жизнедеятельности всех живых организмов и растений. В процессе фотосинтеза при участии воды и света образуются органические вещества, необходимые для растений. Они дают пищу насекомым и травоядным животным, те в свою очередь являются едой для хищников. Вся пищеварительная цепь завязана на потреблении воды.
На климатическом уровне роль воды заключается в регулировании температуры и влажности в слоях атмосферы. Количество испаряемой влаги выпадает в виде осадков. Воздушные массы перемещаются и несут в виде облаков испаряемую с поверхности мирового океана влагу на материки. Крупные течения переносят теплый или холодный воздух, создавая такое разнообразие флоры и фауны на климатических поясах.
Для некоторых живых организмов вода является средой обитания. И даже зарождение и развитие эмбриона человека происходит в водной среде.
Структура и свойства воды
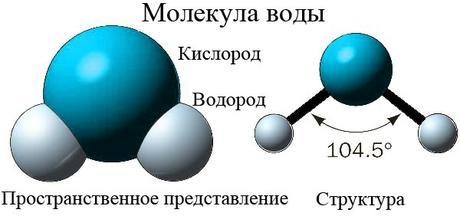
Молекула оксида водорода состоит из двух атомов водорода и одного атома кислорода. В природе может встречаться в трех агрегатных состояниях: жидком, твердом и газообразном. Агрегатное состояние зависит от внешних условий: температуры и давления. Температура замерзания воды - 0 градусов по шкале Цельсия, а температура кипения - 100 градусов Цельсия при давлении в 1 атм. Если давление ниже, тогда вода будет кипеть и при более низких температурах.
Оксид водорода - диполь, поэтому вода имеет высокий уровень теплопроводности и теплоемкости. Она быстро нагревается и долго остывает. А свойство поверхностного натяжения позволяет жидкости занимать форму в соответствии со степенью смачиваемости соприкасаемого с ней вещества. Именно свойство поверхностного натяжения позволяет некоторым видам насекомым скользить по поверхности воды.
Что входит в состав воды? Оксид водорода не имеет цвета и запаха, но в чистом виде вода не встречается, в ее составе длинный перечень органических соединений и химических элементов. По причине полярности своих молекул вода выступает в роли универсального растворителя. Скорость растворения может быть выше при повышении температуры. При увеличении давления раствор воды способен поглотить больше газа.
Роль воды в организме человека

Организм человека состоит из воды на 70-80%. Все ткани насыщены влагой, исключение могут составлять только ткани, из которых состоят волосы, ногти, кости. Вода в организме человека играет роль растворителя и транспорта для доставки питательных веществ к клеткам тканей и выводом продуктов распада. Без участия живительной влаги не происходит ни один процесс метаболизма.
Если человек заболел, врачи рекомендуют больше пить. При поступлении большого количества жидкости из организма быстрее выводятся токсины и элементы патогенной микрофлоры, это способствует быстрейшему выздоровлению. Ежедневное поступление чистой воды, рекомендованное диетологами, должно быть не меньше 1.5-2 литра. При понижении ее уровня в организме срабатывают безусловные рефлексы, которые мы ощущаем в виде жажды. Без постоянного пополнения организма жидкостью наступает смерть. Человек не сможет прожить больше 5-6 суток без воды. Ее поступление в чистом виде необходимо организму, а при недостатке влаги кожа становится сухой, волосы ломкими. Если человек употребляет в пищу некачественную воду в течение длительного времени, тогда могут возникнуть проблемы со здоровьем. Это отразится не только на внешнем виде, но и может стать причиной возникновения серьезных заболеваний.
Перепады температуры внешней среды организму помогает пережить функция терморегуляции, в которой тоже участвует вода. При повышении температуры окружающей среды начинается потоотделение, безусловный рефлекс теплоотдачи, позволяющий организму стабилизировать температуру тела.
Чистая вода для питья
Вода, которая соответствует допустимым требованиям стандартов качества, считается питьевой. Химический состав воды должен соответствовать нормам, установленным государственными стандартами качества. Для ежедневного употребления подойдет только чистый продукт. Вода не должна содержать взвешенные частицы посторонних элементов, а также организмы патогенной микрофлоры, которые могут быть возбудителями опасных для жизни заболеваний. В нашей стране за уровнем качества воды следит ТО ТУ "Роспотребнадзор".
Источником чистой воды может быть колодец или скважина. Вода из крана городской квартиры, как правило, для питья не годится. Чтобы очистить ее от примесей, нужно использовать фильтр. При исследование нового источника нужно проверять химический состав воды в обязательном порядке. Никогда не пейте из незнакомого колодца, это может иметь серьезные последствия.
Бутилированная вода

Из-за низкого качества водопроводной воды люди стали использовать для питья и приготовления пищи бутилированный вариант. Если разобраться, это питьевая вода, в которой не должны содержаться посторонние элементы, включая подсластители, ароматизаторы и красители. Если содержание этих веществ превышает 1%, тогда такое питье приобретает статус безалкогольного напитка.
Существует два вида бутилированной воды: минеральная и питьевая. Минеральная вода берется из официально зарегистрированной скважины и содержит в своем составе полезные соли и элементы. Такая вода готова к употреблению и не нуждается в дополнительной очистке. Пить минеральную воду в больших количествах не рекомендуется. Вода, которая создается искусственно, путем внесения солей и других элементов, не считается минеральной.
Покупайте питьевую и минеральную воду только у проверенных производителей, качество продукции которых соответствует государственным стандартам. Неизвестная марка в сочетании с низкой ценой должна насторожить покупателя, такую воду лучше не употреблять.
Жесткость воды
Этот показатель определяется количеством содержащихся в воде солей. Примеси могут быть в растворенном, а иногда и во взвешенном виде. Само понятие "жесткость воды" сформировалось из-за жесткости ткани, которую стирали в мыльной воде с высоким содержанием жирных кислот.
Если в растворе содержится большое количество различных солей, такую воду можно назвать жесткой. Именно такая вода оставляет накипь в чайнике и на нагревательном элементе стиральной машины. Жесткая вода плохо пенится и при умывании сушит и стягивает кожу. Волосы, помытые в такой воде, плохо расчесываются и становятся "непослушными". Длительное употреблении жесткой воды может спровоцировать образование почечных камней.
Слишком мягкая вода - это тоже плохо. Постоянное употребление такой воды может вызвать гипертензию, язву желудка или двенадцатиперстной кишки, кариеса и гастрита. Зато для бытовых целей мягкая вода очень удобна, если не считать ее способности к более интенсивному окислению металлических элементов. Допустимая жесткость воды - 2-10 мг-экв/л. Этот показатель является средней величиной жесткости. Чтобы проверить, к какой категории относится жидкость из вашего крана, можно провести опыты с мылом и обратить внимание на наличие накипи в чайнике.
Дистиллированная вода

В составе этой воды ничтожно маленькое содержание каких-либо примесей, что понижает ее электропроводность. В дикой природе такой жидкости не найти, а получают ее путем применения дистилляторов. Изменение состава воды происходит в несколько этапов: воду кипятят, выделяется пар - этот конденсат собирают в отдельную емкость. При необходимости процедура повторяется. В результате получается жидкость с минимальным содержанием посторонних веществ.
Области применения:
- медицина;
- промышленность;
- косметология;
- биохимия.
Дистиллированная вода заливается в автомобильные аккумуляторы, играя роль электролита, а также используется в охладительной системе. В области медицины такую воду применяют для создания растворов лекарственных препаратов. Такой вид жидкости не употребляется в пищу, в составе питьевой воды обязательно должны присутствовать соли и минералы.
Святая вода
Православная церковь празднует Крещение Господне 19 января. Считается, что в этот день вся вода наделяется целебными свойствами. Есть традиция, согласно которой в Крещение нужно окунаться в Иордань, там самым можно смыть все грехи и очиститься посредством святой воды. Вода освящается молитвами и, по мнению богослужителей, обладает исцеляющими свойствами.
Научные исследования, направленные на изучение свойств святой воды, проводятся и по сей день. Есть предположение, что 19 января происходит изменение в процессах, связанных с магнитным полем Земли, и по этой причине вся вода заряжается. Структура святой воды, в отличии от обычной, имеет группы молекул, собранные в одну группу - кластер. Это и делает священную воду такой полезной, по мнению народных целителей. На самом деле степень влияния святой воды на организм до конца не изучена, и наука не может объяснить, почему некоторые люди чудесным образом исцеляются от взаимодействия со святой водой.
В православной церкви святая вода используется в ритуалах крещения, освещения храмом и сосудов. Верующие люди используют святую воду в лечебных целях. Если вода замутнела, ее можно выливать только в то место, где не ходят люди или животные, а сосуд, в котором находилась святая вода, больше не использовать в бытовых целях.
Память воды
Структурные элементы воды кластеры могут запоминать и передавать информацию. По мнению ученого С. В. Зенина, вода может "помнить" структуру растворенного в ней вещества. Японский исследователь Масару Эмото провел ряд исследований. Он собрал образцы воды с разных уголков и мира и попеременно воздействовал на на них. Образцы воды, над которыми читались молитвы и пелись песни, выстраивали свою структуру определенным образом, неся позитивную информацию.
Данный феномен не имеет научного обоснования, и противники этих гипотез объясняют факт возникновения структуры воды тем, что звуковые колебания из внешней среды могут влиять на расположение молекул относительно друг друга. А длительное хранение святой воды объясняется отсутствием живых организмов в ледяной крещенской воде.
Анализ на примеси

Возникновение потребности выполнения химического анализа состава воды возникает при исследовании нового источника. Если бурилась новая скважина или копался колодец, перед употреблением воды обязательно нужно проверить ее безопасность. Достаточно взять образец воды и отнести его в СЭС, эта служба занимается проведением лабораторных исследований.
При определении состава воды проводятся исследования на наличие органических и химических составляющих. Выявляется уровень кислотности, наличие солей, определяется жесткость, а также уровень концентрации тяжелых металлов. Если скважина расположена на уровне 10-15 метров, тогда необходимо сделать расширенный анализ, который выявит еще более подробный состав воды. Близкое расположение скважины к поверхности земли увеличивает вероятность попадания в воду поверхностных и стоковых веществ, а также микроорганизмов, которые могут вызвать кишечные инфекции.
Установка очистных сооружений и выбор их типа должны опираться на результаты химического анализа воды. После установки фильтров для проверки уровня очистки необходимо сделать повторный анализ.
Очистка воды

Вода, которую мы используем для приготовления пищи и других ежедневных потребностей, перед поступлением в общий трубопровод, проходит тщательную обработку. На очистных сооружениях жидкость должна пройти несколько этапов очистки, и на момент поступления в водопровод качество воды должно соответствовать нормативным стандартам. Но это не значит, что она пригодна для питья и приготовления пищи. Все дело в том, что в период активной стройки 20 века трубопровод делали из стали, и со временем на трубах стали возникать коррозийные процессы. Вода, проходящая по ржавым трубам, насыщается коррозийными элементами, и становится непригодной для употребления в таком виде. Поэтому необходимо определение состава воды и оборудование квартирного варианта очистных устройств в виде фильтров.

Некоторые свойства воды, непригодной для питья, можно определить невооруженным глазом. Налейте жидкость в стакан и визуально изучите ее. Если вода из крана имеет непрозрачный вид и видимые примеси, тогда употреблять ее в пищу нельзя даже после фильтра. Нужно сдать образец на химическую экспертизу и понять причину такого загрязнения.
Заключение
Вода является незаменимой необходимостью для жизнедеятельности, поэтому нужно следить за ее качеством. Если хотите быть здоровыми, пейте чистую и полезную по составу воду.
fb.ru
Химический состав воды.
Любой, кто хочет преуспеть в таком великолепном хобби, как аквариумистика, а также быть успешным в выращивании и разведении тропических рыб, должен найти время, необходимое для освоения и понимания некоторых базовых химических свойств воды, предназначенной для аквариумных рыб. Понимание и применение знаний химии воды аквариума на практике поможет Вашим рыбкам не только выжить, но и процветать!
Я рекомендую Вам в обязательном порядке купить комплект для тестирования аквариумной воды или отдельные тестеры, продающиеся не в комплекте, а поштучно. Для стандартного тестирования аквариумной воды Вам понадобятся тестеры, проверяющие на:
- Аммиак
- Жесткость Воды
- Нитрит
- Нитрат
- Хлор / Хлорамин
- рН

Химический состав воды и что на него влияет.
Аэробные бактерии в аквариуме.Это бактерии, для жизни которых требуется кислород. Находясь в аквариуме, они вытягивают из воды кислород, необходимый для рыб и других обитателей.
Анаэробные бактерии в аквариуме.Это бактерии, которые могут жить без кислорода, или бактерии, которые не нуждаются в кислороде.
Аммиак в аквариуме.Аммиак – это химическое вещество, являющееся результатом жизнедеятельности рыб и разложения не съеденной ими пищи. Аммиак является основной причиной смерти тропических рыб. С помощью тестеров на присутствие аммиака необходимо обязательно проверять новые аквариумы, переживающие цикл нового аквариума, или переполненные обитателями аквариумы. В идеале, показатель аммиака должен быть 0 промилле. Не вредное количество аммиака в аквариуме – 0,01мг/л, а показатель 0,06-0,5мг/л – не просто недопустим, но и очень вреден (смертелен) для любой рыбы.
Жесткость воды в аквариуме.Уровень жесткости воды связан с количеством минералов, растворенных в воде. Кальций и магний – основные минералы, которые растворены в водопроводной воде. "Мягкая" вода имеет сравнительно мало растворенных минералов, в то время как в "жесткой" растворено много минеральных веществ. Жесткость воды не будет проблемой, если вода не слишком мягкая. В мягкой воде могут возникнуть проблемы с постоянными "прыжками" уровня рН, что особенно актуально для морских аквариумов. Измеряя карбонатную жесткость морской воды, Вы будете иметь хорошее представление о том, насколько устойчив уровень рН в Вашем аквариуме.
Медь в аквариуме.Этот тяжелый металл может попасть в аквариум вместе с водопроводной водой, особенно если в доме старые медные трубы. Также этот металл может быть введен в аквариум вместе с какими-либо лекарственными препаратами на основе меди. Медь достаточно вредна для рыб и беспозвоночных.
Нитраты в аквариуме.Во время циклического процесса в аквариуме нитриты преобразуются в нитраты. Нитраты не столь токсичны, чем аммиак или нитриты, но они все же вредны и при высокой концентрации способны убить рыбок. Единственный способ удаления нитратов из аквариума – частичные подмены воды. В идеале тест должен показывать концентрацию нитратов в воде пресноводных аквариумов – не выше 20 мг/л, а в морских аквариумах – еще ниже.
Нитриты в аквариуме.В аквариуме аммиак с помощью бактерий превращается в нитриты. Уровень нитритов обычно повышается в новых аквариумах, которые еще не прошли ряд химических и биологических преобразований. Нитриты так же токсичны для тропических рыб, как и аммиак. Единственный способ быстро уменьшить их уровень – подмена воды. Через определенное время в новом аквариуме с помощью размножающихся в фильтре полезных бактерий нитриты преобразовываются в нитраты. В идеале концентрация нитритов в аквариуме должна быть равна 0мг/л. Проверить их концентрацию можно с помощью тестового набора, купить который можно практически в любом зоомагазине.
Соленость воды в аквариуме.Соленость – это количество растворенных в воде солей, которые измеряются с помощью прибора – ареометра.
Удельный вес в соленом аквариуме.Для пресноводных тропических рыб удельный вес воды значения не имеет, но вот для морского аквариума – это важный фактор успеха. Удельный вес воды – это измерение в морской воде плотности количества растворенных солей по сравнению с пресной водой. Другими словами, по сравнению с пресноводной аквариумной водой, вода в морском аквариуме – намного более соленая и включает в себя множество различных элементов. Измеряемый удельный вес показывает, насколько соленая вода тяжелее или плотнее, чем пресная.
Фосфаты в аквариуме.Фосфаты попадают в аквариум в основном вместе с водопроводной водой, а также образовываются вследствие разложения отмерших растений и не съеденного корма для рыб. Высокий уровень фосфатов может привести к вспышкам водорослей. Чтобы сохранить свой морской либо пресноводный аквариум в норме, обязательно проводите периодические тестирования воды на уровень в ней фосфатов. В зоомагазинах можно купить специальные препараты, удаляющие фосфаты. Кроме этого, чтобы держать уровень фосфатов в норме, Вы должны следовать своему графику ухода за аквариумом и регулярно осуществлять подмены воды.
Хлорамин в аквариуме.Хлорамин представляет собой сочетание хлора и аммиака. Это вещество является более сильным дезинфицирующим средством, чем хлор. Используется хлорамин там, где необходима дополнительная дезинфекция, например, в водопроводной воде. Из этого следует, что аналогично хлору, хлорамин необходимо удалить из воды, прежде чем вливать ее в аквариум. Если этого не сделать, то рыбки могут погибнуть.
Хлор в аквариуме.Хлор – химикат, встречающийся в большей части водопроводной воды и используется для уничтожения вредных бактерий. Прежде чем вливать воду в аквариум, из нее необходимо удалить весь хлор, иначе он может убить Ваших тропических рыбок.
Цикл азота в аквариуме.Этот цикл обычно занимает от 2-8 недель и возникает абсолютно во всех новых аквариумах. Ускорить цикл азота в новом аквариуме можно, используя для этого фильтрующий материал либо грунт (обычно гравий) из старого бака. Но даже при этом длительность данного процесса может занять несколько недель. Цикл азота – цикл, при котором аммиак превращается в нитриты, а нитриты уже преобразовываются в нитраты. Более детально об этом процессе читайте на Доме Знаний в статье "Цикл азота в аквариуме".
Аммиак -> Нитрит -> Нитрат
рН в аквариуме.рН – показатель, используемый для измерения кислотности либо щелочности воды. Шкала pH варьирует от 0 до 14, где 0 – это самая кислая среда, 7 – нейтральная, а 14 – наиболее щелочная. Определять показания pH в аквариуме можно с помощь тестов, которые продаются в зоомагазинах. Кроме этого в таких магазинах можно купить и средства, понижающие либо повышающие уровень pH.
Интересное на Ютубе:
Похожие материалы:
Понравилась статья? Поделитесь ею с друзьями
Ошибка в тексте? Выделите ее и Нажмите:
Еще по теме:
Если статья Вам полезна,не стесняйтесь и оставляйте свои комментарии.Спасибо за посещение.
Добавить комментарий
domznaniy.info
Химический состав воды
Если капельку природной воды нанести на стекло и подождать, пока она испарится, то на месте капли будут видны белые разводы - это кристаллизуются растворимые в воде соли. Содержание солей в природных водах различается в тысячи раз. Например, в литре дождевой воды содержатся единицы, максимум десятки миллиграммов солей. А в литре воды из залива Кара-Богаз-Гол (Каспийское море) - 300 г, почти треть от массы раствора.
Основные (преобладающие) компоненты
В водных растворах подавляющее большинство солей существует в виде ионов. В природных водах преобладают три аниона (гидрокарбонат HCO3-,хлорид Cl-исульфат SO42-) и четыре катиона (кальций Ca2+,магний Mg2+,натрий Na+икалий K+) - их называют главными ионами. Хлорид-ионы придают воде солёный вкус, сульфат-ионы, ионы кальция и магния - горький, гидрокарбонат-ионы безвкусны. Они составляют в пресных водах свыше 90-95 %, а в высокоминерализованных - свыше 99 % всех растворенных веществ. Обычно нижним пределом концентрации для главных ионов считают 1 мг/л, поэтому в ряде случаев, например для морских и некоторых подземных вод, к главным компонентам можно отнести также Br-, B3+, Sr3+и др. Отнесение ионов K+к числу главных является спорным. В подземных и поверхностных водах эти ионы, как правило, занимают второстепенное положение. Только в атмосферных осадках ионы K+могут играть главную роль.
Однако ионная форма главных компонентов свойственна в полной мере лишь маломинерализованным водам. При увеличении концентрации между ионами усиливается взаимодействие, направленное на ассоциацию, т.е. процесс, обратный диссоциации. При этом образуются ассоциированные ионные пары, например MgHCO3+, CaHCO3+.
Под влиянием климатических и других условий химический состав природных вод изменяется и приобретает характерные черты, иногда специфические для различных видов природных вод (атмосферные осадки, реки, озера, подземные воды).

Атмосферные осадкииз всех природных вод наименее минерализованы, но по химическому составу растворенных в них веществ они не менее разнообразны, чем другие природные воды. Источником их состава являются аэрозоли атмосферы. Ионный состав их довольно разнообразен. При колебаниях средней многолетней минерализации атмосферных осадков в европейской части России в пределах 10-20 мг/л и экстремальных значениях для всей территории 3-4 и 50-60 мг/л ионный состав характеризуется пестротой, причем среди анионов большей частью преобладает SO42-или HCO3-, а среди катионов в зависимости от степени удаленности от побережья Ca2+или Na+. Непосредственно у побережья при ветре, дующем с моря, в результате ветрового механического выноса солей концентрация хлора в осадках бывает повышенной. По мере удаления от побережья относительная концентрация Cl-падает, а SO42-, Ca2+и Mg2+, наоборот, повышается. Причиной повышения содержания SO42-и Ca2+является обогащение атмосферы аэрозолями континентального происхождения. По мере продвижения в глубь континента часть морских аэрозолей вымывается. Наибольшие изменения испытывает концентрация SO42-. Если увеличение содержания Ca2+и Na+связано, скорее всего, с минеральной пылью почв и пород, на поверхности которых всегда присутствуют эти соли, то увеличение содержания SO42-обусловлено, с одной стороны, окислением SO2и h3S, с другой - поднятием сернокислых солей с засоленных поверхностей.
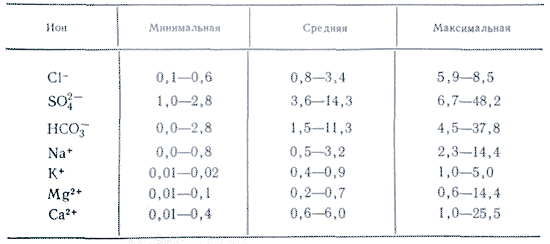
Не поддаются даже приблизительной оценке громадные количества солевых частиц, поднимаемых с почв, соленых озер, поверхности льда, удобрений и, наконец, выбрасываемых химическими и металлургическими производствами, и выбрасываемые в атмосферу в результате другой деятельность людей, а в дальнейшем вымываемые осадками.
Воды большинства рекпринадлежат к гидрокарбонатному классу. По составу катионов эта вода имеет почти исключительно преобладание кальция; гидрокарбонатные воды с преобладанием магния и натрия - крайне редкое явление. Из природных вод гидрокарбонатного класса наиболее распространены воды малой минерализации (суммарное содержание солей до 200 мг/л).
Реки с водой, относящейся к сульфатному классу, сравнительно малочисленны. Они распространены преимущественно в степной полосе и частично в полупустынях. В составе катионов природных вод сульфатного класса, так же как и в водах гидрокарбонатного класса, преобладает кальций. Однако ряд рек сульфатного класса имеет преобладание натрия. По минерализации воды сульфатного класса значительно превосходят воды гидрокарбонатного класса. Речные сульфатные воды с малой (общее количество солей до 200 мг/л) и средней (общее количество солей с 200 до 500 мг/л) минерализацией встречаются сравнительно редко. Наиболее характерна для этих рек повышенная (общее количество солей с 500 до 1000 мг/л), а иногда и высокая (общее количество солей более 1000 мг/л) минерализация воды.
Реки, воды которых относятся к хлоридному классу, встречаются почти так же редко, как и реки, в воде которых преобладают сульфаты. К этой территории относятся преимущественно степные районы и полупустыни. Преобладающими катионами природных вод хлоридного класса являются главным образом ионы натрия. Воды хлоридного класса отличаются высокой минерализацией - свыше 1000 мг/л, реже от 500 до 1000 мг/л.
Приведенная характеристика ионного состава речной воды относится к периоду летней межени. До некоторой степени она характеризует состав и в период ледостава. Существенно иная, значительно меньшая минерализация воды наблюдается в период весеннего половодья.
В распределении ионного состава речной воды на территории России наблюдается определенная закономерность. Имеется общая тенденция к увеличению минерализации воды на большей территории европейской части России с севера на юг и с запада на восток. Зональность ионного состава речных вод объясняется не только действием климатических условий настоящего времени, но и в значительной мере климатом прошлого. Степень выщелоченности почв и пород, наличие в них легкорастворимых солей или засоленность почв - это естественный результат многовекового воздействия соответствующих климатических условий. Нарушают зональность химического состава воды рек на территории России различия состава пород и условий их залегания.
Минерализация и химический состав воды озерв отличие от рек меняется в очень широких пределах. Реки с минерализацией воды свыше 100-200 мг/л, в каких бы условиях они ни находились, - очень редкое явление, в то время как минерализация воды озер бывает от очень низкой, в несколько десятков мг/л (т.е. мало отличающейся от дождевом) до очень высокой 3-3,5% (соляные озера с рассолом до предела насыщенного солями). Различие в минерализации отражается и на ионном составе воды озер. В нем наблюдаются закономерности, которые свойственны и химическому составу речной воды. С увеличением минерализации озерной воды происходит относительный рост ионов в ее составе в такой последовательности: HCO3-→SO42-→Cl-; Ca2+→Mg2+→Na+. При минерализации до 500-1000 мг/л в составе озерной воды преобладают гидрокарбонатные ионы, свыше 0,1% - чаще всего сульфатные, а по достижении 0,3-0,5% в зависимости от литологических особенностей водосборной площади - сульфатные или хлоридные воды. В составе катионов озерных вод преобладающая роль кальция сохраняется лишь до 0,1-0,2%. При дальнейшем росте минерализации эту роль начинают играть ионы натрия. Ионы магния, так же как и во всех других водах, сохраняют при всех минерализациях промежуточное положение. Причина подобного распределения ионного состава заключается в различной растворимости солей. Подавляющая часть пресных озер, так же как и рек, по составу вод гидрокарбонатно-кальциевые.
Состав морской водыхарактеризуется большим содержанием солей. Если в водах материкового стока чаще всего наблюдается соотношение концентраций: HCO3-> SO42-> Cl-и Ca2+> Mg2+> Na+или Ca2+> Na+> Mg2+, то для солоноватых и морских вод, начиная с общей минерализации 1 г/кг, соотношения меняются:: Cl-> SO42-> HCO3-и Na+> Mg2+> Ca2+. Изменение соотношений между нонами от речных к морским водам объясняется последовательным достижением предела растворимости слаборастворимых солей по мере повышения минерализации воды. В сумме ионы и соединения главных компонентов составляют по массе 99,99 % массы всех растворенных в океанской воде минеральных веществ.
Между элементами основного солевого состава океанской воды, между каждым из них и их суммой существует практическое постоянство соотношений концентраций. Окончательно его доказал У. Дитмар, выполнивший полный химический анализ (хлориды, сульфаты, кальций, магний, натрий) 77 проб воды, доставленных из всех океанов с различных глубин экспедицией на "Челленджере": в воде открытого океана независимо от абсолютной концентрации количественные соотношения между главными компонентами основного солевого состава всегда постоянны (закон Дитмара). Под влиянием испарения, атмосферных осадков, образования и таяния льдов изменяется лишь общее количество солей, содержащихся в морской воде, но их соотношения в пределах погрешностей определений практически не меняются. Таким образом, если известно точное отношение общего количества солей и концентраций всех основных компонентов в 1 кг воды к концентрации какого-либо одного ингредиента, то лишь по одному определению можно вычислить полный солевой состав океанской воды. В качестве такого "реперного" ингредиента избрана "хлорность", представляющая собой количество граммов ионов хлора, эквивалентное сумме галогенов (кроме фторидов, которые не осаждаются азотнокислым серебром), содержащихся в 1 кг морской воды (определение Серенсена). Постоянство состава океанской воды слегка нарушается под опресняющим влиянием материкового стока в приустьевых участках и во внутренних морях при затрудненном водообмене с океаном. В составе главных компонентов концентрации катионов кальция и магния, а также сумма концентраций анионов слабых кислот (HCO3-, CO32-, h3BO3-) подвержены более чем на 1 % отклонениям от постоянства соотношении в связи с извлечением карбоната кальция из воды в поверхностных слоях и растворением его на глубинах.
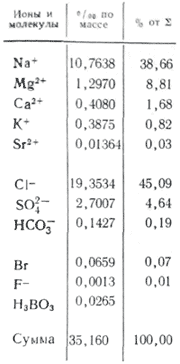
Концентрации микроэлементов настолько малы, что в сумме они не превышают 0,01 % массы всех растворенных солей. Из обобщающей сводки В.В. Гордеева и А.П. Лисицына следует, что в наибольших концентрациях встречаются литий (180 мкг/л), рубидий (120 мкг/л), барий (18 мкг/л), в наименьших - золото (0,004 мкг/л), редкоземельные элементы (менее 0,001 мкг/л), радий (10-7мкг/л).
Чем более изолированно море от океана, тем заметнее отличается состав его воды от состава воды в океане. Первостепенное значение имеют условия водообмена с океаном, соотношение объема материкового стока с объемом моря, глубина моря и характер химического состава вод впадающих рек.
Подземные водыотличаются исключительным разнообразием химического состава, в том числе и ионного. Состав воды бывает всех классов, групп и типов. Ионный состав подземных вод прежде всего зависит от условий их формирования и залегания.
Билет 3
studfiles.net
Химический состав воды | Supersadovod
 Химический состав воды может быть самым разным, так как зависит от содержания частиц неорганических и органических веществ. Протекая в различных слоях земли, вода растворяет соли (кальция, магния, железа и т.д.), насыщаясь ими.
Химический состав воды может быть самым разным, так как зависит от содержания частиц неорганических и органических веществ. Протекая в различных слоях земли, вода растворяет соли (кальция, магния, железа и т.д.), насыщаясь ими.
Располагаясь на поверхности земли, вода соприкасается с газами, растворяя их. Даже природные воды отличаются по химическому составу друг от друга, так как его формируют растворенные в воде газы, основные ионы, биогенные и органические вещества, микроэлементы.
Большое влияние на качество воды и ее химический состав оказывает почва ложа пруда. Вода вымывает из почвы минеральные и органические вещества, что особенно отчетливо наблюдается в первые годы эксплуатации пруда.
Газовый режим в естественных и искусственных водоемах формируется за счет газов, которые попадают в воду из атмосферы и в результате химических процессов. Количество растворенных газов зависит от температуры, давления и наличия в воде солей.
Некоторые газы, а это в первую очередь кислород и углекислый газ, просто необходимы для жизнедеятельности водных организмов. Чем их больше в воде, тем лучше для обитателей водоема. Наоборот, большое количество сероводорода, метана и азота угнетает жизнедеятельность живых существ.
Один из важнейших растворимых газов, постоянно присутствующих в поверхностных водах — это кислород. Его количество в значительной степени зависит от химико-биологического состояния водоема.
Главными источниками насыщения воды кислородом являются— атмосфера- под воздействием ветра воздух смешивается с поверхностными слоями воды;— фотосинтез микроскопических водорослей.
В условиях высокой температуры растворимость кислорода в воде уменьшается, а при низкой температуре увеличивается.
Насыщение воды кислородом в природных условиях обычно ниже 100%, потому что большое количество этого газа идет на окисление органических веществ. При массовом развитии водорослей (в солнечные дни) в некоторых водоемах насыщение кислородом может достигать 150-200%.
Углекислый газ (СО 2 ) в определенных количествах содержится почти во всех природных водах. При этом большая часть углекислого газа находится в растворенном состоянии, а незначительное количество (до 1 %) может взаимодействовать с водой и создавать угольную кислоту.
Содержание углекислоты в воде постоянно меняется. Днем зеленые растения усваивают углекислоту и с помощью солнечной энергии перерабатывают ее в органические вещества.
Ночью содержание СО 2 заметно увеличивается, что объясняется процессами дыхания водных организмов и окисления органических веществ. Чем интенсивнее происходят эти процессы, тем больше углекислоты присутствует в воде, особенно в тех водоемах, где много органических веществ и мало извести. Количество углекислоты в таких прудах может достигать 30-35 мг/л.
Повышение концентрации углекислоты выше оптимального уровня свидетельствует о загрязнении пруда органическими веществами. Особенно важно регулировать соотношение кислорода и углекислоты.
Дабы иметь представление о химическом составе воды и характере его изменения, время от времени следует производить лабораторные анализы. Основную информацию о качестве воды можно получить при помощи специального тестирующего прибора. представляющего собой прозрачный блок с двумя кюветами и цветовой шкалой.
Под действием тех или иных химикатов тестируемая вода приобретает определенный оттенок, который сравнивают с цветовым делением шкалы. Каждому цвету шкалы соответствует определенный уровень кислотности воды.
Кислотность воды (рН) характеризует активную реакцию среды. Чем ближе значение рН к нулю, тем выше концентрация водородных ионов в растворе, тем более кислой является среда.
Оптимальный показатель кислотности воды для человека находится в довольно узком диапазоне 7,2-7,4, максимум 7,6. При таком уровне рН вода не оказывает вредного воздействия на кожный покров человека и препятствует размножению микроорганизмов.
Если показатель рН выше 7,8, то такая вода раздражает кожу (особенно чувствительную) и в воде обильно размножаются микроорганизмы. Кроме того, высокий уровень рН повышает коррозийную активность воды, что в значительной степени сказывается на работоспособности оборудования и коммуникаций.
Наибольшие показатели рН воды (8-8,8) наблюдаются во второй половине вегетационного периода, когда биомасса водорослей достигает наибольшего развития, а процессы фотосинтеза происходят с максимальной интенсивностью.
Вследствие химических реакций, происходящих в воде. уровень рН постоянно меняется, причем не только на протяжении года, но и в течение отдельно взятых суток.
На уровень рН большое влияние оказывает жесткость воды. Так, в мягкой воде уровень рН меньше 7 ,0, а в жесткой может достигать 9,0.
Жесткость воды обусловлена содержанием в ней в основном Са СО2 (извести). которая при температурных изменениях выпадает в осадок на стенках бассейна, фильтрах, теплообменниках и прочем оборудовании.
В соответствии со стандартами жесткость воды не должна превышать 30°dH, где 1 °dН = 10 мг СаО/л. Жесткость воды может меняться в зависимости от времени года. Зимой и в дождливые периоды она несколько снижается.
Окисленность воды свидетельствует о содержании в ней растворимых органических и минеральных веществ.
Величина окисленности показывает, сколько затрачивается кислорода на разрушение органических веществ (мг/л). На протяжении всего вегетационного сезона окисленность воды меняется от 10 до 30 мг 1л и более.
Твитнуть Нравитсяsupersadovod.ru