Большая Энциклопедия Нефти и Газа. Синтез воды
Синтез - вода - Большая Энциклопедия Нефти и Газа, статья, страница 2
Синтез - вода
Cтраница 2
В 1785 г. Лавуазье и Менье в результате опытов по разложению и синтезу воды установили, что 2 г водорода соединяются с 16 г кислорода. Образование воды из двух объемов водорода и одного объема кислорода было доказано в 1805 г. Гумбольдтом и Гей-Люссаком. [16]
Металлы, теоретически предсказанные для этих реакций, сравнивали с уже применяемыми для синтеза воды из водорода и кислорода, а также с металлами, легко образующими восстанавливаемые окислы. В табл. 1 приводится краткое сравнение теоретических и экспериментальных данных. [17]
Эндоэффект образования HCN и разрушения СН4 и Nh4 перекрывается большой энергией, выделяемой при синтезе воды. Катализатором этого процесса служит металлическая платина. [19]
Используйте данные по теплоемкости из табл. 4.3, чтобы опретелпть ЛСт ( 372 К) для синтеза воды, приняв ЛС П ( 298 К) - 237 191 кДж / моль и Д / / ( 298 К) - 241 82 кДж / моль. [20]
В табл. 3 в качестве примеров металлов, катализирующих последовательные элементарные реакции, проходящие по одному из трех указанных механизмов, приведены металлы, ускоряющие синтез воды, в чистом виде, в соединениях или в виде легко восстанавливающихся окисей. Совпадение эксперимента и теории распространяется во многих случаях и на степени окисления, предсказываемые для этих металлов. Трехстадийные реакции катализируются Mn3, Mn4, Mn8, Ru, Ru2, Ru3, Pd и Pt. [21]
Возобновив изучение оксигидрогеннои реакции у адаптированных водорослей, Гаффрон [13] подтвердил, что в отсутствие двуокиси углерода отношение ДН2 / А02 часто значительно ниже теоретической цифры 2 для синтеза воды. [22]
Цикл Свойства веществ в свете атомно-молекулярной теории включает передачи: Химия вокруг нас, Свойства жидкого кислорода, Свойства водорода, Свойства воды, М. В. Ломоносов - основоположник атомно-молекулярной теории, Анализ и синтез воды, Очистка воды. В этих передачах актуализированы понятия о многообразии свойств веществ ( молекулярного и немолекулярного строения), зависимости их свойств от состава и строения. Рассматриваются свойства и получение в лаборатории впервые изучаемых учащимися простых веществ - кислорода и водорода. [23]
К числу факторов, от которых существенно зависят технико-экономические показатели производства карбамида по схемам с жидкостным рециклом, относится концентрация СО2 в рециркулируемом РУАС: чем выше концентрация СО2, тем меньше рецикл в колонну синтеза воды. [24]
Скорость большинства химических реакций с нагреванием возрастает. Так, синтез воды из простых веществ при 20 С осуществить практически невозможно, настолько мала скорость реакции при этой температуре. [25]
Водород не соединяется при обыкновенной температуре с кислородом, но при накаливании такое соединение происходит [118], сопровождаясь отделением большого количества теплоты. Это есть синтез воды; а мы видели ранее ее анализ, ее разложение на составные части. Синтез воды весьма легко видеть, если над горящим пламенем водорода поставить холодный стеклянный колокол или, что еще лучше, если пламя водорода зажечь в трубке холодильника. [26]
Скорость большинства химических реакций с нагреванием возрастает. Так, синтез воды из простых веществ при 20 С осуществить практически невозможно, настолько мала скорость реакции при этой температуре. [27]
Скорость большинства химических реакций с повышением температуры увеличивается. Например, осуществить синтез воды из кислорода и водорода при 20 С даже на 15 % практически невозможно ( на это понадобилось бы 54 миллиарда лет), а при 500 С для этого нужно всего 50 мин, при 700 С реакция между водородом и кислородом протекает мгновенно. [28]
При рассмотрении действия кислорода на металлы Лавуазье вводит название окиси вместо металлических земель. Затем описываются водород, анализ и синтез воды, соединения горючих веществ между собой и так называемые сдлеродные основания. Заключение этой части посвящено металлам. [29]
В химической промышленности металлический палладий в виде пластинок, листов, в губчатом, порошкообразном и коллоидном состояниях применяется как катализатор многочисленных химических реакций. В качестве примеров таких реакций можно назвать синтез воды из элементов, окисление Nh4 до окислов азота, окисление углеводородов кислородом, гидрирование жиров. Катализаторами могут служить различные соли палладия и паллади-рованный асбест, который получают прокаливанием асбеста, пропитанного раствором хлорида палладия ( П) и небольшим количеством спирта. [30]
Страницы: 1 2 3
www.ngpedia.ru
Синтез - вода - Большая Энциклопедия Нефти и Газа, статья, страница 3
Синтез - вода
Cтраница 3
При горении водорода из водорода и кислорода образуется вода. Поэтому данный процесс представляет собой синтез, а именно синтез воды, а не аналитический процесс. [31]
В 1773 г. Лавуазье, повторив опыты Бойля и Ломоносова с обжиганием металлов - свинца, олова, ртути, пришел к тем же выводам, что и Ломоносов. Эти выводы позднее, в 1785 г., он подтвердил опытами по анализу и синтезу воды. [32]
Недостатками описанной схемы являются сравнительно низкая ( 62 - 65 %) степень конверсии карбамата аммония в карбамид, сложность системы регенерации и возврата непрореагировавших компонентов, невозможность рационального использования теплоты синтеза. Поэтому все более широкое распространение получают усовершенствованные процессы ( их называют стрип-пинг-процессы), основанные на отгонке и конденсации большей части непрореагировавших Nh4 и СО2 при давлении синтеза, что позволяет упростить схему, уменьшить количество возвращаемой в узел синтеза воды, утилизировать теплоту конденсации. Дистилляция в таких процессах осуществляется при противоточной обработке плава диоксидом углерода или аммиаком - это обеспечивает возможность дистилляции плава при относительно низкой температуре и предотвращает гидролиз карбамида. [34]
В данной работе было проведено детальное изучение адсорбции на ZnO. Результаты, полученные при изучении этой системы, показали целесообразность расширения кинетического изучения, распространив его на различные окислы п - и / j - типа и на изоляторы в температурном интервале, в котором эти окислы становятся активными катализаторами синтеза воды. [35]
Водород не соединяется при обыкновенной температуре с кислородом, но при накаливании такое соединение происходит [118], сопровождаясь отделением большого количества теплоты. Это есть синтез воды; а мы видели ранее ее анализ, ее разложение на составные части. Синтез воды весьма легко видеть, если над горящим пламенем водорода поставить холодный стеклянный колокол или, что еще лучше, если пламя водорода зажечь в трубке холодильника. [36]
Термодинамические расчеты указывают только на возможность самопроизвольного протекания реакции при данных условиях. Но под действием сопротивления внешней среды, например из-за кинетического сопротивления, реакция может находиться в квазиравновесном состоянии. Так, синтез воды из водорода и кислорода не идет при обычных условиях, хотя и является возможным на основании термодинамических расчетов. Такой синтез возможен с участием катализаторов. [37]
Лавуазье вводит название окиси вместо металлических земель. Затем разбирает анализ и синтез воды, а также описывает свойства водорода и солеродных оснований. В заключение автор останавливается на свойствах металлов. [38]
В школьном учебнике химии эта реакция названа цепной. В настоящее время установлено, что многие химические реакции протекают по цепному мехаиизму. Например, хорошо знакомый вам синтез воды из водорода и кислорода - цепная реакция. [39]
Выше было показано ( см. опыт на стр. Такое же отношение объемов наблюдается и при синтезе воды из водорода и кислорода. Образовавшаяся вода занимает в парообразном состоянии 2 объема. При термическом разложении аммиака из 2 объемов аммиака образуются 1 объем азота и 3 объема водорода. При синтезе хлористого водорода из водорода и хлора используют по 1 объему каждого из этих газов; в результате получается 2 объема хлористого водорода. [40]
Как известно из результатов, полученных для угольного электрода [28-30], адсорбция кислорода может протекать на поверхности электрода в двух формах: без разрыва связи О-О и с ее разрывом. В этих условиях тот или иной путь реакции восстановления кислорода в конечном итоге зависит от соотношения констант скорости процессов диссоциации молекулярного кислорода на атомы и его электрохимического восстановления. Если скорость диссоциации значительно превышает скорость восстановления, то синтез воды осуществляется без образования перекиси водород а, в противном случае оказывается справедливым последовательный механизм реакции. Изменение условий эксперимента, вообще говоря, неодинаково сказывается на величинах констант скорости различных стадий процесса и, следовательно, может привести к смене его механизма. [41]
Часто для установления состава сложного вещества можно пользоваться и реакциями соединения. Например, если при соединении серы и железа образовалось только сернистое железо и ничего больше, то из этого можно сделать заключение, что в состав указанного сложного вещества входят только элементы сера и железо. Метод синтеза и метод анализа, по существу, противоположны друг другу. Для более точного установления состава сложных веществ обычно пользуются обоими этими методами одновременно: методом синтеза проверяют данные анализа, и наоборот. Чтобы окончательно удостовериться, что вода состоит только из элементов водорода и кислорода, производят синтез воды. Для этого водород и кислород соединяют химически и убеждаются в том, получается ли при этой реакции вода или какое-нибудь другое вещество. Так как в указанном случае ничего, кроме воды, не получается, то элементарный состав воды считается окончательно установленным. Химия, в которой анализ является преобладающей формой исследования, ничего не стоит без его противоположности - синтеза ( Энгельс. [42]
Страницы: 1 2 3
www.ngpedia.ru
Вода. Строение молекулы воды. Анализ и синтез воды
Урок №
Класс:
ТЕМА. Вода, строение молекулы. Методы определения состава воды – анализ и синтез. Вода в природе и способы ее очистки
Тип урока: комбинированный урок.
Цель урока: сформировать представление о строении молекулы воды, об анализе и синтезе на примере изучения состава воды.
Задачи:
1. Предметные. Знать качественный и количественный состав воды. Уметь объяснять понятия «анализ» и «синтез». Знать способы очистки воды.
2. Метапредметные. Развивать умения устанавливать аналогии, причинно-следственные связи, строить умозаключение и делать выводы, владеть устной речью, формулировать, аргументировать и отстаивать свое мнение.
3. Личностные. Формировать и развивать экологическое мышление и основы экологической культуры, мировоззрение, соответствующее современному уровню развития науки.
Межпредметные связи: биология, география.
Ресурсы урока (оборудование): ноутбук, проектор.
Ход урока
I. Организация класса
1. Приветствие учащихся.
2. Определение отсутствующих.
3. Проверка готовности учащихся к уроку.
II. Проверка домашнего задания
Письменный опрос
III. Актуализация опорных знаний
Перед вами 3 стакана с водой. Подумайте, почему они здесь?
IV. Организация познавательной деятельности
Вода занимает 2/3 поверхности земного шара, и лишь 1/3 приходится на сушу. Вода в океанах, морях, реках, озёрах, под землёй и в почве. Ледники и айсберги - тоже вода, но замёрзшая. Много воды в атмосфере: это облака, туман, пар, дождь, снег. Поэтому с высоты космического пространства наша планета имеет голубой оттенок. Мы не удивляемся обилию воды. На земле она окружает нас всюду. Вода - самое обыденное и в то же время самое удивительное вещество на нашей планете. Она обладает рядом необычных свойств.
1. Строение молекулы воды
Молекула воды представляет собой маленький диполь, содержащий положительный и отрицательный заряды на полюсах. Так как масса и заряд ядра кислорода больше чем у ядер водорода, то электронное облако стягивается в сторону кислородного ядра. При этом ядра водорода оголяются. Таким образом, электронное облако имеет неоднородную плотность. Около ядер водорода имеется недостаток электронной плотности, а на противоположной стороне молекулы, около ядра кислорода, наблюдается избыток электронной плотности. Именно такая структура и определяет полярность молекулы воды. Если соединить прямыми линиями эпицентры положительных и отрицательных зарядов получится объемная геометрическая фигура - правильный тетраэдр.
2. Тяжелая вода
Тяжёлая вода (оксид дейтерия) — имеет ту же химическую формулу, что и обычная вода, но вместо атомов водорода содержит два тяжёлых изотопа водорода — атомы дейтерия. Формула тяжёловодородной воды обычно записывается как: D2О или 2h3О. Внешне тяжёлая вода выглядит как обычная — бесцветная жидкость без вкуса и запаха.
По своим свойствам тяжелая вода заметно отличается от обычной воды. Реакции с тяжелой водой протекают медленнее, чем с обычной, константы диссоциации молекулы тяжёлой воды меньше таковых для обычной воды.
3. Методы определения состава воды: анализ и синтез.
Получение сложных веществ из более простых называют синтезом (от греч. "синдезис" соединение).
В химии для определения состава веществ и вывода их химических формул пользуются как анализом, так и синтезом. Результаты одного метода проверяются другим.
Вода в природе и способы ее очистки. Вода - самое распространенное на земле вещество. Ею заполнены океаны, моря, озера и реки; пары воды входят в состав воздуха. Вода содержится в организмах животных и растений. Так, например, в организме млекопитающих массовая доля воды составляет примерно 70%, а в огурцах и арбузах ее около 90%.
4. Способы очистки воды (слайд 7)
VI. Рефлексия
Как я усвоил сегодняшний материал:
1. Мусорная корзина
2. Чемодан
3. Мясорубка
VII. Домашнее задание
§31
Просмотр содержимого документа «Вода. Строение молекулы воды. Анализ и синтез воды »

Вода. Строение молекулы воды. Анализ и синтез воды.

Общая характеристика
Химическая формула: H 2 O
Относительная молекулярная масса:
M r ( H 2 O) = 18
Максимальная плотность: 1 г/мг
(при t = 4 0 C)

Строение молекулы

Тяжелая вода
D 2 O – оксид дейтерия
Впервые обнаружена в 1932 г. Гарольдом Юри.
В природных водах соотношение между тяжелой и обычной водой составляет
1:5500

Методы определения состава воды
Анализ – (от греч. - разложение) метод определения состава веществ путем их разложения на более простые.

Методы определения состава воды
Синтез – (от греч. - соединение)
получение сложных веществ из более простых.
Синтез воды
можно осуществить
в эвдиометре

Способы очистки воды
- Пропускание через слой песка или угля;
- Обработка хлором, озоном или ультрафиолетовыми лучами;
- Перегонка, или дистилляция;

Как я усвоил сегодняшний материал
Мусорная корзина – сегодняшний материал я скоро забуду, в жизни он мне не пригодится
Чемодан – материал я хорошо запомнил, буду его применять на практике
Мясорубка – материал я запомнил, но нужно его обдумать, усвоить

Домашнее задание
§31

kopilkaurokov.ru
способ получения воды - патент РФ 2119445
Способ предназначен для получения воды. Воду получают путем смешивания метана и диоксида углерода и последующего синтеза воды из компонентов смеси. Синтез проводят при плазменном состоянии газообразных веществ. Способ позволяет повысить производительность. 2 з.п.ф-лы, 1 табл., 1 ил. Изобретение относится к электротехнике и неорганической химии и может быть использовано для получения воды из газообразных веществ посредством синтеза, преимущественно при промышленном производстве воды в районах с ограниченными водными ресурсами. Известен способ получения воды с использованием электрохимического генератора, включающий подачу газообразных водорода и кислорода в ячейки генератора, подключение генератора к электрической нагрузке, выделение воды в одной группе ячеек с последующей фильтрацией (Лидоренко Н.С., Мучник Г.Ф. Электрохимические генераторы.- М.: Энергоиздат, 1982, с.8 - 10), Недостатком известного способа является высокая стоимость получаемого продукта - чистой воды, поскольку для ее приготовления приходится использовать особо чистые газообразные водород и кислород, изготовление которых сопряжено с весьма высокими затратами. Кроме того, для повышения эффективности синтеза в электрохимическом генераторе приходится использовать дорогостоящие катализаторы, например платину. Известен способ получения воды посредством смешивания газообразных водорода и кислорода и последующего синтеза компонентов смеси (Некрасов Б.В. Основы общей химии.- М.: Химия, 1965, т. 1, с. 118). В известном способе водородно-кислородную смесь подвергают каталитическому воздействию при повышенных температурах, при этом в качестве катализатора используют платину. Недостатком известного способа является высокая стоимость получаемой воды, т. к. изготовление компонентов газообразной смеси сопряжено с высокими затратами. Кроме того, известный способ является взрывоопасным. Наиболее близким по технической сущности к заявленному является способ получения воды путем смешивания газообразных веществ, содержащих водород и кислород и последующего синтеза воды из компонентов смеси (международная заявка PCT (WO) N 94/07795, кл. C 01 B 5/00, опубл. 1994). В известном способе синтез газообразных компонентов, в качестве которых используются водород и кислород, проводят в трубчатом реакторе, изготовленном из каталитически активного материала при воздействии высоких температур. Кроме того, в качестве одного из компонентов газообразной смеси используется нейтральный газ, например аргон, что позволяет снизить взрывоопасность известного способа. Недостатками известного способа являются низкая производительность процесса получения воды и высокая стоимость получаемого продукта, вследствие того, что изготовление исходных компонентов газообразной смеси сопряжено с проведением ряда сложных дорогостоящих операций. Поэтому известный способ не может найти широкого промышленного применения, например в районах с ограниченными водными ресурсами. Технический результат настоящего изобретения заключается в снижении стоимости и повышении производительности способа получения воды посредством синтеза газообразных веществ. Для достижения указанного технического результата в способе получения воды путем смешивания газообразных веществ, содержащих водород и кислород и последующего синтеза воды из компонентов смеси, синтез проводят при плазменном состоянии газообразных веществ, причем в качестве компонентов смеси используют метан и диоксид углерода; при этом смешивают метан и диоксид углерода при избыточном объемном содержании метана или при равенстве объемов или избыточном объемном содержании диоксида углерода. Предлагаемый способ синтеза воды из смеси компонентов газообразных веществ основан на закономерностях окислительно-восстановительных реакций, использующих характерные и уникальные особенности углерода - его возможность проявлять максимальную отрицательную (-4) и максимальную положительную (+4) окислительность. Так, максимальную отрицательную окислительность углерод проявляет только в метане Ch5, а максимальную положительную активность - только в диоксиде углерода CO2. Однако при смешивании метана и диоксида углерода в обычных условиях взаимодействия между ними не происходит. Проведенные эксперименты позволили установить, что если смесь газообразных метана и диоксида углерода подвергнуть полной ионизации, т.е. образовать плазму, то метан и диоксид углерода вступают во взаимодействие, характерными продуктами которого являются вода, углеводороды предельные и непредельные и углерод. При этом метан в состоянии плазмы проявляет восстановительные свойства, а диоксид углерода - отрицательные и поэтому, находясь в плазменном состоянии и стремясь к энергетическому равновесию, они вступают во взаимосвязь. Вследствие того что максимальную электроотрицательность в данной плазменной системе имеет кислород, то к его электронному облаку смещаются атомы водорода, и так как относительная разность значений электроотрицательностей между ними максимальна, то образуется вода как энергетически устойчивое вещество. Второй энергетической ступенью рассматриваемого взаимодействия с образованием устойчивых веществ, учитывая плазменный характер взаимодействия, является образование в качестве побочных продуктов углеводородов предельных и непредельных, для чего соединение метана и диоксида углерода осуществляют при избытке объемного (молярного) содержания метана, а получение в качестве побочного продукта углерода осуществляют при равенстве их объемов или при избытке объемного содержания диоксида углерода. Реакции, имеющие место при осуществлении заявленного способа, могут быть представлены следующими уравнениями: 1) реакции, проходящие при условии (V - объем газа):
(V - объем газа): 2) выход продуктов - вода и предельные (парафиновые) углеводороды:
2) выход продуктов - вода и предельные (парафиновые) углеводороды: где n - количественный показатель, равный 0, 1, 2, 3; выход продуктов - вода и непредельные (нафтиновые) углеводороды; 3) реакции, проходящие при условии
где n - количественный показатель, равный 0, 1, 2, 3; выход продуктов - вода и непредельные (нафтиновые) углеводороды; 3) реакции, проходящие при условии 
 где n - количественный показатель, равный 1, 2, 3; выход продуктов - вода и углерод. На чертеже приведена схема устройства, которое может быть использовано при осуществлении предлагаемого способа. Устройство содержит плазмотрон 1, реактор плазмохимический 2, камеру закалочную 3, выход которой соединен с резервуаром утилизирующим 4, холодильник 5, подключенный к камере абсорбционной 6, накопители 7, 8, в которые поступают продукты синтеза, дроссель регулирующий 9, редуктор баллонный 10, баллоны 11, 12 с исходными газообразными веществами, редуктор баллонный 13, дроссель регулирующий 14, камеру смешивания 15, компрессоры 16, 17, резервуар газовый 18 и манометр 19, при этом выход резервуара утилизирующего 4 дополнительно соединен с камерой закалочной 3, а один из выходов камеры абсорбционной 6 через резервуар газовый 18 и компрессор 17 присоединен к камере смешивания 15. Предлагаемый способ осуществляют следующим образом. Из баллонов 11, 12 исходные газообразные реагенты - диоксид углерода (CO2) и метан (Ch5) пропускают через регулирующую аппаратуру-редукторы 10, 13 и дроссели 9, 14 и подают в камеру смешивания 15, в которой образуется смесь указанных газообразных компонентов. Затем с помощью компрессора 16 полученную газообразную смесь подают в плазмотрон 1 струйного плазмохимического реактора 2 под давлением 105 - 106 Па, при этом ведут контроль рабочего давления с помощью манометра 19. В плазмотроне 1 смесь ионизируется, т.е. обретает плазменное состояние и поступает в реакционный объем плазмохимического реактора 2, где с помощью камеры закалочной 3 происходит химическое взаимодействие диоксида углерода и метана. Происходящие при этом реакции могут быть представлены следующими уравнениями: 1) при избытке метана и n = 0 реагирование компонентов происходит в соответствии с уравнением (1), т.е.
где n - количественный показатель, равный 1, 2, 3; выход продуктов - вода и углерод. На чертеже приведена схема устройства, которое может быть использовано при осуществлении предлагаемого способа. Устройство содержит плазмотрон 1, реактор плазмохимический 2, камеру закалочную 3, выход которой соединен с резервуаром утилизирующим 4, холодильник 5, подключенный к камере абсорбционной 6, накопители 7, 8, в которые поступают продукты синтеза, дроссель регулирующий 9, редуктор баллонный 10, баллоны 11, 12 с исходными газообразными веществами, редуктор баллонный 13, дроссель регулирующий 14, камеру смешивания 15, компрессоры 16, 17, резервуар газовый 18 и манометр 19, при этом выход резервуара утилизирующего 4 дополнительно соединен с камерой закалочной 3, а один из выходов камеры абсорбционной 6 через резервуар газовый 18 и компрессор 17 присоединен к камере смешивания 15. Предлагаемый способ осуществляют следующим образом. Из баллонов 11, 12 исходные газообразные реагенты - диоксид углерода (CO2) и метан (Ch5) пропускают через регулирующую аппаратуру-редукторы 10, 13 и дроссели 9, 14 и подают в камеру смешивания 15, в которой образуется смесь указанных газообразных компонентов. Затем с помощью компрессора 16 полученную газообразную смесь подают в плазмотрон 1 струйного плазмохимического реактора 2 под давлением 105 - 106 Па, при этом ведут контроль рабочего давления с помощью манометра 19. В плазмотроне 1 смесь ионизируется, т.е. обретает плазменное состояние и поступает в реакционный объем плазмохимического реактора 2, где с помощью камеры закалочной 3 происходит химическое взаимодействие диоксида углерода и метана. Происходящие при этом реакции могут быть представлены следующими уравнениями: 1) при избытке метана и n = 0 реагирование компонентов происходит в соответствии с уравнением (1), т.е.  выход продуктов - вода и насыщенные углеводороды; 2) при избытке метана и n = 1 реагирование компонентов происходит в соответствии с уравнением (2), т.е.
выход продуктов - вода и насыщенные углеводороды; 2) при избытке метана и n = 1 реагирование компонентов происходит в соответствии с уравнением (2), т.е.  выход продуктов - вода и ненасыщенные углеводороды; 3) при равных объемах метана и диоксида углерода или при избытке объемного содержания диоксида углерода реагирование компонентов происходит в соответствии с уравнением (3), например, при равных объемах:
выход продуктов - вода и ненасыщенные углеводороды; 3) при равных объемах метана и диоксида углерода или при избытке объемного содержания диоксида углерода реагирование компонентов происходит в соответствии с уравнением (3), например, при равных объемах: выход продуктов - вода и углерод. Дозирование реагентов Ch5 и CO2, при котором устанавливается избыток метана или диоксида углерода в процессе синтеза, обеспечивают при помощи дросселей с регуляторами давления 9,14. Из камеры закалочной 3 полученную продуктивную смесь подают в резервуар утилизирующий 4, где ее охлаждают до температуры 200-300oC, и затем основную часть продуктивной смеси подают в холодильник 5, а остаток - возвращают в камеру закалочную 3 для поддержания закалочных процессов на уровне, обеспечивающем наиболее благоприятные условия синтеза. После охлаждения из холодильника 5 продуктивную смесь направляют в камеру абсорбционную 6, где происходит фазовое разделение продуктов синтеза. Воду и углеводороды предельные и непредельные подают в накопители 7, 8, а углерод, накапливающийся в абсорбционной камере 6 периодически извлекают из нее. Непрореагировавшую часть газовой смеси метана и диоксида углерода направляют в резервуар газовый 18, из которого с помощью компрессора 17 ее возвращают в камеру смешивания 15 на повторной замкнутый плазмохимический цикл. С использованием опытного образца рассмотренного устройства были проведены эксперименты по синтезу воды из газообразных метана и диоксида углерода в соответствии с заявленным способом. Результаты опытов представлены в таблице. Предложенный способ получения воды посредством синтеза газообразных веществ, в качестве которых используют метан и диоксид углерода, обеспечивает снижение стоимости вследствие доступности и дешевизны исходных компонентов и высокой производительности операций способа. Использование предложенного высокоэффективного способа обеспечивает возможность синтезирования воды в промышленных условиях, что особенно важно для районов с ограниченными водными ресурсами. Кроме того, предложенный способ позволяет получать углеводороды предельные и непредельные и углерод с минимальными энергетическими затратами, поскольку они производятся в качестве побочных продуктов в процессе получения воды.
выход продуктов - вода и углерод. Дозирование реагентов Ch5 и CO2, при котором устанавливается избыток метана или диоксида углерода в процессе синтеза, обеспечивают при помощи дросселей с регуляторами давления 9,14. Из камеры закалочной 3 полученную продуктивную смесь подают в резервуар утилизирующий 4, где ее охлаждают до температуры 200-300oC, и затем основную часть продуктивной смеси подают в холодильник 5, а остаток - возвращают в камеру закалочную 3 для поддержания закалочных процессов на уровне, обеспечивающем наиболее благоприятные условия синтеза. После охлаждения из холодильника 5 продуктивную смесь направляют в камеру абсорбционную 6, где происходит фазовое разделение продуктов синтеза. Воду и углеводороды предельные и непредельные подают в накопители 7, 8, а углерод, накапливающийся в абсорбционной камере 6 периодически извлекают из нее. Непрореагировавшую часть газовой смеси метана и диоксида углерода направляют в резервуар газовый 18, из которого с помощью компрессора 17 ее возвращают в камеру смешивания 15 на повторной замкнутый плазмохимический цикл. С использованием опытного образца рассмотренного устройства были проведены эксперименты по синтезу воды из газообразных метана и диоксида углерода в соответствии с заявленным способом. Результаты опытов представлены в таблице. Предложенный способ получения воды посредством синтеза газообразных веществ, в качестве которых используют метан и диоксид углерода, обеспечивает снижение стоимости вследствие доступности и дешевизны исходных компонентов и высокой производительности операций способа. Использование предложенного высокоэффективного способа обеспечивает возможность синтезирования воды в промышленных условиях, что особенно важно для районов с ограниченными водными ресурсами. Кроме того, предложенный способ позволяет получать углеводороды предельные и непредельные и углерод с минимальными энергетическими затратами, поскольку они производятся в качестве побочных продуктов в процессе получения воды. ФОРМУЛА ИЗОБРЕТЕНИЯ
1. Способ получения воды путем смешивания газообразных веществ, содержащих водород и кислород, и последующего синтеза воды из компонентов смеси, отличающийся тем, что проводят синтез при плазменном состоянии газообразных веществ, при этом в качестве компонентов смеси используют метан и диоксид углерода. 2. Способ по п.1, отличающийся тем, что смешивают метан и диоксид углерода при избыточном объемном содержании метана. 3. Способ по п.1, отличающийся тем, что смешивают метан и диоксид углерода при равенстве их объемов или при избыточном объемном содержании диоксида углерода.www.freepatent.ru
Холодный синтез при плазменном электролизе воды
Введение
Холодный ядерный синтез — первая гипотеза об источнике дополнительной энергии при обычном электролизе тяжелой воды. Автора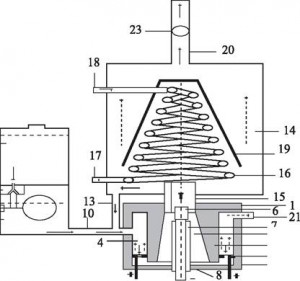 ми этой гипотезы являются американские электрохимики Флешман и Понс [1]. Они объявили об этом в 1989 году. С тех пор в разных странах проведено большое количество экспериментов по получению дополнительной энергии из воды [2], [3], [7], [8], [9], [10], [11], [12]. Мы продолжаем обсуждать эту проблему.
ми этой гипотезы являются американские электрохимики Флешман и Понс [1]. Они объявили об этом в 1989 году. С тех пор в разных странах проведено большое количество экспериментов по получению дополнительной энергии из воды [2], [3], [7], [8], [9], [10], [11], [12]. Мы продолжаем обсуждать эту проблему.
Рис. 1.
Схема плазмоэлектролитического генератора смеси газов: 1-крышка реактора; 3-корпус реактора; 6-катод; 9-анод; 11-дозатор раствора; -охладитель; 20-патрубок для выхода газов, 23-анемометр [6], [12].
Экспериментальная часть I
Для проверки этой гипотезы были проведены следующие эксперименты. Изготовлены два катода массой 18,10 г и 18,15 г из железа. Первый катод проработал 10 часов в растворе KOH, а второй проработал такое же время в растворе NaOH. Масса первого катода не изменилась, а второго уменьшилась на 0,02 грамма. Плазмоэлектролитический реактор работал при напряжении 220 Вольт и силе тока (0,5-1,0) Ампера (Рис. 1). При этом показатели расхода раствора и генерируемых газов оказались такими (Табл. 1).
Таблица 1 Результаты эксперимента
| Показатели | Расход воды, кг | Объём газов, м3 | Затраты энергии, кВт’ч/м3 |
| KOH | 0,272 | 8,75 | 0,28 |
| NaOH | 0,445 | 12,66 | 0,21 |
Известно, что из одного литра воды можно получить 1220л водорода и 620 л кислорода. Как видно (Табл. 1), количество газов, генерируемых плазмоэлектролитическим процессом, значительно больше, чем можно получить их из расходуемой воды [6]. Это дает основание считать, что источником этих газов являются не только молекулы воды, но и ядра щелочных металлов, а также ядра атомов материала катода. Для проверки этого факта и был проведен анализируемый эксперимент.
Известный японский ученый (соавтор этой статьи) Тадахико Мизуно, работающий в исследовательской лаборатории ядерных материалов, Университет Хоккайдо, Япония, любезно согласился провести химический анализ образцов катодов методом ядерной спектроскопии (EDX). Вот результаты его анализа. Содержание химических элементов на поверхности неработавшего катода оказалось следующим: (Табл. 2).
Таблица 2
Химический состав поверхности катода до работы в растворе
| Элемент | Fe |
| % | 99,90 |
На рабочей поверхности катода, работавшего в растворе KOH, появились новые химические элементы (Табл. 3).
Таблица 3
Химический состав поверхности катода, работавшего в растворе KOH
| Элемент | Si | K | Cr | Fe | Cu |
| % | 0,94 | 4,50 | 1,90 | 92,00 | 0,45 |
Химический состав поверхности катода, работавшего в растворе NaOH, оказался другим (Табл. 4).
Таблица 4 Химический состав поверхности катода, работавшего в растворе NaOH
| Элем. | Al | Si | Cl | K | Ca | Cr | Fe | Cu | |
| % | 1,10 | 0,55 | 0,20 | 0,60 | 0,40 | 1,60 | 94,00 | 0,65 |
Теоретическая часть
Многочисленные научные эксперименты показали, что при плазменном электролизе воды устойчиво генерируется до 50% дополнительной тепловой энергии. Это в свою очередь, имеет значительно меньшие результаты расчетов, следующих из уже существующих на сегодняшний день теорий холодного ядерного синтеза. Именно поэтому сегодня появилась необходимость проведения анализа энергетики процесса зарождения частиц при трансмутации ядер атомов [6].
Рассматривая модель электрона, нами было установлено, что он может существовать в свободном состоянии только при условии строго определенной для него электромагнитной массе [6]. Когда он соединяется с ядром атома, то часть его энергии излучается в виде фотонов, и за счет этого, его электромагнитная масса уменьшается. Однако, стабильность его состояния, тем не менее, при этом не ухудшается, оставаясь неизменной, так как энергия, унесенная фотоном, компенсируется энергией связи электрона с атомным ядром [6].
Когда температура окружающей среды повышается, то электрон начинает поглощать тепловые фотоны, переходя таким образом, на более высокие энергетические уровни атома, а связь с атомным ядром тем временем уменьшается. Когда электрон становится свободным, то в связь с атомом вступает только тогда, когда температура окружающей среды вновь понижается. Чем ниже становится температура, тем больше излучается электроном фотонов, а сам он опускается на более низкие энергетические уровни [6].
При условии, что электрон оказывается свободным в результате случайного внешнего воздействия на атом, а в окружающей среде он не находит необходимых ему фотонов для восстановления своей массы, то он немедленно начинает поглощать эфир из окружающей среды и восстанавливать, таким образом, свои константы: массу, заряд, магнитный момент, спин и радиус вращения. Устойчивое свободное состояние электрон может приобрести только в том случае, если восстановлены все его константы. [6].
Таким образом, получается, что, если между свободным состоянием электрона и состоянием его связи с атомным ядром будет происходить периодическая смена в результате случайных воздействий на атом, то электрон каждый раз будет восстанавливать свою электромагнитную массу за счет поглощения эфира из окружающей среды. То есть фактически он выполняет роль преобразователя энергии эфира в энергию тепловых фотонов.
Японские ученые-исследователи Охмори и Мизуно [4] зафиксировав нейтронное излучение при плазменном электролизе воды, сообщили миру о том, что источником этого излучения может быть не только атомно-ядерный процесс, но и процесс захвата электронов свободными протонами. Поскольку при плазмоэлектролитическом процессе водного электролиза генерируется водородная плазма, в которой могут существовать в свободном состоянии и протоны, то имеется вероятность процесса захвата этими частицами свободных электронов.
Известно, что масса покоя электрона me = 9,109534 10—31 кг , масса покоя протона mp = 1,6726485 -10—27 кг , а масса покоя нейтрона mn = 1,6749543 10—27кг . Разность между массой нейтрона и протона оказывается равной Amnp = 23,058 -10—31 кг . Это составляет 23,058 10-31 /9,109 10—31 = 2,531 масс электрона. Таким образом, чтобы протон стал нейтроном, он должен захватить 2,531 электрона. Поскольку поглощается только целое число электронов, то возникает вопрос: куда девается остаток массы (3,0 — 2,531)me = 0,469meэлектрона? Современная физика нарушенный баланс масс в этом процессе объясняет просто: рождением нейтрино. Поскольку нейтрино не имеет заряда, то зарегистрировать его очень трудно. Если нейтрино уносит лишнюю массу или приносит недостающую, то не могут ли этот процесс выполнить сами элементарные частицы?
Поскольку фотоны могут излучать и поглощать только электроны, то протон, поглощающий электроны, не способен превращать остаток массы третьего электрона в фотон. Если электрон поглощается третьим и более половины своей массы отдает протону, для того, чтобы тот смог превратиться в нейтрон, то оставшаяся часть его массы, которая не имеет возможности стать фотоном, превращается в порцию эфира, которая «растворяется» и смешивается с эфиром окружающей среды. Доказательства этого процесса ученые уже предоставили: это отсутствие в составе плазмы фотона с массой, соответствующей той части массы третьего электрона, которую не поглотил протон при превращении в нейтрон. Рассчитать энергию такого фотона очень просто.
Для этого необходимо знать разность между массой нейтрона и протона, которая равняется Δmnp = 23,058 -10 31 кг . Если вычесть эту величину из массы трех электронов, то получим массу mF , из которой должен сформироваться фотон mF = 3me —Δmnp = 3 — 9,109534 -10—31 — 23,05810 —31 кг.
Если из этого остатка массы сформируется фотон, то его энергия будет равна
Eph= Amnp ■ C2 = 23,058-10-31 • (2,998-108)2 / 1,602 -10-19 = 1,294 • 10б eV (3)
Эта величина энергии соответствует рентгеновскому спектру, поэтому рождение каждого свободного нейтрона должно сопровождаться рождением одного рентгеновского фотона. Если происходит по-другому, то остается только два выхода: 1 — считать, что при рождении нейтрона, в рассматриваемом случае, из массы образовалось нейтрино и испарились безвозвратно; 2 — в рассматриваемом процессе отсутствовали условия для формирования фотонов и масса, не оформившись ни в какую частицу, «растворилась» в эфире. Какой вариант ближе к истине, ответить довольно сложно. Точного ответа на сегодняшний день еще нет, но известно, что японские исследователи зафиксировали при плазменном электролизе воды только нейтронное излучение с интенсивностью порядка 50000 нейтронов в секунду и не зафиксировали рентгеновское излучение. [4].
Если бы при этом процессе рождались рентгеновские фотоны, то это бы не повышало бы тепловую эффективность течения плазмоэлектролитического процесса, так как это не тепловые фотоны, которые излучаются и поглощаются при энергетических переходах электронов на самых удаленных от ядер атомов энергетических уровнях, где генерируются инфракрасные и близкие к ним из оптической области спектра фотоны с энергиями (0,001-3,3)eV (Табл. 5).
Таблица 5
| Диапазоны шкалы электромагнитных излучений | ||
| Диапазоны | Длина волны, м | Энергия, eV |
| 1. Низкочастотный | X» 107…104 | E »10-15…10-11 |
| 2. Радио | X» 104 10-1 | E »10-11…10-б |
| 3. Микооволновый | X» 10-1 10-4 | E »10-б…10-3 |
| 4. Реликтовый (макс) | X» 110-3 | E »1,2 -10-3 |
| 5. Инфракрасный | X» 10-4…7,7-10-7 | E »10-3…1,б 10-2 |
| 6. Световой | X» 7,7 10-7…3,8-10-7 | E »1,6 -10-2…3,27 |
| 7. Ультрафиолетовый | X» 3,8• 10-7…10-9 | E » 3,27… 1 • 102 |
| 8. Рентгеновский | X» 10-9. 10-12 | E »102…105 |
| 9. Гамма диапазон | X» 10-12…10-18 | E » 105…109 |
Из этого получается, что процессы синтеза нейтронов при плазменном электролизе воды не будут генерировать дополнительную тепловую энергию. Однако появление нейтронов в плазме будет способствовать тому, что в ней будут образовываться ядра дейтерия и, возможно, трития. Поскольку при этих процессах баланс масс почти не изменяется, то оснований ждать в итоге появления дополнительной энергии при формировании ядер дейтерия и трития нет. Однако она обязательно появляется при синтезе атомов дейтерия и трития, то есть атомов водорода.
Чтобы стать протоном, нейтрон должен излучить нечто с массой Δmnp 23,058 • 10-31кг. Переведем эту массу в энергию.
Eph= Δmnp ■ C2 = 23,058-10-31 • (2,998-108)2 / 1,602 *10-19 = 1,294 • 10б eV (3)
Эта энергия соответствует фотонам гамма диапазона, которые не относятся к тепловым фотонам, и поэтому этот процесс не дает дополнительной энергии. Таким образом, если при плазменном электролизе воды идет процесс рождения атомов гелия, то он должен сопровождаться гамма излучением. Если этого излучения нет, а атомы гелия все-таки образуются, то указанную порцию массы Δmnp уносит нейтрино или же эта масса, не имея возможности оформиться в фотон, «растворяется» в окружающем среде, переходя в эфирное состояние [6]. Поскольку рентгеновские фотоны и гамма фотоны не являются тепловыми, то процессы рождения нейтронов и протонов не дают в этом случае избыточной тепловой энергии.
Возможен и другой вариант прохождения этого процесса. Атомы щелочного металла, атакуя атомы катода, сами полностью разрушаются и разрушают следом атомы материала катода. Под понятием «полностью» при этом следует понимать такое состояние, когда разрушаются и атом, и его ядро. Тогда протоны, освободившиеся из разрушившихся ядер, начинают формировать атомы водорода. И тогда процесс синтеза атомов и молекул водорода генерируют дополнительную тепловую энергию [6].
Если провести предварительный анализ полученных данных (Табл. 2, 3, 4) с учетом моделей ядер атомов [6], то можно будет увидеть следующие результаты. Во-первых, железо является материалом катода, таким образом, ядра его атомов – это мишени ядер атомов щелочного металла калия (Табл. 3). Когда происходит трансмутация ядер железа (Рис. 2b), то образуются ядра атомов хрома (Рис. 2a) и ядра атомов меди (Рис. 2с) [6].
Посчитать, что при разрушении одного ядра атома калия и рождении одного ядра атома кремния образуется 5 свободных протонов и 6 свободных нейтронов, то есть 11 нуклонов, совсем не трудно.
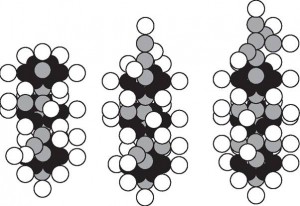
a) Cr (24,28) b) Fe (26,28) c) Cu (29,34)
Рис. 2
При превращении ядра атома железа (Рис. 2b) в ядро атома хрома (Рис. 2а) освобождается два протона и два нейтрона, из которых может образоваться или два атома дейтерия, или один атом гелия. Если же нейтроны превратятся в протоны, то образуется четыре атома водорода.
Нетрудно видеть (Рис. 2), что ядро атома железа (Рис. 2b) должно потерять два верхних протона и два нейтрона для превращения в ядро атома хрома (рис. 2a).
Для образования ядра атома меди (Рис. 2с) из ядра атома железа требуется дополнительно 3 протона и 6 нейтронов, всего 9 нуклонов. Так как на поверхности катода (Табл. 3) атомов хрома, которые, как мы предполагаем, образовались из ядер атомов железа, почти в четыре раза больше, чем атомов меди, то в растворе, несомненно, присутствуют лишние протоны и нейтроны разрушенных ядер атомов железа, и мы можем определить их примерное относительное количество.
Допустим, четыре ядра атомов железа становятся ядрами атома хрома. Тогда общее количество свободных протонов и нейтронов (нуклонов) оказывается равным 16. Поскольку на каждые четыре атома хрома приходится один атом меди, то на формирование одного ядра атома меди расходуется 9 нуклонов, и 7 нуклонов остаются свободными.
Посмотрим, что образуется при разрушении ядра атома калия. Калий расположен в первой группе четвертого периода Периодической таблицы химических элементов. Его ядро содержит 19 протонов и 20 нейтронов (Рис. 3а) [6].
На рис. 3а видно слабое звено ядра атома калия [6]. Оно расположено в середине его осевых нейтронов. При трансмутации ядер атомов калия могут образоваться ядра атомов кислорода (Рис. 3b) и его изотопов, а также ядра атомов кремния (Рис. 3с).
Анализ структуры ядра атома калия (Рис. 3а) показывает, что оно является наиболее вероятным источником ядра атома кремния (Рис. 3b), атомы которого появляются на катоде (Табл. 3).
Нетрудно посчитать, что при разрушении одного ядра атома калия и рождении одного ядра атома кремния образуется 5 свободных протонов и 6 свободных нейтронов, то есть 11 нуклонов.
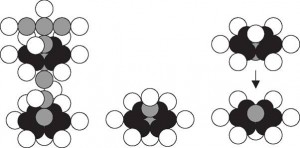
a) K (19,20) b) O (8,8) c) Si (14,14)
Рис. 3.
Схемы ядер атомов: а) калия, b) кислорода, с) кремния
Таким образом, трансмутация ядер атомов железа и атомов калия приводит к образованию свободных протонов и нейтронов. Однако протоны не могут существовать в свободном состоянии, поэтому из них рождаются атомы водорода. Если же положительно заряженные частицы соединяются с нейтронами, после тог, как ядра атомов железа и калия будут разрушены, то возможно образование дейтерия, трития и гелия.
Стоит обратить внимание на тот факт, что в материале катода отсутствуют атомы натрия. На катоде, работавшем в растворе KOH (Табл. 3), появились атомы калия, что вполне естественно. Но вопрос — почему атомы натрия отсутствуют на катоде, работавшем в растворе NaOH, остался. На сегодняшний день ответ только один: ядра атомов натрия полностью разрушаются при плазмоэлектролитическом процессе. При этом наличие калия на поверхности катода, работавшего в растворе NaOH, (Табл.4) можно объяснить также и нетщательной промывкой реактора после работы с раствором KOH.
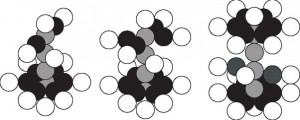
a) Na (11,12) b) Al (13,14) c) Cl (17,18)
Рис. 4
Схемы ядер атомов: а) натрия, b) алюминия, с) хлора
Поскольку при разрушении ядра атома натрия появляются свободные протоны и нейтроны, то некоторые ядра этого элемента начинают достраиваться до ядер атомов алюминия (Рис. 4b), хлора (Рис. 4с) и кальция (Рис. 5). Если знать общее количество трансмутирующих ядер атомов железа, калия и натрия, и точный состав генерируемых газов при плазмоэлектролитическом процессе, то можно было бы определить ядра атомов, формирующихся из дополнительных нуклонов. Сейчас можно только предполагать, что протоны составляют большую часть новых ядер, то есть ядра атомов водорода. Этим и объясняется увеличенный объем газов, генерируемых при плазмоэлектролитическом процессе
Ca (20,20) Рис. 5.
Схема ядра атома кальция
То, что атомы натрия отсутствуют на поверхности (Табл. 4), означает, что ядра этого элемента, несомненно, разрушаются при плазмоэлектролитическом процессе. Поскольку относительное количество образующихся при этом атомов алюминия, хлора и кальция, оседающих на катоде, невелико, то раствор NaOH, генерирует больше газов, чем раствор KaOH (Табл. 1)
Проводя анализ приведенных выше таблиц, можно сказать, что трансмутация ядер железа, из которого изготовлены катоды, приводит в обоих случаях к тому, что образовываются атомы хрома и меди. Из разрушенных ядер натрия, как видно, образуется алюминий, хлор и кальций. У всех этих процессов есть одно общее свойство – это формирование свободных протонов и нейтронов.
Но, стоит заметить, что не все свободные протоны и нейтроны расходуются на формирование новых ядер атомов алюминия, хлора и кальция. Часть этих частиц идет на формирование атомов водорода. Таким образом, в каждом случае, происходит синтез атомов и молекул водорода. Проведенный анализ показал, что плазмоэлектролитический процесс извлекает из одного литра раствора не более 0,005 кг щелочного металла. То есть, можно сделать вывод о том, что если все нейтроны ядер атомов молекул воды и щелочных металлов перевести в протоны и образовать атомы и молекулы водорода, то образующийся объём газа будет значительно меньше зафиксированного в эксперименте (Табл. 1). Возник вопрос: откуда берутся дополнительные газы? Для поиска ответа на этот вопрос был поставлен другой эксперимент.
Экспериментальная часть II
Высокая температура плазмы формирует условия, при которых у катода идет комплекс различных процессов. Прежде всего, вода нагревается до кипения и испаряется. Одновременно часть молекул воды разрушается с выделением атомарного водорода, другая часть молекул воды формирует молекулы ортоводорода. Часть молекул воды разрушается полностью, и у катода выделяется вместе с водородом и кислород. Часть водорода вновь соединяется с кислородом, генерируя микровзрывы (шум) и образуя воду.
При плазменном электролизе воды выделяются водяной пар, водород и кислород одновременно. Если пар конденсировать, то выделится смесь газов. Для измерения скорости потока газов применялся как обычный, так и электронный анемометры. Диаметр электронного анемометра был равен внутреннему диаметру трубки для выхода газов (23, Рис. 1). Его показания регистрировались и обрабатывались компьютером. Эксперимент повторялся десятки раз, и каждый раз его показатели воспроизводились с небольшими отклонениями [11]. Однако мы не имели анализатора водорода, поэтому, полученные результаты не могли признать окончательными. Об этом мы предупреждали во всех изданиях книги «Вода — новый источник энергии» такой записью: «Мы пока воздержимся придать этим результатам официальный статус с надеждой получить необходимое финансирование и повторить их с полным набором необходимых приборов» [12, стр. 176].
В середине 2002 года небольшое финансирование поступило, что позволило изготовить новый реактор и приобрести некоторые измерительные приборы, в частности весы с пределом измерения до 600 г и точностью 0,02 г. Тщательная подготовка, позволила значительно увеличить длительность непрерывной работы реактора и зафиксировать расход раствора на получение газов.
Сложность работы с водородом заключается в том, что его смесь с воздухом (4-74)% или кислородом (4 — 94)% взрывоопасна, и этот факт многократно фиксировался при испытаниях, заставляя испытателей проявлять особую осторожность. Вторая сложность при измерении количества водорода, генерируемого плазмоэлектролитическим реактором, заключается в том, что его молекула имеет наименьшие размеры, поэтому легко проникает туда, где молекулы других веществ не проходят. Молекулярный водород легко диффундирует даже в металлы [39]. Один объем палладия, например, поглощает до 800 объемов водорода.
Известно, что из одного литра воды можно получить 1220 л водорода и 620 л кислорода. Количество газов, генерируемых плазмоэлектролитическим процессом значительно больше, чем можно получить их из расходуемой воды (Табл. 1). Что явилось веским основанием для поиска ошибки измерений. Для этого была использована схема измерения скорости потока газов и их количества (Рис. 6).
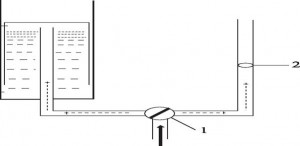
Рис. 6.
Схема измерения скорости газового потока и его объёма: 1- кран для переключения направления движения газового потока, 2 — анемометр, 3 — мерная ёмкость, 4 — ёмкость с водой
Результаты измерений оказались такими. Анемометр показал, что через него за 10 минут прошло 200 литров газовой смеси. В мерной ёмкости за это время оказалось около одного литра газов. Таким образом, измерение газового потока с помощью анемометра искажало результат в 200 раз.
Происходит это потому, что плазма разрушает молекулу воды на водород и кислород, и если эти газы контактируют с плазмой, то водород вновь соединяется с кислородом, и образуется вода. Шум, генерируемый плазмой, это микровзрывы водорода. Импульсы этих микровзрывов и увеличивают показания анемометра. С учетом изложенного, чем больше образовавшегося водорода сгорит в плазме, тем меньше его будет в парогазовой смеси. Следовательно, нужны такие режимы работы реактора, при которых количество сгоревшего водорода было бы минимально (Табл. 5).
ПРОТОКОЛ
испытаний первой модели низкоамперного электролизёра
Известно, что из 1 мл можно получить 1,22 л h3 + 0,62 л O2 = 1,84 л ( h3 + O2 )
Таблица 6 Результаты эксперимента
| Показатели | 1 | 2 | 3 | Сред. |
| 1-длительность эксперимента, час | 1 | 1 | 1 | 1 |
| 2-напряжение, В | 70 | 70 | 70 | 70 |
| 3-ток, А | 0,038 | 0,080 | 0,098 | 0,072 |
| 4 — мощность, Вт | 2,7 | 5,60 | 6,44 | 4,91 |
| 4-объём, израсходованного раствора, мл | 1,67 | 3,98 | 4,32 | 3,32 |
| 5-плотность раствора, кг/л | 1,04 | 1,04 | 1,04 | 1,04 |
| 6-объём, израсходованной воды, мл | 1,60 | 3,83 | 4,15 | 3,19 |
| 7-объём, полученной смеси газов, л | 2,95 | 7,06 | 7,85 | 5,95 |
| 6-объём, полученного водорода, л | 1,95 | 4,67 | 5,07 | 3,80 |
| 7-расход энергии на 1 литр водорода, Ватт-ч/литр | 1,38 | 1,20 | 1,27 | 1,28 |
| 8-расход энергии на 1м3 водорода, кВтч/м3 | 1,38 | 1,20 | 1,27 | 1,28 |
Заключение
При плазменном электролизе воды протекает трансмутация ядер атомов щелочных металлов и ядер атомов материала катода. Плазмоэлектролитический процесс открывает новые перспективы изучения материи на ядерном, атомарном и молекулярном уровнях. Низкоамперный электролиз воды — наиболее перспективный процесс уменьшения затрат энергии на получение водорода из воды.
Литература
1. M. Fleischmann, S. Pons and M. Hawkins. Electrochemically Induced Nuclear Fusion of Deiterium. J. Electroanal. Chem. 261, 301 (1989).
2. 73. ICCF — 7 ACCEPTED ABSTRACTS. Infinite Energy. V 4, Issue 20, p. 59…69.
3. Херольд Л. Фокс. Холодный ядерный синтез: сущность, проблемы, влияние на мир. Взгляд из США. Производственная группа «СВИТЭКС» М:. 1993, 180 с.
4. T. Ohmori, T. Mizuno. Strong Excess Energy Evolution, New Element Production, and Electromagnetic Wave and/or Neutron Emission in Light Water Electrolysis with a Tangsten Cathode. Infinite Energy. Issue 20, 1998. Pages 14-17.
5. T. Mizuno. Nuclear Transmutation: The reality of Cold Fusion. Infinite Energy Press. 1998. 151 pages.
6. Ph. Kanarev. Foundations of Physchemistry of Microworld. Krasnodar 2002. 330 pages. (In Russian and in English).
7. Kenneth R. Shoulders, «Method of and Apparatus for Production and Manipulations of High Density Charge», U.S. Patent 5,054,046, issued Oct 1, 1991.
8. Ken Shoulders & Steve Shoulders, «Observations on the Role of Charge Clusters in Nuclear Cluster Reactions», J. of New Energy, vol. 1, no 3, pp 111-121, Fall 1996, 7 refs, 22 figs.
9. Hal Fox, Robert W. Bass, & Shang-Xian Jin, «Plasma-Injected Transmutation», J. of New Energy, vol. 1, no 3, Fall 1996, pp 222-230, 23 refs, 4 figs.
10. Shang-Xian Jin & Hal Fox, «High Density Charge Cluster Collective Ion Accelerator,» J. of New Energy, vol. 4, no 2, Fall 1999, pp 96-104, 47 refs, 4 figs., 3 tables.
11 . Kanarev. Water is the Main Power Carrier of Future Power Engineering. Journal of New Energy. An International Journal of New Energy stems. Vol. 6, No.2. Pag. 101-121.
12. Ph.M. Kanarev. Water is New Source of Energy. The Third Edition. Krasnodar 2002. 194p. (In English).
zaryad.com
Анализ и синтез воды - Справочник химика 21
Цикл Свойства веществ в свете атомно-молекулярной теории включает передачи Химия вокруг нас , Свойства жидкого кислорода , Свойства водорода , Свойства воды , М. В. Ломоносов — основоположник атомно-молекулярной теории , Анализ и синтез воды , Очистка воды . В этих передачах актуализированы понятия о многообразии свойств веществ (молекулярного и немолекулярного строения), зависимости их свойств от состава и строения. Рассматриваются свойства и получение в лаборатории впервые изучаемых учащимися простых веществ — кислорода и водорода. Основная цель этого цикла — пробудить у учащихся интерес к изучению предмета. Поэтому передачи цикла насыщены эффектными опытами, недоступными или малодоступными для учителя средней щколы. [c.91] Свойства водорода Анализ и синтез воды Свойства воды Очистка воды [c.171]Например, синтезом воды из водорода и кислорода было установлено, что вода является сложным веществом, состоящим из водорода и кислорода. Однако потребовалось прибегнуть еще и к анализу воды, чтобы окончательно убедиться в том, что вода действительно является сложным веществом и состоит из этих элементов. Так, путем синтеза и анализа был определен химический состав воды. [c.14]
Применение антифлогистонной теории позволило Лавуазье в 1783 г., правильно интерпретировав результаты экспериментов английских ученых Г. Кавендиша, Дж. Пристли и Дж. Уатта, установить качественный состав воды, который с той поры стал общепринятым. От опытов по анализу и синтезу воды Лавуазье перешел в 1783 г. к окончательному установлению качественного н количественного состава органических соединений (предварительные работы в этом направлении были проведены им в 1775 г. и продолжались во второй половине 1770-х годов). Показав общность состава растительных и животных тел , Лавуазье заложил основы органического анализа и в конечном счете всей органической химии как химии соединений углерода. [c.117]
Оборудование для анализа и синтеза воды. Рисунок из исследований О разложении и образовании воды , воспроизведенный в Сочинениях Лавуазье (Париж, 1862). [c.140]
Для доказательства постоянства состава воды используются опыты как по синтезу воды из водорода и кислорода, так и по разложению ее электрическим током. Учитель не должен ограничиваться опытами либо по синтезу, либо только по анализу воды. Нужно, чтобы учащиеся убеждались в правильности закона постоянства состава на различных опытах, особенно на противоположных. [c.45]
Важным практическим применением РГХ в анализе загрязнений воды и воздуха является определение чрезвычайно токсичных изоцианатов, используемых в качестве пенообразующего агента в синтезе пенополиуретанов (пороло-ны), в производстве пестицидов, в металлургии и др. Прямое газохроматографическое разделение реакционноспособных изоцианатов является проблематичным, что объясняется наличием у этих ЛОС системы кумулированных связей —N= =0. Поэтому, как правило, эти токсичные соединения определяют методом РГХ, что одновременно позволяет увеличить достоверность идентификации целевых компонентов. [c.325]
Синтезом воды из водорода и кислорода удалось доказать, что вода—сложное вещество, состоящее из элементов водорода и кислорода. Однако потребовалось прибегнуть еще и к анализу воды, чтобы окончательно убедиться в том, что вода действительно яв- [c.14]
Метод синтеза противоположен методу анализа. Синтезом называют получение сложного вещества из менее сложных. Так, воду можно получить, взорвав в замкнутом пространстве смесь двух литров водорода с одним литром кислорода. Так как кислород тяжелее водорода в 16 раз, то отношение их соединившихся масс равно 1 8. [c.14]
Анализ и синтез воды [c.129]
Анализ и синтез воды............ [c.477]
При анализе пробы воды пипеткой переносят исследуемый объем в мерную колбу вместимостью 50 мл с одним делением если необходимо, разбавляют водой до 40 2 мл. Выполняют синтез окрашенного соединения, как при градуировке, и проводят измерение поглощающей способности пробы. [c.290]
В 1773 г. Лавуазье, повторив опыты Бойля и Ломоносова с обжиганием металлов — свинца, олова, ртути, пришел к тем же выводам, что и Ломоносов. Эти выводы позднее, в 1785 г., он подтвердил опытами по анализу и синтезу воды. В 1789 г. в Курсе элементарной химии Лавуазье писал Ничто не создается [c.10]
В процессе биохимической очистки сточных вод ПАВ удаляются из жидкости путем собственно биохимического распада и частичной сорбции их как избыточным активным илом, так и выносимыми с очищенной жидкостью взвешенными веществами. Определение как общего процента удаления ПАВ в процессе пробной очистки сточных вод, так и собственно величины биохимического распада, представляющей сумму окисленной части вещества и используемой микроорганизмами на синтез новой биологической массы, представляет затруднения,главным образом из-за несовершенства существующих аналитических методов анализа сточных вод на содержание ПАВ. [c.16]
АНАЛИЗ И СИНТЕЗ ВОДЫ [c.82]
Анализ и синтез воды..........82 [c.474]
Разложение Н28 через стадию образования Н и 8 + отвергается, так как синтез воды из Н или 0 невозможен. Если возникает 8 , то он должен реагировать с поверхностным 0 с образованием 80 , что не подтверждается анализом адсорбента методами ИК- и масс-спектрометрии. Может происходить распад Н28 до 2Н и 8°, в этом случае образуется Н2О при взаимодействии Н° с ОН -группами поверхности и Нг по реакции между двумя Н°. Нельзя исключать распада Нг8 до Н+ и 8 Н+ быстро реагирует с О на поверхности, давая ОН или Н2О. Но нет подтверждения, что образуется 8 . [c.56]
В табл. 3 в качестве примеров металлов, катализирующих последовательные элементарные реакции, проходящие по одному из трех указанных механизмов, приведены металлы, ускоряющие синтез воды, в чистом виде, в соединениях или в виде легко восстанавливающихся окисей. Совпадение эксперимента и теории распространяется во многих случаях и на степени окисления, предсказываемые для этих металлов. Образование воды по одностадийному механизму катализируется Сг +, Ре +, Со +, N1 +, Си (окисная) и Ag (окисное). Реакция, протекающая по двухстадийному механизму, катализируется 1г и Ни +, Ни +. Трехстадийные реакции катализируются Мп +, Мп +, Мп +, Ки +, Ки +, Ки +, Р(1 и Р1. Подробное обсуждение этих гипотез и расчетов, необходимых для составления табл. 3, приведено в предыдущей работе [3]. Аналогично обрабатывались и данные анализа одностадийной реакции водорода и окиси углерода с образованием промежуточных [c.400]
Для хроматографического анализа с использованием пластинок силуфол UV-254 веществ, синтез которых описан в настоящем руководстве, могут быть рекомендованы следующие системы л -ди-нитробензол, о- и п-нитрофенол, п-нитроанилиновый красный (бензол или петролейный эфир — ацетон 5 1) метиловый оранжевый (пропиловый спирт — триэтиламин — вода 2 1 1) л1-нитробен-зойная кислота (2-бутанол - 3% водный раствор аммиака 5 2). [c.65]
Промежуточную группу образуют псевдоравновесные синтезы, которые выполняются в условиях, когда ряд химических превращений запрещен по причине их кинетической заторможенности, а ход остальных полностью определяется термодинамически ми соображениями. Так, изучая системы с участием оксалатных комплексов, следует помнить, что щавелевая кислота уже при 25 °С нестабильна по отношению к распаду на воду, СО и СО . (Д(3° = —76,6 кДж/моль), поэтому термодинамический анализ во многих случаях должен указывать на полное разрушение комплексов с образованием СО и СО2. Но если температура недостаточно велика для того, чтобы процесс разрыва связи С—С шел с заметной скоростью, при выполнении этого анализа нужно игнорировать продукты, содержащие единственный атом углерода. [c.396]
Зависимость мощности максимумов от атомных номеров. Как электронная плотность атома, так и его электростатическое поле возрастают симбатно с ростом атомного номера. Поэтому в обоих методах (РСА и ЭСА) исследователь сталкивается с затруднениями, когда требуется различить атомы с близкими атомными номерами. Ядерная плотность не является симбатной функцией атомного номера. Атомы, соседние в периодической таблице, например Ре, Со и N1, дают в Фурье-синтезах максимумы, совершенно различные по высоте. Особенно удобен НСА для установления позиций самых легких атомов материи — атомов водорода, фиксация которых в случае РСА не всегда возможна, а точность определения координат заведомо низка. Кроме того, дифракция нейтронов зависит от спиновых магнитных моментов ядер. Для потока нейтронов ядра одного и того же элемента, не совпадающие по ориентации спинового момента, являются разными ядрами. Поэтому НСА широко используется для решения специальных задач, таких, как анализ упорядоченности сплавов, образованных металлами с близкими атомными номерами анализ магнитной структуры кристалла выявление и уточнение координат атомов водо- [c.127]
При рассмотрении действия кислорода на металлы А. Лавуазье вводит название окиси вместо металлических земель . Затем разбирает анализ и синтез воды, а также описывает свойства водорода и солеродных оснований. В заключение автор останавливается на свойствах металлов. [c.94]
Газовые законы химии. При определении атомной массы элемента Дальтон исходил из понятия атомной массы и результатов химического анализа. Однако для установления правильных атомных масс элементов оказались недостаточными указанные исходные позиции Дальтона. Необходимо было атомистику Дальтона дополнить ясными представлениями о молекулах. На этом пути важную роль сыграли газовые законы и особенно закон объемных отношений Гей-Люссака и закон Авогадро. Экспериментальные исследования по изучению химических реакций между газообразными веществами привели Гей-Люссака к открытию закона объемных отношений (1808) при пеизмеппых те мпературе и давлении объемы вступающих в реакцию газов относятся друг к другу, а также к объемам образующихся газообразных продуктов как небольшие целые числа. Так, при образовании хлорида водорода из простых веществ объемы реагирующих и получающихся газов относятся друг к другу как 1 1 2. А при синтезе воды из простых веществ это отношение равно 2 1 2. Эти пропорции небольших и целых чисел нельзя объяснить, исходя из атомистики Дальтона. Закон объемных отношений нашел объяснение в гипотезах Авогадро (1811) [c.11]
В работах [83, 84] применение модифицированного полисорба-1 в газохроматографическом анализе показано на примере разделения спиртов С1—С ,, анализа примесей воды в спиртах, разделения некоторых полупродуктов синтеза витамина В , содержащих, в частности, пропионовую кислоту, а-бромпропионовую кислоту, пропиловый и этиловый эфиры М-формил-а-аланина, 4-метил-5-пропок-сиоксазол, воду. В качестве неподвижных жидких фаз использованы полиэтиленгликольадипат и различные модификации полиэтиленгликольазелапната. Показана возмож- [c.89]
Часто для установления состава сложного вещества можно пользоваться и реакциями соединения. Например, если при соединении серы и железа образовалось только сернистое железо и ничего больше, то из этого можно сделать заключение, что в состав указанного сложного вещества входят только элементы сера и железо. Такой метод получил название синтеза. Метод синтеза и метод анализа, ио существу, противоположны друг другу. Для более точного установления состава сложных веществ обычно пользуются обоими этими методами одновременно методом синтеза проверяют данные анализа, и наоборот. Например, при разложении воды образуются газы водород и кислород (данные анализа). Чтобы окончательно удостовериться, что вода состоит только из элементов водорода и кислорода, производят синтез воды. Для этого водород и кислород соединяют химически и убеждаются в том, получается ли при этой реакции вода или какое-нибудь другое вещество. Так как в указанном случае ничего, кроме воды, не получается, то элементарный состав воды считается окончательно установленным. Химия, в которой анализ является преобладающей формой исследования, ничего не стоит без его противоположности— синтеза (Энгельс. Диалектика природы, Партиздат, 1936, стр. 33). [c.17]
При рассмотрении действия кислорода на металлы Лавуазье вводит название окиси вместо металлических земель . Затем описываются водород, анализ и синтез воды, соединения горючих веществ между собой и так называемые сдлеродные основания. Заключение этой части посвящено металлам. [c.77]
Соляную кислоту получали в две стадии сжиганием водорода в хлоре в стальной двухконусной печи и абсорбцией хлористого водорода водой в абсорбционных колоннах. Газообразный хлор из цеха электролиза через регулирующий вентиль и измерительную диафрагму поступал в горелку печи. Водород, также поступающий из цеха электролиза, проходил последовательно водоотделитель, пламегаситель, регулирующий клапан, диафрагму, регулирующий вентиль и поступал в горелку печи синтеза, где смешивался с хлором. В день аварии перед пуском печи открыли верхнюю свечу для вентиляции и люк для розжига печи. Анализ печной среды показал, что содержание кислорода в ней составляет 18,8%, поэтому печь была дополнительно продута азотом. После этого приступили к розжигу печи. В момент розжига произощел взрыв, который по трубопроводу распространился в абсорбционную колонну. В печи синтеза разорвалась предохранительная мембрана абсорбционная колонна была разрушена. Как показали результаты расследования неработающая печь синтеза была отключена от коллектора только вентилем. На трубопроводе водорода не ыли установлены заглушки. Через неплотности вентиля водород пр01нпк в печь синтеза и абсорбционную колонну. По этой же причине в печь проник хлор, что и привело к взрыву. [c.351]
Активацию катионита проводят следующим образом. К смеси высушенного сульфокатионита дауэкс 50w Х 4 и хлористого этилена добавляют при перемешивании раствор хлорсульфоновой кислоты в хлористом этилене. Смесь охлаждают, поддерживая температуру около 15 °С. После того как реакция в основном закончится, охлаждение прекращают и температуру повышают до 26 °С. Катионит отфильтровывают, промывают хлористым этиленом и суспендируют в 37%-НОЙ соляной кислоте при 20 °С. К этой смеси добавляют небольшими порциями в течение 2 ч гранулированное олово, после чего температуру поднимают до 80 °С для растворения олова. Катионит опять отфильтровывают, промывают 10 о-ной соляной кислотой до полного удаления солей олова, а затем водой — до полного удаления соляной кислоты. Катионит обезвоживают, отгоняя азеотропную смесь воды с бензолом последний удаляется из катионита при высушивании в вакууме. На активированном таким образом ионите проводили синтез дифенилолпропана в статических условиях (80 °С, 6 ч). Анализ показал повышение степени конверсии фенола по сравнению с опытами, в которых использовали неактивированный катионит дауэкс 50 w X 4. [c.153]
В качестве примера рассмотрена зеотропная реакциошая смесь (Тдкоторой протекают две химические реакции А+В->С, А+С->0. В частности, такая реакционная схема соответствует синтезу этиленг-ликоля (Q из этиленоксида (А) и воды (В). Вторая реакция образования диэти-ленгликоля (П) является побочной. Бьшо принято, что ректификационная колонна имеет бесконечную высоту и работает в режиме полного орошения. Эти допущения позволили рассматривать стационарные состояния как предельные и проводигь анализ процесса в параметрическом пространстве двух переменных объем реактора и величина потока рецикла. [c.180]
ПИРОГАЛЛОЛ (пирогалловал кислота, 1,2,3-триоксибензол) СвНэ (ОН)з — трехатомный фенол, бесцветные кристаллы, иглы или пластинки, легко сублими- он рующиеся, т. пл. 133— ОН 134° С хорошо растворим в воде, спирте, эфире. Наиболее характерным свойством П. является способность легко окисляться он мгновенно восстанавливает соли золота и серебра, а его щелочные растворы сильно связывают кислород. Этим пользуются в газовом анализе для количественного определения кислорода. П. используется как восстановитель, в фотографии как проявитель, в газовом анализе для поглощения кислорода, в аналитической химии для обнаружения многих элементов, в органическом синтезе и др. П. ядовит. [c.191]
САЛИЦИЛОВЫЙ АЛЬДЕГИД (о -окси-бензальдегид) НО — С8Н4— СНО — бесцветная жидкость с запахом горького миндаля н жгучим вкусом, т. кип. 196,8 С, плохо растворим в воде, хорошо — в бензоле, смешиг,а-ется со спиртом и эфиром. С. а. получают из фенола, крезола. С. а. широко ис-пользуют в парфюмерии, в органическом синтезе и анализе, в производстве красителей, как фунгицид, для определения сивушного масла в этиловом спирте. [c.218]
Г. Шталь никогда не сомневался в реальности флогистона. Наиболее убедительным доказательством его существования он считал синтез и анализ серы. Сперва Г. Шталь, действуя купоросной (серной) кислотой па масло винного камня (насып енный раствор поташа, полученного прокаливанием кислого тартрата калия), приготовил купоросный винный камень (сульфат калия). Сплавив последний с нотагпом и угольным порошком, он получил серную печень. Из ее раствора в воде после прибавления уксуса выделялась сера в виде сорного молока (мелкодисперсная сера белого цвета). Затем Г. Шталь смешал серную печень с селитрой и пересыпал смесь в раскаленный тигель. Произошла вспышка и [c.52]
К. Шееле был одним из первых, кто в 1772—1774 гг. осуществил объемный анализ и синтез атмосферного воздуха. Затем Г. Мопж нашел, что на образование воды идет соответственно 145 объемов водорода и 74 объема кислорода. Результаты этих опытов, проводимых в 1783 г., были опубликованы в 1786 г. В 1783 г. А. Лавуазье совместно с Ж. Менье определил, что при образовании воды 23 объема водорода взаимодействуют с 12 объемами кислорода. [c.144]
chem21.info
Вода синтеза - Справочник химика 21
Типичный состав водной фазы (реакционной воды) синтеза [387] [c.596]Реакцию доводят до конца, нагревая смесь до 200 °С и одновременно продувая систему азотом или понижая давление, чтобы удалить выделяющуюся воду. Синтез заканчивают, когда кислотное число полимера понижается до 1—4, содержание воды составляет менее 0,1 %, а гидроксильное число достигает заданного значения. [c.242]
Кремнийорганические соединения, как правило, устойчивы на воздухе и нерастворимы в воде. Синтез высокомолекулярных производных со скелетом из группировок —Si—О—Si—О— (т. н. силиконов) открыл возможность их широкого практического использования. [c.606]Синтез состоит из двух процессов получения хлороводорода и поглощения его водой. Синтез ведут в контактной печи — вертикальной стальной трубе (высота 7 м, диаметр 0,6 м) с горелкой, состоящей из двух трубок (рис. 91) по внутренней трубке подается хлор, а по внешней водород. Подожженная смесь горит с образованием хлороводорода, направляемого в поглотительную колонну с кислотоупорными кольцами, обеспечивающими большую поверхность контакта газа с водой (вода и хлороводород движутся навстречу друг другу по принципу противотока). Концентрированную соляную кислоту получают в первой колонне (во второй колонне улавливают остатки хлороводорода). Синтетический метод удобен, не требует расхода кислот и дешев, необходимые хлор и водород получают электролизом раствора хлорида натрия. [c.395]
Как правило, силиконы устойчивы на воздухе и нерастворимы в воде. Синтез высокомолекулярных производных этого тина открыл возможность их широкого практического использования для выработки лаков и смол, характеризующихся высокой термической устойчивостью н рядом других ценных свойств. [c.328]
Кислородные соединения в воде синтеза, г/кж ..... 3,0 [c.568]
Рубидий и цезий марганцовокислые относятся к малорастворимым соединениям. Растворимость перманганата рубидия при 0°—0,5 г, при 60°—4,7 г на 100 г воды растворимость перманганата цезии при 0° — 0,1 г, при 60°— 1,3 г на 100 г воды. Синтез перманганатов рубидия и цезия основан на осаждении их из растворов перманганатом калия и дальнейшей очистке путем перекристаллизации [1]. [c.72]
Образующиеся при синтезе кислородные соединения в большей своей части растворяются в воде синтеза, которая имеет кислую реакцию. [c.522]
Из кислот, содержащихся в воде синтеза, выделены муравьиная кислота — следы, уксусная — около 33%, пропионовая— около 10% и масляная — около 11% (от всех кислот). В спиртах, выделенных из этой же воды, содержалось метилового 9%, н-бутилового около 11% и амиловых спиртов около 6%. [c.522]
Лз воды синтеза должны быть предварительно удалены ценные органические соединения вода должна быть очищена и только после этого ее можно спускать в канализационные стоки. [c.523]
Практический расход синтез-газа на 1 г метанола составляет 2420— 2500 м , а на 1 л газа получается 400—510 г спирта. Выход метанола составляет 85—87%. Метанол-сырец содержит 92—93% метанола, 1— 1,4% диметилового эфира, 0,4—1,0% высших спиртов и 3,7—5,5% воды. Синтез ведется в колонне высокого давления высотой 12 и диаметром 1000 мм при толщине стенок 90 мм. [c.348]
Взаимодействие непредельных углеводородов с окисью углерода и водой (синтез Реппе) [c.149]
В качестве примера синтеза ионитов по второму методу служит получение катионита КУ-2, щироко применяемого для умягчения воды. Синтез КУ-2 осуществляется путем введения сульфогрупп сульфохлорированием сополимера стирола и дивинилбензола с последующим омылением сульфохлоридных групп [c.338]
Рпс. 11-25. Реактор для синтеза соля- Рпс. П-26. Метаппический реактор для ной кислоты, охлаждаемый водой синтеза соляной кислоты [c.100]
V — вода синтеза VI — высококипящие первичные продукты VII — продукты синтеза VIII — остаточный газ п Сз п выше IX — СОг X — отработанный катализатор. [c.567]
Реакция присоединения хлорноватистой кислоты к олефинам представляет большой практический интерес. При пропускании этилена и хлора в воду (синтез атцленхлоргндрина по Гомбергу [270]) с возрастанием концентрации HG1 увеличивается. присоединение хлора. Эта нежелательная побочная реакция усиливается еще тем, что олрфнны и хлор лучше растворяются в образующемся продукте присоединения, чем и ноде. Следовательно, опыт приходится прерывать и заканчивать прв относительно [c.125]
В трехгорлую колбу емкостью 500 мл, снабженную механической мешалкой, обратным холодильником и термометром, шарик которого находится в реакционной смеси (рис. 3 в Приложении I), помещают 42 г ЗпСЬ-гНгО, 225 мл НС1 и 75 мл воды (синтез ведут в вытяжном шкафу), В энергично перемешиваемую смесь через горло, снабженное термометром, небольшими порциями вносят 10 г 4-нитрофталимида (синтез см. СОП., II, 389), следя за тем, чтобы температура не поднималась выше 50 °С. При этом 4-нитро- [c.191]
Прямое превращ. ядерной знергии в химическую может осуществляться в т. и. хемоядерных реакторах, в к-рых активная зона заполнена урансодёржащими металлич. волокнами или листами фольги толщиной 0,3—10 мкм. В-ва, транспортирующиеся между волокнами или листами фольги, вступают в хим. р-цию благодаря энергии излучения и отводят выделяющуюся тепловую энергию, к рая м. б. преобразована в электрическую или использована непосредственно. Возможно применение газообразного или жидкого горючего реагенты в этих случаях смешиваются с горючим. Продукты хим. р-ции выводятся из реактора через спец. устр-ва. Вследствие сложности отделения продуктов хим. р-ции от радиоакт. осколков деления и искусств, радиоакт. элементов, образующихся при поглощении нейтронов реагирующими в-вами, промышл. хемоядерные реакторы пока не построены. В лаб. масштабах изучены фиксация N2 из воздуха, получ. Нг при радиолизе воды, синтезы озона и гидразина и др. Радиационно-хим. выход для таких реакторов, т. е. число молекул, образующихся при поглощении энергии 100 МэВ, составляет от 2 до 30. [c.725]
Морфин (морфий) С17Н вЫОз —главный алкалоид опия (млечного сока несозревших плодов мака, содержанне в нем морфина достигает 10%). Существует в виде кристаллического моногидрата, мало растворимого в воде. Синтез морфина осуществлен в 1952 г. Морфин — сильный яд (наркотик) в медицине используется как сильное болеутоляюще е и снотворное средство. [c.545]
Чтобы полученный сложный эфир не мог взаимодействовать с водой, синтез ведут так, что эфир отгоняется и собирается в ттртстняке. Дя ускорения реакцй вводят шталнаат — ер--ную кислоту. [c.107]
При выработке синтетического спирта по первому методу сточные воды образуются в процессах получения карбида кальция — при мокром охлаждении и очистке окиси углерода и дымовых газов получения ацетилена—при промывке и очистке его от примесей получения ацетальдегида—при щелочной очистке непрореагировавшего газа, промывке аппаратуры, ректификации ацетальдегида, регенерации кислоты, регенерации ртути из щламов и сточных вод синтеза спирта из ацетальдегида. [c.214]
К раствору платинохлористоводородной кислоты в 10-кратном количестве воды (синтез см. стр. 94) добавляют свежеприготовленный 25%-ный раствор хлористого калия до полноты осаждения. Выпадает желтый кристаллический осадок, который отфильтровывают через 1,5—2 часа после осаждения. Осадок промывают разбавленным раствором KG1 и спиртом. Выход 90—95%. Анализ [1] [c.96]
К раствору платинохлористоводородноЁ кислоты в 10-кратпом количестве воды (синтез см. стр. 94) добавляют свежеприготовленный 25%-пый раствор Nh5GI до полноты осаждения. Выпадает кристаллический осадок бледно-желтого цвета. Осадок отфильтровывают, промывают 2 %-пым раствором Nh5GI и спиртом. Выход около 80—90%. [c.97]
Фирма Bayer AG запатентовала способ превращения дибензилового эфира в бензилхлорид и получение чистой соляной кислоты из содержащих НС1 сточных вод синтеза бензилового [c.200]
Вода синтеза имеет кислую реакцию. В ней обнаружены муравьиная, уксусная, проиионовая и масляные кислоты, метиловый и высшие спирты, альдегиды и другие соединения. Содержание кислородсодержащих веществ в воде может доходить до 10—15% (синтез под средним давлением), поэтому перед спуском воды в канализацию эти вещества, представляющие больш ю ценность, должны удаляться с помощью перегонки. [c.498]
Практическое применение нашел хлортиамид — аддукт сероводорода с дихлобенилом, который в почве медленно выделяет последний. Нитрофен тоже используется как предвсходовый гербицид для уничтожения сорняков в растениях семейства крестоцветных (рапсе, капусте листовой, капусте кочанной и т. д.) и других культур. Недавно было запатентовано несколько химически родственных препаратов, в том числе пиразон, входящий в группу N-фенилпиридазинонов. Его применяют главным образом в посевах сахарной свеклы, так как это растение способно детоксифицировать пиразон. Пиразон действует на сорняки, ингибируя процесс фотосинтеза возможно, что он близок по механизму действия к рассмотренным выше гербицидам, блокирующим фотохимическое выделение кислорода из воды. Синтез этого соединения осуществляют путем взаимодействия фенилгидразина с мукохлорной кислотой с последующим аммонолизом продукта. [c.504]
Разработан потенциометрический метод определения малых концентраций масляной кислоты в присутствии больших концентраций соляной кислоты и хлористого натрия в производственных водах синтеза 3,3-ди(хл орметил)оксациклобутана. [c.199]
Средний состав сточных вод синтеза углеводородов по Фишеру — Трошпу [c.410]
Как следует из данных, приведенных в табл. 61, сточные воды синтеза по Фишеру—Тропшу характеризуются слабо кислой реакцией и содержанием небольшого количества жирных кислот. Концентрация растворенных веществ в воде незначительна. [c.410]
Синтетический способ складывается из двух процессов синтеза хлористого водорода и поглош ения его водой. Синтез осуществляют в контактной печи, представляющей собой вертикальную стальную трубу (высота 7 м, диаметр 0,6 м) с горелкой, состоящей из двух трубок (рис. 52). По внутренней трубке подается хлор, а по внешней — водород. Подожженная смесь спокойно горпт с образованием хлористого водорода. Последний поступает в поглотительную колонну, заполненную кислотоупор-нылш кольцами, обеспечиваюшрми большую поверхность соприкосновения газа с водой. Более полное поглощение достигается еще и тем, что вода и хлористый водород движутся навстречу друг другу по принципу противотока. Концентрированная соляная кислота получается в первой колонне. Вторая колонна служит для улавливания остатков хлористого водорода. Синтетический способ удобен, не требует расхода кислот и дешев. Необходтпде для этого хлор и водород получают электролизом раствора поваренной солп. [c.160]
Процесс получения монохлоранилинов сопровождается сильной коррозией аппаратуры под действием соляной кислоты при повышенной температуре. Наиболее опасным в коррозионном отношении является реакционный узел, где происходит каталитическое восстановление хлорнитробензолов (ХНБ). Этот процесс связан с образованием соляной кислоты в результате дегалогенирования хлорорганических продуктов и выделения воды. Синтез осуществляется при температурах до 150° С. [c.164]
chem21.info



















