Этанол - что это? Свойства этанола. Применение этанола. Вода этанол
что это? Свойства этанола. Применение этанола
Этанол - что это за вещество? Каково его применение и как оно производится? Этанол более известен всем под иным названием – спирт. Конечно, это не совсем правильное обозначение. Но между тем, именно под словом «спирт» мы и подразумеваем «этанол». Еще наши предки знали о его существовании. Они получали его путем процесса брожения. В ход шли различные продукты от злаков до ягод. Но в полученной браге, именно так называли в старину спиртные напитки, количество этанола не превышало 15 процентов. Чистый спирт смогли выделить только после того, как изучили процессы дистилляции.
Этанол – что это?
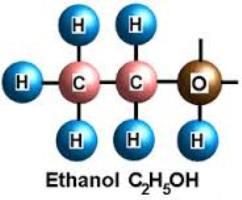
Этанол – это одноатомный спирт. При нормальных условиях он представляет собой летучую, бесцветную, легковоспламеняющуюся жидкость, обладающую специфическим запахом и вкусом. Этанол нашел широкое применение в промышленности, медицине и быту. Он является прекрасным дезинфицирующим средством. Спирт используется как топливо и в качестве растворителя. Но больше всего формула этанола С2Н5ОН известна любителям алкогольных напитков. Именно в этой сфере это вещество нашло широкое применение. Но не стоит забывать и о том, что спирт как действующий компонент алкогольных напитков является сильным депрессантом. Это психоактивное вещество способно угнетать центральную нервную систему и вызывать сильную зависимость.
В наше время сложно найти отрасль промышленности, где не использовался бы этанол. Трудно перечислить все, чем так полезен спирт. Но более всего его свойства оценили в фармацевтике. Этанол – главный компонент практически всех лекарственных настоек. Многие «бабушкины рецепты» для лечения людских недугов основываются на этом веществе. Оно вытягивает из растений все полезные вещества, накапливая их. Это свойство спирта нашло применение и при изготовлении домашних травяных и ягодных настоек. И хотя это и алкогольные напитки, но в умеренных количествах они приносят пользу здоровью.
Польза этанола

Формула этанола известна всем еще со школьных уроков по химии. Но вот в чем польза этого химического вещества, так сразу ответит не каждый. В действительности сложно представить отрасль промышленности, где не использовался бы спирт. Прежде всего, этанол применяют в медицине как мощнейшее дезинфицирующее средство. Им обрабатывают операционную поверхность и раны. Спирт губительно действует практически на все группы микроорганизмов. Но применяется этанол не только в хирургии. Он незаменим для изготовления лекарственных экстрактов и настоек.
В малых дозах спирт полезен для организма человека. Он способствует разжижению крови, улучшению кровообращения и расширению сосудов. Он даже применяется для профилактики сердечно-сосудистых заболеваний. Этанол способствует налаживанию работы желудочно-кишечного тракта. Но только в действительно малых дозах.
В особых случаях психотропное действие спирта может заглушить самые сильные боли. Этанол нашел применение и в косметологии. Благодаря своим ярко выраженным антисептическим свойствам он включен в состав практически всех очищающих лосьонов для проблемной и жирной кожи.
Вред этанола
Этанол – спирт, получаемый путем брожения. При чрезмерном употреблении он способен вызывать сильнейшие токсикологические отравления и даже кому. Это вещество входит в состав алкогольных напитков. Спирт вызывает сильнейшую психологическую и физическую зависимость. Алкоголизм принято считать болезнью. Вред этанола сразу ассоциируют со сценами безудержного пьянства. Неумеренное употребление напитков, содержащих спирт, приводит не только к пищевым отравлениям. Все гораздо сложнее. При частом распитии алкоголя поражаются практически все системы органов. От кислородного голодания, которое вызывает этанол, погибают в большом количестве клетки головного мозга. Происходит деградация личности. На первых стадиях ослабевает память. Затем у человека развиваются заболевания почек, печени, кишечника, желудка, сосудов и сердца. У мужчин наблюдается потеря потенции. На последних стадиях у алкоголика выявляется деформация психики.
История спирта

Этанол – что это за вещество и как его получили? Далеко не все знают, что его использовали еще с доисторических времен. Он входил в состав алкогольных напитков. Правда, концентрация его была небольшой. Но между тем, следы алкоголя были найдены в Китае на 9000-летней керамике. Это однозначно говорит о том, что люди еще в эпоху неолита выпивали содержащие алкоголь напитки.
Первый случай получения спирта был зарегистрирован в 12 веке в Салерно. Правда, это была водно-спиртовая смесь. Чистый же этанол выделил Иоганн Тобиас Ловиц в 1796 году. Он использовал метод фильтрации через активированный уголь. Получение этанола этим способом долго оставалось единственным методом. Формулу спирта вычислил Николо-Теодор де Соссюра, а описал его как углеродное соединение Антуан Лавуазье. В 19-20 веках многие ученые занимались изучением этанола. Были изучены все его свойства. В настоящее время он получил широкое распространение и применяется практически во всех сферах человеческой деятельности.
Получение этанола путем спиртового брожения
Пожалуй, самый известный способ получения этанола – это спиртовое брожение. Оно возможно только при использовании органических продуктов, которые содержат большое количество углеводов, например винограда, яблок, ягод. Еще один важный компонент, чтобы брожение протекало активно – это наличие дрожжей, ферментов и бактерий. Так же выглядит переработка картофеля, кукурузы, риса. Для получения топливного спирта используют сахар-сырец, который вырабатывают из тростника. Реакция довольно сложна. В результате брожения получается раствор, который содержит не более 16% этанола. Более высокую концентрацию получить не удается. Это объясняется тем, что в более насыщенных растворах дрожжи выжить не способны. Таким образом, полученный этанол необходимо подвергнуть процессам очистки и концентрирования. Обычно используют процессы дистилляции.
Чтобы получить этанол, используют вид дрожжей Saccharomyces cerevisiae различных штаммов. В принципе, все они способны активизировать данный процесс. В качестве питательного субстрата можно применять древесные опилки или как альтернативу – раствор, полученный из них.
Топливо

Многие знают о свойствах, которыми обладает этанол. Что это алкоголь или дезинфицирующее вещество, тоже широко известно. Но спирт еще является и топливом. Его используют в ракетных двигателях. Известный факт – во время Первой мировой войны 70% водный этанол применяли как топливо для первой в мире немецкой баллистической ракеты – «Фау-2».
В настоящее время спирт получил большее распространение. В качестве топлива он применяется в двигателях внутреннего сгорания, для нагревательных приборов. В лабораториях его заливают в спиртовки. Каталитическое окисление этанола используют для производства грелок, как военных, так и туристических. Спирт с ограничением применяют в смеси с жидким нефтяным топливом в силу его гигроскопичности.
Этанол в химической промышленности
Широко применение этанола в химической промышленности. Он служит сырьем для производства таких веществ, как диэтиловый эфир, уксусная кислота, хлороформ, этилен, ацетальдегид, тетраэтилсвинец, этилацетат. В лакокрасочной промышленности этанол широко используют как растворитель. Спирт является основным компонентом стеклоомывателей и антифризов. Применяется спирт и в бытовой химии. Он входит в состав моющих и чистящих средств. Особенно часто он встречается в качестве компонента в жидкостях для ухода за сантехникой и стеклом.
Этиловый спирт в медицине

Этиловый спирт можно отнести к антисептикам. Он губительно воздействует практически на все группы микроорганизмов. Он разрушает клетки бактерий и микроскопических грибов. Применение этанола в медицине носит практически повсеместный характер. Это прекрасное подсушивающее и обеззараживающее средство. Благодаря дубящим свойствам спирт (96%) используют для обработки операционных столов и рук хирурга.
Этанол – растворитель лекарственных препаратов. Он широко применяется для изготовления настоек и экстрактов из лекарственных трав и прочего растительного сырья. Минимальная концентрация спирта в подобных веществах не превышает 18 процентов. Часто этанол используют в качестве консерванта.
Этиловый спирт прекрасно применяется и для растираний. Во время лихорадки он производит охлаждающий эффект. Очень часто спирт используют для согревающих компрессов. При этом он абсолютно безопасен, на коже не остается покраснений и ожогов. Кроме того, этанол применяется как пеногаситель при подаче искусственным путем кислорода во время вентиляции легких. Также спирт является компонентом общей анестезии, которую могут применять в случае дефицита медикаментов.
Как ни странно, но этанол медицинский используется в качестве противоядия при отравлении токсичными спиртами, например метанолом или этиленгликолем. Обусловлено его действие тем, что при наличии нескольких субстратов фермент алкогольдегидрогеназа осуществляет только конкурентное окисление. Именно благодаря этому после незамедлительного приема этанола вслед за токсичным метанолом или этиленгликолем наблюдается уменьшение текущей концентрации отравляющих организм метаболитов. Для метанола это муравьиная кислота и формальдегид, а для этиленгликоля – щавелевая кислота.
Пищевая промышленность
Итак, как получить этанол, было известно еще нашим предкам. Но наиболее широкое применение он получил только в 19-20 веках. Наряду с водой, этанол является основой практически всех спиртных напитков, в первую очередь водки, джина, рома, коньяка, виски, пива. В небольших количествах спирт обнаруживается и в напитках, которые получают путем брожения, например в кефире, кумысе, квасе. Но к алкоголю их не причисляют, так как концентрация спирта в них очень мала. Так, содержание в свежем кефире этанола не превышает 0,12%. Но если он отстоится, то концентрация может повыситься до 1%. В квасе этилового спирта чуть более (до 1,2%). Больше всего алкоголя содержится в кумысе. В свежем молочном продукте его концентрация - от 1 до 3%, а в отстоявшемся доходит до 4,5%.
Этиловый спирт - хороший растворитель. Это свойство позволяет использовать его в пищевой промышленности. Этанол является растворителем для ароматизаторов. Кроме того, он может использоваться в качестве консерванта для хлебобулочных изделий. Он зарегистрирован как пищевая добавка Е1510. Этанол имеет энергетическую ценность 7,1 ккал/гр.
Действие этанола на организм человека

Во всем мире налажено производство этанола. Это ценное вещество используется во многих сферах жизни человека. Настойки на спирту являются лекарством. Пропитанные этим веществом салфетки используют как дезинфицирующее средство. Но вот какое влияние этанол оказывает на наш организм при попадании внутрь? Полезен ли он или вреден? Эти вопросы требуют детального изучения. Всем известно, что человечество потребляло алкогольные напитки веками. Но только в прошлом столетии проблема алкоголизма приобрела масштабные размеры. Наши предки употребляли брагу, медовуху и даже ныне столь популярное пиво, но все эти напитки содержали слабый процент этанола. Поэтому нанести существенный вред здоровью они не могли. Но после того как Дмитрий Иванович Менделеев разбавил спирт с водой в определенных пропорциях, все изменилось.
В настоящее время алкоголизм – это проблема практически всех стран мира. Попадая в организм, спирт оказывает патологическое воздействие практически на все органы без исключения. В зависимости от концентрации, дозы, пути попадания и длительности воздействия этанол может проявить токсическое и наркотическое действие. Он способен нарушать работу сердечно-сосудистой системы, способствует возникновению заболеваний пищеварительного тракта, в том числе и язвы желудка и 12-типерстной кишки. Под наркотическим действием подразумевается способность спирта вызывать ступор, нечувствительность к болевым ощущениям и угнетение функций центральной нервной системы. Кроме того, у человека возникает алкогольное возбуждение, очень быстро он становится зависимым. В отдельных случаях чрезмерное употребление этанола может вызвать кому.
Что же происходит в нашем организме, когда мы пьем алкогольные напитки? Молекула этанола способна поражать ЦНС. Под действием спирта происходит выделение гормона эндорфина в прилежащем ядре, а у людей с явно выраженным алкоголизмом и в орбитофронтальной коре. Но, тем не менее, несмотря на это, этанол не признан наркотическим веществом, хотя он и проявляет все соответствующие действия. Этиловый спирт не был внесен в международный список контролируемых веществ. И это спорный вопрос, потому как в определенных дозах, а именно 12 грамм вещества на 1 килограмм массы тела, этанол приводит сначала к острому отравлению, а затем и смерти.
Какие заболевания вызывает этанол?

Сам раствор этанола не является канцерогеном. Но вот его основной метаболит – ацетальдегид – токсичное и мутагенное вещество. Помимо этого, он еще и обладает канцерогенными свойствами и провоцирует развитие онкологических заболеваний. Его качества исследовались в лабораторных условиях на подопытных животных. Эти научные работы привели к весьма интересным, но в то же время настораживающим результатам. Оказывается, ацетальдегид - не просто канцероген, он способен повреждать ДНК.
Длительное употребление алкогольных напитков может вызывать у человека такие заболевания, как гастрит, цирроз печени, язва 12-типерстной кишки, рак желудка, пищевода, тонкой и прямой кишки, сердечно-сосудистые заболевания. Регулярное попадание этанола в организм может спровоцировать оксидативное повреждение нейронов мозга. Вследствие повреждения гематоэнцефалического барьера они погибают. Злоупотребление напитками, содержащими спирт, приводит к алкоголизму и клинической смерти. У людей, регулярно распивающих алкоголь, риск развития инфаркта и инсульта повышается в разы.
Но это еще не все свойства этанола. Это вещество является естественным метаболитом. В малых количествах оно может синтезироваться в тканях человеческого организма. Его называют истинным эндогенным алкоголем. Также оно продуцируется в результате расщепления углеводной пищи в желудочно-кишечном тракте. Такой этанол называют «условно эндогенным алкоголем». Может ли обычный алкотестер определить спирт, который синтезировался в организме? Теоретически это возможно. Его количество редко превышает 0,18 промилле. Это значение находится на нижней границе самых современных измерительных приборов.
fb.ru
Этанол с водой - Справочник химика 21
При смешивании этанола с водой происходит уменьшение объема — контракция. Наибольшая контракция наблюдается при смешивании 52 объемов этанола с 48 объемами воды получается 96,3 вместо 100 объемов смеси при 20°С. [c.255]Смеси этанола с водой (продолжение таблицы 90) [c.795]
Однако во избежание недоразумения уравнением (2.40) и другими выражениями, вытекающими из него, например (2.47), следует пользоваться с осторожностью, так как в ряде случаев уравнение (2.40) приводит к значительным ошибкам. Дело в том, что при смешении жидкостей друг с другом часто происходит изменение объема. Так, например, прибавление бензола к гексану или к бензину сопровождается заметным увеличением объема смеси по сравнению с суммой объемов смешиваемых компонентов наоборот, при смешении этанола с водой объем смеси меньше суммы объемов компонентов. [c.40]
Определяем массу и количество вещества воды, этанола и натрия, помещенных в реакционную систему. Масса этанола с водой составляет [c.223]М раствор. Растворяют 0,2862 г сульфарсазена при нагревании на водяной бане в 100—150 мл смеси этанола с водой (3 2), раствор переводят в мерную колбу вместимостью 500 мл, смывают стенки стакана этой же смесью и после охлаждения доводят объем раствора до метки. Применяют в качестве индикатора при комплексометрических титрованиях цинка, кадмия, никеля и свинца. [c.203]
Цедерберг [34] показал, что формула (Х-28) вполне пригодна для расчета теплопроводности любых смесей жидкостей даже в случае сильно полярных компонентов погрешность расчета теплопроводности по формуле Филиппова и Новоселовой находится в пределах 3—4,8% (проверено на примере смесей этанола с водой). [c.439]
Изящной модификацией описанного метода является конденсация соли карбоновой кислоты и диамина (см. опыт 4-09). Получение соли и саму поликонденсацию проводят в две стадии. Соли получают в кристаллической форме путем растворения эквимольных количеств диамина и дикислоты в растворителе, в котором соль не растворяется (например, в спирте). Для получения высокомолекулярных продуктов исходные соли должны быть нейтральными (эквимольное соотношение диамина и дикислоты) и очень чистыми (например, перекристаллизованными из смеси этанола с водой). [c.205]
Как можно видеть из данных табл. 1.13, при анализе описанным методом смесей этанола с водой допускается содержание последней лишь в интервале 20—25%. Вводя в реакцию большие количества 3,5-динитробензоилхлорида, этот интервал можно значительно увеличить. [c.38]
ГИЯ Н-связи молекул метанола и этанола с водой превышает энергию Н-связи молекул жидкой воды. [c.26]
В течение ряда лет в качестве добавки, повышающей ресурсы бензинов, применяют этанол. В США этиловый спирт получают в основном из зерна и есть опыт применения в различных районах страны бензоэтанольных смесей, названных газо-холлом (10% этанола). Средний перерасход этанолсодержащего топлива составляет 5%. Вследствие хорошего смешения этанола с водой увеличивается коррозионное воздействие на двигатель. Смешение бензина с этанолом должно производиться непосредственно на автозаправочных станциях. Этанол обладает повышенной летучестью и испаряется легче, чем бензин. Попадая в атмосферу, такие выбросы способствуют повышенному образованию озонового смога. Все отмеченные недостатки не позволяют сегодня говорить о массовом применении этанола в качестве компонента модифицированных бензинов в различных странах. [c.227]
Щелочные металлы. Литий, натрий и калий можно четко разделить на необработанной бумап в виде хлоридов, применяя восходящие элюирование метиловым спиртом (Rf . К —0,22 Ма — 0,44 Ы — 0,72) или смесью этанола с водой (9 1). Калин, рубидий и цезий можно отделить один от другого при. элюировании фенолом, насыщенным 20%-ной соляной кислотой. [c.241]
| Рис. 17.8. Разделение смеси ердечных гликозидов на силикагеле с привитыми н-октиль-ными группами. Элюент — гмесь этанола с водой (7 3) (=50°С |  |
Применение растворителя, образующего гетерогенный азеотроп с одним из комнонентов разделяемой смеси, может оказаться более целесообразным, чем растворителя, полностью смешивающегося с обоими компонентами исходной смеси, так как в этом случае для регенерации уводителя требуется меньше оборудования. Примером азеотропной перегонки с применением уводителя, образующего гетерогенный азеотрон, может служить разделение смеси этанола с водой путем добавки бензола или трихлорэтилена в качестве уводителя. [c.129]
Бис-циклогексаноноксалилдигидразон — белые кристаллы, хорошо растворимые в этаноле, смеси этанола с водой (1 1), метаноле н изобутиловом спирте. Нерастворим в воде, хлороформе, бензоле и тетрахлориде углерода. Реактив и его спирто-водные растворы устойчивы при хранении. [c.125]
Потенциометрическое определение кобальта в высоколегированных сталях и магнитных сплавах после его выделения фенилтиогидантоиновой кислотой [548]. Навеску сплава обрабатывают, как обычно, раствором соляной кислоты и затем окисляют раствором азотной кислоты. Далее прибавляют 30 мл 50%-ного раствора лимонной кислоты и раствор гидроокиси аммония (1 1) до щелочной реакции по лакмусу и осаждают горячим раствором фенилтиогидантоиновой кислоты (2 г в 60 мл горячей 50%-ной смеси этанола с водой). Отфильтровывают осадок и обрабатывают его вместе с фильтром серной и азотной кислотами, выпаривая и вновь добавляя азотную кислоту до разложения органических веществ. Затем разбавляют раствор до 60 мл и нейтрализуют избыток кислоты раствором гидроокиси аммония. Далее готовят цитратно-сульфатный раствор 500 г лимонной кислоты и 400 г сульфата аммония прибавляют к небольшому количеству воды, приливают 1575 мл раствора гидроокиси аммония (пл. 0,88), охлаждают и разбавляют водой до 2,5 л. К 200 мл этого цитратно-сернокислого раствора приливают анализируемый раствор, 0,05 М раствор феррицианида калия и оттитровывают избыток последнего потенциометрически стандартным 0,05 N раствором сульфата или нитрата кобальта. [c.194]
Некоторые циклические кетоны, например камфора, требуют применения избытка щелочи и более длительного нагревания. Если кетон не образует оксима ни по одному из описанных выше способов, то 1 г этого кетона следует обработать 1 г гидрохлорида гидроксиламииа, 4 г гидроксида калия и 20 мл 95%-иого этанола. Смесь кипятят с обратным холодильником 2 ч и выливают в 150 мл воды. Суспензию перемешивают и оставляют стоять до выделения ие вошедшего в реакцию исходного кетона. Раствор фильтруют, подкисляют соляной кислотой и оставляют стоять до кристаллизации оксима. Продукт перекристаллизовывают из этанола или из смеси этанола с водой. [c.207]
Бромирующий раствор получают следующим образом 15 г бромида калия растворяют в 100 мл воды и к этому раствору приливают 10 г брома. Полученный раствор медленно добавляют прн встряхивании к раствору 1 г фенола п воде, этаноле, ацетоне нлн дноксане. Бромирующий раствор прибавляют до окрашивания смеси в желтый цвет. Затем приливают около 50 мл воды н смесь энергично встряхивают для измельчения комков образовавшегося бромпроиз-Бодного. Его отфильтровывают, промывают разбавленным раствором бисульфита натрия н перекристаллизовывают нз этанола или нз смеси этанола с водой. [c.410]
В делительную воронку к 20,0 мл испытуемого слабокислого пли нейтрального раствора добавляют 2 мл раствора солянокислого гидроксил-амниа (10 г растворены в 100 мл воды), 2 мл раствора ацетата натрия (10 г СНзСООКа-ЗНгО растворены в 100 мл воды) и 4 мл раствора батофеиантролина [0,33 г реактива растворены в 100 мл смеси этанола с водой (1 1)]. Через 1 мин встряхивают с 20 мл хлороформа в течение 1 мин. Экстракцию повторяют, оба экстракта объединяют в мерную колбу вместимостью 50 мл. Добавляют к экстракту 0,5 г безводного сульфата натрия. Доводят объем хлороформом до метки, перемешивают, дают отстояться и измеряют оптическую плотность при 533 нм в кювете 5 см по хлороформу. [c.51]
Растворяют 0,1 г тонкорастертой пробы в платиновой чашке в 5 мл концентрированной НР и 4 мл h3SO4 (1 1) и нагревают до появления густых белых napoff. По охлаждении разбавляют 4—5 мл воды и нейтрализуют аммиаком (1 1) До слабого запаха. Слабо подкисляют добавкой НС1 (1 6), прибавляют 5 мл 15%-ного раствора ацетата аммоння и 2 мл 10%-ного раствора солянокислого гидроксиламина для восстановления Ре(1П). Переводят раствор в мерную колбу вместимостью 25 мл, добавляют 2 мл раствора батофеиантролина [0,35 г реактива растворены в 100 мл смеси этанола с водой (1 1)] и нагревают, пока все растворится. Посл охлаждения доводят до метки и измеряют оптическую плотность при 520 нм по холостой пробе. [c.53]
Растворяют 2 г пробы в колбе с обратным холодильником в 10—15 мл концентрированной HNO3, затем выпаривают досуха. Растворяют образовавшиеся соли в 2—3 мл воды. Снова выпаривают досуха и остаток растворяют в 50 мл 10 н. НС1. Охлаждают раствор в смеси этанола с водой до 0°С и пропускают через раствор при этой же температуре умеренный поток сернистого газа в течение 90 мнн для восстановления селена. Температура раствора прн этом не должна быть >5°С. Через [c.194]
Раствор 10 мг (0,05 ммоля) и-толилсульфонилметил-С -нитрозамида удельной активностью около 0,6 мкюри1ммолъ в 2 мл диэтилового эфира обрабатывают 2 мл охлажденного до 0° раствора 0,1 г гидроокиси натрия и смеси этанола с водой (10+1) и нагревают на водяной бане при 60—70° в токе азота. Перегнанный диазометан улавливают в две последовательно соединенные ловушки, содержащие каждая 1-2 мл охлажденного льдом диэтилового эфира. Оба эфирных раствора диазометана объединяют и сразу же используют для этерификации жирных кислот в смеси диэтилового эфира и метанола (9 + 1) [39, 47, 58]. [c.77]
Одним из характерных признаков, предопределяющих эффективность активатора, является значение электрического момента его диполя. С увеличением дипольного момента активатора, индукщюнный период комплексообразования уменьшается, выход апкана возрастает (табл. 2). Известно,.что карбамид в воде имеет дипольный момент 14,01 10" ° Кл -м, в ацентоне - 14,61 Кл -м, в этаноле с водой - [c.18]
Под атмосферным давлением температура кршения абсолютного этанола 78,38°. Состав бинарной азеотропной смеси этанола с водой 96,6 вес. % этанола и 4,4 вес. % воды,температура кипения ее 78,15°. Состав тройной азеотропной смеси 64 вес. % бензола, 31 вес. % этанола и 5% вес. % воды, температура кипения ее 69,7°. Состав бинарной азеотропной смеси этанола с бензолом 52,6 вес. % бензола и 47,4 вес. % этанола, темпера--тура кипения 72,5°. [c.158]
Автор в работе совместной с В. В. Александровым вычислил величины lgTo, и lgx в смесях метанола и этанола с водой. В таблице 90 приводим эти данные и вычисленные на их основании величины lgToн+ [c.794]
Величины 1дТон+ протонов в смесях этанола с водой рассчитаны другим путем Грюнвальдом. Он исходил из найденной им эмпирической зависимости влияния растворителей на силу кислот. [c.795]
Мы располагаем результатами значительного числа ггзмерений электрохимических свойств певодных растворов, но данные iro термохимическим свойствам этих систем до последних лет почти отсутствовали. До 1950 г. мояшо было назвать только несколько работ, в которых при одной температуре и в ограниченной зоне концентраций определены теплоты растворения некоторых щелочно-галоидных солей в нескольких органических растворителях и в смесях метанола и этанола с водой. Это было вызвано, в первую очередь, рядом затруднений, связанных с калориметрическим изучением неводных растворов [421. [c.143]
Несмотря на то, что методы осаждения, основанные на фотохимическом переведении определяемого элемента или вещества в осаждаемую форму, имеют отмеченный выше недостаток, они все же находят практическое применение. Например, Сингх и Патнаик [376] разработали метод отделения урана от железа и ванадия, основанный на фотохимическом восстановлении этанолом урана(У1) до ура-на(1У) в растворах, содержащих фторид аммония, и образовании малорастворимого фторида урана(1У). К анализируемому азотнокислотному раствору, содержащему 0,3—0,4 2 урана, прибавляют 2,5 г бифторида аммония, устанавливают pH = 2,0 2,5, вводят 45 мл этанола и разбавляют водой до 150 мл. Полученную смесь облучают солнечным светом 4—5 ч. Выделившийся осадок ЫН4 -ир4-Н20 отфильтровывают и промывают смесью этанола с водой (1 9). [c.115]
chem21.info
Этиловый спирт — Циклопедия
| Этиловый спирт | |
 | |
 | |
 | |
| Систематическоенаименование | Этанол |
| Традиционные названия | Этиловый спирт |
| Химическая формула | С2H5OH |
| Рац. формула | Сh4Сh3OH |
| Состояние | жидкость |
| Молярная масса | 46,069 г/моль |
| Плотность | 0,7893 г/см³ |
| Поверхностное натяжение | 22,39×10−3 Н/м при 20 °C Н/м |
| Т. плав. | -114,3 °C |
| Т. кип. | +78,4 °C |
| Т. всп. | 13 °C |
| Т. свспл. | +363 °C |
| Пр. взрв. | 3,28 — 18,95 % |
| Тройная точка | -114,3 °C, ? Па |
| Кр. точка | +241 °C, 63 бар |
| Мол. теплоёмк. | 112,4 Дж/(моль·К) |
| Энтальпия образования | −234,8 кДж/моль |
| pKa | 15,9 |
| Растворимость в воде | неограничена |
| Показатель преломления | 1,3611 |
| Дипольный момент | (газ) 1,69 Д |
| Рег. номер CAS | 64-17-5 |
| Рег. номер PubChem | 702 |
| SMILES | CCO |
| ЛД50 | 10 300 мг/кг |
| Токсичность | метаболит, малотоксичен |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |

 Этиловый спирт.
Этиловый спирт. Этиловый спирт (этанол, метилкарбинол, винный спирт) — одноатомный алифатический спирт, бесцветная легкоподвижная жидкость с характерным запахом и жгучим вкусом. Относится к сильнодействующим наркотикам, вызывающим сначала возбуждение, а затем паралич нервной системы. Имеет формулу Ch4Ch3OH (упрощённо: С2Н5ОН)[1].
Этиловый спирт получают сбраживанием пищевого сырья. С 1930-1950-х гг. были разработаны способы получения синтетического спирта гидратацией этилена и гидрированием ацетальдегида. Гидратация этилена стала основным способом производства этилового спирта в 1970-е гг.[2]
Этиловый спирт прижигает кожу и слизистые оболочки; при приёме внутрь угнетает центры торможения мозга, имеет наркотический эффект: вызывает опьянение, а при многократном употреблении вызывает алкоголизм. Также вредно воздействует на зародыш ребенка.
Физические свойства
Этиловый спирт — горючая прозрачная жидкость. Температура плавления = - 114.15 °С, температура кипения = 78,39 °С, плотность 0,7893 г/см³. [2] Молярная масса = 46,069.[3]
Химические свойства
Этанол смешивается во всех соотношениях с водой, спиртами, диэтиловым эфиром, глицерином, хлороформом, ацетальдегидом, бензином; образует азеотропные смеси с водой; бензолом; гексаном; толуолом; этилацетатом, а также тройные азеотропные смеси.
Этиловый спирт реагирует с щелочными металлами и с магнием с образованием этилатов и водорода.
Например при реакции с натрием Na образуется этилат натрия:
2C2H5OH + 2Na → 2C2H5ONa + Н2↑
Аналогично идёт реакция с калием K:
2C2H5OH + 2К → 2С2Н5ОК + Н2↑
Этанол вступает в реакцию гидрогалогенирования в присутствии хлорида цинка:
Ch4Ch3OH + HCl → Ch4Ch3Cl + h3O
При поджигании на воздухе этиловый спирт горит бледно-голубым, синеватым пламенем:
C2H5OH + 3O2 → 2CO2↑ + 3h3O
При нагревании в колбе с холодильником этанола с галогеноводородной кислотой, например с HBr (или смесью NаHBr и h3SO4, дающей при реакции бромистый водород), то будет отгоняться маслянистая жидкость — бромистый этил C2H5Вг:
C2H5OH + HBr → C2H5HBr + h3O
При нагревании с серной кислотой (при температуре меньше 120 °C), этиловый спирт превращается в диэтиловый эфир (реакция дегидратации):
2C2H5OH → C2H5-O-C2H5 + h3O
Вступает в реакцию дегидратации в присутствии серной кислоты при температуре больше 120 °C с образованием непредельного углеводорода:
Ch4Ch3OH → Ch3Ch3 + h3O
Этиловый спирт реагируя с карбоновыми кислотами в присутствии серной кислоты при нагревании приводит к реакции этерификации, например в реакции с уксусной кислотой образуется уксусно-этиловый эфир:
СН3СООН + С2Н5ОН → СН3СООC2H5 + h3O
Получение
Этанол получают в основном двумя способами: микробиологическим (спиртовое брожение) и синтетический (гидратация этилена):
Спиртовое брожение представляет собой биохимический процесс превращения сахара в спирт с выделением углекислого газа под воздействием дрожжей вида Saccharomyces cerevisiae и др., по формуле:
C6h22O6 → 2C2H5OH + 2CO2 + 27 ккал
Данный метод в основном применяется в пищевой промышленности, не только для производства этилового спирта, но и например при производстве хлебобулочных изделий, при этом дрожжи, выделяемый углекислый газ разрыхляет и поднимает тесто.
В химической промышленности, используют гидратацию этилена. Гидратацию можно вести по двум схемам:
Первый вариант — прямая гидратация при температуре 300 °C, давлении 7 МПа, в качестве катализатора применяют ортофосфорную кислоту, нанесённую на силикагель, активированный уголь или асбест:
Ch3=Ch3 + h3O → C2H5OH
Второй вариант — гидратация через стадию промежуточного эфира серной кислоты, с последующим его гидролизом (при температуре 80—90 °С и давлении 3,5 МПа:
Ch3=Ch3 + h3SO4 → Ch4-Ch3-OSO2OH (этилсерная кислота)
Ch4-Ch3-OSO2OH + h3O → C2H5OH + h3SO4
Реакция осложняется образованием диэтилового эфира.
Практическое значение
Этиловый спирт широко применяется в промышленности.
Этиловый спирт идёт на изготовление спиртных напитков.
Этанол является растворителем в лакокрасочной и фармацевтической промышленности, в производстве кинофотоматериалов, товаров радиоэлектроники и бытовой химии, взрывчатых веществ и пр.
Этот спирт служит сырьём для производств диэтилового эфира, хлороформа, тетраэтилсвинца, ацетальдегида, уксусной кислоты, этилацетата, этиламина, этилакрилатов, этилсиликатов и пр. Этиловый спирт — компонент антифриза, топливо для реактивных двигателей.
Для технических целей часто используют денатурированный спирт (денатурат) — спирт-сырец, содержащий добавки красителя, окрашивающего этиловый спирт в сине-фиолетовый цвет, и специфических веществ, придающих ему неприятный запах и вкус. Денатурат ядовит.
В медицине этиловый спирт применяется для дезинфекции, как поверхностное сосудорасширяющее средство, коагулянт белка, в том числе при лечении ожогов.
Этанол чрезвычайно гигроскопичен, при концентрации выше 70% (по объему) прижигает кожу и слизистые оболочки; при приёме внутрь угнетает центры торможения мозга, вызывает опьянение, при многократном употреблении вызывает алкоголизм.
ПДК в атмосфере воздухе 5 мг/м³, в воздухе рабочей зоны 1000 мг/м³.
Помимо признанного ВОЗ и ГОСТ наркотического действия, этиловый спирт обладает тератогенным действием (отрицательно воздействует на зародыш, см. в частности Зависимость числа дебилов от потребления алкоголя), его употребление многократно повышает риски преступности и психиатрических проблем, а также является одной из ведущих причин смертности в России (в частности, вследствие убийств, самоубийств и ведущих причин смертности — атеросклеротического кардиосклероза и нарушения мозгового кровообращения).
Источники
Ссылки
cyclowiki.org
Этанол | Наука | FANDOM powered by Wikia


Молекула этанола.
Этано́л (эти́ловый спирт, метилкарбинол, винный спирт, гидроксид пентагидродикарбония, часто просто «спирт») — C2H5OH или Ch4—Ch3—OH, второй представитель гомологического ряда одноатомных спиртов. Действующий компонент алкогольных напитков.
Существует 2 основных способа получения этанола — микробиологический (брожение и гидролиз) и синтетический:
Брожение  Править
Править
C6h22O6 → 2C2H5OH + 2CO2
В результате брожения получается раствор, содержащий не более 15 % этанола, так как в более концентрированных растворах дрожжи обычно гибнут. Полученный таким образом этанол нуждается в очистке и концентрировании, обычно путем дистилляции.
Спирто-водные растворы с концентрацией этанола 30-75 %, получаемые путём примитивной перегонки в домашних условиях, называются в России — самогон, на Украине — самогон, в Англии — виски, в Грузии — чача, в Японии — сётю.
Промышленное производство спирта из биологического сырья  Править
Править
Для гидролизного производства применяется сырьё, содержащее целлюлозу — древесина, солома.
- Отходами бродильного производства являются
барда и сивушные масла
Гидратация этилена  Править
Править
- В промышленности, наряду с первым способом, используют гидратацию этилена. Гидратацию можно вести по двум схемам:
- прямая гидратация при температуре 300 °C, давлении 7 МПа, в качестве катализатора применяют ортофосфорную кислоту, нанесённую на силикагель, активированный уголь или асбест:
Ch3=Ch3 + h3O → C2H5OH
- гидратация через стадию промежуточного эфира серной кислоты, с последующим его гидролизом (при температуре 80—90 °С и давлении 3,5 МПа):
Ch3=Ch3 + h3SO4 → Ch4-Ch3-OSO2OH (этилсерная кислота)
Ch4-Ch3-OSO2OH + h3O → C2H5OH + h3SO4
- прямая гидратация при температуре 300 °C, давлении 7 МПа, в качестве катализатора применяют ортофосфорную кислоту, нанесённую на силикагель, активированный уголь или асбест:
Эта реакция осложняется образованием диэтилового эфира.
Очистка этанола  Править
Править
Этанол, полученный путём гидратации этилена или брожением, представляет собой водно-спиртовую смесь, содержащую примеси. Для его промышленного, пищевого и фармакопейного применения необходима очистка. Фракционная перегонка позволяет получить этанол с концентрацией около 95.6 % об.; эта неразделимая перегонкой азеотропная смесь содержит 4.4 % воды (вес.) и имеет температуру кипения 78.2 °C.
Перегонка освобождает зтанол как от легколетучих, так и от тяжёлых фракций органических веществ (кубовый остаток).
Абсолютный спирт  Править
Править
Абсолютный спирт — этиловый спирт, практически не содержащий воды. Кипение при температуре 78,39 °C в то время как спирт спирт-ректификат, содержащий не менее 4,43 % воды кипит при температуре 78,15 °C. Получают перегонкой водного спирта, содержащего бензол, и другими способами. [1]
Внешний вид: в обычных условиях представляет собой бесцветную летучую жидкость с характерным запахом.
| Молекулярная масса | 46,069 а. е. м. |
| Температура плавления | −114,15 °C |
| Температура кипения | 78,39 °C |
| Критическая точка | 241 °C (при давлении 6,3 МПа) |
| Растворимость | смешивается с бензолом, водой, глицерином, диэтиловым эфиром, ацетоном, метанолом, уксусной кислотой, хлороформом |
| Показатель преломления | 1,3611 (температурный коэффициент показателя преломления 4,0·10−4, справедлив в интервале температур 10—30 °C) |
| Стандартная энтальпия образования ΔH | −234,8 кДж/моль (г) (при 298 К) |
| Стандартная энтропия образования S | 281,38 Дж/моль·K (г) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 1,197 Дж/моль·K (г) (при 298 К) |
| Энтальпия плавления ΔHпл | 4,81 кДж/моль |
| Энтальпия кипения ΔHкип | 839,3 кДж/моль |
| Температура, °C | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| ρ, г/см³ | 0,8062 | 0,7979 | 0,7893 | 0,7810 | 0,7722 | 0,7632 | 0,7541 |
| Массовое содержание C2H5OH, % | 1 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 |
| ρ, г/см³ | 0,99636 | 0,99453 | 0,99103 | 0,98780 | 0,98478 | 0,98187 | 0,97910 | 0,97643 | 0,97387 |
| Массовое содержание C2H5OH, % | 18 | 20 | 22 | 24 | 26 | 28 | 30 | 35 | 40 |
| ρ, г/см³ | 0,97129 | 0,96864 | 0,96592 | 0,96312 | 0,96020 | 0,95710 | 0,95382 | 0,94494 | 0,93518 |
| Массовое содержание C2H5OH, % | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| nD20 | 1,3396 | 1,3470 | 1,3535 | 1,3580 | 1,3612 | 1,3633 | 1,3646 | 1,3649 | 1,3642 | 1,3613 |
| Давление, кПа (мм. рт. ст.) | 0,133(1) | 0,667(5) | 1,333(10) | 2,666(20) | 5,333(40) |
| Tкип, °C | −31,3 | −12,0 | −2,3 | 8,0 | 19,0 |
| Давление, кПа (мм. рт. ст.) | 7,999(60) | 13,333(100) | 26,66(200) | 53,33(400) | 101,32(760) |
| Tкип, °C | 26,0 | 34,9 | 48,4 | 63,5 | 78,4 |
Смесь 96 % спирта и 4 % воды (95.57 % этанола + 4.43 % воды) является азеотропной — т. е. не разделяется при перегонке.
Топливо  Править
Править
Этанол может использоваться как топливо (в т. ч. для ракетных двигателей, двигателей внутреннего сгорания).
Химическая промышленность  Править
Править
Медицина  Править
Править
Файл:Ethanol antiseptic.jpg Парфюмерия и косметика  Править
Править
Является универсальным растворителем различных душистых веществ и основным компонентом духов, одеколонов и т. п. Входит в состав разнообразных лосьонов.
Пищевая промышленность  Править
Править
Наряду с водой, является необходимым компонентом спиртных напитков (водка, виски, джин и др.). Также в небольших количествах содержится в ряде напитков, получаемых брожением, но не причисляемых к алкогольным (кефир, квас, кумыс, безалкогольное пиво и др.). Содержание этанола в свежем кефире ничтожно (0,12 %), но в долго стоявшем, особенно в тёплом месте, может достичь 1 %. В кумысе содержится 1−3 % этанола (в крепком до 4,5 %), в квасе — от 0,6 до 2,2 %.
Растворитель для пищевых ароматизаторов.
Применяется как консервант для хлебобулочных изделий, а также в кондитерской промышленности.
Мировое производство этанола  Править
Править
| США | 13362,3 | 16117,92 | 19946,68 |
| Бразилия | 15078,42 | 15978,06 | 16977,49 |
| Китай | 3643,92 | 3795,12 | 3845,016 |
| Индия | 1746,36 | 1697,22 | 1897,56 |
| Франция | 827,82 | 907,2 | 948,78 |
| Германия | 268,38 | 430,92 | 764,31 |
| Россия | 748,44 | 748,44 | 649,02 |
| ЮАР | 415,8 | 389,34 | 387,07 |
| Великобритания | 400,68 | 351,54 | 279,72 |
| Испания | 298,62 | 298,62 | 463,05 |
| Таиланд | 279,72 | 298,62 | 352,67 |
| Колумбия | - | - | 279,72 |
| Весь мир: | - | 45927 | 50989,17 |
Производство этанола, млн. литров
В разных странах действуют следующие государственные программы применения этанола на транспорте:
В США «Энергетический Билль», подписанный Президентом Бушем в августе 2005 года предусматривает производство к 2012 году ежегодно 8 миллиардов галлонов этанола из зерна и 1 миллиард галлонов из целлюлозы (стебли кукурузы, рисовая солома, отходы лесной промышленности).
Строительство завода по производству этанола мощностью 40 млн. галлонов даёт экономике (на примере США):
- 142 млн. долл. инвестиций во время строительства;
- 41 рабочее место на заводе, плюс 694 рабочих места во всей экономике;
- Увеличивает местные цены на зерновые на 5—10 центов за бушель;
- Увеличивает доходы местных домохозяйств на 19,6 млн. долл. ежегодно;
- Приносит в среднем 1,2 млн. долл. налогов;
- Доходность инвестиций 13,3 % годовых;
В 2006 г. этаноловая индустрия дала экономике США:
- 160231 новых рабочих мест во всех секторах, включая 20000 рабочих мест в строительстве;
- Увеличила доходы домохозяйств на $6,7 миллиарда;
- Принесла $2,7 млрд. федеральных налогов и $2,3 млрд. местных налогов;
В 2006 году в США было переработано в этанол 2,15 миллиарда бушелей кукурузы, что составляет 20,5 % годового производства кукурузы. Этанол стал третьим по величине потребителем кукурузы после животноводства и экспорта. На этанол перерабатывается 15 % урожая сорго США.
В 2006 году этаноловая промышленность произвела 12 млн. тонн кормов. 75—80 % зерна было скормлено КРС, 18—20 % свиньям и 3—5 % птицам.
Производство барды этаноловой промышленностью США, метрических тонн в сухом весе.
| 2,3 млн. | 2,7 млн. | 3,1 млн. | 3,6 млн. | 5,8 млн. | 7,3 млн. | 9,0 млн. | 12 млн. | 20 млн. |
В 2005 году 30 % бензина в США продавалось в смеси с этанолом. В 2006 г. этанол производили 110 заводов в 19 штатах. Производство достигло рекордного уровня в 4,9 млрд. галлонов (18,52 млрд. литров), что на 25 % больше, чем в 2005 году. С 2000 г. производство этанола выросло более чем на 300 %.
За 2006 год было построено 15 новых заводов. Суммарная мощность новых заводов 1051 млрд. галлонов. В январе 2007 г. различных стадиях строительства находятся 73 завода, 8 заводов расширяют свои мощности. К 2009 году производство этанола в США вырастет более чем на 6 млрд. галлонов — до 11,622 млрд.
В 2005 году этанол составил около 20 % в топливном балансе Бразилии.
Этанол хорошо смешивается с водой, в отличие от бензина. Проблема расслаивания смеси бензина и этанола на данный момент не решена.
Автомобильный парк, работающий на этаноле  Править
Править
Смесь этанола с бензином обозначается буквой Е. Цифрой у буквы Е обозначается процентное содержание этанола. Е85 — означает смесь из 85 % этанола и 15 % бензина.
Смеси до 20 % содержания этанола могут применяться на любом автомобиле. Однако, некоторые производители автомобилей ограничивают гарантию при использовании смеси с содержанием более 10 % этанола. Смеси, содержащие более 20 % этанола, во многих случаях требуют внесения изменения в систему зажигания автомобиля.
Автопроизводители выпускают автомобили, способные работать и на бензине и на Е85. Такие автомобили называются «Flex-Fuel». В Бразилии такие автомобили называют «гибридными». В русском языке названия нет. Большинство современных автомобилей либо изначально поддерживают использование такого топлива, либо опционально, по соответствующему запросу.
В 2005 году в США более 5 млн. автомобилей имели Flex-Fuel двигатели. В конце 2006 г. в США эксплуатировалось 6 млн. автомобилей с Flex-Fuel двигателями. Общий автопарк составляет 230 млн. автомобилей.
1120 заправочных станций продают Е85 (январь 2007). Всего в США автомобильное топливо продают около 170 000 заправочных станций.
В Бразилии около 29 000 заправочных станций продают этанол.
Экономичность  Править
Править
Cебестоимость бразильского этанола (около 0,19 долларов США за литр) делает его использование экономически выгодным [1].
Экологические аспекты  Править
Править
Биоэтанол как топливо нейтрален в качестве источника парниковых газов. Он обладает нулевым балансом диоксида углерода, поскольку при его производстве путём брожения и последующем сгорании выделяется столько же CO2, сколько до этого было связано из атмосферы использованными для его производства растениями.
В 2006 году применение этанола в США позволило сократить выбросы около 8 млн. тонн парниковых газов (в СО2 эквиваленте), что примерно равно годовым выхлопам 1,21 млн. автомобилей.
Безопасность и регулирование  Править
Править
- Этанол — горючее вещество, его пары с воздухом взрывоопасны.
- Употребление спиртных напитков может привести к алкоголизму и даже к острому отравлению.
О налогообложении питьевого спирта смотрите статью Алкогольные напитки#Акциз.
Интересный факт  Править
Править
При отравлении метиловым спиртом лучшим антидотом является этиловый спирт в количестве 1-2г/кг, близком к смертельной дозе 4-12г/кг.
Картина отравления  Править
Править
Сила действия этанола зависит от дозы, привычки организма к токсиканту (гипертрофия печени) и степени индивидуальной экспрессии изоферментов, зависящей от генома.
Относится к наркозным средствам жирного ряда. В результате действия на кору головного мозга вызывает опьянение с характерным алкогольным возбуждением. В больших дозах вызывает наркотический эффект. Угнетающее действие на ЦНС обусловлено в первую очередь стимуляцией рецепторов ГАМК. При отравлении этанолом развивается гликогенолиз; характерны тошнота, рвота и дегидратация. Типичен дефицит тиамина, обусловленный нарушением всасывания.
При обычном отравлении (алкогольное опьянение) затрудняет сенсорные восприятия, понижает внимание, ослабляет память. При действии этанола характерно расстройство ассоциативных процессов, вследствие чего появляются дефекты мышления, суждений, дефекты ориентировки, самоконтроля, утрачивается критическое отношение к себе и окружающим событиям. Как правило, имеет место переоценка собственных возможностей. Рефлекторные реакции замедленные и менее точные. Часто появляется говорливость. В эмоциональной сфере - эйфория, понижение болевой чувствительности (анальгезия). Угнетаются спинномозговые рефлексы, расстраивается координация движений. В большой дозе возбуждение сменяется угнетением и наступает сон. При тяжелом отравлении этанолом наблюдается ступорозное или коматозное состояние; кожа бледная, влажная, дыхание редкое, выдыхаемый воздух имеет запах этанола, пульс частый, температура тела понижена.
Средняя смертельная доза — около 6-8 г/кг массы тела (на безводный спирт, для «нетренированного» организма). По некоторым источникам диапазон составляет от 4 до 12 г/кг.
Этанол при хроническом употреблении, даже в малых дозах, вызывает привыкание и зависимость (см. алкоголизм). Это вызывает дополнительные проблемы с обеспечением сохранности этанола и требует специального контроля и охраны складов этанола. Обычно склады находятся под надзором вневедомственной охраны.
Терапия острого отравления алкоголем  Править
Править
- немедленно вызвать врача
Промывание желудка до получения рвоты чистой водой, затем активированный уголь мелко-мелко истолочь (10-15 таблеток как минимум), растворить в воде, выпить.
Польза от длительного применения этанола в малых дозах  Править
Править
Последние исследования опровергли результаты многочисленных исследований по «благоприятному действию этанола на показатели кардиологической смертности». Оказалось, что при формировании групп «абстинентов» — в них вводили и лиц, «вынужденно воздерживающихся» от алкогольных напитков. Их здоровье которых было недостаточно крепким для длительной алкоголизации. Тем самым, они в дальнейшем рассмотрении — искусственно снижали показатели здоровья «сознательных абстинентов» («В мире науки» № 9 2006).
Несовместимость с лекарственными препаратами  Править
Править
Этот раздел добавлен неспециалистом на основе данных из интернета в виду очевидной важности информации о несовместимости этанола с лекарственными препаратами.
Алкоголь несовместим со многими лекарственными препаратами. Неоднократно описаны случаи летального исхода, причиной которого было однократное употребление больным алкоголя во время проводимого курса лекарственной терапии.
Алкоголь негативно воздействует на метаболизм и эффективность множества лекарств, например, усиливает побочные эффекты анальгетиков, приводит к пагубным последствиям в сочетании с антидепрессантами, нарушает надлежащее действие всех психотропных препаратов. Проблема также распространяется и на антигипертензивные средства, так как алкоголь потенцирует ортостатические падения артериального давления, а также гипогликемические средства и антикоагулянты, так как алкоголь индуцирует метаболические энзимы печени.
Описано множество случаев, когда даже 100 грамм водки в сочетании с такими обычными препаратами, как аспирин или амидопирин, вызывали тяжелейшие аллергические реакции, а также желудочные кровотечения. Фуразолидон, метронидазол, левомицитин и ряд антибиотиков могут вызывать нарушение сосудистого тонуса, сердечной деятельности и дыхания даже при незначительных количествах алкоголя. Поражения печени ускоряются при приеме с лекарствами, обладающими собственной гепатотоксичностью: сульфадимезина, тетрациклина, анаболических стероидов, пероральных контрацептивов и других лекарств. В сочетании с такими средствами, как димедрол, седуксен и другие, алкоголь может вызвать тяжелые психические реакции с галлюцинациями. При этом опасность несут не только крепкие напитки. Кажущееся безобидным пиво содержит биогенные амины, которые вызывают головные боли, гипертензию и поражения почек у некоторых его потребителей. По этой же причине употребление пива противопоказано больным, принимающим ингибиторы моноаминооксидазы.
Категорический запрет на прием алкоголя накладывается при лечении антибиотиками. 100 миллилитров пива — это тоже алкоголь. Даже небольшая концентрация алкоголя в крови резко снижает концентрацию антибиотика в крови и тканях. В лучшем случае это приведет к резкому росту инфекции и неизлеченности. Зачастую же это приводит к выработке устойчивых к этому антибиотику штаммов и персистенции инфекции, что чревато повторным, но уже более сложным и длительным курсом лечения.
Безусловно, алкоголь в сочетании с лекарствами не всегда дает столь болезненные реакции. Но стоит ли подвергать себя риску и ставить эксперименты? Только в одном из опубликованных списков насчитывается более 120 препаратов, которые в сочетании с алкоголем дают различные осложнения. Запомнить этот список сложно, да к тому же ежедневно появляются новые препараты (или старые с новыми названиями). Поэтому рекомендация для пациентов может быть крайне простой: любые алкогольные напитки (включая пиво) несовместимы с приемом любых медикаментов без прямого указания лечащего врача.
Виды и марки этанола  Править
Править
Ректификат (точнее, спирт-ректификат) — это очищенный путем ректификации этиловый спирт, содержит 95,57 %, химическая формула C2H5OH.
Формула этилового спирта часто используется в шутках. Например:
«Перегоним всю гуашь // на C2H5OH!».
«На сердце веселее // и радостней пейзаж, // когда в желудке плещется // C2H5OH».
- ↑ Статья «Абсолютный спирт» в БСЭ
- Страница 0 - краткая статья
- Страница 1 - энциклопедическая статья
- Разное - на страницах: 2 , 3 , 4 , 5
- Прошу вносить вашу информацию в «Этанол 1», чтобы сохранить ее
ru.science.wikia.com
Этиловый спирт Этанол водой - Справочник химика 21
Однако при добавлении третьего компонента, называемого разделяющим агентом, например этанола или фенола, характер разделения смеси может измениться. Этому же способствует понижение давления при ректификации. Так, полное разделение азеотропа этилового спирта и воды наступает, когда перегонка ведется при остаточном давлении 70 мм рт. ст. Разделяющий агент подбирают с таким расчетом, чтобы он с одним из компонентов смеси образовал второй азеотроп, кипящий при более низкой температуре, чем исход- [c.326] Известно, что при отсутствии воды хлор, бром и иод не окисляют металлы, фтороводород не действует на стекло и т. д. Катализаторы нередко отличаются избирательным действием, или селективностью. Например, при нагревании этилового спирта (этанола) протекают параллельно два процесса 1) дегидратация— отщепление воды (на 20%) и 2) дегидрирование — отщепление водорода (на 80%) [c.25]Этиловый спирт, содержащий воду, может быть обезвожен перегонкой водного этанола с бензолом. Ввиду токсичности бензола существенно, чтобы весь спирт, используемый для приготовления лекарств или для внутреннего [c.521]
Этиловый спирт (этанол, винный спирт) имеет характерный алкогольный запах, жгучий вкус. Обычный спирт содержит около 4,5% воды. Эта нераздельно перегоняющаяся, так называемая [c.165]
Этиловый спирт (этанол), или винный спирт, — бесцветная жидкость с плотностью 0,8 г/см , кипит при +78°, замерзает при —110,5° С, смешивается с водой в любых отношениях. [c.316]
Действие органического растворителя, например этанола или ацетона, на двухфазную смесь из воды и сильно гидрофобного соединения, например бутанола-1, совершенно отличается от действия того же растворителя на смесь воды с сильно гидрофильным соединением, например сахарозой. В первом случае растворимость увеличивается, а во втором уменьшается. Если сильноосновная или сильнокислотная ионообменная смола находится в равновесии со смесью из этилового спирта и воды, то концентрация спирта в растворе внутри смолы ниже, чем во внешнем растворе. Это показано в табл. 35 [30]. Отсюда следует, что коэффициенты распределения сильно гидрофильных соединений должны иметь более высокие значения в смесях этанол — вода, чем в чистой воде, что и показано в табл. 36. Значения С вычисляли из значений U [311, предположив, что V = 0,400 Уь- [c.251]
Еще Д. И. Менделеев в 1887 г. в работе Соединение этилового спирта с водой [177] изучал плотность смесей воды с этанолом и наблюдаемое при этом отклонение от аддитивности объяснял образованием сольватов различного состава. Это явилось толчком для развития физико-химического анализа жидких систем. [c.133]
Этиловый спирт этанол, винный спирт) имеет характерный алкогольный запах, жгучий вкус. Обычный спирт содержит около 4,5% воды. Эта нераздельно перегоняющаяся, так называемая азеотропная смесь кипит при температуре 78,15°С (760 мм рт. ст.). [c.174]
Этиловый спирт(этанол) Летуч, смешивается с водой, инактивируется неионогенными ПАВ Консервант оральных лекарств с pH [c.352]
При сгорании спиртов развивается меньшая температура, что облегчает создание надежно работающего двигателя. Кроме того, спирты имеют более высокую теплоемкость и скрытую теплоту испарения, чем нефтепродукты. Это обстоятельство, а также высокое относительное содержание спиртов в готовых топливных смесях (до 40—50%) дает возможность с успехом использовать спирты для охлаждения стенок камеры сгорания. Этиловый спирт (этанол) СгН ,ОН имеет температуру кипения 78° С и очень низкую температуру замерзания —П4. Обычно применяют спирт ректификат, содержащий около 6% воды по весу плотностью около 0,814 или же водные растворы спирта еще меньшей концентрации. При смешении этилового спирта с водой из-за гидратации (образования групп молекул С2Н5ОН-л НгО) происходит уменьшение объема и плотность оказывается повышенной. Добавление воды в спирт, при определенных условиях может играть положительную роль, так как она понижает температуру сгорания и одновременно увеличивает газообразование и массу отбрасываемого вещества. [c.122]
Этиловый спирт (этанол) С2Н5ОН является жидкостью, кипящей при 78,3 °С с воздухом образует взрывоопасные смеси в пределах концентраций 3—20% (об.). С водой дает азеотропную смесь, содержащую 95,6% спирта и кипящую при 78,1 °С. В виде такого ректификата этанол обычно и употребляют в технике. [c.187]
Этиловый спирт (этанол) С2Н5ОН — бесцветная жидкость. Горит слабосветящимся пламенем. С водой смешивается во всех отношениях. Спирт с содержанием воды 4—4,5%. называется ректификатом, а спирт, содержащий только доли процента воды, называется абсолютным спиртом. Такой спирт получают химической обработкой Б присутствии водоотнимающих средств (СаО, безводного купороса USO4 и др.). [c.111]
ЭТИЛОВЫЙ СПИРТ (этанол, винный спирт) СгНзОН является ва 1 1ейшим представителем одноатомных спиртов, бесцветная жидкость, со жгучим вкусом, с характерным запахом, т. кип. 78,39 С, замерзает при —110,5 С, смешивается в любых отношениях с водой, спиртами эфирами, глицерином, бензином и другими органическими растворителями, го- [c.294]
Этиловый спирт (этанол, или винный спирт) С2Н5ОН. Представляет собой бесцветную жидкость с характерным запахом и жгучим вкусом (табл. 11). Смешивается в любых отношениях с водой от основной массы воды может быть отделен дробной перегонкой (ректификацией), но при этом образуется нераздельнокипящая смесь (темп. кип. 78,13° С), в которой содержится около 4% воды. Содержание (крепость) спирта выражают в объемных процентах. Крепость обычного чистого спирта — ректификата — равна 96%. Для получения совершенно безводного абсолютного) спирта ректификат обрабатывают веществами, химически связывающими воду (негашеная известь, безводный сульфат меди, металлический кальций). [c.114]
Наиболее практически важен этиловый спирт этанол, С2Н5ОН), называемый иначе винным. Получают его синтетически или путем сбраживания природных продуктов, содержащих в своем составе крахмал или сахар. С водой этанол (т. пл. —117°С, т. кип. +78 °С) смешивается во всех отношениях. [c.316]
Реактивы и оборудование этиловый спирт (этанол) 95%-ный ме-1иловый спирт (метано.ч) хлороформ Н2504 (конц.) вода дистиллированная. [c.169]
Этиловый спирт (этанол, винный спирт) С2Н5ОН — бесцветная, легко подвижная жидкость со жгучим вкусом, т. кип. 78 °С, смешивается в любых отношениях с водой, спиртами, эфиром, глицерином и другими растворителями, горит бесцветным пламенем. Э. с. образует со многими соединениями азеотропные смеси. Проявляет все химические свойства спиртов. При пропускании паров Э. с. над катализаторами при 400 С образуется бутадиен-1,3 (дивинил) (способ Лебедева) [c.160]
Для выполнения реакции к раствору ацетата (или к твердой соли) прибавляют немного концентрированной Н2504 и этилового спирта (этанола). Нагревают смесь на кипящей водяной бане в течение 1—2 мин и выливают смесь в стакан с холодной водой. В присутствии иона СН3СОО- появляется запах этилацетата. [c.87]
При фракционной перегонке (ректификации) жидкости сбраживания ( бражки ) получают смесь этилового спирта с водой, так называемый спирт-ректификат с т. кип. 78,15 °С, который содержит около 95,5% этанола и 4,5% воды. Получить безводный этанол можно химическим способом при связывании воды СаО, Na или азеот-ропным методом. Так называемый абсолютный спирт имеет т. кип. 78,4 С. [c.295]
ЭТАНОЛО-ВОДНЫЕ СМЕСИ. ОГНЕОПАСНОСТЬ, Смеси этилового спирта с водой широко применяются в различных отраслях народного хозяйства. Характеристики огнеопасности смесей этилового спирта с водой приводятся ниже по данным М. Г. Годжелло. [c.747]
Спирты также являются ыьными раствсрнтеля-ми. Обычный, этиловый спирт (этанол) среди них наиболее распространен. В лосьонах для лица часто используют 15 - 25%-ную смесь воды и спирта. По [c.124]
При наличии ()Инарной смеси с азеотропной точкой и ограниченно растворимого третьего комионента ие всегда образуется тройная смесь с азеотропной точкой. Так, изоамиловый спирт ограниченно растворим в воде, а смесь этанол — вода имеет азеотропную точку. Однако тройная смесь изоамиловый спирт — этанол — вода не имеет азеотропной точки это объясняется тем, ЧТС1. 4. с. этанол — вода имеет более низкую температуру кипения, чем изоамштовЕлй спирт — вода в присутствии этано.па. Это обстоятельство но-зво.г1яет отделить изоамиловый спирт от смеси этанол — вода и практически используется для удаления сивушного мас ла в процессе ректификации этилового спирта брожения. [c.27]
В предыдущем разделе мы рассмотрели азеотропы, образуемые этиловым спиртом и водой. Кроме воды, многие другие вещества образуют с этиловым спиртом азеотропы, играющие значительную роль в процессе ректификации и особенно абсо-лютирования этанола. [c.33]
Этиловый спирт (этанол, винный, или пищевой, спирт) С2Н5ОН. Это бесцветная легкоподвижная жидкость с характерным запахом, специфическим вкусом, горит слабосветящим пламенем. Смешивается с водой во всех отношениях — при этом происходит уменьшение общего объема например, 52 объема спирта и 48 объемов еоды дают 96,3 объема разбавленного спирта. Является растворителем для многих веществ. Физические константы см. в табл. 15. [c.90]
Этиловый спирт (этанол), С2Н5О, м. м. 46,07, бесцветная жидкость с характерным спиртовым запахом, /кип 78,39 °С, tnп П2 °С, 1,3611, с 4 0,79356. Обычный этиловый спирт ( кип 78,15 °С) содержит около 4,5 % воды. [c.24]
Как изменится скорость сольволиза грег-бутил-хлорида в каждом из указанных растворителей по сравнению со скоростью сольволиза в этаноле (просто указать — быстрее или медленнее) уксусная кислота 90% ацетона —10% воды 507о этилового спирта — 50% воды грег-бутиловый спирт [c.95]
Этиловый спирт (этанол) С2Н5ОН. Прозрачная бесцветная горючая жидкость с характерным запахом. Плотность 0,790 г/см (при 20°С). Температура кипения 78,3° С. Смешивается во всех соотношениях с водой, бензолом. Растворяет большинство органических соединений. [c.18]
Этиловый спирт—(этанол) кипит при 78,3°С смесь С2Н5ОН [30% (об.)] с воздухом взрывоопасна с водой спирт образует азеотропную смесь, содержащую 95,6% С2Н5ОН кипящую при 78,1 °С. Этиловый спирт широко применяется в пищевой и медицинской промышленности, является компонентом жидкостного ракетного топлива, антифризом и т. д. Особенно широко этанол, используется как полупродукт органического синтеза, и, в частности, [c.327]
Этиловый спирт (этанол) С2Н5ОН — жидкость ( кип = 78,4 °С, 4атв=114,2°С). Хорощо растворяется в воде. Водный раствор, содержащий 95,6% С2Н5ОН, представляет собой азеотропную смесь, кипящую при 78,1 °С. [c.215]
Лоскольку в процессе рекуперации часть растворителя теряется (относительно велики потери спирта), требуется добавлять их. Так как в техническом этиловом спирте содержится вода и осушить его сравнительно сложно, спирт добавляют обычно перед подачей влажного метиленхлорида в осушительную колонну, и в таком количестве, чтобы в смеси (после осушения) этанола было больше расчетного, необходимого для получения прядильного раствора (т. е. немногим более 10%). Это делается для того, чтобы при получении смеси растворителей нужного состава добавлять сухой метиленхлорид, а не спирт, всегда содержащий некоторое количество воды. Как указывалось выше, вода в прядильном растворе влияет отрицательно на его качество, процесс формования и свойства получаемого волокна. [c.169]
Этиловый спирт (этанол) С2Н5ОН является жидкостью, кипящей при 78,3°С с воздухом образует взрывоопасные смеси в пределах концентраций 3—20 объемн.%. С водой дает азеотропную [c.266]
Этиловый спирт (этанол) oHgOH — бесцветная жидкость (плотность 0,789 г/сж т. кип. 78,4 °С т. затв. —112 °С). Во всех соотношениях смешивается с водой смесь 95,5% спирта и 4,5% воды (спирт-ректификат) имеет постоянную температуру кипения 78,15 °С. [c.11]
Этиловый спирт — этанол С2Н5ОН — представляет собой жидкость с характерным запахом и жгучим вкусом. Его температура кипения 78,3° С, температура замерзания—112° С и уд. вес при 20° С—0,789. Этиловый спирт в воде растворяется во всех отношениях и образует с ней азеотропную смесь, содержащую 95,6% спирта с температурой кипения 78,ГС. Его пары с воздухом взрывоопасны, предел взрываемости 4—14% (объемных). [c.260]
Этиловый спирт (этанол) называют иначе винным спиртом, или просто спиртом. Ои представляет собой бесцветную жидкость, имеющую удельный вес 0,8, кипяшую при температуре 78,3°, со своеобразным запахом. С водой смешивается в любой пропорции. Хорошо растворяет многие неорганические и органические вещества. Продажный спирт-ректификат содержит 96% спирта и 4% воды. [c.314]
Этиловый спирт (этанол, винный спирт) С2Н5ОН — бесцветная жидкость, неограниченно растворяется в воде. Т.кип. 78 °С. Применяется как растворитель и консервант. В больших дозах — сильный яд. [c.276]
Реакция окисления нитрозобензолов в соответствующие нитробензолы с помощью надуксусной кислоты в водном этаноле меет первый порядок по каждому реагенту [302]. Реакция ускоряется при наличии электронодонорных заместителей в пара-положении и при замене этилового спирта (растворитель) водой электроноакцепторные заместители в пара-положе-пии замедляют реакцию. По всей вероятности, с более сильными надкислотами реакция протекает быстрее так, хлорнадуксусная кислота и кислота Каро окисляют нитрозобензол быстрее, чем надуксусная кислота. Механизм, находящийся в согласии с этими фактами, требует, чтобы реакция начиналась нуклеофильной атакой атома азота нитрозогруппы внешним атомом кислорода надкислоты с переходным состоянием, в которое входит надкис-лота, нитрозосоединение и молекула растворителя. Этот механизм подтверждается также направлением и величиной эффекта заместителей (р = —1,58), величинами энергии и энтальпии активации окисления нитрозобензола [Ёа = 16,1 ккал/моль Л5+= — 22 кал/(моль-град)] и отсутствием кислотного катализа. [c.196]
chem21.info
Этиловый спирт с водой - Справочник химика 21
При смешивании этилового спирта с водой наблюдается уменьшение их объема. Так, например, при смешивании 50 объемов спирта и 50 объемов воды получаются 96,4, а не 100 объемов смеси. Степень сжатия водно-спиртового раствора зависит от соотношения спирта и воды. Величина сжатия, вычисленная Г. И. Фертманом для температуры 20° С, приведена в табл. 40. [c.54]Тепловой эффект при смешивании этилового спирта с водой [c.68]
При смешивании этилового спирта с водой выделяется тепло, вследствие чего температура раствора повышается. Количество выделенного тепла зависит от соотношения количеств смешиваемых спирта и воды и от температуры. Теплота, выделенная при получении [c.68]Величина сжатия при смешивании этилового спирта с водой при температуре 20°С [50, 116] [c.54]
Водно-спиртовые растворы являются очень сложными и недостаточно нартенными системами. Их физическим свойствам присущи многре особёиностн, причины которых еще не получили объяснения. Так, например, при смешивании этилового спирта с водой объем полученной смеси меньше суммы объемов спирта и воды. Это явление сжимаемости (сжатия) называется контракцией. Величина сжатия вначале возрастает с увеличением концентрации спирта, достигает максимума при содержании его в растворе 46% мае., а затем снова уменьшается. [c.36]
При сгорании спиртов развивается меньшая температура, что облегчает создание надежно работающего двигателя. Кроме того, спирты имеют более высокую теплоемкость и скрытую теплоту испарения, чем нефтепродукты. Это обстоятельство, а также высокое относительное содержание спиртов в готовых топливных смесях (до 40—50%) дает возможность с успехом использовать спирты для охлаждения стенок камеры сгорания. Этиловый спирт (этанол) СгН ,ОН имеет температуру кипения 78° С и очень низкую температуру замерзания —П4. Обычно применяют спирт ректификат, содержащий около 6% воды по весу плотностью около 0,814 или же водные растворы спирта еще меньшей концентрации. При смешении этилового спирта с водой из-за гидратации (образования групп молекул С2Н5ОН-л НгО) происходит уменьшение объема и плотность оказывается повышенной. Добавление воды в спирт, при определенных условиях может играть положительную роль, так как она понижает температуру сгорания и одновременно увеличивает газообразование и массу отбрасываемого вещества. [c.122]
В настоящее время имеется небольшое число надежных данных о уон+ в ряде спиртов, в смесях метилового и этилового спиртов с водой, в муравьиной кислоте и в аммиаке. На основании этих данных можно получить представления о кислотности, выраженной в единой шкале. [c.419]
На рис. 109 приведена зависимость полноты испарения X жидкостей от времени т и относительного расхода впр по экспериментальным данным. Так, при медианном диаметре капель этилового спирта, смеси этилового спирта с водой и водного аммиака =15 мкм продолжительность испарения капель спектра распыливания этих жидкостей находится в пределах от т=0,0125 с (этиловый спирт) до т=0,022 с (водный аммиак). На полное испарение капли воды необходимо время т>0,06 с. [c.260]При более высоких значениях полноты испарения водного аммиака и смеси этилового спирта с водой (л =0,90- 0,97) снижение температуры воздуха составило 20—45°С. [c.263]
Смесь этилового спирта с водой 27,53 + 1, 430 [c.263]
Как видно из рис. 112, для исследуемого ГТД максимальный расход охлаждающих жидкостей составил этилового спирта 0,0085 кг/кг сухого воздуха, смеси этилового спирта с водой 0,020 кг/кг сухого воздуха. Относительный расход водного аммиака и воды не достигал максимально допустимых пределов, так как с увеличением относительного расхода этих жидкостей наблюдалась больщая неполнота испарения их, что могло привести при длительной работе ГТД к эрозионному изнашиванию деталей компрессора. [c.265]
Частота вращения ротора уменьшается менее значительно при подаче водного аммиака, чем при подаче воды, а смесь этилового спирта с водой при впр >0,015 кг/кг сухого воздуха приводит к увеличению частоты вращения. Заметно отличается влияние впрыска этилового спирта на массовый расход воздуха. При работе ГТД с подачей этилового спирта и неизменном количестве основного топлива, подаваемого в форкамеры, частота вращения ротора увеличивалась до 41 ООО об/мин, что и привело к более заметному повышению массового расхода воздуха. [c.265]
Однако применение этилового спирта для форсирования мощности наземных ГТД длительное время может оказаться неприемлемым по экономическим показателям, а также вследствие значительного повышения температуры продуктов сгорания перед газовой турбиной. Поэтому практически для форсирования мощности ГТД можно применять конденсат, химически обработанную воду, водный аммиак и смесь спирта с водой в летний период времени — конденсат и воду, а зимой — водный аммиак и смесь этилового спирта с водой. [c.269]
Характер тепловых диаграмм прн охлаждении ГТД смесью спирта с водой отличается от диаграмм, снятых при испарительном охлаждении впрыскиванием воды. При одинаковом относительном расходе смеси спирта с водой и воды тепловое состояние контрольного участка форкамеры при подаче смеси выше по сравнению с тепловым состоянием при подаче воды. Этого и следовало ожидать, так как теплота испарения воды примерно в 2,5 раза выше теплоты испарения смеси этилового спирта с водой. [c.280]
Приближенным правилом аддитивности объемов следует пользоваться с осторожностью. В рассмотренном примере истинная молярность полученного раствора оказывается равной 1,80 М. Значит, это приближенное правило позволяет определить молярность с ошибкой 3,3%. Но для жидкостей, молекулы которых сильно взаимодействуют между собой, как, например, этиловый спирт с водой, полный объем после смешения может значительно уменьшиться вследствие притяжения молекул. Приближенным правилом аддитивности объемов можно пользоваться только для грубой предварительной оценки молярности растворов. [c.78]
Необходимо отметить, что при смешивании этилового спирта с водой происхЬдит сжатие смеси, называемое явлением контрактации. [c.12]
В этом параграфе речь пойдет о важном в термодинамике растворов понятии о парциальных мольных величинах. Отчасти о них уже шла речь в гл. V в связи с химическим потенциалом, являющимся, с другой стороны, парциальным мольным изобарным потенциалом. Остановимся на этом понятии подробно. Допустим, речь идет об объеме раствора. Равен ли он сумме объемов компонентов Вообще говоря, не равен. Например, при смешении этилового спирта с водой общий объем уменьшается. Объем раствора может быть и меньше и больше, суммы объемов компонентов, взятых в отдельности. Но все-таки каждый компонент вносит свой вклад в объем или другое экстенсивное свойство раствора (например, энергию и т. д.). Для оценки этого вклада и применяются парциальные мольные величины. [c.264]
Так как температура вспышки близка к температуре воспламенения, то можно для вычислений температуры вспышки и пределов воспламенения воспользоваться результатами, полученными для определения температуры воспламенения. Такая попытка оказалась успешной для индивидуальных жидкостей и для смеси этилового спирта с водой. Целесообразно сделать такую попытку и в отношении смесей горючих жидкостей. Для этого следует воспользоваться формулой (1.27), определить постоянную Л и по соотношению (1.3) вычислить предел воспламенения к смесей. [c.46]
Типичными примерами таких смесей являются смеси этилового спирта с водой и этилового спирта с бензолом. [c.552]
Данные анализа этого препарата на содержание углерода, водорода, азота и серы прекрасно совпадают с вычисленными значениями. После двух дополнительных кристаллизаций из смеси этилового спирта с водой (10 мл спирта и 10 мл воды на 1 г) температура плавления повышается до 183—185° (с разложением). На температуру разложения несколько влияет скорость нагревания указанные значения были получены для образца, который помещали в прибор для определения точки плавления при 160, а температуру бани повышали со скоростью 8" в минуту. [c.28]
Для разбавления экстракта оказались эффективными ледяная уксусная кислота, а также равные объемы этилового спирта с водой. В последнем случае хорошим электролитом оказалась 0,5—0,6 М НЫОз, но концентрация Н1 0з должна поддерживаться постоянной, так как она влияет на высоту волны урана. [c.200]
Азеотроп этилового спирта с водой содержит 4,4 вес. % воды и перегоняется (без изменения состава) при температуре 78,15° С. [c.299]Контактную жидкость наносят кистью вдоль линии перемещения преобразователя. Брызги и подтеки контактной жидкости в направлении прозвучивания должны быть удалены, так как жидкость влияет на распространение нормальных волн. К чистоте поверхности ОК предъявляются повышенные требования. В качестве контактной жидкости рекомендуется использовать 30 %-ную смесь этилового спирта с водой. [c.426]
Полученные результаты удовлетворительно согласуются с опытом [2, с. 54]. Это хорошо видно, например, из рис. 1.2. Экспериментальные точки — результаты измерений фотографических снимков пламен различных смесей этилового спирта с водой, сгоравших в стеклянной горелке диаметром 22 мм. Сплошная кривая проведена в соответствии с уравнением, описывающим форму ламинарного диффузионного пламени. [c.12]
В литературе приводятся данные о зависимости температуры вспышки смесей этилового спирта с водой и с четыреххлористым углеродом, но отсутствие необходимых сведений о парциальных давлениях пара этих смесей при различных температурах не дает возможности сопоставить результаты, вытекающие из уравнений (1.30), с только что упомянутыми результатами опытов. [c.45]
Полученные результаты удовлетворительно согласуются с опытом. Это хорошо видно из рис. 4. По оси абсцисс отложена величина г Я, а по оси ординат — безразмерная координата 2/6, различными значками обозначены результаты измерений фотографических снимков пламен разных смесей этилового спирта с водой, сгоравших в стеклянной горелке диаметром 22 мм. Сплошная линия на рисунке проведена по формуле (2.12). Опытные точки достаточно хорошо располагаются около теоретической кривой. [c.54]
Представляют интерес данные опытов сгорания смесей, одним из компонентов которых является горючая, а другим — негорючая жидкость. Опыты проводили со смесями этилового спирта с водой, этилового спирта с четыреххлористым углеродом, бензина с четыреххлористым углеродом и бензина и керосина с водой. [c.94]
Остановимся на результатах работы со взаиморастворимыми жидкостями. Ознакомимся с данными по смесям этилового спирта с водой, сгоравшими в стеклянной горелке диаметром 7,7 мм. Во время этих опытов смеси, [c.94]
Епрсзн он — относительный расход этилового спирта или смеси этилового спирта с водой на испарительное охлаждение воздуха, кг/кг сухого воздуха [c.245]
В литературе имеются подробные данные о константах диссоциации примерно 50 кислот в смесях метилового и этилового спиртов с водой с содержанием от 20 до 95% спирта. В основном эти данные получены Михаэлисом и Митцутани, Брайт н Бриско. Их данные недостаточно точны, так как измерения во всех случаях производились в цепях с водным каломелевым электродом и полученные величины отнесены к бесконечно разбавленному водному раствору понов водорода как единому стандартному состоянию. Обычно при содержании до 85% спирта эти константы мало отличаются от истинных, но при большем его содержашш отличия достигают 1,5—2,5 единицы р Г, как показывает их сопоставление с данными Бардлея и Льюиса. Несмотря на эти недостатки, найденные величины правильно характеризуют относительную силу кислот в смесях. [c.278]
Такие же результаты наблюдались нами и для некоторых ионов (ионы рубидия и хинолина), мало сольватированных и мало изменяющих степень сольватации под влиянием растворителей. Гептери получил такие же простые соотношения для иона таллия в этилен-гликоле. Но уже для ионов натрия в смесях этилового спирта с водой не выполняется правило диф = onst, что, вероятно, является следствием изменения сольватации этих ионов. Этим же, но-видимому, объясняется наблюдавшееся Перачио и Мелох различное изменение высот волн ряда щелочных металлов при переходе к неводным растворителям. [c.467]
Исследование теплопроводности водных растворов этилового спирта проведено нами при атмосферном давлении для объемных концентраций 25, 38, 50, 65, 80, 94 и 98% этилового спирта. Смешение этилового спирта с водой производилось при +20° С. На рис. 9-2 нанесены наши экспериментальные значения теплопроводности растворов этилового спирта, значения теплопроводности 100% этилового спирта, определенные путем экстраполяции по данным для растворов от 25 до 987о состава (Л. 9-8], и теплопроводность воды по опытным данным Тимрота и Варгафтика [Л. 9-16]. [c.328]
Оксиэтилцеллюлоза (ОЭЦ) СбН7 02 (ОН)з д-[(ОСН2СН2) ,ОН]д. является продуктом взаимодействия целлюлозы с эталеноксидом, который реагирует не только с гидроксильными группами целлюлозы, но и с оксиэтильными группами. При этом образуется привитой сополимер целлюлозы и полиэтиленоксида. ОЭЦ хорошо растворяется в воде, смеси этилового спирта с водой (30 70 по массе), муравьиной кислоте, диме-тилсульфоксиде, этиленхлоргидрине. [c.22]
Бретчер [306] перегонял тетрахлорэтилен в вакуУме с целью избежать образования фосгена и сохранял его в темноте без доступа воздуха. Гринвальд [749] удалял 1,1,2-трихлорэтан и 1,1,1,2-тетра-хлорэтан из тетрахлорэтилена противоточным экстрагированием его смесями этилового спирта с водой. Очищенный препарат оказался более стойким по отношению к свету, теплу, влаге и окислению. [c.406]
При фракционной перегонке (ректификации) жидкости сбраживания ( бражки ) получают смесь этилового спирта с водой, так называемый спирт-ректификат с т. кип. 78,15 °С, который содержит около 95,5% этанола и 4,5% воды. Получить безводный этанол можно химическим способом при связывании воды СаО, Na или азеот-ропным методом. Так называемый абсолютный спирт имеет т. кип. 78,4 С. [c.295]
Рис. 16 дает зависимость Ок от состава смесей этилового спирта с водой, относящихся к несовершенным смесям второго типa . У смесей, богатых спиртом, состав пара одинаков с составом жидкой фазы паровая фаза остальных смесей богаче спиртом, чем жидкость. Отмеченной особенностью рассматриваемых смесей и объясняются результаты, содержащиеся в табл. 2.4 и относящиеся к этим смесям. [c.72]
chem21.info
Применение спиртов: все грани таинственного вещества!
Главная » Наука и техника » Применение спиртов...

Применение спиртов во многих сферах деятельности — медицине, косметологии, промышленности — делают эти органические соединения незаменимым продуктом для человека.
Спирты завораживают. Они многообразны. Способны приносить, подобно ядам, пользу и вред. Имеют загадочную этимологию: слово пришло в наш язык благодаря заимствованию английского spirit (от spiritus — лат. «душа, дух, дыхание»).
Содержание статьи:
История открытия
Хмельные напитки, в состав которых входит этанол — одноатомный винный спирт, знакомы человечеству с древности. Их готовили из меда и перебродивших фруктов. В древнем Китае в напитки добавляли также рис.
Спирт из вина был получен на Востоке (VI —VII вв.). Европейские ученые создали его из продуктов брожения в XI в. Российский царский двор познакомился с ним в XIV в.: генуэзское посольство презентовало его как живую воду («аква вита»).
Т.Е. Ловиц, русский ученый XVIII в., впервые получил опытным путем абсолютный этиловый спирт при перегонке с использованием поташа — карбоната калия. Для очистки химик предложил применять древесный уголь.
Благодаря научным достижениям XIX —XX вв. стало возможным глобальное использование спиртов. Ученые прошлого разработали теорию строения водно-спиртовых растворов, исследовали их физико-химические свойства. Открыли способы брожения: циклический и непрерывно-проточный.
Значимые изобретения химической науки прошлого, которые сделали реальным полезное свойство спиртов:
- ратификационный аппарат Барбе (1881)
- брагоперегонный тарельчатый аппарат Саваля (1813)
- разварник Генце (1873)
Был открыт гомологический ряд спиртовых веществ. Проведены серии экспериментов по синтезу метанола, этиленгликоля. Передовые научные исследования послевоенных лет XX века помогли улучшить качество производимой продукции. Подняли уровень отечественной спиртовой промышленности.
Распространение в природе
В природе спирты встречаются в свободным виде. Вещества также являются компонентами сложных эфиров. Естественный процесс брожения содержащих углеводы продуктов создает этанол, а также бутанол-1, изопропанол. Спирты в хлебопекарной промышленности, пивоварении, виноделии связано с использованием процесса брожения в этих отраслях. Большая часть феромонов насекомых представлена спиртами.

Спиртовые производные углеводов в природе:
- сорбит — содержится в ягодах рябины, вишни, имеет сладкий вкус.
Многие растительные душистые вещества — это терпеновые спирты:
- фенхол — компонент плодов фенхеля, смол хвойных деревьев
- борнеол — составной элемент древесины борнеокамфорного дерева
- ментол — компонент состава герани и мяты
Желчь человека, животных содержит желчные многоатомные спирты:
- миксинол
- химерол
- буфол
- холестанпентол
Вредное воздействие на организм
Повсеместное использование спиртов в сельском хозяйстве, промышленности, военном деле, транспортной сфере делают их доступными для рядовых граждан. Это становится причиной острых, в том числе массовых, отравлений, летальных исходов.
Опасность метанола
Опасным ядом является метанол. Он токсично воздействует на сердце, нервную систему. Прием внутрь 30 г метанола приводит к смерти. Попадание меньшего количества вещества — причина тяжелых отравлений с необратимыми последствиями (слепотой).
Предельно допустимая его концентрация в воздухе на производстве — 5 мг/м³. Опасны жидкости, содержащие даже минимальное количество метанола.
При легких формах отравления проявляются симптомы:
- озноб
- общая слабость
- тошнота
- головные боли
По вкусу, запаху метанол не отличается от этанола. Это становится причиной ошибочного употребления яда внутрь. Как отличить этанола от метанола в домашних условиях?

Медную проволоку сворачивают спиралью и сильно накаляют на огне. При ее взаимодействии с этанолом чувствуется запах прелых яблок. Соприкосновение с метанолом запустит реакцию окисления. Станет выделяться формальдегид — газ с неприятным резким запахом.
Токсичность этанола
Этанол приобретает токсичные и наркотические свойства в зависимости от дозы, способа попадания в организм, концентрации, длительности воздействия.
Этанол способен вызвать:
- нарушение работы ЦНС
- кому
- рак пищевода, желудка
- гастрит
- цирроз печени
- болезни сердца
4—12 г этанола на 1 кг массы тела — смертельная разовая доза. Канцерогенным, мутагенным, токсичным веществом является ацетальдегид — основной метаболит этанола. Он изменяет мембраны клеток, структурные характеристики эритроцитов, повреждает ДНК. Изопропанол похож на этанол токсическим воздействием.
Производство спиртов и их оборот регулируются государством. Этанол не признан юридически наркотиком. Но его токсичное воздействие на организм доказано.
Особенно разрушительным становится влияние на головной мозг. Уменьшается его объем. Происходят органические изменения нейронов коры мозга, их повреждение и гибель. Возникают разрывы капилляров.
Нарушается нормальная работа желудка, печени, кишечника. При чрезмерном употреблении крепкого алкоголя появляются острые боли, диарея. Слизистая оболочка органов желудочно-кишечного тракта повреждается, застаивается желчь.
Ингаляционное воздействие спиртов
Общераспространенное использование спиртов во многих отраслях промышленности создает угрозу их ингаляционного воздействия. Токсичное воздействие исследовали на крысах. Получены результаты приведены в таблице.
| метанол | 3,2 % | 18—21 ч | летальный исход |
| 2,3 % | 8 ч | наркотический эффект | |
| 0,8 % | 8 ч | летаргия | |
| этанол | 3,2 % | 8 ч | частичная летальность |
| 2,2 % | 8 ч | глубокий наркоз | |
| 0,64 % | 8 ч | летаргия | |
| изопропанол | 1,2 % | 8 ч | летальность, 50 % |
| 1,2 % | 4 ч | наркотический эффект |
Пищевая промышленность
Этанол — основа алкогольных напитков. Его получают из сахарной свеклы, картофеля, винограда, злаковых культур — ржи, пшеницы, ячменя, другого сырья, содержащего сахар или крахмал. В процессе производства применяются современные технологии очистки от сивушных масел.
Содержание этилового спирта — основа классификации алкогольных напитков.
Они подразделяются на:
- крепкие с долей этанола 31—70 % (коньяк, абсент, ром, водка)
- средней крепости — от 9 до 30 % этанола (ликеры, вина, наливки)
- слабоалкогольные — 1,5—8 % (сидр, пиво).
Этанол является сырьем для натурального уксуса. Продукт получается при окислении уксуснокислыми бактериями. Аэрирование (принудительное насыщение воздухом) — необходимое условие процесса.
Этанол в пищевой промышленности не единственный спирт. Глицерин — пищевая добавка Е422 — обеспечивает соединение несмешиваемых жидкостей. Его используют при изготовлении кондитерских, макаронных, хлебобулочных изделий. Глицерин входит в состав ликеров, придает напиткам вязкость, сладкий вкус.
Применение глицерина благоприятно влияет на продукцию:
- клейкость макарон уменьшается
- консистенция конфет, кремов улучшается
- предотвращается быстрое зачерствение хлеба, проседание шоколада
- выпекание изделий происходит без налипания крахмала
Распространено использование спиртов как сахарозаменителей. Для этого по свойствам подходят маннит, ксилит, сорбит.
Парфюмерия и косметика
Вода, спирт, парфюмерная композиция (концентрат) — основные компоненты парфюмерных продуктов. Они используются в разных пропорциях. Таблица представляет виды парфюмерных изделий, пропорции главных составных частей.
| Духи | 96 % | 25-30 % |
| Дневные духи | 90 % | 5 — 25 % |
| Туалетная вода | 85 % | 6 — 15 % |
| Одеколон | 70 — 80 % | 6 % |
В производстве парфюмерной продукции этанол высшей очистки выступает растворителем душистых веществ. При реакции с водой образуются соли, которые выпадают в осадок. Раствор несколько дней отстаивается и фильтруется.
2-фенилэтанол в парфюмерной и косметической промышленности заменяет натуральное розовое масло. Жидкость обладает легким цветочным запахом. Входит в состав фантазийных и цветочных композиций, косметического молочка, кремов, эликсиров, лосьонов.
Основной базой многих средств по уходу является глицерин. Он способен притягивать влагу, активно увлажнять кожу, делать ее эластичной. Сухой, обезвоженной коже полезны крема, маски, мыла с глицерином: он создает на поверхности влагосберегающую пленку, сохраняет мягкость кожного покрова.
Существует миф: что использование спирта в косметике вредно. Однако эти органические соединения — необходимые для производства продукции стабилизаторы, носители активных веществ, эмульгаторы.
Спирты (особенно жирные) делают средства по уходу кремообразными, смягчают кожу и волосы. Этанол в шампунях и кондиционерах увлажняет, быстро испаряется после мытья головы, облегчает расчесывание, укладку.
Медицина
Этанол в медицинской практике используют как антисептик. Он уничтожает микробы, предупреждает разложение в открытых ранах, задерживает болезненные изменения крови.
Его подсушивающее, обеззараживающее, дубящее свойства — причина использования для обработки рук медицинского персонала до работы с пациентом. Во время искусственной вентиляции легких этанол незаменим как пеногаситель. При нехватке медикаментозных средств становится компонентом общей анестезии.
При отравлении этиленгликолем, метанолом этанол становится противоядием. После его приема уменьшается концентрация токсичных веществ. Применяют этанол в согревающих компрессах, при растирании для охлаждения. Вещество восстанавливает организм при лихорадочном жаре и простудном ознобе.
Спирты в лекарственных средствах и их воздействие на человека исследует наука фармакология. Этанол как растворитель используют при изготовлении экстрактов, настоек целебного растительного сырья (боярышника, перца, женьшеня, пустырника).

Принимать эти жидкие лекарственные средства можно только после врачебной консультации. Необходимо строго следовать предписанной медиком дозировке!
Топливо
Коммерческая доступность метанола, бутанола-1, этанола — причина использования их в качестве топлива. Смешивают с дизельным топливом, бензином, применяют как горючее в чистом виде. Смеси позволяют уменьшить токсичность выхлопных газов.
Спирт, как альтернативный источник горючего имеет свои минусы:
- у веществ повышенные коррозийные характеристики, в отличие от углеводородов
- если в топливную систему попадет влага, произойдет резкое снижение мощности из-за растворимости веществ в воде
- существует риск возникновения паровых пробок, ухудшения работы двигателя из-за низких температур кипения веществ.
Однако газовые и нефтяные ресурсы исчерпаемы. Поэтому применение спиртов в мировой практике стало альтернативой использования привычного топлива. Налаживается их массовое производство из отходов промышленности (целлюлозно-бумажной, пищевой, деревообрабатывающей) — одновременно решается проблема утилизации.
Промышленная переработка растительного сырья позволяет получить экологически чистое биотопливо — биоэтанол. Сырьем для него является кукуруза (США), сахарный тростник (Бразилия).
Положительный энергетический баланс, возобновляемость топливного ресурса делают производство биоэтанола популярным направлением мировой экономики.
Растворители, поверхностно-активные вещества
Кроме производства косметики, парфюмерии, жидких лекарственных средств, кондитерских изделий спирты еще являются хорошими растворителями:
Спирт как растворитель:
- при изготовлении металлических поверхностей, электронных элементов, фотобумаги, фотопленок
- при очистке натуральных продуктов: смол, масла, воска, жиров
- в процессе экстракции — извлечения вещества
- при создании синтетических полимерных материалов (клея, лака), красок
- в производстве медицинских, бытовых аэрозолей.
Популярные растворители — изопропанол, этанол, метанол. Также используют многоатомные и циклические вещества: глицерин, циклогексанол, этиленгликоль.
Поверхностно-активные вещества производят из высших жирных спиртов. Полноценный уход за автомобилем, посудой, квартирой, одеждой возможен благодаря ПАВ. Они входят в состав чистящих, моющих средств, используются во многих отраслях экономики (см. таблицу).
| Сельское хозяйство | Входят в состав эмульсий; увеличивают продуктивность процесса передачи растениям питательных веществ |
| Строительство | Уменьшают водопотребность бетона, цементных смесей; увеличивают морозостойкость, плотность материалов |
| Кожевенная промышленность | Предотвращают слипание, повреждения изделий |
| Текстильная промышленность | Снимают статическое электричество |
| Металлургия | Снижают трение; способны выдержать высокие температуры |
| Бумажная промышленность | Разделяют вареную целлюлозу от чернил в процессе переработки использованной бумаги |
| Лакокрасочная промышленность | Способствуют полному проникновению краски на поверхности, включая небольшие углубления |

Применение спиртов в пищевой промышленности, медицине, производстве парфюмерии и косметике, использование в качестве топлива, растворителей, поверхностно-активных веществ положительно сказывается на состояние экономики страны. Приносит удобство в жизнь человека, но требует соблюдения техники безопасности из-за токсичности веществ.
saovxlam.ru





















