1.6. Химические свойства серы. Сера вода
Сера, её физические и химические свойства. Биологическое значение серы, её применение (демеркуризация). СЕРА S
Cера в природе Самородная сера Сульфиды PbS - свинцовый блеск Cu2S – медный блеск ZnS – цинковая обманка FeS2 – пирит, серный колчедан, кошачье золото h3S – сероводород (в минеральных источниках и природном газе) Белки Сульфаты CaSO4 * 2h3O - гипс MgSO4 * 7h3O – горькая соль (английская) Na2SO4 *10h3O – глауберова соль (мирабилит) Физические свойства Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности), t°кип = 445°С. Одно из особенных физических свойств серы - флотация, способность мелкого порошка серы всплывать, тогда, как ее крупные кристаллы тонут в воде. Дело в том, что сера не смачивается водой, и ее частички держатся на поверхности воды за счет прилипших к ним мелких пузырьков воздуха. Это свойство используют при отделении самородной серы от примесей. Руду размалывают, заливают водой, а снизу продувают воздухом, сера всплывает, а примеси остаются на дне.Аллотропия Для серы характерны несколько аллотропных модификаций, но наиболее известные видоизменения: ромбическая (кристаллическая), моноклинная (игольчатая) и пластическая.
Взаимопревращение аллотропных модификаций серы Строение атома серы Размещение электронов по уровням и подуровням
Получение серы 1. Промышленный метод - выплавление из руды с помощью водяного пара. 2. Неполное окисление сероводорода (при недостатке кислорода). 2h3S + O2 = 2S + 2h3O 3. Реакция Вакенродера 2h3S + SO2 = 3S + 2h3O Химические свойства серы
Тренажёр №1 - Характеристика серы по её положению в периодической системе Д. И. Менделеева Тренажёр №2 - Химические свойства серы Тренажёр №3 - Взаимодействие серы с металлами Применение Вулканизация каучука, получение эбонита, производство спичек, пороха, в борьбе с вредителями сельского хозяйства, для медицинских целей (серные мази для лечения кожных заболеваний), для получения серной кислоты и т.д. Применение серы и её соединений Домашнее задание параграф 21; упражнения 1, 3, 4 стр. 99-100. Дополнительные зхадания Закончите уравнения реакций, расставьте коэффициенты методом электронного баланса, укажите окислитель, восстановитель.
№2. Осуществите превращения по схеме: 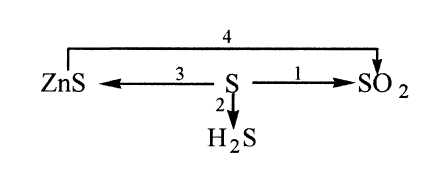 Это интересно...
Знаете ли вы..
| ||
1.6. Химические свойства серы
При комнатной температуре сера вступает в реакции только с ртутью. С повышением температуры её активность значительно повышается. При нагревании сера непосредственно реагирует со многими простыми веществами, за исключением инертных газов, азота, селена, теллура, золота, платины, иридия и йода. Сульфиды азота и золота получены косвенным путем.
Взаимодействие с металлами
Сера проявляет окислительные свойства, в результате взаимодействия образуются сульфиды:
Cu + S = CuS.
Взаимодействие с водородом происходит при 150–200 °С:
h3 + S = h3S.
Взаимодействие с кислородом
Сера горит в кислороде при 280 °С, на воздухе при 360 °С, при этом образуется смесь оксидов:
S + O2 = SO2;
2S + 3O2 = 2SO3.
Взаимодействие с фосфором и углеродом
При нагревании без доступа воздуха сера реагирует с фосфором, углеродом, проявляя окислительные свойства:
2P + 3S = P2S3;
2S + C = CS2.
Взаимодействие с фтором
В присутствии сильных окислителей проявляет восстановительные свойства:
S + 3F2 = SF6.
Взаимодействие со сложными веществами
При взаимодействии со сложными веществами сера ведет себя как восстановитель:
S + 2HNO3 = 2NO + h3SO4.
Реакция диспропорционирования
Сера способна к реакциям диспропорционирования, при взаимодействии со щелочью образуются сульфиды и сульфиты:
3S + 6KOH = K2S+4 O3 + 2K2S-2 + 3h3O.
1.7. Получение серы
Из самородных руд
При нагревании пирита без доступа воздуха
FeS2 = FeS + S.
Окислением сероводорода при недостатке кислорода
2h3S + O2 = 2S + 2h3O.
Из отходящих газов металлургических и коксовых печей, при нагревании в присутствии катализатора
h3S + SO2 = 2h3O + 3S.
1.8. Сероводород
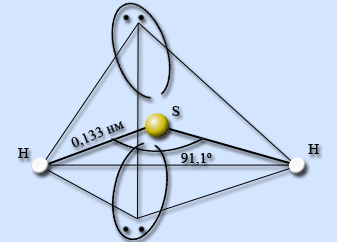
Водородное соединение серы – сероводород h3S. Сероводород – ковалентное соединение. Строение молекулы аналогично строению молекулы воды, атом серы находится в состоянии sp3-гибридизации, однако в отличие от воды молекулы сероводорода не образуют между собой водородных связей. Атом серы менее электроотрицательный, чем атом кислорода, имеет больший размер и, как следствие, меньшую плотность заряда. Валентный угол HSH составляет 91,1°, длина связи H – S равна 0,133 нм.
Физические свойства
При обычных условиях сероводород – бесцветный газ, с сильным характерным запахом тухлых яиц. Тпл = -86 °С,Ткип = -60 °С, плохо растворим в воде, при 20 °С в 100 г воды растворяется 2,58 мл h3S. Очень ядовит, при вдыхании вызывает паралич, что может привести к смертельному исходу. В природе выделяется в составе вулканических газов, образуется при гниении растительных и животных организмов. Хорошо растворим в воде, при растворении образует слабую сероводородную кислоту.
Химические свойства
В водном растворе сероводород обладает свойствами слабой двухосновной кислоты:
h3S = HS- + H+;
HS- = S2- + H+.
Сероводород горит в воздухе голубым пламенем. При ограниченном доступе воздуха образуется свободная сера:
2h3S + O2 = 2h3O + 2S.
При избыточном доступе воздуха горение сероводорода приводит к образованию оксида серы (IV):
2h3S + 3O2 = 2h3O + 2SО2.
Сероводород обладает восстановительными свойствами. В зависимости от условий сероводород может окисляться в водном растворе до серы, сернистого газа и серной кислоты.
Например, он обесцвечивает бромную воду:
h3S + Br2 = 2HBr + S.
взаимодействует с хлорной водой:
h3S + 4Cl2 + 4h3O = h3SO4 + 8HCl.
Струю сероводорода можно поджечь, используя диоксид свинца, так как реакция сопровождается большим выделением тепла:
3PbO2 + 4h3S = 3PbS + SO2 + 4h3O.
Взаимодействие сероводорода с сернистым газом используется для получения серы из отходящих газов металлургического и сернокислого производства:
SO2 + 2h3S = 3S + 2h3O.
С этим процессом связано образование самородной серы при вулканических процессах.
При одновременном пропускании сернистого газа и сероводорода через раствор щелочи образуется тиосульфат:
4SO2 + 2h3S + 6NaOH = 3Na2S2O3 + 5h3O.
studfiles.net
Соединения серы: формулы, свойства и примеры
Сера
В свободном состоянии сера – твердое кристаллическое вещество желтого цвета. Для серы характерно явление аллотропии, т.е. существование в виде нескольких простых веществ – аллотропных модификаций. Аллотропные модификации серы – ромбическая (наиболее устойчивая), моноклинная и пластическая. Молекулы серы в ромбической модификации состоят из 8-ми атомов.
Сера относится к семейству p-элементов. Электронная конфигурация серы [Ne]3s23p4. Для серы характерно наличие трех степеней окисления «-2», «+4» и «+6».
Для получения серы используют реакцию Вакенродера (1) или получают ее неполным окислением сероводорода (2):
2h3S + SO2 = 3S↓ + 2h3O (1)
h3S + O2 = 2S↓ + 2h3O (2)
Из-за наличия нескольких степеней окисления сера способна проявлять и окислительные (в реакциях с металлами) и восстановительные (в реакциях с сильными окислителями) свойства:
Fe +S = FeS
Fe0 -2e = Fe2+ — процесс окисления (восстановитель)
S0 +2e = S2- — процесс восстановления (окислитель)
S + O2 = SO2
S0 – 4e = S4+ — процесс окисления (восстановитель)
O20 + 2e = 2O2- — процесс восстановления (окислитель)
Сера взаимодействует с концентрированными растворами кислот (растворяется в них) и со щелочами (диспропорционирует):
S +2h3SO4 = 3SO2 + 2h3O
3S + NaOH = K2SO3 + 2K2S + 3h3O
Сероводород. Сероводородная кислота. Сульфиды
При нагревании серы с водородом происходит обратимая реакция в результате которой выделяется сероводород – бесцветный газ с запахом тухлых яиц, ядовитый и плохо растворимый в воде:
S + h3 ↔h3S ↑
Однако, выход сероводорода в этой реакции невелик и для его получения чаще всего используют реакцию действия разбавленных кислот на сульфиды (соли сероводородной кислоты):
FeS + 2HCl = FeCl2 + h3S ↑
Водный раствор сероводорода – очень слабая кислота, диссоциация которой протекает в две ступени:
h3S↔H+ + HS—
HS— ↔ H+ + S2-
В связи с этим, для сероводородной кислоты характерна способность к образованию солей двух видов – средних – сульфидов (кислотный остаток — S2-) и кислых – гидросульфидов (кислотный остаток — HS—).
Сероводородная кислота – сильный восстановитель, т.к. сера, входящая в состав этого вещества, находится в низшей степени окисления и способна повысить её до «+4» или «+6», поэтому состав продуктов реакции определяется силой и количеством окислителя:
h3S + 4Cl2 + 4h3O = h3SO4 + 8HCl
h3S + 3h3SO4=4SO2 + 4h3O
h3S + 4Br2 = S + 3HBr
Для сульфидов, как для солей образованных слабой кислотой, характерна способность к гидролизу. Сульфиды металлов, стоящих в ряду активности левее железа, растворимы в сильных кислотах:
ZnS + h3SO4 = ZnSO4 + h3S ↑
Качественной реакцией на h3S и растворимые в воде сульфиды является:
h3S + Pb(NO3)2 = PbS↓ + 2HNO3
S2- + Pb2+ = PbS↓ (осадок черного цвета)
Оксид серы (IV). Сернистая кислота
В степени окисления «+4» сера образует оксид, которому соответствует кислота. Оксид серы (IV) представляет собой газообразное вещество (сернистый газ) без цвета, но обладающее резким запахом, хорошо растворимое в воде.
Выделяют промышленные и лабораторные способы получения оксида серы (IV). Так, в промышленности (1), его получают при обжиге сульфидов, а в лаборатории (2) – при действии сильных кислот на сульфиты:
4FeS2 + 11O2 =2Fe2O3 + 8SO2↑ (1)
Na2SO3 + 2HCl = 2NaCl + SO2↑ + h3O (2)
В водном растворе оксида серы (IV) возможно одновременное существование нескольких химических равновесий:
h3O + SO2 ↔ h3SO3 ↔H+ + HSO3— ↔ 2H+ + SO32-
Образующаяся в результате сернистая кислота (h3SO3) является двухосновной, поэтому способна к образованию двух типов солей – средних — сульфитов (кислотный остаток SO32) и кислых — гидросульфитов (кислотный остаток HSO2—).
Для оксида серы (IV), сернистой кислоты и её солей характерны химические свойства, которые можно разделить на 3 группы: кислотно-основные реакции (1), реакции окисления (2) и реакции восстановления (2):
Ca(OH)2 + SO2 = CaSO3↓ + h3O (1)
Na2SO3 + Cl2 + h3O = Na2SO4 + 2HCl (2)
SO2 + C= S↓ + CO2↑ (3)
Качественная реакция на SO2 и сульфиты – обесцвечивание раствора перманганата калия:
5SO2 + 2KMnO4 + 2h3O = 2h3SO4 + K2SO4 + MnSO4
Оксид серы (VI). Серная кислота
Оксид серы (VI) представляет собой бесцветную жидкость, которую получают окислением оксида серы (IV) кислородом в присутствии катализатора (V2O 5):
2SO2 + O2 ↔ 2SO3
Оксид серы (VI) хорошо растворим в воде (образуется серная кислота) и в 100%-ной серной кислоте (образуется олеум):
SO3 + h3O = h3SO4
Серная кислота представляет собой тяжелую вязкую жидкость, которая хорошо смешивается с водой в любых отношениях. Водный раствор серной кислоты – сильная кислота. Поскольку h3SO4 двухосновная кислота, она способна образовывать два типа солей – средние – сульфаты (кислотный остаток SO42-) и кислые – гидросульфиты (кислотный остаток HSO4—).
При взаимодействии с металлами (как, стоящими в ряду активности до водорода, так и после него) серная кислота восстанавливается до оксида серы (IV):
Zn + h3SO4 = ZnSO4 + SO2↑ +2h3O
Cu +2h3SO4= CuSO4 + SO2↑ +2h3O
Разбавленная серная кислота окисляет только металлы, стоящими в ряду активности до водорода:
Zn + h3SO4 = ZnSO4 + h3↑
Качественной реакцией на серную кислоту и растворимые сульфаты является образование осадка сульфата бария – осадка белого цвета, нерастворимого в щелочах и кислотах:
Ba2+ + SO42- = BaSO4↓
Примеры решения задач
ru.solverbook.com
Сера широко распространена в природе.

Сера. Нахождение в природе
Она составляет 0,05%массы земной коры.
Сера встречается в свободном состоянии (самородная сера).
Важнейшими природными соединениями серы являются:
сульфиды металлов:
FеS2– железный колчедан, или пирит;
ZnS – цинковая обманка;
РbS – свинцовый блеск;
НgS — киноварь и др.
соли серной кислоты (кристаллогидраты):
СаSO4·2Н2O– гипс,
Nа2SO4 · 10Н2О – глауберова соль,
МgSO4 · 7Н2O – горькая соль и др.
Сера содержится в организмах животных и растений, так как входит в состав белковых молекул.
Органические соединения серы содержатся в нефти.

Сера. Физические свойства
Сера —твердое хрупкое вещество желтого цвета.
В воде практически нерастворима, но хорошо растворяется всероуглероде,анилине и некоторых других растворителях.
Плохо проводит теплоту и электричество.
Сера образует несколько аллотропических модификаций.
При 444,6° С сера кипит, образуя парытемно-бурогоцвета.
Если их быстро охладить, то получается тонкий порошок, состоящий из мельчайших кристалликов серы, называемой
серным цветом.
Природная сера состоит из смеси четырех устойчивых
изотопов:
3216 S,1633S,3416S,3616S.

Сера. Химические свойства
Атом серы, имея незавершенный внешний энергетический уровень, может присоединять два
электрона и проявлять степень окисления –2.
Такую степень окисления сера проявляет в соединениях с металлами и водородом (например,
Nа2Sи Н2S).
При отдаче или оттягивании электронов к другому атому более электроотрицательного элемента степень окисления может быть +2,+4 и+6.
При обычных условиях молекула твердой серы
состоит из восьми атомов, замыкающихся в кольцо
(атомы в кольце не лежат в одной плоскости),
химическая связь ковалентная.

Сера. Химические свойства
 При нагревании кольцоS8 разрывается. При высоких
При нагревании кольцоS8 разрывается. При высоких
температурах существуют обрывки цепей: S2 (>900oС),
S2↔2S (свыше1500° С).
В парах серы существует равновесие между молекулами S8,
S6,S4 иS2.
Oбразование пластической серы объясняется тем, что частьколец-молекулразрывается и возникшие цепочки соединяются друг с другом вдлинные цепи.
В результате получается высокомолекулярное соединение – полимер с каучукоподобной эластичностью.
Сера легко образует соединения со многими элементарными веществами.
При сгорании ее на воздухе или в кислороде образуется оксид серы (IV) SO2 и частично оксид серыSO3 (VI). Это наиболее важные оксиды серы.
S +O2 =SO2 и 2S+3O2 = 2SO3.

Сера. Химические свойства
 При нагреваниисера непосредственно соединяется сводородом,галогенами (кроме иода),фосфором,углем, а также со всеми металлами, кромезолота,
При нагреваниисера непосредственно соединяется сводородом,галогенами (кроме иода),фосфором,углем, а также со всеми металлами, кромезолота,
платины и иридия. Например:
S +h3 = h3S; | 3S +2P= P2S3; |
S +Сl2 =SCl2 ; | 2S +C= CS2 ; |
S +Fe= FeS.
В реакциях с металлами и некоторыми неметаллами сера являетсяокислителем.
В реакциях же с более активными неметаллами,
как, например, с кислородом,хлором –
восстановителем.

Сера. Применение
Сера широко применяется впромышленности исельском хозяйстве.
Около половины ее добычи расходуется для получения серной кислоты.
Применяют серу для вулканизации каучука.
Каучук приобретает повышенную прочность и упругость.
В виде серного цвета (тонкого порошка) применяетсядля борьбы с болезнями растений, главным образом винограда и хлопчатника.
Она употребляется для получения пороха,спичек,
светящихся составов.
В медицине используются серные мази для лечения
кожных заболеваний.

Сероводород. Нахождение в природе
Сероводород Н2S – бесцветный газс запахом
тухлых яиц.
Хорошо растворим в воде (при20° С в1 объеме
воды растворяется 2,5 объема сероводорода).
Сероводород встречается в природе в
вулканических газах и в водах некоторых минеральных источников (Пятигорска, Мацесты).
Он образуется при гниении серусодержащих
органических веществ различных растительных и животных остатков.
Этим объясняется характерный неприятный запах
сточных вод, выгребных ям и свалок мусоря.

Сероводород. Получение
Сероводород может быть получен при непосредственном соединениисеры сводородом при нагревании:
S+h3 ←t→h3S.
Но обычно его получают действием разбавленной соляной или серной кислот на сульфид железа (II) ваппарате Киппа
FeS +2HCl= h3S↑ +FeCl2.

Сероводород. Физические свойства
Сероводород — очень ядовитый газ,
поражающий нервную систему.
Поэтому работать с ним надо в вытяжных шкафах или с герметически закрывающимися приборами.
Допустимое содержание сероводорода в производственных помещениях составляет 0,01 мг в 1 л воздуха.
Раствор сероводорода в воде называется сероводородной водой или сероводородной кислотой (она обнаруживает свойства слабой
кислоты).

Сероводород. Химические свойства
Сероводород — менее прочное соединение, чем вода.
При сильном нагревании почти полностью разлагается на серу
иводород:
h3S←t→h3 ↑ +S↓.
Газообразный Н2S горит на воздухеголубым пламенем:.
2h3S+3О2 = 2h3О+2SО2 .
При недостатке кислорода образуется сера и вода:
2h3S+О2 = 2h3О+2S.
Такой реакцией пользуются для получения серы из сероводорода в промышленном масштабе.

Сероводород. Химические свойства
Сероводород — очень сильныйвосстановитель,
что объясняется его способностью в растворе
легко отдавать электроны молекулам кислорода
воздуха:
h3S−2e =S+2H+, окисление,
−2
О2 +4е = 2О, окисление.
Сероводород окисляется кислородом воздуха, а
выпавшая свободная сера делает сероводородную воду мутной.
Суммарное уравнение реакции:

Сероводород. Химические свойства
Этим объясняется и тот факт, что сероводород не накапливается
в очень больших количествах в природе при гниении органических веществ.
Кислород воздуха окисляет сероводород в свободную серу.
Энергично реагирует сероводород с растворамигалогенов:
h3S+I2 = 2HI+S.
h3S−2е = 2H+ +S, окисление,
I2 +2e = 2I−, восстановление.
Происходит выделение серы и обесцвечивание раствораиода.
Слабая сероводородная кислота диссоциирует на ионы:
| h3S H+ +НS− 1ступень. |
В ее растворе в очень малых количествах содержатся и сульфид- | |
ионы: | HS− H+ +S2− 2ступень. |

Сульфиды
Сероводородная кислота как двухосновная образуетдва ряда солей – средние (сульфиды) и кислые (гидросульфиды).
Например, Nа2S –сульфид нaтрия,NаНS –гидросульфид натрия.
Гидросульфиды почти все хорошорастворимы в воде.
Сульфиды щелочных ищелочноземельных металлов также
растворимы в воде.
Сульфиды остальных металлов в воде практически нерастворимы или малорастворимы, а некоторые не растворяются и в разбавленных кислотах.
Поэтому такие сульфиды можно легко получить, пропуская сероводород через раствор соли соответствующего металла:
CuSO4 +h3S= CuS↓ +h3SO4 ,
Cu2+ +h3S= CuS↓ +2H+.

Сульфиды
Несмотря на то, что в ходе реакции получается кислота, CuS выпадает в осадок:сульфид меди не растворяется ни в воде, ни в разбавленных кислотах.
Но при действии сероводорода на раствор какой-либосоли железа (II) осадка не получается – сульфид железа (II)FeS нерастворим в воде, но растворяется в кислотах.
Это различие обусловлено тем, что произведение растворимости CuS много меньше произведения растворимости
FeS.
Растворимые сульфиды не могут быть получены из солей
соответствующих металлов действием сероводорода или других сульфидов.
Различиями в растворимости сульфидов пользуются в аналити-
ческой химии для последовательного осаждения металлов из растворов их солей.

Сульфиды
Сульфиды, как соли очень слабой кислоты,
подвергаются гидролизу.
Например, Na2S при растворении в воде почти
целиком гидролизуется с образованием кислой соли
– гидросульфида натрия:
Na2S+h3O NaHS+ NaOH,
S +h3O HS− +OH−.
Серебряные и медныепредметы чернеют в
воздухе и в воде, содержащих сероводород.
Это происходит оттого, что они покрываются налетом соответствующего сульфида.
4Ag +2h3S+O2 = 2Ag2S+2h3O.

Сульфиды
При этом окислителем служиткислород, находящийся в
воздухе или растворенный в воде.
При взбалтывании раствора какого-нибудьсульфида, например сульфида натрия, с серой последняя растворяется в нем, и после выпаривания получается остаток, содержащий, кроме сульфида натрия, также соединения с большим содержанием серы – отNa2S2 доNa2S5.
Такие соединения называются полисульфидами.
Среди сульфидов имеется много соединений переменного состава.
Например, сульфид железа(II) может иметь состав от FeS1,01
до FeS1,14.

Сульфиды. Применение
Природные сульфиды составляют основу рудцветных и редких металлов и широко используютсяв металлургии.
Некоторые из них служат также сырьем для получения серной кислоты.
В этих же целях используется и природный полисульфид — железный колчедан (пирит)FeS2 .
Сульфиды щелочных и щелочноземельных металлов находят применение в химической и влегкой промышленности.
Так Na2S,CaS иBaS применяются вкожевенном производстве для удаления волосяного покрова с кож.
Сульфиды щелочноземельных металлов, цинка и кадмия служат основой люминофоров .
Некоторые сульфиды обладают полупроводниковыми свойствами и применяются в электронной технике.

Сульфиды. Качественная реакция
Некоторые сульфиды имеют характерную окраску: СuS и РbS – черную, СdS – желтую, ZnS – белую,
MnS – розовую,SnS – коричневую, Sb2S3 – оранжевую и т. д.
На различной растворимости сульфидов и различной окраске многих из них основан качественный анализ катионов.
Качественной реакцией на сероводородную кислоту является взаимодействие раствора кислоты с растворимымисолями свинца (ионами свинца).
При этом образуется малорастворимый в воде
сульфид свинца – осадок черного цвета:

Оксиды серы
Оксид серы (IV) – это бесцветный газ с резким, удушливым запахом.
При охлаждении до –10°С сжижается вбесцветную жидкость.
В жидком виде его хранят в стальных баллонах.
В лаборатории оксид серы (IV) получают взаимодействием гидросульфита натрия с серной кислотой:
2NaHSO3 +h3SO4 = Na2SO4 +2SO2 +2h3O,
или нагреванием меди с концентрированной серной кислотой:
Cu +h3SO4конц = СuSO4 +SO2 ↑ +2h3O,
Cu −2е = Сu2+,окисление,
+6 | +4 |
S | +2e = S, восстановление. |
Оксид серы (IV) образуется также при сжигании серы.

Оксиды серы
В промышленных условиях SO2 получают при обжиге пиритаFеS2 и при обжигесернистых руд цветных металлов (цинковой обманкиZnS, свинцового блескаРbS
идр.).
Образующийся оксид серы (IV) употребляется главным образом для полученияSO3 и серной кислоты.
В присутствии катализатора при нагревании SO2 присоединяет кислород воздуха и образуетсяSO3:
+O2 2SO3.
В этой реакции сера+4меняет+степень6 окисления от+4 до+6:
S−2e = S.
Значит, для SO2 характерны восстановительные свойства.
Оксид серы (IV) проявляют все свойства кислотных оксидов.

Сернистая кислота
Оксид серы (IV) хорошо растворим в воде . В1 объеме воды при при200 С растворяется40 объемовSO2.
При этом образуется существующая только в водном растворе сернистая кислота: +Н2О Н2SO3.
Реакция соединения SO2 с водой обратима.
В водном растворе оксид серы (IV)и сернистая кислота
находятся в химическом равновесии, которое можно смещать влево и вправо.
При связывании Н2SO3 щелочью (нейтрализация кислоты) реакция протекаетслева направо.
При удалении SO2 (продувание через раствор азота или нагревание) реакция протекаетсправа налево.
В растворе сернистой кислоты всегда имеется оксид серы (IV), который придает ему резкий запах.

Сернистая кислота
Сернистая кислота обладает всеми свойствами кислот.
В растворе Н2SО3 диссоциирует ступенчато:
h3SO3 Н+ +HSO− 1ступень.
3
HSО3− H+ +SО32− 2ступень.
Как двухосновная кислота она образует два ряда солей –
сульфиты и гидросульфиты.
Сульфиты получаются при полной нейтрализациикислоты щелочью:
+2NaOH = Na2SO3 +2h3O.
Гидросульфиты – при недостатке щелочи(по сравнению с количеством, необходимым для полной нейтрализации
кислоты):
h3SO3 + NaOH= NaHSO3 +h3O.

Сернистая кислота
Сернистая кислота и ее соли сильные восстановители.
При этом степень окисления серы возрастает.
Так, Н2SO3 легко окисляется в серную кислоту дажекислородом воздуха:
2h3SO3 +O2 = 2h3SO4.
Поэтому долго хранившиеся растворы сернистой кислоты всегда содержат серную кислоту.
Еще легче протекает окисление сернистой кислотыбромом и
перманганатом калия:
H |
| +4 |
| +Br0 | +H | O = H |
| +6 |
| −1 |
2 | S O | 3 | 2 | S O | 4 | +2H Br. | ||||
|
| 2 | 2 |
|
|
| ||||
|
| +4 |
| +6 |
|
|
|
| ||
| h3 S O3 −2е = S О42− +2Н+,окисление, | |||||||||
Br20 +2e = 2Br−,восстановление.

Сернистая кислота
| +4 |
| +7 | +6 | +2 |
|
| 5h3 S O3 | +2K Mn O4 | = 2h3 S O4 | +2 Mn SO4 | +K2SO4 +3h3O. | |
5 | +4 | +6 |
|
| ||
h3 S O3 | −2е = S О42− +2Н+,окисление, |
| ||||
2MnO−4 +5e +8H+ = Mn2+ +4h3O,восстановление.
Оксид серы (IV) и сернистая кислотаобесцвечивают многие красители, образуя с ними бесцветные соединения.
Обычно оксидом серы (IV) отбеливаютшерсть, шелк и солому (хлорной водой эти материалы разрушаются).
Оксид серы (IV) убивает многие микроорганизмы.
Поэтому для уничтожения плесневых грибковим окуривают сырые подвалы, погреба, винные бочки и др.
В больших количествах SO2 идет для получениясерной кислоты.
Бумажную массу и волокна древесины обрабатывают раствором гидросульфита кальция Са(НSO3)2 – (сульфитным щелоком).

Оксид серы (VI)
Оксид (VI) – SO3 – это бесцветная жидкость, затвердевающая при температуре ниже 17° С в
твердую кристаллическую массу.
Он энергично поглощает влагу, образуя серную
кислоту:
SO3 +Н2О Н2SO4.
Поэтому SO3 хранят в запаянных колбах.
Оксид серы (VI) обладает всеми свойствами кислотных оксидов.
Получают его окислением SO2.
Он является промежуточным продуктом в
производстве серной кислоты.

Серная кислота. Получение
 Наибольшее значение имеетконтактный способ получения
Наибольшее значение имеетконтактный способ получения
серной кислоты.
По этому способу можно получить Н2SO4 любой концентрации, а также олеум,раствор SO3 вН2SO4.
Процесс состоит из трех стадий:
получение SO2;
2) окисление SO2 вSO3;
3) получение Н2SO4.
SO2 получают путем обжига пиритаFeS2 в специальных печах:
4FeS +11O | 2 | ←t→2Fe | 2 | O | 3 | +8SO | 2 | . | |||
2 | +2 | +3 |
|
|
|
| |||||
4 |
| Fe−е | = Fe | окисление, |
|
| |||||
| −1 |
|
|
|
| ||||||
|
|
| +4 |
|
|
|
|
|
| ||
|
| 2 S −10e = | 2S |
|
|
|
|
|
| ||
11 |
| O02 +4е = | −2 |
|
|
|
|
|
| ||
| 2O,восстановление. |
|
| ||||||||

Серная кислота. Получение
Для ускорения обжига пирит предварительноизмельчают.
Для более полного выгорания серы вводят значительно большевоздуха (кислорода), чем требуется для реакции.
Газ, выходящий из печи обжига, состоит изоксида серы (IV),
кислорода, азота, соединений мышьяка(из примесей в колчедане) и паров воды.
Он называется обжиговым газом.
Обжиговый газ подвергается тщательной очистке, так как
содержащиеся в нем даже ничтожные количества соединений мышьяка, а также пыль и влага отравляют катализатор.
От соединений мышьяка и пыли газ очищают, пропуская его через специальные электрофильтры и промывную башню.
Влага поглощается концентрированной серной кислотой в сушильной башне.

Серная кислота. Получение
Очищенный газ, содержащий кислород,нагревается в теплообменнике до450° С и
поступает в контактный аппарат.
Внутри контактного аппарата имеются
решетчатые полки, заполненные катализатором.
Раньше катализатором служила мелко раздробленная металлическая платина.
Затем она была заменена соединениями ванадия
(оксидом ванадия (V)VН2O5 или сульфатом ванадилаVOSO4), которые дешевле платины и медленнее отравляются.

Серная кислота. Получение
Реакция окисления S02 вS03 обратима: 2SО2+О2↔2S03.
Увеличение количествакислорода в обжиговом газе повышает выход оксида серы (VI).
При 450° С он обычно достигает95% и выше.
Оксид серы (VI) поглощается концентрированной серной кислотой — образуетсяолеум.
Разбавив олеум водой, можно получить кислоту необходимой концентрации.
То, что S03 поглощается концентрированнойh3SO4, а не водой, объясняется тем, чтооксид серы (VI) выходит из контактного аппарата мелко распыленный и с парами воды образует туман, состоящий из мелких капелек серной кислоты, который не поглощается водой.
При поглощении S03 концентрированной серной кислотой туман не образуется.

Серная кислота. Физические свойства
Серная кислота – тяжелая бесцветная маслянистая жидкость.
Крайне гигроскопична. Поглощает влагу с выделением большого количества теплоты, поэтому нельзя воду приливать к концентрированной кислоте – произойдет разбрызгивание кислоты.
Для разбавления надо серную кислоту приливать небольшими количествами к воде.
Безводная серная кислота растворяет до70%оксида серы (VI).
При обычной температуре она не летуча, не имеет запаха.
При нагревании отщепляет SO3 до тех пор, пока не образуется раствор, содержащий98,3%Н2SO4.
Безводная Н2SO4 почти не проводит электрический ток.

Серная кислота. Химические свойства
Концентрированная серная кислота обугливает органические вещества: сахар, бумагу, дерево, волокна и т. д., отнимая от них воду.
При этом образуются гидраты серной кислоты.
Обугливание сахара можно выразить уравнением:
C12h32O11 +h3SO4 =12C+h3SO4 nh3O.
Образовавшийся уголь частично вступает во взаимодействие с кислотой:
C +2h3SO4 | = CO2 +2SO2 +2h3O. | ||
|
|
| +4 |
1 |
| C −4е = C,окисление, | |
| |||
2 |
| +6 | +4 |
| S+2e = S,восстановление. | ||

Серная кислота. Химические свойства
Поэтому кислота, которая идет в продажу, имеет бурый цвет от случайно попавших и обуглившихся в ней частичек пыли и органических веществ.
На поглощении (отнятии) воды серной кислотой основана осушка газов.
Как сильная нелетучая кислота Н2SO4 вытесняет из сухих солей другие
кислоты:
NaNO3 +h3SO4 = NaHSO4 +HNO3.
Однако если Н2SO4 добавляется к растворам солей, то вытеснения кислот не происходит.
Очень важное химическое свойство серной кислоты – отношение ее к металлам.
Разбавленная и концентрированная серная кислота реагирует с ними различно.
Разбавленная серная кислота растворяет металлы, стоящие в ряду стандартных электродных потенциалов до водорода.

Серная кислота. Химические свойства
У свинца на поверхности образуется пленка из РbSO4, которая защищает его от дальнейшего взаимодействия с кислотой.
Металлы, стоящие в ряду напряженийпосле водорода, с разбавленнойН2SO4 не реагируют.
Концентрированная серная кислота при обычной температуре со многими металлами не реагирует.
Поэтому безводную серную кислоту можно хранить в железной таре и перевозить в стальных циcтернах.
Однако при нагревании концентрированнаяh3S04 взаимодействуетпочти со всеми металлами (кромеPt,Au и некоторых других).
При этом она выступает как окислитель, сама восстанавливается.
Водород в этом случаене выделяется, а образуется вода:
Смотрите тему «Взаимодействие металлов с кислотами».
Серная кислота обладает всеми свойствами кислот.

Серная кислота. Применение
Серная кислота – важнейший продукт основной химической промышленности.
Наибольшее количество ее расходуется для получения фосфорных и азотных удобрений.
Будучи нелетучей кислотой, серная кислота используется для получения других кислот –соляной,плавиковой,фосфорной,уксусной и т. д.
Используется для очистки нефтепродуктов– бензина, керосина и смазочных масел от вредных примесей.
В машиностроении серную кислоту используют дляочистки поверхности металлов oт оксидов перед покрытием (никелированием, хромированием и др.).
В производстве взрывчатых веществ, искусственного волокна, красителей, пластмасси многих других.
Ее употребляют для заливки аккумуляторов.
В сельском хозяйстве она используетсядля борьбы с сорняками (гербицид).

Соли серной кислоты
Серная кислота, будучи двухосновной, образует два ряда солей:средние –сульфаты икислые –гидросульфаты.
Сульфаты получают при полной нейтрализациикислоты щелочью (на 1 моль кислоты приходится 2
моля щелочи).
Гидросульфаты – при недостатке щелочи(на 1 моль кислоты – 1 моль щелочи):
h3SO4 +2NaOH= Na2SO4 +2h3O,
h3SO4 + NaOH= NaHSO4 +h3O.
Многие соли серной кислоты имеют большое
практическое значение

Соли серной кислоты
Na2S04 —сульфат натрия. Из водных растворов кристаллизуется десятиводный гидратNa2S04·10Н2О, называемыйглауберовой солью.
Глауберова соль применяется в медицине как слабительное.
Безводный сульфат натрия применяется в производствесоды истекла.
(Nh5)2SО4 —сульфат аммония, азотное удобрение.
K2SO4 –сульфат калия, калийное удобрение.
CaSО4 – сульфат кальция.
В природе встречается в виде минерала гипса CaSО4·2h3О. При нагревании до150° С теряет часть воды и переходит в гидрат состава2CaSО4·h3О, называемыйжженым гипсом или
алебастром.
Алебастр при замешивании с водой в тестообразную массу через некоторое время снова затвердевает, превращаясь в
2CaSО4·2h3О.

Соли серной кислоты
При нагревании до 150° С2CaSО4·2h3О теряет часть
воды и переходит в гидрат состава 2CaSО4·h3О, называемыйжженым гипсом илиалебастром.
Алебастр при замешивании с водой в тестообразную
массу через некоторое время снова затвердевает, превращаясь в 2CaSО4·2h3О. Гипс широко применяется в строительном деле (штукатурка).
MgSО4 –сульфат магния. Содержится в морской воде, обусловливая ее горький вкус. Кристаллогидрат, называемый горькой солью, применяется как
слабительное.

Соли серной кислоты
Купоросы — техническое названиекристаллогидратов сульфатов металлов Fe, Си, Zn, Ni, Со (обезвоженные соли купоросами называть
нельзя).
СиSО4·5Н2О –медный купорос, ядовитое вещество синего цвета. Разбавленным раствором опрыскивают
растения и протравливают семена перед посевом.
FeSO4·7Н2O железный купорос,светло-зеленоевещество. Применяется для борьбы с вредителями растений, приготовления чернил, минеральных красок, консервирования дерева и т. д.
ZnSO4·7h3O –цинковый купорос, применяется в
производстве минеральных красок, в ситцепечатании, медицине.

Качественная реакция на сульфат-ион
Большинство солей серной кислотырастворимо в воде и растворах кислот.
Соли CaSО4 иPbSО4 малорастворимы в воде, aBaSО4 практическинерастворима как в воде, так и в кислотах.
Это свойство позволяет использовать любую растворимую соль бария, например ВаСl2, какреагент на серную кислоту и ее соли
(точнее, на cульфат-ион):
h3SO4 +BaCl2 = BaSO4 ↓ +2HCl,
Na2SO4 +BaCl2 = BaSO4 ↓ +2NaCl.
В ионной форме:
SO24- +Ba2+ = BaSO4 ↓.
При этом выпадает белый нерастворимый в воде и кислотах
осадок сульфата бария.

Вопросы
Изобразить графическую электронную формулу серы.
В виде каких соединений сера встречается в природе?
Описать физические и химические свойства серы.
Какие степени окисления проявляет сера в своих соединениях?
Как получить сероводород? Назвать его важнейшие физические и химические свойства.
Как получают серную кислоту в промышленности?
Какие предосторожности надо соблюдать при
разбавлении концентрированной серной кислоты водой?

Перечислить важнейшие физические и химические свойства серной кислоты. Где она применяется?
Почему ион Ва2+ является реагентом на серную кислоту и ее соли?
Как получить оксид серы (IV)? Каковы его физические и химические свойства?
Назвать свойства сернистой кислоты и ее солей.
Как осуществить превращения:
Nа2SO3 → SO2 → h3SO3?
Каковы свойства оксида серы (VI)?
studfiles.net




























