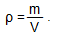Количественная характеристика кислот и оснований по теории Бренстеда – Лоури. Рка воды
Органическая химия (конспект лекций): Учебное пособие, страница 7
Силу кислоты выражают количественно через константу кислотности:
| Ka = | Kp[h3O] = | [A-][h4O+] |
| [AH] |
где: Ka – константа кислотности; Kp – константа равновесия.
Кислота там сильнее, чем больше константа кислотности. Часто пользуются значениями рКа. Чем меньше величина рКа, тем сильнее кислота.
рКа = -lgКа
Например, рКа фенола = 10, рКа этанола = 16. Это означает, что фенол на шесть порядков (в миллион раз) более сильная кислота, чем этиловый спирт.
Основность может быть выражена через рКb.
рКb = 14 - рКa
Важно помнить, что рКа воды = 15,7. Все вещества, которые имеют рКа больше, чем вода, не способны проявлять кислые свойства в водных растворах. Вода, как более сильная кислота, подавляет диссоциацию более слабых кислот. Так как у большинства органических соединений кислотные свойства выражены во много раз слабее, чем у воды, разработан полярографический подход к оценке их кислотности (И.П. Белецкая и др.). Он позволяет оценивать кислотность до рКа = 50, хотя для очень слабых кислот значения рКа можно оценить только очень приблизительные.
Чрезвычайно важна качественная оценка кислотности как в рядах близких по строению веществ, так и для соединений различных классов. Способность кислоты отдавать протон связана со стабильностью образующегося аниона. Чем стабильнее образующийся анион, тем меньше его стремление захватить протон обратно и превратиться в нейтральную молекулу. При оценке относительной стабильности аниона надо учитывать несколько факторов.
Природа атома, отдающего протон. Атом тем легче теряет протон, чем выше его электроотрицательность и поляризуемость. Поэтому в ряду кислот способность к диссоциации уменьшается следующим образом:
S-H > O-H > -N-H > C-H
Этот ряд прекрасно соответствует свойствам атомов, известным из периодической таблицы.
Влияние окружения. Если сравниваются близкие по строению вещества, оценка проводится сравнением электронной плотности на атоме, отдавшем протон. Все структурные факторы, способствующие уменьшению заряду, стабилизирует анион, а увеличению заряда – дестабилизируют. Таким образом, все акцепторы увеличивают кислотность, все доноры – уменьшают.

Это происходит независимо от того, за счет какого эффекта передачи электронов (индуктивного или мезомерного) происходит перераспределение электронной плотности.
Сольватационный эффект. Сольватация (взаимодействие с молекулами растворителя) повышает стабильность аниона за счет перераспределения избытка электронной плотности между анионом и молекулами растворителя. В общем случае закономерность следующая:
· чем полярнее растворитель, тем сильнее сольватация;
· чем меньше ион, тем лучше он сольватируется.
Основность по Брёнстеду – способность вещества предоставить свою пару электронов для взаимодействия с протоном. Как правило, это вещества, содержащие в молекуле атомы азота, кислорода и серы.
Чем слабее основный центр удерживает пару электронов, тем выше основность. В ряду
R3-N > R2O > R2S
основность уменьшается. Эту последовательность легко запомнить, используя мнемоническое правило “NOS”.
Среди оснований Брёнстеда существует зависимость: анионы более сильные основания, чем соответствующие нейтральные молекулы. Например, гидроксид-анион (–ОН) более сильное основание, чем вода (Н2О). При взаимодействии основания с протоном могут образовываться ониевые катионы:
· R3О+ - оксониевый катион;
· NR4+ - аммониевый катион;
· R3S+ - сульфониевый катион.
Качественная оценка основности у близких по строению веществ проводится с использованием той же логики, что и оценка кислотности, но с обратным знаком.
Поэтому все акцепторные заместители основностьи уменьшают, все донорные – увеличивают.
Кислоты и основания по Льюису
Основания по Льюису – доноры электронной пары, как и основания по Брёнстеду.
Определение Льюиса для кислот заметно отличается от привычного (по Брёнстеду). Кислотой по Льюису считается любая молекула или ион, имеющая свободную орбиталь, которая может быть в результате взаимодействия заполнена электронной парой. Если по Брёнстеду кислота – донор протона, то по Льюису сам протон (Н+) – кислота, поскольку его орбиталь пуста. Кислот Льюиса очень много: Na+, Mg2+, SnCl4, SbCl5, AlCl3, BF3, FeBr3 и т.д. Теория Льюиса позволяет описать многие реакции как кислотно-основные взаимодействия. Например:
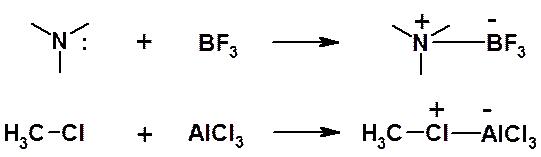
Часто в реакциях с кислотами Льюиса в качестве оснований участвуют органические соединения, являющиеся донорами пары p-электронов:
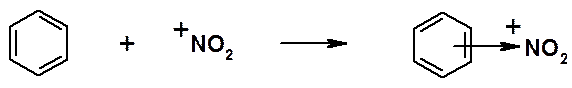
В органической химии принято следующее:
· если используется термин «кислота» - подразумевается кислота по Брёнстеду;
· если используют термин «кислота» в льюисовском понимании – говорят «кислота Льюиса».
Лекция № 5
Углеводороды
Алканы
· Гомологический ряд, номенклатура, изомерия, алкильные радикалы. Электронное строение молекул алканов, sp3-гибридизация, s-связь. Длины C-C и C-H связей, валентные углы, энергии связей. Пространственная изомерия органических веществ. Способы изображения пространственного строения молекул с sp3-гибридизованными атомами углерода. Спектральные характеристики алканов. Физические свойства алканов и закономерности их изменения в гомологическом ряду.
Алканы (насыщенные ациклические соединения, парафины)
Алканы - углеводороды с открытой цепью атомов, отвечающие формуле Сnh3n+2, где атомы углерода связаны между собой только σ-связями.
Термин «насыщенный» означает, что каждый углерод в молекуле такого вещества связан с максимально возможным числом атомов (с четырьмя атомами).
Строение метана подробно изложено в лекции № 2.
Изомерия, номенклатура
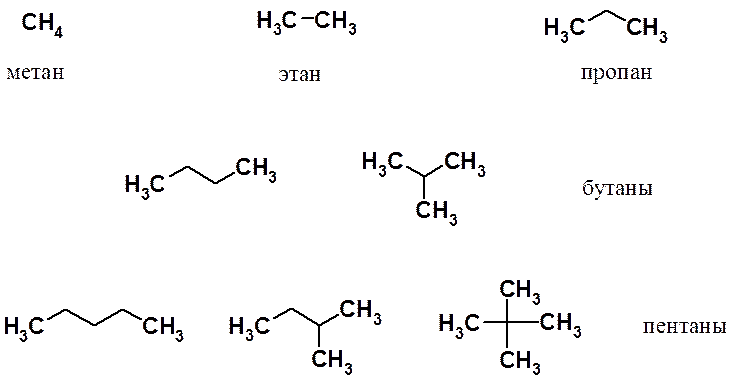
Три первых члена гомологического ряда (метан, этан и пропан) существуют в виде одного структурного изомера. Начиная с бутана число изомеров стремительно растет: у пентана три изомера, а у декана (С10Н22) их уже 75.
Конформационная изомерия
vunivere.ru
| Константы диссоциации Кa и константы кислотности pКa=-lg(Кa) неорганических кислот в водных растворах
Источник: Новый справочник химика и технолога. Химическое равновесие. Свойства растворов. — СПб.: АНО НПО «Профессионал», 2004. — 998 с. |
1_Osnovy_Stroenia_Organicheskikh_Soedineniy
В общем виде кислотно-основное взаимодействие описывается уравнением

В принципе большинство органических соединений можно рассматривать как потенциальные кислоты, поскольку в них содержатся атомы водорода, связанные с разными элементами (О, S, N, С). Элемент и связанный с ним атом водорода называют кислотным центром. Органические кислоты соответственно классифицируют по кислотному центру как ОН-, SH-, NH- и СН-кислоты. Кислотами могут быть не только нейтральные молекулы, но и положительно заряженные ионы, а также диполярные ионы. Органические основания для образования ковалентной связи с протоном кислоты должны либо иметь неподеленную пару электронов у гетероатома (нейтральные молекулы), либо быть анионами. В целом основания, имеющие в молекулах гетероатом, называются n-основаниями. Существует еще одна группа оснований — π-основания, в которых центром основности являются электроны локализованной π-связи или π-электронного облака сопряженной системы. π-Основания образуют с протоном не ковалентные связи, а короткоживущие π-комплексы.
Кислотность и основность веществ по Брёнстеду-Лоури характеризуется количественно. Применяя закон действующих масс, можно выразить кислотные свойства кислоты А—Н через константу равновесия Kp, представленной выше реакции обратимого кислотно-основного взаимодействия:

Очевидно, что константа равновесия реакции ионизации кислоты имеет постоянное значение только для данной системы и по отношению к каждому основанию существует своя шкала констант кислотности. Наиболее важным случаем является ионизация кислот в водном растворе (вода играет роль основания):

Поскольку вода присутствует в большом избытке, то ее концентрация остается практически постоянной, равной 55,5 моль/л. Это значение включают в константу равновесия и получают характеристику, называемую константой кислотности Ка:

Чем больше Ка, тем сильнее кислота. Однако даже такая сравнительно сильная по меркам органических соединений кислота, как уксусная, имеет Ка= 1,75 • 10-5. Для большинства органических соединений Ка имеют еще меньшие значения. Поэтому для оценки силы органических кислот значительно удобнее пользоваться значениями рКа представляющими собой отрицательный логарифм констант кислотности: рКа = -lgКа. При этом чем меньше рКа, тем сильнее кислота. Кислоты, у которых рКа > 7, не изменяют цвет нейтральной индикаторной бумаги; кислоты с рКа >10 не имеют кислого вкуса.
Основность соединений в водном растворе можно охарактеризовать величиной рКb, которая связана с рКа через ионное произведение воды: рКb = 14 - рКа. Однако в настоящее время для характеристики основности чаще используют величину рКа сопряженной основанию В кислоты ВН+, обозначаемую как рKBH+. Такой подход позволяет применять одну и ту же шкалу для характеристики ионизации как кислот, так и оснований. В этом случае чем больше pKBH+, тем сильнее основание.
Слабые кислоты и основания в биологических системах. Большинство биологически активных органических соединений, в частности лекарственных веществ, являются слабыми кислотами или основаниями. Степень ионизации таких соединений в той или иной среде имеет важное значение для проявления биологического действия. Известно много лекарственных веществ, терапевтическая активность которых определяется долей присутствующих неионизированных молекул, хотя существуют и другие примеры, когда, наоборот, ионизированная часть вещества обусловливает биологический эффект за счет взаимодействия с катионными или анионными центрами рецепторов. Различия в степени ионизации обеспечивают избирательность действия, и это связано с такими факторами, как, например, проникновение через мембраны в плазму крови или клетку, адсорбцией на поверхностях ферментов, возможной ионизацией центров рецептора в зависимости от pH и т. д.

Степень ионизации органических кислот и оснований в растворе определяется значениями двух параметров: pH раствора и рКа кислоты (или рКBH+ основания). Если значения рКа (или pKBH+) вещества и pH раствора известны, то степень ионизации может быть рассчитана следующим образом:

Степень ионизации имеет важное значение для процессов проникновения веществ через различные мембраны в организме, например при всасывании (абсорбции) лекарств из желудочно-кишечного тракта. Мембраны эпителия пищеварительного тракта можно рассматривать как липидный бислой, в который встроены белковые молекулы. Гидрофобные участки мембранных белков погружены во внутреннюю полость мембраны, а ионизированные участки обращены к водной фазе внутри и снаружи. Согласно классической теории, мембраны подобного типа препятствуют прохождению ионов, так как, во-первых, ионы вследствие гидратации имеют относительно большой размер и, во-вторых, если заряд иона и заряд белковой поверхности, к которой он приближается, аналогичны по знаку, то происходит отталкивание, а если противоположны, то происходит адсорбция иона на поверхности мембраны. Через природные мембраны проникают только те ионы, для которых существуют специфические транспортные системы или переносчики. Нейтральные липидорастворимые молекулы проникают через мембраны и тем быстрее, чем выше их липофильные свойства. Таким образом в желудочно-кишечном тракте происходит всасывание неионизированных молекул лекарственных веществ.
Препараты кислотной природы будут лучше всасываться из желудка (pH 1—3), а всасывание лекарств-оснований будет происходить только после того, когда они пройдут из желудка в кишечник (содержимое тонкого кишечника имеет pH 7—8). В течение одного часа из желудка крыс всасывается почти 60% ацетилсалициловой кислоты и только 6% анилина от введенной дозы. В кишечнике крыс всасывается уже 56% от введенной дозы анилина. Примечательно, что такое слабое основание, как кофеин (рKВH+ 0,8), всасывается за то же время в гораздо большей степени (36%), так как даже в сильнокислой среде желудка кофеин в значительной степени находится в неионизированном состоянии.
Эффективность действия лекарственных веществ обусловливается способностью их проникновения к рецептору. Дли веществ, способных к ионизации, биологическая активность может определяться долей неионизированных молекул или, наоборот, ионизированной частью вещества. Имеются многочисленные примеры и того, и другого вариантов. Так, и фенол и уксусная кислота прекращают рост различных плесневых грибов; их биологическое действие обусловлено неионтированными молекулами, и поэтому наибольшая эффективность уксусной кислоты проявляется при pH ниже 4, а для фенола при любых значениях pH ниже 9, так как в этих диапазонах значений pH и фенол и уксусная кислота находятся в неионизированном состоянии. Также только неионизированный теофиллин, в отличие от своего аниона, стимулирует деятельность сердца черепахи. На примере ряда сульфаниламидных препаратов, наоборот, установлено, что их антибактериальная активность обусловлена анионами. Оптимальное для проявления активности значение рКа сульфаниламидов находится в интервале 6—8. Через мембрану в клетку проникают неионизированные молекулы, но при физиологических значениях pH вновь образуются ионы, пока по обе стороны мембраны не установится равная степень ионизации:

Антибактериальная активность сульфаниламидов пропорциональна степени ионизации, но зависит также и от липофильности молекул.
И еще один пример, когда биологическая активность обусловлена ионизированной формой вещества: антибактериальное (бактериостатическое) действие аминоакридинов проявляется только в катионной форме этих соединений и возрастает при повышении степени их катионной ионизации. Изменение степени ионизации в зависимости от pH среды широко используют для выделения лекарственных веществ из биологических жидкостей (кровь, моча) с целью их последующего анализа, например, при проведении фармакокинетических исследований.
Кислоты и основания Льюиса. Согласно теории Льюиса, кислотно-основные свойства соединений определяются их способностью принимать или отдавать пару электронов с образованием новой связи. Кислоты Льюиса — акцепторы пары электронов. Основания Льюиса доноры пары электронов.
Основания Брёнстеда и основания Льюиса являются донорами пары электронов — либо неподеленной, либо находящейся на р-орбитали, т. е. понятия тождественны в той и другой теории. Кислотность по Льюису имеет новый и более широкий смысл. Кислотой считается любая частица с вакантной орбиталью, которая способна дополнить свою электронную оболочку парой электронов. По Брёнстеду кислота — это донор протона, а по Льюису — сам протон Н+ является кислотой, так как имеет вакантную орбиталь.
Кислотами Льюиса являются галогениды элементов второй и третьей групп периодической системы (BF3, А1С13, FeCl3, FeBr3, ZnCl2 и др.). К кислотам Льюиса также относятся галогениды других элементов, имеющих вакантные орбитали — SnX4, SbX5, AsX5 и даже оксид серы (VI) SО3. Галогениды бора, алюминия имеют по шесть электронов на внешней оболочке и способны принимать пару электронов с образованием ковалентной связи. Тетрахлорид олова, например, имеет 8 электронов на внешней оболочке, но как элемент, имеющий вакантные орбитали, способен принять еще пару электронов. К кислотам Льюиса относятся также катионы металлов (Na+, Mg2+, Ag+), карбокатионы R3C+, нитроил-катион NО2+ и др. В гетеролитических реакциях кислоты Льюиса участвуют как электрофильные реагенты. Ниже приведены некоторые примеры взаимодействия между кислотами и основаниями Льюиса:

Многие распространенные органические реакции относятся к кислотноосновным взаимодействиям в рамках теории Льюиса. Однако в этой теории гораздо сложнее дать количественную оценку кислотности и основности, и такая оценка может быть лишь относительной. Для этого определяют энергии взаимодействия различных соединений в строго определенных условиях (растворитель, температура) с одним и тем же стандартом, являющимся соответственно кислотой или основанием Льюиса. Поэтому количественных измерений для кислот и оснований Льюиса сделано намного меньше, чем для кислот и оснований Брёнстеда.

Жесткие и мягкие кислоты и основания. Развитие теории Льюиса привело к созданию принципа жестких и мягких кислот и оснований (принцип ЖМКО, принцип Пирсона). Согласно принципу Пирсона, кислоты и основания подразделяются на жесткие и мягкие.
Жесткие кислоты — это кислоты Льюиса, в которых акцепторные атомы малы по размеру, обладают большим положительным зарядом, большой электроотрицательностью и низкой поляризуемостью. Мягкие кислоты Льюиса содержат акцепторные атомы большого размера с малым положительным зарядом, небольшой электроотрицательностью и высокой поляризуемостью.
Низшая свободная молекулярная орбиталь (НСМО), которая участвует в связывании с орбиталью донора пары электронов, у жестких кислот имеет низкую энергию. Самой жесткой кислотой является протон. НСМО мягких кислот имеет высокую энергию. Мягкие кислоты содержат легко поляризуемые вакантные орбитали. Положительный заряд у атома — акцептора пары электронов мал вследствие делокализации или вообще отсутствует (так, мягкой кислотой является молекула иода).
Жесткие основания — это донорные частицы, обладающие высокой электроотрицательностью, низкой поляризуемостью, трудно окисляющиеся. Мягкие основания, напротив, — это донорные частицы с низкой электроотрицательностью, высокой поляризуемостью, довольно легко окисляющиеся. Термин «жесткое основание» подчеркивает, что соединение — донор пары электронов — прочно удерживает свои электроны. У жестких оснований высшая занятая молекулярная орбиталь (ВЗМО), которая участвует в связывании с орбиталью акцептора пары электронов, имеет низкую энергию (расположена близко к ядру атома). Атомами-донорами в жестких основаниях являются азот, кислород, фтор, хлор. Мягкие основания слабо удерживают свои валентные электроны, ВЗМО донора имеет высокую энергию. Донорами пары электронов выступают атомы углерода, серы, фосфора, иода.
Следует отметить, что понятия «жесткие» и «мягкие» кислоты и основания не равноценны понятиям «сильные» и «слабые» кислоты и основания. Это две независимые характеристики кислот и оснований. Принцип ЖМКО используется для качественного описания эффективности протекания кислотно-основного взаимодействия: (!) жесткие кислоты лучше координируются с жесткими основаниями, мягкие кислоты — с мягкими основаниями. Концепция Пирсона основана на том, что взаимодействие между орбиталями с близкими энергиями более эффективно, чем между орбиталями, имеющими разную энергию.
Действие принципа ЖМКО можно проиллюстрировать следующим примером. При взаимодействии галогеноалканов с нуклеофилами (являющимися также и основаниями) могут происходить конкурентные реакции — нуклеофильного замещения или элиминирования. Реакция нуклеофильного замещения осуществляется посредством взаимодействия нуклеофила с атомом углерода, связанным с галогеном. В реакции элиминирования происходит также и отщепление протона от соседнего атома углерода под влиянием основания.
При взаимодействии 1,2-дихлороэтана с жестким основанием (метоксид-ионом) вследствие атаки реагента на жесткую кислоту — протон преимущественно происходит реакция элиминирования. Мягкое основание — тиофеноксид-ион — предпочтительно реагирует с более мягкой кислотой — атомом углерода, в результате чего образуется продукт реакции нуклеофильного замещения:

Типы органических кислот. Факторы, определяющие кислотность. Примеры.
Способность органических соединений к ионизации изменяется в широких пределах. В водном растворе экспериментально возможно определить рКа лишь до значений -15 (рКа воды 15,7). Для более слабых кислот определение рКа проводят в других растворителях. Например, в жидком аммиаке можно определять рКа до значения 33. Соотнести кислотность в воде и аммиаке можно, определив рКа для какого-либо соединения параллельно в этих двух средах, что позволяет осуществлять переход от одной шкалы к другой. Подход к оценке кислотности очень слабых СН-кислот - предложили полярографическую шкалу кислотности. Эта шкала охватывает кислоты, у которых кислотность изменяется в пределах 50 порядков. И все же полученные значения рКа для слабых СН-кислот являются весьма приблизительными.
Ввиду необъятно большого числа органических соединений невозможно для каждого из них иметь количественную оценку кислотных свойств. Действительно, константы рКа в различных растворителях установлены для относительно небольшого числа соединений и неизвестны для многих даже важных биологически активных веществ. Поэтому большое значение приобретает качественный подход к оценке кислотных свойств разных кислотных центров, который базируется на оценке стабильности сопряженного основания: (!) сила кислоты определяется стабильностью сопряженного основания (аниона), образующегося из этой кислоты. Чем стабильнее анион, тем сильнее кислота.
Другими словами, кислотность зависит от совокупности ряда факторов, обусловливающих стабильность аниона А-:
электроотрицательности и поляризуемости элемента, отдающего протон;
степени делокализации отрицательного заряда в анионе;
способности аниона к сольватации, т. е. взаимодействию с молекулами растворителя.
Обычно на кислотность большинства веществ в растворе оказывают влияние одновременно несколько факторов, но в каждом конкретном случае один или несколько из них будут преобладающими. Ниже будет рассмотрена роль этих факторов в определении стабильности анионов (вначале без учета влияния среды). В отсутствие эффектов сольватации проявляется истинная (собственная) кислотность данного соединения. Собственная кислотность проявляется в газовой фазе, и в этом случае она определяется исключительно структурой соединения.
Природа атома в кислотном центре. Роль электроотрицательности и поляризуемости элемента в кислотном центре может быть наглядно продемонстрирована на примере кислот Брёнстеда с различными кислотными центрами, но с одинаковыми заместителями, в данном случае этильными радикалами:

По возрастанию кислотности кислоты Брёнстеда: 
В таком же порядке возрастает стабильность соответствующих анионов. Чем более электроотрицательным является элемент в кислотном центре, тем он более способен нести отрицательный заряд и соответственно тем стабильнее будет образующийся анион.
Поскольку электроотрицательность атома кислорода (3,5) больше, чем атома азота (3,0) и атома углерода (2,5), то в таком же порядке будет уменьшаться стабильность соответствующих анионов. Сравниваемые элементы находятся в одном периоде, и их поляризуемость практически одинакова. Для элементов третьего и последующего периодов периодической системы основное влияние на стабильность аниона оказывает фактор поляризуемости. В приведенной выше группе кислот Брёнстеда в случае этантиол а атом серы больше по размеру и легче поляризуется, чем элементы второго периода (О, N, С) у других кислот. Отрицательный заряд на атоме серы делокализован в большей степени. Поэтому алкантиолят-ион стабильнее, чем соответствующий алкоксид-ион и т. д. В целом же SH-кислота будет сильнее ОН-, NH- и СН-кислот. Для представленной выборки соединений кислотность в газовой фазе и в растворе будет одинаковой в связи с тем, что сольватация близких по размеру анионов будет нивелирована. Тиолы, как более сильные кислоты, реагируют со щелочами, а также с оксидами, гидроксидами и солями тяжелых металлов. Со щелочными металлами тиолы образуют растворимые в воде соли, с тяжелыми металлами — нерастворимые:

Способность тиолов связывать ионы тяжелых металлов обусловила использование их в качестве противоядия при отравлениях соединениями мышьяка, ртути, хрома, висмута и других металлов, относящихся к тиоловым ядам.
Спирты, как слабые кислоты, практически не реагируют с гидроксидами металлов; значения рКа спиртов близки рКа воды, равной 15,7. При взаимодействии этанола со щелочью равновесие сдвинуто в сторону исходного спирта и содержание этоксида натрия в реакционной смеси будет невелико. Однако спирты способны реагировать со щелочными металлами и сильными основаниями, такими, как гидриды или амиды металлов, литий- и магнийорганические реагенты:


Этиламин и пропан не проявляют заметных кислотных свойств. Тем не менее в других NH- и СН- кислотные свойства выражены гораздо сильнее, что обусловлено электроноакцепторным влиянием заместителей, связанных с кислотным центром.
Стабилизация аниона за счет сопряжения. При сравнительной оценке кислотности соединений, имеющих одинаковый элемент в кислотном центре, основным фактором, определяющим собственную кислотность, становится делокализация отрицательного заряда в анионе. Стабильность аниона значительно повышается, если имеется возможность делокализации отрицательного заряда по системе сопряженных связей. Характерным примером проявления действия этого фактора в группе ОН-кислот является повышение кислотности при переходе от спиртов к фенолам и к карбоновым кислотам.
Увеличение кислотности фенолов по сравнению с алифатическими спиртами объясняется большей стабильностью феноксид-иона, в котором отрицательный заряд делокализуется с участием атомов углерода бензольного кольца:

Повышенная по сравнению с фенолами кислотность карбоновых кислот обусловлена стабилизацией ацилат-ионов, в которых отрицательный заряд за счет р,π-сопряжения распределен поровну между двумя атомами кислорода:

Делокализация отрицательного заряда по системе сопряженных связей, приводящая к стабилизации аниона, приводит к увеличению кислотности и других типов кислот.
Влияние электронных эффектов заместителей, связанных с кислотным центром. Независимо от механизма передачи электронного влияния заместителя (индуктивного или мезомерного) в общем случае выполняется нижеприведенное правило: (!) Электроноакцепторные заместители способствуют делокализации отрицательного заряда, стабилизируют анион и тем самым увеличивают кислотность. Электронодонорные заместители, наоборот, понижают ее. Влияние на кислотность электроноакцепторных атомов галогенов наглядно иллюстрируется значениями рКа моно- и тригалогенозамещенных уксусных кислот. Наиболее сильный эффект оказывает самый электроотрицательный элемент фтор:

Влияние заместителей особенно ярко проявляется в ряду замещенных фенолов. Электроноакцепторная нитрогруппа, например, дополнительно стабилизирует образующийся анион, что приводит к увеличению кислотности n-нитрофенола (рКа 7,1) по сравнению с незамещенным фенолом (рКа 10). Наличие в бензольном кольце трех нитрогрупп приводит к тому, что 2,4,6-тринитрофенол (пикриновая кислота) становится уже очень сильной кислотой (рКа 0,8), сравнимой с минеральными кислотами. Электронодонорные метальная и аминогруппы дестабилизируют феноксид-ионы и уменьшают кислотность n-метилфенола (рКа 10,1) и n-аминофенола (рКа 10,5):

В ароматических кислотах влияние заместителей, находящихся в мета- и пара-положениях бензольного кольца, подчиняется общему правилу: электроноакцепторные — увеличивают кислотность, электронодонорные — уменьшают. Поведение орто-замещенных кислот часто бывает аномальным. Как правило, орто-замещенные бензойные кислоты сильнее соответствующих пара-изомеров, независимо от того, является ли заместитель донором или акцептором. Такое влияние заместителя называют орто-эффектом. Иногда орто-эффект имеет вполне очевидное объяснение. Например, n-гидроксибензойная кислота (рKa4,58) слабее бензойной (рKa4,19), как и ожидалось исходя из влияния на кислотность электронодонорной ОН-группы. Однако салициловая (о-гидроксибензойная) кислота гораздо сильнее (рКа 2,98), поскольку в стабилизацию образующегося из этой кислоты салицилат-иона вносит вклад внутримолекулярная водородная связь, что и приводит к увеличению кислотности именно этого изомера:


Эффект сольватации. Влияние сольватации может быть очень значительным. Почти во всех случаях кислотно-основных взаимодействий можно считать, что исходные нейтральные молекулы и образующиеся ионы сольватируются по-разному. Стабильность аниона существенно зависит от его сольватации в растворе. Взаимодействие между растворителем и ионом может быть различным по своей природе — электростатическим, координационным (в том числе и за счет водородных связей), гидрофобным. При сольватации иона происходит перераспределение заряда с участием окружающих его молекул растворителя. Как правило, сольватация ионов в полярных растворителях тем сильнее, чем более полярен растворитель. Поскольку всю совокупность взаимодействий между ионом и окружающей его средой учесть чрезвычайно трудно, то обычно пользуются эмпирическим правилом: (!) чем меньше размер иона и чем больше локализован в нем заряд, тем он лучше сольватируется.
Трудным для интерпретации является вопрос о соотношении между кислотностью соединений в водной среде и газовой фазе. Развитие методов ионного циклотронного резонанса и масс-спектрометрии высокого давления обеспечило возможность достаточно точных определений термодинамических равновесий в газовой фазе. Так, было установлено, что по силе кислотности уксусная кислота и фенол в газовой фазе близки, тогда как в воде рКа этих соединений за счет эффекта гидратации анионов различаются на пять порядков. Полагают, что делокализация отрицательного заряда по бензольному кольцу в фенолят-ионе снижает его способность к образованию водородных связей с водой. Собственная кислотность алифатических спиртов в газовой фазе возрастает с увеличением длины и разветвленности алкильного радикала:

studfiles.net
Количественная характеристика кислот и оснований по теории Бренстеда – Лоури.
Л6. ПРОТОЛИТИЧЕСКИЕ РАВНОВЕСИЯ И ПРОЦЕССЫ.
Согласно теории электролитической диссоциации Аррениуса кислотой является любое вещество в состав, которого входит ион водорода, основанием – гидроксид ион. Но в органической и биологической химии для оценки кислотности и основности используютпротолитическую теорию кислот и оснований Бренстеда – Лоури (1923г.).По теории понятия кислотность и основность связаны с переносом протона.
Кислотойявляется любая частица, способная отдать ион водорода.
Nh5+ → H+ + Nh40 HCl → H+ + Cl-
Основаниемявляется любая частица, способная принять ион водорода.
h3O + H+ → h4O+ NO3- + H+→ HNO3
По теории кислота и основание должны находиться в сопряженной системе, т.е. кислота не может существовать без основания.
HA + B = A- + BH+
кислота + основание = сопряженное основание + сопряженная кислота
Из этого уравнения следует: кислота и основание образуют кислотно-основные пары. Чем сильнее кислота, тем слабее будет сопряженное с ней основание и наоборот.
Пример 1:..
СН3СООН + НОН ↔ СН3СОО-+ Н3О+
кислота основание сопряж. основание сопряж. кислота
Поскольку этот процесс обратим, то он характеризуется равновесием:
Кс= [СН3СОО-]·[Н3О+] / [СН3СООН]·[НОН]
Кс· [Н2О] = [СН3СОО-]·[Н3О+] / [СН3СООН]
Ка= [СН3СОО-]·[Н+] / [СН3СООН] –константа кислотности
Чем больше константа кислотности, тем сильнее кислота, например: Ка (СН3СООН) = 1,75·10-5; Ка (Н2СО3) = 4,7·10-7.
Так как величины констант кислотности очень малы, то удобнее использовать не абсолютные значения констант кислотности, а их отрицательные логарифмы – показатели кислотности - рКа.
рКа= -lgКа
рКа(СН3СООН) = -lg1,75·10-5= 4,76
рКа(Н2СО3) = -lg4,7·10-7= 6,33
Чем больше показатель кислотности, тем слабее кислота и наоборот.
Пример 2:..
Nh4+HOH↔Nh5++OH-
основание кислота сопряж. кислота сопряж. основание
Кс= [Nh5+]·[ОH-] / [NН3]·[НОН]
Кс· [НОН] = [Nh5+]·[ОH-] / [NН3]
Кв= [Nh5+]·[ОH-] / [NН3] –константа основности.
Чем выше константа основности, тем сильнее основание. Так как величины констант основности очень малы, то удобнее использовать не абсолютные значения констант основности, а их отрицательные логарифмы – показатели основности – рКв.
рКв= -lgКв
Чем меньше показатель основности, тем сильнее основание и наоборот.
Диссоциация воды. Ионное произведение воды.
..
НОН + НОН = ОН-+ Н3О+
кислота основание сопряж. основание сопряж. кислота
Вода по данной теории может быть как кислотой, так и основанием. Если процесс равновесный, то мы можем охарактеризовать его константой диссоциации – Кд.
Кд= [ОН-]·[Н3О+] / [НОН]·[НОН] = [ОН-]·[Н+] / [НОН]
Кд · [НОН] = [ОН-]·[Н+]
Кw= [ОН-]·[Н+] = 1·10-14 моль/л –ионное произведение воды.
В воде [H+] = [ОН-] = 1·10-7 моль/л; 10-1÷ 10-5– кислая среда, 10-5÷ 10-7– слабокислая среда, 10-7– нейтральная среда, 10-7÷ 10-9– слабощелочная среда, 10-9÷ 10-14– щелочная среда.
На практике чаще пользуются не абсолютным значением ионного произведения воды, а отрицательным логарифмом равновесной концентрации ионов водорода или гидроксид ионов.
рН = -lg[H+]; рОН = -lg[ОН-]
рН + рОН = 14
Для водных растворов рН = 1 ÷ 5 – кислая среда; рН = 5 ÷ 7 – слабокислая среда; рН = 7 – нейтральная среда; рН = 7 ÷ 9 – слабощелочная среда; рН = 9 ÷ 14 – щелочная среда.
Показатель кислотности для слабых кислот и оснований высчитывается по формулам:
рНслабой кислоты = ½ рКа– ½lgС(fэ)кислоты
рНслабого основания = 14 – ½ рКв+ ½lgС(fэ)основание
Внутренняя среда организма характеризуется постоянством концентрации ионов водорода. Это явление называют изогидрия. Например: рН крови = 7,1 ÷ 7,2; желудочного сока = 0,9 ÷ 1,1; пузырной желчи = 5,4 ÷ 6,9; грудного молока = 6,6 ÷ 6,8; слезной жидкости = 7,4. Изменения рН приводит к нарушению деятельности ферментов, регуляции осмотического давления и может приводить даже к гибели клеток. Сдвиг рН в кислую сторону, называетсяацидоз, а в щелочную –алкалоз.Так при сахарном диабете (кетоацидоз) наблюдается ацидоз, а при потери кислоты в случае неукротимой рвоты - алкалоз. Постоянство рН внутренних сред организма поддерживается работой почек, легких, печени – физиологический механизм, но основную роль играет химический механизм – за счет буферных систем.
studfiles.net
Загадки простой воды. Раритетные издания. Наука и техника
Всеволод Арабаджи
Вода вокруг нас
Воде принадлежит огромная роль в природе. В самом деле, ведь именно море явилось первой ареной жизни на Земле. Растворенные в морской воде аммиак и углеводы в контакте с некоторыми минералами при достаточно высоком давлении и воздействии мощных электрических разрядов могли обеспечить образование белковых веществ, на основе которых в дальнейшем возникли простейшие организмы. По мнению К.Э. Циолковского, водная среда способствовала предохранению хрупких и несовершенных вначале организмов от механического повреждения. Суша и атмосфера стали впоследствии второй ареной жизни.
Можно сказать, что все живое состоит из воды и органических веществ. Без воды человек, например, мог бы прожить не более 2...3 дней, без питательных же веществ он может жить несколько недель. Для обеспечения нормального существования человек должен вводить в организм воды примерно в 2 раза больше по весу, чем питательных веществ. Потеря организмом человека более 10% воды может привести к смерти. В среднем в организме растений и животных содержится более 50% воды, в теле медузы ее до 96, в водорослях 95...99, в спорах и семенах от 7 до 15%. В почве находится не менее 20% воды, в организме же человека вода составляет около 65% (в теле новорожденного до 75, у взрослого 60%). Разные части человеческого организма содержат неодинаковое количество воды: стекловидное тело глаза состоит из воды на 99%, в крови ее содержится 83, в жировой ткани 29, в скелете 22 и даже в зубной эмали 0,2%.
В первичной водной оболочке земного шара воды было гораздо меньше, чем теперь (не более 10% от общего количества воды в водоемах и реках в настоящее время). Дополнительное количество воды появилось впоследствии в результате освобождения воды, входящей в состав земных недр. По расчетам специалистов, в составе мантии Земли воды содержится в 10...12 раз больше, чем в Мировом океане. При средней глубине в 4 км Мировой океан покрывает около 71% поверхности планеты и содержит 97,6% известных нам мировых запасов свободной воды. Реки и озера содержат 0,3% мировых запасов свободной воды.
Большими хранилищами влаги являются и ледники, в них сосредоточено до 2,1% мировых запасов воды. Если бы все ледники растаяли, то уровень воды на Земле поднялся бы на 64 м и около 1/8 поверхности суши было бы затоплено водой. В эпоху оледенения Европы, Канады и Сибири толщина ледяного покрова в горных местностях достигала 2 км. В настоящее время вследствие потепления климата Земли постепенно отступают границы ледников. Это обусловливает медленное повышение уровня воды в океанах.
Около 86% водяного пара поступает в атмосферу за счет испарения с поверхности морей и океанов и только 14% за счет испарения с поверхности суши. В итоге в атмосфере концентрируется 0,0005% общего запаса свободной воды. Количество водяного пара в составе приземного воздуха изменчиво. При особо благоприятных условиях испарения с подстилающей поверхности оно может достигать 2%. Несмотря на это, кинетическая энергия движения воды в морях составляет не более 2% от кинетической энергии воздушных течений. Происходит это потому, что более трети солнечного тепла, поглощаемого Землей, тратится на испарение и переходит в атмосферу. Кроме того, значительное количество энергии поступает в атмосферу за счет поглощения проходящего через нее солнечного излучения и отражения этого излучения от земной поверхности. Прошедшая же через водную поверхность лучистая энергия Солнца и небесного свода уменьшается в интенсивности наполовину уже в верхнем полуметре воды вследствие сильного поглощения в инфракрасной части спектра.
Очень большое значение в жизни природы имеет то обстоятельство, что наибольшая плотность у воды наблюдается при температуре 4°C. При охлаждении пресных водоемов зимой по мере понижения температуры поверхностных слоев более плотные массы воды опускаются вниз, а на их место поднимаются снизу теплые и менее плотные. Так происходит до тех пор, пока вода в глубинных слоях не достигнет температуры 4°C. При этом конвекция прекращается, так как внизу будет находиться более тяжелая вода. Дальнейшее охлаждение воды происходит только с поверхности, чем и объясняется образование льда в поверхностном слое водоемов. Благодаря этому подо льдом не прекращается жизнь.
Вертикальное перемешивание морской воды осуществляется за счет действия ветра, приливов и изменения плотности по высоте. Ветровое перемешивание воды происходит в направлении сверху вниз, приливное – снизу вверх. Плотностное перемешивание возникает за счет охлаждения поверхностных вод. Ветровое и приливное перемешивания распространяются на глубину до 50 м, на больших глубинах может сказываться действие только плотностного перемешивания.
Интенсивность перемешивания придонных и поверхностных вод способствует их освежению, обогащению кислородом и питательными веществами, необходимыми для развития жизни. Растворенный в воде воздух всегда более богат кислородом, чем воздух атмосферный. Имеющийся в воде кислород оказывает благотворное влияние на развитие в ней жизненных процессов. За счет повышенного количества кислорода в растворенном воздухе погруженные в воду металлы усиленно подвергаются разрушению (коррозии).
При замерзании чистая вода расширяется почти на 10%, у морского льда изменение объема происходит на меньшую величину. Поскольку вода при замерзании расширяется, увеличение внешнего давления понижает температуру ее замерзания; температура плавления льда, наоборот, повышается с давлением. В лабораторных условиях при давлении более 40 тыс. атмосфер можно получить лед, который будет плавиться при температуре 175°C. Теплоемкость и теплота плавления льда уменьшаются с температурой, теплопроводность же почти не зависит от температуры. Когда толщина льда на поверхности водоема достигает 15 см, он становится надежным теплоизолятором между водой и воздухом.
Морская вода замерзает при температуре – 1,91°C. При дальнейшем понижении температуры до – 8,2°C начинается осаждение сернокислого натрия, и только при температуре – 23°C из раствора выпадает хлористый натрий. Так как часть рассола при кристаллизации уходит изо льда, соленость его меньше солености морской воды. Многолетний морской лед настолько опресняется, что из него можно получать питьевую воду. Температура максимальной плотности морской воды ниже температуры замерзания. Это является причиной довольно интенсивной конвекции, охватывающей значительную толщу морской воды и затрудняющей замерзание. Теплоемкость морской воды стоит на третьем месте после теплоемкости водорода и жидкого аммиака.
Иногда вода замерзает при положительной температуре. Такое явление наблюдается в трубопроводах и почвенных капиллярах. В трубопроводах вода может замерзнуть при температуре +20°C. Объясняется это присутствием в воде метана. Поскольку молекулы метана занимают примерно в 2 раза больший объем, чем молекулы воды, они «расталкивают» молекулы воды, увеличивают расстояние между ними, что приводит к понижению внутреннего давления и повышению температуры замерзания. В почвенной влаге аналогичную роль выполняют молекулы белка. За счет влияния белковых молекул температура замерзания воды в почвенных капиллярах может возрасти до +4,4°C.
Снежинки, как правило, бывают в виде шести- и двенадцатилучевых звездочек, шестиугольных пластинок, шестигранных призм. При понижении температуры воздуха уменьшаются размеры образующихся кристаллов и возрастает разнообразие их форм. Особенности роста кристаллов в воздухе связаны с наличием в нем водяного пара.
Все знают, что сода в море соленая. Это зависит от концентрации растворенных в ней солей, но не всем известно, что в разных морях и океанах соленость воды неодинакова. Средняя соленость вод океана составляет 35%; соленость морской воды может изменяться от нуля вблизи мест впадения крупных рек до 40% в тропических морях. Вода для питья должна содержать менее 0,05% растворенных солей. Растения погибают при наличии в поливной воде в виде примеси более 0,25% солей.
Существующие в природе жидкости можно разделить на нормальные и ассоциированные. Нормальными называются те жидкости, у которых молекулы не объединяются в группы (ассоциации). Жидкости, не подчиняющиеся этому условию, называются ассоциированными. Вода принадлежит к числу ассоциированных жидкостей. Если бы вода была неассоциированной жидкостью, температура плавления льда в нормальных условиях была бы +1,43°C, а температура кипения воды 103°C. Как правило, теплоемкость жидкостей с температурой растет, но у воды с приближением к температуре +35°C теплоемкость после роста спадает до минимума, а затем снова переходит к монотонному росту. Происходит это из-за того, что при такой температуре разрушаются молекулярные ассоциации. Чем проще молекулярная структура, тем меньше теплоемкость вещества. Температура наибольшей плотности воды понижается с увеличением давления и при давлении 150 атмосфер достигает 0,7°C. Это также объясняется изменением структуры молекулярных ассоциаций.
Среди существующих в природе жидкостей вода обладает наибольшей теплоемкостью. Это предопределяет большое ее влияние на климат. Основным терморегулятором климата являются воды океанов и морей: накапливая тепло летом, они отдают его зимой. Отсутствие водоемов на местности обычно приводит к образованию резко континентального климата. Благодаря влиянию океанов на значительной части земного шара обеспечивается перевес осадков на суше над испарением, и организмы растений и животных получают нужное им для жизни количество воды. Водная и воздушная оболочки земного шара постоянно обмениваются углекислотой с горными породами, растительным и животным миром, что также способствует стабилизации климата.
Известно, что молекулы, находящиеся на поверхности жидкости, имеют избыток потенциальной энергии и поэтому стремятся втянуться внутрь так, что при этом на поверхности остается минимальное количество молекул. За счет этого вдоль поверхности жидкости всегда действует сила, стремящаяся сократить поверхность. Это явление в физике получило название поверхностного натяжения жидкости.
Среди существующих в природе жидкостей поверхностное натяжение воды уступает только ртути. С поверхностным натяжением воды связано ее сильное смачивающее действие (способность «прилипать» к поверхности многих твердых тел). Кроме того, вода является универсальным растворителем. Теплота ее испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь аммиаку.
В природе существует шесть изотопов кислорода. Три из них радиоактивны. Стабильными изотопами являются О16, О17 и О18. При испарении в водяной пар в основном переходит изотоп О16, неиспарившаяся же вода обогащается изотопами О17 и О18. В водах морей и океанов отношение О18 к О16 больше, чем в водах рек. В раковинах животных тяжелые изотопы кислорода встречаются чаще, чем в воде. Содержание изотопа О18 в атмосферном воздухе зависит от температуры. Чем выше температура воздуха, тем больше воды испаряется и тем большее количество О18 переходит в атмосферу. В период оледенений планеты содержание изотопа О18 в атмосфере было минимальным.
Как известно, молекула воды состоит из двух атомов водорода и одного атома кислорода. В составе обычной воды h3O имеется небольшое количество тяжелой воды D2O и совсем незначительное количество сверхтяжелой воды T2O. В молекулу тяжелой воды вместо обыкновенного водорода H – протия входит его тяжелый изотоп D – дейтерий, в состав молекулы сверхтяжелой воды входит еще более тяжелый изотоп водорода Т – тритий. В природной воде на 1 000 молекул h3O приходится две молекулы D2O и на одну молекулу T2O – 1019 молекул h3O.
Тяжелая вода D2O бесцветна, не имеет ни запаха, ни вкуса и живыми организмами не усваивается. Температура ее замерзания 3,8°C, температура кипения 101,42°C и температура наибольшей плотности 11,6°C. По гигроскопичности тяжелая вода близка к серной кислоте. Ее плотность на 10% больше плотности природной воды, а вязкость превышает вязкость природной воды на 20%. Растворимость солей в тяжелой воде примерно на 10% меньше, чем в обычной воде. Поскольку D2O испаряется медленнее легкой воды, в тропических морях и озерах ее больше, чем в водоемах полярных широт.
Комбинируя различные сочетания изотопов водорода и стабильных изотопов кислорода, можно получить следующие разновидности молекул воды: h3O16, h3O17, h3O18, HDO16, HDO17, HDO18, D2O16, D2O17, D2O18, T2O16, T2O17, T2O18, THO16, THO17, THO18, TDO16, TDO17, TDO18. Если же использовать и нестабильные изотопы кислорода O14, O15 и O19, то всего можно получить 36 разновидностей воды. В природе чаще встречаются молекулы воды, построенные из наиболее распространенных изотопов. Молекул h3O16 в природной воде содержится 99,73%, молекул h3O18...0,2% и молекул h3O17...0,04%.
Рассмотрим некоторые наиболее важные оптические свойства воды и льда. Не все знают, что вода прозрачна только для видимых лучей и сильно поглощает инфракрасную радиацию. Поэтому на инфракрасных фотографиях водная поверхность всегда получается черной. При прохождении света через слой морской воды толщиной в 0,5 м поглощаются только инфракрасные лучи, ниже поглощаются последовательно красные, желтые, а затем и сине-зеленые тона. По наблюдениям из батискафа человеческий глаз может обнаружить присутствие солнечного света на глубине до 600...700 м. Эталоном прозрачности воды является Саргассово море. Белый диск в этом море виден на глубине до 66,5 м. Дальность видимости снизу вверх в приповерхностном слое моря составляет около 100 м.
Не весь солнечный свет поглощается водой. Вода отражает 5% солнечных лучей, в то время как снег – около 85%. Под лед океана проникает только 2% солнечного света.
Синий цвет чистой океанской воды объясняется избирательным поглощением и рассеянием света в воде. В условиях диффузного освещения морской поверхности вследствие преобладания при этом отраженного света море выглядит более серым. При наличии ряби и волнения насыщенность цвета увеличивается (с подветренной стороны более, чем с наветренной).
Существенную роль в жизни растений играют оптические свойства водяного пара. Дело в том, что водяной пар сильно поглощает инфракрасные лучи с длиной волны от 5,5 до 7 микрон, что важно для предохранения почвы от заморозков. Еще более действенным средством от заморозков является выпадение росы и образование тумана: конденсация влаги сопровождается выделением большого количества тепла, задерживающего дальнейшее охлаждение почвы.
Зная физические свойства воды и льда, человек давно использует их в своей практической деятельности. Так, например, иногда применяется прокладка голых электрических проводов прямо по льду, так как электропроводность сухого льда и снега весьма мала. Она во много раз меньше электропроводности воды. Различные примеси оказывают значительное влияние на электропроводность воды и почти не изменяют электропроводности льда. Электропроводность химически чистой воды обусловлена частичной диссоциацией молекулы воды на ионы H+ и OH–. Основное значение для электропроводности и воды и льда имеют перемещения ионов H+ («протонные перескоки»). Электропроводность химически чистой воды при 18°C равна 3,8·10–8 Ом–1·см–1 а электропроводность морской воды около 5·10–2 Ом–1·см–1. Электропроводность пресной природной воды может быть 1 000 раз меньше, чем морской. Это объясняется тем, что в воде морей и океанов растворено большее количество солей, чем в речной воде.
Существенную характеристику электрических свойств вещества дает относительная диэлектрическая проницаемость. У воды она имеет величину в пределах 79...81, у льда 3,26, у водяного пара 1,00705.
Без воды не было бы на Земле ни жизни, ни производства.
Судьбы и нравы рек
Оглавление
Текст издания:
Арабаджи Всеволод Исидорович. Загадки простой воды. М.: «Знание», 1973
Дата публикации:
7 сентября 2001 года
n-t.ru