Природные воды (стр. 2 из 2). Природные воды
Природные воды - часть 2
Различные веществаадсорбируют на своей поверхности некоторое количество воды за счет межмолекулярных сил притяжения. Вода,присоединенная по адсорбционному типу, называется гигроскопической; онаудаляется легче, чем кристалллизационная.
Ионныйсостав природных вод.
Происходящее в почвахпроцессы окисления органических веществ вызывают расход кислорода и выделениеуглекислоты, поэтому в воде при фильтрации её через почву возрастает содержаниеуглекислоты, что приводит к обогащению природных вод карбонатами кальция,магния и железа, с ообразованием растворимых в воде кислых солей типа:
CaCO3 + h3O + CO2 ® Ca(HCO3)2
Бикарбонаты присутствуютпочти во всех водах в тех или иных количествах. Большую роль в формированиихимического состава воды играют подстилающие почву грунты, с которыми водавступает в соприкосновение, фильтруясь и растворяя некоторые минералы. Особенно интенсивно обогащают воды осадочныепороды,такие, как известняки, доломиты,мергели, гипс, каменная соль и др. Всвою очередь почва и породы обладают способностью адсорбировать из природнойводы некоторые ионы ( например, Ca2+ , Mg2+ ), замещая ихэквивалентным количество других ионов ( Na+ , K+ ).
Подпочвенными водамилегче всего расстворяются хлориды и сульфаты натрия и магния, хлорид кальция.Силикатные и алюмосиликатные породы граниты, кварцевые породы и т.д. ) почтинерасстворимы в воде и содержащей углекислоту и органические кислоты.
Наиболеераспространенними в природных водах являются следующие ионы : Cl-,SO4 ,HCO3 ,CO2 ,Na+ ,Mg2+ ,Ca2+ ,H+.
Ион хлора присутствуетпочти во всех природных водоемах, причем его содержание меняется в оченьшироких пределах. Сульфат - ион также распространен повсеместно. Основнымисточником растворенных в воде сульфатов является гипс. В подземных водах ссодержанием сульфат - иона обычно выше, чем в воде рек и озер. Из ионовщелочных металлов в природных водоемах в наибольших количествах находится ионнатрия, который является характерным ионом сильноминерализованных вод морей иокеанов.
Ионы кальция и магния вмаломинерализованных водах занимают первое место. Основным источником ионовкальция является известняки, а магния -доломиты (MgCO3 ,CaCO3). Лучшая расстворимость сульфатови карбонатов магния позволяет присутствовать ионам магния в природных водах вбольших концентрациях, чем ионов кальция.
Ионы водорода вприродной воде обусловлены диссоциацией угольной кислоты. Большинство природныхвод имеют pH в пределах 6,5 - 8,5. Для поверхностных вод в связи с меньшим содержаниемв них углекислоты pH обычно выше, чем для подземных.
Соединения азота вприродной воде представлены ионами аммония, нитритными, нитратными ионами засчет разложения органических веществ животного и растительного происхождения.Ионы аммония, кроме того, попадают в водоемы со сточными промышленными водами.
Соединения железа оченьчасто встречаются в природных водах, причем переход железа в раствор можетпроисходить под действием кислорода или кислот ( угольной, органических(. Такнапример, при окислении весьма распространенного в породах пирита получаетсясернокислое железо:
FeS2 + 4O2 ® Fe2+ + 2SO2а придействии угольной кислоты - карбонат железа:
FeS2 + 2h3CO3 ® Fe2+ + 2HCO3 + h3S + S.
Соединения кремния вприродных водах могут быть в виде кремнеивой кислоты. При pH < 8 кремниеваякислота находится практически в недиссоциированном виде; при pH >8кремниевая кислота присутствует совместно с HSiO2, а при pH >II -только HsiO2. Часть кремния находится в коллоидном состоянии, счастицами состава HSiO2h3O , а также в видеполикремнеивой кислоты: X·SiO2·y·h3O. Вприродных водах присутствуют также Al3+ ,Mn2+ и другиекатионы.
Помимо веществ ионноготапа природные воды содержат также газы и органические и грубоцисперсныевзвеси. Наиболее распространенными в природных водах газами являются кислород иуглекислый газ. Источником кислорода является атмосфера, углекислоты -биохимические процессы, происходящие в глубинных слоях земной коры, углекислотаиз атмосферы.
Из органических веществ,попадающих извне, следует отметить гуминовые вещества, вымываемые водой изгумусовых почв (торфянников, сапропелитов и др.). Большая часть из нихнаходится в коллоидном состоянии. В самих водоемах органические веществанепрерывно поступают в воду в результате отмирания различных водных организмов.При этом часть из них остается взвешенной в воде, а другая опускается на дно,где происходит их распад.
Грубодисперсные примеси,обуславливающие мутность природных вод, представляют собой веществаминерального и органического происхождения, смываемые с верхнего покрова землидождями или талыми водами во время весенних паводков.
Подземныеводы.
Советский ученый лебедевна основе многочисленных экспериментов разработал классификацию видов воды впочвах и грунтах. Представления А.Ф.Лебедева, получившие дальнейшее развитие вболее поздних исследованиях, позволили выделить следующие виды воды в горныхпородах: в форме пара, связанную, свободную, в твердом состоянии.
Парообразованная водазанимает в породе поры, не заполненные жидкой водой, и перемещается за счетразличной величины упругости пара или потоком воздуха. Конденсируясь начастицах породы, водяные пары переходят в другие виды влаги.
Различают нескольковидов связанной воды. Сорбированная вода удерживается частицами породы подвлиянием сил, возникающих при взаимодействии молекул воды с поверхностью этихчастиц и с обменными катионами. Сорбированную воду разделяют на прочносвязаннуюи рыхлосвязанную. Если влажную глину подвергать давлению, то даже под давлениемв несколько тысяч атмосфер часть воды невозможно удалить из глины. Этопрочносвязанная вода. Полное удаление такой воды достигается лишь притемпературе 150 - 300оС. Чем меньше минеральные частицы, слагающиепороду, и, следовательно, выше их поверхностная энергия, тем большее количествопрочносвязанной воды в этой породе. Рыхлосвязанная, или пленочная, водаобразует плёнку вокруг миниральных частиц. Она удерживается слабее и довольнолегко удаляется из породы под давлением. Особенно важную роль играетсорбированная вода в глинистых породах. Она влияет на просностные свойства глини фильтрационную способность.
Как уже указывалось, связаннаявода участвует в строении кристаллических решёток некоторых минералов.Кристаллизационная вода входит в состав кристаллической решётки. Гипс, напримерсодержит две молекулы воды CaSO4·2h3O. Принагревании гипс теряет воду и превращается в ангидрит (CaSO4).
Известно, что притемпературе около 4оС вода имеет максимальную плотность 1,000 г/см3.При 100оС её плотность - 0,958 г/см3, при 250оС- 0,799 г/см3. За счетпониженной плотности происходит конвективное, восходящее движение нагретыхподземных вод.
Принято считать, чтовода практически несжимаема. Действительно, коэффициент сжимаемости воды,показывающий, на какую долю первоначального объема уменьшится объём воды приувеличении давления на I aт, очень мал. Для чистой воды он равен 5·10-5 I/ат.Однако упругие свойства воды, а также водовмещающих пород играют важнейшую рольв подземной гидродинамике. За счет сил упругости создается напор подземных вод.Температура и давление действуют на плотность воды в противоположномнаправлении.
Плотность подземных водзависит также от их химического состава и концентрации солей. Если пресныеподземные воды имеют плотность, близкую к 1 г/см3, то плотность концентрированных рассолов достигает1,3 - 1,4 г/см3. Повышение температуры приводит к значительномууменьшению вязкости подземных вод и, таким образом, облегчает их движение черезмельчайшие поры.
Подземные водыисключительно разнообразны по свому химическому составу. Высокогорные источникиобычно дают очень пресную воду с низким содержанием растворенных солей, иногдаменее 0,1 г. в 1 л., а в одной из скважин в Туркменистане был рассол сминерализацией 547 г/л.
Списоклитературы
1. “Состав, свойства иметоды очистки сточных вод предприятий горной промышленности” Е.Ф. Панина1990г.
2. И.Ф.Ливчак, Ю.В.Воронов "Охранаокружающей среды".
3. Н.М.Чернова,А.М.Былова "Экология".
4. журнал"ЗНАНИЕ"(народный университет естественнонаучный факультет),"Земля людей".
mirznanii.com
Природные воды - это... Что такое Природные воды?
Природные воды3.16 природные воды: Воды Земли с содержащимися в них твердыми, жидкими и газообразными веществами (ГОСТ 19179).
3.15 природные воды: Воды Земли с содержащимися в них твердыми, жидкими и газообразными веществами (ГОСТ 19179).
Словарь-справочник терминов нормативно-технической документации. academic.ru. 2015.
- Природные
- Природные источники излучения
Смотреть что такое "Природные воды" в других словарях:
природные воды — Воды Земли с содержащимися в них твердыми, жидкими и газообразными веществами. [ГОСТ 19179 73] Тематики гидрология суши EN natural water DE Naturwasser FR eau naturelle … Справочник технического переводчика
природные воды — gamtinis vanduo statusas T sritis ekologija ir aplinkotyra apibrėžtis Žemės, kaip planetos, vanduo. atitikmenys: angl. natural waters vok. Naturgewässer, n rus. природные воды … Ekologijos terminų aiškinamasis žodynas
Природные ресурсы — (Natural Resources) История использования природных ресурсов, мировые природные ресурсы Классификация природных ресурсов, природные ресурсы России, проблема исчерпаемости природных ресурсов, рациональное использование природных ресурсов… … Энциклопедия инвестора
Природные — 24. Природные опасности России. Геокриологические опасности / Под ред. В.И. Осипова, С.К. Шойгу М.: Изд. фирма «Крук». 2000. Источник: РД 153 34.2 02.409 2003: Методические указания по оценке влияния гидротехнических сооружений на окружающую… … Словарь-справочник терминов нормативно-технической документации
Воды — Вода Общие Систематическое наименование Оксид водорода Традиционные названия вода Химическая формула Н2O … Википедия
Природные пожары в России в 2010 году — Природные пожары в России (2010) Дым над Европейской Россией 4 августа 2010 … Википедия
Природные ресурсы — (a. natural resources; н. naturliche Ressourcen; ф. ressources naturelles; и. recursos naturales) совокупность объектов и систем живой и неживой природы, компоненты окружающей человека естеств. среды, используемые в процессе обществ.… … Геологическая энциклопедия
Природные радионуклиды — радиоактивные элементы рядов урана 238, тория 232 и калий 40. Источник … Словарь-справочник терминов нормативно-технической документации
природные ресурсы — Природные богатства, пригодные для использования человеком, т.е. компоненты окружающей среды, такие как ископаемое топливо, минеральное сырье, леса, воды, плодородие почв, климат, которые могут удовлетворить различные потребности людей (природные … Словарь по географии
ПРИРОДНЫЕ ЛЕЧЕБНЫЕ РЕСУРСЫ — по определению ФЗ О природных лечебных ресурсах, лечебно оздоровительных местностях и курортах от 27 января 1995 г. минеральные воды, лечебные грязи, рапа лиманов и озер, лечебный климат, другие природные объекты и условия, используемые для… … Юридический словарь
Книги
- Природные воды Земли и литосфера, Б. Л. Личков. Работа профессора Б. Л. Личкова "Природные воды Земли и литосфера" состоит из двух частей. В первой из них на основе изучения истории некоторых идей в области астрономии, географии, геологии… Подробнее Купить за 486 руб
- Природные целебные средства, А. А. Алтымышев. Автор рассматривает возможность применения природных целебных средств - климатических условий и физических факторов (тепло, ветер, холод, влага, солнечная радиация, грязи, минеральные воды,… Подробнее Купить за 160 руб
- Вещные права на природные ресурсы: публичные и частные интересы, Ю. И. Шуплецова. В учебном пособии рассмотрены актуальные проблемы права собственности и других вещных прав на землю, лес, воды, недра, объекты животного мира. На основе анализа исторического материала,… Подробнее Купить за 149 руб электронная книга
normative_reference_dictionary.academic.ru
Примеси, загрязняющие природные воды
Все примеси, загрязняющие природную воду в результате ее кругооборота, можно по степени дисперсности (крупности) разделить на три группы: 1) грубодисперсные с размером частиц больше 100 ммк; 2) коллоиднодисперсные с размерами частиц от 1 до 100 ммк и 3) молекулярнодисперсные с размером частиц меньше 1 ммк. Грубодисперсные и коллоиднодисперсные примеси образуют с водой гетерогенную систему, т. е. систему с наличием границ раздела между фазами, входящими в состав системы, а молекулярнодисперсные - истинные растворы, т. е. гомогенную систему. Грубодисперсные частицы задерживаются при фильтровании через обыкновенную фильтровальную бумагу; в отличие от них коллоидно- и молекулярнодисперсные вещества не задерживаются фильтровальной бумагой. Между этими тремя группами веществ нет резких границ.
Грубодисперсные вещества, обусловливающие мутность природных вод и являющиеся механическими примесями, состоят из песка, глины и других частиц минерального и органического происхождения, которые смываются с верхнего покрова земли дождями или талыми водами во время весенних и осенних паводков, а также попадают в воду в результате размыва русла рек. Природная вода считается прозрачной при концентрации грубодисперсных взвешенных веществ меньше 5 мг/л. С течением времени частицы грубодисперсных веществ осаждаются в воде, если плотность их больше плотности воды.
Коллоиднодисперсные вещества по размерам частиц занимают промежуточное положение между грубодисперсными и молекулярнодисперсными. Они свободно проходят через бумажный фильтр, но не проникают через мелкие поры животных и растительных перепонок. Коллоидные частицы не осаждаются даже в течение весьма длительного времени. В природных водах в коллоиднодисперсном состоянии находятся соединения кремния, алюминия, железа, а также органические вещества, образующиеся в результате распада животных и растительных организмов.
К молекулярнодисперсным веществам относятся растворенные в воде соли, кислоты и щелочи. В подавляющем большинстве случаев состав природных вод определяется следующими ионами:
Са2+, Mg2+, Na+, Cl-, SO42-, HCO3-, HSiO3-.
Остальные ионы: СО32-, Н+, ОН-, Nh5+, NО2-, NO3-, Fe2+, Cu2+ и др. обычно содержатся в природных водах в незначительных количествах, хотя иногда они существенно влияют на свойства воды и поведение ее в котлах, тракте питательной воды и конденсаторах паровых турбин.
Ионы кальция в маломинерализованных водах по количеству занимают первое место. Основными источниками появления ионов кальция в природных водах являются известняки, состоящие из карбоната кальция СаСО3, которые растворяются находящейся в воде свободной углекислотой. Другим источником появления Са2+ в природных водах является гипс CaSО4 • 2h3О.
Ионы магния поступают в воду преимущественно при растворении доломитов MgCО3 • СаСО3 при наличии в воде свободной углекислоты.
С ростом минерализации природных вод относительное содержание ионов Са2+ уменьшается, так как СаСО3 и CaSО4 при увеличении их концентрации из-за испарения воды переходят в твердую фазу вследствие их малой растворимости и непрерывно выводятся из раствора.
Вследствие лучшей растворимости MgCО3 и MgSО4 ионы Mg2+ могут содержаться в природных водах в больших концентрациях, доходящих в минерализованных водах до нескольких граммов в литре, а в соленых озерах до десятков г/л.
Из ионов щелочных металлов в природных водах в наибольшем количестве содержатся ионы натрия, причем с увеличением минерализации воды их концентрация возрастает.
Ионы хлора присутствуют почти во всех природных водах, причем содержание их изменяется в очень широких пределах. Залежи хлористых солей осадочных пород растворяются в воде и выносятся подземными водами и реками в моря и океаны, где постепенно они накапливаются, достигая высокой концентрации. Подобно ионам Na+ ионы С1- являются характерными ионами сильно минерализованных вод морей и океанов.
Сульфат-ионы, так же как и хлорид-ионы, распространены повсеместно. В подземных водах содержание SО42- обычно выше, чем в воде рек и озер. Основным источником появления в воде растворенных сульфат-ионов является гипс CaSО4 • 2h3О.
Водородные (Н+) и гидроксильные (ОН-) ионы появляются в воде в результате ее диссоциации:
Н2О ↔ Н+ + ОН-. Водородные ионы могут появиться в растворах также в результате диссоциации кислот, например: НС1 ↔ Н+ + С1-,
а гидроксильные ионы - в результате диссоциации щелочей, например: NaOH ↔ Na+ + OH-. В химически чистой воде при температуре 23°С концентрации [Н+] и [ОН-] равны 10-7 г-ион/л и характеризуют нейтральную реакцию жидкости. В кислой среде [Н+] > 10-7 > [OH-], а в щелочной [Н+] < 10-7 < [ОН-]. Реакцию раствора удобнее выражать показателями рН или рОН, каждый из которых является отрицательным логарифмом концентрации соответствующего иона. В нейтральной среде рН=7=рОН. Кислая среда характеризуется неравенством рН<7<рОН, а щелочная - неравенством рН>7>рОН.
Угольная кислота является двухосновной и имеет две ступени диссоциации:
Н2СО3 ↔ Н+ + НСО3-;
НСО3- ↔ Н+ + СО32-.
В природных водах, кроме так называемой «свободной» углекислоты, находящейся в них в виде растворенного углекислого газа СО2 и недиссоциированных молекул угольной кислоты Н2СО3, содержатся бикарбонатные ионы НСО3-, а в некоторых случаях карбонатные ионы CO32-.
Количественные соотношения между СО2, Н2СО3, НСО3- и СО32- определяют значение рН воды (табл. 11).
Таблица 11. Соотношение форм угольной кислоты в воде при 25° С и различных значениях рН, %
| Форма угольной кислоты | рН | ||||||||
| 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
| СО2+Н2СО3 | 100 | 95 | 70 | 20 | 2 | - | - | - | - |
| НСО3- | - | 5 | 30 | 80 | 98 | 95 | 70 | 17 | 2 |
| СО32- | - | - | - | - | - | 5 | 30 | 83 | 98 |
В водных растворах существует кинетическое равновесие между различными формами угольной кислоты:
2НСО3- ↔ CO32- + Н2О + СО2.
Из этого уравнения следует, что для поддержания в растворе определенной концентрации НСО3- требуется, чтобы в воде присутствовало соответствующее этой концентрации количество свободной «равновесной углекислоты» СО2. Если фактически содержащееся в воде количество свободной углекислоты больше «равновесной концентрации», то избыток ее будет способен вызывать растворение СаСО3 при контакте воды, например, с известняками, доломитами и бетонными сооружениями. Такую воду называют «агрессивной».
Наоборот, при недостатке СО2 по сравнению с равновесной концентрацией будет наблюдаться распад части бикарбонатных ионов, т. е. сдвиг равновесия вправо. Это приведет к образованию дополнительного количества карбонатных ионов СО32-, которые будут реагировать с обычно присутствующими в природных водах катионами кальция, выделяя из раствора осадок карбоната кальция по уравнению Са2++СО33- → СаСО3.
Соединения азота встречаются в природной воде в виде ионов аммония Nh5+, нитритных ионов NО2+, и нитратных ионов NO3+. Основным источником появления этих ионов в природных водах являются продукты распада различных сложных органических веществ животного и растительного происхождения. Ионы аммония, кроме того, попадают в водоемы со сточными промышленными водами. В незагрязненных поверхностных водах содержание NH+4 исчисляется долями мг/л, а в загрязненных водах оно может достигать сотен мг/л. В присутствии достаточного количества кислорода и особого вида бактерий ионы аммония окисляются в нитритные, а затем нитратные ионы.
Таким образом, NO2- и NО3- являются конечным продуктом сложного процесса минерализации органических веществ.
Соединения железа встречаются в природных водах в виде двухвалентного (закисного) и трехвалентного (окисного) железа. Эти соединения могут быть в истинно растворенном состоянии, в виде коллоидов и суспензий.
В грунтовых водах содержится преимущественно бикарбонат закиси железа Fе(НСО3)2, легко гидролизующийся и окисляющийся при наличии в воде кислорода и уменьшении концентрации растворенной в воде углекислоты.
В поверхностных водах железо содержится главным образом в виде органических комплексных соединений либо в виде гидрата окиси железа Fe(OH)3.
Примером органического комплексного соединения железа является гуминовокислое железо в речных водах болотного питания. Частой причиной содержания железа в речных водах является загрязнение их производственными сточными водами. Концентрация железа в исходной воде может увеличиваться в процессе транспортирования ее по стальным и чугунным трубам в результате загрязнения воды продуктами коррозии.
Соединения кремния присутствуют в природных водах в виде соединений различной степени дисперсности (коллоидных частиц, молекул и ионов). Разнообразие форм кремнекислых соединений объясняется тем, что кремниевый ангидрид способен присоединять разные количества молекул воды, образуя различные кислоты с общей формулой mSiO2 • nh3О. Соли этих кислот образуют ряд минералов, растворение которых природными водами дает кремнекислые соединения разного химического состава. Растворимость кремниевой кислоты в природных водах зависит от ряда факторов и в первую очередь от ионного состава воды и величины рН. Присутствие в воде катионов Са2+ и Mg2+, способных образовывать с кремниевой кислотой малорастворимые силикаты, понижает возможную концентрацию ее в растворе. Наличие в воде катионов Na+ и повышение значения рН, наоборот, повышают растворимость кремниевой кислоты.
В поверхностных водах рек, озер, водохранилищ и прудов, а также в грунтовых водах артезианских скважин кремнесодержание в пересчете на SiO32- обычно находится в пределах 0,6-40 мг/л и лишь в отдельных случаях повышается до 65 мг/л.
Кремниевая кислота является двухосновной и имеет две ступени диссоциации:
h3SiO3 ↔ H+ + HSiО3-;
HSiO3- ↔ H+ + SiО32-.
В табл. 12 приведены соотношения различных форм кремниевой кислоты при 25°С в зависимости от величины рН. Приведенные данные свидетельствуют о том, что в поверхностных водах, значение рН которых близко к 7, вторая ступень диссоциации h3SiО3 практически не возникает.
Таблица 12. Соотношения форм кремниевой кислоты в воде при 25° С и различных рН, %
| Форма кремниевой кислоты | рН | ||||||
| 5 | 6 | 7 | 8 | 9 | 10 | 11 | |
| h4SiО3 | 100 | 99,9 | 99,9 | 90,9 | 50,0 | 8,9 | 0,8 |
| HSiO3- | - | 0,1 | 1,0 | 9,1 | 50,0 | 91,0 | 98,2 |
| SiО32- | - | - | - | - | - | 0,1 | 1,0 |
Часть соединений кремния находится в коллоидном состоянии в виде частиц поликремниевой кислоты mSiО2 • nh3О. Как показали проведенные исследования, количество коллоидной кремниевой кислоты составляет от 3 до 18% общего содержания ее в воде. Между коллоидной и ионной формами кремниевой кислоты существует равновесие, зависящее от физических и химических условий.
В природных водах присутствуют также А13+, Мn2+ и другие ионы.
Наиболее распространенными в природных водах газами являются азот, кислород и углекислый газ, из которых последние два являются коррозионно агрессивными. Растворимость газов в воде зависит от температуры воды и парциального давления данного газа над нею.
Источником обогащения природных вод кислородом в естественных условиях является атмосфера, кислород которой абсорбируется соприкасающимися с воздухом поверхностными слоями воды. Содержание кислорода в воде регулируется его парциальным давлением в атмосфере. С другой стороны, кислород в природных водах расходуется на различные окислительные процессы. На рис. 11 показана растворимость кислорода в воде (мг/л) при различных температурах, барометрическом давлении 1,01 бар (760 мм рт. ст.), контакте с воздухом и равновесном состоянии раствора. На графике показаны также парциальные давления воздуха, водяных паров и кислорода.
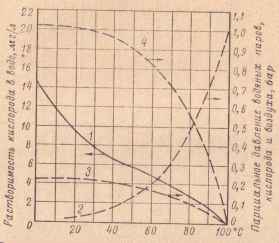
Рис. 11. Растворимость кислорода в воде при различных температурах и давлении 1,01 бар. (760 мм рт. ст.), контакте с воздухом и равновесном состоянии раствора. Парциальные давления водяных паров, кислорода и воздуха при тех же условиях. 1 - растворимость кислорода в воде; 2 - парциальное давление водяных паров; 3 - то же кислорода; 4 - то же воздуха.
Источником появления углекислого газа в природных водах являются различные биохимические процессы окисления органических веществ как в самих водоемах, так и в почве, при фильтрации через которую вода обогащается углекислотой. В глубинных водах нередко содержится большое количество СО2 в результате химических реакций, связанных с изменением состава горных пород.
Большая часть углекислоты находится в виде свободного молекулярно растворенного газа и лишь незначительная часть ее, прореагировав с водой, образует угольную кислоту. Углекислота присутствует в том или ином количестве почти во всех природных водах. Только при рН>8,5 содержание свободной углекислоты в воде практически равно нулю.
Содержание углекислоты в природной воде может уменьшиться из-за выделения избыточной части ее в атмосферу либо из-за связывания углекислоты с карбонатами кальция и магния известняков и доломитов и, наконец, вследствие жизнедеятельности водных растений.
www.comodity.ru
Природные воды
Природные воды, содержащие до 0,1% растворенных веществ, называются пресными, от 0,1 до 2,5% — минерализованными (солоноватыми), от 2,5 до 5% — водами с морской соленостью, более 5% — рассолами .[ ...]
Вода не только обеспечивает жизнь, она — сама жизнь. Недаром В. Вернадский считал, что «жизнь — это особая коллоидная система, особое царство природных вод».[ ...]
Природные воды могут быть загрязнены самыми различными примесями, разделяющимися на группы по их биологическим и физико-хими-ческим свойствам. К первой группе относятся вещества, растворяющиеся в воде и находящиеся там в молекулярном или ионном состоянии (это две разные подгруппы). Вторая группа — это те вещества, которые образуют с водой взвеси или коллоидные системы (это также две разные подгруппы). В коллоидном состоянии могут быть минеральные или органические частицы, нерастворимые формы гумуса и отдельные вирусы. Взвесями же являются чаще всего планктон, бактерии и нерастворимые мельчайшие твердые частицы.[ ...]
Природные воды подразделяют на два больших класса: пресные и соленые. Пресной называют воду, в 1 кг которой содержится не более 1 г солей. Остальные природные воды относят к соленым, на их долю приходится 97,5% всего мирового запаса воды.[ ...]
Вода на земле находится в постоянном круговороте. Несмотря на то что человечество ежедневно потребляет X млрд. тмюды, общее ее количество не уменьшается. Между тем уже сейчас вследствие неравномерного распределения на земле водных ресурсов и населения начинает ощущаться «водный голод», охватывающий прежде всего большие города и высокоразвитые промышленные страны, которые наносят себе непоправимый вред, выпуская загрязненные сточные воды в реки и отравляя природную воду, или «минерал жизни», как ее называл геохимик академик В. И. Вернадский.[ ...]
Природная вода с повышенным содержанием минеральных компонентов классифицируется на четыре группы.[ ...]
Природные воды и почвы обладают буферными возможностями, они способны нейтрализовать определенную часть кислоты и сохранить среду, однако эти способности не беспредельны.[ ...]
Природные воды являются одним из объектов нефтяного загрязнения и наряду с атмосферой и литосферой испытывают техногенное воздействие при разведке и добыче углеводородов. При этом, в первую очередь, происходит снижение качества вод в результате загрязнения нефтью, промысловыми стоками, химреагентами, буровыми растворами.[ ...]
Природная вода является смесью различных видов молекул следующего состава: Н21бО, Н2170, Н2180, НБ160, Н0170, Н0180, 021й0, 02Х10, 02180.[ ...]
Вкус воды характеризуется определениями соленый, кислый, сладкий, горький, а все остальные вкусовые ощущения называют привкусами. Оценивают вкус по такой же пятибалльной шкале, как и запах, с градациями: очень слабый, слабый, заметный, отчетливый, очень сильный. Цвет воды определяют фотометрически, путем сравнения испытуемой воды с эталонными растворами, имитирующими цвет природной воды. Оценивают цвет по специальной шкале цветности с градациями от нуля до 14. Сходным образом исследуют мутность.[ ...]
РАССОЛЫ - природные воды с уровнем минерализации выше 50 г/кг.[ ...]
Жесткость воды. Природная вода, содержащая большое количество растворенных солей кальция и магния, называется жесткой. Соли, обусловливающие жесткость воды, не являются вредными для здоровья человека. Но присутствие в питьевой воде значительных количеств магния нежелательно, так как он ухудшает ее органолептические свойства. По нормам пределом содержания окиси магния считается 15 мг/л. Избыток солей магния (свыше 50% от общей жидкости) затрудняет умягчение воды.[ ...]
В природных водах содержится в концентрациях 0,0001-0,085 мг/л, в питьевой воде - 0,0008 мг/л.[ ...]
Утторигти В природных водах Европейской части РФ хлориды содержатся в среднем в концентрации 6,5 мг/л, в источниках водоснабжения - 1,5-650 мг/л.[ ...]
Примечания: 1. Для природных вод с минерализацией свыше 0,1—0,2% применяется способ выражения концентрации в промилле (°/ооЬ т е- количествам граммов вещества в 1 кг раствора; 1%10СМ% (см. п. 2.2.2). Соответственно 1 г/кг = 10СМ%; 10 мг/л = Ю36 0; ] мг/м3 = ЮЙС0; I мг экв/л = Ю3СЭ 0 (см. п. 2.2.2).[ ...]
В связи с тем, что природная вода является буферной системой, содержащей ионы НСОз- в присутствии малодиссоцииро-ванной Н2С03, pH ее при коагуляции меняется в небольших пределах и непропорционально дозе коагулянта. Поэтому применение данного показателя даже при наличии автоматических рН-метров нецелесообразно.[ ...]
Привкусы и запахи природных вод могут быть естественного и искусственного происхождения. Различают четыре основных вкуса воды: соленый, горький, сладкии и кислый. Их оттенки, складывающиеся из основных вкусовых ощущений, называют привкусами.[ ...]
Следует учесть, что природная вода представляет собой многофазную гетерогенную систему открытого типа, обменивающуюся веществами и энергией с другими средами (водные объекты, атмосфера, донные отложения) и с ее биологической составляющей. Кроме того, в природной воде присутствует множество взвешенных твердых частиц и микропузырьков газов. Обычно их общее число составляет 108 - 10" шт/л 29 . Помимо них толща воды пронизана микроорганизмами, образующими биоту, которая находится в динамическом равновесии с внешней средой и представлена совокупностью гиОробионтов. Все эти факторы игр;иот важную роль в формировании качества поверхностных вод и их способности к самоочищению.[ ...]
Показатели качества природных вод в целом характеризуются разнообразными показателями, важнейшими из которых являются: температура, реакция среды, цветность, запах и привкус, мутность, ионный состав, наличие соединений железа и марганца, жесткость, окис-ляемость, наличие растворенных газов, наличие соединений фтора, иода и токсичных соединений, санитарно-бактериологические и гидробиологические показатели. Показатели качества воды регламентируются ГОСТами.[ ...]
При изучении очистки природных вод с разными цветностью и мутностью, а также для выяснения роли основных добавок, применяемых на водопроводах для интенсификации процесса, был использован метод триангулярных диаграмм, впервые примененный Думанским [82] для исследования лиофобных коллоидных систем. Использование такого метода в исследовании процесса водоочистки, по нашему мнению, является плодотворным, так как позволяет систематизированно изучать влияние различных факторов, устанавливать оптимальные области, выявлять рентабельность применения в водоочистке тех или иных реагентов, их рациональные соотношения и пр., особенно при разработке систем автоматического регулирования. Первая исследованная диаграмма устанавливает связь между коагулянтом, взвешенными веществами (мутностью) и окрашенными веществами (цветностью воды). Вторая диаграмма дает представление о влиянии добавок хлора и извести на процесс очистки воды коагуляцией.[ ...]
Выделяемые из пресных природных вод комплексы ионов тяжелых металлов по их молекулярным массам различаются в тысячи раз - от нескольких сотен до сотен тысяч и более Дальтонов (а. е. м.). В природных водах часто наблюдается полимо-дальное распределение ионов одного и того же металла. Так, по свидетельству Линника и Чубарь (1995), в водах водохранилищ Днепра наибольшие количества хрома входили в состав комплексов с молекулярными массами менее 5000 и более 30 000 Да. Эти же авторы отмечали, что молекулярно-массовое распределение комплексов может изменяться в течение года.[ ...]
Содержится в природных и незагрязненных водоисточниках в виде малотоксичных соединений и случаи отравления им людей и животных не описаны. Концентрация его в природных водах колеблется от 0,001 до 10 мг/л Хлорид алюминия в концентрации 0,1 мг/л придает воде слабый горьковато-вяжущий привкус в 2 балла и запах в 2 балла (0 баллов - никакого привкуса/запаха, 1 - очень слабый, 2 - слабый, 3 - заметный, 4 -отчетливый и 5 баллов очень сильный привкус/запах) - 0,5 мг/л (на А13+). Нитрат алюминия в концентрации 0,1 мг/л (на А13+) сообщает привкус в 2 балла.[ ...]
Концентрация ионов БО - в природных водах, содержащих ионы Са2+, не превышает 1500 мг/л вследствие малой растворимости Са804 (см. п. 2.4.4), однако в сильноминерализованных водах в результате уменьшения активности ионов (см. п. 2.4.2.3) концентрации ионов БО часто более высокие. Так, в морской воде с содержанием солей 35 г/кг и Са2+—0,0104 моль/кг концентрация БО - достигает 2,7 г/кг.[ ...]
При содержании нитратов в воде более 0,3 мг/л в водоемах усиливается рост водорослей. ЛД50 для молоди чавычи - 5800 мг/л через 96 ч при 16 ‘С и 4800 мг/л через 168 ч; для молоди радужной форели - 6000 мг/л при 14 °С через 96 ч и 4700 мг/л через 168 ч. Сульфаты. В природных водах содержится от нескольких миллиграмм на литр воды до насыщенных растворов (сульфат натрия и магния), в дождевых водах - от 1 до 10 мг/л, в реках Европейской части РФ средняя концентрация - 26,6 мг/л.[ ...]
Содержание микроэлементов в природных водах обычно невысоко в пределах от единиц до десятков, реже сотен микрограммов на 1 л, а содержание многих микроэлементов часто недоступно определению обычными химическими или физико-химическими методами. Особенно это характерно для морских и океанических вод.[ ...]
Под засорением поверхностных природных вод следует понимать поступление в водотоки и водоемы посторонних нерастворимых предметов, например древесины, металлолома, шлака, строительного мусора и т. д. Серьезный вклад в засорение вносит лесосплав. Около 90 % древесины, заготавливаемой в нашей стране, транспортируется по воде. Современный объем лесосплава составляет 130 млн. м3 в год; для него используются более 2000 рек, 250 озер, 11 крупных водохранилищ. Лесосплав не предъявляет к качеству воды требований, но сам является источником загрязнения водотоков затонувшей древесиной и различными попутными отходами. Потери при молевом сплаве нередко достигают 30 % первоначального количества древесины, что является серьезным фактором ухудшения качества воды, в частности, для рыбного хозяйства.[ ...]
Таким образом, загрязненность воды - не абсолютное понятие: оно относится только к вполне определенному месту или зоне водного объекта и к конкретному виду водопользования. Поэтому водный объект вне места водопользования не считается загрязненным, даже если его экосистема полностью разрушена вследствие сброса вредных веществ. Такое положение является объективно вынужденным, ибо полностью прекратить сбросы и разбавление в природных водах загрязняющих веществ пока нереально, однако с экологических позиций оно совершенно неприемлемо, ибо из него следует, что вне места водопользования водная экосистема, даже полностью разрушенная, загрязненной не считается.[ ...]
Из неорганических соединений в воде растворимы большинство солей кислот и оснований. Растворы этих веществ являются электролитами. В наибольших количествах в природных водах содержатся гидрокарбонаты; хлориды и сульфаты щелочноземельных и щелочных металлов; в меньших —их нитраты, нитриты, силикаты, фториды, фосфаты и соли других кислот.[ ...]
Еще одним источником загрязнения природных вод являются атмосферные воды, несущие в себе вымываемые из воздуха загрязняющие вещества промышленного происхождения. При стекании по поверхности земли атмосферные и талые воды увлекают за собой органические и минеральные вещества из почвы. В первую очередь это касается территорий санитарно неблагоустроенных населенных пунктов, сельскохозяйственных объектов и угодий, особенно в период весеннего паводка, что приводит к сезонному ухудшению качества питьевой воды.[ ...]
Формирование химического состава природных вод - это процесс обмена химическими веществами природных вод с другими природными средами ( атмосфера,горные породы, почвы, растительный и животный мир ) в различных физико-географических условиях, в результате чего в природные воды переходят или извлекаются из них растворенные, газообразные, коллоидные и взвешенные вещества.[ ...]
Содержание естественных примесей в природных водах зависит от многих причин, в том числе от минерального состава подстилающих пород, их физических свойств, выпадения из атмосферы пыли и осадков, обилия живых организмов. Сами водные организмы составляют важный компонент систем самоочистки природных вод. К естественному, разному в разных водоемах содержанию примесей, у водных организмов в процессе эволюции выработаны многочисленные приспособления.[ ...]
Важным фактором при оценке качества природных вод является скорость течений, а, следовательно, и переноса ЗВ. Создание каскада ГЭС и водохранилищ привело к значительному снижению скорости движения воды, образованию больших площадей мелководий. В результате усилилась бактериальное загрязнение воды. В слабопроточных зонах водохранилищ скорость течения воды составляет менее 0,01— 0,03 м/сек [Эдельштейн, 1998]. Особо малопроточные пять водохранилищ на р. Волге — Иваньковское, Рыбинское, Угличское, Камское, Куйбышевское. Такие водохранилища как Волгоградское, Горьковское, Саратовское и Боткинское, напротив, являются сильно проточными. В них происходит интенсивное смешение масс воды с значительно большим объемом проходящей транзитом основной водной массы. Эти обстоятельства учитывались при вычислении коэффициентов трансформации ЗВ на разных участках реки. Приведенная скорость переноса ЗВ на каждом выделенном участке Волжской ВХС принята постоянной и, таким образом, является кусочно-постоянной функцией номера руслового участка.[ ...]
Отличительной особенностью поверхностных природных вод является непостоянство их состава по сезонам года. На процесс формирования состава воды поверхностных водоемов влияет множество факторов.[ ...]
В отличие от других металлов ионы №2 и Со2+ в природных водах подвержены гидролизу в меньшей степени. Вклад гидроксокомплексов для никеля становится ощутимым при pH > 6, а для кобальта - при рн > 9. В обоих случаях доминирующими гидроксоформами являются №(ОН)2 и Со(ОН)2. В речных и озерных водах степень закомплексованности никеля и кобальта обычно не превышает 40-50%. Однако несмотря на существенный вклад растворимых форм никеля и кобальта в общее содержание этих металлов в воде, подавляющая их часть переносится речными водами во взвешенном состоянии.[ ...]
В поверхностных водоемах и водотоках с увеличением жесткости воды, а в гидрокарбонатных водах — щелочности цветность обычно уменьшается. Мягкие природные воды с небольшой щелочностью, как правило, всегда высокоцветные.[ ...]
| Относительная вязкость растворов солей, встречающихся в природных водах и используемых в качестве реагентов (при 25 °С) | 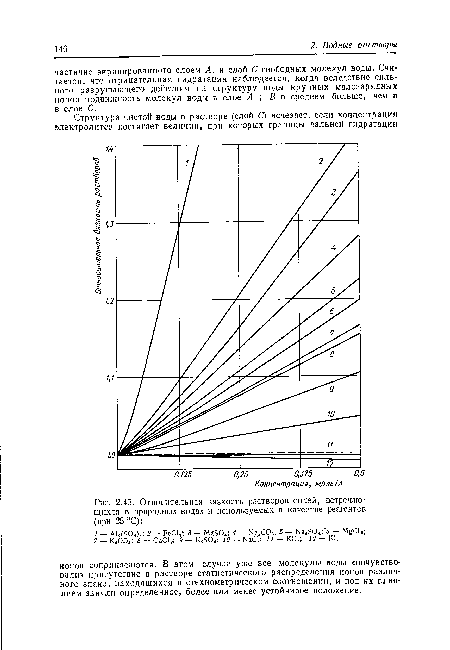 |
Учитывая отрицательное влияние ПАВ на органолептические свойства воды, ее самоочищающую способность, на теплокровные организмы, использующие эту воду, флору и фауну природных вод и т.д., необходимо строгое нормирование сброса сточных вод в рыбопромысловые и хозяйственно-питьевые водоисточники, а также установление предельно допустимых концентраций ПАВ в воде.[ ...]
Формы миграции. Имеющиеся сведения о формах миграции микроэлементов в природных водах свидетельствуют о весьма сложном их состоянии. Миграционная подвижность зависит от химических свойств элементов, а также от сложной совокупности реакций взаимодействия органических и неорганических компонентов природных вод, механического и минералогического составов взвешенных веществ.[ ...]
Основными компонентами, ответственными за процессы связывания ионов водорода, в большинстве природных вод являются ионы НС03 , С032 и ОН.[ ...]
Особого типа взаимодействия наблюдаются при появлении в таком структурированном растворителе, как вода, соединений, диссоциирующих на ионы, когда сочетаются чисто физические явления, обусловленные присутствующими в стехиометрических соотношениях положительными и отрицательно заряженными частицами, с явлениями нарушения структурных элементов среды, характеризуемых общим термином «гидратация ионов». Физико-химические свойства таких систем и соответствующих им по составу природных вод будут различны в зависимости от наличия в них однозарядных (йа+ и К+) или двухзарядньпс (Са2+ и Л 2+) катионов, а также одноатомных (С1—) или многоатомных (НСОэ и Б01 ) анионов. Важность высказанного положения становится ясной, если напомнить, что при исследованиях химических процессов водоподготовки еще недостаточно внимания уделяется изучению влияния ионных примесей воды на кинетику этих процессов. Эю затрудняет статистическую обработку накопленных обширных материалов по эксплуатации станций подготовки воды с различной минерализацией.[ ...]
Современное производство тепловой и электрической энергии сопровождается использованием большого количества природной воды и сбросом сточных вод разного уровня загрязненности. Особенно остро эта проблема стоит перед электростанциями, работающими как на органическом (ТЭС), так и на ядерном (АЭС) топливе [10.1—10.4].[ ...]
Примерно такие же отношения наблюдаются в глобальном круговороте серы (рис. 3.20), в котором кроме бактерий, грибов и растений, использующих сульфат природных вод и почвы для синтеза серосодержащих аминокислот, работают еще несколько групп специализированных бактерий, осуществляющих превращения в реакциях НгБ оБо Б04 и НгБ о 804.[ ...]
При проведении геологоразведочных работ, эксплуатации месторождений и транспортировке нефти происходит изъятие земельных площадей, загрязнение природных вод и атмосферы, все компоненты окружающей среды в районах нефтедобычи испытывают интенсивную техногенную нагрузку (табл. 1.1).[ ...]
На территории СССР и других стран введены в действие новые законы о водопользовании и охране водных ресурсов. Строго регламентировано качество сбросных вод, максимально используется оборотное водоснабжение, запрещено или ограничено производство медленноокисляющихся веществ. Борьба за чистоту водоемов уже дала результаты. Но использование природных вод все же невозможно без их глубокой физико-химической очистки, в которой коагулированию принадлежит ведущая роль.[ ...]
Одним из аспектов функционирования Волжской водохозяйственной системы является выполнение ею канализационных функций, что обусловливает ухудшение качества природных вод. Изменятся химический состав вод, деградируют экосистемы водных объектов и прилегающих территорий. Основной причиной ухудшения качества природных вод является превышение предельных нагрузок массами ЗВ, сбрасываемыми в водные объекты (предельными называются такие нагрузки, при которых химические и биологические качества водной среды еще соответствуют требованиям водопользователей и окружающей территории).[ ...]
По-видимому, несовершенство техники эксперимента (определение обменной емкости взвеси и оптимальной дозы коагулянта) не позволило Ланжелье проверить выводы на природных водах разного состава. К тому же методика исследований не предусматривала поддержания постоянства значений pH среды, что, безусловно, оказывало влияние и на химический состав продуктов гидролиза алюминия и на величину Ек.[ ...]
Особые трудности возникают при изучении соединений элемента в различных степенях окисления, поскольку отсутствуют надежные методы их разделения. Пока лишь для немногих элементов имеются сведения о существовании их в природных водах в различных степенях окисления (Сг, Мп, V). Для некоторых элементов выяснены условия превращения одних форм в другие. Важнейшими условиями являются pH и окислительно-восстановительный потенциал природных вод, а также присутствие органических соединений.[ ...]
Мономолекулярный слой нефти на 50 % снижает газопропускание, и нефтяные загрязнения препятствуют нормальному газо- и теплообмену между атмосферой и гидросферой. Эти нарушения способны вызвать неконтролируемые изменения климата планеты, а массовая гибель фитопланктона, который, по некоторым оценкам, продуцирует около 70 % кислорода, может привести к серьезным нарушениям баланса кислорода на Земле. По меньшей мере 80 % проб природных вод в той или иной концентрации содержат нефтепродукты.[ ...]
ru-ecology.info


















