Плавление тел (стр. 1 из 3). Плавление воды
Температура плавления и кипения воды. Плавление тел
Похожие главы из других работ:
Водородная связь. Определение, энергия, типы водородной связи. Водородная связь и сорбционные процессы. Роль водородной связи в процессах жизнедеятельности
3.1.2 Температура плавления и кипения
За счёт водородной связи молекулы объединяются друг с другом и образуют целые группы молекул. Это затрудняет испарение воды, а, следовательно, повышает температуру плавления и кипения. Соседи воды, водородные соединения серы, селена...
Изучение тепловых явлений в школьном курсе физики
8. УДЕЛЬНАЯ ТЕПЛОТА ПЛАВЛЕНИЯ И ОТВЕРДЕВАНИЯ
Определение удельной теплоты плавления вводят после анализа графика плавления нафталина, позволяющего установить наличие теплообмена между нагревателем и телом без повышения его температуры и, следовательно...
Исследование физических свойств воды
Опыт 1. Зависимость температуры кипения воды от концентрации растворённой в ней соли
Опыт проводился в один день на протяжении 1-1,5 часа. Так что все измерения фиксировались при постоянном атмосферном давлении. Фиксировалась температура воды на момент закипания. Глубина воды в кастрюле тоже была постоянной...
Исследование физических свойств воды
Опыт 2. Зависимость температура кипения от атмосферного давления
В данном эксперименте мы хотели проверить справедливость утверждения о том, что температура кипения зависит от давления на поверхность воды. Так как в наших опытах сосуд с водой кастрюля был открытым...
Исследование физических свойств воды
Опыт 3. Зависимость температуры кипения от высоты столба жидкости в сосуде
В данном опыте при прочих равных условиях мы кипятили воду, когда в кастрюле было 5, 10, 15, 20, 25, 30 см воды. Данные эксперимента приведены в таблице 4. Теоретические объяснения опытов исследования кипения воды...
Исследование физических свойств воды
Опыт 4. Зависимость температуры кипения от продолжительности кипения
В этом опыте мы проверили гипотезу о постоянстве температуры кипения. К удивлению экспериментально было обнаружено, что с течением времени температура кипящей воды увеличивается. Данные опыта приведены в таблице 5...
Плавление тел
Удельная теплота плавления
Удемльная теплотам плавлемния (также: энтальпия плавления; также существует равнозначное понятие удемльная теплотам кристаллизамции) -- количество теплоты...
Проект теплоэлектроцентрали (ТЭЦ)
5.1.4 Температура сетевой воды в узле смешения перед основными сетевыми подогревателями.
, где Gобр - расход сетевой воды в обратном трубопроводе тепловой сети, кг/с....
Расчет водоподготовительной установки КЭС
7.2 Нормы качества подпиточной воды теплосетей и сетевой воды
Наиболее экономичной и эффективной является прямоточная система технического водоснабжения. Забор воды из реки производят из створа, расположенного выше по течению, чем сброс воды. Такая система разрешена в том случае...
Расчет основных параметров выпарной установки для концентрирования водного раствора
3. Определение температур кипения растворов
Общий перепад давлений в установке равен, МПа: (7) где - давление греющего пара в первом корпусе, МПа; - давление греющего пара в барометрическом конденсаторе, МПа...
Самарская ГРЭС
Температура питательной воды
...
Теплогидравлический расчёт реактора ВВЭР-440
Температура теплоносителя:
Коэффициент теплоотдачи Коэффициент теплоотдачи определяется по формуле На средненагруженный твэл: На максимальный нагруженный твэл Число...
Теплогидравлический расчёт ядерного реактора мощностью 3070 МВт
5. Определение координат и паросодержания зоны поверхностного кипения
Определение критерия Рейнольдса где - средняя тепловая нагрузка в расчёте на единицу поверхности ТВЭла, - плотность воды при давлении насыщения, - плотность пара при давлении насыщения...
Физика низких температур
Термодинамическая температура
Классическая термодинамика подразумевает скрытое движение частиц, выражаемое температурой. Это положение является в термодинамике столь важным, что его иногда называют нулевым началом термодинамики...
Экспериментальная установка для определения точки Кюри магнитных материалов в широком диапазоне температур
1.3 Температура Кюри
температура кюри магнитный поле Температура Кюри, -- температура фазового перехода II рода, связанного со скачкообразным изменением свойств симметрии вещества (например, магнитной -- в ферромагнетиках, электрической -- всегнетоэлектриках...
fis.bobrodobro.ru
§ 8.8. Теплота плавления
При плавлении происходит разрушение пространственной решетки кристаллического тела. На этот процесс расходуется определенное количество энергии от какого-нибудь внешнего источника. В результате внутренняя энергия тела в процессе плавления увеличивается.
Количество теплоты, необходимое для перехода тела из твердого состояния в жидкое при температуре плавления, называется теплотой плавления.
В процессе отвердевания тела, наоборот, внутренняя энергия тела уменьшается. Тело отдает теплоту окружающим телам. Согласно закону сохранения энергии количество теплоты, поглощенное телом при плавлении (при температуре плавления), равно количеству теплоты, отданному этим телом при отвердевании (при температуре отвердевания).
Удельная теплота плавления
Теплота плавления зависит от массы плавящегося вещества и его свойств. Зависимость теплоты плавления от рода вещества характеризуют удельной теплотой плавления этого вещества.
Удельной теплотой плавления вещества называется отношение теплоты плавления тела из этого вещества к массе тела.
Обозначим теплоту плавления через Qпл, массу тела буквой т и удельную теплоту плавления буквой λ. Тогда
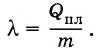 (8.8.1)
(8.8.1)
Таким образом, чтобы расплавить кристаллическое тело массой m, взятое при температуре плавления, необходимо количество теплоты, равное
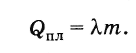 (8.8.2)
(8.8.2)
Теплота кристаллизации
Согласно закону сохранения энергии количество теплоты, выделяемое при кристаллизации тела (при температуре кристаллизации), равно
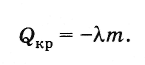 (8.8.3)
(8.8.3)
Из формулы (8.8.1) следует, что удельная теплота плавления в СИ выражается в джоулях на килограмм.
Довольно велика удельная теплота плавления льда 333,7 кДж/кг. Удельная теплота плавления свинца всего лишь 23 кДж/кг, а золота — 65,7 кДж/кг.
Формулы (8.8.2) и (8.8.3) используются при решении задач на составление уравнений теплового баланса в тех случаях, когда мы имеем дело с плавлением и отвердеванием кристаллических тел.
Роль теплоты плавления льда и кристаллизации воды в природе
Поглощение теплоты при таянии льда и выделение ее при замерзании воды оказывают значительное влияние на изменение температуры воздуха, особенно вблизи водоемов. Все вы, вероятно, замечали, что во время обильных снегопадов обычно наступает потепление.
Очень важно большое значение удельной теплоты плавления льда. Еще в конце XVIII в. шотландский ученый Д. Блэк (1728—1799), открывший существование теплоты плавления и кристаллизации, писал: «Если бы лед не обладал значительной теплотой плавления, то тогда весной вся масса льда должна была бы растаять в несколько минут или секунд, так как теплота из воздуха непрерывно передается льду. Но тогда последствия этого были бы ужасны: ведь и при существующем положении возникают большие наводнения и сильные потоки воды при таянии больших масс льда и снега».
Сопло космической ракеты
Приведем интересный технический пример практического использования теплоты плавления и парообразования. При изготовлении сопла для космической ракеты следует учитывать, что струя газов, выходящая из сопла ракеты, имеет температуру около 4000 °С. В природе практически отсутствуют материалы, которые в чистом виде могли бы выдержать такую температуру. Поэтому приходится прибегать ко всякого рода ухищрениям, чтобы охладить материал сопла во время горения топлива.
Сопло изготавливают методом порошковой металлургии. В полость формы закладывается порошок тугоплавкого металла (вольфрам). Затем его подвергают сдавливанию. Порошок спекается, получается пористая структура типа пемзы. Затем эта «пемза» пропитывается медью (ее температура плавления всего 1083 °С).
Полученный материал называется псевдосплавом. На рисунке 8.31 показана фотография микроструктуры псевдосплава. На белом фоне вольфрамового каркаса видны медные включения неправильной формы. Этот сплав может, как это ни невероятно, кратковременно работать даже при температуре газов, образующихся при сгорании топлива, т. е. выше 4000°С.


Рис. 8.31
Происходит это следующим образом. Вначале температура сплава растет, пока не достигнет температуры плавления меди t1 (рис. 8.32). После этого температура сопла не будет меняться, пока вся медь не расплавится (промежуток времени от τ1 до τ2). В дальнейшем температура опять возрастает до тех пор, пока медь не закипит. Это происходит при температуре t2 = 2595 °С, меньшей температуры плавления вольфрама (3380 °С). Пока вся медь не выкипит, температура сопла опять меняться не будет, так как испаряющаяся медь забирает теплоту от вольфрама (промежуток времени от τ3 до τ4). Конечно, сколько угодно долго сопло работать не будет. После испарения меди вольфрам опять начнет нагреваться. Однако двигатель ракеты работает всего лишь несколько минут, а за это время сопло не успеет перегреться и расплавиться.
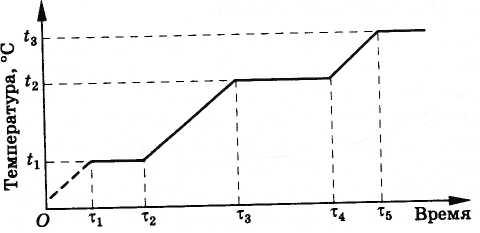
Рис. 8.32
studfiles.net
Плавление тел
РЕФЕРАТ
«Плавление тел»
Выполнила:
Присяжнюк Ольга 9-А
Проверила:
Невзорова Татьяна Игоревна
2010 г.
Содержание
Введение
1) Расчет количества теплоты
2) Плавление
3) Удельная теплота плавления
4) Плавление металлов
5) Температура плавления и кипения воды
6) Расплавы
7) Интересное о плавлении
Заключение (выводы)
Список использованной литературы
Введение
Агрега́тное состоя́ние — состояние вещества, характеризующееся определёнными качественными свойствами: способностью или неспособностью сохранять объём и форму, наличием или отсутствием дальнего и ближнего порядка и другими. Изменение агрегатного состояния может сопровождаться скачкообразным изменением свободной энергии, энтропии, плотности и других основных физических свойств.
Выделяют три основных агрегатных состояния: твёрдое тело, жидкость и газ. Иногда не совсем корректно к агрегатным состоянием причисляют плазму. Существуют и другие агрегатные состояния, например, жидкие кристаллы или конденсат Бозе — Эйнштейна.
Изменения агрегатного состояния суть термодинамические процессы, называемые фазовыми переходами. Выделяют следующие их разновидности: из твёрдого в жидкое — плавление; из жидкого в газообразное — испарение и кипение; из твёрдого в газообразное — сублимация; из газообразного в жидкое или твёрдое — конденсация. Отличительной особенностью является отсутствие резкой границы перехода к плазменному состоянию.
Для описания различных состояний в физике используется более широкое понятие термодинамической фазы. Явления, описывающие переходы от одной фазы к другой, называют критическими явлениями.
Твёрдое тело: Состояние, характеризующееся способностью сохранять объём и форму. Атомы твёрдого тела совершают лишь небольшие колебания вокруг состояния равновесия. Присутствует как дальний, так и ближний порядок.
Жидкость: Состояние вещества, при котором оно обладает малой сжимаемостью, то есть хорошо сохраняет объём, однако неспособно сохранять форму. Жидкость легко принимает форму сосуда, в который она помещена. Атомы или молекулы жидкости совершают колебания вблизи состояния равновесия, запертые другими атомами, и часто перескакивают на другие свободные места. Присутствует только ближний порядок.
Газ: Состояние, характеризующееся хорошей сжимаемостью, отсутствием способности сохранять как объём, так и форму. Газ стремится занять весь объём, ему предоставленный. Атомы или молекулы газа ведут себя относительно свободно, расстояния между ними гораздо больше их размеров.
Другие состояния: При глубоком охлаждении некоторые (далеко не все) вещества переходят в сверхпроводящее или сверхтекучее состояние. Эти состояния, безусловно, являются отдельными термодинамическими фазами, однако их вряд ли стоит называть новыми агрегатными состояниями вещества в силу их неуниверсальности. Неоднородные вещества типа паст, гелей, суспензий, аэрозолей и т. д., которые при определённых условиях демонстрируют свойства как твёрдых тел, так и жидкостей и даже газов, обычно относят к классу дисперсных материалов, а не к каким-либо конкретным агрегатным состояниям вещества.

Плавление
Рис. 1. Состояние чистого вещества (диаграмма)

Рис. 2. Температура плавления кристаллического тела

Рис. 3. Температура плавления щелочных металлов

Плавление - переход вещества из кристаллического (твёрдого) состояния в жидкое; происходит с поглощением теплоты (фазовый переход I рода). Главными характеристиками П. чистых веществ являются температура плавления (Тпл) и теплота, которая необходима для осуществления процесса П. (теплота плавления Qпл).
Температура П. зависит от внешнего давления р; на диаграмме состояния чистого вещества эта зависимость изображается кривой плавления (кривой сосуществования твёрдой и жидкой фаз, AD или AD' на рис. 1). П. сплавов и твёрдых растворов происходит, как правило, в интервале температур (исключение составляют эвтектики с постоянной Тпл). Зависимость температуры начала и окончания П. сплава от его состава при данном давлении изображается на диаграммах состояния специальными линиями (кривые ликвидуса и солидуса, см. Двойные системы). У ряда высокомолекулярных соединений (например, у веществ, способных образовывать жидкие кристаллы) переход из твёрдого кристаллического состояния в изотропное жидкое происходит постадийно (в некотором температурном интервале), каждая стадия характеризует определённый этап разрушения кристаллической структуры.
Наличие определённой температуры П.— важный признак правильного кристаллического строения твёрдых тел. По этому признаку их легко отличить от аморфных твёрдых тел, которые не имеют фиксированной Тпл. Аморфные твёрдые тела переходят в жидкое состояние постепенно, размягчаясь при повышении температуры (см. Аморфное состояние). Самую высокую температуру П. среди чистых металлов имеет вольфрам (3410 °С), самую низкую — ртуть (—38,9 °С). К особо тугоплавким соединениям относятся: TiN (3200 °С), HfN (3580 °С), ZrC (3805 °С), TaC (4070 °С), HfC (4160 °С) и др. Как правило, для веществ с высокой Тпл характерны более высокие значения Qпл. Примеси, присутствующие в кристаллических веществах, снижают их Тпл. Этим пользуются на практике для получения сплавов с низкой Тпл (см., например, Вуда сплав с Тпл = 68 °С) и охлаждающих смесей.
П. начинается при достижении кристаллическим веществом Тпл. С начала П. до его завершения температура вещества остаётся постоянной и равной Тпл, несмотря на сообщение веществу теплоты (рис. 2). Нагреть кристалл до Т > Тпл в обычных условиях не удаётся (см. Перегрев), тогда как при кристаллизации сравнительно легко достигается значительное переохлаждение расплава.
Характер зависимости Тпл от давления р определяется направлением объёмных изменений (DVпл) при П. (см. Клапейрона — Клаузиуса уравнение). В большинстве случаев П. вещества сопровождается увеличением их объёма (обычно на несколько %). Если это имеет место, то возрастание давления приводит к повышению Тпл (рис. 3). Однако у некоторых веществ (воды, ряда металлов и металлидов, см. рис. 1) при П. происходит уменьшение объёма. Температура П. этих веществ при увеличении давления снижается.
П. сопровождается изменением физических свойств вещества: увеличением энтропии, что отражает разупорядочение кристаллической структуры вещества; ростом теплоёмкости, электрического сопротивления [исключение составляют некоторые полуметаллы (Bi, Sb) и полупроводники (Ge), в жидком состоянии обладающие более высокой электропроводностью]. Практически до нуля падает при П. сопротивление сдвигу (в расплаве не могут распространяться поперечные упругие волны, см. Жидкость), уменьшается скорость распространения звука(продольных волн) и т.д.
Согласно молекулярно-кинетическим представлениям, П. осуществляется следующим образом. При подведении к кристаллическому телу теплоты увеличивается энергия колебаний (амплитуда колебаний) его атомов, что приводит к повышению температуры тела и способствует образованию в кристалле различного рода дефектов (незаполненных узлов кристаллической решётки — вакансий; нарушений периодичности решётки атомами, внедрившимися между её узлами, и др., см. Дефекты в кристаллах). В молекулярных кристаллах может происходить частичное разупорядочение взаимной ориентации осей молекул, если молекулы не обладают сферической формой. Постепенный рост числа дефектов и их объединение характеризуют стадию предплавления. С достижением Тпл в кристалле создаётся критическая концентрация дефектов, начинается П.— кристаллическая решётка распадается на легкоподвижные субмикроскопические области. Подводимая при П. теплота идёт не на нагрев тела, а на разрыв межатомных связей и разрушение дальнего порядка в кристаллах (см. Дальний порядок и ближний порядок). В самих же субмикроскопических областях ближний порядок в расположении атомов при П. существенно не меняется (координационное число расплава при Тпл в большинстве случаев остаётся тем же, что и у кристалла). Этим объясняются меньшие значения теплот плавления Qпл по сравнению с теплотами парообразования и сравнительно небольшое изменение ряда физических свойств веществ при их П.
Процесс П. играет важную роль в природе (П. снега и льда на поверхности Земли, П. минералов в её недрах и т.д.) и в технике (производство металлов и сплавов, литьё в формы и др.).
Удельная теплота плавления
Уде́льная теплота́ плавле́ния (также: энтальпия плавления; также существует равнозначное понятие уде́льная теплота́ кристаллиза́ции) — количество теплоты, которое необходимо сообщить одной единице массы кристаллического вещества в равновесном изобарно-изотермическом процессе, чтобы перевести его из твёрдого (кристаллического) состояния в жидкое (то же количество теплоты выделяется при кристаллизации вещества). Теплота плавления — частный случай теплоты фазового перехода I рода. Различают удельную теплоту плавления (Дж/кг) и молярную (Дж/моль).
Удельная теплота плавления обозначается буквой
 (греческая буква лямбда) Формула расчёта удельной теплоты плавления:
(греческая буква лямбда) Формула расчёта удельной теплоты плавления:  ,
, где
 — удельная теплота плавления,
— удельная теплота плавления, — количество теплоты, полученное веществом при плавлении (или выделившееся при кристаллизации),
— количество теплоты, полученное веществом при плавлении (или выделившееся при кристаллизации),  — масса плавящегося (кристаллизующегося) вещества.
— масса плавящегося (кристаллизующегося) вещества. mirznanii.com
1
1. СВОЙСТВА И СТРУКТУРА ВОДЫ
1.1. Аномальность свойств воды
Только в конце XVIIIначалеXIXв. стало известно, что представляет собой вещество, называемое водой. Опытами Г. Кавендиша, А. Лавуазье, А. Гумбольдта, Ж.Л. Гей-Люссака было доказано, что вода образуется из двух объемов водорода и одного объема кислорода, т.е. имеет химическую формулуН2О и молекулярную массу 18. Постепенно, однако, становилось ясно, что почти по всем физико-химическим параметрам это вещество уникальное, резко отличающееся от других природных соединений.
Температуры плавления и кипения воды
На них основываются принятые системы отсчета температур.
Избрание воды для создания температурных шкал.
Цельсий (1701-44). Шкала Цельсия –1741 г. Температуры кипения и плавления воды при атмосферном давлении соответственно равны 100оС и 0оС,
Реомюр(1683-1757). Шкала Реомюра 1730 г. Температура кипения воды принята за 80о (1оС = 5/4оR).
Фаренгейт (1686-1736). Точка таяния льда принята 32оF, точка кипения воды – 180оF (tоС = 5/9 tоF - 32).
Открытие периодического закона Д.И.Менделеева (1869 г). Несоответствие физических параметров воды периодическому закону.
Несоответствие периодическому закону видно из сравнения температур кипения и плавления водородных соединений элементов группы кислорода. Данные для Н2Se cнимаются с графика. Для воды видно, что при соответствии периодическому закону температура плавления воды составляла бы около минус 90о, а температура кипения – около -70о. Вода при “нормальных” условиях была бы токсичным дурнопахнущим газом. Жизнь на Земле была бы невозможна.
Благодаря этим «аномальным» свойствам вода оберегает жизнь и регулирует тепловой и газовый режим нашей планеты.
Теплоемкость воды
Удельная теплоемкость воды – самая высокая из всех жидкостей. И здесь вода принята за эталон: для того, чтобы нагреть 1 г воды на 1оС на до затратить 1 калорию тепловой энергии (calor – тепло, лат.). Для сравнения: гипс - 0,27, сухая глина 0,22 кал. (1 кал = 4,187 Дж.). Удельная теплоемкость льда и пара вдвое ниже – 0,5 кал/г.град. Необычайно велики и скрытые теплоты плавления и парообразования воды – 79 и 539 кал. Таким образом, чтобы перевести 1г льда с температурой 0оС в пар надо затратить 79+100+539 = 718 калорий тепла. Благодаря такой чрезвычайно высокой теплоемкости вода является главным регулятором теплового режима на нашей планете. Влияние Мирового океана сказывается практически во всех точках Земли, даже наиболее удаленных от морских берегов, характеризующихся, так называемым, континентальным климатом. Крупные водоемы, и прежде всего, Мировой океан, – регуляторы теплового режима Земли. Для почвенного слоя годовой теплооборот 1,5-3 ккал/см2, для,например, Балтийского и Черного морей 48-52. При отсутствии водоемов летом температура поднималась бы, а зимой опускалась на несколько сот градусов ижизнь на Земле была бы невозможна;наоборот, если бы Земля полностью была бы покрыта океаном, годовая амплитуда воздуха изменялась бы от 0 на экваторе до 5-6оС на полюсах. Влияние океана распространяется на всю планету, включая полюса холода в Антарктиде.
С высокой теплоемкостью воды связаны такие показатели, как скрытая теплота плавления, составляющая 333,7·103 Дж/кг, и скрытая теплота парообразования, составляющая 2258,103 Дж/кг, т.е. для превращения 1 кг льда в жидкость и 1 кг жидкой воды в пар нужны огромные затраты энергии. Это свидетельствует о высокой энергоемкости воды, предопределяющей ее исключительную роль как аккумулятора энергии при протекании природных процессов.
Диэлектрическая постоянная воды ()
Величина диэлектрической постоянной для воды является наиболее высокой из всех жидкостей и равна 80,1 при температуре 20оС. при температуре около 0оС составляет около 82. Это означает, что при растворении в воде солей, сила электрического взаимодействия между разноименно заряженными частицами уменьшается в 80 раз, в результате чего соли диссоциируют на ионы. У большинства растворителей не выше 50, у неполярных жидкостей (бензин, керосин) не более 3. Это свойство воды предопределяет явлениеэлектролитической диссоциации, т.е. способность солей, кислот, щелочей распадаться в водных растворах на разноименно заряженные ионы. Вода инертна как растворитель. Она привносит питательные вещества в живые организмы и выносит шлаки и заменить ее нечем. Т.о. и без этого свойства водыжизнь на Земле была быневозможна.
Вода растворяет минералы, но они вновь возрождаются, если воду испарить. Эта особенность имеет колоссальное геологическое и биологическое значение, предопределяя водные круговороты самых разных порядков, которые проходят за несколько часов (в живых организмах) и длятся многие миллионы лет в недрах Земли (геологические). По-видимому, и появление жизни на Земле в значительной степени связано с этим удивительным свойством воды.
Плотность воды.
Все вещества обладают максимальной плотностью при температуре плавления, кроме воды.Максимальная плотность воды(1,0 г/см3) соответствует т-ре 3,98о; плотность льда 0,918 г/см3; только вода не тонет в собственном расплаве; на это обратил внимание еще Фалес Милетский. При замерзании воды образуется тонкая защитная корка льда, обеспечивающая сохранение водоемов, прежде всего – Мирового океана – главного регулятора воздушного режима планеты. И без этого свойства водыжизнь обрела бы совсем другие формы.
1.2. Представления о скрытой структуре воды
Структура воды. Тридцатые годы ХХ века принесли новое крупное открытие, связанное с изучением воды: английские физики Дж. Бернал и Р. Фаулер на основании рентгенографических и спектроскопических исследований установили, что молекулы воды определенным образом упорядочены, каждая молекула воды окружена по тетраэдру четырьмя другими. Тем самым была подтверждена высказанная в конце XVIII в. В. Рентгеном мысль о сложном строении жидкой воды и существовании между отдельными молекулами дополнительных связей. Это явление ученые называют структурой воды, хотя понятно, что полностью отождествлять его с кристаллической решеткой твердых веществ нельзя, так как жидкая вода является смесью мономерных и полимерных молекул, связи между отдельными мономерами динамичны: они постоянно появляются, разрушаются, усиливаются, ослабевают.
Главной причиной существования структуры воды является особый тип связи между отдельными атомами – водородной. Эта связь имеет электростатическую природу, но она слабее нормальной валентной связи между атомами водорода и кислорода, образующими отдельные мономеры. В каждом мономере Н2О расстояние между атомами водорода и кислорода составляет 0,1 нм, а угол, образуемый между валентными связями, - около 105º. В водородной связи расстояние между атомами увеличивается до 0,176 нм, причем оно не является строго постоянным.
Существует несколько моделей структуры воды, основанных на идее соединения отдельных мономеров водородной связью. Дж. Бернал и Р. Фаулер предположили существование трех типов расположения молекул: а) структуры, приближающиеся к кристаллической решетке льда, существуют при температуре от 0 до 4ºС; б) структуры типа кварца, преобладают при температуре 4-200ºС ; в) структуры с плотной упаковкой, характерной для нормальных жидкостей (почти лишенные водородных связей), возникают при температуре выше 200 ºС [Блох А.М. Структура воды и геологические процессы .Л., 1969, с.216].
Интересный подход к интерпретации структурных особенностей воды предложил итальянский физик М. Анджено (1967 г.). Согласно его представлениям, каждая молекула воды может участвовать не более чем в двух, но так называемых коллективных, водородных связях, в результате чего сочетание валентных и водородных связей образует звенья разных типов (рис.1).

Рис. 1. Молекулярные агрегаты в жидкой воде (по М. Аджендо).
Эти звенья могут формировать цепочки, кольца и более сложные системы, непрерывно образующиеся, разрушающиеся, обменивающиеся молекулами. При этом общее число водородных мостиков в системе остается постоянным и возможные типы агрегатов присутствуют в воде в разных пропорциях в статическом равновесии, определяемом температурой. Кольца из шести молекул, видимо, приближаются к структуре льда.
С позиций структурного строения жидкой воды объясняются все ее аномальные свойства. Необходимость разрушения водородных связей предопределяет высокую энергоемкость воды, в результате чего аномально высокими становятся точки плавления и кипения, теплоемкость и скрытые теплоты плавления и парообразования. При охлаждении воды в интервале температур от 4 до 0ºС происходит перестройка структуры от более плотной тетрагональной к гексагональной упаковке льда. Прочная связь между молекулами воды делает ее инертной по отношению к растворенным веществам. Поскольку структура воды формируется электростатическими связями, на нее воздействуют различные поля (температурное, геодинамическое, магнитное, электрическое).
С повышением температуры структура воды начинает разрушаться. Оценки разных авторов, подсчитывающих процент молекул с сохранившимися водородными связями, близки: в холодной воде структурировано около половины молекул, по достижении температуры 100ºС структурные связи сохраняются примерно у 30 % молекул, а при приближении к критической температуре (374 ºС) структурированные молекулы исчезают.
При приложении давления молекулы жидкостей сближаются и их вязкость повышается. Совсем по-иному ведет себя вода. Первые ступени нагрузок приводят к перестройке структуры воды, заполнению межмолекулярных пустот, сопровождающемуся уменьшением ее вязкости, и только начиная с давлений около 100 МПа (достаточно высоких для природных условий) начинается постепенное повышение вязкости.
1.3. Разновидности воды
Структурные свойства воды и существование нескольких изотопов кислорода и водорода являются причиной того, что вода может образовывать много физико-химических разновидностей. Вот некоторые из них.
Представления об активированной воде
Опыты новосибирских ученых (Ф.А.Летников и др.) по обработке воды в автоклавах при температурах 300-400 ºС и давлениях до 100 МПа показали, что при этом усиливается растворяющая способность воды по многим минералам (к сульфидам, гипсу, кварцу), уменьшается рН, увеличивается электропроводность. Влияние температуры и давления на изменение структур воды навели специалистов на мысль о возможности имитации свойств воды, находящейся на больших глубинах (т.е. при высоких температурах и давлениях), и привели к открытию так называемой активированной воды. После обработки воды в автоклавах Обнаружение активированного состояния у воды термальных минеральных источников наводит мысль о том, что целебные свойства некоторых типов минеральных вод могут быть связаны не только с их химическим составом, но и с повышением биологической активности воды при ее активации. Открытие явления активации не только позволяет объяснить некоторые свойства гидротермальных растворов, но и открывает перспективы искусственного приготовления минеральных вод.
Влияние электрического поля
При помещении воды в электрическое полемогут произойти определенные изменения ее структуры. Так, электрический ток ослабляет структурные связи, и после обработки воды переменным электрическим током скорость испарения увеличивается по имеющимся немногочисленным данным на 11-18 %). Замечено влияние электрических полей на интенсивность поглощения водой световых лучей.
Влияние магнитного поля
Положительное воздействие на человеческий организм воды, побывавшей в магнитном поле, было замечено еще в средние века. В 1945 г. бельгийский инженер Т. Вермайерн запатентовал простой способ уменьшения интенсивности образования накипи в паровых котлах с помощью предварительной магнитной обработки воды. В настоящее время этот метод борьбы с накипью находит очень широкое применение. Достаточно сослаться на опыт многих ТЭЦ (Ростовская, Астраханская и др.), ГРЭС (Симферопольская, Саратовская), заводов, шахт и других предприятий.
При замачивании семян многих сельскохозяйственных культур, цветов и фруктов омагниченной водой резко возрастает их всхожесть. В настоящее время отечественной промышленностью выпускаются даже специальные устройства для омагничивания воды, рекомендуемые сельскохозяйственным предприятиям и садоводам.
Вода-II. В начале 60-х годов XX в. Н.Н. Федякин обнаружил чрезвычайно интересное явление: при конденсировании паров воды в тонких кварцевых капиллярах диаметром 5-20 мкм) образуется жидкость, которая по свойствам значительно отличается от обычной воды. Позднее эта жидкость, названная вода-II, изучалась крупными российскими и зарубежными исследователями, в частности большим коллективом ученых во главе с Б.В. Дерягиным. Было обнаружено, что вода-II представляет собой вязкую жидкость с плотностью около 1 г/см3 и показателем преломления 1,49 (против 1,33 для обычной воды). Эта жидкость переходит в твердое состояние при охлаждении до минус 35÷40 ºС без скачка объема. Температура кипения воды-II при атмосферном давлении примерно 250 ºС. Вода-II обладает уникальным инфракрасным спектром поглощения, не отвечающим ни одному из известных веществ. Модифицированное состояние полученного вещества устойчиво и сохраняется при перегонке (эта процедура была использована для укрупнения порций воды-II). Было доказано, что вновь полученное вещество строго отвечает формуле Н2О; кварц, видимо, выполняет роль катализатора при синтезе воды-II.
Исследование воды-II привело Б.В. Дерягина и его сотрудников к выводу о возможности существования особого типа прочной молекулярной связи между водородом и кислородом, формирующей полимеры, состоящие из 6-10 мономерных молекул Н2О. Пока трудно определить роль воды-II в природных системах, но ясно, что ее исследование сулит определенные перспективы в изучении глубинных геологических процессов.
Тяжелая вода. В настоящее время известно три изотопа водорода (1Н-протий, 2Н –дейтерий D, 3Н- тритий Т) и три изотопа кислорода (16О, 17О, 18О). Это означает, что может существовать значительное количество разновидностей воды с разными изотопными комбинациями. Наиболее устойчивой из них является так называемая тяжелая вода D2O, содержащаяся в виде примеси в обычной воде в сотых долях процента. По свойствам тяжелая вода существенно отличается от обычной: максимальная плотность отмечается при t=11,2 ºС и составляет 1,056 г/см3; вязкость на 20 % выше; диэлектрическая постоянная на 0,3-0,5 % ниже. Температура плавления тяжелой воды 3,8 ºС; температура кипения 101,4 ºС. Судя по приведенным данным и ряду других данных, дейтериевая связь является еще более прочной, чем водородная.. Используется тяжелая вода как замедлитель нейтронов атомных реакторах. Тяжелая вода токсична, живые существа и растения в ней погибают. Некоторые ученые связывают эволюцию жизни на нашей планете с изменениями концентрации дейтерия в воде: в частности, пониженной по сравнению с современной концентрацией дейтерия в воде объясняют существование гигантских травоядных в мезозое. Впрочем, положения эти носят спорный характер.
Приведенные здесь примеры разновидностей воды, предопределяемых ее сложной структурой и изотопией, показывают, насколько неисчерпаемы перспективы появления новых открытий при изучении такого удивительного вещества, как вода.
studfiles.net





















