Оксиды: классификация и химические свойства. Оксид воды
Оксиды - получение и свойства
Хотелось бы дать возможно более простое определение оксида - это соединение элемента с кислородом. Но существуют кислоты и соли. Рассмотрим соединения h3O2 и BaO2. Перекись водорода является слабой кислотой (она диссоциирует в воде давая ионы водорода и анионы HO2- и O2-2). Пероксид бария - это бариевая соль перекиси водорода. У молекул h3O2 и BaO2 есть кислородный мостик -O-O-, поэтому степень окисления кислорода в этих соединениях -1. В неорганической химии обычно пероксиды к классу оксидов не относят и поэтому необходимо уточнить определение оксида таким образом, чтобы пероксиды в этот класс не попадали. Фтор самый активный неметалл и вслед за ним идет кислород. Формальная степень окисления атома кислорода в оксиде фтора +2, а во всех других оксидах -2. Следовательно, оксидами называют соединения элементов с кислородом, в которых кислород проявляет формальную степень окисления равную -2 (за исключением оксида фтора, где она равна +2).
Один и тот же химический элемент может образовывать с кислородом не один оксид, а несколько, например, у азота известны оксиды N2O, NO, N2O3, NO2, N2O4, N2O5. Во всех этих оксидах степень окисления у кислорода -2, а у азота, соответственно, +1, +2, +3, +4, +4 и +5. У двух оксидов: NO2 и N2O4 степен окисления азота и кислорода совпадают. В названии веществ отражается история развития химии как науки. В период накопления экспериментальных данных в химии названия веществ отражали либо способ их получения (жженая магнезия: MgCO3 ® MgO + CO2), либо характер воздействия на человека (N2O - веселящий газ), либо сферу применения (пурпурно-красная краска "сурик" - Pb3O4) и т.д. По мере того как все большее число людей изучало химию, по мере того как все большее число веществ надо было охарактеризовать и запомнить возникла необходимость просто словами называть формулу вещества. Введение понятий валентность, степень окисления и т.д. влияло на названия веществ. Мы приведем таблицу, в которой даны названия оксидов азота при использовании различных стилей и номенклатур.
Получение оксидов
При изучении данной главы особое внимание будет уделено взаимосвязи "родственных" веществ из разных классов.
Как получить оксиды из простых веществ? Их окислением:
2Mg + O2 = 2MgO, 2C + O2 = 2CO, C + O2 = CO2.
Рассмотрим лишь принципиальную возможность получения оксида из простых веществ. Получение CO и CO2 будет рассмотрено в разделе "Углерод".
Можно ли получить оксиды из оксидов? Да:
2SO2 + O2 = 2SO3, 2SO3 = 2SO2 + O2, Fe2O3 + CO = 2FeO + CO2.
Можно ли получить оксиды из гидроксидов ? Да:
Ca(OH)2 CaO + h3O, h3CO3 = CO2 + h3O.
Можно ли получить оксиды из солей ? Да:
CaCO3 CaO + CO2, 2Cu(NO3)2 = 2CuO + 4NO2 + O2.
Свойства оксидов
Если посмотреть внимательно реакции, написанные выше, то те из них, в которых оксиды встречались в левой части уравнения, будут говорить нам о свойствах оксидов. Эти общие для всех оксидов свойства относятся к окислительно-восстановительным процессам:
2SO2 + O2 = 2SO3, 2SO3 = 2SO2 + O2, Fe2O3 + CO = 2FeO + CO2, Al + Fe2O3 = Al2O3 + Fe, C + Fe2O3 = CO + 2FeO.
Но тем не менее, свойства оксидов обычно рассматриваются с учетом их классификации.
Свойства основных оксидов
Прежде всего надо показать, что отвечающие им гидроксиды являются основаниями:
CaO + h3O = Ca(OH)2, Ca(OH)2 = Ca2+ + 2OH-,
т.е. оксиды щелочных и щелочно-земельных металлов при взаимодействии с водой дают растворимые в воде основания, которые называются щелочами.
Основные оксиды, реагируя с кислотными или амфотерными оксидами, дают соли:
CaO + SO3 = CaSO4, BaO + Al2O3 = Ba(AlO2)2.
Основные оксиды, реагируя с кислотными или амфотерными гидроксидами, дают соли:
CaO + h3SO4 = CaSO4 + h3O, K2O + Zn(OH)2 = K2ZnO2 + h3O.
Основные оксиды, реагируя с кислыми солями, дают средние соли:
CaO + Ca(HCO3)2 = 2CaCO3 + h3O.
Основные оксиды, реагируя с нормальными солями, дают основные соли:
MgO + MgCl2 + h3O = 2Mg(OH)Cl.
Свойства кислотных оксидов
Отвечающие кислотным оксидам гидроксиды являются кислотами:
SO3 + h3O = h3SO4, h3SO4 = 2H+ + SO42- .
Многие кислотные оксиды, растворяясь в воде, дают кислоты. Но есть и такие кислотные оксиды, которые не растворяются в воде и с ней не взаимодействуют: SiO2.
Кислотные оксиды, реагируя с основными или амфотерными оксидами, дают соли:
SiO2 + CaO = CaSiO3, 3SO3 + Al2O3 = Al2(SO4)3.
Кислотные оксиды, реагируя с основными или амфотерными гидроксидами, дают соли:
SO3 + Ca(OH)2 = CaSO4 + h3O, SO3 + Zn(OH)2 = ZnSO4 + h3O.
Кислотные оксиды, реагируя с основными солями, дают средние соли.
Кислотные оксиды, реагируя с нормальными солями, дают кислые соли:
CO2 + CaCO3 + h3O = Ca(HCO3)2.
Свойства амфотерных оксидов
Отвечающие амфотерным оксидам гидроксиды обладают амфотерными свойствами:
Zn(OH)2 = Zn2+ + 2OH-, h3ZnO2 = 2H+ + ZnO22-.
Амфотерные оксиды не растворяются в вводе.
Амфотерные оксиды, реагируя с основными или с кислотными оксидами, дают соли:
Al2O3 + K2O = 2KAlO2, Al2O3 + 3SO3 = Al2(SO4)3.
Амфотерные оксиды, реагируя с основными или кислотными гидроксидами, дают соли:
ZnO + 2KOH = K2ZnO2 + h3O, ZnO + h3SO4 = ZnSO4 + h3O.
www.himikatus.ru
Оксиды: классификация и химические свойства
Оксидами называются сложные вещества, в состав молекул которых входят атомы кислорода в степни окисления – 2 и какого-нибудь другого элемента.
 Оксиды могут быть получены при непосредственном взаимодействии кислорода с другим элементом, так и косвенным путём (например, при разложении солей, оснований, кислот). В обычных условиях оксиды бывают в твёрдом, жидком и газообразном состоянии, этот тип соединений весьма распространён в природе. Оксиды содержатся в Земной коре. Ржавчина, песок, вода, углекислый газ – это оксиды.
Оксиды могут быть получены при непосредственном взаимодействии кислорода с другим элементом, так и косвенным путём (например, при разложении солей, оснований, кислот). В обычных условиях оксиды бывают в твёрдом, жидком и газообразном состоянии, этот тип соединений весьма распространён в природе. Оксиды содержатся в Земной коре. Ржавчина, песок, вода, углекислый газ – это оксиды.
Они бывают солеобразующими и несолеобразующие.
Солеобразующие оксиды – это такие оксиды, которые в результате химических реакций образуют соли. Это оксиды металлов и неметаллов, которые при взаимодействии с водой образуют соответствующие кислоты, а при взаимодействии с основаниями – соответствующие кислые и нормальные соли. Например, оксид меди (CuO) является оксидом солеобразующим, потому что, например, при взаимодействии её с соляной кислотой (HCl) образуется соль:
CuO + 2HCl → CuCl2 + h3O.
В результате химических реакций можно получать и другие соли:
CuO + SO3 → CuSO4.
Несолеобразующими оксидами называются такие оксиды, которые не образуют солей. Примером могут служить СО, N2O, NO.
Солеобразующие оксиды в свою очередь бывают 3-х типов: основными (от слова «основание»), кислотными и амфотерными.
Основными оксидами называются такие оксиды металлов, которым соответствуют гидроксиды, относящиеся к классу оснований. К основным оксидам относятся, например, Na2O, K2O, MgO, CaO и т.д.
 Химические свойства основных оксидов
Химические свойства основных оксидов
1. Растворимые в воде основные оксиды вступают в реакцию с водой, образуя основания:
Na2O + h3O → 2NaOH.
2. Взаимодействуют с кислотными оксидами, образуя соответствующие соли
Na2O + SO3 → Na2SO4.
3. Реагируют с кислотами, образуя соль и воду:
CuO + h3SO4 → CuSO4 + h3O.
4. Реагируют с амфотерными оксидами:
Li2O + Al2O3 → 2LiAlO2.
Если в составе оксидов в качестве второго элемента будет неметалл или металл, проявляющий высшую валентность (обычно проявляют от IV до VII), то такие оксиды будут кислотными. Кислотными оксидами (ангидридами кислот) называются такие оксиды, которым соответствуют гидроксиды, относящие к классу кислот. Это, например, CO2, SO3, P2O5, N2O3, Cl2O5, Mn2O7 и т.д. Кислотные оксиды растворяются в воде и щелочах, образуя при этом соль и воду.
Химические свойства кислотных оксидов
1. Взаимодействуют с водой, образуя кислоту:
SO3 + h3O → h3SO4.
Но не все кислотные оксиды непосредственно реагируют с водой (SiO2 и др.).
2. Реагируют с основанными оксидами с образованием соли:
CO2 + CaO → CaCO3
3. Взаимодействуют со щелочами, образуя соль и воду:
CO2 + Ba(OH)2 → BaCO3 + h3O.
В состав амфотерного оксида входит элемент, который обладает амфотерными свойствами. Под амфотерностью понимают способность соединений проявлять в зависимости от условий кислотные и основные свойства. Например, оксид цинка ZnO может быть как основанием, так и кислотой (Zn(OH)2 и h3ZnO2). Амфотерность выражается в том, что в зависимости от условий амфотерные оксиды проявляют либо осно́вные, либо кислотные свойства.
Химические свойства амфотерных оксидов
1. Взаимодействуют с кислотами, образуя соль и воду:
ZnO + 2HCl → ZnCl2 + h3O.
2. Реагируют с твёрдыми щелочами (при сплавлении), образуя в результате реакции соль – цинкат натрия и воду:
ZnO + 2NaOH → Na2 ZnO2 + h3O.
При взаимодействии оксида цинка с раствором щелочи (того же NaOH) протекает другая реакция:
ZnO + 2 NaOH + h3O => Na2[Zn(OH)4].
Координационное число – характеристика, которая определяет число ближайших частиц: атомов или инов в молекуле или кристалле. Для каждого амфотерного металла характерно свое координационное число. Для Be и Zn – это 4; Для и Al – это 4 или 6; Для и Cr – это 6 или (очень редко) 4;
Амфотерные оксиды обычно не растворяются в воде и не реагируют с ней.
Остались вопросы? Хотите знать больше об оксидах?Чтобы получить помощь репетитора – зарегистрируйтесь.Первый урок – бесплатно!
Зарегистрироваться
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
blog.tutoronline.ru
Оксиды. Примеры, классификация, свойства
Практически все элементы периодической системы Менделеева могут образовывать оксиды, или окислы – бинарные соединения, содержащие в своих молекулах атомы кислорода. Класс этих неорганических соединений, в свою очередь, делится на несколько групп: основные, кислотные, амфотерные и безразличные оксиды. Целью нашей статьи является изучение физических и химических свойств оксидов, а также их практического применения и значения для человека.
Способы получения
Главной химической реакцией получения окислов является непосредственное взаимодействие металла или неметалла с кислородом.
h3 + O2 = h3O (реакция идет с взрывом)
4K + O2 = 2K2O
К другим способам образования оксидов можно отнести горение сложных веществ, например, углеводородов. Оно заканчивается получением углекислого газа и воды. При термическом разложении нерастворимых в воде оснований или солей: карбонатов, нитратов также выделяются оксиды. Примеры таких реакций приведены ниже:
- Fe(OH)2=FeO+h3O оксид железа (II)
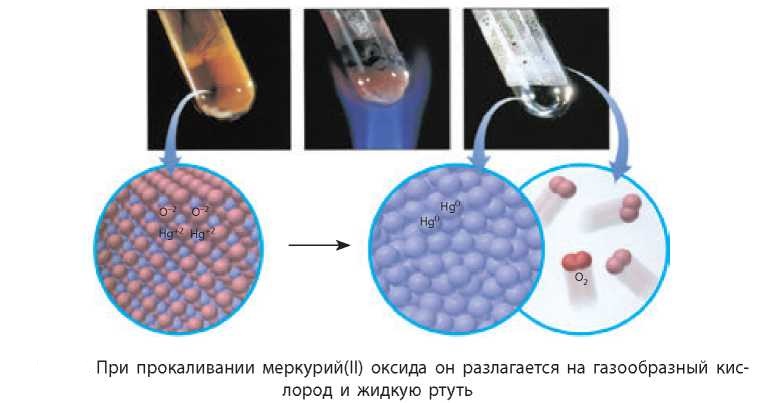
- 2KNO3= 2KNO2 + O2↑
Физическая характеристика
Агрегатное состояние бинарных соединений кислорода с металлами или неметаллами может быть различным. Например, оксиды углерода, двуокись азота, окись серы (IV) – газы. Жидкостями являются вода, серный ангидрид, а оксиды металлов – это твердые вещества. Растворимость соединений также различна. Приведем примеры оксидов с различной степенью взаимодействия с водой. Так, углекислый газ растворяется в воде при комнатной температуре в соотношении 1:1, оксид азота (II) - малорастворимый, а диоксид кремния нерастворим вовсе.
Основные оксиды
Если в состав молекулы вещества входят атомы типичных металлов, оно проявляет основные свойства. Вещество будет реагировать с кислотами и кислотными оксидами, а также с водой. Например, оксид кальция может реагировать с хлоридной кислотой:
2HCl + CaO = CaCl2 + h3O.
Продуктами реакции будет средняя соль и вода. Если этот же оксид кальция вступает во взаимодействие с оксидом углерода, то получаем одно вещество – соль.
CaO + CO2 = CaCO3.
Свойства оксидов, образованных металлами, нашли применение в различных отраслях промышленности. Так, оксид кальция, называемый еще негашеной или жженой известью, имеет важное значение как сырье для получения гашеной извести. Гидроксид кальция широко используется в промышленности в качестве строительного раствора. Известковую воду применяют в качестве индикатора на присутствие в растворе молекул углекислого газа.

Примеры оксидов, входящих в состав железной руды – это FeO и Fe2O3 – бурый и магнитный железняк. В домне их восстанавливают коксом и оксидами углерода и получают сплав железа с углеродом – чугун. В процессе его дальнейшей переработки в металлургической промышленности выплавляют различные сорта стали, в том числе и легированной.
Реакция с водой оксидов щелочных или щелочноземельных металлов приводит к получению щелочи.
Характеристика кислотных окислов
Оксиды азота, карбона, серы, кремния и др. образуют группу кислотных окислов. Химические свойства оксидов – это реакции со щелочами, основными окислами и водой. Продуктами взаимодействия между гидроксидом калия и углекислым газом будут карбонат калия и вода. Если между собой вступают в реакцию основание натрия и диоксид кремния, получаем силикат натрия и воду.
Некоторые кислотные оксиды реагируют с водой. Продуктом реакции будет соответствующая кислота (угольная):
CO2 + h3O = h3CO3.

Кислотные оксиды, примеры которых мы приведем далее, имеют важное значение. Так, серный ангидрид SO3 – бесцветная жидкость, является исходным сырьем для промышленного получения сульфатной кислоты – основного продукта химической промышленности. Соединения азота, например, NO2, используют для производства нитратной кислоты. В реакции кроме диоксида азота, участвуют также вода и кислород. Азотная кислота, полученная в результате реакции оксидов азота с водой, применяется в производстве минеральных удобрений, взрывчатых веществ, красителей, лекарственных препаратов, пластмасс и т.д
Амфотерные соединения
Окислы, в состав которых входят, например, атомы цинка или алюминия, проявляют двойственные химические свойства. Они могут реагировать как с кислотами, так и с щелочами. В этом случае продуктами взаимодействия оказываются средние соли. Вот характеристика физических свойств некоторых амфотерных оксидов, примеры которых мы рассмотрим. Так, Al2O3 - это корунд, он представляет собой твердое вещество, температура плавления которого достигает 2050°. В природе окисел входит в состав глинозема, а также образует окрашенные кристаллы, являющиеся драгоценными камнями - рубины и сапфиры.
Оксид цинка ZnO – это бесцветные кристаллы, при температуре 1800° переходящие в состояние пара. Это явление называется сублимацией. Вещество нерастворимо в воде, при вдыхании пылевидных частиц вызывает отравление. Окись цинка нашла применение в качестве абразивного материала, в производстве красок, искусственной кожи, в медицине, в стоматологии - в качестве пломбировочного материала.

В нашей статье мы изучили классификацию оксидов, химические и физические их свойства, а также применение в промышленности.
fb.ru
Оксиды
Несолеобразующие (безразличные, индифферентные) оксиды СО, SiO, N20, NO.
Солеобразующие оксиды:
Основные. Оксиды, гидраты которых являются основаниями. Оксиды металлов со степенями окисления +1 и +2 (реже +3). Примеры: Na2O - оксид натрия, СаО - оксид кальция, CuO - оксид меди (II), СоО - оксид кобальта (II), Bi2O3 - оксид висмута (III), Mn2O3 - оксид марганца (III).
Амфотерные. Оксиды, гидраты которых являются амфотерными гидроксидами. Оксиды металлов со степенями окисления +3 и +4 (реже +2). Примеры: Аl2O3 - оксид алюминия, Cr2O3 - оксид хрома (III), SnO2 - оксид олова (IV), МnO2 - оксид марганца (IV), ZnO - оксид цинка, ВеО - оксид бериллия.
Кислотные. Оксиды, гидраты которых являются кислородсодержащими кислотами. Оксиды неметаллов. Примеры: Р2О3 - оксид фосфора (III), СO2 - оксид углерода (IV), N2O5 - оксид азота (V), SO3 - оксид серы (VI), Cl2O7 - оксид хлора (VII). Оксиды металлов со степенями окисления +5, +6 и +7. Примеры: Sb2O5 - оксид сурьмы (V). СrОз - оксид хрома (VI), МnОз - оксид марганца (VI), Мn2O7 - оксид марганца (VII).

Изменение характера оксидов при увеличении с. о. металла | Cr+2O (осн.) | Cr+32O 3(амф.) | Cr+6O 3(кисл.) |
Mn+2O (осн.) | Mn+4O2 (амф.) | Mn+6O3 (кисл.) | |
Mn+32O3 (осн.) | Mn+72O 7 (кисл.) |
Оксиды бывают твердые, жидкие и газообразные, различного цвета. Например: оксид меди (II) CuO черного цвета, оксид кальция СаО белого цвета - твердые вещества. Оксид серы (VI) SO3 - бесцветная летучая жидкость, а оксид углерода (IV) СО2 - бесцветный газ при обычных условиях.
Твердые:
CaO, СuО, Li2O и др. основные оксиды; ZnO, Аl2O3, Сr2O3 и др. амфотерные оксиды; SiO2, Р2O5, СrO3 и др. кислотные оксиды.
Жидкие:
SO3, Cl2O7, Мn2O7 и др..
Газообразные:
CO2, SO2, N2O, NO, NO2 и др..
Растворимые:
а) основные оксиды щелочных и щелочноземельных металлов;
б) практически все кислотные оксиды (исключение: SiO2).
Нерастворимые:
а) все остальные основные оксиды;
б) все амфотерные оксиды
в) SiO2
1. Кислотно-основные свойства
Общими свойствами основных, кислотных и амфотерных оксидов являются кислотно-основные взаимодействия, которые иллюстрируются следующей схемой:

Пример:

(только для оксидов щелочных и щелочно-земельных металлов) (кроме SiO2).

Амфотерные оксиды, обладая свойствами и основных и кислотных оксидов, взаимодействуют с сильными кислотами и щелочами:

2. Окислительно - восстановительные свойства
Если элемент имеет переменную степень окисления (с. о.), то его оксиды с низкими с. о. могут проявлять восстановительные свойства, а оксиды с высокими с. о. - окислительные.
Примеры реакций, в которых оксиды выступают в роли восстановителей:
Окисление оксидов с низкими с. о. до оксидов с высокими с. о. элементов.
2C+2O + O2 = 2C+4O2
2S+4O2 + O2 = 2S+6O3
2N+2O + O2 = 2N+4O2
Оксид углерода (II) восстанавливает металлы из их оксидов и водород из воды.
C+2O + FeO = Fe + 2C+4O2
C+2O + h3O = h3 + 2C+4O2
Примеры реакций, в которых оксиды выступают в роли окислителей:
Восстановление оксидов с высокими с о. элементов до оксидов с низкими с. о. или до простых веществ.
C+4O2 + C = 2C+2O
2S+6O3 + h3S = 4S+4O2 + h3O
C+4O2 + Mg = C0 + 2MgO
Cr+32O3 + 2Al = 2Cr0 + 2Al2O3
Cu+2O + h3 = Cu0 + h3O
Использование оксидов малоактивных металлов дпя окисления органических веществ.

Некоторые оксиды, в которых элемент имеет промежуточную с. о., способны к диспропорционированию;
например:
2NO2 + 2NaOH = NaNO2 + NaNO3 + h3O
1. Взаимодействие простых веществ - металлов и неметаллов - с кислородом:
4Li + O2 = 2Li2O;
2Cu + O2 = 2CuO;
S + O2 = SO2
4P + 5O2 = 2P2O5
2. Дегидратация нерастворимых оснований, амфотерных гидроксидов и некоторых кислот:
Cu(OH)2 = CuO + h3O
2Al(OH)3 = Al2O3 + 3h3O
h3SO3 = SO2↑ + h3O
h3SiO3 = SiO2 + h3O
3. Разложение некоторых солей:
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
CaCO3 = CaO + CO2↑
(CuOH)2CO3 = 2CuO + CO2↑ + h3O
4. Окисление сложных веществ кислородом:
Ch5 + 2O2 = CO2 + h3O
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
4Nh4 + 5O2 = 4NO + 6h3O
5.Восстановление кислот-окислителей металлами и неметаллами:
Cu + h3SO4 (конц) = CuSO4 + SO2↑ + 2h3O
10HNO3 (конц) + 4Ca = 4Ca(NO3)2 + N2O↑ + 5h3O
2HNO3 (разб) + S = h3SO4 + 2NO↑
6. Взаимопревращения оксидов в ходе окислительно-восстановительных реакций (см. окислительно-восстановительные свойства оксидов).
examchemistry.com
К кислотным оксидам относятся оксиды неметаллов: примеры, свойства
Бинарные соединения кислорода с неметаллическими элементами – это большая группа веществ, которые входят в класс оксидов. Многие оксиды неметаллов всем хорошо известны. Это, например, углекислый газ, вода, двуокись азота. В нашей статье мы рассмотрим их свойства, выясним области применения бинарных соединений и их влияние на окружающую среду.
Общая характеристика
Практически все неметаллические элементы, за исключением фтора, аргона, неона и гелия, могут образовывать оксиды. Большинство элементов имеют несколько оксидов. Например, сера образует два соединения: двуокись серы и серный ангидрид. Это вещества, в которых валентность сульфура равна четырем и шести соответственно. Водород и бор имеют только по одному оксиду, а наибольшее количество бинарных веществ с кислородом характерно для азота. Высшими называются такие окислы, в которых степень окисления атома неметалла равна номеру группы, где находится элемент в периодической системе. Так, CO2 и SO3 – это высшие оксиды углерода и серы. Некоторые соединения могут подвергаться дальнейшему окислению. Например, угарный газ в таком случае превращается в диоксид углерода.

Строение и физические свойства
Практически все известные оксиды неметаллов состоят из молекул, между атомами которых образуются ковалентные связи. Сами частицы вещества могут быть как полярными (например, у диоксида серы), так и неполярными (молекулы углекислого газа). Двуокись кремния, представляющая собой природную форму песка, имеет атомное строение. Агрегатное состояние ряда кислотных оксидов может быть различным. Так, окислы карбона, такие как монооксид и диоксид углерода, - газообразны, а бинарные кислородные соединения водорода (h3O) или серы в высшей степени окисления (SO3) представляют собой жидкости. Особенностью воды является то, что оксид относится к несолеобразующим. Их еще называют безразличными.

Трехокись серы или серный ангидрид – это кристаллическое белое вещество. Оно быстро поглощает из воздуха влагу, поэтому диоксид серы хранят в запаянных колбах из стекла. Вещество используется в качестве осушителя воздуха и в производстве сульфатной кислоты. Окислы фосфора или кремния являются твердыми кристаллическими веществами. Взаимное превращение агрегатного состояния характерно для оксидов азота. Так, соединение NO2 – это газ бурого цвета, а соединение с формулой N2O4 имеет вид бесцветной жидкости или белого твердого вещества. При нагревании жидкость превращается в газ, а его охлаждение приводит к образованию жидкой фазы.
Взаимодействие с водой
Известны реакции кислотных оксидов с водой. Продуктами реакций будут соответствующие кислоты:
SO3 + h3O = h3SO4 – сульфатная кислота
К ним можно отнести взаимодействие пятиокиси фосфора, а также диоксидов серы, азота, углерода с молекулами h3O. Однако оксид кремния непосредственно с водой не реагирует. Чтобы получить силикатную кислоту, применяют косвенный способ. Сначала SiO2 сплавляют со щелочью, например, с гидроксидом натрия. На полученную среднюю соль – силикат натрия, действуют сильной кислотой, например хлоридной.

В результате выпадает белый студенистый осадок кремниевой кислоты. Двуокись кремния может при нагревании реагировать с солями, при этом образуются летучие кислотные оксиды. К кислотным оксидам относятся несколько соединений азота, серы и фосфора, которые занимают ведущее место в загрязнении воздуха. Они взаимодействуют с атмосферной влагой, что приводит к образованию серной, нитратной и азотистой кислоты. Их молекулы вместе с дождем или снегом попадают на растения и почву. Кислотные осадки не только вредят посевам, снижая их урожайность, но также негативно влияют на здоровье людей. Они разрушают постройки из известняка или мрамора, вызывают коррозию металлических конструкций.
Безразличные окислы
К кислотным оксидам относится группа соединений, которые не могут вступать в реакции ни с кислотами, ни со щелочами и не образуют соли. Всем вышеперечисленным соединениям не соответствуют ни кислоты, ни основания, то есть они являются несолеобразующими. Таких соединений немного. Например, к ним относится угарный газ, закись азота и его монооксид - NO. Он, наряду с диоксидом азота и двуокисью серы, участвует в образовании смога над большими промышленными предприятиями и городами. Предотвратить образование токсичных окислов можно, если снизить температуру сгорания топлива.

Взаимодействие со щелочами
Способность к реакциям со щелочами – важная особенность кислотных оксидов. Например, при взаимодействии гидроксида натрия и трехокиси серы образуется соль (сульфат натрия) и вода:
SO3 + 2NaOH → Na2SO4 + h3O
К кислотным оксидам относится двуокись азота. Ее интересной особенностью является реакция со щелочью, в продуктах обнаруживаются соли двух видов: нитраты и нитриты. Это объясняется способностью оксида азота (IV) при взаимодействии с водой образовывать две кислоты – азотную и азотистую. Двуокись серы также взаимодействует со щелочами, при этом образуются средние соли – сульфиты, а также вода. Соединение, попадая в воздух, сильно загрязняет его, поэтому на предприятиях, использующих топливо с примесью SO2, отработанные промышленные газы очищают, распыляя в них негашеную известь или мел. Также можно пропускать диоксид серы через известковую воду или раствор сульфита натрия.
Роль бинарных кислородных соединений неметаллических элементов
Многие кислотные оксиды имеют важное практическое значение. Например, углекислый газ используют в огнетушителях, так как он не поддерживает горение. Окись кремния – песок, широко используется в строительной промышленности. Угарный газ является исходным сырьем для получения метилового спирта. К кислотным оксидам относится пятиокись фосфора. Это вещество применяют в производстве ортофосфорной кислоты.

Бинарные кислородные соединения неметаллов влияют на организм человека. Большинство из них являются токсичными. О вредном влиянии угарного газа мы говорили ранее. Также доказано негативное воздействие оксидов азота, особенно двуокиси азота, на дыхательную и сердечно-сосудистую систему. К кислотным оксидам относится углекислый газ, который не считают ядовитым веществом. Но если его объемная доля в воздухе превышает 0,25%, у человека возникают симптомы удушья, которые могут иметь летальный исход вследствие остановки дыхания.
В нашей статье мы изучили свойства кислотных оксидов и привели примеры их практического значения в жизни человека.
fb.ru



















