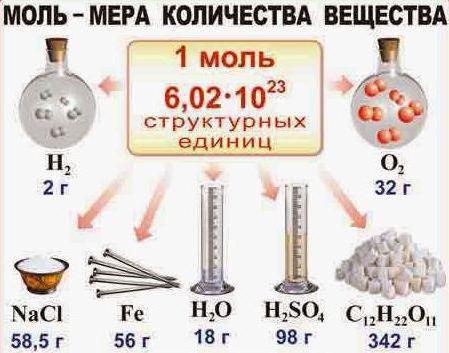
1.3.3. Моль, молярная масса, молярный объем. Моль воды
Что такое моль в химии :: SYL.ru
Понятие моль используют для измерения химических веществ. Выясним особенности этой величины, приведем примеры расчетных заданий с ее участием, определим важность данного термина.
Определение
Моль в химии – это единица вычисления. Она представляет собой количество определенного вещества, в котором находится столько структурных единиц (атомов, молекул), сколько содержится в 12 граммах атома углерода.

Число Авогадро
Количество вещества связано с числом Авогадро, которое составляет 6*10^23 1/моль. Для веществ молекулярного строения считают, что один моль включает именно число Авогадро. Если нужно посчитать число молекул, содержащееся в 2 молях воды, то необходимо умножить 6*10^23 на 2 , получаем 12*10^23 штук. Давайте рассмотрим, какую роль играет моль в химии.
Количество вещества
Вещество, которое состоит из атомов, содержит число Авогадро. Например, для атома натрия это 6*10*23 1/моль. Каково его обозначение? Моль в химии обозначают греческой буквой «ню» или латинской «n». Для проведения математических вычислений, связанных с количеством вещества, используют математическую формулу:
n=N/N(A), где n – количество вещества, N(A) – число Авогадро, N – количество структурных частиц вещества.
При необходимости можно вычислить число атомов (молекул):
N=N(A) * n
Фактическая масса моля называется молярной. Если количество вещества определяют в молях, то величина молярной массы имеет единицы измерения г/моль. В численном выражении она соответствует значению относительной молекулярной массы, которую можно определить путем суммирования относительных атомных масс отдельных элементов.

Например, для того чтобы определить молярную массу молекулы углекислого газа, необходимо провести следующие расчеты:
M (CO2)=Ar(C)+2Ar(O)=12+2*16=44
При вычислении молярной массы оксида натрия получаем:
M (Na2O)=2*Ar(Na)+Ar(O)=2*23+16=62
При определении молярной массы серной кислоты суммируем две относительные атомные массы водорода с одной атомной массой серы и четырьмя относительными атомными массами кислорода. Их значения всегда можно найти в периодической таблице Менделеева. В итоге получаем 98.
Моль в химии позволяет проводить разнообразные расчеты, связанные с химическими уравнениями. Все типовые расчетные задачи в неорганической и органической химии, которые предполагают нахождение массы и объема веществ, решаются именно через моли.
Примеры расчетных задач
Молекулярная формула любого вещества указывает на количество молей каждого элемента, включенного в его состав. Например, один моль фосфорной кислоты содержит три моля атомов водорода, один моль атомов фосфора и четыре моля атомов кислорода. Все достаточно просто. Моль в химии является переходом из микромира молекул и атомов в макросистему с килограммами и граммами.
Задача 1. Определите число молекул воды, содержащихся в 16,5 молях.
Для решения используем связь между числом Авогадро (количество вещества). Получаем:
16,5*6,022*1023 = 9,9*1024 молекул.

Задача 2. Рассчитайте число молекул, содержащихся в 5 г углекислого газа.
Сначала необходимо вычислить молярную массу данного вещества, воспользовавшись ее связью с относительной молекулярной массой. Получаем:
M (CO2)=Ar(C)+2Ar(O)=12+2*16=44.
Далее вычисляем число молекул, используя формулу, приведенную выше:
N=5/44*6,023*1023=6,8*1023 молекул.
Алгоритм задач на химическое уравнение
При вычислении массы или продуктов реакции по уравнению используют определенный алгоритм действий. Сначала определяют, какое из исходных веществ в недостатке. Для этого находят их количество в молях. Далее составляют уравнение процесса, обязательно расставляют стереохимические коэффициенты. Над веществами записывают исходные данные, под ними указывают количество вещества, взятое в молях (по коэффициенту). В случае необходимости осуществляют перевод единиц измерения, пользуясь формулами. Далее составляют пропорцию и решают ее математическим способом.
Если предлагается более сложная задача, то предварительно вычисляют массу чистого вещества, убирая примеси, потом уже приступают к определению его количества (в молях). Ни одна задача в химии, связанная с уравнением реакции, не решается без такой величины, как моль. Кроме того с помощью данного термина, легко можно определить количество молекул или атомов, воспользовавшись для таких вычислений постоянным числом Авогадро. Расчетные задания включены в тестовые вопросы по химии для выпускников основной и средней общеобразовательной школы.
www.syl.ru
Объяснение что такое «моль», «молярная масса» и «количество вещества»
Вчера обещал объяснить это доступным языком. Вещь важная для понимания химии. Если один раз понять, то потом уже не забудешь.Химия имеет свой язык, как и любая наука. 2h3 + O2 → 2h3O — на химическом языке запись реакции образования воды из простых веществ, водорода (H) и кислорода (O). Маленькие цифры относятся к количеству атомов (Они стоят после символа химического элемента), большие — к количеству молекул. Из уравнения видно что две молекулы водорода соединяются с одной молекулой кислорода и в результате выходит две молекулы воды. Внимание — это очень важно понять! Соединяются именно молекулы с молекулами, не «грамм с граммом», а молекула с молекулой.
Эта пропорция сохранится всегда:
| 2 молекулы водорода | соединятся с одной молекулой кислорода | и получится | 2 молекулы воды |
| 200 молекул водорода | соединятся с 100 молекул кислорода | и получится | 200 молекулы воды |
| 2000 молекул водорода | соединятся с 1000 молекул кислорода | и получится | 2000 молекулы воды |
| 2 миллиона молекул водорода | соединятся с миллионом молекул кислорода | и получится | 2 миллиона молекул воды |
Всё бы хорошо, но есть две проблемы. Первая — в реальной жизни мы не сможем отмерить один миллион молекул кислорода или водорода. Мы сможем отмерить один грамм или одну тонну реактивов. Вторая — молекулы очень маленькие. В одном стакане воды их 6,7·1024 штук. Или, в обычной записи 6,7 триллионов триллионов (именно так — почти семь триллионов раз по триллиону молекул). Оперировать такими цифрами неудобно.
Какой же выход? Молекулы ведь тоже имеют массу, пускай очень маленькую. Мы просто берём массу одной молекулы, умножаем на количество молекул и получаем нужную нам массу. Договорились так — берём очень большое количество молекул (600 миллиардов триллионов штук) и изобретаем для этого количества специальную единицу измерения моль. Как для 12 штук чего-либо есть специальное название «дюжина», и когда говорят о «десяти дюжинах», то имеют в виду 120 штук. 5 дюжин яиц = 60 штук. Так и с молями. 1 моль — это 600 миллиардов триллионов молекул или, в математической нотации, 6,02·1023 молекул. То есть когда нам говорят «1 моль» водорода, мы знаем что речь идёт о 600 миллиардах триллионов молекул водорода. Когда говорят о 0,2 молях воды, то мы понимаем что речь идёт 120 миллиардах триллионов молекул воды.
Ещё раз — моль это просто такая счётная единица, только специально для молекул. Как «десяток», «дюжина» или «миллион», только гораздо больше.
Продолжая таблицу выше, можно написать:
| 2 моля водорода | соединятся с одним молем кислорода | и получится | 2 моля воды |
| 20 молей водорода | соединятся с 10 молями кислорода | и получится | 20 молей воды |
| 1000 молей водорода | соединятся с 500 молями кислорода | и получится | 1000 молей воды |
Первую проблему мы решили, писать 1 моль или 2 моля гораздо удобнее чем 600 миллиардов триллионов молекул или 1,2 триллиона триллионов молекул. Но для одного удобства не стоило огород городить. Вторая проблема, как помним, переход от количества молекул (не считать же их поштучно!) к массе вещества, к тому что мы можем отмерить на весах. Такое количество молекул в одном моле (оно ведь немного странное, некруглое — 6,02·1023 молекул) выбрано неспроста. Один моль молекул углерода весит ровно 12 грамм.
Понятно что все молекулы разные. Есть большие и тяжелые — в них может быть много атомов, или не очень много, но зато сами атомы тяжелые. А есть маленькие и легкие молекулы. Для каждого атома и для многих молекул есть в справочниках таблицы с их молярной массой. То есть с весом одного моля таких молекул (если нет, можно легко самим посчитать, сложив молярные массы всех атомов, из которых составлена молекула). Молярная масса измеряется в грамм/моль (сколько грамм весит один моль, то есть сколько грамм весят 6,02·1023 молекул). Мы помним ведь что моль — просто счётная единица. Ну как если бы в справочнике писали — 1 дюжина куриных яиц весит 600 грамм, а 1 дюжина страусиных весит 19 килограмм. Дюжина — просто количество (12 штук), а сами яйца, куриное или страусиное, весят по-разному. И дюжина таких или других яиц тоже по-разному весит.
Так и с молекулами. 1 моль маленьких и лёгких молекул водорода весит 2 грамма, а 1 моль больших молекул серной кислоты — 98 грамм. 1 моль кислорода весит 32 грамма, 1 моль воды — 18 грамм. Вот картинка для примера, где видны маленькие молекулы водорода и большие молекулы кислорода. Эта картинка — графическое отображение реакции 2h3 + O2 → 2h3O.
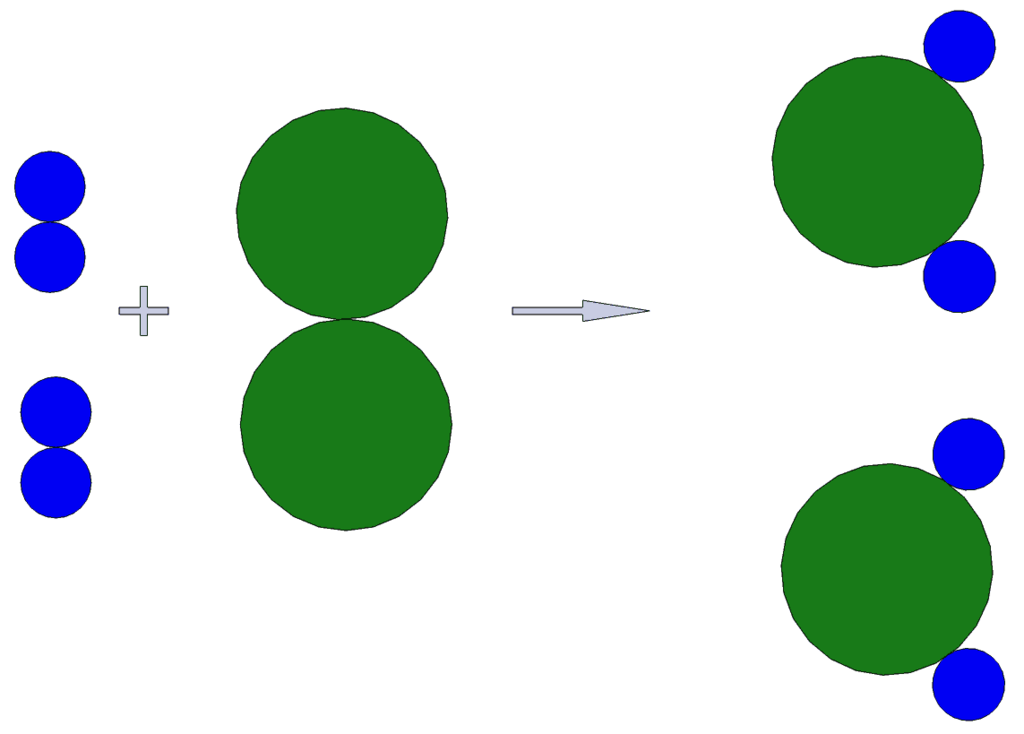
Продолжаем заполнять таблицу:
| 2 моля водорода | соединятся с одним молем кислорода | и получится | 2 моля воды |
| 4 грамма водорода (т.к. 1 моль водорода весит два грамма) | соединятся с 32 граммами кислорода | и получится | 36 грамм воды |
Видите переход от количества молекул к их массе? Видите что выполняется закон сохранения вещества? 4 грамма + 32 грамма дали 36 грамм.
Теперь мы можем решать простые задачи по химии. Вот самая примитивная: Было 100 молекул кислорода и 100 молекул водорода. Что произойдёт в результате реакции? Мы знаем что на 1 молекулу кислорода нужно 2 молекулы водорода. Поэтому прореагируют все 100 молекул водорода (и образуется 100 молекул воды), а вот кислород прореагирует не весь, ещё 50 молекул останется. Кислород в избытке.
Молекулы штуками, как я уже сказал выше, никто не считает. Вещества обычно отмеряют граммами. Теперь задача из школьного учебника: есть 10 г. водорода и 64 г. кислорода, что будет если их смешать? Мы для начала должны перевести массы в моли (то есть в количество молекул или количество вещества, как говорят химики). 10 г. водорода — это 5 моль водорода (1 моль водорода весит 2 грамма). 64 г. кислорода — это 2 моля (1 моль весит 32 грамма). Мы знаем что на 1 моль кислорода при реакции уходит 2 моля водорода. Значит, в нашем случае прореагирует весь кислород (2 моля) и 4 моля водорода из пяти. Получится 4 моля воды и ещё останется один моль водорода.
Переведём ответ снова в граммы. Прореагирует весь кислород (64 грамма) и 8 грамм водорода (4 моля * 2 г/моль). 1 моль водорода останется не прореагировавшим (это 2 грамма) и получится 72 грамма воды (4 моля * 18 г/моль). Закон сохранения вещества опять выполняется — 64 + 10 = 72 + 2.
Думаю что теперь уже всем должно быть понятно. 1 моль — просто количество молекул. Молярная масса — это масса одного моля. Она нужна для того чтобы переходить от массы вещества (с которой мы работаем в реальном мире) к количеству молекул, или количеству вещества, нужному для реакций.
Снова повторимся:
а) вещества реагирует в соотношении n молекул одного к m молекул другого. Это пропорция будет одинаковой и для 100 молекул исходного вещества, и для ста триллионов, или для ста триллионов триллионов.б) для удобства, чтобы не считать молекулы штуками, придумали специальную счётную единицу — моль, то есть сразу 6,02·1023 молекул. Количество этих молей называют обычном «количество вещества»в) моль каждого вещества весит по-разному, т.к. молекулы и атомы, из которых состоит вещества, сами весят по-разному. Масса одного моля вещества называется его молярной массой. Ещё один пример — обычные и силикатные кирпичи весят по-разному. Если мы проведём аналогию, то «вес тысячи кирпичей» — это «молярная масса» (с тем отличием что молекул не 1000, а больше). Масса этой «тысячи кирпичей» разная для силикатных и обычных кирпичей.г) весь этот огород городим для того чтобы легко можно было переходить от массы реактивов к количеству вещества (количеству молекул, количеству молей) и обратно. А переходить туда/обратно нужно потому что в реальном мире мы отмеряем реактивы граммами, а химические реакции идут пропорционально не массе, а количеству молекул.
P.S. Химикам и прочим — я здесь специально многое упрощал. Не нужно мне объяснять что 12 грамм весит не 1 моль углерода, а 1 моль молекул изотопа С12, или про то что вместо «молекул» нужно было бы писать «структурных единиц» (молекул, ионов, атомов...), специально не упомянул что 1 моль газа занимает одинаковый объём при одинаковых условиях и ещё про многое другое
Что мне не нравилось в учебниках — только формальное определение моля, без указания смысла этого понятия и для чего это нужно.
chva.livejournal.com
1.3.3. Моль, молярная масса, молярный объем
Одной из основных единиц в Международной системе единиц (СИ) является единица количества вещества – моль.
Моль – это такое количество вещества, которое содержит столько структурных единиц данного вещества (молекул, атомов, ионов и др.), сколько атомов углерода содержится в 0,012 кг (12 г) изотопа углерода 12С.
Учитывая, что значение абсолютной атомной массы для углерода равно m(C) = 1,99·1026 кг, можно рассчитать число атомов углерода NА, содержащееся в 0,012 кг углерода.
Моль любого вещества содержит одно и то же число частиц этого вещества (структурных единиц). Число структурных единиц, содержащихся в веществе количеством один моль равно 6,02·1023 и называется числом Авогадро (NА).
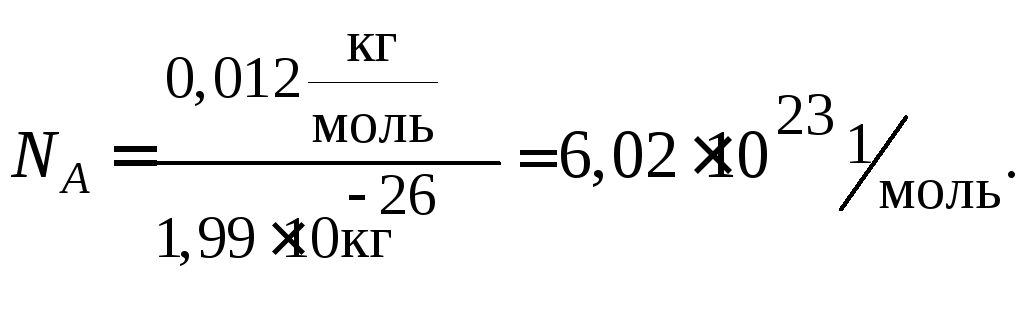
Например, один моль меди содержит 6,02·1023 атомов меди (Cu), а один моль водорода (h3) – 6,02·1023 молекул водорода.
Молярной массой (M) называется масса вещества, взятого в количестве 1 моль.
Молярная масса обозначается буквой М и имеет размерность [г/моль]. В физике пользуются размерностью [кг/кмоль].
В общем случае численное значение молярной массы вещества численно совпадает со значением его относительной молекулярной (относительной атомной) массы.
Например, относительная молекулярная масса воды равна:
Мr(Н2О) = 2Аr (Н) + Аr (O) = 2∙1 + 16 = 18 а.е.м.
Молярная масса воды имеет ту же величину, но выражена в г/моль:
М (Н2О) = 18 г/моль.
Таким образом, моль воды, содержащий 6,02·1023 молекул воды (соответственно 2·6,02·1023 атомов водорода и 6,02·1023 атомов кислорода), имеет массу 18 граммов. В воде, количеством вещества 1 моль, содержится 2 моль атомов водорода и один моль атомов кислорода.
1.3.4. Связь между массой вещества и его количеством
Зная массу вещества и его химическую формулу, а значит и значение его молярной массы, можно определить количество вещества и, наоборот, зная количество вещества, можно определить его массу. Для подобных расчетов следует пользоваться формулами:
ν = m / M,
m = ν · M,
где ν – количество вещества, [моль]; m – масса вещества, [г] или [кг]; М – молярная масса вещества, [г/моль] или [кг/кмоль].
Например, для нахождения массы сульфата натрия (Na2SO4) количеством 5 моль найдем:
1) значение относительной молекулярной массы Na2SO4, представляющую собой сумму округленных значений относительных атомных масс:
Мr(Na2SO4) = 2Аr(Na) + Аr(S) + 4Аr(O) = 142,
2) численно равное ей значение молярной массы вещества:
М(Na2SO4) = 142 г/моль,
3) и, наконец, массу 5 моль сульфата натрия:
m = ν · M = 5 моль · 142 г/моль = 710 г.
Ответ: 710.
1.3.5. Связь между объемом вещества и его количеством
При нормальных условиях (н.у.), т.е. при давлении р, равном 101325 Па (760 мм. рт. ст.), и температуре Т, равной 273,15 К (0С), один моль различных газов и паров занимает один и тот же объем, равный 22,4 л.
Объем, занимаемый 1 моль газа или пара при н.у., называется молярным объемом газа и имеет размерность литр на моль.
Vмол = 22,4 л/моль.
Зная количество газообразного вещества (ν) и значение молярного объема (Vмол) можно рассчитать его объем (V) при нормальных условиях:
V = ν · Vмол,
где ν – количество вещества [моль]; V – объем газообразного вещества [л]; Vмол = 22,4 л/моль.
И, наоборот, зная объем (V) газообразного вещества при нормальных условиях, можно рассчитать его количество (ν):
ν = V /Vмол.
studfiles.net
Урок 5. Моль и молярная масса – HIMI4KA
В уроке 5 «Моль и молярная масса» из курса «Химия для чайников» рассмотрим моль как единицу измерения количества вещества; дадим определение числу Авогадро, а также научимся определять молярную массу и решать задачи на количество вещества. Базой для данного урока послужат основы химии, изложенные в прошлых уроках, так что если вы изучаете химию с нуля, то рекомендую их просмотреть хотя бы мельком.

Единица измерения количества вещества
До этого урока мы обсуждали лишь индивидуальные молекулы и атомы, а их массы мы выражали в атомных единицах массы. В реальной жизни с индивидуальными молекулами работать невозможно, потому что они ничтожно малы. Для этого химики взвешивают вещества ни в а.е.м., а в граммах.

Чтобы перейти от молекулярной шкалы измерения масс в лабораторную шкалу, используют единицу измерения количества вещества под названием моль. 1 моль содержит 6,022·1023 частиц (атомов или молекул) и является безразмерной величиной. Число 6,022·1023 носит название Число Авогадро, которое определяется как число частиц, содержащихся в 12 г атомов углерода 12C. Важно понимать, что 1 моль любого вещества содержит всегда одно и то же число частиц (6,022·1023).

Как уже было сказано, термин «моль» применяется не только к молекулам, но также и к атомам. Например, если вы говорите о моле гелия (He), то это означает, что вы имеет количество равное 6,022·1023атомов. Точно так же, 1 моль воды (h3O) подразумевает количество равное 6,022·1023молекул. Однако чаще всего моль применяют именно к молекулам.
Молярная масса вещества
Молярная масса – это масса 1 моля вещества, выраженная в граммах. Молярную массу одного моля любого химического элемента без труда находят из таблицы Менделеева, так как молярная масса численно равна атомной массе, но размерности у них разные (молярная масса имеет размерность г/моль). Запишите и запомните формулы для вычисления молярной массы, количества вещества и числа молекул:
- Молярная масса формула M=m/n
- Количество вещества формула n=m/M
- Число молекул формула N =NA·n
где m — масса вещества, n — количество вещества (число молей), М — молярная масса, N — число молекул, NA — число Авогадро. Благодаря молярной массе вещества химики могут вести подсчет атомов и молекул в лаборатории просто путем их взвешивания. Этим и удобно использование понятия моль.
На рисунке изображены четыре колбы с различными веществами, но в каждой из них всего 1 моль вещества. Можете перепроверить, используя формулы выше.
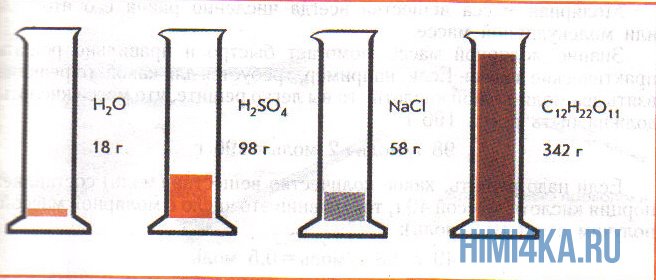
Задачи на количество вещества
Пример 1. Сколько граммов Н2, Н2O, СН3ОН, октана (С8Н18) и газа неона (Ne) содержится в 1 моле?
Решение: Молекулярные массы (в атомных единицах массы) перечисленных веществ приведены в таблице Менделеева. 1 моль каждого из названных веществ имеет следующую массу:
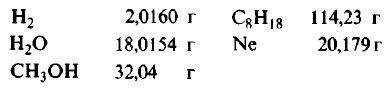
Поскольку массы, указанные в решении примера 1, дают правильные относительные массы взвешиваемых молекул, указанная масса каждого из перечисленных веществ содержит одинаковое число молекул. Этим и удобно использование понятия моля. Нет даже необходимости знать, чему равно численное значение моля, хотя мы уже знаем, что оно составляет 6,022·1023; эта величина называется числом Авогадро и обозначается символом NA. Переход от индивидуальных молекул к молям означает увеличение шкалы измерения в 6,022·1023 раз. Число Авогадро представляет собой также множитель перевода атомных единиц массы в граммы: 1 г = 6,022·1023 а.е.м. Если мы понимаем под молекулярной массой массу моля вещества, то ее следует измерять в граммах на моль; если же мы действительно имеем в виду массу одной молекулы, то она численно совпадаетс молекулярной массой вещества, но выражается в атомных единицах массы на одну молекулу. Оба способа выражения молекулярной массы правильны.
Пример 2. Сколько молей составляют и сколько молекул содержат 8 г газообразного кислорода O2?
Решение: Выписываем из таблицы Менделеева атомную массу атома кислорода (O), которая равна 15,99 а.е.м, округляем до 16. Так как у нас молекула кислорода, состоящая из двух атомов O, то ее атомная масса равна 16×2=32 а.е.м. Хорошо, а теперь переводим ее в молярную массу: 32 а.е.м = 32 г/моль. Это означает, что 1 моль (6,022·1023 молекул) O2 имеет массу 32 грамма. Ну и в заключении по формулам выше находим количество вещества (моль) и число молекул, содержащихся в 8 граммах O2:
- n = m / M = 8г / 32г/моль = 0,25 моль
- N = NA × n = 6,022·1023 × 0,25 = 1,505·1023 молекул
Пример 3. 1 молекула Н2 реагирует с 1 молекулой Сl2, в результате чего образуются 2 молекулы газообразного хлористого водорода НСl. Какую массу газообразного хлора необходимо использовать, чтобы он полностью прореагировал с 1 килограммом (кг) газообразного водорода?
Решение: Молекулярные массы h3 и Cl2 равны 2,0160 и 70,906 г/моль соответственно. Следовательно, в 1000 г h3 содержится
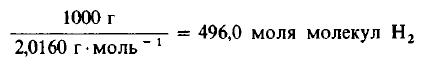
Даже не выясняя, сколько молекул содержится в одном моле вещества, мы можем быть уверены, что 496 моля Cl2 содержат такое же число молекул, как и 496,0 моля, или 1000 г, h3. Сколько же граммов Cl2 содержится в 496 молях этого вещества? Поскольку молекулярная масса Cl2 равна 70,906 г/моль, то
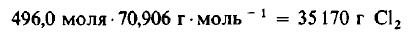
Пример 4. Сколько молекул h3 и Cl2 принимает участие в реакции, описанной в примере 3?
Решение: В 496 молях любого вещества должно содержаться 496 моля × 6,022·1023 молекул/моль, что равно 2,99·1026 молекул.
Чтобы наглядно показать, сколь велико число Авогадро, приведем такой пример: 1 моль кокосовых орехов каждый диаметром 14 сантиметров (см) мог бы заполнить такой объем, какой занимает наша планета Земля. Использование молей в химических расчетах рассматривается в следующей главе, но представление об этом пришлось ввести уже здесь, поскольку нам необходимо знать, как осуществляется переход от молекулярной шкалы измерения масс к лабораторной шкале.
Надеюсь урок 5 «Моль и молярная масса» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Урок 5. Моль и молярная масса
5 (100%) 3 voteshimi4ka.ru
"Моль – единица количества вещества. Молярная масса". 8-й класс

Разделы: Химия
Цель: Познакомить учащихся с понятиями «количество вещества», «молярная масса» дать представление о постоянной Авогадро. Показать взаимосвязь количества вещества, числа частиц и постоянной Авогадро, а также взаимосвязь молярной массы, массы и количества вещества. Научить производить расчёты.
Тип урока: урок изучения и первичного закрепления новых знаний.
Ход урока
I. Организационный момент
II. Проверка д/з по теме: «Типы химических реакций»
III. Изучение нового материала
1. Количество вещества – моль
Вещества вступают в реакцию в строго определённых соотношениях. Например, чтобы получить вещество вода нужно взять столько водорода и кислорода, чтобы на каждые две молекулы водорода приходилась одна молекула кислорода:
2Н2 + O2 = 2Н2О
Чтобы получить вещество сульфид железа, нужно взять столько железа и серы, чтобы на каждый атом железа приходился один атом серы.
Fe + S = FeS
Чтобы получить вещество оксид фосфора, нужно взять столько молекул фосфора и кислорода, чтобы на четыре молекулы фосфора приходилось пять молекул кислорода.
4P + 5O2 = 2P2O5
Определить количество атомов, молекул и других частиц на практике невозможно – они слишком малы и не видны невооружённым глазом. Для определения числа структурных единиц (атомов, молекул) в химии применяют особую величину – количество вещества (v – ню). Единицей количества вещества является моль.
- Моль – это количество вещества, которое содержит столько структурных частиц (атомов, молекул), сколько атомов содержится в 12 г углерода.
Экспериментально установлено, что 12 г углерода содержит 6·1023 атомов. Значит один моль любого вещества, независимо от его агрегатного состояния содержит одинаковое число частиц – 6· 1023 .
- 1 моль кислорода (O2) содержит 6·1023 молекул.
- 1 моль водорода (Н2) содержит 6·1023 молекул.
- 1 моль воды (Н2O) содержит 6·1023 молекул.
- 1 моль железа (Fe) содержит 6·1023 молекул.
Задание: Используя полученную информацию, ответьте на вопросы:
а) сколько атомов кислорода содержится в 1 моле кислорода?
– 6·1023·2 = 12· 1023 атомов.
б) сколько атомов водорода и кислорода содержится в 1 моле воды (Н2O)?
– 6·1023·2 = 12· 1023 атомов водорода и 6·1023 атомов кислорода.
Число 6·1023 названо постоянной Авогадро в честь итальянского учёного 19 века и обозначается NА. Единицы измерения атомы/моль или молекулы/моль.
2. Решение задач на нахождение количества вещества
Часто нужно знать, сколько частиц вещества содержится в определённом количестве вещества. Или же найти количество вещества по известному числу молекул. Эти расчёты можно сделать по формуле:
где N – число молекул, NА – постоянная Авогадро, v – количество вещества. Из этой формулы можно выразить количество вещества.
Задача 1. Сколько атомов содержится в 2 молях серы?
N = 2·6·1023 = 12·1023 атомов.
Задача 2. Сколько атомов содержится в 0,5 молях железа?
N = 0,5·6·1023 = 3·1023 атомов.
Задача 3. Сколько молекул содержится в 5 молях углекислого газа?
N = 5·6·1023 = 30·1023 молекул.
Задача 4. Какое количество вещества составляет 12·1023 молекул этого вещества?
v = 12·1023/ 6·1023 = 2 моль.
Задача 5. Какое количество вещества составляет 0,6·1023 молекул этого вещества?
v = 0,6·1023/ 6·1023 = 0,1 моль.
Задача 6. Какое количество вещества составляет 3·1023 молекул этого вещества?
v = 3·1023/ 6·1023 = 0,5 моль.
3. Молярная масса
Для химических реакций нужно учитывать количество вещества в молях.
В: Но как на практике отмерить 2, или 2,5 моль вещества? В каких единицах лучше всего измерять массу веществ?
Для удобства в химии используют молярную массу.
Молярная масса – это масса одного моля вещества.
Обозначается – М. Измеряется в г/моль.
Молярная масса равна отношению массы вещества к соответствующему количеству вещества.
где М – молярная масса вещества, v – количество вещества, т – масса вещества.
Молярная масса – величина постоянная. Численное значение молярной массы соответствует значению относительной атомной или относительной молекулярной массы.
В: Как можно найти значения относительной атомной или относительной молекулярной массы?
Мr (S) = 32; M (S) = 32 г/моль – что соответствует 1 молю серы
Мr (Н2О) = 18; М (Н2О) = 18 г/моль – что соответствует 1 молю воды.
Следует отличать понятия «моль молекул» и «моль атомов». Например, Н2О соответствует одному молю молекулы воды. В: Сколько молей атомов кислорода и водорода содержится в одном моле молекулы воды? В одном моле молекулы воды содержится два моля атомов водорода и один моль атомов кислорода. |
4. Решение задач на нахождение массы вещества
Задача 7. Определить массу 0,5 моль железа.
m = 0,5·56 = 28 г
Задача 8. Определить массу 0,25 моль меди
m = 0,25·64 = 16 г
Задача 9. Определить массу 2 моль углекислого газа (СO2)
m = 2·44 = 88 г
Задача 10. Сколько молей оксида меди – CuО составляют 160 г оксида меди?
v = 160 / 80 = 8 моль
Задача 11. Сколько молей воды соответствуют 30 г воды
v =30/18 = 1,66 моль
Задача 12. Сколько молей магния соответствует его 40 граммам?
v = 40 /24 = 1,66 моль
IV. Закрепление
Фронтальный опрос:
- Что такое количество вещества?
- Чему равен 1 моль любого вещества?
- Что такое молярная масса?
- Отличается ли понятия «моль молекул» и «моль атомов»?
- Объясните на примере молекулы аммиака NН3.
- Зачем необходимо знать формулы при решении задач?
Задачи:
- Сколько молекул содержится в 180 граммах воды?
- Сколько молекул составляет 80 г углекислого газа?
V. Домашнее задание
Изучить текст параграфа, составить две задачи: на нахождение количества вещества; на нахождение массы вещества.
Литература:
- Гара Н.Н. Химия. Уроки в 8 классе: пособие для учителя. _ М.: Просвещение, 2009.
- Рудзитес Г.Е., Фельдман Ф.Г. Химия. 8 класс.: Учебник для общеобразовательных учебных учреждений – М.: Просвещение, 2009.
xn--i1abbnckbmcl9fb.xn--p1ai
Количество - моль - вода
Количество - моль - вода
Cтраница 2
ОН ] - концентрации соответственно водородных и гидроксильных ионов в воде в г-ион / л, а [ Н2О ] - количество молей воды в 1 л ее. Константа диссоциации воды зависит от температуры. [16]
Измерена электропроводность перфорированных ионообменных мембран МРФ-4МБ и ПФСП при 30, 60 и 80 С в зависимости от концентрации обменных групп и количества сорбированных молей воды. [17]
В этом объеме при температуре кипения воды 7380 К необходимо обеспечить давление водяных паров, равное ро для чего надо нагреть до температуры кипения и испарить некоторое количество молей воды. [18]
Так как вода - очень слабый электролит, то количество молекул воды, распавшихся на ионы - будет крайне незначительно и практически концентрация молекул воды Н2О равна количеству молей воды в 1 л воды. [19]
В табл. 5 составы растворов пересчитаны на одновалентные ионы и содержание воды приведено на 100 эквивалентов солей, а в табл. 6 составы растворов пересчитаны на двухвалентные ионы и поэтому количество молей воды на 100 двойных эквивалентов солей удваивается. [21]
При втором выводе следует иметь в виду два обстоятельства: во-первых, что под 1 - п или п всегда нужно подразумевать истинное число переноса, а не гитторфское, и, во-вторых, что наряду с переносом соли посредством тока возможен также перенос воды, благодаря образованию гидратов обоих ионов. Если т - количество молей воды, которое при прохождении 1 F переносится в направлении положительного тока ( как это до сих пор всегда наблюдалось, см. стр. [22]
Вершины нижнего квадрата соответствуют 100 % - ному содержанию солей, причем концентрация выражена в ионных массовых процентах. В верхнем квадрате отложено количество молей воды на 1 моль суммы солей. [24]
При перегонке бромбензола с водяным паром под нормальным атмосферным давлением смесь кипит при 95 25 С. Считая, что бромбензол практически не растворим в воде, определить соотношение количества молей воды и бромбензола в парах и процентное содержание бромбензола и воды в дистилляте. [25]
При перегонке бромбензола CeHsBr с водяным паром под нормальным атмосферным давлением смесь кипит при 95 25 С. Считая, что бромбензол практически не растворим в воде, определить соотношение количеств молей воды и бромбензола в парах и процентное содержание бромбензола и воды в дистилляте. [26]
Далее рассчитывают количество кислоты, которая должна образоваться на более верхних тарелках, и воды, поступающей с верхней тарелки. От числа молей окислов азота, поступивших на данную тарелку, отнимают число молей НМО3, поступивших с конденсатом. Аналогично, от количества молей воды на данной тарелке отнимают количество молей воды в конденсате. [27]
Далее рассчитывают количество кислоты, которая должна образоваться на более верхних тарелках, и воды, поступающей с верхней тарелки. От числа молей окислов азота, поступивших на данную тарелку, отнимают число молей НМО3, поступивших с конденсатом. Аналогично, от количества молей воды на данной тарелке отнимают количество молей воды в конденсате. [28]
Поскольку мы делали все время довольно грубые допущения, следует считать, что совпадение в определении числа молей гидратной воды у иона водорода, полученное в трех различных методах ( сорбция неэлектролитов, кинетика ионного обмена и набухание), вполне допустимое. Идея о разделении внутренней воды на свободную и гидратационную, вероятно, разумна, однако допущение постоянства количества молекул воды, входящей в гидратную оболочку фиксированных ионов и противоионов смолы, независимо от степени сшивки смолы, является почти наверняка грубым упрощением. Это взаимодействие стремится вытеснить молекулы воды из гидратной оболочки катиона и уменьшить степень его гидратации. Таким образом, в случае иона, находящегося в смоле с высокой степенью сшивки, определение количества молей воды, входящих в его гидратную оболочку, будет приводить к более низким результатам, чем в случае того же иона, находящегося в смоле с малой степенью сшивки. В некотором отношении это подтверждается приведенными выше цифрами. Количества молей воды, входящих в гидратную оболочку иона водорода, найденные с помощью определения сорбции неэлектролитов или подсчитанные из скоростей ионного обмена, получены в обоих случаях в результате экстраполяции к бесконечно большой степени сшивки; они поэтому представляют собой верхние пределы этой величины, равные 4 г-моль / г-ион и соответственно 5 г-моль / г-ион. [29]
Поскольку мы делали все время довольно грубые допущения, следует считать, что совпадение в определении числа молей гидратной воды у иона водорода, полученное в трех различных методах ( сорбция неэлектролитов, кинетика ионного обмена и набухание), вполне допустимое. Идея о разделении внутренней воды на свободную и гидратационную, вероятно, разумна, однако допущение постоянства количества молекул воды, входящей в гидратную оболочку фиксированных ионов и противоионов смолы, независимо от степени сшивки смолы, является почти наверняка грубым упрощением. Это взаимодействие стремится вытеснить молекулы воды из гидратной оболочки катиона и уменьшить степень его гидратации. Таким образом, в случае иона, находящегося в смоле с высокой степенью сшивки, определение количества молей воды, входящих в его гидратную оболочку, будет приводить к более низким результатам, чем в случае того же иона, находящегося в смоле с малой степенью сшивки. В некотором отношении это подтверждается приведенными выше цифрами. Количества молей воды, входящих в гидратную оболочку иона водорода, найденные с помощью определения сорбции неэлектролитов или подсчитанные из скоростей ионного обмена, получены в обоих случаях в результате экстраполяции к бесконечно большой степени сшивки; они поэтому представляют собой верхние пределы этой величины, равные 4 г-моль / г-ион и соответственно 5 г-моль / г-ион. [30]
Страницы: 1 2
www.ngpedia.ru





















