Большая Энциклопедия Нефти и Газа. Критическая вода
Критическая точка - вода - Большая Энциклопедия Нефти и Газа, статья, страница 1
Критическая точка - вода
Cтраница 1
Критическая точка воды имеет следующие параметры: ркр22 136 МПа; / Кр 374 15 С. [2]
Точка / ( - критическая точка воды. Выше температуры 373 С вода не может находиться в жидком состоянии ни при каком сколь угодно большем давлении, чем 219 82 - 105 Па. Выше критической температуры ни при каком давлении не происходит разделения на жидкую и газообразную фазы. [3]
Критическая кривая Д л / Св, соединяющая критическую точку воды К л с критической точкой соли / С в ( в ряде случаев гипотетической, так как соль разлагается, еще не достигнув критического состояния), лежит в области ненасыщенных растворов и с кривой растворимости ( кривой трехфазного равновесия) не пересекается. [4]
Максимум значении при содержании кремнезема и глинозема находится в области критической точки воды. [5]
В некоторых случаях ( например, Na2SO4) растворимость с приближением к критической точке воды ( 374, 2) падает до нулевого значения; иногда зависимость усложняется, потому что в качестве второй фазы наряду с раствором появляется еще расплав, содержащий пары воды. [7]
Кривые растворимости солей ( рис. 64) при повышении температуры резко меняют ход и направляются к критической точке воды ( 374 2 С), что свидетельствует об очень быстром уменьшении растворимости. При достаточном приближении к критической температуре воды растворимость названных выше солей должна стать настолько незначительной, что наступление критических явлений следует ожидать уже при параметрах, практически совпадающих с критическими параметрами чистой воды. [9]
Эта точка плавления от прибавления хлористого натрия понижается до так называемой криогидратной точки, от которой кривая растворимости правильно поднимается до критической точки воды. У солей же, точка плавления которых лежит ниже критической температуры воды, например у нитрата серебра, кривая растворимости поднимается до точки плавления чистой соли. Между точкой плавления льда и криогидратной точкой находится в равновесии с насыщенным раствором лед. В криогидратной точке лед и поваренная соль находятся друг подле друга в равновесии с насыщенным раствором; выше этой точки в равновесии с насыщенным раствором находится поваренная соль. При всех температурах выше кривой растворимости раствор поваренный соли ненасыщен. Ниже кривой растворимости никакой раствор не обладает постоянством. Если удается приготовить подобные растворы, то может произойти самопроизвольное нарушение пересыщенного состояния, причем из таких растворов выкристаллизовывается либо лед, либо поваренная соль. [11]
Снижение растворимости соли с ростом температуры приводит к тому, что максимум давления пара насыщенных растворов в системах данного типа отсутствует: повышение температуры вызывает только увеличение давления пара, так как при этом концентрация соли в растворе уменьшается. При температуре, достаточно близкой к критической точке воды, растворимость соли столь незначительна, что состав и свойства жидкой и паровой фаз сближаются и становятся идентичными при температуре, практически совпадающей с критической температурой воды. До температуры кипения раствора зависимость давления водяного пара от температуры выражается плавно повышающейся кривой, как и для солей первого типа. [13]
Высококонцентрированные жидкие растворы NaCl существуют при температурах, на сотни градусов превышающих критическую температуру воды; в системе NaCl - l - hO имеется критическая линия ( см. рис. 5), указывающая температуры, давления и концентрации, при которых паровые и жидкие фазы становятся идентичными. В системах же Na2SO4 - ЬЬО и CaSCu - HaO по результатам авторов [19] критическая линия стягивается в точку, практически совмещенную с критической точкой воды. [14]
Фазы перехода информации в энергию, движение, массу или наоборот ( как вьысняется) на первый взгляд зафиксировать невооруженным глазом и без достаточной научной проработки невозможно. Генерализационная роль информации во всех без исключения процессах Вселенной проявляется в одновременном существовании различных фаз материи в состоянии равновесия, как это имеет место при двойной и тройной критических точках воды, сублимационных процессах двуокиси углерода и др. Проявления информационных форм обеспечивают не только состояния материи в двойной или тройной критических точках. Твердое, жидкое, газообразное, плазменное и безвоздушное одновременные проявления также являются результатом как бы четверной точки информационного ( состояния) равновесия Вселенной, которое обеспечивается на основе информационной ( тонкой) автонастройки таких мировых констант, как величина элементарного заряда, скорость света, постоянная Планка, гравитационная постоянная и др. В этом и заключается суть закона информационного равновесия ( ЗИР) Вселенной, который можно сформулировать следующим образом. [15]
Страницы: 1 2
www.ngpedia.ru
Критическая точка
Как следует из фазовой P–Vдиаграммы (рис.3.3) по мере роста давления различие между удельными объемами кипящей жидкости (V') и сухого насыщенного пара (V'') постепенно уменьшается и в точке К становится равным нулю. Такое состояние называется критическим, а точка К – критической точкой вещества.
Pк,Tк, Vк ,Sк – критические термодинамические параметры вещества.
Например, для воды:
Pк = 22,129 МПа;
Tк = 374, 140С;
Vк= 0, 00326 м3/кг
В критической точке свойства жидкой и газообразной фаз одинаковы.
Как следует из фазовой Т – Sдиаграммы (рис 3.4) в критической точке теплота парообразования, изображаемая как площадь под горизонтальной линией фазового перехода (С' - С''), от кипящей жидкости к сухому насыщенному пару , равна нулю.
Точка К для изотермы Тк в фазовойP–Vдиаграмме (рис.3.3) является точкой перегиба.
Изотерма Тк , проходящая через точку К, являетсяпредельной изотермой двухфазной области, т.е. отделяет область жидкой фазы от области газообразной.
При температуре выше Тк изотермы уже не имеют ни прямолинейных участков, свидетельствующих о фазовых переходах, ни точки перегиба, характерной для изотермы Тк , а постепенно принимают вид плавных кривых, близких по форме к изотермам идеального газа.
Понятия «жидкость» и «газ» (пар) в известной степени условны, т.к. взаимодействия молекул в жидкости и газе имеют общие закономерности, отличаясь лишь количественно. Этот тезис можно проиллюстрировать рисунком3.6, где переход из точки Е газообразной фазы в точку L жидкой фазы произведен в обход критической точки К по траектории EFL.
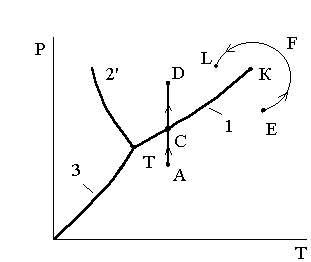
Рис.3.6. Два варианта фазового перехода
из газообразной в жидкую фазу
При переходе по линии ADв точке С происходит разделение вещества на две фазы и затем вещество постепенно переходит из газообразной (парообразной) фазы в жидкую.
В точке С свойства вещества изменяются скачком (в фазовой P–Vдиаграмме точка С фазового перехода превращается в линию фазового перехода (С' - С'')).
При переходе по линии EFLпревращение газа в жидкость происходит непрерывно, так как линияEFLнигде не пересекает кривую парообразования ТК, где вещество одновременно существует в виде двух фаз: жидкой и газообразной. Следовательно, при переходе по линииEFLвещество не будет распадаться на две фазы и останется однофазным.
Критическая температура Тк– это предельная температура равновесного сосуществования двух фаз.
Применительно к термодинамическим процессам в сложных системах это классическое лаконичное определение Ткможет быть развернуто следующим образом:
Критическая температура Тк - это нижняя температурная граница области термодинамических процессов, в которых невозможно появление двухфазного состояния вещества «газ - жидкость» ни при каких изменениях давления и температуры. Это определение иллюстрируются рис.3.7 и 3.8. Из этих рисунков следует, что эта область ограниченная критической температурой, охватывает только газообразное состояние вещества (газовую фазу). Газообразное состояние вещества, именуемое паром в эту область не входит.
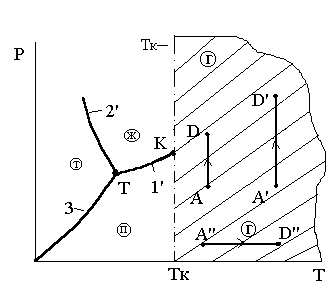
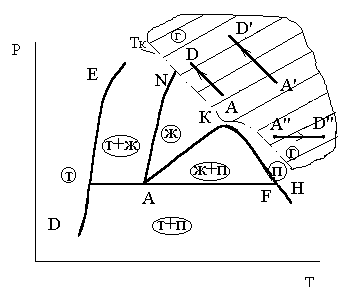
Рис. 3.7. К определению критической Рис.3.8.К определению критиче-
температуры ской температуры
Из этих рисунков следует, что эта заштрихованная область, ограниченная критической температурой, охватывает только газообразное состояние вещества (газовую фазу). Газообразное состояние вещества, именуемое паром в эту область не входит.
Используя понятие критической точки, можно из общего понятия «газообразное состояние вещества» выделить понятие «пар».
Пар– это газообразная фаза вещества в области температур ниже критической.
В термодинамических процессах, когда линия процесса пересекает или кривую парообразования ТК, или кривую сублимации 3, газообразная фаза всегда сначала является паром.
Критическое давление Рк – это давление, выше которого разделение вещества на две одновременно и равновесно сосуществующие фазы: жидкость и газ невозможно при любой температуре.
Это классическое определение Рк, применительно к термодинамическим процессам в сложных системах можно сформулировать более подробно:
Критическое давление Рк – это нижняя по давлению граница области термодинамических процессов, в которых невозможно появление двухфазного состояния вещества «газ - жидкость» ни при каких изменениях давления и температуры. Это определение критического давления иллюстрируется рис.3.9. и 3.10. Из этих рисунков следует, что эта область, ограниченная критическим давлением, охватывает не только часть газообразной фазы, расположенную выше изобары Рк, но и часть жидкой фазы, расположенную ниже изотермы Тк.
Для сверхкритической области за вероятную (условную) границу «жидкость-газ» условно принимают критическую изотерму.
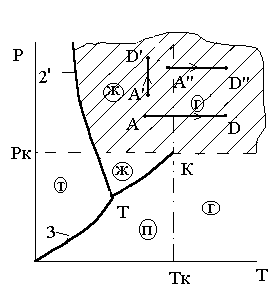
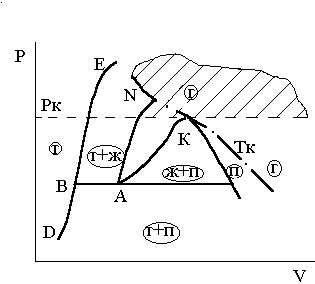
Рис.3.9.К определению критичес - Рис.3.10. К определению критического
кого давления давления
Если давление перехода много больше давления в критической точке, то вещество из твердого (кристаллического) состояния будет переходить прямо в газообразное состояние, минуя жидкое состояние.
Из фазовых Р-Т диаграмм аномального вещества (рис 3.6, 3.7, 3.9) это не очевидно, т.к. на них не показана та часть диаграммы, где вещество, имеющее при больших давлениях несколько кристаллических модификаций (и, соответственно, несколько тройных точек), снова приобретает нормальные свойства.
На фазовой Р – Т диаграмме нормального вещества рис. 3.11 этот переход из твердой фазы сразу в газообразную показан в виде процесса А'D'.
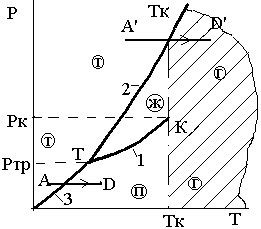
Рис. 3.11. Переход нормального
вещества из твердой фазы сразу в
газообразную при Р>Ртр
Переход вещества из твердой фазы в паровую, минуя жидкую, возложен лишь при Р<Ртр. Примером такого перехода, называемого сублимацией, является процесс АDна рис 3.11.
Критическая температура имеет весьма простое молекулярно – кинетическое истолкование.
Объединение свободно движущихся молекул в каплю жидкости при сжижении газа происходит исключительно под действием сил взаимного притяжения. При Т>Тккинетическая энергия относительного движения двух молекул больше энергии притяжения этих молекул, поэтому образование капель жидкости (т.е. сосуществование двух фаз) невозможно.
Критические точки имеют только кривые парообразования, так как они соответствуют равновесному сосуществованию двух изотропных фаз: жидкой и газообразной. Линии плавления и сублимации не имеют критических точек, т.к. они соответствуют таким двухфазным состояниям вещества, когда одна из фаз (твердая) являетсяанизотропной.

studfiles.net
Критическая температура - вода - Большая Энциклопедия Нефти и Газа, статья, страница 4
Критическая температура - вода
Cтраница 4
При температурах же ниже критической температуры воды жидкие растворы могут существовать в широком интервале изменений давления, в то время как в отсутствие хлоридов жидкие растворы сульфатов щелочных металлов при температурах, лишь слегка превышающих критическую температуру воды, вовсе не существуют ( имеют место флюидные растворы), а при температурах ниже критической температуры воды, хотя эти растворы и существуют, но только в очень узком интервале изменений давления пара. [47]
Необходимо иметь в виду, что объемная диаграмма состояния трехкомпонентной системы соль - соль - вода во многих случаях не может быть доведена до температур плавления всех трех компонентов, поскольку температура плавления солей часто превышает критическую температуру воды и, кроме того, многие соли при нагревании разлагаются раньше, чем достигается температура их плавления. [49]
Поскольку Т достаточно мало меняется с изменением давления ( для воды - от 580 К при р 0 1 МПа до 647 28 К при критическом давлении), в [45] рекомендуется считать температуру гомогенной нуклеации в соотношении (2.222) равной термодинамической критической температуре воды. [50]
Как было показано в главе V, в качестве растворителей могут быть использованы не только водные растворы хорошо растворимых при высоких температурах электролитов, но и растворы тех солей, которые в присутствии паровой фазы при температурах, близких к критической температуре воды, имеют ничтожную растворимость. [51]
Первые обширные и систематические исследования критических параметров Гк, рк, VK ряда веществ были проведены русским физиком М. П. Авенариусом и его учениками А. И. Надеждиным, В. И. Зайончевским и другими в физической лаборатории Киевского университета в 1873 - 1895 гг. А. И. Надеждин впервые в 1885 г. определил критическую температуру воды: 71 374 С. [52]
Как уже отмечалось в главе I, температурный коэффициент растворимости ( ТКР) солей, образующих системы 2-го типа, во всем температурном интервале или начиная с некоторых температур отрицателен, вследствие чего концентрация насыщенных растворов таких солей при температурах, приближающихся к критической температуре воды, становится очень незначительной. Давление пара насыщенных растворов таких солей, в особенности при высоких температурах, близко к давлению пара чистой воды; соответствующие кривые, в отличие от солей 1-го типа, максимума не имеют и заканчиваются в критической точке, параметры которой, вследствие малой растворимости соли, должны быть близки к критическим параметрам чистой воды. [53]
Результаты исследования растворимости и давления пара в насыщенных растворах галогенидов калия и натрия имели большое значение, так как экспериментально доказали, во-первых, наличие максимума давления пара насыщенных растворов не только в системах из легкоплавких, но и в системах из относительно тугоплав-ских солей и, во-вторых, отсутствие критических явлений в насыщенных растворах во всем температурном интервале их существования даже при температурах, на сотни градусов превышающих критическую температуру воды. [54]
Если мощность осадочной толщи очень велика ( 10 км и более), нижняя граница зоны насыщения пород капельно-жидкими водами может определяться температурными ( геотермическими) условиями. Критическая температура воды равна 364 С, но при больших давлениях она повышается. При геотермической ступени 30 м, нередкой в нефтегазоносных районах, на глубине 10 км температура должна быть близкой к критической. На достигнутых бурением глубинах ( около 7 км) в песчаных породах наблюдается перегретая жидкая вода. [55]
Кривые растворимости солей ( рис. 64) при повышении температуры резко меняют ход и направляются к критической точке воды ( 374 2 С), что свидетельствует об очень быстром уменьшении растворимости. При достаточном приближении к критической температуре воды растворимость названных выше солей должна стать настолько незначительной, что наступление критических явлений следует ожидать уже при параметрах, практически совпадающих с критическими параметрами чистой воды. [57]
Как только температура достигала Tk, двухфазная система ( жидкость - пар) превращалась в однородную систему ( газ) и трубка устанавливалась горизонтально. Таким путем была впервые определена критическая температура воды. [58]
Как только температура достигала Tk, двухфазная система ( жидкость - пар) превращалась в однородную систему ( газ) и трубка устанавливалась горизонтально. Таким путем была впервые определена критическая температура воды. [59]
Как только температура достигала Tk, двухфазная система ( жидкость - пар) превращалась в однородную систему ( газ) и трубка устанавливалась горизонтально. Таким путем была впервые определена критическая температура воды. [60]
Страницы: 1 2 3 4
www.ngpedia.ru
Критическая температура - вода - Большая Энциклопедия Нефти и Газа, статья, страница 2
Критическая температура - вода
Cтраница 2
Если мирабилит или раствор сульфата натрия нагреть в автоклаве почти до критической температуры воды, то практически весь сульфат окажется в твердой фазе. Так как растворимость примесей с ростом температуры увеличивается и они остаются в жидкой фазе, то сульфат получается более чистым, чем при других методах обезвоживания мирабилита. Этот метод, весьма экономичный в тепловом отношении, пока не нашел практического применения из-за трудности аппаратурного оформления. [16]
Если мирабилит или раствор сульфата натрия нагреть в автоклаве почти до критической температуры воды, то практически весь сульфат окажется в твердой фазе. Так как растворимость примесей с ростом температуры увеличивается, то сульфат получается более чистым, чем при других методах обезвоживания мирабилита. Этот метод, весьма экономичный в тепловом отношении, пока не нашел практического применения из-за трудности аппаратурного оформления. [17]
Если мирабилит или раствор сульфата натрия нагреть в автоклаве почти до критической температуры воды, то практически весь сульфат окажется в твердой фазе. Так как растворимость примесей с ростом температуры увеличивается и они остаются в жидкой фазе, то сульфат получается более чистым, чем при других методах обезвоживания мирабилита. Этот метод, весьма экономичный в тепловом отношении, пока не нашел практического применения из-за трудности аппаратурного оформления. [18]
Верхняя температура такого цикла 7 ( рис. 8.7 6) определяется критической температурой воды ( 374 14 С) и, очевидно, может быть принята не выше 350 С, при этом давление р составляет 16 5 МПа. Нижняя температура ТУ цикла Карно определяется температурой окружающей среды, которая принимается равной 25 С, что соответствует р20 003 МПа. Как видно, перепад давлений довольно большой. [19]
Высококонцентрированные жидкие растворы NaCl существуют при температурах, на сотни градусов превышающих критическую температуру воды; в системе NaCl - l - hO имеется критическая линия ( см. рис. 5), указывающая температуры, давления и концентрации, при которых паровые и жидкие фазы становятся идентичными. В системах же Na2SO4 - ЬЬО и CaSCu - HaO по результатам авторов [19] критическая линия стягивается в точку, практически совмещенную с критической точкой воды. [20]
По геотермическим условиям на глубине 12 км температура должна быть близкой к критической температуре воды ( 364) и, следовательно, теоретически, вода в жидком состоянии может существовать до глубины 10 - 12 км и даже более, так как при больших давлениях критическая температура значительно поднимается и вода может находиться в перегретом состоянии. В действительности, однако, глубина распространения скоплений ка-пельно-жидкой воды значительно меньше. [21]
За последнее время получены также некоторые данные о поведении при температурах, превышающих критическую температуру воды, тех солей, растворимость которых при высоких температурах незначительна. [22]
Поттер и Клинн [33] недавно выполнили тщательные измерения растворимости благородных газов в воде вплоть до критической температуры воды. Для всех газов температурная зависимость растворимости экстремальная. Гелий ведет себя особо: он выпадает из в целом очень хорошей корреляции растворимости с ковалентным радиусом атома. При низких температурах ( 290 К) он менее растворим из всех газов, но с ростом температуры растворимость Не быстро увеличивается: выше 330 К он уже более растворим чем Ne, а при 520 К - более, чем Аг и Кг. [23]
Огромное увеличение растворимости во флюидной фазе с увеличением давления при температурах, близких и превышающих критическую температуру воды от небольших долей процента до десятков процентов с образованием высококонцентрированных растворов, было обнаружено нами и в других изученных системах. [25]
Изучение гидротермальных процессов заключается в исследовании определенных водных систем при высоких температурах, приближающихся к критической температуре воды или превышающих ее. Таким образом, эти процессы идут при значительных давлениях, развиваемых при этих температурах чистой водой и водными растворами. [26]
Фактически температура в системе не может быть поднята до температуры плавления чистой соли, так как критическая температура воды ниже. Кроме того, при столь высоких температурах сол-и разлагаются. [27]
Давление пара насыщенных растворов в системах 2-го типа, в особенности при температурах, приближающихся к критической температуре воды, очень близко к давлению пара чистой воды. [29]
При мокром сжигании отработанных сульфатных щелоков органическое вещество окисляется кислородом воздуха при температурах, лежащих между 225 и критической температурой воды ( 374 С), и при давлениях 50 - 150 ати с использованием образующегося тепла. [30]
Страницы: 1 2 3 4
www.ngpedia.ru
Критическая температура - вода - Большая Энциклопедия Нефти и Газа, статья, страница 3
Критическая температура - вода
Cтраница 3
Область равновесий жидкость-газ стягивается в точку при критической температуре воды, вторая область существует и при температурах, превосходящих критическую температуру воды. Критические точки второй области равновесий характеризуются резким увеличением давления при возрастании температуры. [32]
На рис. 5 видно, что растворимость Li2CO3 в воде с повышением температуры непрерывно уменьшается, при приближении к критической температуре воды выражается лишь сотыми долями процента. [34]
Все изученные соли, дающие системы 1-го типа, при высоких температурах и, в частности, при температурах, близких к критической температуре воды, образуют столь концентрированные насыщенные растворы, что критические явления в этих растворах отсутствуют во всем интервале их существования. [36]
Относительно невысокие pq ( около ЮООкГ / сж2) и значительные CQ ( 30 - 40 %) доказывают возможность получения при температурах, превышающих критическую температуру воды, и при не столь уж высоких давлениях высококонцентрированных флюидных и жидких растворов солей, растворимость которых при тех же температурах, но при более низких давлениях очень незначительна. [38]
Характерной особенностью этого вида солей является то, что при достаточно высоких температурах им свойствен уже отрицательный температурный коэффициент растворимости, и при приближении к критической температуре воды растворимость этих солей становится совсем незначительной. [39]
Это можно осуществить разными путями, а частности следующими четырьмя приемами: 1) нагреть водяной пар, оставляя давление неизменным, до температуры, превышающей критическую температуру воды; 2) затем сжать перегретый водяной пар давлением, превышающим критическое давление; 3) вновь охладить перегретый и сжатый водяной пар до температуры Т, сохраняя давление неизменным; 4) наконец, снизить давление до заданного значения 1 ат. [40]
Приводимые в литературе диаграммы растворимости таких хорошо известных солей, как сульфаты натрия, калия, карбоната натрия, обычно заканчиваются при температуре, близкой к критической температуре воды, так как растворимость этих солей вблизи 374 С при давлениях, равных давлению пара растворов, чрезвычайно мала. Но результаты изучения фазовых равновесий в системах Na2SO4 - h3O, K2SO4 - h3O, Li2SO4 - h3O, Na2CO3 - Н2О, KLiSO4 - h3O доказывают существование при высоких температурах и давлениях весьма концентрированных растворов исследованных солей. В соответствии с этим диаграммы растворимости сульфатов натрия, калия, лития и карбоната натрия должны быть дополнены фазовыми равновесиями в околокритической и надкритической областях. Именно в этих областях исключительный интерес представляет вопрос о влиянии на растворимость солей такого важного фактора равновесия, как давление. [41]
Авенариусом и рядом его учеников, особенно Надеждиным Зайончевским и др., были определены критические параметры многих жидкостей, в том числе Надеждиным и Страусом была определена различными методами критическая температура воды. [42]
Ингерсон [3] указывал, что такого поведения нужно было ожидать для включения, состоящего при комнатной температуре из воды и пара в определенном отношении ( около 3: 7) и затем нагретого до критической температуры воды. В рассматриваемых включениях система является не такой простой, но принцип, повидимому, сохраняется. [43]
Но уже при приближении к критической температуре воды на изотермах появляется выпуклость к оси давлений, которая по мере повышения температуры становится все более и более явственной и при температурах, достаточно близких к критической температуре воды ( например, 348 и 373 С Li2SO4 - h3O, 372 С K2SO4 - h3O, 370 С KLiSO4 - Н2О, 350 С Na4SO4 - Н2О), становится очень четко выраженной. [44]
По данным Тренева и Григорович [24], жидкие водные растворы сульфатов натрия и калия и трехзамещенного фосфата натрия существуют при давлении водяного пара 300 am и при температурах ( 380 и 400), превышающих критическую температуру воды. [45]
Страницы: 1 2 3 4
www.ngpedia.ru
|
Химически чистой воды в природе не существует. В зависимости от местности и глубины залегания, а также с учетом особенностей техногенного загрязнения почвы, в грунтовых водах может содержаться до 50 различных элементов в виде разных соединений - растворы, взвеси т.д. Тем не менее, для многих расчетов и оценки качества грунтовых вод используются физические характеристики чистой воды. Итак, чистая вода - это жидкость, не имеющая ни цвета, ни запаха, ни вкуса. Состоит эта жидкость из кислорода (88,89%) и водорода (11,11%) и имеет следующие физические параметры:
Из паспорта скважины всегда можно получить следующие данные: статический и динамический уровень, структура грунта на всей глубине бурения, диаметр и материалы труб, а также дебит. Документ на скважину выдается бурильщиками.
Часто покупка скважинного адаптера считается оптимальным вариантом, но во внутренних помещениях коттеджа придется выделить пространство для водонапорного оборудования, фильтров грубой очистки, а также автоматики насоса. Скважинный адаптер считается экономичной альтернативой железному кессону или каменному приямку.
Кессон абсолютно герметичен, что гарантированно избавит от проникновения сточных вод к верхней части скважины. Обустройство каменного приямка рационально не во всех случаях, но приямок в большинстве случаев стоит бюджетнее покупки готового кессона.
При сравнительно малой глубине водоносного слоя рациональнее купить пластиковую обсадную трубу – в равных условиях этот выбор наиболее экологичен, удобен и к тому же будет стоить дешевле железной. Преимущество металлических труб – прочность.
Даже в случае, если бурение в одну колонну можно осуществить, при наличии плывунов и/или вышестоящих водоносных горизонтов применение такой технологии обычно для застройщика не имеет особого смысла. Не редко бывают ситуации, при которых бурение в одну колонну нежелательно, хоть и обходится дешевле.
В случае, когда производительность скважины уменьшается – приготовьтесь к бурению новой скважины. Прочистка скважины - удовольствие недешевое. |
||

 Паспорт скважины - это обязательно!
Паспорт скважины - это обязательно! В каких случаях лучше покупать скважинный адаптер?
В каких случаях лучше покупать скважинный адаптер? Каким образом обустроить верх скважины?
Каким образом обустроить верх скважины? ПВХ или железо: как правильно выбрать скважинные трубы
ПВХ или железо: как правильно выбрать скважинные трубы Во сколько колонн?
Во сколько колонн? Как ремонтируют скважины?
Как ремонтируют скважины?

















