Ионное произведение воды. Водородный показатель. Концентрация воды
Концентрация воды в воде - Справочник химика 21
На рис. 91,6 изображены кривые, выражающие зависимость между концентрациями воды в жидкости и в паре при различных концентрациях уксусной кислоты. На этом рисунке нижняя кривая выражает условия фазового равновесия в бинарной системе вода—этилацетат. Другой граничной кривой является кривая равновесия бинарной системы вода—уксусная кислота. Расчет производится следующим образом. [c.236] Концентрация органических кислот и сложных эфиров редко превышает пределы 40—200 и 50—100 мкг/л. Содержание углеводов несколько выше и нередко достигает единиц миллиграммов в 1 л. Значительную часть органического вещества природных вод составляют гумусовые вещества гуминовые кислоты и фульвокислоты. Особенно богаты гуминовыми веществами воды северных районов страны, где концентрация их часто составляет единицы и десятки миллиграммов на 1 л. В морских и океанических водах среднее содержание гумусовых веществ ниже и редко превышает 3 мг/л. [c.136]Исследование газопроницаемости пленок полимеров, находящихся в равновесии с сорбированными парами, показало, что при сорбции паров СеНи и U полиэтиленом низкой плотности наблюдается значительное повышение проницаемости полиэтиленовых пленок по отношению к азоту и кислороду . При этом значение коэффициентов газопроницаемости Р полиэтилена линейно возрастает с увеличением весовой концентрации сорбированного гексана, а значение энергии активации Ер остается приблизительно постоянным. Изменение значений Р обусловлено ростом коэффициента диффузии D, в то время как коэффициент растворимости газов а при сорбции пленкой органических растворителей существенно не изменяется. В системе гидрат целлюлозы — вода значение Р для О2 и N2 и в особенности для СО2 быстро возрастает с увеличением относительного давления паров воды. График зависимости Р для Oj от весовой концентрации воды в гидрате целлюлозы имеет два линейных отрезка, пересекающиеся в точке, отвечающей относительной влажности, равной 74%. На значения Р полиэтилена для О2, N2, СО2 относительная влажность газов не влияет. Предполагается, что сорбция паров воды не влияет на содержание кристаллической части и набухание происходит только в аморфных областях полимеров. Газопроницаемость смеси газов часто зависит от высокой растворимости одного из входящих в смесь газов. Так, исследование полиэтилена по отношению к смеси этана с бутаном показало что проницаемость смеси увеличивается с ростом концентрации бутана по сравнению с расчетной (по исходным коэффициентам Р) [c.172]
Интенсивность поглощения в области 6200—6000 см определяется не только концентрацией НС1, но и концентрацией воды в растворе, причем при одной и той же концентрации НС1 поглощение увеличивается при возрастании общего содержания воды в растворе, что, по-видимому, можно объяснить увеличением степени электролитической диссоциации НС1 в растворе и более полной гидратацией протона. С увеличением содержания НС1 происходит изменение и других полос поглощения (рис. 71) интенсивность полосы поглощения молекул в ассоциациях вода — растворитель заметно уменьшается, полоса поглощения молекул в ассоциациях вода —вода при малых концентрациях H I остается практически неизменной уменьшение ее интенсивности можно заметить лишь при концентрации НС1 выше 3—4 N. Это свидетельствует о том, что гидратация протона происходит за счет разрушения ассоциатов вода — растворитель. Образовавшийся ион гидроксония сольватируется молекулами растворителя, что приводит также к некоторому смещению полосы С = 0-группы. [c.162]
Изменение температуры раствора приводит к перераспределению молекул воды в ассоциациях вода — вода и вода — растворитель. При малом общем содержании воды (до 0,5%), когда концентрация жидкой воды пренебрежимо мала, перераспределение идет между ассоциациями с симметрично и асимметрично нагруженными молекулами воды. При этом в спектрах поглощения при повышении температуры растет интенсивность полос воды в асимметричных ассоциациях RB...HOH...RB и уменьшается в симметричных RB...HOH...BR. При концентрации воды свыше 1,5—2%, когда полоса жидкой воды четко фиксируется в спектрах (6920 сж" ), при повышении температуры растет интенсивность полос поглощения молекул воды в ассоциациях вода — растворитель, а в ассоциациях вода — вода уменьшается (рис. 2). При очень больших концентрациях воды (свыше 30—40%) характер изменения полос поглощения противоположен. Этот температурный эффект можно объяснить, если учесть, что при очень малом содержании воды ассоциации типа вода — растворитель образуются чаще, чем вода —-вода, хотя энергия связи между молекулами воды много больше, чем между молекулами воды и растворителя. При повышении температуры играет все большую роль вероятностный фактор, при понижении температуры — энергетический. Рассмотренные выше температурные эффекты необходимо [c.188]
Так, например, газохроматографический анализ смесей органических соединений с водой представляет серьезные трудности, вследствие несимметричности пика воды, близких времен удерживания воды и органических кислородсодержащих соединений, что особенно резко проявляется при определении малых концентраций воды в органических соединениях. Для преодоления этих трудностей в работах [11, 12] были разработаны специальные методы определения следов воды в органических растворителях и анализа водных растворов. Методика анализа основана на количественном превращении паров воды в ацетилен в результате реакции с карбидом кальция. Образующийся ацетилен в виде узкого пика быстро элюируется впереди анализируемых компонентов. Метод применим для анализа смесей воды и углеводородов, альдегидов, кетонов, эфиров, спиртов. [c.11]
Режим хлорирования в отношении длительности подачи хлора и периодичности его дозирования определяется также опытным путем на основе специальных наблюдений за интенсивностью биологических обрастаний в данных конкретных условиях. Из практики известны случаи, когда конденсаторы турбин загрязнялись очень быстро и воду приходилось хлорировать каждые 1,5—2 ч при длительности подачи реагента до 30 мин. При медленном загрязнении конденсаторов бывает достаточным хлорировать воду 1—2 раза в сутки в течение 1—2 ч. Погибающие при хлорировании колонии бактерий и водорослей теряют прочность связи с поверхностью металла, легко смываются с нее и выносятся из конденсатора потоком воды. Когда подача хлора прекращается, на очищенной поверхности металла снова начинают поселяться живые организмы. На одной и той же установке режим хлорирования меняется по временам года в соответствии с сезонными изменениями качества воды источника водоснабжения. В связи с непостоянством метеорологических условий в режимы хлорирования требуется ежегодно вносить уточнения. Замечено, что во время паводков биологические обрастания уменьшаются. Считают, что это связано с резким увеличением в воде концентраций грубодисперсных примесей, т. е. ила, песка и т. п., которые, перемещаясь по трубкам конденсатора с большими скоростями, механически очищают поверхность от возникающих обрастаний. [c.245]
При постоянной концентрации высаливающих агентов состав которых входят одноименные анионы коэффициенты распределения при извлечении кетонами, диметил-пиридином и ТБФ меняются симбатно изменению таких параметров, как электроотрицательность металла в водном растворе X,- [18], изменение потенциального барьера выхода воды из первой гидратной оболочки иона АЕ [9], изменение энтропии воды на разделе первой и второй гидратной оболочек —Д5п [19, 20] и отношение времен релаксации молекулы в поле иона и в поле структуры воды Тг /т [21, 22] (рис. 3—6). Такое совпадение изменения значений коэффициентов распределения и параметров, характеризующих гидратацию катионов, трудно объяснить какими-либо другими причинами, кроме как влиянием катионов на состояние воды в равновесных водных фазах. [c.124]
С целью определения эффективности разделения водно-топливных эмульсий от воздействия только электростатического поля целесообразно проводить предварительное отстаивание их в поле сил тяжести. Установлено, что процесс разделения смесей водно-топливных эмульсий с топливами (Т-1, ТС-1, Т-2) при отстаивании начинается практически сразу после выключения механической мешалки. Процесс разделения идет тем интенсивнее, чем больше концентрация воды в исходной эмульсии. В эмульсиях с более вязкими топливами процесс разделения идет менее интенсивно. Так, водно-топливная эмульсия (сх-1 = 15 %) после 30 с отстаивания содержала всего 3,7 % воды, остальная вода коагулировала из коллоидного раствора. Наиболее интенсивно процесс седиментации под действием сил тяжести идет в начальный период времени. [c.20]
Метод определения фазовой стабильности. Испытание проводится в два этапа. На первом этапе по ГОСТ 14870—77 Реактивы. Методы определения содержания воды , п. 2.3.3.2 Электрометрическое титрование проводят определение концентрации воды в испытуемом бензине. На втором этапе испытания, если будет установлено, что концентрация воды в испытуемом бензине летнего вида 0,05% мае. и более или в бензине зимнего вида 0,15% мае. и более, проводят определение температуры помутнения по ГОСТ 5066—56 (методом без обезвоживания). При меньшем количестве растворенной воды отбирают пробу испытуемого бензина в количестве 30 см и помещают в коническую колбу вместимостью 50 см . С помощью медицинского шприца на 1 см вводят воду до концентрации 0,05% в летний бензин и до концентрации 0,15%— в зимний бензин. Пробу тщательно перемешивают для растворения введенной воды в бензине. Затем определяют температуру помутнения испытуемого бензина по ГОСТ 5066—56. [c.414]
Эффект автоускорения наблюдается при щелочном алкоголизе и гидролизе ПВА в спиртах и смесях спиртов и ацетона с водой. В то же время в водно-щелочной среде образуется сополимер ВС и ВА с неупорядоченной структурой. По мнению Саку-рада, отсутствие автокаталитического эффекта в водной среде вызвано трудностью адсорбции полимером щелочи из воды, по сравнению с адсорбцией из водно-ацетонового раствора. Авторы работ [77, 78] также считают, что снижение скорости щелочного гидролиза ПВА с повышением концентрации воды согласуется с сорбционной теорией автокатализа, так как вода сольватирует ион ОН и тем самым ухудшает его взаимодействие с гидроксильной группой звена ВС. [c.77]
Эмульсия определяется как дисперсная система, состоящая из двух нерастворимых жидкостей. Примером является водонефтяная эмульсия, которая представляет собой грубодисперсную систему с размером капель дисперсной фазы от 0,1 мкм и выше. Водонефтяные эмульсии бывают двух видов. Если объемная концентрация воды мала по сравнению с объемной концентрацией нефти, то сплошной фазой является нефть, а вода в виде взвешенных в нефти капель представляет собой дисперсную фазу. Такого вида эмульсии называются обратными или эмульсиями типа вода в масле (в/м). Если объемная концентрация нефти мала по сравнению с объемной концентрацией воды, то такая эмульсия называется прямой или масло в воде (м/в). При этом вода служит сплошной, а нефть — дисперсной фазой. [c.243]
В безводных апротонных растворителях титан также не пассивируется. Например, в растворах НС1 в ДМФ титановый анод при концентрациях воды менее 0,3 % находится в активном состоянии, при концентрации более 0,6 % — в пассивном. В интервале 0,6 % >СнгО>0,3 % на титане наблюдается питтинги. В отсутствие тока с ростом содержания воды размеры питтингов и их число уменьшаются [1164]. [c.116]
Известно, что нет такого производства, которое бы не использовало воду. Вода расходуется каждым населенным пунктом, промышленностью и сельским хозяйством в огромных количествах. Примерно % ее превращается в стоки. Стоки исчисляются миллиардами кубометров в год, попадают в водоемы, загрязняют и заражают их ядовитыми и токсическими соединениями. Часто загрязненная ими вода делается непригодной ни для питьевых, ни для хозяйственно-бытовых целей. Позтому возникает тревога о воде, появляется тревожное слово водный голод , ибо уже нет тех избытков чистой воды, которой в прежние времена разбавляли эти стоки до безвредных для жизни концентраций. [c.20]
ИЛИ за счет снижения скоростей побочных реакций. Эксперименты показали [94], что введение паров воды не только несколько снижает содержание примесей, но в определенных условиях значительно увеличивает активность катализатора. Установлено, что производительность катализатора меняется в зависимости от содержания паров воды в газах синтеза. В интервале исследованных температур и при давлении 32 МПа максимальное повышение производительности (на 25—45%) наблюдается при парциальном давлении паров воды, равном 0,07—0,17 МПа. При повышении температуры оптимальное содержание паров воды увеличивается (рис. 3.7 парциальное давление СО 3,8 МПа, объемная скорость газа 40-10 ч ). По достижении определенной концентрации паров воды дальнейшее повышение ее тормозит образование метанола вплоть до содержания, характерного для аналогичных условий синтеза при работе на сухом газе. Следует отметить, что чем ниже температура процесса, тем уже интервал концентраций паров воды, при котором наблюдается повышение производительности. При увеличении парциального давления оксида углерода эффект влияния паров воды остается [c.78]
Таким образом, кислота или основание с рК, например, около 8 в разбавленных водных растворах, не содержащих других кислот или оснований, диссоциирует максимум на 9%. Удовлетворительное приближение к максимальной степени диссоциации наблюдается при концентрациях около 10 моль л, дальнейшее разбавление раствора (при рК 8) не способно заметно увеличить степень диссоциации. Это объясняется тем, что в очень разбавленных растворах диссоциация слабой кислоты (основания) подавляется водородными (гидроксильными) ионами воды. По отношению к разбавленным растворам слабых кислот (оснований) вода способна проявлять свои кислотные (или основные) свойства. Чем меньше концентрация слабого электролита в растворе и чем меньше его константа диссоциации, тем сильнее влияние воды на степень диссоциации. Степень диссоциации в очень разбавленных растворах можно изменить только путём изменения pH или температуры. [c.26]
Очистка растворителя. Коммерческий ацетон имеет достаточно высокую чистоту, однако дальнейшее повышение чистоты, особенно в отношении содержания воды, весьма затруднительно. Предложено несколько методов очистки. Коци и Сиао [2] сушили ацетон над безводным aS04 (25-50 г/л) в течение 2 нед и затем перегоняли со свежей порцией aS04 (10 г/л). При этом концентрация воды в конечном продукте была равна 15-25 мМ. Воду удаляли также перегонкой с Р2О5 [4]. В этом случае остаточная концентрация воды составляла 0,001%. Однако такая очистка вызывала полимеризацию. Для удаления воды растворитель перколировали через молекулярные сита типа 5А [3. [c.48]
При более высоком содержании воды в бензоле ее молекулярный вес увеличивается с повышением концентрации воды в бензоле. Если считать, что в ассоциированном состоянии находится только избыточное при данной температуре количество воды, то молекулярный вес воды, образующей водородную связь с молекулами присадки, окажется равным 72, т. е. присадка удерживает в растворенном состоянии ассоциат, состоящий из четырех молекул воды. Избыточная вода начинает выделяться в тот момент, когда содержание ее в топливе становится настолько высоким, что последнее не может удерживать ее без добавления присадки. Присадка взаимодействует с выделившейся водой (образуется водородная связь) и удерживает ее в топливе в растворенном состоянии. Можно предположить, что присутствие присадки в топливе не оказывает влияния на первичный процесс выделения избыточной воды из топлива происходит конденсация водяных паров на центрах конденсации с образованием первичных ассоциатов, которые взаимодействуют с присадкой, и благодаря этому удерживаются в топливе, т. е. присадка практически повышает растворимость воды в топливе. [c.132]
Исследовано также влияние концентрации воды, стабилизаторов и метанола на стабильность бензино-метанольных смесей. При увеличении концентрации воды от 0,07 до 0,8% (масс.) зависимость температуры расслаивания от концентрации метанола проходит через максимум, а при концентрации воды более 1% (масс.) в области низких концентраций метанола (10— 20% масс.) появляется пеоегиб (рис. 6.14). Причем, чем выше концентрация 2-метилпропанола-1 в бензино-метанольных смесях, тем при более высоком содержании воды наблюдается перегиб на кривых, описывающих зависимость расслаивания от концентрации метанола. Характерно, что npiH высоких концентрациях метанола (60—80% масс.) стабильность смесей незначительно зависит от концентрации воды, /в то время как при низких концентрациях метанола это влияние проявляется резко. [c.218]
К [34]. Хотя природа связывания молекул воды при образовании различных кристаллических решеток совершенно различна, объединенные вклады трех колебательных и трех поступательных степеней свободы молекул воды приблизительно равны. Поэтому значение теплоемкости воды в зависимости от ее содержания в полимерах дает ценные указания о количестве связанной воды. Если при низких концентрациях в кристаллических гидратах вода специфически связывается, то ее вклад в теплоемкость будет мал и равен вкладу льда. В области высоких содержаний в основном присутствует объемная вода, причем вклад воды приблизительно вдвое превышает вклад льда. Можно ожидать, что в промежуточной области величина теплоемкости будет проходить через максимум, если при повышении температуры связанная вода с низким значением энергии превраш,ается в свободную воду с более высокой энергией. Вблизи комнатной температуры теплоемкость была определена для гидратированных образцов коллагена [34, 35], эластина [30], поли-2-(2-оксиэтоксиэтил)метакрилата [36] и метилцеллюлозы [37]. Значения теплоемкости Ср для образцов, содержащих на 1 г полимера у граммов воды, в зависимости от значения у представлены на рис. 7.1. Во всех случаях экспериментальные данные укладываются на прямые линии. Наклоны этих линий дают значение парциальной молярной теплоемкости Ср. Значения, полученные для вклада воды в теплоемкость, находятся в интервале значений для объемной воды [18 кал/(град моль)]. Это может служить однозначным указанием на то, что воду, сорбированную этими образцами, можно рассматривать в термодинамическом смысле как отдельную жидкоподобную фазу. Значения парциальной молярной теплоемкости при комнатной температуре намного ближе к значениям для объемной воды, чем для льда. Отсюда можно полагать, что свойства сорбированной воды также близки к свойствам объемной воды. С учетом экспериментальной ошибки при комнатной температуре может присутствовать максимально лишь несколько процентов связанной воды. Сходство результатов, полученных для совершенно разных полимеров, говорит о том, что распространенная концепция, согласно которой сорбированная вода может [c.145]
При дальнейшем росте температуры темп увеличения скорости процесса замедляется, и в, интервале 280—320° С скорость реакции практически не изменяется. Дальнейшее повышение температуры сопровождается увеличением скорости превращения, вплоть до 420—430° С, где скорость реакции резко падает Энергая активации, найденная в узком интервале температур 380—400° С, составляет величину 11— 12 ккал1моль. Сложная зависимость скорости реакции от тем-лературы может быть объяснена изменением концентрации адсорбированной воды. При низкой температуре (Н,0)адс > (Рпов), так что увеличение температуры ускоряет процесс соответственно энерпии активации образований или распада переходного комплекса. В каком-то температурном интервале, зависящем от парциального давления пара воды, начинает сказываться уменьшение (НгО) аде- Увеличение скорости реакции выше 320° С связано, вероятно, с отрывом электрона от группы ОН или, иначе говоря, второго электрона от молекулы воды с образованием другого переходного комплекса с большей энергией активации. Выше температуры 420—430° С, ио-видимому, дефектная решетка не может существовать из-за сильно возросшей подвижности ионов — реакция сопровождается выделением новой твердой фазы, затрудняющей доступ молекул воды. [c.58]
При отнесении обсуждавшихся выше частот Штраусс и Саймонс [386,387] использовали спектральные данные для метанольных растворов с небольшими добавками воды. Было обнаружено, что даже при концентрации воды 0,1 М полоса ОН-колебания, приписанная концевой молекуле метанола в цепи, исчезает. Из этого можно сделать вывод, что каждая молекула воды является мостиком между двумя цепями, причем атомы водорода молекул воды связаны с атомами кислорода концевых молекул метанола, имеющими свободные электронные пары. Однако полоса I, приписанная сильнейшей водородной связи, также исчезает, тогда как II становится сильнее. Это может указывать на вхождение молекулы воды в координационную сферу, хотя данное объяснение противоречит тому факту, что в метанольном растворе способность молекул воды к образованию водородных связей меньше, чем у метанола. Вероятнее всего, имеет место образование циклического сольвата [c.118]
Исследования каталитического действия фтористого бора Кларком [19] в четыреххлористом углероде при О—25° показало, что вода является сокатализатором. При концентрации воды меньше Ю моль 1л и избытке фтористого бора скорость зависела от [Стирол] -[НгО], тогда как для [НгО] > 10 моль1л скорость зависела от величины [Стирол] и не зависела от [НгО]. При низких концентрациях воды третий порядок относительно стирола не сохранялся до высоких степеней превращения, причем скорость в процессе реакции снижалась, а при высоких концентрациях воды процесс к концу ускорялся. Степень полимеризации уменьшалась при повышении концентрации воды, но была независима от концентрации стирола. Кларк предположил, что при низких концентрациях воды реакция гомо- [c.228]
При высокой плотности тока, когда реакция (1) будет требовать большого количества катионов алюминия в определенном энергетическом состоянии для того, чтобы им выделиться из пленки и перейти в раствор, мы можем ожидать, что реакция (2) будет преобладать, хотя реакция (1) также будет иметь место. Это согласуется с наблюдаемыми фактами. Промежуточным продуктом анодного окисления является твердая окись алюминия, но в серной кислоте найден и сульфат алюминия в изобилии — более, чем можно было бы объяснить разрушением окиси алюминия. Становится понятным, что для успешного анодирования ванна должна иметь соответствующий состав. Для протонного механизма необходима вода, но количество свободной воды должно быть минимальным. Свободная вода будет способствовать протеканию реакции (1), которая требует обеспечения каждого иона алюминия, переходящего в раствор, оболочкой из молекул воды. С другой стороны, свободная вода будет тормозить реакцию (2) при условии правильного расположения цепочек из молекул воды на внешней поверхности растущей окисной пленки, конкурируя с ионами (Х04) . Ванны, которые содержат большой запас молекул воды, связанных с молекулами кислоты, и лишь небольшую концентрацию свободных молекул воды, могут дать лучшие результаты. Электролиты, благоприятные для анодного окисления, в действительности содержат много меньше свободной воды, чем общее ее количество. В серной кислоте например, большое количество воды, вероятно, присутствует в виде кислого гидрата, как это следует из кривой точек замерзания, которая имеет максимум при составе, соответствующем Н2504-Н20 таким образом, количество активной воды лежит много ниже общей концентрации воды. Глицерин или гликоль, которые обладают сродством к воде, могут еще более снижать содержание свободной воды, и эти вещества часто добавляются в ванны для анодирования. Фосфорная и хромовая кислоты также обладают сродством к воде, быстро поглощают ее из обычного воздуха, как это делает серная кислота. Случай с щавелевой кислотой менее прост. Твердое вещество имеет состав СООН-СООН-2Н20, но есть основание считать, что две молекулы воды не являются кристаллизационной водой действительно, кристаллическая структура указывает на то, что эти молекулы воды могут присутствовать не в виде НаО, а в виде ионов (Нз0)+ [74а]. [c.229]
Измерьте ареометром плотность имеющегося в лаборатории концентрированного раствора кислоты (щелочи) и определите по табл. 1 его процентную концентрацию. Рассчитайте, какой объем концентрированного раствора и воды необходим для приготовления раствора заданной нормальной концентрации. (Объем воды в этом случае можно определить как разность между заданным объемом раствора и объемом концентрированного.) Отмерьте маленьким цилиндром (под тягой) подсчитанный объем концентрированного раствора. Большим цилиндром или мензуркой отмерьте вычисленный объем воды. Воду перелейт4 в плоскодонную колбу, затем туда же вылейте не льшими порциями концентрированный раствор при постоянном перемешивании встряхиванием колбы. Цилиндр ополосните несколько раз приготовленным раствором. Закройте колбу пробкой и тщательно перемешайте ее содержимое. Колбу с раствором передайте лаборанту. [c.100]
Питание микроорганизмов осуществляется через поверхность их тела путем диффузии в результате разных концентраций веществ внутри и вне организма. Движение растворенных веществ лод действием осмотического давления происходит в сторону мень-щих концентраций, воды — в сторону больших. Так как поступающие в клетку вещества вовлекаются в биохимические процессы и усваиваются микроорганизмом, равновесия их внутри клетки и. вне ее практически не наступает. Однако проникновение вещества -В клетку не всегда объяснимо осмосом. Цитоплазматическая мембрана обладает избирательной способностью отличать нужные вещества от ненужных и извлекать их из растворов с малой концентрацией, не пропуская вредные для клетки вещества, содержащиеся в среде в значительных концентрациях (до определенных лределов). Так как поверхность клеток на единицу их массы лредставляет громадную величину, то процессы обмена и размножения микроорганизмов происходят с большими скоростями, и этим объясняются интенсивные биоповреждения некоторых материалов, на которых идут такие процессы. Давление в клетке создается поступившими в нее веществами, продуктами обмена и веществами клеточного синтеза. В связи с высоким осмотическим давлением внутри клетки создается постоянный приток в нее воды. Этим можно объяснить способность микроорганизмов развиваться на сравнительно сухих средах. Так, микрогрибы способны повреждать материалы, имеющие влажность 15...20 % и ниже. [c.15]
В приложениях часто встречается комбинированный режим конвекционных течений, уже рассматривавшийся нами в гл. 6, при котором местная подъемная сила возникает вследствие одновременного переноса тепловой энергии и химических компонентов. Одно из первых исследований неустойчивости для такой системы было осуществлено Стерном [72]. Важным примером подобного рода является комбинированный перенос тепла и солености в морской воде. В результате такого переноса на поверхности моря возникает слой льда, тающий или намерзающий на своей нижней поверхности, которая контактирует с морской водой. При этом в результате таяния образуется прослойка пресной воды, которая является более легкой и, следовательно, может стабилизировать слой, поскольку влияние солености на плотность часто оказывается более сильным, чем влияние температуры. Намерзающий снизу лед не содержит солевых компонентов. Образующийся в результате слой воды с высокой концентрацией соли формирует мощное дестабилизирующее воздействие, налагающееся на эффект, обусловленный понижением температуры по направлению вверх Оба процесса переноса должны рассматриваться совместно с целью определения как режима неустойчивости, так и возможности возникновения любой формы конвективного переноса, который может развиться в подобном случае. При этом анализ данной проблемы оказывается достаточно затруднительным из-за перемены знака коэффициента Соре для солевых компонентов ири низких температурах воды [9, 10, 56]. Напомним, что эффект Соре представляет собой явление диффузии химических компонентов под воздействием температурных градиентов. [c.229]
Для растворителей разного типа отклонение градуировочного графика от прямой линии при малом общем содержании воды тем значительней, чем больше в растворе концентрация молекул в ассоциатах вода — вода. Пользуясь методом наименьших квадратов для вычисления коэффициентов экстинкции неразрешающихся полос, можно в некоторых случаях определить не только общую концентрацию воды в растворителе, но и содержание ее в ассоциатах вода — растворитель и вода — вода. [c.160]
Нормы орошения зависят от многих факторов — концентрации сточных вод, вида выращиваемых культур, климатических условий, типа почв. Использование производственных сточных вод на полях орошения должно быть согласовано с органами Государственного санитарного надзора. Основным требованием к предназначенным для орошения про-изводстзенным сточным водам является исключение возможности вредного их воздействия на почву, подземные воды, выращиваемые культуры, а также на здоровье людей. [c.21]
Известно [64], что на практике растворяют целлюлозу в гидратах оксидов третичных аминов, т.е. в присутствии некоторого небольшого количества воды. По существу, вода является обязательным компонентом растворяющей системы, и от ее содержанри зависит концентрация целлюлозы в смешанном растворителе. Рассмотрим вкратце основные факторы, характеризующие взаимодействие воды с самой целлюлозой и с аминоксидным растворителем. Неоднозначность механизма взаимодействия целлюлозы с водой обусловлена сложностью строенрм целлюлозы и самой воды. Вода сопровождает целлюлозу как в процессе роста растений, так и после ее выделения из них. В многочисленных литературных источниках утверждается, что вода взаимодействует только с аморфной частью целлюлозы. Небольшие (до 6-7 масс.%) количества связанной с целлюлозой через образование водородных связей (адсорбированной) воды приводят к значительным изменениям как физических свойств целлюлозы (например, тангенс угла диэлектрических потерь, плотность, температура стеклования), так и свойств самой адсорбированной воды (76, 77]. Кластерная структура воды у поверхности целлюлозы переходит в структуру типа "частокола" из полярных молекул (толщина слоя 1,75-2,25 мкм). Анализ показал [78], что соседние диполи воды (при содержании ее в целлюлозе до 7%) направлены преимущественно параллельно, а при содержании более 10% - антипараллельно. Параллельная ориентация [c.378]
В зависимости от перечисленных условий может изменяться концентрация в водах целого ряда элементов. Элементы, которые могут в конкретных условиях находиться в водах, поступающих к барьеру, в повыщенных концентрациях, приведены в разделе с общим названием парагенная ассоциация . Так, в нейтральных и слабощелочных сероводородных водах могут быть повышены содержания 8 и 8е (см. табл. 1). Такие элементы, как N3, К, КЬ, С8, N, С1, Вг, ], могут находиться в повыщенных концентрациях и быть геохимически подвижными в водах любого состава. [c.25]
Повьпиению концентрации водорода в водородсодержащем тазе при работе на заданном режиме способствует снижение температуры сепарации этого газа. Так, снижение температуры сепарации на 10 "С при давлении в системе 2,5 МПа позволяет увеличить концентрацию водорода в среднем на 0,4%(об.), а плотность водородсодержащего газа-снизить на 0,017 кг/нм , В промышленных условиях температура сепарации зависит от эффективности работы аппаратов воздушного и водяного охлаждения и в значительной степени определяется температурой окружающей среды, влажностью и др. Для поддержаЕшя температуры сепарации на уровне 15-20 "С и увеличения длительности межрегенерационных циклов до двух лет целесообразно вырабатывать на абсорбционных холодильных установках, например, холодную воду с температурой 5-7 "С [46]. При необходимости получения водородсодержащего газа повышенной чистоты, например для пуска установки, целесообразно применять более глубокий холод. Схема использования захоложенной воды показана на рис. 66. Газопродуктовая смесь из последнего реактора риформинга поступает в теплообменник для сырья, где нагревает сырье, охлаждается в теплообменнике и нагревает циркулирующий теплоноситель, который питает энергией абсорбционную холодильную установку. Вырабатываемую на установке холодную воду используют для окончательного охлаждения газопродуктовой смеси до 10-20 °С. Предварительно ее охлаждают в аппаратах воздушного и водяного охлаждения. [c.103]
Таким образом, зная концентрацию различных ингредиентов в очищенной сточной воде и в воде водоема, а также степень разбавления сточных вод водой водоема, можно подсчитать концентрации ингредиентов после смешения вод. Лучшее смешение сточных вод с водой водоема достигается рассеивающим выпуском, когда сточная вода попадает в водоем в нескольких точках, а не в одной, как в случае берегового выпуска. Расчет вероятного разбавления сточных вод в проточном водоеме производится по методу В. А. Фролова и И. Д. Родзил-лера, в соответствии с которым внесенные загоязненпя распределяются в воде водоема по упавнению [c.180]
Писаржевский и Глюкман [42] исследовали влияние растворителя на каталитическое разложение перекиси водорода над платиной и двуокисью марганца на угле. Растворителями служили вода, эфир, смесь эфира и воды и ацетон. Каталитическое разложение в водных растворах происходит мономолекулярно. Кинетика реакции сильно меняется, если в качестве растворителя употреблять смесь воды и эфира скорость реакции в воде с эфиром всегда выше, чем в чисто й Воде или чистом эфире. Наиболее важный фактор во влиянии растворителя на разложение перекиси водорода — действие эффективного пространства растворителя. Оно накладывается на взаимодействие молекул растворителя с ионами действующ его как катализатор металла и ведет к образованию сольватов ионов, участвующ,их тем или иным способом в катализе. Сольватация молекул перекиси водорода, повидимому, не играет особой роли. Пользуясь в качестве растворителя ацетоном, который в противоположность эфиру смешивается с водой во всех пропорциях, Рлюкман [19] обнаружил, что вода ускоряет реак цию, и присутствие 10—15% воды необходимо в этом случае для получения того же эффекта, как и при содержании 0,7% воды в эфире. Небольшое изменение концентрации растворенной в эфире воды (0,7—1,2%о) всегда сильно влияет на скорость реакции (20—30 раз). Для достижения такого же изменения скорости реакции в растворе ацетона приходится добавлять гораздо больше воды, именно до 80%. Кривые, изображающие зависимость скорости реакции от содержания воды, в случае эфира имеют максимум, но этого не наблюдается у ацетона. [c.682]
Предельно допустимые концентрации, установленные по эстетическим соображениям, основаны на том, что присутствие в воде тех или ипых веществ делает ее менее желательной для употребления. Это относится к веществам, придающим воде неприятный вкус и запах, ухудшающим ее качество с точки зрения экономики и эстетики. Сюда же относятся вещества, токсичные для рыб или растений. Вещества, активно действующие на метиленовую синь и находящиеся в высоких К01щент-рациях в некоторых моющих средствах, могут придавать воде неприятный вкус и пенистость. Хлориды, сульфаты и растворенные частицы также влияют на вкус воды и, кроме того, обладают слабительным действием, а высокоминерализованная вода ухудшает качества кофе и чая. Сульфат натрия и сульфат магния — хорошо известные слабительные с общепринятыми названиями глауберова соль и горькая соль . Послабляющее действие воды, богатой сульфатами, обычно отмечается приезжими из других районов и новыми потребителями. Медь является важным питательным элементом и не представляет угрозы для здоровья. Рекомендуемый предел содержания меди устанавливают таким, чтобы избежать появления у воды медного привкуса. Цинк — также важный элемент в питании человеческого организма, однако в больших количествах он раздражающе действует на желудочно-кишечный тракт. Экстракт хлороформа содержит большое количество органических остатков, до сих пор мало исследованных. Предельно допустимые концентрации веществ, экстрагируемых хлороформом, установлены для того, чтобы не допустить присутствия неизвестных органических соединений. Вода с высокими концентрациями нитратов для взрослых людей не опасна, но у детей может вызывать тяжелые отравления. Многие случаи детской метгемоглобинемии были результатом пользования водой, загрязненной азотосодержащими стоками и забиравшейся из частных водораспределительных систем. В настоящее время еще не разработан способ экономичного удаления избыточных нитратов из воды. Поэтому в тех районах, где вода содержит нитраты в высоких концентрациях, необходимо предупреждать население о потенциальной опасности такой воды для детей. Железо и марганец нежелательны из-за того, что они вызывают появление коричневатых пятен на белье и фарфоре, а также из-за горько-сладкого привкуса, присущего л елезу. Оптимальные концентрации фтора в питьевой воде приведены в табл. 5.3. Количество потребляемой людьми воды зависит от климатических условий, поэтому оптимальные концентрации установлены для средней максимальной дневной температуры воздуха. [c.120]
Обращается особое внимание [134] на склонность четырехоки- и азота превращаться при взаимодействии с водой в азотную кислоту, являющуюся, как известно, сильным коррозионным агентом. Поэтому необходимо исключить контакт окислителя с влагой воздуха, а также прямое попадание воды. Обводненные окислители становятся коррозионно-активными, и эффективность ингибиторов может резко упасть. Объясняется это тем, что при увеличении концентрации воды в окислителе концентрация ингибитора может снизиться за критическое значение, в результате чего ингибитор превратится в стимулятор коррозионного процесса. Особенно это относится к НР, который эффективен только при фиксированной концентрации и определенном содержании воды. При повышении содержания воды в окислителях на основе азотной кислоты НР может вызвать сильную коррозию нержавеющих сталей. [c.216]
Реакция взаимодействия между тиосульфатом натрия и серной кислотой приводит к выделению свободной серы, которая появляется в виде мути. Скорость появления мути в растворе будет зависеть от концентрации реагирующих веществ и от температуры. Скорость всего процесса в данном случае будет определяться скоростью распада тиосерной кислоты, так как образование этой кислоты идет очень быстро. Для выполнения опыта взять три бюретки одну наполнить водой, вторую 0,1 н. раствором тиосульфата натрия, третью 0,1 н. раствором серной кислоты. В четыре пронумерованных пробирки налить из бюретки указананое в таблице 1 число мл раствора тиосульфата натрия и воды, в четыре другие пробирки — по 6 мл серной кислоты. Влить в первую пробирку отмеренное количество кислоты и перемешать содержимое пробирки. Отметить по секундомеру время от момента смешения раствора до момента появления мути. Аналогичные опыты [c.81]
chem21.info
Ионное произведение воды. Водородный показатель
Вода является практически незаменимым растворителем в экспериментальной и прикладной химии, поэтому необходимо изучение ее свойств. Остановимся на таких понятиях как ионное произведение воды и водородный показатель pH.
Ионное произведение воды
При определенных условиях, вода может вести себя как акцептор протонов (в присутствии кислоты) или как донор протонов (в присутствии основания). Интересной особенностью воды является то, что она может подвергаться процессу самодиссоциации (автоионизации), т.е. быть одновременно донором и акцептором протонов по отношению к самой себе.
2h3O ↔ h4O+ + OH—
Эта реакция – самопроизвольная диссоциация, осуществляется в небольшой степени. Ее можно упростить, если h4O+ заменить на H+
h3O ↔ H+ + OH—
Запишем выражение для константы равновесия, опираясь на закон действия масс:
K = [H+]·[OH—]/[h3O]
Концентрацию воды, принято исключать из данного выражения, вследствие ее практически постоянного значения в разбавленных растворах. Получаем новую константу равновесия KН2О, которая называется ионным произведением воды:
KН2О = [H+]·[OH—]
При температуре 25ºС KН2О = 1·10-14 и остается постоянным в водных растворах кислот, щелочей, солей или других соединений.
KН2О = [H+]·[OH—] = 1·10-14
При повышении температуры ионное произведение воды сильно возрастает.
Полученное выражение применимо не только к чистой воде, но и к растворам.
Если осуществляется условие [H+] = [OH—], то раствор называется нейтральным, но обычно эти величины не совпадают, тогда при увеличении одного показателя, другой должен уменьшаться, так, чтобы их произведение оставалось постоянным (1·10-14)
Водородный показатель pH
Кислотно – основные свойства растворов определяются величиной концентрации ионов водорода или гидроксила. Мы уже знаем, что ионное произведение воды при определенной температуре постоянно, а [H+] и [OH—] — переменные, то по их величинам можно говорить о кислотности или щелочности раствора. При нейтральном характере раствора, т.е. [H+] = [OH—], получаем следующее:
[H+] = [OH—] = (KН2О)1/2 = (1·10-14)1/2 = 10-7 М
Увеличение или уменьшение концентраций иона водорода или гидроксид — иона меняет характер среды. Таким образом, в растворах с различным характером среды, при температуре 25ºС, выполняются следующие условия:
| Нейтральная среда | [H+] = [OH—] = 10-7 М |
| Кислая среда | [H+] > [OH—], [H+] > 10-7 М, [OH—] ˂ 10-7 М |
| Щелочная среда | [H+] ˂ [OH—], [H+] ˂ 10-7 М, [OH—] > 10-7 М |
Следует помнить, что не зависимо от характера среды, в водных растворах всегда существуют оба иона.
Выражение характера среды данным способом информативно, но сопряжено с некоторыми трудностями в случае выражения небольших значений концентрации иона водорода. Более удобно пользоваться отрицательным логарифмом этой величины, называемой водородным показателем pH:
pH = -lg[H+] = lg (1/[H+])
Отметим, что изменению [H+] в 10 раз соответствует изменение pH всего на 1 единицу.
pOH = -lg[OH—] = lg (1/[OH—])
pH и pOH нейтрального раствора равен 7:
pH = -lg[H+] = -lg(1·10-7) = 7
| Нейтральная среда | pH = pOH = 7, pH + pOH = 14 |
| Кислая среда | pH ˂ pOH, pH ˂ 7, pH + pOH = 14 |
| Щелочная среда | pH > pOH, pH > 7, pH + pOH = 14 |
На следующем рисунке наглядно показано зависимость характера среды от величины pH
 шкала pH
шкала pHВсе рассмотренные нами представления об ионном произведении воды справедливы для случая диссоциации химически чистой воды. Если же равновесные концентрации H+ или ОH— составляют большие величины, то ионное произведение воды выражается формулой:
aH+aOH— = K`h3O
где aH+ и aOH— — соответственно активности ионов водорода и ионов гидроксила;
K`h3O — истинная константа, значение которой не зависит от величины ионной силы раствора.
Учитывая, что
aH+ = [H+] · fH+ , aOH— = [OH—] · fOH—
преобразуем выражение:
[H+]·[OH—] = K`h3O/(fH+· fOH— )
где fH+· fOH— — коэффициенты активности
Для определения характера среды раствора существует много методов, самый простой из них – применение индикаторов. Далее приведены некоторые индикаторы и зависимость изменения их окраски от концентрации ионов водорода.
 изменение окраски индикатора в зависимости от характера среды
изменение окраски индикатора в зависимости от характера средыzadachi-po-khimii.ru
9_Ионное произведение воды

ЛЕКЦИЯ 9
ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
ПЛАН ЛЕКЦИИ
 Электролитическая диссоциация воды.
Электролитическая диссоциация воды.
 Ионное произведение воды.
Ионное произведение воды.
 Водородный показатель (рН).
Водородный показатель (рН).
 Определение рН водных растворов.
Определение рН водных растворов.
 Буферные растворы.
Буферные растворы.
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ВОДЫ
Вода обладает незначительной электрической проводимостью, является
слабым электролитом. Удельная электрическая проводимость воды при 298 К
составляет 6,2 10-8 Ом1  см1 . Полярные молекулы воды подвергаются самоионизации в результате переноса протонов с одной молекулы на другую
см1 . Полярные молекулы воды подвергаются самоионизации в результате переноса протонов с одной молекулы на другую
2h3O h4O+ + OH .
h4O+ + OH .
Такой процесс называют автопротолизом. Упрощенная форма записи уравнения диссоциации воды:
h3O H+ + OH .
H+ + OH .
Константа диссоциации воды может быть вычислена по уравнению
K | a H | aOH | , | |
| a H | O | ||
|
|
| ||
|
| 2 |
|
|
где aH , aOH
, aOH , ah3O - активности ионов Н+, ОН и молекул воды.
, ah3O - активности ионов Н+, ОН и молекул воды.
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

При комнатной температуре самоионизации подвергается незначительная часть молекул воды (приблизительно одна из 108 молекул), поэтому в выражении константы диссоциации воды активности заменяют концентрациями
K | [H | ][OH ] | 1,8 10 | 16 | при 298 К. |
|
|
| |
|
|
|
|
|
| ||||
| [h3O] |
|
|
|
| ||||
|
|
|
|
|
|
|
| ||
|
|
|
|
|
|
| 0 |
| кДж |
Диссоциация воды - обратимый эндотермический процесс: | h398 | 55,76 | моль . | ||||||
Повышение температуры ведет к смещению равновесия в сторону прямой реакции и возрастанию концентраций ионов Н+ и ОН:
T, K | 273 | 293 | 298 | 323 | 353 | 373 |
|
|
|
|
|
|
|
([H ] [OH- ]) 107 ,моль | 0,34 | 0,78 | 1,05 | 2,44 | 5,02 | 7,40 |
л |
|
|
|
|
|
|
|
|
|
|
|
|
|
ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ
Произведение равновесных концентраций ионов H+ и OH− называютионным произведением воды (K w )
Kw [H ][OH ].
Как следует из выражения константы диссоциации воды,
K w K[h3O].
Равновесную концентрацию молекул [H 2O]можно принять равной общему количеству вещества воды в одном литре, т.е.
| [h3O] CH O |
|
| m | 1000 | 55,56 моль/л . | ||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
| |||||||||||
|
| MV | 18 1 | |||||||||||||||||||
|
| 2 |
|
|
|
|
|
|
|
|
| |||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
| Kw | 1,8 10 16 55,56 |
|
| 10 14 при 298К (250С). | |||||||||||||||||
Исполнитель: |
|
| Дата: |
|
|
|
|
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

При данной температуре ионное произведение воды является постоянной величиной для любых разбавленных водных растворов.
Значение ионного произведения воды возрастает при повышении температуры:
t,0C | 25 | 50 | 70 | 100 |
|
|
|
|
|
K w 1014 | 1,0 | 5,5 | 15,8 | 55,0 |
|
|
|
|
|
Пример.
Вычислите концентрации ионов H+ и OH в 0,01М растворе гидроксида натрия.
в 0,01М растворе гидроксида натрия.
Решение. NaOH - щелочь, сильный электролит, в водном растворе полностью распадается на ионы: NaOH = Na+ + OH . Молярная концентрация ионов OH равна молярной концентрации NaOH:
равна молярной концентрации NaOH:
[OH ] CNaOH 10-2 моль/л .
Концентрация ионов водорода:
[H ] | Kw |
| 10 | 14 | 10 | 12 | моль/л . | |
|
|
|
|
|
| |||
[OH ] | 10 2 |
| ||||||
|
|
|
| |||||
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ(pН)
Поскольку степенные выражения неудобны в количественных расчетах, их заменяют логарифмическими функциями, имеющими специальные обозначения и названия:
|
|
| lg[H | ] |
| pH, | ||||||||||||
|
| lg[OH | ] |
| pOH, | |||||||||||||
|
|
| lgK w |
| pK w . | |||||||||||||
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
|
| Мероприятие № |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 4 | 2 | 7 | 1 | |||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Символ рН называют водородным показателемpH lg[H ] .
Логарифмируя ионное произведение воды, получим
lg[H | ] | lg[OH | ] lg Kw , |
pH | pOH | pK w , | |
pH | pOH 14 (при 298К). | ||
Пример 1. Вычислите рН 0,01 M раствора соляной кислоты. | |||
Решение. Водородный | показатель | pH lg[H ] . Соляная кислота | |
является сильным электролитом, т.е. в водном растворе полностью распадается на ионы:
HCl = H+ + Cl .
Молярная концентрация ионов водорода в данном случае равна молярной концентрации кислоты:
[H ] CHCl 102 моль/л ; pH lg102 2.
lg102 2.
Пример 2. Рассчитайте рН 0,1 M раствора гидроксида калия.
Решение. KOH - щелочь, сильный электролит, в водном растворе полностью распадается на ионы:
KOH = K+ + OH .
Молярная концентрация ионов OH равна молярной концентрации KOH:
равна молярной концентрации KOH:
|
| [OH ] | CKOH 10-1 моль/л , | ||||||||||||||
|
| pOH = -lg[OH−]= 1, | |||||||||||||||
|
| pH 14 - pOH = 14 – 1 = 13, | |||||||||||||||
|
|
|
| рН = 13. | |||||||||||||
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 4 | 2 | 7 | 1 | |||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Пример 3. Рассчитайте рН 0,01 M раствора бромноватистой кислоты.
Решение. Бромноватистая кислота – слабый электролит. Уравнение диссоциации:
HBrO H+ + BrO−, | K | [H ][BrO | ] | 2,2 10 | 9 (при 298 K). |
|
| ||||
[HBrO] |
| ||||
|
|
|
|
|
Согласно уравнению диссоциации, [H+] = [BrO−] , т.е.
| [H ]2 |
|
|
K | [HBrO] , | [H ] | K [HBrO] . |
Степень диссоциации слабого электролита мала, [HBrO] ≈ СHBrO.
Концентрация ионов водорода и значение рН:
|
| 2,2 10 9 0,01 | 4,7 10 5 моль/л. |
[H ] K CHBrO | |||
| pH | lg( 4,7 10 5 ) | 4,3. |
Пример 4. Рассчитайте рН 0,01 M водного раствора аммиака.
Решение. В водном растворе аммиака существует равновесие:
NH | 3 | H | O | NH | OH , | K | [Nh5 ] [OH ] | 1,8 10 | 5 | (при 298 K), | ||||
|
|
|
| |||||||||||
| 2 |
|
| 4 |
|
| [Nh4 | h3O] |
|
|
|
| ||
|
|
|
|
|
|
|
|
|
|
|
| |||
т.е. гидрат | аммиака | NH 3 | H 2O | проявляет | свойства | слабого электролита. | ||||||||
Диссоциация слабого электролита протекает в малой степени, можно считать,
что [Nh4 h3O] |
| СNh4 h3 O . Согласно уравнению диссоциации [Nh5 ] | [OH ], | ||||||||||||||||||||||||||||
следовательно K |
| [OH ]2 |
|
| . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||
| CNH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||
|
|
|
| 3 | H | O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||
|
|
|
|
|
| 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
Концентрация ионов ОН−: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 5 10 | 2 4,2 104 моль/л . |
|
|
|
| |||||||
[OH ] | K C | NH |
|
| H |
| O | 1,8 10 |
|
|
|
| |||||||||||||||||||
|
|
|
|
| 3 |
| 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
|
|
|
|
| pOH lg[OH ] | lg(4,2 | 10 4 ) 3,4 . |
|
|
|
| ||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
Исполнитель: |
|
|
|
|
|
|
|
|
| Дата: |
|
|
|
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 | |||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Значение рН:
pH = 14 – рОН- = 14 - 3,4 = 10,6.
Значения концентраций ионов H+ или OH , а также показатель рН являются количественной характеристикой среды раствора (кислой,
нейтральной, щелочной).
В нейтральной среде
[H ] [OH ]  Kw ,
Kw ,
[H ] 10 14 107 моль/л , pH | lg[H ] lg10 7 7 . |
В кислой среде
[H ] 10 7 моль/л , lg[H ] lg107 , lg[H ] 7 , т.е.pH 7 .
В щелочной среде
[H ] 10 7 моль/л , lg[H ] lg107 , lg[H ] 7 , т.е.pH 7 .
КОЛИЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ РЕАКЦИИ СРЕДЫ
| Концентрация ионов, моль/л |
| ||
Среда |
|
| рН | |
[H+] | [OH ] | |||
|
| |||
|
|
|
| |
нейтральная | 10 7 | 10 7 | 7 | |
|
|
|
| |
кислая | >10 7 | <10 7 | < 7 | |
|
|
|
| |
щелочная | <10 7 | >10 7 | > 7 | |
|
|
|
| |
ОПРЕДЕЛЕНИЕ РН ВОДНЫХ РАСТВОРОВ
Измерение рН растворов (рН-метрия)используется довольно широко.
Контроль значений pH крови и других биологических растворов позволяет диагностировать патологические процессы в организмах. Значение рН
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

природных вод является важнейшим гидрохимическим, гидрогеологическим и экологическим показателем. В сельском хозяйстве по значению рН контролируют кислотность почв. Величина рН используется для контроля и автоматического регулирования производства, в технологии которого используются растворы.
Точное измерение рН осуществляют с помощью приборов – потенциометров
(pH-метров),в которых используется система со стеклянными и вспомогательными электродами. Потенциал стеклянного электрода зависит от концентрации ионов H+ в растворе. Принцип действияpH-метровоснован на измерении разности потенциалов электродов, помещенных в анализируемый раствор. Диапазон измеряемых значений рН 0 14, точность измерения - 0,01 единицы pH.
Измерение рН раствора на рН-метретипа«Эксперт-рН»показано на рисунке.
Для грубой оценки рН используют кислотно - основные индикаторы – органические вещества, окраска которых зависит от рН среды. Широко применяемыми индикаторами являются лакмус, фенолфталеин, метиловый оранжевый и другие слабые органические кислоты и основания.
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Например, индикатор метиловый оранжевый (н –
диметиламиназобензолсульфат натрия) может существовать в молекулярной
(HInd) и ионной (Ind ) формах, имеющих соответственно красную и желтую окраску. В интервале значений рН 3,1-4,4в результате смещения ионного
равновесия |
|
HInd | H+ + Ind |
происходит постепенное изменение окраски: от красной к желтой при повышении рН и от желтой к красной при понижении рН.
Индикатор фенолфталеин - слабая органическая кислота, при значениях рН ниже 8,2 находится преимущественно в молекулярной (бесцветной) форме.
Добавление щелочи приводит к смещению равновесия в сторону ионной формы, раствор приобретает малиновую окраску.
Изменение окраски кислотно - основных индикаторов происходит в некотором интервале, соответствующем 1-2единицы рН.
ОБЛАСТИ ПЕРЕХОДА ХАРАКТЕРНОЙ ОКРАСКИ НЕКОТОРЫХ ИНДИКАТОРОВ
Индикатор | Область перехода pH | Переход окраски при | |
повышении рН | |||
|
| ||
|
|
| |
метиловый оранжевый | 3,1 - 4,4 | красная → желтая | |
метиловый красный | 4,2 - 6,3 | красная → желтая | |
лакмус | 6,0 – 8,0 | красная → синяя | |
феноловый красный | 6,8 – 8,4 | желтая→ красная | |
фенолфталеин | 8,2 – 10,0 | бесцветная→ малиновая | |
|
|
|
Для определения рН раствора в более широком диапазоне часто применяют универсальный индикатор, представляющий собой смесь индикаторов.
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

ХАРАКТЕРНАЯ ОКРАСКА УНИВЕРСАЛЬНОГО ИНДИКАТОРА
Интервал рН | Окраска индикатора |
|
|
0,0 - 3,4 | красная |
3,4 - 4,7 | оранжевая |
4,7 - 6,2 | жѐлтая |
6,2 - 7,2 | зелѐная |
7,2 - 8,5 | синяя |
8,5 - 13,0 | фиолетовая |
|
|
БУФЕРНЫЕ РАСТВОРЫ
Многие аналитические реакции проводят при строго определенном значении pH, которое должно сохраниться в течение всего времени проведения реакции. Концентрация водородных ионов (соответственно, и pH) может изменяться в ходе некоторых реакций, а также под действием СО2 воздуха,
стекла посуды, различных примесей, присутствующих в дистиллированной воде. Для сохранения постоянного значения рН в заданном диапазоне применяют буферные растворы. Чаще всего в качестве буферных растворов используют смеси слабых кислот (или слабых оснований) и одноименных солей.
Например, ацетатный буферный раствор содержит уксусную кислоту и ацетат натрия, диссоциации которых соответствуют уравнения:
СН3СООН СН3СОО− + Н+
СН3СОО− + Н+
СН3СООNa = СН3СОО− + Na+
Концентрация водородных ионов в растворе уксусной кислоты может быть найдена из выражения константы диссоциации
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

К | [Ch4COO ][H ] | 1,8 10 | 5 | , [H ] | K [Ch4COOH] | . | ||
[Ch4COOH] |
|
| [Ch4COO- ] |
| ||||
|
|
|
|
| ||||
Присутствие в растворе одноименной соли подавляет диссоциацию уксусной кислоты. В результате концентрация недиссоциированных молекул кислоты становится почти равной концентрации кислоты, а концентрация ацетатных ионов – концентрации соли
К | Ссоли [H ] | , | [H ] | K Cкислоты | , |
|
| ||||
| Скислоты |
| Ссоли | ||
где Скислоты – концентрация кислоты, Ссоли – концентрация соли.
Концентрация ионов водорода в таком растворе определяется только соотношением концентраций кислоты и одноименной соли и не зависит от абсолютных значений концентраций. При разбавлении раствора значение рН практически не изменяется. Добавление небольшого количества сильной кислоты или щелочи также не приводит к заметному изменению рН таких растворов. Добавленные в раствор ионы H+ связываютсяацетат-ионами:
Ch4COO- + H+ = Ch4COOH,
ионы OH- - недиссоциированными молекулами уксусной кислоты CН3COOH:
OH- + Ch4COOH = h3O +Ch4COO-.
Аммиачный буферный раствор приготовляют смешением водного раствора аммиака и соли аммония.
NH 3  h3O
h3O Nh5 OH ,
Nh5 OH ,
Nh5Cl Nh5 Cl
Концентрацию ионов ОН− в растворе можно определить из уравнения:
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
studfiles.net
9_Ионное произведение воды

ЛЕКЦИЯ 9
ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
ПЛАН ЛЕКЦИИ
 Электролитическая диссоциация воды.
Электролитическая диссоциация воды.
 Ионное произведение воды.
Ионное произведение воды.
 Водородный показатель (рН).
Водородный показатель (рН).
 Определение рН водных растворов.
Определение рН водных растворов.
 Буферные растворы.
Буферные растворы.
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ВОДЫ
Вода обладает незначительной электрической проводимостью, является
слабым электролитом. Удельная электрическая проводимость воды при 298 К
составляет 6,2 10-8 Ом1  см1 . Полярные молекулы воды подвергаются самоионизации в результате переноса протонов с одной молекулы на другую
см1 . Полярные молекулы воды подвергаются самоионизации в результате переноса протонов с одной молекулы на другую
2h3O h4O+ + OH .
h4O+ + OH .
Такой процесс называют автопротолизом. Упрощенная форма записи уравнения диссоциации воды:
h3O H+ + OH .
H+ + OH .
Константа диссоциации воды может быть вычислена по уравнению
K | a H | aOH | , | |
| a H | O | ||
|
|
| ||
|
| 2 |
|
|
где aH , aOH
, aOH , ah3O - активности ионов Н+, ОН и молекул воды.
, ah3O - активности ионов Н+, ОН и молекул воды.
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

При комнатной температуре самоионизации подвергается незначительная часть молекул воды (приблизительно одна из 108 молекул), поэтому в выражении константы диссоциации воды активности заменяют концентрациями
K | [H | ][OH ] | 1,8 10 | 16 | при 298 К. |
|
|
| |
|
|
|
|
|
| ||||
| [h3O] |
|
|
|
| ||||
|
|
|
|
|
|
|
| ||
|
|
|
|
|
|
| 0 |
| кДж |
Диссоциация воды - обратимый эндотермический процесс: | h398 | 55,76 | моль . | ||||||
Повышение температуры ведет к смещению равновесия в сторону прямой реакции и возрастанию концентраций ионов Н+ и ОН:
T, K | 273 | 293 | 298 | 323 | 353 | 373 |
|
|
|
|
|
|
|
([H ] [OH- ]) 107 ,моль | 0,34 | 0,78 | 1,05 | 2,44 | 5,02 | 7,40 |
л |
|
|
|
|
|
|
|
|
|
|
|
|
|
ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ
Произведение равновесных концентраций ионов H+ и OH− называютионным произведением воды (K w )
Kw [H ][OH ].
Как следует из выражения константы диссоциации воды,
K w K[h3O].
Равновесную концентрацию молекул [H 2O]можно принять равной общему количеству вещества воды в одном литре, т.е.
| [h3O] CH O |
|
| m | 1000 | 55,56 моль/л . | ||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
| |||||||||||
|
| MV | 18 1 | |||||||||||||||||||
|
| 2 |
|
|
|
|
|
|
|
|
| |||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
| Kw | 1,8 10 16 55,56 |
|
| 10 14 при 298К (250С). | |||||||||||||||||
Исполнитель: |
|
| Дата: |
|
|
|
|
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

При данной температуре ионное произведение воды является постоянной величиной для любых разбавленных водных растворов.
Значение ионного произведения воды возрастает при повышении температуры:
t,0C | 25 | 50 | 70 | 100 |
|
|
|
|
|
K w 1014 | 1,0 | 5,5 | 15,8 | 55,0 |
|
|
|
|
|
Пример.
Вычислите концентрации ионов H+ и OH в 0,01М растворе гидроксида натрия.
в 0,01М растворе гидроксида натрия.
Решение. NaOH - щелочь, сильный электролит, в водном растворе полностью распадается на ионы: NaOH = Na+ + OH . Молярная концентрация ионов OH равна молярной концентрации NaOH:
равна молярной концентрации NaOH:
[OH ] CNaOH 10-2 моль/л .
Концентрация ионов водорода:
[H ] | Kw |
| 10 | 14 | 10 | 12 | моль/л . | |
|
|
|
|
|
| |||
[OH ] | 10 2 |
| ||||||
|
|
|
| |||||
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ(pН)
Поскольку степенные выражения неудобны в количественных расчетах, их заменяют логарифмическими функциями, имеющими специальные обозначения и названия:
|
|
| lg[H | ] |
| pH, | ||||||||||||
|
| lg[OH | ] |
| pOH, | |||||||||||||
|
|
| lgK w |
| pK w . | |||||||||||||
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
|
| Мероприятие № |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 4 | 2 | 7 | 1 | |||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Символ рН называют водородным показателемpH lg[H ] .
Логарифмируя ионное произведение воды, получим
lg[H | ] | lg[OH | ] lg Kw , |
pH | pOH | pK w , | |
pH | pOH 14 (при 298К). | ||
Пример 1. Вычислите рН 0,01 M раствора соляной кислоты. | |||
Решение. Водородный | показатель | pH lg[H ] . Соляная кислота | |
является сильным электролитом, т.е. в водном растворе полностью распадается на ионы:
HCl = H+ + Cl .
Молярная концентрация ионов водорода в данном случае равна молярной концентрации кислоты:
[H ] CHCl 102 моль/л ; pH lg102 2.
lg102 2.
Пример 2. Рассчитайте рН 0,1 M раствора гидроксида калия.
Решение. KOH - щелочь, сильный электролит, в водном растворе полностью распадается на ионы:
KOH = K+ + OH .
Молярная концентрация ионов OH равна молярной концентрации KOH:
равна молярной концентрации KOH:
|
| [OH ] | CKOH 10-1 моль/л , | ||||||||||||||
|
| pOH = -lg[OH−]= 1, | |||||||||||||||
|
| pH 14 - pOH = 14 – 1 = 13, | |||||||||||||||
|
|
|
| рН = 13. | |||||||||||||
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 4 | 2 | 7 | 1 | |||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Пример 3. Рассчитайте рН 0,01 M раствора бромноватистой кислоты.
Решение. Бромноватистая кислота – слабый электролит. Уравнение диссоциации:
HBrO H+ + BrO−, | K | [H ][BrO | ] | 2,2 10 | 9 (при 298 K). |
|
| ||||
[HBrO] |
| ||||
|
|
|
|
|
Согласно уравнению диссоциации, [H+] = [BrO−] , т.е.
| [H ]2 |
|
|
K | [HBrO] , | [H ] | K [HBrO] . |
Степень диссоциации слабого электролита мала, [HBrO] ≈ СHBrO.
Концентрация ионов водорода и значение рН:
|
| 2,2 10 9 0,01 | 4,7 10 5 моль/л. |
[H ] K CHBrO | |||
| pH | lg( 4,7 10 5 ) | 4,3. |
Пример 4. Рассчитайте рН 0,01 M водного раствора аммиака.
Решение. В водном растворе аммиака существует равновесие:
NH | 3 | H | O | NH | OH , | K | [Nh5 ] [OH ] | 1,8 10 | 5 | (при 298 K), | ||||
|
|
|
| |||||||||||
| 2 |
|
| 4 |
|
| [Nh4 | h3O] |
|
|
|
| ||
|
|
|
|
|
|
|
|
|
|
|
| |||
т.е. гидрат | аммиака | NH 3 | H 2O | проявляет | свойства | слабого электролита. | ||||||||
Диссоциация слабого электролита протекает в малой степени, можно считать,
что [Nh4 h3O] |
| СNh4 h3 O . Согласно уравнению диссоциации [Nh5 ] | [OH ], | ||||||||||||||||||||||||||||
следовательно K |
| [OH ]2 |
|
| . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||
| CNH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||
|
|
|
| 3 | H | O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||
|
|
|
|
|
| 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
Концентрация ионов ОН−: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 5 10 | 2 4,2 104 моль/л . |
|
|
|
| |||||||
[OH ] | K C | NH |
|
| H |
| O | 1,8 10 |
|
|
|
| |||||||||||||||||||
|
|
|
|
| 3 |
| 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
|
|
|
|
| pOH lg[OH ] | lg(4,2 | 10 4 ) 3,4 . |
|
|
|
| ||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
Исполнитель: |
|
|
|
|
|
|
|
|
| Дата: |
|
|
|
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 | |||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Значение рН:
pH = 14 – рОН- = 14 - 3,4 = 10,6.
Значения концентраций ионов H+ или OH , а также показатель рН являются количественной характеристикой среды раствора (кислой,
нейтральной, щелочной).
В нейтральной среде
[H ] [OH ]  Kw ,
Kw ,
[H ] 10 14 107 моль/л , pH | lg[H ] lg10 7 7 . |
В кислой среде
[H ] 10 7 моль/л , lg[H ] lg107 , lg[H ] 7 , т.е.pH 7 .
В щелочной среде
[H ] 10 7 моль/л , lg[H ] lg107 , lg[H ] 7 , т.е.pH 7 .
КОЛИЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ РЕАКЦИИ СРЕДЫ
| Концентрация ионов, моль/л |
| ||
Среда |
|
| рН | |
[H+] | [OH ] | |||
|
| |||
|
|
|
| |
нейтральная | 10 7 | 10 7 | 7 | |
|
|
|
| |
кислая | >10 7 | <10 7 | < 7 | |
|
|
|
| |
щелочная | <10 7 | >10 7 | > 7 | |
|
|
|
| |
ОПРЕДЕЛЕНИЕ РН ВОДНЫХ РАСТВОРОВ
Измерение рН растворов (рН-метрия)используется довольно широко.
Контроль значений pH крови и других биологических растворов позволяет диагностировать патологические процессы в организмах. Значение рН
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

природных вод является важнейшим гидрохимическим, гидрогеологическим и экологическим показателем. В сельском хозяйстве по значению рН контролируют кислотность почв. Величина рН используется для контроля и автоматического регулирования производства, в технологии которого используются растворы.
Точное измерение рН осуществляют с помощью приборов – потенциометров
(pH-метров),в которых используется система со стеклянными и вспомогательными электродами. Потенциал стеклянного электрода зависит от концентрации ионов H+ в растворе. Принцип действияpH-метровоснован на измерении разности потенциалов электродов, помещенных в анализируемый раствор. Диапазон измеряемых значений рН 0 14, точность измерения - 0,01 единицы pH.
Измерение рН раствора на рН-метретипа«Эксперт-рН»показано на рисунке.
Для грубой оценки рН используют кислотно - основные индикаторы – органические вещества, окраска которых зависит от рН среды. Широко применяемыми индикаторами являются лакмус, фенолфталеин, метиловый оранжевый и другие слабые органические кислоты и основания.
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Например, индикатор метиловый оранжевый (н –
диметиламиназобензолсульфат натрия) может существовать в молекулярной
(HInd) и ионной (Ind ) формах, имеющих соответственно красную и желтую окраску. В интервале значений рН 3,1-4,4в результате смещения ионного
равновесия |
|
HInd | H+ + Ind |
происходит постепенное изменение окраски: от красной к желтой при повышении рН и от желтой к красной при понижении рН.
Индикатор фенолфталеин - слабая органическая кислота, при значениях рН ниже 8,2 находится преимущественно в молекулярной (бесцветной) форме.
Добавление щелочи приводит к смещению равновесия в сторону ионной формы, раствор приобретает малиновую окраску.
Изменение окраски кислотно - основных индикаторов происходит в некотором интервале, соответствующем 1-2единицы рН.
ОБЛАСТИ ПЕРЕХОДА ХАРАКТЕРНОЙ ОКРАСКИ НЕКОТОРЫХ ИНДИКАТОРОВ
Индикатор | Область перехода pH | Переход окраски при | |
повышении рН | |||
|
| ||
|
|
| |
метиловый оранжевый | 3,1 - 4,4 | красная → желтая | |
метиловый красный | 4,2 - 6,3 | красная → желтая | |
лакмус | 6,0 – 8,0 | красная → синяя | |
феноловый красный | 6,8 – 8,4 | желтая→ красная | |
фенолфталеин | 8,2 – 10,0 | бесцветная→ малиновая | |
|
|
|
Для определения рН раствора в более широком диапазоне часто применяют универсальный индикатор, представляющий собой смесь индикаторов.
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

ХАРАКТЕРНАЯ ОКРАСКА УНИВЕРСАЛЬНОГО ИНДИКАТОРА
Интервал рН | Окраска индикатора |
|
|
0,0 - 3,4 | красная |
3,4 - 4,7 | оранжевая |
4,7 - 6,2 | жѐлтая |
6,2 - 7,2 | зелѐная |
7,2 - 8,5 | синяя |
8,5 - 13,0 | фиолетовая |
|
|
БУФЕРНЫЕ РАСТВОРЫ
Многие аналитические реакции проводят при строго определенном значении pH, которое должно сохраниться в течение всего времени проведения реакции. Концентрация водородных ионов (соответственно, и pH) может изменяться в ходе некоторых реакций, а также под действием СО2 воздуха,
стекла посуды, различных примесей, присутствующих в дистиллированной воде. Для сохранения постоянного значения рН в заданном диапазоне применяют буферные растворы. Чаще всего в качестве буферных растворов используют смеси слабых кислот (или слабых оснований) и одноименных солей.
Например, ацетатный буферный раствор содержит уксусную кислоту и ацетат натрия, диссоциации которых соответствуют уравнения:
СН3СООН СН3СОО− + Н+
СН3СОО− + Н+
СН3СООNa = СН3СОО− + Na+
Концентрация водородных ионов в растворе уксусной кислоты может быть найдена из выражения константы диссоциации
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

К | [Ch4COO ][H ] | 1,8 10 | 5 | , [H ] | K [Ch4COOH] | . | ||
[Ch4COOH] |
|
| [Ch4COO- ] |
| ||||
|
|
|
|
| ||||
Присутствие в растворе одноименной соли подавляет диссоциацию уксусной кислоты. В результате концентрация недиссоциированных молекул кислоты становится почти равной концентрации кислоты, а концентрация ацетатных ионов – концентрации соли
К | Ссоли [H ] | , | [H ] | K Cкислоты | , |
|
| ||||
| Скислоты |
| Ссоли | ||
где Скислоты – концентрация кислоты, Ссоли – концентрация соли.
Концентрация ионов водорода в таком растворе определяется только соотношением концентраций кислоты и одноименной соли и не зависит от абсолютных значений концентраций. При разбавлении раствора значение рН практически не изменяется. Добавление небольшого количества сильной кислоты или щелочи также не приводит к заметному изменению рН таких растворов. Добавленные в раствор ионы H+ связываютсяацетат-ионами:
Ch4COO- + H+ = Ch4COOH,
ионы OH- - недиссоциированными молекулами уксусной кислоты CН3COOH:
OH- + Ch4COOH = h3O +Ch4COO-.
Аммиачный буферный раствор приготовляют смешением водного раствора аммиака и соли аммония.
NH 3  h3O
h3O Nh5 OH ,
Nh5 OH ,
Nh5Cl Nh5 Cl
Концентрацию ионов ОН− в растворе можно определить из уравнения:
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
studfiles.net
Ионное произведение воды. Водородный показатель
⇐ ПредыдущаяСтр 8 из 10Следующая ⇒Электростатическое взаимодействие полярных молекул воды приводит к их самоионизации: 2Н2О↔Н3О++ОН- или в упрощенной форме Н2О↔Н++ОН-;
Константа диссоциации воды весьма мала при 25°С
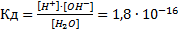
Принимая поэтому концентрацию воды [Н2О] величиной практически постоянной, можно записать К∙ [Н2О]=[Н+] ∙ [ОН-] = 1,8∙10-16[Н2О]. Но концентрация воды равна 1000/18=55,56 моль∙л-1, отсюда получаем
[Н+]∙[ОН-] = =1,8∙10-16∙55,56=1∙10-14=Кв.
Произведение концентраций ионов водорода и ионов гидроксида называется ионным произведением воды Кв. Ионное произведение водыесть величина постоянная при постоянной температуре. В чистой воде и нейтральных растворах[Н+]=[ОН-]=√10-14=10-7 моль∙л-1.
Математически более удобной характеристикой среды является водородный показатель рН, равный десятичному логарифму концентрации водородных ионов, взятому с обратным знаком: рН = -lg[Н+].
Тогда рН различных растворов будут иметь следующие значения:
кислый рН <7;
нейтральный рН = 7;
щелочной рН >7.
Аналогично, отрицательный десятичный логарифм концентрации гидроксо-ионов называется гидроксильным показателем и обозначается рОН. Следовательно,
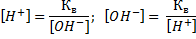
рН + рОН = 14.
Пример 1. Вычисление водородного показателя раствора.
Вычислите водородный показатель рН раствора гидроксида натрия, содержащегося в растворе в концентрации 4,2∙10-3 моль∙л-1 .
Решение. Концентрация ОН- ионов в растворе NaOH равна
[0Н-]=4,2∙10-3моль∙л -1. Исходя из ионного произведения воды Кв, находим концентрацию ионов водорода: [Н+]=КВ/[ОН-]=10-14/4,2∙10-3=0,24∙10-11. Водородный показатель раствора NaOH равен: рН= -lg([Н+])=-lg(0,24∙10-11)=11,62.
Пример 2.Определение концентрации ионов Н+ и ОН- в растворах сильных кислот и оснований.
Определите концентрацию ионов водорода и рН в 0,01 М раствора соляной кислоты.
Решение. Соляная кислота – сильный электролит, в растворе полностью диссоциирует на ионы: НС1  Н+ + С1-. Концентрация ионов [Н+] численно равна концентрации НС1. Из 0,01 моль НС1 образуется 0,01 моль иона Н+. Отсюда [Н+] =0,01∙10-2; рН=-lg(1∙10-2)=2.
Н+ + С1-. Концентрация ионов [Н+] численно равна концентрации НС1. Из 0,01 моль НС1 образуется 0,01 моль иона Н+. Отсюда [Н+] =0,01∙10-2; рН=-lg(1∙10-2)=2.
Пример 3. Вычисление рН сильного электролита с учетом его коэффициента активности.
Найдите водородный показатель раствора НNO3, если его молярная концентрация равна 0,178 моль∙л-1.
Решение. При значительной концентрации сильного электролита его активная концентрация существенно отличается от истинной. Поэтому в таких случаях нужно вводить поправку на активность электролита. Определяем ионную силу раствора НNO3: J= 1/2∙ (0,176∙I2 + 0,178∙I2) = 0,356/2 = 0,178.
Далее по вычисленной ионной силе находим коэффициент активности иона [Н+]= f(Н+)=0.838. Тогда активность ионов [Н+], а (Н+) =0,83∙0,178=0,148. Водородный показатель раствора НNO3 равен: рН = -lg а(Н+) = -lg 0,148=0,83.
Пример 4. Определение концентрации ионов Н+ и ОН- в растворах слабых кислот и оснований.
Концентрации [Н+] и [ОН-] ионов в растворах слабой кислоты и слабого основания могут быть вычислены, если известны их константы диссоциации. В общем виде формула для вычисления концентрации [Н+] в растворе слабой кислоты: 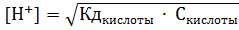
Концентрация ионов [Н+]и [ОН-] в растворе слабого основания может быть вычислена по формуле: 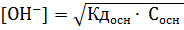 ; [Н+]= Кв/[ОН-];
; [Н+]= Кв/[ОН-];
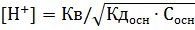 .
.
Определите концентрацию[Н+], [ОН-], рН, рОН, в 0,0М раствора муравьиной кислоты, если Кд(HCOOH)=2,1∙10-4
Решение:
[Н+]=√2,1∙10-4∙3∙10-2 = √6,3∙10-6= 2,5∙10-3 моль∙л-1;
рН= -lg 2,5∙10-3=3-lg 2,5 = 3-0,4= 2,6;
[ОН-]= Кв/[Н+]= 10-14/(2,5∙10-3)=4∙10-12 моль∙л-1;
рОН= 14-рН=14-2,6 = 11,4.
ГИДРОЛИЗ СОЛЕЙ
Под гидролизом понимают реакции обменного взаимодействия вещества с водой. Гидролиз является частным случаем сольволиза – обменного разложения растворенного вещества и растворителя. Процесс гидролиза в большинстве случаев обратим. Он происходит только в тех случаях, когда из ионов соли может образоваться хотя бы одно слабо диссоциирующее или труднорастворимое вещество. Образование такого вещества сопровождается связыванием одного из ионов, на которые диссоциирует вода, при этой происходит смещение равновесия этого процесса в сторону его усиления и изменение рН раствора. Различают три случая гидролиза.
1. Гидролиз по катиону. Характерен для солей, образованных слабым основанием и сильной кислотой (например, NН4Сl, Al(NO2)3, CuSO4 и др.). Рассмотрим гидролиз хлорида аммония NН4Сl. Анионы Сl, образующиеся при диссоциации NН4Сl= NН4 + + Сl-, не связывают ионов водорода, так как НС1 – сильная кислота. Катионы NН4+ связывают ионы ОН- с образованием слабо диссоциирующего основания NН4СН по уравнению NН4+ +НОН  NН4ОН+Н+. При этом освобождаются ионы Н+, обеспечивающие кислую реакцию среды (рН<7).
NН4ОН+Н+. При этом освобождаются ионы Н+, обеспечивающие кислую реакцию среды (рН<7).
Молекулярное уравнение гидролиза записывается в виде
NН4Сl+Н2О  NН4ОН+НСl.
NН4ОН+НСl.
Самым слабым электролитом в рассматриваемой системе является вода, поэтому равновесие смещено влево и гидролиз до конца не идет.
2. Гидролиз по аниону. Характерен для солей, образованных сильным основанием и слабой кислотой (например, КCN, СН3СООNа, Na2CO3, K2S и др.).
Рассмотрим гидролиз ацетата натрия СН3СООNа. Рассуждая аналогично первому случаю, приходим к выводу, что в данной соли гидролизуется анион СН3СОО- по уравнению:
СН3СОО- + НОН  СН3СООН + ОН-
СН3СООН + ОН-
Реакция среды щелочная (рН> 7).
Молекулярное уравнение реакции записывается следующим образом:
СН3СООNa + Н2О  СН3СООН + NaОН.
СН3СООН + NaОН.
3. Гидролиз по аниону и катиону. Характерен для солей, образованных слабым основанием и слабой кислотой.
Например, при гидролизе ацетата аммония Nh5Ch4COO и катион, и анион участвуют в процессе, образуя слабо диссоциирующие основание и кислоту:
Nh5+ +Ch4COO- + НОН  Nh5ОН + Ch4COOН.
Nh5ОН + Ch4COOН.
В этом случае реакция среды определяется относительной силой (константой диссоциации) образующихся основания и кислоты. Если основание и кислота одинаковы по силе, то константы диссоциации их равны и рН=7; если кислота сильнее основания, т.е. константа ассоциации кислоты больше константы диссоциации основания, то реакция среды слабокислая, и наоборот.
В зависимости от основности слабой кислоты, образующей соль, и кислотности слабого основания различают две формы гидролиза: простейший и ступенчатый.
Простейший гидролиз. Характерен для солей, образованных одноосновной слабой кислотой и (или) слабым многокислотным основанием (Nh5CN, Nh5Cl, NaCl, Ch4COONa, KNO2 и др.).
Ступенчатый гидролиз. Характерен для солей, образованных слабой многоосновной кислотой и (или) слабым многокислотным основанием (Na2CO3, K2S, (Nh5)2, FeCL3, CuSO4, CuCL2 и др.).
Гидролиз по катиону. Рассмотрим гидролиз FеС13. Катионы Fе3+,образующиеся при диссоциации молекул соли FеСl3=Fe3+ + 3Cl-, связывают ионы ОН- с образованием слабодиссоциирующих частиц, причем присоединение гидроксильных групп происходит постепенно,по ступеням:
1 ступень: Fе3+ + НОН  FеОН2+ + Н+
FеОН2+ + Н+
2 ступень: FeOh3+ + HOH  Fe(OH)2+ + H+
Fe(OH)2+ + H+
3 ступень: практически не протекает.
Накапливающиеся в системе ионы Н+ обеспечивают кислую реакцию среды и сильно смещают процесс диссоциации воды Н2О ↔ Н+ + ОН-влево, что приводит к ослаблению гидролиза на ступени 2, а поступени 3 гидролиз практически не идет.
Таким образом, гидролиз солей, образованных слабым многокислотным основанием и сильной кислотой, протекает ступенчато с образованием основных солей. Молекулярные уравнения:
1 ступень: FeCl3 + h3O  FeOh3+ + H+
FeOh3+ + H+
2 ступень:FeOHCl2+ h3O  Fe(OH)2Cl + HCl
Fe(OH)2Cl + HCl
3 ступень: практически не идет.
Гидролиз по аниону. Рассмотрим гидролиз соли Na2S. Анионы S2-, образующиеся при диссоциации соли Na2S  2Na+ + S2-, связывают ионы Н+ с образованием слабо диссоциирующих частиц. Присоединение Н+ происходит постепенно:
2Na+ + S2-, связывают ионы Н+ с образованием слабо диссоциирующих частиц. Присоединение Н+ происходит постепенно:
1 ступень: S2- + НОН  HS- + OH-
HS- + OH-
2 ступень: HS- + HOH  h3S + OH-
h3S + OH-
Накапливающиеся в системе ионы OH- обеспечивают щелочную реакцию среды и ослабляют течение гидролиза по ступени 2.
Таким образом, гидролиз солей, образованных сильным основаниеми слабой многоосновной кислотой, протекает ступенчато с образованием кислых солей. Молекулярное уравнение:
1 ступень: Na2S + h3O  NaHS + NaOH
NaHS + NaOH
2 ступень: практически не идет.
Полный необратимый гидролиз. Некоторые соли, образованные очень слабым основанием и слабой летучей кислотой (Cr2S3, Cr2(CO3)3, Fe2(CO3)3, Al2(CO3)3 и др.), подвергаются полному необратимому гидролизу. При этом образуется слабо диссоциирующие основание и кислота. Оба продукта уходят из сферы реакции в виде осадков и газов. Аналогично гидролизируются смеси солей, одна из которых образована очень слабым основанием и сильной кислотой, а другая – сильным основанием и слабой летучей кислотой (Na2S+CrCl3 , Na2CO3 + Al2(SO4)3 и т.п.). Например:
2AlCl3 + 2Na2S + 6h3O = 2Al(CO)3↓+ 3h3S↑ + 6NaCl
Количественными характеристиками процесса гидролиза служат степень и константа гидролиза.
Таблица 5
Примеры сильных и слабых кислот и оснований
| Кислоты | Основания | |||
| Сильные | Средней силы | Слабые | Сильные | Слабые |
| HCL | h4PO4 | HCN | Гидроксиды щелочных металлов (KOH, NaOH, ZiOH), Ba(OH)2 и др. | Na4OH и нерастворимые в воде основания (Ca(OH)2, Zi(OH)2, AL(OH)3 и др. |
| HBr | h3SO3 | HNO2 | ||
| HI | HP | h3CO3 | ||
| HNO3 | h3S | |||
| h3SO4 | Ch4COOH | |||
| HMnO4 | HCIO | |||
| HCLO4 |
Константа гидролиза равна отношению произведения концентрацийпродуктов гидролиза к концентрации негидролизованной соли.
Пример 1. Вычислить степень гидролиза Nh5Cl.
Решение: Из таблицы находим Кд(Nh5ОН)=1,8∙10-3, отсюда
Кγ=Кв/Кдк= =10-14/1,8∙10-3= 5,56∙10-10.
Пример 2. Вычислить степень гидролиза ZnCl2 по 1 ступени в 0,5 М растворе.
Решение: Ионное уравнение гидролиза Zn2 + h3O  ZnOH+ + H+
ZnOH+ + H+
KдZnOH+1=1,5∙10-9; hγ=√(Кв/ [Кдосн∙Cм]) = 10-14/1,5∙10-9∙0,5=0,36∙10-2 (0,36%).
Пример 3.Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: a) KCN; б) Na2CO3; в) ZnSO4. Определите реакцию среды растворов этих солей.
Решение: а) Цианид калия KCN — соль слабой одноосновной кислоты (см. табл. I приложения) HCN и сильного основания КОН. При растворении в воде молекулы KCN полностью диссоциируют на катионы К+ и анионы CN-. Катионы К+ не могут связывать ионы ОН- воды, так как КОН — сильный электролит. Анионы же CN- связывают ионы Н+ воды, образуя молекулы слабого элекролита HCN. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза
CN- + Н2О  HCN + ОН-
HCN + ОН-
или в молекулярной форме
KCN + Н2О  HCN + КОН
HCN + КОН
В результате гидролиза в растворе появляется некоторый избыток ионов ОН-, поэтому раствор KCN имеет щелочную реакцию (рН > 7).
б) Карбонат натрия Na2CO3 — соль слабой многоосновной кислоты и сильного основания. В этом случае анионы соли СО32-, связывая водородные ионы воды, образуют анионы кислой соли НСО-3 , а не молекулы Н2СО3, так как ионы НСО-3 диссоциируют гораздо труднее, чем молекулы Н2СО3. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза
CO2-3+h3O  HCO-3 +ОН-
HCO-3 +ОН-
или в молекулярной форме
Na2CO3 + Н2О  NaHCO3 + NaOH
NaHCO3 + NaOH
В растворе появляется избыток ионов ОН-, поэтому раствор Na2CO3 имеет щелочную реакцию (рН > 7).
в) Сульфат цинка ZnSO4 — соль слабого многокислотного основания Zn(OH)2 и сильной кислоты h3SO4. В этом случае катионы Zn+ связывают гидроксильные ионы воды, образуя катионы основной соли ZnOH+. Образование молекул Zn(OH)2 не происходит, так как ионы ZnOН+ диссоциируют гораздо труднее, чем молекулы Zn(OH)2. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза
Zn2+ + Н2О  ZnOН+ + Н+
ZnOН+ + Н+
или в молекулярной форме
2ZnSO4 + 2Н2О  (ZnOH)2SO4 + h3SO4
(ZnOH)2SO4 + h3SO4
В растворе появляется избыток ионов водорода, поэтому раствор ZnSO4 имеет кислую реакцию (рН < 7).
Пример 4.Какие продукты образуются при смешивании растворов A1(NO3)3 и К2СО3? Составьте ионно-молекулярное и молекулярное уравнение реакции.
Решение. Соль A1(NO3)3 гидролизуется по катиону, а К2СО3 — по аниону:
А13+ + Н2О  А1ОН2+ + Н+
А1ОН2+ + Н+
СО2-3 + Н2О  НСО- з + ОН-
НСО- з + ОН-
Если растворы этих солей находятся в одном сосуде, то идет взаимное усиление гидролиза каждой из них, ибо ионы Н+ и ОН-образуют молекулу слабого электролита Н2О. При этом гидролитическое равновесие сдвигается вправо и гидролиз каждой из взятых солей идет до конца с образованием А1(ОН)3 и СО2 (Н2СО3). Ионно-молекулярное уравнение:
2А13+ + ЗСО2-3 + ЗН2О = 2А1(ОН)3 + ЗСО2
молекулярное уравнение: ЗСО2 + 6KNO3
2A1(NO3)3 + ЗК2СО3 + ЗН2О = 2А1(ОН)3
Произведение растворимости. Примеры решения задач
Гетерогенное равновесие "осадок ↔ насыщенный раствор" подчиняется правилу произведения растворимости, если малорастворимыйэлектролит диссоциирует по уравнению AmBn  [А+]m - [B-]n. Отсюда вытекают два следствия:
[А+]m - [B-]n. Отсюда вытекают два следствия:
1. Условие растворения осадка. Произведение концентраций ионов, возведенных в степень стехиометрических коэффициентов, должно быть меньше величины произведения растворимости:[А+]m[B-]n<ПР (AmBn).
2. Условие осаждения осадка. Произведение концентраций ионов,возведенных в степень их стехиометрических коэффициентов, должнобыть больше величины произведения растворимости: [А+]m[B-]n>Пр(AmBn).
Пример 1. Определение условий выпадения осадка. Образуется ли осадок СаСО3 при смешивании равных объемов 0,02 М растворов хлористого кальция и углекислого натрия? (Пр(СаСО3) = 1,0∙10-3)
Решение: При смешении равных объемов растворов CaCI2 и Na2CO3 объем смеси увеличивается в 2 раза, а концентрация каждого из ионов уменьшается в 2 раза. Следовательно,
[CaCI2]= [Ca+2] = 0,02∙0,5=1∙10-2 моль∙л-1.
[Na2CO3] = [CО32-] = 0,2∙0,5 = 1∙10-2 моль∙л-1.
Откуда [Ca+2]∙[CО32-]= 1∙10-2 ∙1∙10-2 = 1∙10-4 . Осадок образуется, так как 1,0∙10-3< 1∙10-4.
Пример 2. Вычисление концентрации ионов малорастворимого электролита в его насыщенном растворе.
Произведение растворимости BaF2 при 18ºС равно 1,7∙106. Рассчитайте концентрацию ионов Ba+2 и F- в насыщенном растворе BaF2 при этой температуре.
Решение: BaF2 диссоциирует по уравнению BaF2 Ba+2 + 2F-. При диссоциации BaF2 ионов F-1 получается в 2 раза больше, чем ионов Ba+2. Следовательно, [F-1] = 2[Ва+2]. Произведение растворимости соли ПР(BaF2)=[Ва+2]∙[F+]. Выразим концентрацию ионов Ва+2, тогда
Ba+2 + 2F-. При диссоциации BaF2 ионов F-1 получается в 2 раза больше, чем ионов Ba+2. Следовательно, [F-1] = 2[Ва+2]. Произведение растворимости соли ПР(BaF2)=[Ва+2]∙[F+]. Выразим концентрацию ионов Ва+2, тогда
ПР (BaF2) = [Ва+2] ∙ 2∙ [Ва+2]2 = 4[Ва+2]3= 1,7∙10-6
Концентрация ионов [Ва+2] равна: [Ва+2]= √1,7∙10-6 / 4 = 0,75∙10-2 моль∙л-1;
Концентрация ионов F-1 равна: [F-1]=0,75∙10-2∙2=1,5∙10-2 моль∙л-1;
Пример 3. Вычисление произведения растворимости малорастворимого электролита.
Растворимость Ag3PO4 в воде при 20ºС равна 0,0065 г∙л-1. Рассчитайте значение произведения растворимости.
Решение. Растворимость Ag3PO4 в моль∙л-1 равна:
Р=6,5∙10-3/418,58 = 1,6∙10-5 моль∙л-1.
При диссоциации 1 моль Ag3PO4 образует 3 моль ионов Ag+. 1 моль ионов PO43-, поэтому концентрация ионов PO43- равна растворимости Ag3PO4, а концентрация иона Ag+ в 3 раза больше, т.е.
С[PO43-] =1,6∙10-5моль∙л-1. [Ag+]= 3∙1,6∙10-5.
Произведение растворимости Ag3PO4 равно:
ПР=[Ag+]3 + [PO43-]= (4,8∙10-5)3∙1,6∙10-5= 110,6 ∙10-15∙1,6∙10-3= 1,77∙10-18.
Пример 4. Определение условий одновременного выпадения осадков солей из раствора.
При каком соотношении концентрации ионов Zn+2Cd+2 в растворе прибавление к нему раствора Na2CO3 вызывает одновременное осаждение карбонатов этих ионов? ПР(ZnCOз)= 6∙10-11
Решение. Концентрацию вводимых карбонат-ионов обозначим через[СО32- ], тогда
[Zn+2]=ПР(ZnCOз) / С(СО32-), [Cd+2] = ПР (CdСОз)/[СО32- ].
[Zn+2]/[Cd+2] = ПР(ZnCOз)/ПР (CdСОз)=6∙10-11/2,5∙10-14=2,4∙103=2400
Карбонаты цинка и кадмия будут выпадать одновременно из раствора, если [Zn+2] >[Cd+2] в 2400 раз. Если отношение [Zn+2] /[Cd+2] > 2400, то первым из раствора будет выпадать ZnCO3, до тех пор, пока отношение [Zn+2] /[Cd+2] не будет равным 2400. И только после этого начнется одновременное выпадение осадков. Если же отношение концентрации ионов цинка и кадмия меньше 2400, то первым начнет осаждаться карбонат кадмия. Осаждение карбоната кадмия будет протекать до тех пор, пока отношение [Zn+2] /[Cd+2] не достигнет значения, при котором ZnCOз и CdСОз будут осаждаться одновременно.
Пример 5. Вычисление растворимости электролита по величинепроизведения растворимости.
Произведение растворимости ПР оксалата бария ВаС2О4 равно1,62∙10-1. Вычислите растворимость ВаС2О4 в воде.
Решение. В растворе труднорастворимого сильного электролитаВаС2О4 существует равновесие: ВаС2О4= Ва+2 + (С2О42-).
ПрВаС2О4= [Ва+2] ∙ [С2О42-]
в осадке в растворе
Так как оксалат бария диссоциирует на два иона, то его концентрация в растворе равна концентрации каждого из ионов, т.е.
[ВаС2О4] = [Ва+2] = [С2О42-] = √1,62∙10-7 = 0,4∙10-3моль-л-1,
т.е. растворимость оксалата бария в воде при t =20°С равна 0,4∙10-3моль-л-1.
ЖЕСТКОСТЬ ВОДЫ
В природной воде содержатся различные по растворимости соли.Если в воде содержится большое количество солей кальция или магния, то такая вода называется жесткой в отличие от мягкой воды,в которой таких солей мало или они отсутствуют. Суммарное содержание в воде солей кальция и магния называется общей жесткостью.Она подразделяется на карбонатную и некарбонатную.
Карбонатная жесткость обусловлена содержанием гидрокарбонатовкальция и магния; некарбонатная – содержанием сульфатов или хлоридов кальция и магния.
Вода, обладающая карбонатной жесткостью, при кипячении даетосадок, состоящий в основном из карбоната кальция СаСО3
Са(НСС3)2 → СаСО3↓ + СО2↑ + Н2О
Карбонатная жесткость относится к временной жесткости, количественно она характеризуется содержанием гидрокарбонатов, удаляющихся при кипячении воды в течение одного часа. Жесткость, остающаяся после такого кипячения, называется постоянной жесткостью.
Сумма миллиэквивалентов ионов магния и кальция, содержащаясяв 1 литре воды, определяет ее жесткость. Один миллиэквивалент жесткости соответствует содержанию 20,04 мг/л [Са2+] или 12,16 мг/л [Mg2+].Жесткость природной воды в разных водоемах различна и колеблется в течение года. Из Европейских рек наибольшую жесткость воды имеет Волга (общая - 5,9; карбонатная - 3,5 мэкв/л), наименьшую - Нева (общая 0,5; карбонатная - 0,5 мэкв/л). Жесткость Москвы-реки - общая - 4,2, карбонатная 4,1 мэкв/л.
Жесткая вода непригодна для технических целей. Для уменьшенияжесткости используют методы водоумягчения:
- осаждение катионов Са2+ и Mg2+кипячением или добавлениемхимических реагентов ( Na2CO3) ;
- ионный обмен (воду пропускают последовательно через слойкатионита и слой анионита).
Пример 1. Вычислите жесткость воды, зная, что в 500 л ее со-держится 202,5 г Са(НСОз)2.
Решение. В 1л воды содержится 202,5 : 500 = 0,405 г Са(НСОз)2 , что составляет 0,405 : 81 = 0,005 эквивалентных масс или 5 мэкв/л.
81 г/моль - эквивалентная масса Са(НСОз)2. Следовательно, жесткость воды 5 мкэв.
Пример 2. Сколько граммов CaSO4 содержится в 1 м3 воды, еслижесткость, обусловленная присутствием этой соли, равна 4 мэкв?
Решение: Мольная масса CaSO4=136,14 г/моль; эквивалентнаямасса равна 136,14/2=63,07 г/моль. В 1 м3 воды жесткостью 4 мэкв содержится 4∙1000=4000 мэкв, или 4000∙68,07= 272280 мг= 272,280 г CaSO4 .
Пример 3. Какую массу соды надо добавить к 500 л воды, чтобыустранить ее жесткость, равную 5 мэкв?
Решение. В 500 л вода содержится 530 ∙ 5 = 2500 мэкв солей, обусловливающих жесткость воды. Для устранения жесткости следуетприбавить 2500 ∙ 53 = 132 500 мг = 132,5 г соды (53 г/моль - эквивалентная масса Na2CO3).
Пример 4. Вычислите карбонатную жесткость воды, зная, что на титрование 100 см3 этой воды, содержащей гидрокарбонат кальция,потребовалось 6,25 см3 0,08 н. раствора НС1.
Решение. Вычисляем нормальность раствора гидрокарбоната кальция. Обозначив число эквивалентов растворенного вещества в 1 л раствора, т.е. нормальность, через х, составляем пропорцию.
6,25/100=х/0,08, х= 0,005.
Таким образом, в 1 л исследуемой воды содержится 0,005∙1000 = 5 мэкв гидрокарбоната кальция или 5 мэквСа2+ ионов. Карбонатная жесткость воды 5 мэкв. Приведенные примеры решают, применяя формулу Ж =m/ЭV, где m- масса вещества, обусловливающего жесткость воды или применяемого для устранения жесткости воды, мг; Э - эквивалентная масса этого вещества; V - объем воды, л.
Решение примера 1. Ж =m/ЭV=202500/81∙500=5 мэкв. 81 - эквивалентная масса Ca(HCO3)2, равная половине его мольной массы.
Решение примера 2. Из формулы Ж =m/ЭV, m = 4∙68,07∙1000=272280 мг = =272,280 г. CaSO4.
Читайте также:
lektsia.com
Водородные ионы воды, концентрация - Справочник химика 21
КОНЦЕНТРАЦИЯ ВОДОРОДНЫХ ИОНОВ в ВОДНЫХ РАСТВОРАХ ЭЛЕКТРОЛИТОВ 1. КОНЦЕНТРАЦИЯ ВОДОРОДНЫХ ИОНОВ воды. ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ [c.94]Рассмотрим кратко диссоциацию воды и кислот, гидролиз солей а также способы вычисления концентрации водородных ионов этих электролитов в зависимости от их концентрации и от величины соответствующих констант. Слабые основания и их соли не рассматриваются подробнее, так как для них легко применить совершенно аналогичный способ расчета концентрации гидроксильных ионов. [c.292]
Увеличение концентрации водородных ионов вызывает соответствующее уменьщение концентрации гидроксид-ионов, и наоборот. Равновесие между ионами Н+ и ОН существует не только в воде, но и во всех водных растворах. Поэтому указанное соотношение может характеризовать кислотность и основность раз,-личных сред. [c.255]Однако подобный механизм взаимодействия окиси этилена с водой противоречит факту увеличения скорости реакции в присутствии водородных ионов, когда концентрация гидроксила понижается. [c.92]
Общую концентрацию водородных ионов составляют водородные ионы сильной кислоты плюс водородные ионы воды (их количество равно [ОН ]). Если раствор не слишком разбавленный (Сл>10 ./И), вторым членом можно пренебречь. [c.42]
Концентрация водородных ионов (pH воды) является одним из основных параметров десорбции сероводорода из воды. Влияние этого параметра изучалось на минерализованной сточной воде с заданной величиной pH при температуре 22° С и давлении перед соплом 3,75 кГ/см . [c.102]
Вернер назвал ангидрооснованиями соединения, которые в водном растворе связывают водородные ионы воды и вследствие этого сдвигают равновесие диссоциации воды до некоторой характерной для них предельной концентрации ОН -ионов. [c.69]
Определения показали, что ряд металлов (Ag, Си, d и дрЛ в широком диапазоне концентраций собственных ионов дает обратимые значения потенциалов, однако при очень низких концентрациях собственных ионов значения потенциалов перестают удовлетворять уравнению (63). Это объясняется участием в катодном процессе водородного иона воды [c.53]
В идеально чистой воде и в строго нейтральных разбавленных растворах электролитов концентрация водородных ионов равна концентрации гидроксильных ионов [Н+] = [0Н ]. [c.353]
Опуская слово концентрация и сохраняя квадратные скобки, всегда помнят, что при таком обозначении имеют в виду нормальную концентрацию водородных ионов или, что то же, концентрация выражена в молях на литр. Известно, что при тех же условиях для чистой воды можно принять, что [Н ] = [ОН ], т. е. концентрация водородных ионов равна концентрации гидроксильных ионов. Благодаря этому первое уравнение может быть записано так [c.32]
Определение активной реакции, или концентрации водородных ионов, воды обычно производится колориметрическим способом, [c.102]
Концентрация водородных ионов вод- [c.272]
Концентрация водородных ионов вод- 6,5—8,5 [c.272]
Метод определения pH (концентрации водородных ионов) водной вытяжки смазки заключается в извлечении дистиллированной водой кислых или щелочных соединений и в определении в водной вытяжке концентрации водородных ионов потенциометрическим способом. [c.180]
Развивая эту проблему, Филд провел производственные испытания и осуществил ряд экспериментальных измерений. Он нашел, что предложенная им система будет находиться под воздействием трех основных независимых переменных. Во-первых, pH на входе может изменяться (со скоростью 1 единица рН/л ин) между 1 и 13, т. е. концентрация водородных ионов меняется в 10 раз. Во-вторых, скорость потока сточных вод варьирует от 23 до 45 м /мин, и расход может изменяться в пределах всего указанного диапазона в течение 5 мин. Наконец, концентрация реагентов, используемых для нейтрализации, может изменяться на несколько процентов. [c.144]
Для правильного ведения технологического режима в производстве катализаторов и адсорбентов необходимо постоянно контролировать к нцентрацию водородных ионов (величину pH) золя и формовочной воды, а также концентрацию ПАВ (поверхностно-активного вещества). [c.148]
Здесь, как и ранее, мы пренебрегли учетом концентрации водородных ионов, образуемых в результате самодиссоциации воды. Проведенное рассмотрение остается достаточно строгим для большинства ситуаций, в том числе для всех рассматриваемых в данной главе. Более полный вывод можно найти в приложении 5.) [c.244]
Дистиллированная вода должна быть прозрачной бесцветной жидкостью, не имеющей запаха. Концентрация водородных ионов (pH) Должна составлять 5,4- 6,6. [c.18]
В настоящее время в Советском Союзе основной объем нефти добывают, применяя для заводнения нефтяных пластов сточную и минерализованную воду различных эксплуатационных горизонтов, а также пресную и морскую воду, которые транспортируют по трубопроводам большой протяженности. Концентрация водородных ионов в этих водах, как правило, отвечает нейтральным или близким к нейтральным средам, а один из основных коррозионных агентов в них — кислород. [c.160]
Чистая вода содержит ионы Н+ и ОН" в разных концентрациях, находящихся в равновесии с недиссоциированной водой (НаО Н+ + ОН"), поэтому можно рассчитать активность как водородного иона, так и гидроксид-иона, исходя из константы диссоциации, значение которой при 25 °С составляет 1,01.10" , [c.37]
В данное время все шире применяются приборы автоматического контроля таких показателей, как фракционный состав нефтепродуктов, вязкость, содержание воды и солей в нефтях, концентрация водородных ионов, состав углеводородных газов и т. д. Автоматизация [c.107]
В процессе диазотирования раствор должен иметь кислую ре-,ию, так как при более высоких значениях pH равновесие ион ния 7 амин смещается в сторону свободного основания, ко-значительно труднее растворяется в воде (за исключением аминов, содержащих карбоксильные или сульфогруппы), а реакционноспособные формы диазотирующего агента переходят в неактивные формы — свободную азотистую кислоту и нитрит-ион N0 (см. механизм диазотирования). Наконец, при небольших концентрациях водородных ионов образовавшееся диазосоединение реагирует с амином, образуя диазоаминосоединение [c.104]
Иногда, например при исследовании белков, оказывается необходимым создавать условия, в которых аминокислота при диссоциации дает одинаковую концентрацию как положительных (ЫН КСООН), так и отрицательных (Nh3R 00 ) ионов. В чистой воде такое условие невыполнимо, так как константы диссоциации обеих ступеней неодинаковы. Чтобы одну ступень дисссщиации усилить, а другую — подавить, необходимо создать в растворе соответствующую концентрацию водородных ионов, добанляя либо кислоту, либо основание. Значение pH, при котором амфолит образует одинаковые концентрации положительных и отрицательных ионов, называется изоэлектрической точкой. В изоэлектрической точке, очевидно, соблюдается условие [c.511]
Осадок должен быть практически нерастворим. Для уменьшения растворимости обычно употребляют избыток осадителя. Известно далее, что в большинстве случаев осадки являются солями слабых кислот, поэтому полнота осаждения их сильно зависит от концентрации водородных ионов в растворе. В некоторых случаях, как например, при осаждении сернокислого свинца, для уменьшения растворимости применяют спирт и другие органические растворители, в которых данное соединение меньше растворимо, чем в воде. [c.32]
Основания. Для вычисления pH оснований пользуются следующим соотношением. Из выражения ионного произведения воды видно, что концентрацию водородных ионов можно рассчитать, если известна концентрация гидроксильных ионов [c.295]
Умножив и разделив это выражение на величину концентрации водородных ионов и приняв во внимание формулу (3), а также ионное произведение воды, получим [c.296]
Отсюда следует, что алюминий наполовину переходит в окрашенный ком--плекс при концентрации водородных ионов, равной концентрации реактива, т. е, при [Н+]=[Н2АИ8]. Реактив мало растворим в воде кроме того, большой избыток реактива вво.дить неудобно, так как сам реактив окрашен. Если принять концентрацию реактива [НгАИз] равной приблизительно 10— моль л, то связывание половины алюминия в комплекс имеет место при рН 4. Более полное связывание алюминия требует повышения pH. Однако, как следует из р 3 =5,5, при pH 5,5 уже половина свободного реактива превращается в анион, окрашенный так же, как и комплекс алюминия с ализарином. [c.282]
Под концентрацией водородных ионов нодразуменают концентрацию с и о-бедных, не связанных с анионом водородных ионов ее отрицательный десятичный логарифм обозначают pH. Как известно, стенень диссоциации химически чистой воды чрезвычайно мала, следовательно, ничтожна в ней и концентрация свободных водородных ионов в литре воды содержится примерно 10" грамм-эквивалентов свободных Н-ионов и, конечно, столько же грамм-эквивалентов ОН -ионов Н2О 5 Н - -ОН для воды (при температуре 22° С) pH = 7. Произведение концентрации водородных и гидроксильных ионов в воде для каждой температуры — величина постоянная [Н ] [ОН ] = 10" (22° С). Поэтому в щелочных растворах, т. е, содержащих избыток ОН -ионов, концентрация Н -ионов 7, а в кислых, растворах наоборот pH[c.37]
Вода имеет нейтральную реакцию, потому что концентрация водородных ионов в ней равна концентрации гидрокси31ьных ионов. Всякий раствор, в котором концентрации водородных и гидроксильных ионов равны между собой, также имеет нейтральную реакцию. Раствор является кислым в том случае, когда в нем концентрация водородных ионов больше концентрации гидроксильных ионов, и щелочным в том случае, когда концентрация гидроксильных ионов преобладает над концентрацией ионов водорода. [c.84]
Имеется много патентов [131 на способы разрушения эмульсий Н/В при помощи кислот. Исследования Шеррика, изучавшего адсорбцию водородных ионов, происходящую при добавлении кислот к нефтяным эмульсиям, показали, что для полного деэмульгирования нужна определенная концентрация водородных ионов. Но эффективности действия кислоты можно расположить в следующий ряд НС1 > h3SO4 > Gh4 OOH. Он также обнаружил, что при использовании хлорного железа происходит адсорбция ионов, в результате чего эмульсия разделяется на два слоя. В некоторых случаях эмульсии нефти в воде хорошо разрушаются при добавлении солей с двух- и трехвалентными катионами (хлористый кальций, хлористый алюминий). [c.45]
Следует указать еще па опыты по определению концентрации водородных ионов в растворах NaOH в присутствии глицерина. Было найдено, что при прибавлении глицерина концентрация водородных ионов увеличивается, концентрация же гидрооксиль-ных ионов уменьшается. Вычисленная коистапта диссоциации воды в присутствии глицерина в щелочном растворе практически остается ностояиной нри различных коицентрациях глицерина. [c.176]
Более высокая, чем у спиртов, киелотноеть. меркаптанов становится понятной, если вспомнить, что водный раствор сероводорода характеризуется большей концентрацией водородных ионов, чем обычная вода. [c.154]
Для тех случаев, когда концентрацией водородных ионов воды моячно пренебречь сравнительно сЛдтИ //дд, только что написанное выражение мошет быть заменено более простым рН,—рН2 = 2.5. [c.21]
Тщательно исследовано образование и разложение этилсерной кислоты в водном растворе [172]. Более удовлетворительные значения константы равновесия получены при допущении, что серная кислота существует в виде дигидрата, а этилсерная кислота остается негидратировапной. Скорость образования эфира сильно уменьшается в присутствии воды [173]. Для выражения этой зависимости Кайлан предложил сложную эмпирическую формулу. Прибавление соляной кислоты к реакционной смеси увеличивает скорость этерификации в меньшей степени, чем это следовало бы ожидать в результате увеличения концентрации водородных ионов. [c.33]
Если обратиться к рассмотрению реакций ионного обмена, приведенных на стр. 8—9, то станет ясным, что при наличии в воде солей сильных кислот реакция Н-катионирования является обратимой, а при значительной концентрации таких солей в исходной воде эта реакция будет сильно затормаживаться действием образуюшдхся водородных ионов, обладающих сравнительно сильной энергией поглощения. При наличии же в исходной воде солей слабых кислот (например, бикарбоната кальция или магния) реакция Н-катионирования необратима вследствие того, что углекислота в основном выходит из сферы реакции. Поэтому противодействие Н-ионов в этом случае практически не имеет места. [c.19]
Водородный показатель. Постоянство ионного ироизведения воды позволяет вычислять концентрацию гидроксид-ионов ио величине концентрации ионов гидроксония и наоборот. Очевидно, что в чистой воде концентрации ионов 0Н+ и ОН одинаковы и равны 10- моль/л. В кислых растворах концентрация ионов ОН+ больще 10 , а ОН--—меньше моль/л. В щелочных растворах, наоборот, [ОН ] Ю моль/л. Соотношением этих концентраций и характеризуется кислотность и щелочность различных водных растворов. Однако поскольку неудобно применять числа с отрицательными показателями степени, для характеристики кислотности и щелочности водных сред используется не само значение концентрации иоиов гидроксония (для простоты нх обычно называют ионами водорода), а его десятичный логарифм, взятый с обратным знаком. Эта величина получила название водородного показателя и обозначается pH. Таким образом, [c.178]
Окисляемость воды обусловлена содержанием в воде органических примесей и определяется количеством миллиграммов перманганата калия,, израсходованного при кипячении 1 л воды с избытком К. 1и04 в течение 10 мин. Реакция воды — степень ее кислотности или щелочности — характеризуется концентрацией водородных ионов и определяется при помощи индикаторов, Реакция природных вод близка к нейтральной, pH колеблется в пределах 6,8—7,3, Реакция оборотных вод зависит от характера производства. При рНвода кислая, при рН> 7,5 вода щелочная. [c.25]
Гидролиз. Эфпры карбоновых и сульфокислот весьма сильно различаются по скорости гидролиза. Метиловый эфир бензол-сульфокпслоты реагирует с водой при комнатной температуре примерно в 15 раз скорее метплбепзоата [199]. Скорость гидролиза алкилсульфонатов мало изменяется нри повышении концентрации водородных ионов [200] раствора, тогда как для эфиров карбоновых кпслот скорость гидролиза имеет минимум в слабо кислой области. При нагревании метилового эфира бензолсульфокислоты даже с разбавленной соляной кислотой образуется значительное количество хлористого мети.ла [c.358]
Химическая очистка емкостей и трубопроводов из углеродистой стали включает в себя 1) очистку и обезжиривание прокачиванием 8—10-процентного раствора каустической соды при температуре около 65° С 2) промывку чистой водой 3) очистку от песка, ржавчины и окалины прокачиванием 10-процентного раствора соляной кислоты с добавкой 0,25— 0,50% бифтористого аммиака раствор, нагретый не менее чем на 65° С, должен циркулировать в трубопроводе 4 ч или более в зависимости от его состояния 4) просушку трубопровода сухим азотом 5) промывку его чистой водой до получения нейтрального значения показателя концентрации водородных ионов pH 6) нейтрализацию трубопровода 0,25-процентным раствором лимонной кислоты. Операция нейтрализации может быть заменена просушкой трубопровода горячим воздухом, наполнением его смазочным маслом и последующей продувкой горячим воздухом. [c.527]
В сильнощелочных растворах вследствие нйзкой концентрации в них водородных ионов на катоде происходит восстановление молекул воды [c.109]
chem21.info





















