Как получить из этана хлорэтан в органической химии. Хлорэтан вода
Хлорэтан в воде - Справочник химика 21
Хлорэтан (води, р-р) Этанол [c.577]Тетра-хлорэтан Г ексан Гептан Декан Додекан Тетрадекан Ацетон Бензол Вода Толуол Четыреххлористый углерод Этиленгликоль Вода Бензол Диэтиловый эфир Изоамиловый спирт Сероуглерод Хлороформ Этиловый спирт Вода Этиловый спирт Вода Бензол Вода [c.410]
Вода — ацетон или бутанон-2— хлорбензол, н-гептан или 1,1,2-трн-хлорэтан, [c.203]
Этилен с бромной водой, содержащей хлорид натрия, дает три продукта — 2-бромэтанол, 1-бром-2-хлорэтан и 1,2-дибромэтан [c.584]Свойство сухих ионообменников жадно поглощать воду применено для обезвоживания полярных и неполярных жидкостей [37]. С помощью сульфокатионита дауэкс-50 W в К-форме удалось понизить концентрацию воды, например, в этаноле и 1,1,1-три-хлорэтане менее чем до 10- %. [c.16]
Азеотропная отгонка применяется для очистки сточных вод, содержащих, например, хлорэтан, ароматические углеводороды, сложные эфиры и полиэфиры, фенол, акрилонитрил, бутилацетат [c.114]
Хорошо растворяется в углеводородах, спиртах, плохо растворяется в воде. Растворимость в воде при 20°С равна 0,05%. растворимость воды в пента-хлорэтане при 20°С равна 0,03 /о- [c.185]
Хлорэтан-1-сульфокислота получена с небольшим выходом действием сернистокислого натрия на хлористый этилиден [116]. В качестве побочных продуктов реакционная смесь содержит ацетальдегид и альдегидные смолы. Сульфохлорид образуется с выходом 50% нри хлорировании водной суспензии тритиоацетальдегида [69г, 117] или его раствора в ледяной уксусной кислоте. Кипящая вода гидролизует его в сульфокислоту. Кипящий метиЛовый спирт действует аналогичным образом, тогда как с кипящим этиловым спиртом сульфохлорид не реагирует для этой реакции необходима температура 130. Превращение сульфохлорида в кислоту происходит, вероятно, через промежуточное образование эфира [c.125]
ДИФТОРИ-ХЛОРЭТАН (хладон 142) СНзСРзС , л —130,8 °С, кип —9,2 С не раств. в воде КПВ 10,6— 15,1%. Получ. хлорированием 1,1-дифторэтана при УФ облучении. Хладагент. При высокой конц. оказывает удушающее действие. [c.186]
Синтез двухводного кристаллогидрата -окси-2-хлорэтан-сульфата натрия. В стакане емкостью 500 мл, снабженном мешалкой, растворяют 104 г М) сернистокислого кислого натрия в 160 мл воды. К полученному раствору добавляют концентрированный раствор хлорацетальдегида, содержащий по анализу 87,5 г [ М) димергидрата хлорацетальдегида. Раствор фильтруют, переносят в колбу Кляйзена и в вакууме (60—70 мм) при температуре не выше 40° отгоняют воду до образования сухого остатка. После высушивания в вакуум-эксикаторе над серной кислотой или пятиокисью фосфора получают около 180 г дигидрата 1-окси-2-хлорэтансульфоната натрия. Выход близок к количественному. [c.18]
В производственных (условиях, а также при изучении работы различных опытных адсорбционных установок для очистки сточных вод применяли в качестве экстрагентов адсорбированных веществ из углей хлористый метил в виде насыщенных паров в смеси с жидким конденсатом, хлорэтан, метанол, этанол, ацетон, бензол, хлорбензол, б)утилацетат и др. В большинстве случаев эти экстрагенты относятся к легковоспламеняющимся веществам, что препятствует их широкому применению. [c.121]
Бретчер [306] перегонял тетрахлорэтилен в вакуУме с целью избежать образования фосгена и сохранял его в темноте без доступа воздуха. Гринвальд [749] удалял 1,1,2-трихлорэтан и 1,1,1,2-тетра-хлорэтан из тетрахлорэтилена противоточным экстрагированием его смесями этилового спирта с водой. Очищенный препарат оказался более стойким по отношению к свету, теплу, влаге и окислению. [c.406]
Абгазы, очищенные от водорастворимых примесей, через холодильник 4 и газоотделитель поступают в колонну Гас-паряна 2, орошаемую водой. Из колонны 2 инертные газы и некоторые нерастворившиеся в кислоте примеси (хлорэтан, хлор) через холодильник 5 и газоотделитель 17 направляются в санитарную колонну. Очищенная соляная киспота из копонны [c.82]
При повышенных температурах пентапласт стоек к абгазам хлорирования этилового спирта (хлористый водород — 85—90%, хлор—5—10%, хлорэтил — 2—3%) до 45 °С, перхлорэтилену при 50 °С, спиртовой адсорбции хлора (сумма альдегидов по хлоралю 8—10%, соляная кислота 10—15%, вода 10%, остальное — этанол) при 35—50 °С, полихлорпропану при 40 °С, четыреххлористому углероду при 40 С, смеси перхлорэтилена (42,5%) с четыреххлористым углеродом (53,8%) и хлорэтаном (3—5%) при наличии следов хлористого водорода и хлора при 40 °С, 25—30%-ной соляной кислоте при 40—100 С, соляной кислоте с примесью монохлоруксусной кислоты, фенолам и дихлорфенолам при 30—40 °С, хлористому водороду при 100 С, хлористому натрию при 90 °С. [c.272]
Для определения примесей в винилхлориде, получаемом в промышленности каталитическим газофазным гидрохлорированием ацетилена, были использованы методы газо-жидкостной хроматографии в сочетании с химическим микроанализом и ИК-снектро-скоиией. Хроматографический анализ с предварительным концентрированием примесей позволял количественно определять примеси в винилхлориде высокой чистоты на уровне до 5-10" — 5-10- %. В техническом винилхлориде обнаружено 26 примесей, из них идентифицировано 24 вода, железо, хлористый водород, ацетилен, метилацетилен, винилацетилен, хлорэтан, ацетальдегид, р-хлорпро-пилен, винилиденхлорид, транс-дихлорэтилен, г/ыс-дихлорэтилен, [c.169]
Роторно-щелевые = 25 мм с , = 35 мм (бензол, толуол, ди-хлорэтан, метилхлорвд — вода) [c.113]
С d 0,9542, n 1,4859, ц 7-10" Па-с раств. в воде, СП., ацетоне, ограниченно — в эф. вся 94 °С, т-ра самовоспламенения 365 С. Получ. взаимод. ЫНз с 1,2-ди-хлорэтаном хаталитич. взаимод. NHi с этаноламином под давл. На. Примен. в произ-ве ПАВ, ингибиторов коррозии, сукцинимидных присадок к моторным маслам, ионообменных смол, лек. ср-в отвердитель эпоксидных смол. Раздражает слизистые оболочки верхних дыхатеяьяых путей и кожу, поражает печень (ПДК в воздухе 2 мг/м в воде 0,7 мг/л). [c.194]Линии I — вода II — хлор 111—этан IV — этан (рециркуляция) V— винилхло-рид VI — этан, винилхлорид VII — хлорэтан, дихлорэтан VIII — хлорированные продукты IX — дихлорэтан X — хлористый этил XI — хлор XII — этан, этилен и хлорированные продукты XIII — трихлорэтан. [c.19]
Гидраты газов существуют в нескольких различных структурных формах [162]. Одну структуру образуют молекулы небольших размеров, например хлор, сернистый ангидрид, мегилмеркаптан, сероводород, бромметил, хлорметил, бром. Ячейка этой структуры содержит 48 молекул воды в ней имеется восемь полостей, в которых могут находиться связываемые в виде гидратов молекулы. Вторая структура наблюдается у гидратов более крупных молекул, таких как хлороформ, дихлорметан, хлорэтан. Элементарная ячейка этой структуры содержит 136 молекул воды в ней имеется восемь больших полостей п [c.122]
Конденсация с формальдегидом дает пблйацётали, трудно растворимые или совсем не растворимые в большинстве обычных органических растворителей, хотя они отлично растворяются в хлорированных углеводородах (хлороформ, тетра-хлорэтан, хлористый метилен и т. д.). Продукты конденсации с ацетальдегидом растворимы во всех обычных растворителях, но значительно сильнее набухают в воде. [c.363]
Позднее Смут и Бэбб [182] провели исследование массопередачи в ПСЭ ( )к = 0,05 м, Я=1,2 м, /1т = 40—60 мм, с о=1,5—3,0мм, уксусная кислота — вода и три-хлорэтан — ацетон — вода. Для смесительно-отстойного режима получено корреляционное уравнение [c.325]
Для газо-жидкостноп распределительной хроматографии применяют специальную аппаратуру, так же как и для адсорбционной хрохматографии газов, что позволяет проводить как качественный, так и количественный анализ. Приборы — хроматографы обеспечивают автоматизацию процесса анализа, например, прп газовом каротаже в нефтяной промышленности, при непрерывном анализе парафиновых углеводородов, при определении суммы всех горючих газов и их раздельном определении, при анализе нефтяных газов. Осуществляется непрерывный автохлгатический контроль и экспресс-анализ. При поточных процессах в промышленности осуществляется автоматический многокомпонентный анализ. Методы газовой хроматографии позволяют определять микро-количества п даже следы различных органических веществ, например при меси бензола и циклогексанола в толуоле и циклогек-сане, примесь метилового спирта в воде, изопропилового спирта в бензоле. В 99%-ном хлорэтане можно таким путем обнаружить примеси углеводородов и галоидонроизводных. Можно определять очень малые количества метана, окиси углерода, азота и кислорода в чистом этилене. С другой стороны, методы газовой хроматографии позволяют разделять большие количества веществ непрерывным процессом, нанример получать чистый ацетилен пз газовых смесей, содержащих мало ацетилена (метод непрерывной газовой хроматографии). Газовые хроматографы с программным управлением получили применение нри препаративном разделении смесей различных органических соединений. Их колонки обеспечивают высокую производительность, что очень важно при разделениях сложных по составу смесей углеводородов и др. Высокотемпературная хроматография позволяет при 500—600° С осуществлять программированное изменение температуры. [c.198]
При быстром методе по Tausz и Rumm y (см. стр. 542)32 в качестве жидкости для перегонки глицерина наиболее пригоден тетрахлорэтан. Вследствие его ядовитости недавно был предложен перхлорэтилен (т. кип. 119°). 33 Необходимо особенно следить за тем, чтобы насадка аппарата при перегонке была достаточно высокой для удержания увлекаемых паров глицерина, чтобы вода, собирающаяся над тетра-хлорэтаном, практически не содержала глицерина. Для определения берут 100 г глицерина и 150 г тетрахлорэтана, причем перегонка про- [c.559]
Отходящие пз хлоратора 1 газы, которые содержат непрореагн-ровавший этилен, воздух, пары дихлорэтана и хлористый водород, образовавшийся в результате реакции, поступают для выделения дихлорэтана в конденсатор смешения 3, смонтированный над холодильником 4. Прн этом газы, от.ходящие из верхней части конденсатора смешения 3 (пенрореагировавшпй этилен, воздух, газообразные примеси, содержащиеся в исходном хлоре и этилене), после отмывки водой от НС1 в скруббере 5 удаляются в атмосферу. В верхнюю часть конденсатора 3 подают из холодильника 4 охлажденный до —20° С дихлорэтан. Газы, попавшие в нилчасть конденсатора, о.хлаждаются. При этом газообразный ди.хлорэтан [c.88]
Свойства серовато-белый порошок уд. вес 1,29 т. пл. 135 —140°. Растворяется в бензоле и ди.хлорэтане слабо в ацетоне не растворяется в бенз15не, воде. [c.227]
Представляло интерес выяснить, что дает режим Кафарова на тонких лабораторных насадках. С помощью экспериментов сравнивали эффективности колонки диаметром 17 мм при режиме Кафарова и при пленочном режиме. Исследование проведено при использовании насадки четырех видов (стеклянные кольца Рашига диаметром 5,5 мм, одновитковые константановые спиральки Фен-ске диаметром 3,5 мм, одновитковые константановые кольца диаметром 1,8 мм, двух- и трехвитковые треугольники из них-ромовой проволоки с внутренней высотой треугольника 1,3 мм) на четырех бинарных системах четыреххлористый углерод — бензол, 1,2-ди-хлорэтан — бензол, ге-гептан — бензол и уксусная кислота — вода. [c.70]
ЭТИЛЕНХЛОРГИДРИН (1-окси-2-хлорэтан, Р-хлорэтиловый снирт, 2-хлорэтанол) СЮН3СН2ОН, мол. в. 80,517— бесцветная с эфирным запахом жидкость т. пл. —62,6°, т. К1Ш. 128,7°/760 мм, 60°/50 мм 1,20190 1,44197 смешивается с водой и многими органич. растворителями вязкость 3,913 спуаз (15°) теплота парообразования 9,901 ккал1молъ (т. КИН.) т. всп. 58,9° (в закрытом сосуде) диэлектрич. проницаемость 25,8 (25°) дипольный момент (20°) 1,75 В. Э. образует азеотропные смеси с водой, т. шш. 97,75/748 мм, 42,3% Э. с толуолом 106,05°, 31% циклогексаном и др. В пром-сти Э. получают иа этплена п хлора в водной среде [c.523]
На стадии пиролиза требуется очень чистый ДХЭ (не менее 99,5%). Если ДХЭ, полученный прямым хлорированием, удовлетворяет этим требованиям, то ДХЭ процесса оксихлорирования содержит в виде примесей этилхлорид, дихлорэтилены, три-хлорэтан, хлорметаны, хлораль и другие соединения. После объединения ДХЭ со всех стадий его промывают водой, затем раствором NaOH (каустическая сода) и подвергают ректификации, выделяя чистый ДХЭ, отделенный от легких и тяжелых примесей в двух колоннах. От следов хлорида железа (П1) ДХЭ очищают с помощью активированного угля, боксита, бентонита (Пат. 2652332, ФРГ, 1977 2540—332, 1977). Поскольку непревращенный ДХЭ на стадии пиролиза рециркулирует, то необходимо учесть примеси, появляющиеся в результате этого процесса (трихлорэтилен, хлоропрен). Их удаляют обработкой ДХЭ-рециркулята хлором, хлороводородом или гидрированием. [c.79]
В качестве растворителя для экстракции жиров может быть использован бензин, ди.хлорэтан, трихлорэтилен, гексан и др. На наших заводах преимущественно применяется бензин. Он хоро-. шо растворяет жир и меньше других растворителей извлекает " Ьежировые вещества. Недостатком является то, что он очень легко воспламеняется. В этом отношении имеют некоторое преимущество хлорированные углеводороды. Например, дихлорэта.ч при соприкосновении с пламенем сначала вспыхивает, а затем гаснет. Но дихлорэтан токсичнее, чем бензин. Он лучше растворяется в воде, за счет этого увеличиваются потери в производстве, и больше извлекает посторонних нежировых веществ И1 масличных семян. [c.8]
chem21.info
Хлорэтан (Хлорэтил): инструкция по применению, показания
Мощное наркотическое средство, применяемое для ингаляционного наркоза. Хлорэтан (хлорэтил) имеет отличительное свойство – при быстром развитии анестезии очень небольшое время действия.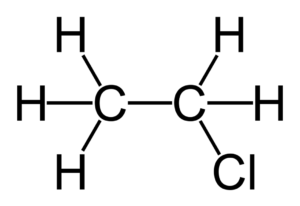
Главный недостаток препарата – небольшая терапевтическая широта, которая в разы повышает риск возникновения передозировки.
Именно поэтому хлорэтан в настоящее время очень редко используется для общей анестезии, разве что в случаях, когда оперативное вмешательство будет очень коротким.
Зато хлорэтил стал незаменимым средством для быстрого и кратковременного местного обезболивания кожных покровов.
Форма выпуска, состав и описание
Хлорэтил – прозрачная бесцветная жидкость со специфическим запахом, которая очень трудно растворяется в воде.
Активное действующее вещество – этилхлорид.
Выпускается в ампулах объемом 30 мл (по 10 штук в упаковке) и баллончиках-аэрозолях по 100 и 480 мл.
Фармакологическое действие
- Механизм действия препарата заключается в том, что при соприкосновении с кожными покровами анестетик начинает моментально испаряться (температура кипения этилхлорида 12 градусов по Цельсию). Это вызывает ощущение сильного охлаждения и приводит к ишемии тканей. За счет вышеописанной реакции и достигается эффект кратковременного обезболивания.
- Обезболивающий эффект развивается за 5-10 секунд и продолжается около 20 минут
- Анальгезия в этом случае обусловлена не угнетающим воздействием на центральную нервную систему, а нарушением синаптической передачи импульса
- При вдыхании этилхлорида наркоз наступает быстро, за 2 минуты, но и длится примерно столько же. При неграмотном использовании этого средства можно легко получить передозировку.
Показания
- Общий наркоз при кратковременных хирургических вмешательствах
- Обезболивание при ушибе мягких тканей, при растяжении связок и сухожилий. Широко используется для анальгезии спортивных травм
- Кожные реакции, которые сопровождаются невыносимым зудом
- Неврит
- Межреберная невралгия
- Ожоги, укусы насекомых
- Криотерапия при рожистых воспалениях, бородавчатых лишаях, нейромизитах, невралгиях
Противопоказания
Для общего наркоза
- Заболевания сердечнососудистой системы
- Почечная и печеночная недостаточность
- Нарушения работы органов дыхания
- Тяжелое состояние пациента
- Атеросклероз
- Алкоголизм
Для местного обезболивания
- Варикозное расширение вен
- Сосудистые спазмы
- Воспаление или нарушение целостности кожных покровов
Побочные действия
Наркоз: тошнота, рвота, головная боль, угнетение дыхательного центра
Местное обезболивание: гиперемия кожных покровов и нарушение их целостности с экссудацией
Инструкция по применению
Инструкция по применению хлорэтила подробно описывает способ применения и нужную дозу лекарства.
- С ампулы снимается резиновый колпачок, после чего хлорэтан несколько минут нагревается в ладони
- После чего ампула с хлорэтаном устанавливается на расстояние 30 сантиметров от места, где необходимо обезболивание
- Вытекающая из ампулы жидкость направляется непосредственно на кожу (на ней сразу же образуется иней, а ткани станут плотными и нечувствительными)
- Спрей с хлорэтан использовать легче, он наносится обычным для аэрозоля способом
Важно! Частота нанесения хлорэтана — не более раза в неделю.
Передозировка
Передозировка препаратом (во время введения в наркоз) о которой мы уже упоминали выше, имеет очень опасные симптомы. От тошноты, рвоты, головокружения и головной боли до угнетения и последующего паралича дыхательного центра. Если наблюдаются симптомы передозировки, пациента немедленно подключают к искусственной вентиляции легких.
vnarkoze.ru
Хлорэтан — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
Хлорэтан | ||
Хлорэтан (хлорэтил, лат. Aethylii chloridum) — бесцветный легкосжижаемый газ со слабым характерным запахом, огнеопасен. Применяется в медицине для анестезии методом сильного охлаждения, ранее иногда использовался для ингаляционного наркоза, и применяется в рекреационных целях, наподобие попперс и закиси азота.
Также известен как хладагент R-160.
Синонимы
Этилхлорид, Aether chloratus, Aethylis chloridum, Aethylium chloratum, Chelen, Chlorene, Chloretan, Ethylis chloridum, Ethyl chloride, Kelen, Хлористый этил, хлорэтан.
Общая информация
Хлорэтил является мощным наркотическим средством. При концентрации хлорэтила во вдыхаемой смеси 3—4 об. % наступает хирургическая стадия наркоза. Наркоз развивается быстро, в течение 2—3 мин, стадия возбуждения непродолжительна. Пробуждение наступает быстро.
Основной недостаток хлорэтила — малая терапевтическая широта и в связи с этим опасность передозировки.
В настоящее время хлорэтил применяют для наркоза редко (лишь при очень кратковременных оперативных вмешательствах), в основном он используется как местное средство для кратковременного поверхностного обезболивания кожных покровов.
При попадании на кожу он вызывает вследствие быстрого испарения сильное охлаждение кожи, ишемию и понижение чувствительности, что позволяет пользоваться им при небольших поверхностных операциях (разрезы кожи).
Кроме того, хлорэтилом пользуются для уменьшения кожного зуда, а также для лечения (криотерапия) рожистого воспаления, нейромиозитов, невралгий, термических ожогов, бородавчатой формы красного лишая, очаговой алопеции. Для этих целей с бокового капилляра ампулы с хлорэтилом снимают резиновый колпачок, согревают ампулу в ладони и выделяющуюся струю направляют на поверхность кожи (с расстояния 25—30 см). После появления на коже «инея» ткани становятся плотными и нечувствительными. В лечебных целях процедуры производят раз в день в течение 7—10 дней.
Применять хлорэтил следует с осторожностью: возможны гиперемия и повреждение целостности кожи с экссудацией.
Противопоказания
Противопоказаниями к применению являются нарушения целостности кожных покровов, заболевания сосудов (варикозное расширение вен, сосудистые спазмы). Больные не должны вдыхать хлорэтил, испаряющийся с поверхности кожи.
Физические свойства
Прозрачная, бесцветная, легко летучая жидкость своеобразного запаха. Трудно растворим в воде (приблизительно 1:50). Смешивается во всех соотношениях со спиртом и эфиром. Огнеопасен. Горит, окрашивая пламя в зелёный цвет. Плотность 0,919—0,923 (при 0 °C). Температура кипения +12—13°С.
Форма выпуска
Хранение
В прохладном, защищённом от света месте.
Напишите отзыв о статье "Хлорэтан"
Литература
Отрывок, характеризующий Хлорэтан
Управляющий не говорил, что это совершенно невозможно; он предлагал для достижения этой цели продажу лесов Костромской губернии, продажу земель низовых и крымского именья. Но все эти операции в речах управляющего связывались с такою сложностью процессов, снятия запрещений, истребований, разрешений и т. п., что Пьер терялся и только говорил ему: – Да, да, так и сделайте. Пьер не имел той практической цепкости, которая бы дала ему возможность непосредственно взяться за дело, и потому он не любил его и только старался притвориться перед управляющим, что он занят делом. Управляющий же старался притвориться перед графом, что он считает эти занятия весьма полезными для хозяина и для себя стеснительными. В большом городе нашлись знакомые; незнакомые поспешили познакомиться и радушно приветствовали вновь приехавшего богача, самого большого владельца губернии. Искушения по отношению главной слабости Пьера, той, в которой он признался во время приема в ложу, тоже были так сильны, что Пьер не мог воздержаться от них. Опять целые дни, недели, месяцы жизни Пьера проходили так же озабоченно и занято между вечерами, обедами, завтраками, балами, не давая ему времени опомниться, как и в Петербурге. Вместо новой жизни, которую надеялся повести Пьер, он жил всё тою же прежней жизнью, только в другой обстановке. Из трех назначений масонства Пьер сознавал, что он не исполнял того, которое предписывало каждому масону быть образцом нравственной жизни, и из семи добродетелей совершенно не имел в себе двух: добронравия и любви к смерти. Он утешал себя тем, что за то он исполнял другое назначение, – исправление рода человеческого и имел другие добродетели, любовь к ближнему и в особенности щедрость. Весной 1807 года Пьер решился ехать назад в Петербург. По дороге назад, он намеревался объехать все свои именья и лично удостовериться в том, что сделано из того, что им предписано и в каком положении находится теперь тот народ, который вверен ему Богом, и который он стремился облагодетельствовать. Главноуправляющий, считавший все затеи молодого графа почти безумством, невыгодой для себя, для него, для крестьян – сделал уступки. Продолжая дело освобождения представлять невозможным, он распорядился постройкой во всех имениях больших зданий школ, больниц и приютов; для приезда барина везде приготовил встречи, не пышно торжественные, которые, он знал, не понравятся Пьеру, но именно такие религиозно благодарственные, с образами и хлебом солью, именно такие, которые, как он понимал барина, должны были подействовать на графа и обмануть его. Южная весна, покойное, быстрое путешествие в венской коляске и уединение дороги радостно действовали на Пьера. Именья, в которых он не бывал еще, были – одно живописнее другого; народ везде представлялся благоденствующим и трогательно благодарным за сделанные ему благодеяния. Везде были встречи, которые, хотя и приводили в смущение Пьера, но в глубине души его вызывали радостное чувство. В одном месте мужики подносили ему хлеб соль и образ Петра и Павла, и просили позволения в честь его ангела Петра и Павла, в знак любви и благодарности за сделанные им благодеяния, воздвигнуть на свой счет новый придел в церкви. В другом месте его встретили женщины с грудными детьми, благодаря его за избавление от тяжелых работ. В третьем именьи его встречал священник с крестом, окруженный детьми, которых он по милостям графа обучал грамоте и религии. Во всех имениях Пьер видел своими глазами по одному плану воздвигавшиеся и воздвигнутые уже каменные здания больниц, школ, богаделен, которые должны были быть, в скором времени, открыты. Везде Пьер видел отчеты управляющих о барщинских работах, уменьшенных против прежнего, и слышал за то трогательные благодарения депутаций крестьян в синих кафтанах.wiki-org.ru
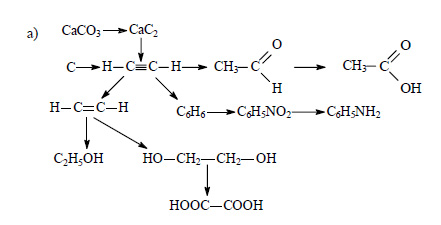
Составьте уравнения реакций по следующей схеме, отражающей генетическую связь между органическими и неорганическими веществами:
Ответ:
При сильном нагревании карбонат кальция разлагается на оксид кальция и оксид углерода (IV):
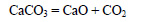
Оксид кальция при высокой температуре реагирует с углем с образованием карбида кальция:
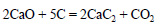
При действии на карбид кальция воды получается ацетилен:
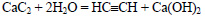
Этиловый спирт из ацетилена можно получить в две стадии. При гидрировании ацетилена в присутствии катализатора образуется этилен:
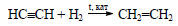
При присоединении к этилену воды в присутствии кислот образуется этиловый спирт.
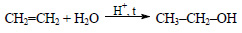
При окислении этилена раствором перманганата калия образуется этиленгликоль:
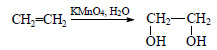
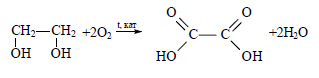
При окислении этиленгликоля образуется щавелевая кислота:
Ацетилен в присутствии сульфата ртути (II) присоединяет воду, образуется уксусный альдегид (реакция Кучерова):
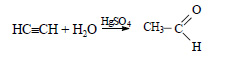
При окислении уксусного альдегида образуется уксусная кислота:

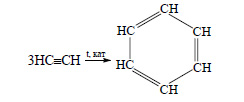
Из трех молекул ацетилена может образоваться молекула бензола (реакция тримеризации):
При действии на бензол смеси концентрированной азотной кислоты и концентрированной серной кислоты происходит замещение атома водорода на нитрогруппу и образуется нитробензол:
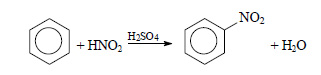
Нитробензол можно восстановить в аминобензол (анилин):

б)
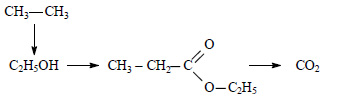
Из этана в две стадии можно получить этанол. При хлорировании этана образуется хлорэтан:
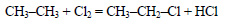
При действии на хлорэтан водного раствора щелочи происходит замещение атома хлора на гидроксильную группу и образуется этанол.

При реакции этанола с пропионовой кислотой образуется этилпропионат (этиловый эфир пропионовой кислоты):
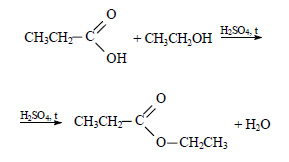
При сгорании этилпропионата образуется оксид углерода (IV). Молекулярная формула этилпропионата C5h20O2.

Оксид кальция при высокой температуре реагирует с углем с образованием карбида кальция:
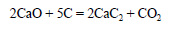
При действии на карбид кальция воды получается ацетилен:
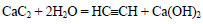
При хлорировании этана образуется хлорэтан:

При реакции хлорэтана с хлорметаном в присутствии натрия образуется пропан:
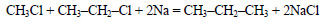
Из пропана в две стадии можно получить гексан. При хлорировании пропана образуется смесь изомеров – 1-хлорпропана и 2-хлорпропана. Изомеры имеют разные температуры кипения и их можно разделить перегонкой.
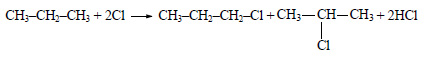
При взаимодействии 1-хлорпропана с натрием образуется гексан:
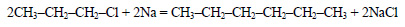
При взаимодействии 1-хлорпропана с натрием образуется гексан:

Бензол можно получить также при дегидрировании циклогексана:

г) Составьте уравнения реакций согласно второму форзацу учебника «Химия-11»:
При горении угля образуется оксид углерода (IV):

При реакции оксида углерода с гидроксидом кальция образуется оксид углерода (IV):

При сильном нагревании карбонат кальция разлагается на оксид кальция и оксид углерода (IV):
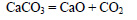
Оксид кальция образуется также при реакции кальция с кислородом:
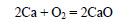
При реакции кальция с водой образуется гидроксид кальция:

При реакции кальция с соляной кислотой образуется хлорид кальция:

Из хлорида кальция можно получить кальций электролизом расплава:
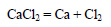
При реакции кальция или оксида кальция с углеродом при высокой температуре образуется карбид кальция:

При реакции карбида кальция с водой образуется ацетилен:
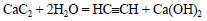
Ацетилен можно получить также из метана:
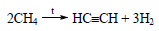
При разложении метана образуется также углерод:
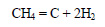
Синтез-газ можно получить, пропуская водяной пар через раскаленный уголь:

Синтез-газ получают также из смеси метана и кислорода при нагревании в присутствии катализатора. При этом протекают следующие реакции: часть метана сгорает с образованием оксида углерода (IV) и воды.

Затем образовавшиеся вода и оксид углерода (IV) взаимодействую с оставшимся метаном:
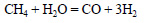
Из синтез-газа можно получить уксусный альдегид при помощи следующей последовательности реакций:
При пропускании синтез-газа над катализатором образуется метанол:
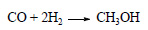
При действии на метанол хлороводорода в присутствии серной кислоты образуется хлорметан (метилхлорид):
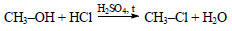
При взаимодействии хлорметана с натрием образуется этан (реакция Вюрца):
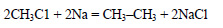
Из этана в две стадии можно получить этанол. При хлорировании этана образуется хлорэтан:
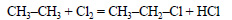
При действии на хлорэтан водного раствора щелочи происходит замещение атома хлора на гидроксильную группу и образуется этанол.

Этанол окисляется оксидом меди при нагревании в уксусный альдегид:

При гидрировании ацетилена в присутствии катализатора образуется этилен:
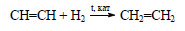
Наоборот, при дегидрировании ацетилена образуется этилен:

При присоединении к этилену воды в присутствии кислот образуется этиловый спирт.

При сильном нагревании этилового спирта с серной кислотой происходит дегидратация и образуется этилен:
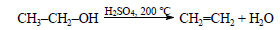
Ацетилен в присутствии сульфата ртути (II) присоединяет воду, образуется уксусный альдегид (реакция Кучерова):
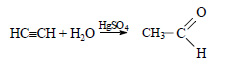
При окислении уксусного альдегида образуется уксусная кислота:
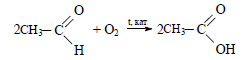
При восстановлении уксусного альдегида образуется этиловый спирт:
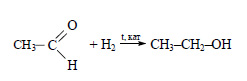
При реакции уксусной кислоты с этиловым спиртом образуется этилацетат:
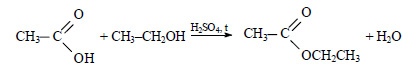
При горении этилацетата образуется оксид углерода (IV):

Из этилового спирта в присутствии катализаторов образуется 1,3-бутадиен:

При полимеризации бутадиена получается синтетический каучук.
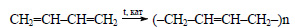
Ацетилен димеризуется с образованием винилацетилена.

При присоединении к винилацетилену хлороводорода образуется 2-хлорбутадиен-1,3 (хлоропрен), при полимеризации которого образуется хлоропреновый каучук.

При тримеризации ацетилена образуется бензол:

При реакции бензола с бромэтаном в присутствии катализатора образуется этилбензол (алкилирование бензола):
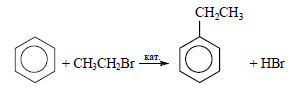
При дегидрировании этилбензола образуется винилбензол (стирол):
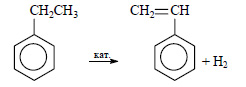
При полимеризации стирола образуется полистирол:

5terka.com
Хлорэтан этил хлористый - Справочник химика 21
Хлорэтан (этил хлористый) [c.404]Обычно трихлорэтилен производят из ацетилена через 1,1,2,2-тетра-хлорэтан. Для этого ацетилен хлорируют в растворе тетрахлорэтана при 80°, используя в качестве катализатора хлористую сурьму или хлорное железо. Чтобы избежать перегревов в местах высоких концентраций ацетилена и хлора, процесс проводят при очень энергичном перемешивании и тщательной регулировке температуры. При обработке кипящим известковым молоком 1,1,2,2-тетрахлорэтан теряет одну молекулу хлористого водорода. Отщепление хлористого водорода можно вызвать также нагреванием при 600°, а в присутствии хлористого бария — при более низкой температуре (230—320°) [9, 10] [c.168]
Хлорэтан см. Этил хлористый. [c.283]Хлорэтан, или хлористый этил, СгН С применяется в производстве тетраэтилсвинца РЬ (СгН ) , являющегося антидетонатором для моторного топлива. Хлористый метилен — негорючий и сильно летучий растворитель. [c.330]
Хлорэтил (хлорэтан, этилхлорид, этил хлористый) 0,2 с.-т. 4 [c.602]
Этил хлористый (хлорэтан) 0.10 [c.34]
Хлористый винил из дихлорэтана получают действием на хлорэтан спиртового раствора щелочи или каталитическим пиролизом его при высоких температурах. Первую реакцию проводят периодическим способом, загружая в реактор, снабженный мешалкой, обратным холодильником и обогревающей рубашкой, едкий натр (0,5 вес. части), этиловый спирт (0,5 вес. части) и дихлорэтан (1 вес. часть). В качестве побочных продуктов образуются этиленгликоль и следы ацетилена. Недостатком этого метода являются большой расход едкого натра и спирта и периодичность работы аппаратуры. [c.793]
Этилхлорид (хлорэтан) получают хлорированием этана при 400 °С или же присоединением хлористого водорода к этилену в присутствии хлорида алюминия. Служит местно-анестезирующим средством, в больших масштабах используется при синтезе антидетонационной присадки— тетраэтилсвинца (см. раздел 2.2.19.10). [c.299]
Фотохимическое хлорирование этана на свету при температуре 125—150°С позволяет получать преимущественно хлористый этил (хлорэтан) [c.102]
Хлорэтил Хлорэтан, этилхло-рид, этил хлористый 0,2 [c.19]
Попытки приготовления пентахлорэтана хлорированием в жидкой фазе симметричного тетрахлорэтана в присутствии катализаторов были безуспешныг, при этом всегда получался гексахлорэтан. Однако имеются указания, что пентахлорэтан может быть получен при хлорировании тетрахлорсоединения под влиянием химически активного света Физические свойства хлорпроизводных этана даны в таблице в гл. 20. Хлорэтан (этилхлорид, хлористый этил) представляет интерес с точки зрения возможного применения его для синтезов этилового спи рта и его производных. [c.779]
Этил хлористый СН3СН2С1 (хлорэтан). Характеристика. Газ ири охл аждении огущаётоя в жвдкость служит исходным материалом для получения тетраэтилсвинца используется для местной анестезии. [c.105]
Тетрахлорметан (четыреххлористый углерод) Хлорэтан (этилхлорид, хлористый этил) Трихлорэтен (трихлор-этилен) [c.9]
Хлорэтан-1-сульфокислота получена с небольшим выходом действием сернистокислого натрия на хлористый этилиден [116]. В качестве побочных продуктов реакционная смесь содержит ацетальдегид и альдегидные смолы. Сульфохлорид образуется с выходом 50% нри хлорировании водной суспензии тритиоацетальдегида [69г, 117] или его раствора в ледяной уксусной кислоте. Кипящая вода гидролизует его в сульфокислоту. Кипящий метиЛовый спирт действует аналогичным образом, тогда как с кипящим этиловым спиртом сульфохлорид не реагирует для этой реакции необходима температура 130. Превращение сульфохлорида в кислоту происходит, вероятно, через промежуточное образование эфира [c.125]
Хлористый этил (хлорэтан) С2Н5—С1 — газ, способный конденсироваться при небольшом давлении в жидкость, кипяш,ую при + 12,4°С. В больших количествах хлористый этил используется для получения антидетонатора — тетраэтилсвинца (ТЭС), в качестве этилирующего агента и в медицине (для местной анестезии). [c.97]
В производственных (условиях, а также при изучении работы различных опытных адсорбционных установок для очистки сточных вод применяли в качестве экстрагентов адсорбированных веществ из углей хлористый метил в виде насыщенных паров в смеси с жидким конденсатом, хлорэтан, метанол, этанол, ацетон, бензол, хлорбензол, б)утилацетат и др. В большинстве случаев эти экстрагенты относятся к легковоспламеняющимся веществам, что препятствует их широкому применению. [c.121]
Окислительное хлорирование этана приводит к получению хлорэтана. При увеличении избытка хлористого водорода и кислорода при температуре 300 °С можно получить до 40% дихлорэтана. При более высоких температурах (500 °С) выделяют смесь хлорэтанов и до 50% винилхлорида. [c.134]
Количество побочных продуктов может быть значительно кращено, если вести сульфирование в растворителе (лучше в, хлорэтане). При этом количество образующихся сульфохлори не превышает 4—5%. К тому же не происходит вспенивания м сы, легче отделяется хлористый водород. Сульфирование хл сульфоновой кислотой должно слагаться из двух стадий п текающего при низких температурах собственно процесса суль рования и выдержки, имеющей целью отдувку остатков хло стого водорода. Обе стадии могут осуществляться по непрерыв схеме при использовании одного секционированного сульфуратс Влияние условий сульфирования на изомерный состав образ щихся сульфокислот иллюстрируется данными табл. 4.2.2. [c.133]
Лейчер, Эмери, Бомфолк и Парк [824] измеряли энтальпию реакции между хлорэтаном и водородом с образованием этана и хлористого водорода ими получено значение АЯ/з д д) = = —25,8 ккал молъ. Кейси и Фордхам [199] на основании результатов измерения энтальпии сгорания получили значение д) = [c.583]
Линии I — вода II — хлор 111—этан IV — этан (рециркуляция) V— винилхло-рид VI — этан, винилхлорид VII — хлорэтан, дихлорэтан VIII — хлорированные продукты IX — дихлорэтан X — хлористый этил XI — хлор XII — этан, этилен и хлорированные продукты XIII — трихлорэтан. [c.19]
h4 h3 I Хлорэтан Хлористый этил, хлористоводородный эфир -138,7 12,2 0,910 [c.505]
Гексахлорэтан можно также получить пропусканием ацетилена в кипящую хлористую серу. Выход можно повысить, если в образующуюся при этом смесь пропускать попеременно хлор и ацетилен Тетрахлорэтан можно весьма быстро и почти количественно превратить в гексахлорметан действием хлора Г присутствии света — или от открытой дуговой лампы, или от лампы с парами ртути. В случае прекращения реакции в тот момент, когда введен приблизительно 10%-ный избыток хлора (в сравнении с требующимся для образования пентахлорэтана), можно получить в качестве промежуточного продукта пента-хлорэтан [c.515]
chem21.info
Как получить из этана хлорэтан в органической химии
Для того чтобы понять, как получить из этана хлорэтан, для начала проанализируем особенности предельного углеводорода этана.
Краткая характеристика этана
Данный углеводород имеет формулу С2Н6. Углероды в его молекуле находятся в sp3 гибридном состоянии. Это отражается на физических и химических свойствах данного вещества. При обычных условиях этан является газообразным веществом малорастворимым в воде. Как и все остальные представители класса алканов, этан имеет насыщенные простые связи. Это отражается на химических свойствах данного углеводорода. Он не способен вступать в реакции присоединения, для него допустимо только радикальное замещение.
Особенность протекания
Выясним, как получить из этана хлорэтан. Для этого необходимо провести реакцию между этаном и хлором при наличии кванта света (повышенной температуре). Благодаря гомолитическому разрыву связи образуются радикалы хлора. Для образования свободных радикалов необходима определенная затрата энергии.
Ее можно приобретать разными способами. В качестве одного из вариантов образования радикалов можно рассмотреть термический пиролиз. Чтобы из этана получить хлорэтан, уравнение записывается при температуре около 5000С. Той энергии, которая при этом будет выделяться, достаточно для разрыва связей. Вторым способом формирования активных радикалов является использование ультрафиолетового излучения.

Механизм реакции радикального замещения
Рассмотрим, как из этана получить хлорэтан. Уравнение реакции протекает по механизму SR-действия галогенов с алканами. В газовой фазе при реакции этана с хлором сначала происходят диссоциация хлора под действием УФ. Данную стадию называют инициированием, именно она характеризуется возникновением активных частиц-радикалов хлора. Образующиеся частицы атакуют молекулу этана, образуя хлороводород, а также радикал этил С2Н5.
Продолжим разговор о том, как получить из этана хлорэтан. На следующем этапе этильный радикал вступает во взаимодействие с молекулой хлора, образуя этанхлорид и еще один радикал хлора. Именно он способен заново вступать в реакцию, продолжая цикл цепной реакции. Данная стадия именуется ростом цепи. Количество активных радикалов на этом этапе взаимодействия не меняется, а сохраняется в полном объеме. В качестве завершения цикла выступает третий этап реакции, который называется обрывом цепи. Он подразумевает столкновения свободных частиц, в результате чего образуются продукты реакции.

Применение
Ответ на вопрос, как получить из этана хлорэтан. Остановимся на применении. Получаемый хлорэтил является серьезным наркотическим веществом. Его применяют в качестве наркоза при хирургических операциях. Достаточно двух-трех секунд для того, чтобы свести к минимуму двигательную активность.
В качестве основного недостатка данного вещества отметим возможность передозировки. Даже незначительное увеличение допустимой нормы вызывает серьезные проблемы для организма человека. В наши дни хлорэтан лишь в некоторых случаях применяют в качестве наркотического вещества.
В большей степени он востребован в качестве местного средства для кратковременного поверхностного обезболивания кожного покрова. Попадая на кожу, вещество испаряется, происходит переохлаждение кожи, понижается ее чувствительность, в результате чего возникает возможность проводить разрезы, то есть, осуществлять незначительные поверхностные операции.
Также данное вещество применяют для снижения кожного зуда, лечения термических ожогов, нейромиозитов, криотерапии воспаления. Ампулу сначала нагревают в ладони, затем направляют струю на кожу. Для лечебных целей процедура проводится один раз в день 7-10 дней.
fb.ru