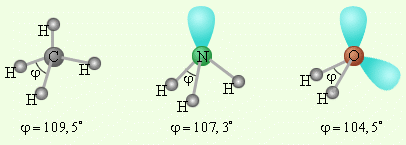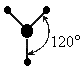Влияние гибридизации на свойства молекул. Структура воды. Гибридизация воды
Тип гибридизации атомов :: SYL.ru
В процессе определения геометрической формы химической частицы важно учитывать, что пары валентных электронов основного атома, включая и те, которые не образуют химической связи, находятся на большом расстоянии друг от друга в пространстве.
Особенности термина
Рассматривая вопрос, касающийся ковалентной химической связи, часто применяют какое понятие, как гибридизация атомных орбиталей. Этот термин связан с выравниванием формы и энергии. Гибридизация атомных орбиталей связана с квантово-химическим процессом перестройки. Орбитали в сравнении с исходными атомами имеют иное строение. Суть гибридизации заключается в том, что тот электрон, который располагается рядом с ядром связанного атома, определяется не конкретной атомной орбиталью, а их совокупностью с равным главным квантовым числом. В основном данный процесс касается высших, близких по энергии атомных орбиталей, имеющих электроны.
Специфика процесса
Типы гибридизации атомов в молекулах зависят от того, как происходит ориентация новых орбиталей. По типу гибридизации можно определить геометрию иона либо молекулы, предположить особенности химических свойств.
Типы гибридизации
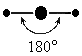
Такой тип гибридизации, как sp, представляет собой линейную структуру, угол между связями составляет 180 градусов. Примером молекулы с подобным вариантом гибридизации является BeCl2.
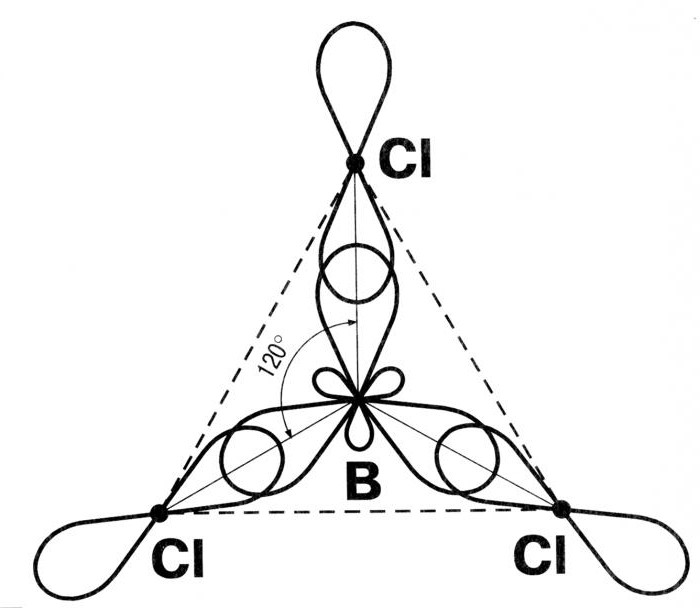
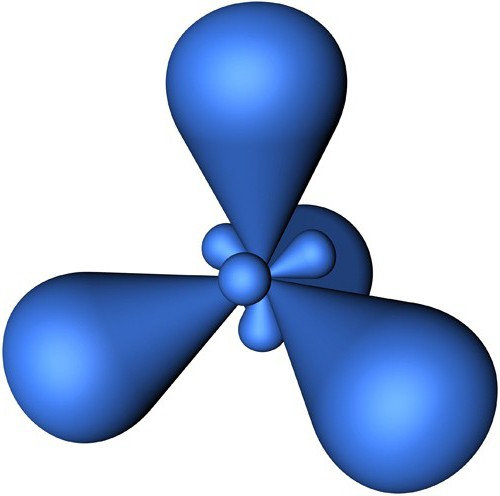
Следующий тип гибридизации – sp2. Молекулы характеризуются треугольной формой, угол между связями составляет 120 градусов. Типичным примером такого варианта гибридизации является BCl3.
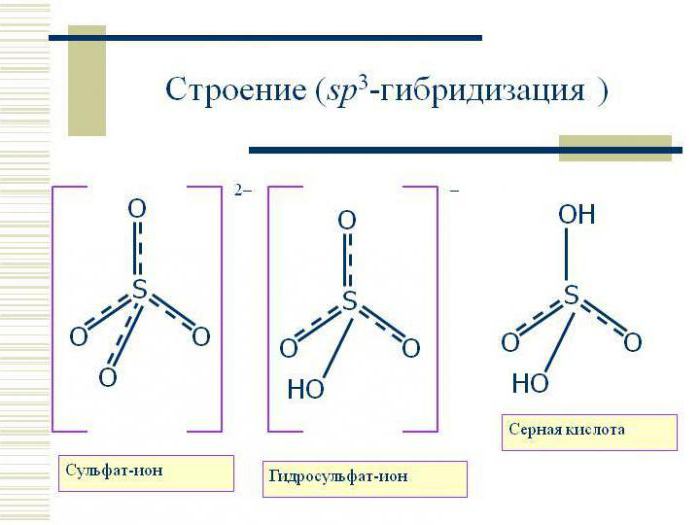
Тип гибридизации sp3 предполагает тетраэдрическое строение молекулы, типичным примером вещества с данным вариантом гибридизации является молекула метана Ch5. Валентный угол в таком случае составляет 109 градусов 28 минут.
В гибридизации принимают непосредственное участие не только парные электроны, но и неразделенные пары электронов.
Гибридизация в молекуле воды
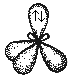
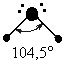
К примеру, в молекуле воды между атомом кислорода и атомами водорода существуют две ковалентные полярные связи. Кроме того, сам атом кислорода обладает двумя парами внешних электронов, которые не принимают участия в создании химической связи. Эти 4 электронные пары в пространстве занимают определенное место вокруг кислородного атома. Так как все они обладают одинаковым зарядом, в пространстве они отталкиваются, электронные облака находятся друг от друга на существенном расстоянии. Тип гибридизации атомов в данном веществе предполагает изменение формы атомных орбиталей, происходит их вытягивание и выстраивание к вершинам тетраэдра. В результате молекула воды приобретает угловую форму, между связями кислород-водород валентный угол составляет 104,5o.
Чтобы предсказать тип гибридизации, можно воспользоваться донорно-акцепторным механизмом образования химической связи. В результате осуществляется перекрытие свободных орбиталей элемента с меньшей электроотрицательность, а также орбиталей элемента с большей электрической отрицательностью, на которой находится пара электронов. В процессе составления электронной конфигурации атома учитывается их степень окисления.
Правила выявления вида гибридизации
Для того чтобы определить тип гибридизации углерода, можно использовать определённые правила:
- выявляют центральный атом, вычисляют количество σ-связей;
- ставят в частице степени окисления атомов;
- записывают электронную конфигурацию главного атома в требуемой степени окисления;
- составляют схему распределения по орбиталям валентных электронов, спаривая электроны;
- выделяют орбитали, которые принимают непосредственно участие в образовании связи, находят неспаренные электроны (при недостаточном для гибридизации количестве валентных орбиталей применяют орбитали следующего энергетического уровня).
Геометрия молекулы определяется типом гибридизации. На нее не влияет присутствие пи-связей. В случае дополнительного связывания возможно изменение валентного угла, причина состоит во взаимном отталкивании электронов, образующих кратную связь. Так, в молекуле оксида азота (4) при sp2-гибридизации происходит возрастание валентного угла со 120 градусов до 134 градусов.
Гибридизация в молекуле аммиака
Неразделенная пара электронов оказывает влияние на результирующий показатель дипольного момента всей молекулы. В аммиаке тетраэдрическое строение вместе с неразделенной парой электронов. Ионность связи азот-водород и азот-фтор имеют показатели 15 и 19 процентов, длины определены в 101 и 137 пм соответственно. Таким образом, в молекуле фторида азота должен быть больший дипольный момент, но результаты эксперимента свидетельствуют об обратном.
Гибридизация в органических соединениях
Для каждого класса углеводородов характерен свой тип гибридизации. Так, при образовании молекул класса алканов (предельных углеводородов) все четыре электрона атома углерода образуют гибридные орбитали. При их перекрывании образуется 4 гибридных облака, вытраиваемых к вершинам тетраэдра. Далее их вершины перекрываются с негибридными s-орбиталями водорода, образуя простую связь. Для насыщенных углеводородов характерна sp3-гибридизация.
У ненасыщенных алкенов (их типичным представителем является этилен) в гибридизации принимают участие только три электронных орбитали - s и 2 p, три гибридных орбитали образуют в пространстве форму треугольника. Негибридные p-орбитали перекрываются, создавая в молекуле кратную связь. Этот класс органических углеводородов характеризуется sp2-гибридным состоянием углеродного атома.
Алкины отличаются от предыдущего класса углеводородов тем, что в процессе гибридизации участвуют всего два вида орбиталей: s и p. Оставшиеся у каждого атома углерода два негибридных p-электрона перекрываются в двух направлениях, образуя две кратные связи. Данный класс углеводородов характеризуется sp-гибридным состоянием углеродного атома.
Заключение
Благодаря определению вида гибридизации в молекуле можно объяснить строение разных неорганических и органических веществ, предсказать возможные химические свойства конкретного вещества.
www.syl.ru
2.2. Гибридизация атомных орбиталей
Изучение таких молекул, как ВеСI2, BCI3 , СН4 , показало, что все связи в них равноценны, несмотря на то, что в образовании их участвуют различные орбитали центрального атома. Слейтер и Полинг объяснили это явление тем, что орбитали различной симметрии, не сильно отличающиеся по энергиям, образуют гибридные орбитали. 
Гибридизация - это процесс перераспределения электронных плотностей близких по энергии орбиталей, который приводит к их полной равноценности.
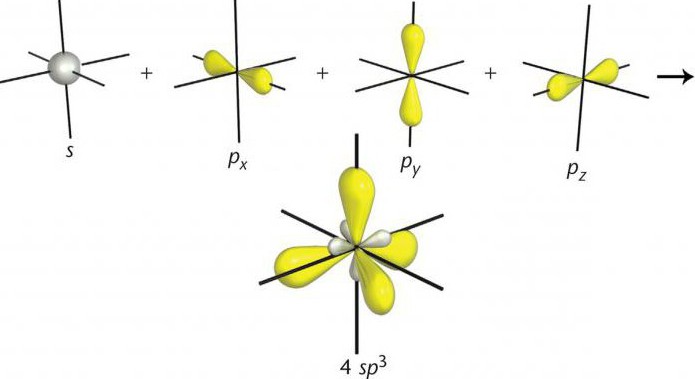
Число гибридных орбиталей равно числу орбиталей, участвующих в гибридизации. Гибридные орбитали более вытянуты в направлении образования химических связей и поэтому обусловливают лучшее перекрывание электронных облаков. По числу участвующих в гибридизации атомных орбиталей различают следующие, наиболее распространенные типы гибридизации: sp -, sр2 - и sр3.
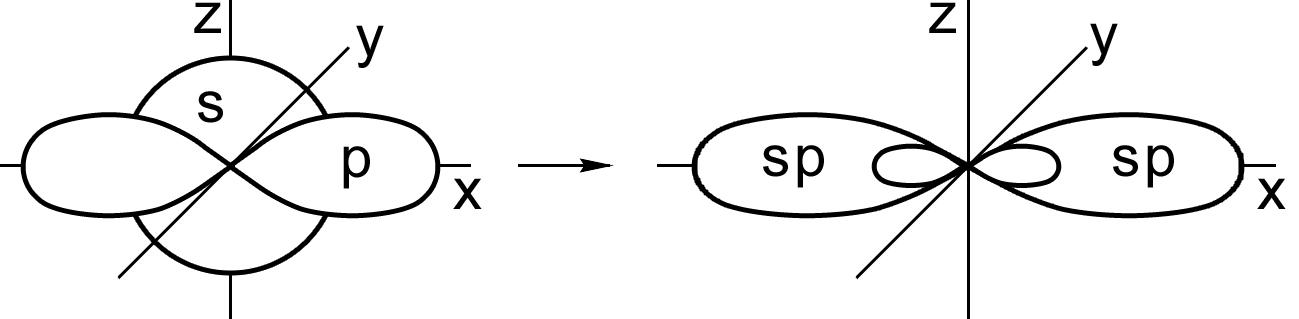
Гибридизация одной s - и одной р -электронных орбиталей приводит к образованию двух гибридных sp - орбиталей (рис. 9).
s – орбиталь и p - орбиталь → 2 гибридные sp -орбитали
Рис. 9. Образование sp - гибридных орбиталей
Относительно друг друга две гибридные sp - орбитали расположены под углом 180°, поэтому молекулы с таким видом гибридизации линейны, две связи в них расположены по прямой и противоположно направлены от ядра (рис. 10).
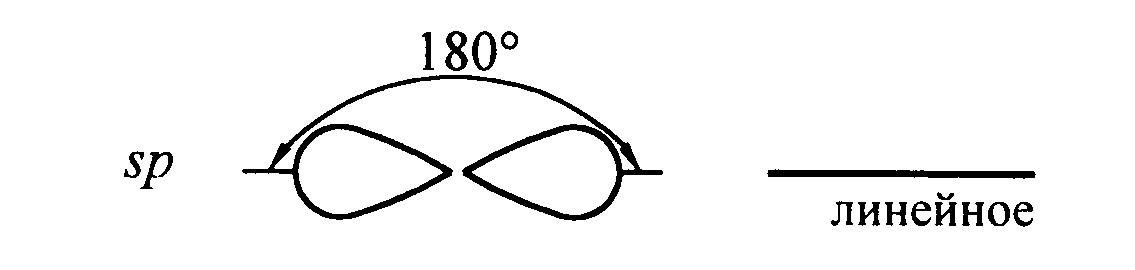
Рис. 10. sp – гибридизация
Гибридизация одной s - и двух р - электронных орбиталей приводит к образованию трех гибридных sр2 - орбиталей. Эти три гибридные орбитали расположены в одной плоскости и направлены в вершины равностороннего треугольника; углы между осями sр2 – гибридных орбиталей составляют 120° (рис. 11).
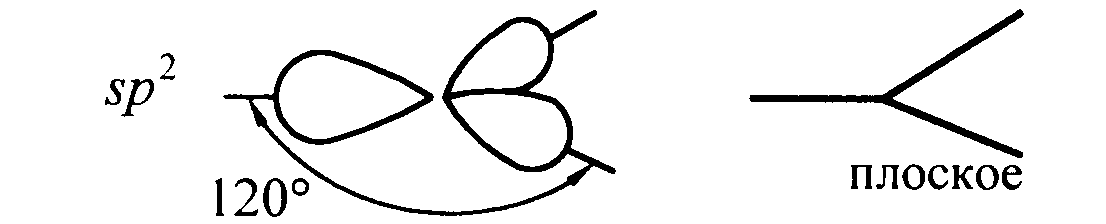
Рис. 11. sp2 - гибридизация
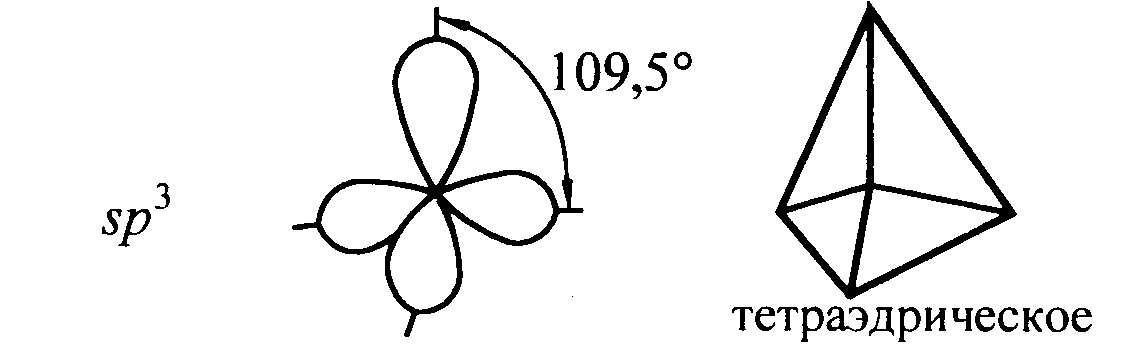
Рис. 12. sp3 - гибридизация
Гибридизация одной s - и трех р - электронных орбиталей приводит к образованию четырех гибридных sр3 - орбиталей. В этом случае четыре гибридные орбитали имеют оси, лежащие в пространстве под углами 109,5о; они направлены к вершинам правильного тетраэдра (рис. 12).
Таким образом, тип гибридизации определяется видом и количеством участвующих в гибридизации электронных орбителей (см. табл.6).
Таблица 6
Типы гибридизации и геометрия молекул
| Тип моле-кулы | Тип гибри-дизации | Число гибридных орбиталей атома А | Геометрия молекул | Валент-ные углы | Примеры |
| АВ2 | sp (s+p) | 2 | линейная | 180о | BeF2, CO2, C2h3 |
| АВ3 | sp2 (s+2p) | 3 | плоская | 120о | BCl3, AlF3, C2h5 |
| АВ4 | sp3 (s+3p) | 4 | тетраэдри-ческая | 109,5о | h3O, Nh4, Sih5, CCl4, Ch5, |
Пример 1. Перекрывание sp – гибридных орбиталей атома бериллия с 1s – АО двух атомов водорода приводит к образованию линейной молекулы гидрида бериллия Beh3; валентный уголH-Be-H в молекуле Beh3 равен 180о (рис. 13 ).
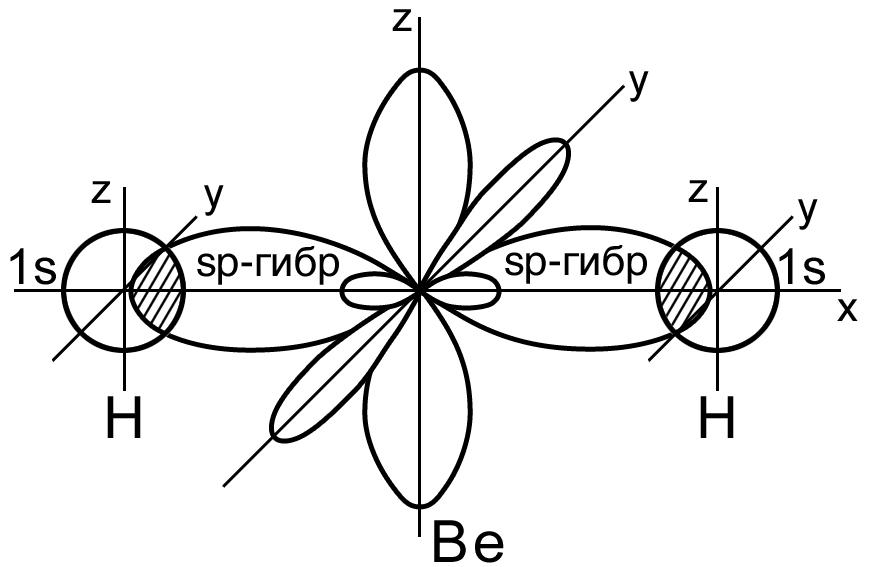
Рис. 13. Пространственная конфигурация молекулы Beh3
Пример 2. Перекрывание sp2– гибридных орбиталей атома бора с 1s – АО трех атомов водорода приводит к образованию треугольной (тригональной) молекулы гидрида бора Bh4; валентный уголH – B – H в молекуле Bh4 равен 120о (рис. 14).
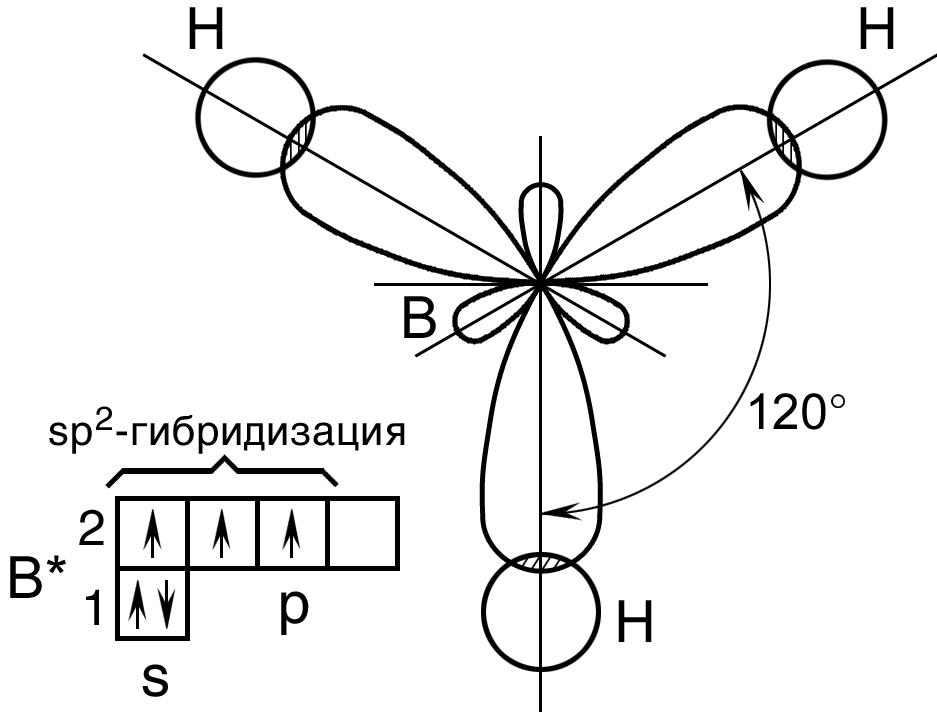
Рис. 14. Пространственная конфигурация молекулы Bh4
Пример 3. Перекрывание sp3– гибридных орбиталей атома кремния с 1s – АО четырех атомов водорода приводит к образованию тетраэдрической молекулы силана Sih5; валентный уголH-Si-H равен 109,5о (рис. 15).
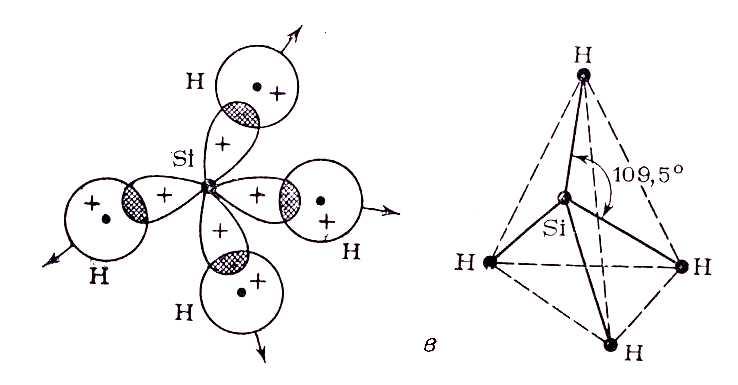
Рис. 15. Пространственная конфигурация молекулы Sih5
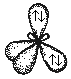
Разные по составу молекулы СН4, Nh4 и h3O имеют одинаковое пространственное расположение связей. Этот факт подтверждает гибридизацию орбиталей. Атомы углерода, азота и кислорода в указанных молекулах находятся в состоянии sp3 - гибридизации.
Молекула аммиака. В невозбужденном состоянии центральный атом азота в молекуле аммиака Nh4 имеет 1s2 2s2 2p3 - электронную конфигурацию.
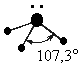
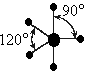
Графическая схема распределения электронов по энергетическим ячейкам представлена схемой на рис. 16, согласно которой могут образоваться три взаимно перпендикулярные связи с тремя атомами водорода. Однако в действительности валентные углы в аммиаке равны 107о при тетраэдрическом их расположении. Азот в молекуле аммиака находится в sp3–гибридном состоянии. При этом гибридизуются 2s – орбиталь, заполненная парой электронов и три 2p – орбитали, имеющие по одному электрону. В результате получается четыре sp3 – гибридных орбитали, из которых одна содержит неподеленную пару электронов. Остальные три гидридные орбитали перекрываются с орбиталями трех атомов водорода. Неподеленная пара электронов находится в одной из вершин тетраэдра, а атомы водорода расположены в вершинах основания тетраэдра, т.е. находятся в одной плоскости (рис. 16).
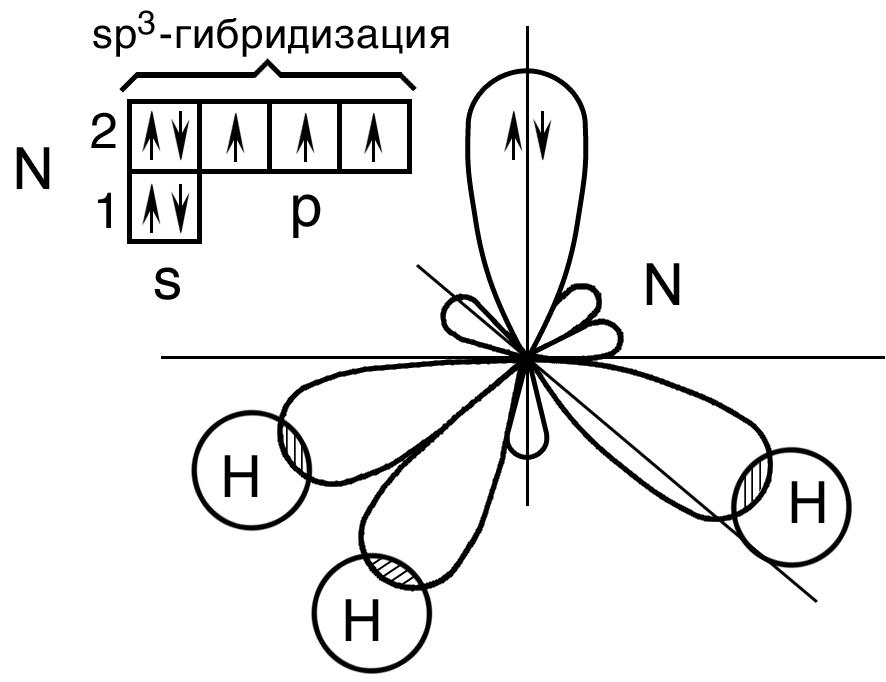
Рис. 16. Пространственная конфигурация молекулы Nh4
Молекула воды. В молекуле воды h3O центральным атомом является атом кислорода, который в невозбужденном состоянии имеет следующую электронную конфигурацию: 1s22s22p2.
Кислород в молекуле воды также находится в состоянии sp3 – гибридизации (рис. 17).
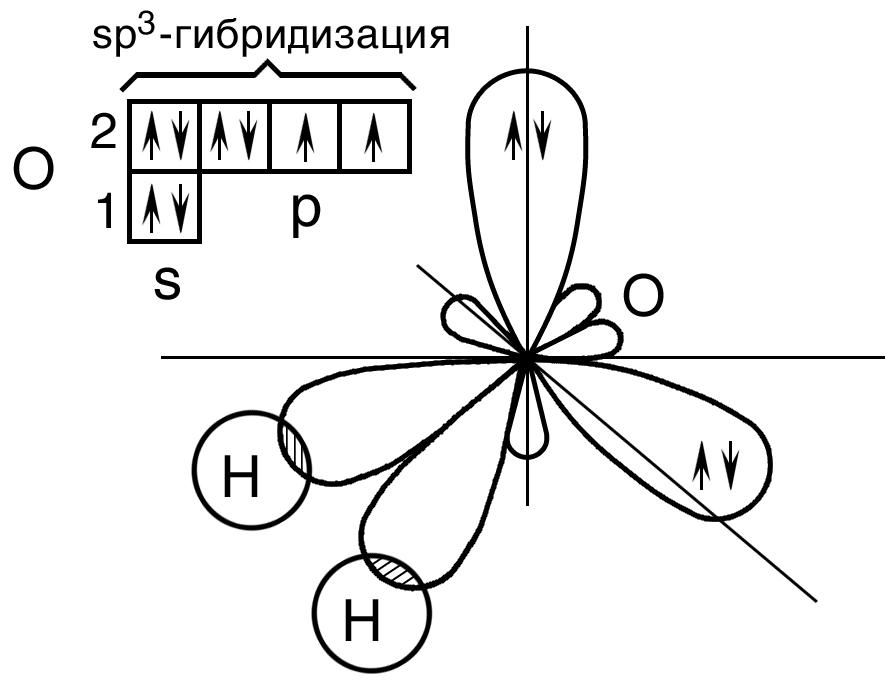
Рис. 17. Пространственная конфигурация молекулы Н2О
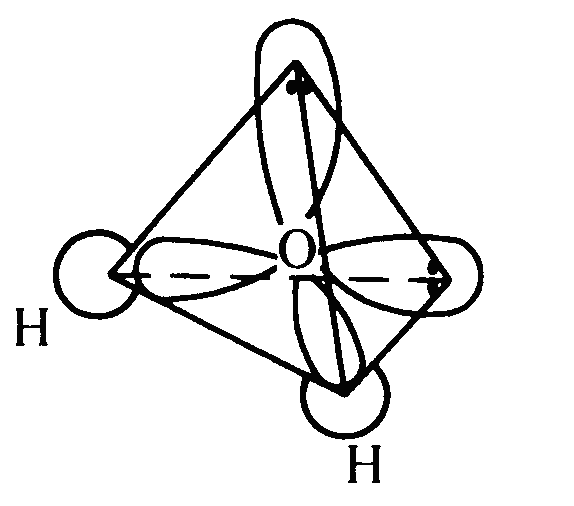
Рис. 18. Тетраэдрическое расположение связей в молекуле воды
В отличие от молекулы аммиака, в молекуле воды имеются две гибридные орбитали с неподеленными парами электронов и две гибридные орбитали, имеющие по одному электрону. Валентный угол между связями равен 104,5о при тетраэдрическом их расположении (рис. 18).
У рассмотренных молекул аммиака и воды углы между связями отклоняются от тетраэдрического 109о29′ и прямого 90о. Это обусловлено различием сил взаимного отталкивания орбиталей, заполненных только парой электронов, и орбиталей, перекрывающихся с атомами водорода. Орбитали с парой электронов, т.е. не имеющие области перекрывания, обладают бόльшим отталкивающим эффектов по сравнению с орбиталями, образующими связь.
В молекуле Nh4 имеется одна sp3 – гибридная орбиталь, заполненная парой электронов, и она отталкивает в направлении от себя три остальные орбитали связи N - H, уменьшая угол до 107о. В молекуле h3O - две орбитали с парами электронов. Их влияние на орбитали связи еще сильнее, и угол H-O-H уменьшается до 104,5о.
studfiles.net
Влияние гибридизации на свойства молекул. Структура воды.
Влияние гибридизации на свойства молекул.
Структура воды.
В настоящее время образование связи между двумя атомами рассматривают как результат перекрывания атомных орбиталей; чем сильнее перекрывание, тем прочнее образующаяся связь. Согласно данным квантовохимического расчёта, относительная эффективность перекрывания орбиталей возрастает в ряду: s=1,00; р=1,72; sp1=1,93; sp2=1,99; sp3=2,00; dsp2-2,69; d3s-2,95; d2sp3-2,921. Из этих данных ясно, почему использование гибридных орбиталей приводит к возникновению более прочных связей. Термин гибридизация введён Л. Полингом (США) и обозначал просто смешение орбиталей [2]. В современных учебниках по химии неправильно трактуется гибридизация электронных орбиталей как «процесс их взаимодействия, приводящий к выравниванию по форме и энергии».[3,4,5]. Тип гибридизации обуславливает её геометрию и другие трансферабельные свойства молекул, такие как дипольный момент, длины и энергии связей, валентные углы.
Образование четырёх одинаковых, равноценных облаков происходит только у атомов, имеющих одинаковые заместители. Например, в метане, четырёххлористом углероде все четыре гибридные орбитали, участвующие в образовании связей, одинаковы. Они состоят из 1/4 s-орбитали и 3 /4 р-орбитали и направлены к вершинам тетраэдра с углом связи 109º28' . Поэтому их считают каноническими.
Неравноценность химических связей в менее симметричных молекулах объясняется различным соотношением s- и р-орбиталей в гибридном облаке. Интересно отметить, что 2s-орбиталь углерода на 5,3 эв (122ккал/моль) беднее энергией 2р-орбитали, поэтому гибридные орбитали с большей долей s-характера приближены к ядру атома и они удерживают электроны сильнее. Чем больше электроотрицательность заместителя у атома углерода, тем больший р-характер проявляет атом углерода, тем более р-орбиталь вытянута в сторону электроотрицательного атома. Например, в хлороформе три атома хлора увеличивают р-долю в гибридных облаках более чем на 75%, вытягивая их на себя. Орбиталь С-Н приобретает благодаря этому дополнительную часть s-характера, оттягиваясь на углерод, при этом ослабляется связь водорода с углеродом. Водород в НССI3 становится более подвижным, способным даже к образованию водородной связи.
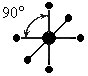
Отклонение от идеальной тетраэдрической конфигурации c sp3-орбиталями могут вызывать как геометрические факторы (образование циклов- циклопропан, циклогексан и т.д.), так и введение в молекулы гетероатомов азота, кислорода, фтора, фосфора и других атомов, содержащих неподелённые электронные пары. Атомы азота и кислорода в состоянии sр2-гибридизации должны были бы иметь валентные углы 90, однако в молекулах аммиака и воды углы оказались гораздо большими, ближе по величине к тетраэдрическому (за 100), а это значит, что в указанных соединениях азот и кислород образует близкие к sp3-связи. Рассмотрим гибридизацию на примерах отдельных гетероатомов.
Атом азота имеет электронную конфигурацию 1s22s22p3 и способен к гибридизации. В валентно-возбуждённом состоянии происходит переход 2s электрона в 2р ячейку с образованием свободной пары электронов.
(1s22s2p4). Три sp3- орбитали используются для связи с водородом, а одна орбиталь занята неподелённой парой электронов. Эта электронная пара отталкивает sp3- гибридные орбитали, и они стремятся принять тетраэдрическую направленность с углом Н-N-H, равным 107º30'. Это меньше, чем у метана. Неподелённая пара электронов несёт на себе дополнительную долю s-характеpа и придаёт алифатическим аминам основные свойства. Если для Nh4 рКα=9,21, то углеводородные группы у замещённых производных аммиака вследствие положительного индукционного эффекта (+I эффект) повышают электронную плотность на атоме азота, что приводит к увеличению основности замещённых аминов [рКα=10.65 для N(C2H5)3]. Переход от аммиака к гидразинам, т.е. замена атома водорода в аммиаке на аминогруппу при сохранении sр3- гибридизации приводит к уменьшению основности ( рКα~7,8) из-за –I эффекта группы -Nh3.
А переход к ароматическим аминам связан со значительным понижением электронной плотности на атоме азота, обусловленным –I эффектом бензольного кольца и особенно сильным резонансным эффектом ( рКα=4,60 для С6Н5Nh3), электронная пара «размазывается» по бензольному кольцу, при этом атом азота переходит в состояние sp2-гибридизации. Гибридные орбитали азота используются и для образования двойных =С=N:- и тройных -С≡N: связей с углеродом. Образование -связи в них происходит в результате бокового перекрывания негибридизованных р-орбиталей атомов азота и углерода. Возникают sp2- и sp- конфигурации, в которых основность азота весьма низка. Подобные конфигурации мы наблюдаем и между атомами азота в диазо-соединениях, в азидах, в неописанных в литературе циклических азот-содержащих соединениях типа N6 или N6h3. Низкую основность мы наблюдаем и в амидах кислот ( рК= -0,63 для СН3СОNh3 ), что объясняется мезомерным эффектом и переходом атома азота в sp2-гибридизацию. Если в молекуле присутствуют две группы С=О, то подобные имиды обладают достаточно высокой кислотностью и дают со щелочными металлами соли. ( фтальимид).
Не всегда основность аминов связана с гибридизацией. Весьма низка основность азота в нитросоединениях ( семиполярная связь- атом азота отдал пару электронов кислороду) и в не очень стабильных N-окисях третичных аминов R3NO. N-окиси триалкиламинов высокополярны, не обладают основными свойствами; они менеее стабильны, чем окиси фосфинов, где возможно -d перекрывание. Эта нестабильность окисей объясняется характером семиполярной связи NО. Молекула (СН3)3N+O- имеет большой дипольный момент 5,02 D, длина связи NO равна 1,40А, а энергия её составляет 70 ккал/моль. (Энергия связи Р=О 140 ккал/моль, а длина 1,28А).
Более стабильны ароматические N- окиси. Окись пиридина имеет дипольный момент 4,24D и стабильна из-за наличия резонансных структур. Определённая стабильность отмечается в ряде нитроксильных радикалов, у которых в -положении отсутствуют атомы водорода, типа
-С-N-С-
О
Ещё интереснее представляется гибридизация в присутствии двух неподелённых пар атома кислорода на примере молекулы воды. Атом кислорода имеет электронную конфигурацию 1s22s22p4, переходящую в возбуждённом состоянии в 1s22s2p5. Кислород в молекуле воды способен образовывать две связывающие sp3- гибридные орбитали с атомами водорода, обеспечивающие образование наиболее прочных связей, а две пары свободных электронов находятся в углах тетраэдра. Они отталкивают гибридные sp3-орбитали сильнее, чем в аммиаке, поэтому тетраэдрический угол Н-О-Н равен 10427 .
Химическая практика показала, что эти две пары свободных электронов неравноценны, так как только одна из них способна образовывать водородную связь. Особенно ярко это проявляется в динамике, когда, по нашему мнению, водород одной молекулы воды, имеющий небольшой положительный заряд, приближаясь к атому кислорода соседней молекулы воды, оттягивает на себя одну из пар электронов атома кислорода, удлиняя её, уменьшая тем самым её s-характер. При этом образуется водородная связь длиной 1,73Аº, увеличивается длина тетрагональной пирамиды молекулы воды, уменьшаются углы между связями и всё это приводит к увеличению s-характера орбитали другой пары электронов. Вследствие этого, одна орбиталь- слабосвязывающая, а вторая орбиталь вообще не способна участвовать в образовании второй водородной связи.
Неравноценность электронных пар в атоме кислорода проявляется не только при создании водородной связи, но и в многочисленных химических реакциях. Особенно ярко наблюдается разница в энергиях этих орбиталей при образовании иона гидроксония (Н3О)+. При подходе протона к молекуле воды реакция идёт, очевидно, через образование водородной связи, а затем приводит к полному переносу электронной пары кислорода на протон с образованием ковалентной связи; при этом протонное сродство составляет 773 кДж/моль. Теоретический расчёт показал, что энергия присоединения протона к молекуле воды - 0,8 е2/r108 эрг, а энергия присоединения второго протона к иону гидроксония на порядок ниже ( 0,06 е2\r 108 эрг).6. Другие примеры. Вода и СО2 образуют равновесный комплекс в соотношении 1:1, представляющий слабую угольную кислоту. Спирты и простые эфиры реагируют с кислотами с образованием солей алкил- и диалкилоксония в соотношении (1:1). Диоксан очень легко образует продукт присоединения с бромом, с серной кислотой в соотношении 1:1, эфиры, спирты, фенолы с ВF3 образуют эфираты за счёт свободных пар кислорода только в соотношении 1:1, гликоли с медью дают комплексы–гликоляты, в которых 4 или 6 молекул воды могут координироваться вокруг катиона Сu+, образуя гидраты- комплексные соединения и т.д. :
ОН2
{ H-O-Н }+ R-O-H +НВr→ [R-О-Н ]+: Вr--: [Н2О Сu ОН2 ]2+
H Н Н ОН2
Н…О-С=О [ R-O-R ] [ R-O-R]+CI- СН2-О Сu О-СН2 (Bh5)-:ОR2
Н …О F3 В H СН2-О О-СН2
Н
Таким образом, мы приходим к выводу, что неподелённые пары у sp3-гибридизованного атома кислорода совершенно разные по энергетике и атом кислорода максимально может иметь только три координации. Это значительно упрощает структуру воды, так как при возможных образованиях ею циклических структур, подобных рибозе или глюкозе, все три связи атома кислорода оказываются задействованы. Образование глобул из n- числа молекул воды становится невозможным, как это описано в ряде работ.7,8.
Водородные связи в таких циклических структурах могут образовывать только внешние аксиальные атомы водорода. Эти водородные связи весьма слабы, длина их постоянно меняется. Кроме циклических структур в состав воды входят и цепочечные структуры. Доктор Андрес Нилссон и его коллеги из Стэнфордского университета исследовали воду с помощью рентгеновских лучей и обнаружили, что вода имеет переменную структуру, состоящую из колец и цепочек молекул 13. Эта концепция подтверждается и тем, что главную роль в химических и биохимических процессах играют легко рарушаемые цепочечные структуры воды в виде димеров и мономеров. Они сольватируют в водных растворах многочисленные катионы и анионы: Na+, К+, Мg2+ и т.д., делая их подвижными в различных химических и биохимических реакциях. При наличие лишь крупных глобул в водных растворах биохимические процессы становятся невозможными.12.
Несколько по иному выглядит гибридизация атома кислорода в фенолах. Одна из кислородных пар взаимодействует с - облаком бензольного кольца, образуя единую электронную систему. В результате у атома кислорода изменяется гибридизация электронных облаков до sp2, связь ОН ослабляется и водород приобретает «кислотный» характер. Аналогично ведёт себя атом кислорода при образовании двойной связи с углеродом. В кетонах кислород использует три sp2-гибридные орбитали для образования трёх -связей, негибридизовнные р-орбитали атомов кислорода и углерода при боковом перекрывании образуют -связь. В этих соединениях угол С-O- C составляет 120, длина связи С=О равна 1,22А, энергия составляет 179 ккал/моль.
Удивительна гибридизация атома фтора, например, в жидкой фтористоводородной кислоте ( Н-F..H-F..). Электронная конфигурация атома фтора 1s22s22p5. Она может переходить в 1s22s2p6. Как и вода, фтористоводородная кислота (НF)х существует в виде линейных и циклических ассоциатов. Атом фтора, находящийся в центре тетраэдра, имеет три свободные sp3 гибридные пары электронов, лежащие в углах тетраэдра. Практика показывает, из трёх этих пар только одна из них может принимать участие в химических реакциях, например, в образовании только одной водородной связи ( 7 ккал/моль). Таким образом, в отличие от атома кислорода атом фтора имеет одну связывающую орбиталь, образующую ковалентную связь и одну слабосвязвающую орбиталь, т.е. только две связи. Например, фтористый водород с BF3 образует комплексное соединение НВF4 , а с анионом F- устойчивый анион (НF2)-:
… НF…НF...НF… F3 В…F-Н [ F-H…F] – КF+ HFKHF2
Остановимся коротко на атоме фосфора. У нейтрального атома фосфора выявлена следующая электронная конфигурация: 1s22s22p63s23p3.
В возбуждённом состояние он способен передавать 3s-электрон на р и даже на d уровни, которые по энергетике достаточно близки для атомов третьего периода. Вследствие этого, для ФОС характерны в основном три состояния: большая группа трёхкоординационных ФОС, громадное количество четырёхкординационных соединений и относительно неустойчивые пятикоординационные системы.
В трёхкоординационных ФОС электронные облака атома фосфора гибридизованы незначительно. и принимают от заместителей три электрона, образуя три -связи с участием практически чистых 3р-электронов фосфора с углами 93-100; при этом атом РIII со своей 3s2 неподелённой парой находится в вершине пирамиды. В молекуле PF3 валентный угол F-P-F оценён в 1043, у РН3 он равен 93,3, что объясняют эффектом действия 3s2 неподелённой пары. Эксперименты подтверждают - неподелённая пара фосфора III в отличие от азота не способна к сопряжению с -системами заместителей и это объясняется её повышенным s-характером. Это показано на примерах ароматических прозводных трёхвалентного фосфора. Валентные углы при атоме трёх-координационного фосфора лежат в большинстве случаев в интервале 93 -100, что составляет 80% s-характера неподелённой пары, а при атоме трёхвалетного азота углы составляют 102-107 и, следовательно, его неподелённая пара имеет преимущественно p-характер, что позволяет ей участвовать в -сопряжении.8. Нестойкость трёхвалетных ФОС связана с сильным сродством атома фосфора к кислороду, к желанию его перейти в более устойчивую структуру, имеющую sp3-гибридизацию, что и происходит при его многочисленных превращениях.
Атом четырёхкоординационного фосфора находится в центре пирамиды и его гибридные орбитали неравноценны, здесь многое зависит от характера заместителей при нём. Угол О-Р-О в такой пирамиде составляет 110-115, длина связи Р-О равна 1,60А. Атом кислорода фосфорильной группы связан с атомом фосфора при помощи -связи за счёт перекрывания sp3 -гибридной орбитали фосфора с р-орбитой кислорода и -связи за счёт бокового перекрывания р-орбиталей. Эта образовавшаяся Р=О связь (её длина равна 1,50А) сильнее поляризована по сравнению с С=О -связью. В отличие от производных карбоновых кислот сопряжение между непредельными системами и фосфорильной группой проявляется в значительно меньшей степени, хотя присоединение вторичных аминов к винильным системам у атома фосфора всегда происходит в - положение.9. Наличие у атома кислорода в Р=О двух электронных пар и близость энергетически доступных d-орбит атома фосфора, позволяет предположить возможность попадания одной электронной пары на d-орбиты. Это в большей степени характерно для соединений фосфора, имеющих элктроотрицательные заместители типа F, CI и т.д. Поэтому характер связи Р=О может меняться от ковалентной в (СН3)3РО до почти тройной координационной в F3PO.
Атом фосфора (IV) несёт большой положительный заряд(0,55+), который обуславливает участие его в реакциях нуклеофильного замещения. Постулируют, что в таких реакциях атом фосфора находится в переходном sp3d состоянии и в них возможно принимают участие d-орбиты. Это переходное состояние имеет форму тригональной бипирамиды с атомом фосфора в центре и с подходящим нуклеофилом и уходящей группой в вершинах этой бипирамиды .10.
Пятикоординационные производные фосфора относительно не- стабильны и находятся в sp3d гибридизации в виде бипирамиды. ( РСI5 и другие).11.
Гибридизация возможна у других атомов III периода, переходящих в возбуждённое состояние, таких как сера, селен, хлор и т.д. Наличием гибридных валентных связей характеризуются комплексные соединения IV,V,VI периодов, которые отличаются лишь присутствием переходных элементов.
Заключение.
Гибридизация электронных орбиталей, их геометрия весьма значимы для понимания физических и химических свойств молекул, комплексных соединений. Поэтому правильное определение понятия
« гибридизация» весьма важно при изучении курса химия в школе. Настораживает выражение в школьных учебниках « приводящий к выравниванию по форме и энергии». Многие химики, биологи и медики понимают термин «выравнивание« в прямом смысле как равное. Под термином «выравнивания» орбит можно потерять электронную пару на атоме азота, электронные пары на атомах кислорода и фтора, а с ними и основные физико-химические свойства молекул аммиака, воды и т.д. В действительности электронные пары остаются, но только на гибридизированных орбиталях. Правильное определение должно звучать так:
«Гибридизация - это процесс возбуждения атомов, ведущий к образованию энергетически выгодных смешанных орбиталей ».
Литература
1.П.Сайкс- Механизмы реакций в органической химии. М., Химия,1977,с.309
2. Л. Полинг, П.Полинг- Химия, М.,1978, с.402
3. О.О. Максименко –Химия, Справочник абитуриента, Слово,1999, с.638
4. О.С. Габриелян -Химия 10 класс Дрофа, 2004,с.305
5. О.С. Габриелян -Химия 11 класс Дрофа, 2004,с.359
6. Реми Г.- Курс неорганической химии, М, Мир, 1972, с.755-760
7.Габуда С.- Связанная вода. Факты и гипотезы, Новосибирск, Наука 1982, с. 161.
8. Зенин С.В.- Вода.ФНКЭЦ ТМДЛ МЗ РФ, М.,2000,с.48
9. Цветков Е. Н. -Сб. «Химия и применение ФОС». Труды 5 конференции. М., Наука, 1974г. с.279
10.Р. Обрайн -Токсичные эфиры кислот фосфора, М.,Мир.1964, с.631
11.Р. Хадсон -Структура и механизм реакций ФОС. М., Мир,1967,с.361
12.Д.Мецлер- Биохимия т. 1, М.Мир,1980,с.407
13.Интернет, сайт –www inopressa ru.
Арбисман Ян Семёнович-кандидат химических наук, преподаватель
412970,г.Шиханы Саратовская область, ул.Ленина, д.24, кв.65.
тел.дом.884593 41242, моб.7 9172053687
nsportal.ru
3.4 Геометрия молекул. Гибридизация атомных орбиталей
Гибридизация орбиталей – это выравнивание формы и энергии некоторых орбиталей при образовании ковалентной связи. Гибридные орбитали представляют собой линейную комбинацию АО и обладают определенной ориентацией в пространстве (симметрией).
Таким образом, когда один атом образует несколько связей, а его валентные электроны принадлежат разным орбиталям (s и p; s, p и d), для объяснения геометрии молекул в МВС необходимо привлекать теорию гибридизации атомных орбиталей. Основные положения теории следующие:
1) гибридные орбитали обладают более высокой энергией, чем исходные атомные, зато они обеспечивают максимальное перекрывание АО в направлении локализованных σ-связей и, соответственно, дают больший выигрыш в энергии при образовании связи;
2) число гибридных орбиталей равно числу АО, участвующих в гибридизации;
3) гибридизуются близкие по энергии валентные АО независимо от того, заполнены они в атоме полностью, наполовину или пусты;
4) химические связи и неподеленные электронные пары в молекулах стремятся расположиться как можно дальше друг от друга.
Если валентная оболочка атома включает электроны на одной s-орбитали и одной p-орбитали, имеет место sp-гибридизация. Рассмотрим её на примере молекулы BeCl2.
Э лектронная конфигурация валентной оболочки бериллия 2s2. Для реакции с двумя атомами хлора необходим переход электронов бериллия в возбужденное состояние.
лектронная конфигурация валентной оболочки бериллия 2s2. Для реакции с двумя атомами хлора необходим переход электронов бериллия в возбужденное состояние.
Если бы один атом хлора связывался с бериллием за счет 2s-электрона бериллия, а другой - за счет 2px-электрона бериллия, то связи Be-Cl не были бы равноценными. Однако на самом деле обе связи имеют одинаковую длину, прочность и расположены под углом 180° за счёт того, что одна s– орбиталь и одна p– орбиталь “смешиваются” и выравниваются по форме и энергии, давая две одинаковые sp– гибридные орбитали (рисунок 13).
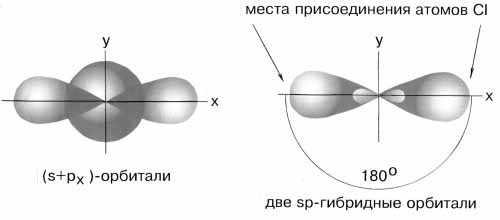
Рисунок 13 - sp-гибридизация валентных орбиталей бериллия
Каждая гибридная орбиталь несимметрична (вытянута в сторону от ядра). Обе гибридные орбитали бериллия отталкиваются и лежат на одной прямой и благодаря этому молекула BeCl2 имеет линейную форму, а обе связи Be-Cl совершенно одинаковы. Такова геометрия и у всех других sp-гибридизованных молекул - независимо от элементов, которые входят в эти молекулы: HC≡CH, MgН2 и т. д.
Е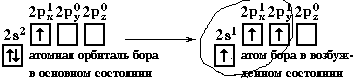
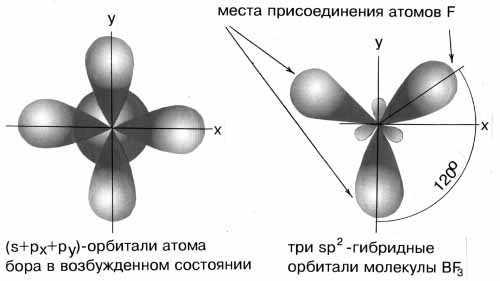 сли валентная оболочка атома включает электроны на однойs-орбитали и двух p-орбиталях, то наблюдается sp2-гибридизация, которая даёт несколько иную геометрию молекулы. Примером может служить sp2-гибридизация бора при образовании молекулы BF3 (рисунок 14). Три sp2-гибридные орбитали лежат в одной плоскости под углом 120°. Они располагаются как можно дальше друг от друга и молекула имеет форму плоского треугольника.
сли валентная оболочка атома включает электроны на однойs-орбитали и двух p-орбиталях, то наблюдается sp2-гибридизация, которая даёт несколько иную геометрию молекулы. Примером может служить sp2-гибридизация бора при образовании молекулы BF3 (рисунок 14). Три sp2-гибридные орбитали лежат в одной плоскости под углом 120°. Они располагаются как можно дальше друг от друга и молекула имеет форму плоского треугольника.
Рисунок 14 - sp2-гибридизация валентных орбиталей бора
Такую же форму будут иметь и молекулы Bh4, h3C=Ch3, C6H6 и т. д.
Н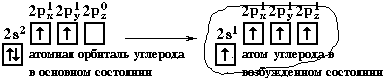 аконец, когда смешиваютсяодна s- и три p-орбитали, возникают sp3-гибридизованные молекулы, имеющие геометрию тетраэдра (рисунок 15).
аконец, когда смешиваютсяодна s- и три p-орбитали, возникают sp3-гибридизованные молекулы, имеющие геометрию тетраэдра (рисунок 15).
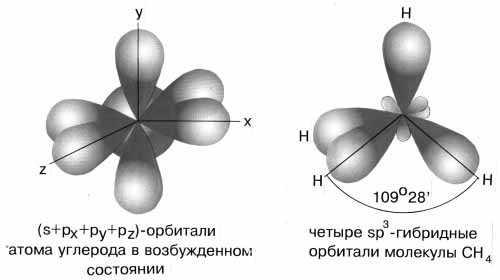
Рисунок 15 - sp3-гибридизация валентных орбиталей углерода
Примером может служить соединение углерода с водородом СН4 (метан). В стационарном состоянии углерод двухвалентен, а для образования связи с водородом необходимо четыре свободных электрона. Они появляются при распаривании s-электронов. В результате образуется четыре гибридных орбитали, которые расположатся максимально далеко друг от друга только тогда, когда молекула примет форму правильного тетраэдра, у которого в центре находится атом C, а в вершинах – атомы H. Углы между всеми связями равны и составляют 109°28'.
Такой же тип гибридизации будет характерен для молекул CCl4, h4C–Ch4.
Все вышеописанные молекулы образуются, когда все периферические атомы в многоэлектронной молекуле (или ионе) одинаковы и их число совпадает с числом гибридных орбиталей. Однако, если число гибридных орбиталей больше числа связанных атомов, то часть гибридных орбиталей заселена электронными парами, не участвующими в образовании связи, – несвязывающими или неподеленными электронными парами.
| |
| Рисунок 16 - Несвязывающие электронные пары и углы связи в молекулах Nh4 и h3O в сравнении с молекулой Ch5 |
Объясняется это тем, что электроны связывающих и несвязывающих пар по-разному взаимодействуют между собой. Обычно считается, что несвязывающие пары занимают больший объем, чем связывающие, а объем связывающих пар тем меньше, чем больше электроотрицательность периферийных атомов, то есть неподеленные пары отталкиваются между собой несколько сильнее, чем от поделенных пар, и чем поделенные пары отталкиваются друг от друга.
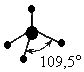
Поэтому реально этот тетраэдр в молекулах Nh4 и h3O слегка искажен, потому что реальный угол составляет не 109о, а 107,3о и 104,5о соответственно.
При образовании иона аммония Nh5+ по донорно-акцепторному механизму неподелённая электронная пара азота занимает свободную атомную орбиталь протона водорода и угол в ионе увеличивается до 109°28'.
Аналогичное явление наблюдается при образовании иона аксония Н3О+, но угол увеличивается до 107,3о, поскольку только одна из двух неподелённых пар находит себе свободную орбиталь. А вот в ледяной воде угол увеличивается до109°28', поскольку ещё одна неподелённая пара электронов оказывается вовлечённой в водородную связь.
studfiles.net
Вопрос№13. Гибридизация атомных орбиталей и строение молекул.
sp-Гибридизация - это гибридизация, в которой участвуют атомные орбитали одного s- и одного p-электронов (рис. 1).
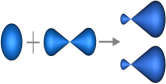
Рис. 1. Образование sp-гибридных орбиталей
В процессе гибридизации образуются 2 гибридные орбитали, которые ориентируются друг к другу под углом 180° (рис. 2).
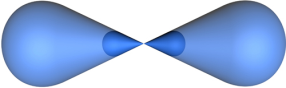
Рис. 2. Модель атома с sp-гибридными орбиталями.
Пространственная конфигурация молекулы, центральный атом которой включает sp-гибридные орбитали, представлено на рис. 3.

Рис. 3. Пространственная конфигурация молекулы, центральный атом которой включает sp-гибридные орбитали.
Представление о sp-гибридизации орбиталей можно применить для объяснения линейной формы, например, молекулы Beh3, в которой атом бериллия образован гибридными sp-орбиталями. Модель этой молекулы показана на рис. 4.

Рис. 4. Модель молекулы Beh3
sp2-Гибридизация – гибридизация, в которой участвуют атомные орбитали одного s- и двух p-электронов (рис. 1).
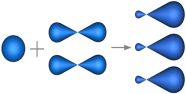
Рис. 1. Образование sp2-гибридных орбиталей
В результате гибридизации образуются три гибридные sp2 орбитали, расположенные в одной плоскости под углом 120° друг к другу (рис. 2).

Рис. 2. Модель атома с sp2-гибридными орбиталями
Пространственная конфигурация молекулы, центральный атом которой включает в себя sp2-гибридные орбитали, представлена на рис. 3.
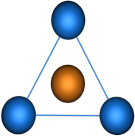
Рис. 3. Пространственная конфигурация молекулы, центральный атом которой включает в себя sp2-гибридные орбитали
Этот тип гибридизации наблюдается, например в молекуле BCl3. Модель этой молекулы изображена на рис. 4.
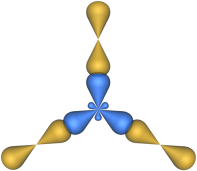
Рис. 4. Модель молекулы BCl3
sp3-Гибридизация – гибридизация, в которой участвуют атомные орбитали одного s- и трех p-электронов (рис. 1).
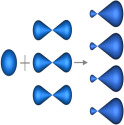
Рис. 1. Образование sp3-гибридных орбиталей
Четыре sp3-гибридные орбитали симметрично ориентированны в пространстве под углом 109°28' (рис. 2).
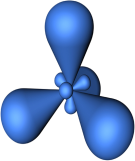
Рис. 2. Модель атома с sp3-гибридными орбиталями
Пространственная конфигурация молекулы, центральный атом которой образован sp3-гибридными орбиталями – тетраэдр (рис. 3).
Рис. 3. Тетраэдрическая пространственная конфигурация молекулы, центральный атом которой образован sp3-гибридными орбиталями
На рис. 4 представлена модель молекулы метана (Ch5), в которой атом углерода подвергается sp3-гибридизации. 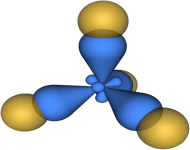
Рис. 4. Модель молекулы Ch5
Вопрос№14. Полярная и неполярная ковалентная связь. Дипольный момент связи молекулы.
Различают две разновидности ковалентной связи: полярную и неполярную.
Полярная ковалентная связь образуется между атомами разных элементов с различной относительной электроотрицательностью. В этом случае электронное облако смещается в сторону более электроотрицательного атома. Пример
HCl, h3O, h3S, Nh4.
Образование молекулы хлороводорода HCl можно представить схемой:
Электронная пара смещена в сторону хлора, так как относительная электроотрицательность атома хлора больше, чем атома водорода.
Неполярная ковалентная связь образуется между атомами одного и того же элемента. Пример
h3, O2, Cl2
Образование молекулы хлора Cl2:
studfiles.net
это что такое? Типы гибридизации :: SYL.ru
О гибридах нам говорят много. О них повествуют и фильмы, и книги, а также их рассматривает наука. В первых двух источниках гибриды являются очень опасными существами. Они могут принести уж очень много зла. Но далеко не всегда гибридизация - это плохое явление. Достаточно часто оно бывает хорошим.

Пример гибридизации - это каждый человек. Все мы являемся гибридами двух людей - отца и матери. Так, слияние яйцеклетки и сперматозоида также является своего рода гибридизацией. Именно данный механизм позволяет двигать эволюцию. При этом бывает и гибридизация с отрицательным знаком. Давайте рассмотрим данное явление в целом.
Общее представление о гибридизации

Впрочем, не только биология включает данное понятие. И пусть во вступлении был рассмотрен пример с гибридами как полноценными особями непонятного биологического вида. При этом данное понятие может использоваться и в других науках. И значение данного термина будет несколько отличаться. Но при этом кое-что общее все же есть. Это слово "объединение", которое объединяет все возможные значения данного термина.
Где существует данное понятие?

Термин "гибридизация" используется в ряде наук. А поскольку большая часть существующих ныне дисциплин пересекается, то можно смело говорить об использовании каждого значения данного термина в любой науке, так или иначе связанной с естественными исследовательскими отраслями. При этом наиболее активно данный термин используется в:
- Биологии. Отсюда пошло понятие гибрида. Хотя, как всегда, при перемещении из науки в повседневную жизнь произошло некоторое искажение фактов. Мы под гибридом понимаем особь, получившуюся в процессе скрещивания двух других видов. Хотя так бывает не всегда.
- Химии. Данное понятие означает смешивание нескольких орбиталей - своеобразных путей движения электронов.
- Биохимии. Здесь ключевым понятием является гибридизация ДНК.
Как видим, третий пункт находится на стыке двух наук. И это абсолютно нормальная практика. Один и тот же термин может образовывать на стыке двух наук абсолютно другое значение. Давайте более детально рассмотрим понятие гибридизации в этих науках.
Что такое гибрид?

Гибрид - это существо, которое получилось в процессе гибридизации. Данное понятие относится к биологии. Гибриды могут получаться как случайно, так и специально. В первом случае это могут получиться животные, которые создаются в процессе спаривания двух разновидовых существ.
Например, рассказывают о том, что появляются у кошек и собак дети, которые не являются ни одними из них. Иногда гибриды создаются специально. Например, когда к абрикосу прикрепляют вишню, мы имеем дело как раз с специальной гибридизацией.
Гибридизация в биологии

Биология - интересная наука. И понятие гибридизации в ней не менее увлекательное. Под данным термином подразумевается объединение генетического материала разных клеток в одной. Это могут быть как представители одного вида, так и нескольких. Соответственно, происходит деление на такие разновидности гибридизации.
- Внутривидовая гибридизация. Это когда две особи одного вида создают потомка. Примером внутривидовой гибридизации можно считать человека. Он получился в процессе слияния половых клеток представителей одного биологического вида.
- Межвидовая гибридизация. Это когда скрещиваются похожие, но принадлежащие к разным видам, животные. Например, гибрид коня и зебры.
- Отдаленная гибридизация. Это когда скрещиваются представители хоть и одного вида, но при этом не объединенные семейными связями.
Каждая из этих разновидностей помогает не только эволюции. Ученые также активно стараются скрещивать разные виды живых существ. Лучше всего получается с растениями. Причин этому несколько:
- Разное количество хромосом. У каждого вида есть не только специфическое количество хромосом, но и их набор. Все это мешает воспроизводить потомство.
- Размножаться могут только растения-гибриды. И то не всегда.
- Полиплоидными могут быть только растения. Чтобы растение размножалось, оно должно стать полиплоидным. В случае с животными это верная смерть.
- Возможность вегетативной гибридизации. Это очень простой и удобный способ создания гибридов нескольких растений.
Это причины, по которым скрещивать два растения значительно проще и эффективнее. В случае с животными, возможно, в будущем получится добиться возможности размножения. Но на данный момент официальным в биологии считается мнение, что животные-гибриды утрачивают способность размножаться, так как данные особи являются генетически нестабильными. Следовательно, неизвестно, к чему может привести их размножение.
Виды гибридизации в биологии

Биология - наука достаточно широкая по своей специализации. Бывает два вида гибридизации, которые она предусматривает:
- Генетическая. Это когда из двух клеток делается одна с уникальным набором хромосом.
- Биохимическая. Примером данного вида является гибридизация ДНК. Это когда комплементарные нуклеиновые кислоты объединяются в одну ДНК.
Можно делить на большее количество разновидностей. Но это мы сделали в предыдущем подразделе. Так, отдаленная и внутривидовая гибридизация - это составные части первого типа. А там классификация еще больше расширяется.
Понятие вегетативной гибридизации
Вегетативная гибридизация - это понятие в биологии, которое означает такую разновидность скрещивания двух растений, при котором часть одного вида приживается на другом. То есть, гибридизация происходит за счет совмещения двух разных частей организма. Да, так можно растение охарактеризовать. Ведь у него также есть свои органы, объединенные в целую систему. Следовательно, если называть растение организмом, ничего зазорного в этом нет.
Вегетативная гибридизация имеет ряд преимуществ. Это:
- Удобство.
- Простота.
- Эффективность.
- Практичность.
Данные плюсы делают такую разновидность скрещивания очень популярной у садоводов. Также есть такое понятие, как соматическая гибридизация. Это когда скрещивают не половые клетки, а соматические, вернее, их протопласты. Данный способ скрещивания производится тогда, когда невозможно создать гибрид стандартным половым путем между несколькими растениями.
Гибридизация в химии
Но теперь мы немного отступим от биологии и поговорим о другой науке. В химии есть свое понятие, называется оно "гибридизация атомных орбиталей". Это очень сложный термин, но если разбираться немного в химии, то ничего сложного в нем нет. Сперва нужно объяснить, что же такое орбиталь.
Это своеобразный путь, по которому движется электрон. Нас этому учили еще в школе. И если происходит такое, что данные орбитали разного типа смешиваются, получается гибрид. Существует три вида явления, называемого "гибридизация орбиталей". Это такие разновидности:
- sp-гибридизация - одна s и другая p орбиталь;
- sp2-гибридизация - одна s и две p орбитали;
- sp3-гибридизация - одна s и три p орбитали соединяются.
Данная тема достаточно сложная для изучения, и ее нужно рассматривать неразрывно от остальной части теории. Причем понятие гибридизации орбиталей касается больше конца данной темы, а не начала. Ведь нужно изучить само понятие орбиталей, какими они бывают и так далее.
Выводы
Итак, мы разобрались в значениях понятия "гибридизация". Это, оказывается, достаточно интересно. Для многих было открытием то, что в химии также есть данное понятие. Но если бы этого такие люди не знали, то чему бы они могли научиться? А так, есть развитие. Важно не прекращать тренировать эрудицию, так как это обязательно будет характеризовать вас с хорошей стороны.
www.syl.ru
Теория гибридизации
Попытки применения МВС в простейшем варианте, изложенном выше для описания химического строения большинства молекул состоящих из 3 и более атомов оказались неудачными. Во многих случаях теория абсолютно не соответствовала экспериментальным данным. Для устранения этого противоречия была разработана теория гибридизации.
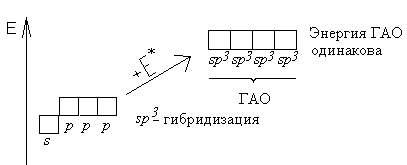
Гибридизация - это глубокая перестройка АО, возникающая при переходе атома из нормального в возбужденное состояние. При этом АО превращаются в ГАО (гибридные атомные орбитали). ГАО резко отличаются от исходных АО по энергии, форме и ориентации в пространстве. В то же время ГАО одного атома абсолютно одинаковы по энергии и форме между собой.
Пример: sp3- гибридизация атома углерода:
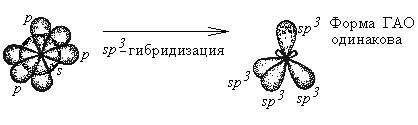
Все ГАО имеют форму ассиметричной гантели (т.е. вытянуты в одном направлении). Гибридизации могут подвергаться только орбитали валентных подуровней. В ходе гибридизации из n АО получаются n ГАО. ГАО участвуют в образовании только - связей, причем эти связи более прочные, чем аналогичные - связи с участием негибридных АО.
В настоящее время в различных веществах обнаружено около 20 различных типов гибридизации. Но чаще всего встречаются 6 типов гибридизации:
| Тип гибридизации | Взаимное расположение ГАО в пространстве | Структурные формы |
| sp | | |
| sp2 | | |
| sp3 | | |
| sp3d1 |
| |
| sp3d2 | | |
| spd2 | | |
Наличие гибридизации и ее тип у того или иного атома в молекуле в общем случае предсказать нельзя. Для однозначного решения этой задачи в большинстве случаев нужно знать:
1. Сколько связей между каждой парой атомов (первая связь - всегда - связь, вторая и третья - - связи).
2. Чему равны валентные углы (углы между связями) или, по крайней мере, чему равен дипольный момент молекулы (сумма дипольных моментов связей).
Пример 1. Известно, что молекула CСl4 не полярна ( = 0). Углы между связями С - Сl одинаковы и равны 10928. Все связи C - Cl одинаковы по длине и энергии. Все эти данные свидетельствуют в пользу того факта, что углерод в этой молекуле находится в состоянии sp3 - гибридизации.
Поэтому орбитальная диаграмма выглядит следующим образом:
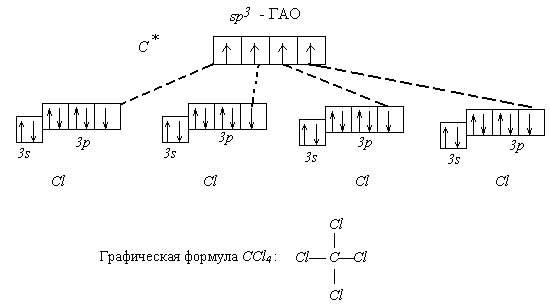
Пространственное строение CCl4 - атомы Cl образуют правильную фигуру (тетраэдр). Относительно возможной гибридизации атомов хлора ничего сказать нельзя, т.к. исходных данных недостаточно для этого.
Пример 2. Молекула Н2О полярна ( 0 ), угол между связями Н-О равен 10530. Водород не может подвергаться гибридизации, так как у него всего одна валентная орбиталь. Кислород может быть негибридизированным (тогда угол между связями должен быть 90) или иметь один из 3 типов гибридизации (другие невозможны из-за отсутствия валентных d и f - орбиталей): sp - гибридизация (валентный угол 180), sp2 - гибридизация (120), sp3 - гибридизация (10928).
Так как валентный угол в молекуле воды наиболее близок к таковому для случая sp3 - гибридизации, орбитальная диаграмма этой молекулы следующая:
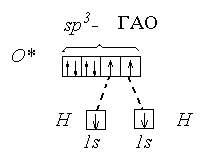
Валентный угол в такой молекуле отличается от стандартного тетраэдрического (10928) за счет того, что ГАО кислорода неравноценны: две из них связывающие (принимают участие в образовании связей О - Н), а две – несвязывающие:
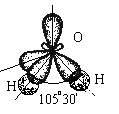
Несвязывающие атомные орбитали кислорода сильно отталкиваются друг от друга и это приводит к тому, что валентный угол в молекуле воды меньше на 5 относительно стандартного для sp3-гибридизации.
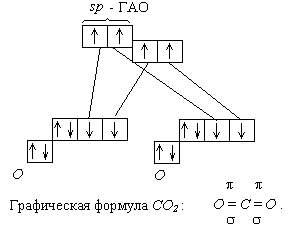
Пример 3: Молекула СО2 неполярна ( = 0). Этого вполне достаточно, чтобы описать строение этой молекулы. Каждая связь С - О является полярной, так как атомы углерода и кислорода сильно отличаются по электроотрицательности. Чтобы молекула в целом была неполярной, необходимо чтобы связи С - О имели валентный угол равный 180:

При сложении 2 векторов одинаковых по длине и противополжных по направлению получается ноль. Угол 180 соответствует sp -гибридизации атома углерода. Отсюда следует орбитальная диаграмма:
studfiles.net