Урок 15. Сера. Вода сера
Сера
Электронное строение атома.Сера относится к элементу, находящемуся в VI-й группе главной подгруппы периодической системы Д.И.Менделеева. Его электронная конфигурация атома 1s22s22p63s23p4.
Нахождение в природе.
В обычных условиях сера представляет собой лёгкие, жёлтые кристаллы, нерастворимые в воде, но хорошо растворимые в сероуглероде. Кристаллическая решётка серы – молекулярная, в узлах которой находится циклическая молекула S8. Сера имеет ряд аллотропных модификаций.
Вышеуказанная форма серы называется моноклинной серой, при охлаждении которой переходит в устойчивые кристаллы ромбической серы.
Если расплавленную серу влить в холодную воду, то образуется ещё одна аллотропная модификация – пластическая сера. Температура кипения серы +445оС. В парах расплавленной серы содержатся молекулы S8, S6, S4, S2.
В природе сера встречается в трёх формах:

1) Самородная сера
2) Сульфидная сера:
FeS2 – серный или железный колчедан, пирит.CuS – медный блеск.CuFeS2 – халькопирит или медный колчедан.PbS – свинцовый блеск.ZnS – цинковая обманка.HgS – киноварь.
3) Сульфатная сера:
CaSO4x2h3O – гипс.CaSO4xh3O – алебастр.Na2SO4x10h3O – глауберова соль.MgSO4x 7h3O – горькая соль.
Химические свойства.
1. Свойства простого вещества.
Сера может проявлять как окислительные, так и восстановительные свойства. Окислителем сера является в первую очередь по отношению к металлам:
S + 2Na = Na2SS + Ca = CaS3S +2Al = Al2S3
В качестве окислителя сера проявляет свои свойства и при взаимодействии с неметаллами:
S + h3 = h3S3S + 2P = P2S3 2S + C = CS2
Однако с неметаллами, имеющими электроотрицательность бóльшую, чем у серы, она реагирует в качестве восстановителя:
S +3F2 = SF6S + Cl2 = SCl2
Сера реагирует со сложными веществами, как правило, окислителями. Причём азотная кислота окисляет её до серной кислоты:
S + 6HNO3 = h3SO4 + 6NO2 + 2h3O
Другие окислители окисляют серу до степени окисления (+4):
S + 2h3SO4 = 3SO2 + 2h3O3S + 2KClO3 = 3SO2 + 2KCl
По механизму реакции ДИСПРОПОРЦИОНИРОВАНИЯ сера реагирует с щелочами. В процессе этой реакции образуются соединения серы (-2) и (+4):
3S + 6KOH = K2SO3 + 2K2S + 3h3O
Непосредственно с водой сера не реагирует, однако при нагревании подвергается дисмутации в атмосфере водяного пара.
Сера может быть получена в процессе реакций:
SO2 + 2CO = S + 2CO2Na2S2O3 + 2HCl = S + SO2 + 2NaCl + h3O
2. Соединения серы (-2).
У серы в степени окисления (-2) соединения называются сульфидами. Это бинарные соединения, в которых одним из элементов является металл: Na2S, ZnS, Al2S3, PbS2 и др.
Соединение серы (-2) с водородом называется сероводород – h3S. Сероводород – газ без цвета, неприятного запаха, тяжелее воздуха, очень ядовит, мало растворим в воде. Сероводород можно получить различными способами. Oбычно, в лаборатории, сероводород получают, действуя на сульфиды сильными кислотами:
FeS + 2HCl = FeCl2 + h3S
Для сероводорода и его солей характерны восстановительные свойства:
h3S + SO2 = 3S + 2h3O
В указанной реакции сера образуется по механизму конпропорционирования ( из двух атомов серы, имеющих различные степени окисления (-2) и (+4) образуется соединение серы со степенью окисления (0).
SO2 + 2CO = S + 2CO2Na2S2O3 + 2HCl = S + SO2 + 2NaCl + h3O
В лаборатории сероводород получают:
FeS + 2HCl = FeCl2 + h3S
При сгорании в кислороде он образует различные продукты:
2h3S + O2 = 2h3O + 2S (недостаток кислорода)2h3S + 3O2 = 2h3O + 2SO2 (избыток кислорода)
Cероводород легко окисляется галогенами, оксидом серы, хлоридом железа (III):
h3S + Cl2 = 2HCl + S2h3S + SO2 = 2h3O + 3Sh3S + 2FeCl3 = 2FeCl2 + S + 2HCl
На воздухе сероводород окисляет серебро, чем и объясняется почернение серебряных изделий со временем:
2h3S + 4Ag + O2 = 2Ag2S + 2h3O
Водные растворы сероводорода являются слабой кислотой. Диссоциирует в две стадии, образует два типа солей: гидросульфиды и сульфиды:
h3S ↔ HS-1 + H+HS-1 ↔ H+ + S-2
Сульфиды большинства металлов нерастворимы и имеют различную окраску. Это является фактором, благодаря которому можно распознавать те или иные катионы в растворах:
Чёрные – HgS, Ag2S, PbS, CuS, FeS, NiS;
Коричневые – SnS, Bi2S3;
Оранжевые – Sb2S3, Sb2S5;
Жёлтые – As2S3, As2S5, SnS2, CdS;
Розовые - MnS
Белые – ZnS, Al2S3, BaS, CaS;
Cульфиды в водной среде проявляют восстановительные свойства, обычно окисляясь до серы: 
3h3S + 2KMnO4 = 3S + 2MnO2 + 2KOH + 2h3O
h3S + 2HNO3 = S + 2NO2 + 2h3O3h3S + 2FeCl3 = S + FeS + 6HClh3S + J2 = S + 2HJ
При взаимодействии с более сильными окислителями сульфиды окисляются до соединений со степенью окисления (+6):
h3S + 4h3O + Cl2 = h3SO4 + 8HClMnS + 3HNO3 = MnSO4 + 8NO2 + 4h3OPbS + 4h3O2 = PbSO4 + 4h3O
3. Соединение серы (+4).
Из соединений серы со степенью окисления (+4) наиболее характерны оксид серы (SO2) или сернистый газ и сернистая кислота (h3SO3) и её соли. Оксид серы представляет собой газ с резким запахом, бесцветный, тяжелее воздуха, хорошо растворяется в воде. Получают при неполном горении сероводорода или при окислении сульфидов. В лаборатории его получают при взаимодействии меди с концентрированной серной кислотой:
Cu + h3SO4 = CuSO4 + SO2 + h3ONa2SO3 + 2HCl = 2NaCl + SO2 + h3O
Для оксида серы (+4) характерны как окислительные:
SO2 + h3S = 3S + 2h3O
так и восстановительные свойства:
2SO2 + O2 = 2SO3 2SO2 + 2h3O + Br2 = h3SO4 + 2HBrSO2 + Cl2 = SO2Cl2SO2 + 2HNO3 = h3SO4 + 2NO2
Оксид серы (+4) – типичный кислотный оксид, он реагирует с основания-ми с образованием солей, с водой образует сернистую кислоту:
SO2 + 2NaOH = Na2SO4 + h3OSO2 + h3O = h3SO3
Сернистая кислота – слабая кислота, диссоциирует в две стадии, образует два типа солей: кислые - гидросульфитыи средние -сульфиты :
h3SO3 ↔ HSO3- + H+HSO3-↔ SO32- + H+
Соли сернистой кислоты неустойчивы, разлагаются при действии более сильных кислот и при нагревании:
Na2SO3 + HNO3 = 2NaNO3 + SO2 + h3O K2SO3 = K2O + SO2
В растворах сульфит-ионы проявляют чаще всего восстановительные свойства:
Na2SO3 + 2KOH + KMnO4 = Na2SO4 + 2K2MnO4 + h3O
4. Соединения серы (+6)
Из соединений серы в степени окисления (+6) наиболее характерны оксид серы - SO3 или серный ангидрид и h3SO4 - cерная кислота. SO3 - бесцветный газ с характерным резким запахом, тяжелее воздуха, хорошо растворим в воде.
Оксид серы (+6) получают окислением оксида серы (+4) в присутствии катализатора и высоком давлении:
2SO2 + O2 = 2SO3SO3 + h3O = h3SO4
Оксид серы (+6) является сильным окислителем:
SO3 + 2KJ = J2 + K2SO3SO3 + h3S = 4SO2 + h3O25SO3 + 2P = P2O5 + 5SO2
Кроме того, он проявляет кислотные свойства, так как является кислотным оксидом:
SO3 + ZnO = ZnSO4SO3 + KOH = KHSO4SO3 + 2KOH = K2SO4 + h3O
Серная кислота, её соли.
Серная кислота представляет собой бесцветную маслообразную жидкость, максимальная плотность которой 1,84 г/мл. Исходным сырьём для получения серной кислоты является серный колчедан или пирит:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Далее, под воздействием катализатора - V2O5 происходит окисление оксида серы (+4) до оксида серы (+6):
2SO2 + O2 = 2SO3
Полученная безводная серная кислота называется олеум, т.к. в действительности, оксид серы (+4) растворяют в 98%-ной серной кислоте.
SO3 + h3O = h3SO4
Концентрированная серная кислота проявляет сильное водоотнимающее действие. Это свойство положено в основу многочисленных химических процессов, особенно в органической химии (получение спиртов, простых и сложных эфиров, альдегидов и т.д.). Концентрированная серная кислота является сильным окислителем. Например, при взаимодействии с просты-ми веществами, она окисляет их до кислот или оксидов:
2P + 5h3SO4 = 2h4PO4 + 5SO2 + 2h3OC + h3SO4 = 2SO2 + CO2 + 2h3O
При обычной температуре она окисляет галогенводороды и сероводород:
h3SO4 + 8HJ = 4J2 + h3S + 4h3Oh3SO4 + 2HBr = Br2 + SO2 + 2h3O h3SO4 + h3S = S + SO2 + 2h3O
Серная кислота термически устойчива и не летуча, поэтому способна вытеснять другие кислоты из их солей:
h3SO4 + KClO3 = KHSO4 + HClO4
Cерная кислота диссоциирует в две стадии, образует два типа солей:
кислые – гидросульфатыи средние – сульфаты:
h3SO4 ↔ HSO4- + H+
HSO4- ↔ SO42- + H+
Серная кислота проявляет свойства, характерные для остальных кислот: она реагирует с металлами, оксидами металлов, гидроксидами, солями слабых кислот. Качественной реакцией на сульфат-ионы в растворах является взаимодействие её с ионами бария Ва2+, в результате чего выпадает белый осадок:
Ba2+ + SO42- = BaSO4
При прокаливании сульфаты разлагаются на различные классы соединений в зависимости от металла, входящего в состав соли. Сульфаты щелочных металлов плавятся без разложения. Сульфаты металлов средней активности разлагаются на соответствующие оксиды:
ZnSO4 = ZnO + SO3
Сульфат железа (II) разлагается по механизму внутримолекулярной ОВР:
4FeSO4 = 2Fe2O3 + 4SO2 + O2
Сульфаты наиболее тяжёлых или малоактивных металлов разлагаются с образованием простых веществ – металла и кислорода:
HgSO4 = Hg + SO2 + O2
Некоторые сульфаты, являясь окислителями, реагируют с простыми веществами:
CaSO4 + C = CaO + SO2 + COBaSO4 + 4C = BaS + 4CO
Большое значение в промышленности, лабораторных исследованиях имеет взаимодействие серной кислоты с металлами. Эта тема заслуживает особого внимания, т.к. образуются различные продукты реакции в зависимости от положения реагируемого металла в ряду напряжений, степени разбавленности кислоты, температуры, катализаторов.
Разбавленная серная кислота с металлами, стоящими в ряду активности до водорода, при обычной температуре образует соль и водород:
h3SO4 + Zn = ZnSO4 + h3
Разбавленная кислота не реагирует с металлами, стоящими в ряду активности после водорода (медь, серебро, ртуть), но концентрированная кислота образует с ними соль, оксид серы (+4) и воду:
h3SO4 + Cu = CuSO4 + SO2 + h3O
Такие же продукты реакции концентрированная серная кислота образует при взаимодействии с металлами, стоящими в ряду активности до водорода:
2h3SO4 + Zn = ZnSO4 + SO2 + 2h3O
Однако, концентрированная серная кислота реагирует не со всеми металлами. Алюминий, железо, свинец и олово она пассивирует с образованием на их поверхности тонких оксидных плёнок, предотвращающих дальнейшее растворение металла:
h3SO4 + Al = Al2O3 + SO2 + h3O
Активные щелочные и щелочноземельные металлы могут образовывать с разбавленной кислотой не только водород. Например, магний с очень разбавленной серной кислотой на холоду образует соль, серу и воду:
h3SO4 + Mg = MgSO4 + S + h3O
Натрий при обычной температуре с очень разбавленной серной кислотой образует соль, серу и воду:
h3SO4 + Na = Na2SO4 + S + h3O,
а при охлаждении образует сероводород:
h3SO4 + Na = Na2SO4 + Н2S + h3O
Соли серной кислоты находят большое применение в промышленности, сельском хозяйстве, в быту.
Na2SO4x 10h3O – глауберова соль, применяется в медицине в качестве слабительного,(Nh5)2SO4 – азотное удобрение для сельского хозяйства,CaSO4 – безводный гипс, применяется в строительстве.CaSO4x 2h3O – водный гипс,2CaSO4 xh3O – алебастр, продукт получения гипса,MgSO4 – горькая соль, применяется в медицине как слабительное и гипотензивное средство,BaSO4 – баритова каша, средство, применяемое как рентгеноконтрастное средство.CuSO4 x 5h3O – медный купорос, применяется в строительстве,FeSO4x 7h3O – железный купорос,ZnSO4 x 7h3O – цинковый купорос,KАl(SO4)2 x 12h3O – алюмокалиевые квасцы.
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
blog.tutoronline.ru
Сера | Химия свойства элементов
Общие сведения и методы получения
Сера (S) — неметалл, представляющий собой хрупкие кристаллы желтого цвета.
Известна с древнейших времен (за 2000 лет до н.э.). Элементарную природу серы установил французский химик Лавуазье. В 1822 г, Ми-черлих обнаружил аллотропию серы. Название элемента связано с его цветом — от латинского «sulfur» светло-желтый. Русское название «сера» происходит от санскритского «сира», что также означает светло-желтый; имеется и другое древнерусское название серы «жупель» — сера горючая.
Общее содержание серы в земной коре составляет —0,1 % (по массе).
Сера встречается в природе как в свободном виде (самородная), так и в соединениях.
Известно более 200 минералов, содержащих серу. Наиболее распространены соединения серы с различными металлами — сульфиды: PbS — свинцовый блеск; ZnS — цинковая обманка; Cu2S —медный блеск; FeS2 — пирит; HgS — киноварь и др. Широко распространены в природе также сульфаты: Na2SO|- 10Н2О — глауберов»! соль; BaS04— тяжелый шпат; CaS04-2h30 — гипс и др. В виде сульфатов натрия, калия, магния и других элементов сера содержится в водах мирового океана (0,08—0,09 %), в углях, нефти, сланцах, природных газах.
Элементарную серу получают из самородных руд, используя ее способность легко плавиться. Полученную серу очищают перегонкой в рафинировочных печах, где она нагревается до кипения и конденсируется на стенках камеры в виде светло-желтого порошка или при температуре свыше 120 °С в виде жидкости, которую выпускают из камеры в формы, где она застывает в виде лалочек.
Серу получают также из сероводорода h3S и восстановлением диоксида серы S02.
Важными источниками получения серы являются пирит FeS2 и полиметаллические руды, содержащие сернистые соединения меди, цинка и других цветных металлов. Некоторое количество серы (газовая сера) получают из газов, образующихся при коксовании и газификации угля.
Физические свойства
Атомные характеристики. Атомный номер 16, атомная масса 32,064 а. е. м., атомный объем 15,38*10-6 м3/моль, атомный радиус 0,104 нм, ионные радиусы s2- 0,174 нм, s+ 0,037 нм, s6+ 0,034 нм. Конфигурация внешних электронных оболочек 3s23p4. Значения потенциалов ионизации / (эВ): 10,357; 23,4; 34,8. Сродство к электрону 2,07—2,33 эВ. Электроотрицательность 2,6.
Существует ряд кристаллических и аморфных модификаций серы. До 95,6 °С устойчива ромбическая, или a-S, с параметрами а= 1,04646 нм, 6=1,28660 нм, с = 2,44860 нм; в интервале 95,6—119,3°С моноклинная, или B -S, с параметрами решетки а=0,090 нм, 6=1,096 нм, с= 1,102 нм; 6 = 86 16'. Энергия кристаллической решетки серы 223,0 мкДж/ /кмоль. Выше 119,3°С Й -S переходит в жидкую X-S. При быстром нагреве ромбическая a-S непосредственно превращается в подвижную жидкость соломенного цвета X-S.
В жидкой сере наблюдается равновесие A ,-S =<=tB -s +n -s и при 160 °С в ней содержится 89,2 % ^-S; 4,1 % p-S; 6,7 % я -S.
Аморфная темно-красная пластическая p-S образуется при резком охлаждении жидкой серы; она нерастворима в сероуглероде и быстро переходит в ромбическую a-S.
Химические свойства
В соединениях сера проявляет степени окисления —2, +2, +3, +4, +5, +6.
Элементарная сера химически активна и взаимодействует при нагревании со многими металлами и неметаллами (за исключением золота, платины, азота, иода и инертных газов), с органическими и неорганическими соединениями. При комнатной температуре во влажном воздухе сера слабо окисляется, при 280 °С она горит в кислороде, а при 360 °С — на воздухе. Смесь паров серы и кислорода взрывается.
При обычных условиях сера с кислородом не взаимодействует. При цагреваиии на воздухе или в кислороде сера образует оксиды: S02 — оксид серы (IV), или сернистый газ, представляющий собой бесцветный газ с резким удушливым запахом, легко конденсирующийся в бесцветную жидкость, кипящую при —10 °С, хорошо растворяющуюся в воде с образованием сернистой кислоты h3S03; S03 — оксид серы (VI), серный ангидрид, представляющий собой бесцветную легкоподвижную жидкость, кипящую при 44,7 "С и кристаллизующуюся при 16,9 °С; при хранении в присутствии следов влаги превращается в длинные шелковистые кристаллы, хорошо растворяется в воде, образуя серную кислоту h3S04. Известны малоустойчивые оксиды серы: S20, SO, S203, S04, S07, S3O10.
Существует ряд кислородсодержащих кислот: h3S03— сернистая кислота — непрочное соединение, существует только в водных растворах, окисляется кислородом воздуха, превращаясь в серную кислоту h3S04, хороший восстановитель, двухосновная кислота, образует два ряда солей: сульфиты и гидросульфиты!
h3S04 — серная кислота — бесцветная маслянистая жидкость без запаха, нелетучая, кристаллизующаяся при 10,3 °С, тяжелая, активно поглощает пары воды, сильный окислитель, двухосновная кислота, образует два ряда солей: сульфаты и гидросульфаты, из которых практически нерастворимы только BaS04, PbS04 и SrS04.
h3S207 — пиросерная, или двусерная кислота. Растворением серного ангидрида S03 в серной кислоте получают олеум, состоящий главным образом из пиросерной кислоты. При охлаждении олеума кислота выделяется в виде бесцветных кристаллов. Пиросерная кислота образует соли — дисульфаты или пиросульфаты, которые при нагревании выше температуры плавления разлагаются, превращаясь в сульфаты.
h3S02 — сульфоксиловая кислота; в свободном состоянии не выделена.
h3S208 —пероксодвусерная, или надсерная, кислота, обладает сильными окислительными свойствами, образует соли персульфаты.
h3S202 — тиосернистая кислота, образуется как промежуточный продукт при различных реакциях.
h3S203 — тиосерная кислота — неустойчива, уже при комнатной температуре распадается, образует соли — тиосульфаты, которые значительно устойчивее кислоты.
h3S204 — дитионистая кислота, существует только в виде солей.
Существует группа политионовых кислот, отвечающих общей форму, ле h3S*06, где х принимает значения от 2 до 6. К группе таких кислот принадлежат h3S4O0 (тетратионовая кислота) и h3S2Oe (дитионовая кислота). Политионовые кислоты неустойчивы и известны лишь в водных растворах. Соли их — полнтионаты — более устойчивы, некоторые из них получены в виде кристаллов.
При обычных условиях сера с водородом ие соединяется, при нагревании образует соединения, отвечающие общей формуле PbS* — суль-фаны; h3S — сероводород; h3S2 — двухсернистый водород; h3S3 — трех-сернистый водород и т. д. Водные растворы сульфанов обладают свойствами слабых двухосновных кислот. Сероводород h3S —бесцветный газ с характерным запахом, ядовитый, немного тяжелее воздуха, горючий, легко воспламеняется, сильный восстановитель, хорошо растворяется в воде, образуя сероводородную кислоту, соли которой — сульфиды.
Остальные сульфаны — малоустойчивые желтоватые маслянистые жидкости; растворимы в воде с образованием соответствующих кислот, соли которых — полисульфиды.
Сера взаимодействует почти со всеми металлами (кроме золота, иридия, платины), образуя сульфиды. Прн комнатной температуре сера соединяется со щелочными н щелочноземельными металлами, а также с Си, Ag, Hg; при иагреваиин — с Pb, Sn, Ni, Со, Zn, Mn, Cr, Al; в присут ствии влаги — с Fe; тугоплавкие металлы н некоторые металлы платиновой группы взаимодействуют с серой прн высокой температуре в мелкораздробленном состоянии; некоторые — с парами серы под дав лением.
Различают основные сульфиды (Na2S, MgS), амфотерные (A1 2 S3, Cr 2 S3) и кислотные (MoS, WS3). Сульфиды могут соединяться друг с другом, образуя тиосоли (например. Na2WS4 — тиовольфрамат натрия).
Соединения серы с азотом получены косвенным путем. Известны N4S4 —азотистая сера — золотисто-желтые кристаллы с температурой плавления 178 °С; при ударе и нагревании выше температуры плавления разлагаются на элементы, в воде не растворяются; N2 S4 — четырехсер-иистый азот — темно-красные кристаллы с температурой плавления 23 °С, постепенно самопроизвольно разлагающиеся; при нагревании вспыхивают, в воде не растворяются; N2Ss — сернистый азот.
При 800—900 °С сера взаимодействует с углеродом, образуя сероуглерод CS2 — бесцветную жидкость, которая кипит при 40 °С, плохо растворяется в воде; сероуглерод хорошо растворяет жиры, масла, смолы, склонен к полимеризации. При взаимодействии углерода, кислорода и серы при высокой температуре образуется серооксид COS. Известны неустойчивые низшие сульфиды углерода: CS — белый налет, который уже при —180 "С со взрывом превращается в коричневый продукт полимери. зации (OS)*; несколько более устойчива C3S2 —слезоточивая жидкость, затвердевающая при 5 °С и склонная к полимеризации.
При сплавлении фосфора с серой, взятых в соответствующих соотношениях, образуются тиоангидриды P4S3, P4S5, P4S7, P4Si0, которые гид-ролизуются во влажном воздухе с выделением фосфииа РН3.
Галогены, за исключением иода, непосредственно соединяются с се рой. Уже на холоду сера энергично взаимодействует со фтором, образуя ряд соединений: SF6 — бесцветный газ, термически и химически стойкий, не реагирующий с водой, соляной кислотой, едким натром, водородом и кислородом; SF4 — бесцветный газ, энергично взаимодействующий с во-дой, термически устойчивый до 600 °С, хороший фторирующий агент; S2Fi0 и др.
При полном отсутствии влаги уже при комнатной температуре сера взаимодействует с хлором н бромом, образуя соединения: S2C19 — оранжево-желтую маслянистую жидкость с температурой кипения 137 "С, хорошо растворяющую серу, дымящую во влажном воздухе; в воде подвергается гидролизу; SC12 — красную жидкость с удушливым за. пахом, гидролитически разлагающуюся водой; SC14 — белый порошок, устойчивый только в твердом состоянии при низкой температуре; S2Br2 — красную маслянистую жидкость, очень чувствительную к влаге воздуха; прн температуре выше 90 °С разлагается на элементы.
Соединения серы с иодом неустойчивы, легко разлагаются. Получены соединения S*I2, где х —от 2 до 6.
Кроме того, известны галогенопроизводные сульфанов, имеющие общую формулу Sx(^)2, где X — галогены. Многообразны оксигалогениды серы общей формулы SO(A")2и S02(X)2.
С водой и разбавленными кислотами сера не взаимодействует. Концентрированная азотная кислота окисляет серу до серной кислоты. Соляная кислота не действует на серу, но в присутствии окислителей пе реводит серу в серную кислоту. Царская водка также окисляет серу до серной кислоты. Концентрированная серная кислота на холоду на серу не действует, с расплавленной серой реагирует с образованием сернисто го газа S02и воды.
Со щелочами сера взаимодействует с образованием сульфидов и сульфитов (реакция обратимая). При нагревании в растворе аммиака Nh4 сера образует полисульфид и тиосульфат аммония.
Расплавленная сера реагирует с оксидами щелочных металлов с образованием сульфидов, сульфитов и сульфатов. С оксидами тяжелых металлов сера заметно взаимодействует при 150—200 °С с выделением сернистого газа.
В воде сера практически не растворяется, хорошо растворяется в безводном аммиаке, сероуглероде и ряде органических растворителей (феноле, бензоле, дихлорэтане и др.).
Области применения
Основной потребитель серы — химическая промышленность: около 50% добываемой серы идет на производство серной кислоты. Большое количество серы расходуется в резиновой и целлюлозно-бумажной промышленности, вискозном и спичечном производстве, в органическом синтезе (получение сернистых красителей, сероуглерода, искусственных волокон, фармацевтических препаратов, ускорителей вулканизации каучука). Серу применяют при получении различных цементов, замазок, асфальтов, дымного пороха, светящихся составов, бенгальских огней.
В сельском хозяйстве серу широко применяют в виде серного цвета, используя для уничтожения некоторых вредителей растений; серные удобрения повышают морозостойкость растений и злаков.
Добавки серы улучшают обрабатываемость автоматных сталей и антифрикционные свойства спеченных антифрикционных материалов.
В медицине используют как элементарную серу, так и ее соединения. Все сульфамидные препараты — это органические соединения серы.
Широко применяются соединения серы:
— FeS2 (пирит) — для получения серной кислоты; сульфиды щелочных и щелочноземельных металлов (Na2S, CaS и BaS) —в кожевенной промышленности; сульфиды цинка ZnS и кадмия CdS служат основой люминофоров; некоторые сульфиды обладают полупроводниковыми свойствами и применяются в электронной технике; многие природные сульфиды используются в металлургии для выплавки цветных и редких металлов;
— оксид серы (IV) S02 — для получения серной кислоты; для отбеливания соломы, шерсти, шелка; как дезинфицирующее средство; для лечения домашних животных;
— сульфиты калия K2S03 и натрия Na2S0.3 для отбеливания некоторых материалов в текстильной промышленности при крашении тканей, в фотографии;
— гидросульфит кальция Ca(HS03)2 — при переработке древесины в сульфитную целлюлозу, из которой затем получают бумагу;
— сульфат натрия Na2S04 — при производстве стекла; глауберову соль Na2SO4-10h3O в медицине; гипс CaS04-2h30 для изготовления отливочных форм и слепков с различных предметов, в строительстве, в хирургии; медный купорос CaS04-5h30 — в сельском хозяйстве, для приготовления минеральных красок, для электролитического покрытия металлов медью; алюмокалиевые квасцы KA1(S04)2- 12Н20 — для дубления кожи, в красильном деле;
— олеум h3S207 — для очистки нефтепродуктов, для производства некоторых красителей и взрывчатых веществ;
— серная кислота h3S04 — для получения минеральных удобрений, некоторых кислот (НС1, Н3Р04 и др.), взрывчатых веществ, красок, при очистке керосина, нефтяных масел и продуктов коксохимического производства (бензола, толуола), при травлении черных металлов (снятия окалины), в свинцовых аккумуляторах;
— персульфаты — как средства для отбелки, в качестве окислителей в лабораторной практике и для некоторых технических целей;
— тиосульфат натрия Na2S203 — в фотографии как закрепитель, в текстильной промышленности для удаления остатков хлора после отбелки тканей, в медицине и ветеринарии;
— хлорид серы (I) S2C12 — для вулканизации каучука.
ibrain.kz
Cера — химические свойства, получение, соединения. VIа группа » HimEge.ru
Сера расположена в VIа группе Периодической системы химических элементов Д.И. Менделеева.На внешнем энергетическом уровне атома серы содержится 6 электронов, которые имеют электронную конфигурацию 3s23p4. В соединениях с металлами и водородом сера проявляет отрицательную степень окисления элементов -2, в соединениях с кислородом и другими активными неметаллами – положительные +2, +4, +6. Сера – типичный неметалл, в зависимости от типа превращения может быть окислителем и восстановителем.
Сера встречается в свободном (самородном) состоянии и связанном виде.
Важнейшие природные соединения серы:
FeS2 — железный колчедан или пирит,
ZnS — цинковая обманка или сфалерит (вюрцит),
PbS — свинцовый блеск или галенит,
HgS — киноварь,
Sb2S3 — антимонит.
Кроме того, сера присутствует в нефти, природном угле, природных газах, в природных водах (в виде сульфат-иона и обуславливает «постоянную» жёсткость пресной воды). Жизненно важный элемент для высших организмов, составная часть многих белков, концентрируется в волосах.
Аллотропия — это способность одного и того же элемента существовать в разных молекулярных формах (молекулы содержат разное количество атомов одного и того же элемента, например, О2 и О3, S2 и S8, Р2 и Р4 и т.д).
Сера отличается способностью образовывать устойчивые цепочки и циклы из атомов. Наиболее стабильны S8, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета.
Открытые цепи имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую).
1) ромбическая — S8
t°пл. = 113°C; r = 2,07 г/см3
Наиболее устойчивая модификация.
2) моноклинная — темно-желтые иглы
t°пл. = 119°C; r = 1,96 г/см3
Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую.
3) пластическая — коричневая резиноподобная (аморфная) масса
Неустойчива, при затвердевании превращается в ромбическую
- Промышленный метод — выплавление из руды с помощью водяного пара.
- Неполное окисление сероводорода (при недостатке кислорода):
2h3S + O2 → 2S + 2h3O
- Реакция Вакенродера:
2h3S + SO2 → 3S + 2h3O
Окислительные свойства серы(S0 + 2ē → S-2)
1) Сера реагирует со щелочными металлами без нагревания:
2Na + S → Na2S
c остальными металлами (кроме Au, Pt) — при повышенной t°:
2Al + 3S –→ Al2S3
Zn + S –→ ZnS
2) С некоторыми неметаллами сера образует бинарные соединения:
h3 + S → h3S
2P + 3S → P2S3
C + 2S → CS2
Восстановительные свойства сера проявляет в реакциях с сильными окислителями:(S — 2ē → S+2; S — 4ē → S+4; S — 6ē → S+6)
3) c кислородом:
S + O2 –t° → S+4O2
2S + 3O2 –t°;pt → 2S+6O3
4) c галогенами (кроме йода):
S + Cl2→ S+2Cl2
S + 3F2→ SF6
Со сложными веществами:
5) c кислотами — окислителями:
S + 2h3SO4(конц) → 3S+4O2 + 2h3O
S + 6HNO3(конц) → h3S+6O4 + 6NO2 + 2h3O
Реакции диспропорционирования:
6) 3S0 + 6KOH → K2S+4O3 + 2K2S-2 + 3h3O
7) сера растворяется в концентрированном растворе сульфита натрия:
S0 + Na2S+4O3 → Na2S2O3 тиосульфат натрия


himege.ru
Сера - Наука и образование
В периодической системе химических элементов сера занимает место в главной подгруппе VI группы. Внешний электронный слой её атома содержит 6 электронов, т.е. близок к завершению. Отсюда следует ожидать, что сера должна быть ярко выраженным неметаллом.
Химический знак – S
Атомный вес – 32
Заряд ядра – 16
Формула оксида серы – SO2
Уравнение реакции серы с водородом – h3 + S = h3S
Физические свойства серы
В природе свободная сера встречается в виде прозрачных кристаллов золотисто–желтого цвета. В виде порошка она продается в аптеках и магазинах химических товаров.
Сера – твердое вещество желтого цвета. Она легко измельчается в порошок (в продаже такой порошок называется молотой серой). Свободная сера проявляет все признаки неметалла. Кристаллическая решетка серы молекулярная и слагается из восьмизвенных кольцеобразных молекул S8. Поэтому сера легкоплавка: она плавится при температуре, лишь немного превышающей точку кипения воды. При дальнейшем нагревании сера загустевает, превращаясь в другую аллотропную модификацию, называемую пластической серой.
Пластическая сера состоит из цепочкообразных молекул очень большой длины, беспорядочно перепутанных. Поэтому по свойствам она похожа на резину: при растяжении сильно растягивается, а при отпускании сокращается. Растягивание происходит за счет распрямления ее нитевидных молекул в направлении растягивающей силы, а сокращение – за счет обратного скручивания их, подобно спутанным в клубок пружинкам при растягивании и отпускании клубка.
При сильном нагревании сера переходит в пар бурого цвета.
Сера нерастворима в воде и даже не смачивается ею. Если бросить в воду щепотку молотой серы, частички серы не потонут, а останутся плавать на поверхности, образуя на ней желтую пленку. Такое всплывание мелких частиц вещества, не смачивающегося водой, называется флотацией (тот же корень имеет слово «флот»).
Подобно свободной сере, не смачиваются водой многие природные соединения серы с металлами. Примеси же, образующие в таких рудах «пустую породу», смачиваются водой. Поэтому флотация широко применяется в металлургии как метод обогащения руд, т. е. отделения нужного минерала от пустой породы.
Химические свойства серы
Поскольку сера – неметалл, изучим сначала реакции ее с металлами. Нам уже известно, что смесь порошков серы и железа после нагревания в одном месте сама собой раскаляется вследствие происходящей экзотермической реакции, и получается сернистое железо:
Fe + S = FeS
Смесь порошков серы и алюминия или цинка при поджигании реагирует мгновенно с ослепительной вспышкой. Образуются в виде белых порошков сернистый алюминий или сернистый цинк:
Zn + S = ZnS
2Al + 3S = Al2S3
При этом часть продукта реакции в виде мельчайших частичек выбрасывается в воздух, образуя белое облачко.
Пучок из медных проволок сгорает в парах серы, образуя черную сернистую медь:
2Cu + S = Cu2S
С некоторыми металлами сера взаимодействует даже при обычной температуре. Так, при растирании в ступке жидкой ртути с порошком серы получается сернистая ртуть:
Hg + S = HgS
Соединения серы с металлами называются сернистыми металлами или сульфидами.
Сера взаимодействует также с водородом. При пропускании водорода в пробирку с кипящей жидкой серой у отверстия газоотводной трубки ощущается запах тухлых яиц. Это запах газообразного соединения серы с водородом – сероводорода. Уравнение реакции:
h3 + S = h3S
Сера, как и кислород, в соединениях с водородом и металлами отрицательно двухвалентна. Поэтому по составу сероводород сходен с водой, а сульфиды – с окислами металлов:
|
h3+S2- Сероводород |
Na2+S2- Сульфид натрия |
Zn2+S2- Сульфид цинка |
Al23+S32- Сульфид алюминия |
|
h3+O2- Вода |
Na2+O2- Окись натрия |
Zn2+O2- Окись цинка |
Al23+O32- Окись алюминия |
Перейдем теперь к рассмотрению реакции соединения серы с кислородом. Сера находится втой же главной подгруппе VI группы, что и кислород. Известно, что в главных подгруппах неметаллические свойства химических элементов с возрастанием порядкового номера ослабляются. Следовательно, по отношению к кислороду сера выступает как электроположительный элемент, т.е. электроны должны смещаться от атомов серы к атомам кислорода. Ее связи с кислородом полярны, сера проявляет в них положительную, а кислород – отрицательную валентность. В образовании этих связей могут принимать участие 4 из 6 валентных электронов атома серы или все 6. В первом случае образуется окисел SO2 – двуокись серы, во втором – SO3 – трехокись серы.
Сера легко соединяется с кислородом, сгорая на воздухе голубым, а в кислороде ярко–синим пламенем. При этом возникает характерный резкий запах сернистого газа:
S + O2 = SO2
Как и все бесцветные газы, сернистый газ невидим. Но при сгорании серы он всегда получается слегка мутным от присутствия Й нем мельчайших частичек трехокиси серы, в которую превращается небольшая часть сгорающей серы.
scibio.ru
Урок 15. Сера – HIMI4KA

Строение атома и свойства серы
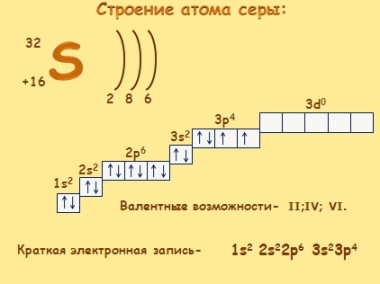
Сера — элемент шестой группы третьего периода периодической системы Менделеева. Поэтому строение атома серы изображается так:
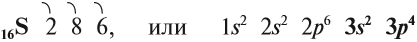
Строение атома серы указывает на то, что это неметалл, т. е. атом серы способен и к приёму электронов и к отдаче электронов:
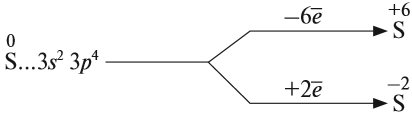
Задание 15.1. Составить формулы соединений серы, содержащие атомы серы с данными степенями окисления.
Простое вещество «сера» — твёрдый хрупкий минерал жёлтого цвета, нерастворимый в воде. В природе встречается как самородная сера, так и её соединения: сульфиды, сульфаты. Сера как активный неметалл легко реагирует с водородом, кислородом, почти со всеми металлами и неметаллами:

Задание 15.2. Назовите полученные соединения. Определите, какие свойства (окислителя или восстановителя) проявляет сера в этих реакциях.
Как типичный неметалл простое вещество сера может быть и окислителем, и восстановителем:
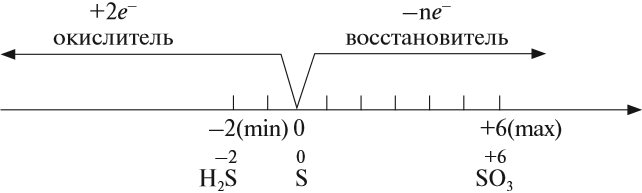
Иногда эти свойства проявляются в одной реакции:
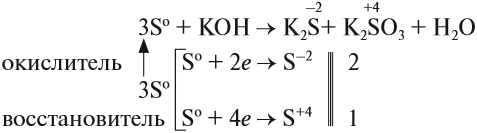
Поскольку атом-окислитель и атом-восстановитель одинаковые, их можно «сложить», т. е. на оба процесса нужно три атома серы.
Задание 15.3. Расставьте остальные коэффициенты в этом уравнении.
Сера может реагировать с кислотами — сильными окислителями:
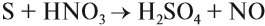
Таким образом, являясь активным неметаллом, сера образует множество соединений. Рассмотрим свойства сероводорода, оксидов серы и их производных.


Сероводород
h3S — сероводород, сильно ядовитый газ с противным запахом тухлых яиц. Правильнее сказать, белки яиц при гниении разлагаются, выделяя сероводород.
Задание 15.4. Исходя из степени окисления атома серы в сероводороде, предcкажите, какие свойства будет проявлять этот атом в окислительно-восстановительных реакциях.
Поскольку сероводород — восстановитель (атом серы имеет низшую степень окисления), он легко окисляется. Кислород воздуха окисляет сероводород даже при комнатной температуре:

Сероводород горит:
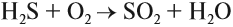
Сероводород немного растворим в воде, причём его раствор проявляет свойства очень слабой кислоты (сероводородной h3S). Она образует соли сульфиды:
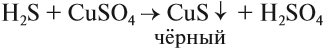
Вопрос. Как, имея сульфид, получить сероводород?
Сероводород в лабораториях получают, действуя на сульфиды более сильными (чем h3S) кислотами, например:
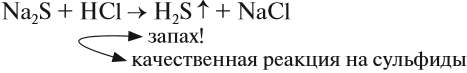


Сернистый газ и сернистая кислота
SO2— сернистый газ с резким удушливым запахом. Ядовит. Растворяется в воде, образуя сернистую кислоту:
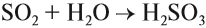
Эта кислота средней силы, но очень неустойчива, существует только в растворах. Поэтому при действии на её соли — сульфиты — другими кислотами можно получить сернистый газ:
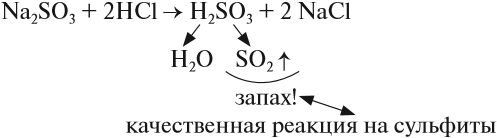
При кипячении полученного раствора эта кислота разлагается полностью.
Задание 15.5. Определите степень окисления серы в сернистом газе, сернистой кислоте, сульфите натрия.
Поскольку степень окисления +4 для серы является промежуточной, все перечисленные соединения могут быть и окислителями и восстановителями:
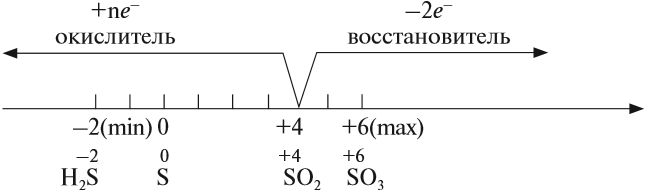
Например:
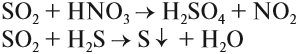
Задание 15.6. Расставьте коэффициенты в этих схемах методом электронного баланса. Укажите, какие свойства проявляет атом серы со степенью окисления +4 в каждой из реакций.
Восстановительные свойства сернистого газа применяются на практике. Так, при восстановлении теряют цвет некоторые органические соединения, поэтому оксид серы IV и сульфиты применяют при отбеливании. Сульфит натрия, растворённый в воде, замедляет коррозию труб, так как легко поглощает кислород из воды, а именно кислород является «виновником» коррозии:
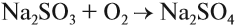
Окисляясь в присутствии катализатора, сернистый газ превращается в серный ангидрид SO3:
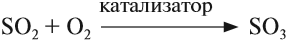


Серный ангидрид и серная кислота
Серный ангидрид SO3 — бесцветная жидкость, бурно реагирующая с водой:
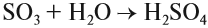
Серная кислота h3SO4 — сильная кислота, которая в концентрированном виде активно поглощает влагу из воздуха (это свойство применяется при осушении различных газов) и из некоторых сложных веществ:
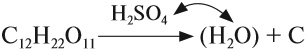
Кроме того, концентрированная серная кислота, являясь сильным окислителем, окисляет углерод:

Поэтому, попадая на кожу, концентрированная серная кислота вызывает тяжёлые ожоги, а попадая на ткани, бумагу и другие вещества, обугливает их.
Являясь окислителем (+6 — высшая степень окисления для серы!), концентрированная серная кислота реагирует почти со всеми металлами (кроме железа и благородных металлов) без выделения водорода:
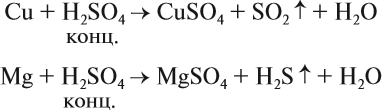
Задание 15.7. Уравняйте эти схемы методом электронного баланса. Укажите, какой атом является окислителем в каждом случае.
Но разбавленная серная кислота и её соли — сульфаты — окислительных свойств (за счёт атома серы) практически не проявляют:
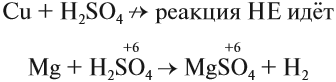
Задание 15.8. Определите, какой атом является окислителем в данной реакции.
Растворы серной кислоты проявляют все свойства сильных кислот.
Задание 15.9. Составьте уравнения реакций, отражающие эти свойства. (При затруднении см. урок 2.2.)
Качественной реакцией на SO42– является образование белого осадка BaSO4, нерастворимого в кислотах:
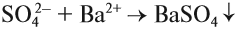
Серная кислота имеет разнообразное применение: её используют при получении стиральных порошков, лекарств, красителей, удобрений и других необходимых веществ.


Выводы
Изложенное выше можно отразить в шутливом стишке: «Сера, сера, буква S, 32 атомный вес, сера в воздухе горит, образует ангидрид (какой кислоты?), ангидрид плюс вода — получилась кислота (какая?)».
Урок 15. Сера
5 (100%) 5 voteshimi4ka.ru





















