Ацетилен. Этин вода
Этин Википедия
| Ацетилен | |
 | |
  | |
| Этин | |
| Ацетилен | |
| C2h3 | |
| 26,038[1] г/моль | |
| 1,0896 г/л | |
| 11,4±0,1 эВ[2] | |
| -80,8 1277 мм Hg °C | |
| −119±1 °F[2] | |
| −83,6 °C | |
| 335 °C | |
| 2,5±0,1 об.%[2] | |
| −80,55 | |
| 35,2°С; 6,4 МПа | |
| 44,036 Дж/(моль·К) | |
| -227,4 кДж/моль | |
| 1302 кДж/моль | |
| 44,2±0,1 атм[2] | |
| 25 | |
| 10018 мл/100 мл | |
| 60018 мл/100 мл | |
| sp | |
| 74-86-2 | |
| 6326 | |
| 200-816-9 | |
| AO9600000 | |
| 27518 | |
| 1001 | |
| 6086 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Ацетиле́н (по ИЮПАК — этин) — органическое соединение, непредельный углеводород C2h3. Имеет тройную связь между атомами углерода, принадлежит к классу алкинов. При нормальных условиях — бесцветный газ.
Получение
В лаборатории
В лаборатории, а также в газосварочном оборудовании, ацетилен получают действием воды на карбид кальция[3] (Ф. Вёлер, 1862 год),
CaC2+2h3O→Ca(OH)2+C2h3↑{\displaystyle {\mathsf {CaC_{2}+2H_{2}O\rightarrow Ca(OH)_{2}+C_{2}H_{2}\uparrow }}}а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
2Ch5→C2h3+3h3{\displaystyle {\mathsf {2CH_{4}\rightarrow C_{2}H_{2}+3H_{2}}}}В промышленности
В промышленности ацетилен получают гидролизом карбида кальция и пиролизом углеводородного сырья — метана или пропана с бутаном. В последнем случае ацетилен получают совместно с этиленом и примесями других углеводородов. Карбидный метод позволяет получать очень чистый ацетилен, но требует высокого расхода электроэнергии. Пиролиз существенно менее энергозатратен, т.к. для нагрева реактора используется сгорание того же рабочего газа во внешнем контуре, но в газовом потоке продуктов концентрация самого ацетилена низка. Выделение и концентрирование индивидуального ацетилена в таком случае представляет сложную задачу. Экономические оценки обоих методов многочисленны, но противоречивы[4][:стр. 274].
Получение пиролизом
Электрокрекинг
Метан превращают в ацетилен и водород в электродуговых печах (температура 2000—3000 °С, напряжение между электродами 1000 В). Метан при этом разогревается до 1600 °С. Расход электроэнергии составляет около 13000 кВт•ч на 1 тонну ацетилена, что относительно много (примерно равно затрачиваемой энергии по карбидному методу) и потому является недостатком процесса. Выход ацетилена составляет 50 %.
Регенеративный пиролиз
Иное название — Вульф-процесс. Сначала разогревают насадку печи путём сжигания метана при 1350—1400 °С. Далее через разогретую насадку пропускают метан. Время пребывания метана в зоне реакции очень мало и составляет доли секунды. Процесс реализован в промышленности, но экономически оказался не таким перспективным, как считалось на стадии проектирования.
Окислительный пиролиз
Метан смешивают с кислородом. Часть сырья сжигают, а образующееся тепло расходуют на нагрев остатка сырья до 1600 °С. Выход ацетилена составляет 30—32 %. Метод имеет преимущества — непрерывный характер процесса и низкие энергозатраты. Кроме того, с ацетиленом образуется еще и синтез-газ. Этот процесс (Заксе-процесс или BASF-процесс) получил наиболее широкое внедрение.
Гомогенный пиролиз
Является разновидностью окислительного пиролиза. Часть сырья сжигают с кислородом в топке печи, газ нагревается до 2000 °С. Затем в среднюю часть печи вводят остаток сырья, предварительно нагретый до 600 °С. Образуется ацетилен. Метод характеризуется большей безопасностью и надёжностью работы печи.
Пиролиз в струе низкотемпературной плазмы
Процесс разрабатывается с 1970-х годов, но, несмотря на перспективность, пока не внедрён в промышленности. Сущность процесса состоит в нагреве метана ионизированным газом. Преимущество метода заключается в относительно низких энергозатратах (5000—7000 кВт•ч) и высоких выходах ацетилена (87 % в аргоновой плазме и 73 % в водородной).
Карбидный метод
Этот способ известен с XIX века, но не потерял своего значения до настоящего времени. Сначала получают карбид кальция, сплавляя оксид кальция и кокс в электропечах при 2500—3000 °С:
CaO+3C→CaC2+CO{\displaystyle {\mathsf {CaO+3C\rightarrow CaC_{2}+CO}}}Известь получают из карбоната кальция:
CaCO3→CaO+CO2{\displaystyle {\mathsf {CaCO_{3}\rightarrow CaO+CO_{2}}}}Далее карбид кальция обрабатывают водой:
CaC2+2h3O→C2h3+Ca(OH)2{\displaystyle {\mathsf {CaC_{2}+2H_{2}O\rightarrow C_{2}H_{2}+Ca(OH)_{2}}}}Получаемый ацетилен имеет высокую степень чистоты 99,9 %. Основным недостатком процесса является высокий расход электроэнергии: 10000—11000 кВт•ч на 1 тонну ацетилена.
Физические свойства
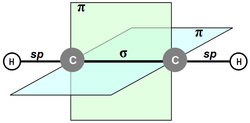 Рис.1. Пи-связи в молекуле ацетилена
Рис.1. Пи-связи в молекуле ацетилена При нормальных условиях — бесцветный газ, легче воздуха. Чистый 100 % ацетилен не обладает запахом. Технический ацетилен хранится в баллонах с пористым наполнителем, пропитанным ацетоном (т.к. чистый ацетилен при сжатии взрывается), и может содержать другие примеси, которые придают ему резкий запах[5]. Малорастворим в воде, хорошо растворяется в ацетоне. Температура кипения −83,6 °C[6]. Тройная точка −80,55 °C при давлении 961,5 мм рт. ст., критическая точка 35,18 °C при давлении 61,1 атм[7].
Ацетилен требует большой осторожности при обращении. Может взрываться от удара, при нагреве до 500 °C или при сжатии выше 0,2 МПа[8] при комнатной температуре. Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки. Для хранения ацетилена используются специальные баллоны, заполненные пористым материалом, пропитанным ацетоном[9].
Ацетилен обнаружен на Уране и Нептуне.
Химические свойства
 Ацетилено-кислородное пламя (температура «ядра» 2621 °C)
Ацетилено-кислородное пламя (температура «ядра» 2621 °C) Для ацетилена (этина) характерны реакции присоединения:
HC≡CH + Cl2 -> ClCH=СНСl
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³ (50,4 МДж/кг). При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в ~500 °C. В присутствии катализаторов, например, трикарбонил(трифенилфосфин)никеля, температуру реакции циклизации можно снизить до 60-70 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так, ацетилен вытесняет метан из эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра и одновалентной меди.
Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.):
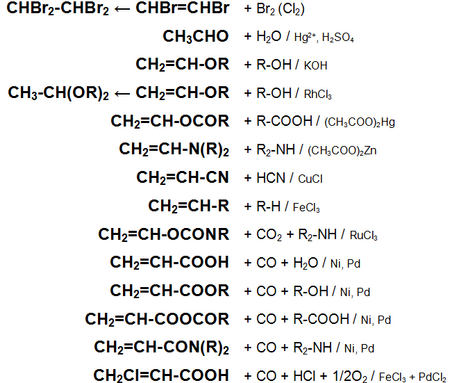
Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации, сводная таблица 2.):
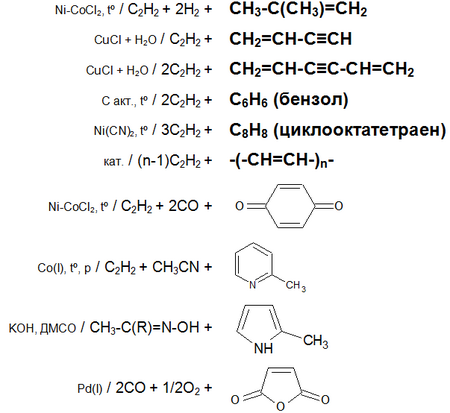
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Реагирует с аммиачными растворами солей Cu(I) и Ag(I) с образованием малорастворимых, взрывчатых ацетиленидов — эта реакция используется для качественного определения ацетилена и его отличия от алкенов (которые тоже обесцвечивают бромную воду и раствор перманганата калия).
История
Открыт в 1836 году Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. Бертло (1862 год).
Применение
 Ацетиленовая лампа
Ацетиленовая лампа Ацетилен используют:
- для газовой сварки и резки металлов,
- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидная лампа),
- в производстве взрывчатых веществ (см. ацетилениды),
- для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
- для получения технического углерода
- в атомно-абсорбционной спектрофотометрии при пламенной атомизации
- в ракетных двигателях (вместе с аммиаком)[10]
Безопасность

Поскольку ацетилен нерастворим в воде, и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций, его нельзя собирать в газометры.
Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3—80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном.
При длительном соприкосновении ацетилена с медью и серебром образуются ацетилениды меди и серебра, которые взрываются при ударе или повышении температуры. Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов).
Ацетилен обладает незначительным токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м³ согласно гигиеническим нормативам ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населённых мест».
ПДКр.з. (рабочей зоны) не установлен (по ГОСТ 5457-75 и ГН 2.2.5.1314-03), так как концентрационные пределы распределения пламени в смеси с воздухом составляет 2,5—100 %.
Хранят и перевозят его в заполненных инертной пористой массой (например, древесным углём) стальных баллонах белого цвета (с красной надписью «А») в виде раствора в ацетоне под давлением 1,5—2,5 МПа.
Примечания
- ↑ ГОСТ 5457-75. Ацетилен растворённый и газообразный технический. Технические условия
- ↑ 1 2 3 4 http://www.cdc.gov/niosh/npg/npgd0008.html
- ↑ Видео данного процесса
- ↑ Лапидус А. Л., Голубева И. А., Жагфаров Ф. Г. Газохимия. Учебное пособие. — М.: ЦентрЛитНефтеГаз, 2008. — 450 с. — ISBN 978-5-902665-31-1.
- ↑ Большая энциклопедия нефти и газа. Неприятный запах — ацетилен. Проверено 10 октября 2013.
- ↑ Корольченко. Пожаровзрывоопасность веществ, 2004, с. 198.
- ↑ Миллер. Ацетилен, его свойства, получение и применение, 1969, с. 72.
- ↑ Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
- ↑ Ацетилен. Проверено 10 октября 2013.
- ↑ В России разработали ракетный двигатель на аммиаке — Известия
Литература
- Миллер С. А. Ацетилен, его свойства, получение и применение. — Л.: Химия, 1969. — Т. 1. — 680 с.
- Корольченко А. Я., Корольченко Д. А. Пожаровзрывоопасность веществ и материалов и средства их тушения. Справочник: в 2-х частях. Часть 1. — М.: Ассоциация «Пожнаука», 2004. — 713 с. — ISBN 5-901283-02-3.
Ссылки
wikiredia.ru
Химические свойства ацетилена, основные химические реакции, применение
Синтетический каучук, этиловый спирт, уксусная кислота, поливинилхлоридные смолы, бензол – это далеко не полный перечень важнейших химических соединений. Их производит промышленность органического синтеза. Получают эти продукты из ацетилена. Химические свойства ненасыщенных углеводородов с тройной связью, к которым относится данное вещество, обуславливают их способность к реакциям присоединения, окисления и полимеризации. Отдельно нужно сказать о высокой энергоемкости газа.

Поэтому этин в смеси с кислородом применяется в сварке металлических деталей. Они могут быть изготовлены из чугуна, стали и цветных металлов. Горение ацетилена можно контролировать, что является большим преимуществом. Вещество используют в качестве сырья для производства полимеров, растворителей, волокон и других ценных материалов. Наличие двойных связей в молекуле обеспечивает способность к присоединению атомов других химических элементов. При сгорании соединения выделяется много тепла. В нашей статье мы подробно изучим перечисленные выше химические свойства ацетилена, называемого еще этином, а также выясним способы получения его в промышленности.
Как строение молекулы обуславливает свойства органического вещества
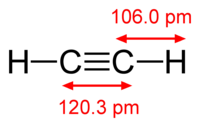
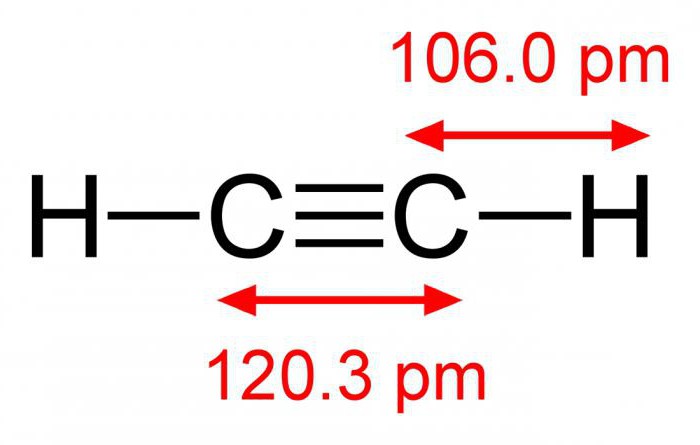
Линейная молекула этина содержит в своем составе два атома углерода, связанных между собой одной сигма- и двумя пи-связями. Углеродные атомы находятся в состоянии sp-гибридизации. Два атома водорода вместе с углеродным скелетом располагаются в плоскости молекулы, а двойные связи ориентированы во взаимно перпендикулярных плоскостях. Такие реакции ацетилена, как окисление бромной воды или присоединение галогеноводородов, происходят по месту разрыва пи-связей. По сравнению с веществами ряда этилена, эти процессы протекают у алкинов намного активнее. Это обусловлено присутствием в их молекулах тройной связи. Она же объясняет и тот факт, что реакция присоединения осуществляется в две стадии: сначала образуются соединения ряда этена, затем – конечный продукт, относящийся к предельным углеводородам или их галогенопроизводным.
Физическая характеристика и получение
Агрегатная форма этина при обычных условиях – газ. Ацетилен легче воздуха и плохо растворяется в воде. Его формула – C2h3, молекулярная масса – 26 г/моль. Вещество кипит при температуре порядка 83,8 °C. Как любой газ, может сжиматься под давлением, но процесс сопровождается взрывом. Соединение очень энергоемко, удельная теплота сгорания равна 14000 ккал/м3. Ацетилен получают из карбида кальция или этана.
Основной и экономически выгодный промышленный способ получения углеводорода – это пиролиз. Он имеет несколько разновидностей, среди которых наиболее перспективными считаются гомогенный и окислительный процессы. Исходным сырьем в них служит метан, молекулы которого дегидрируют. Достаточно давно в химии применяют карбидный метод. Здесь реагируют между собой карбид кальция и вода. Ацетилен, полученный этим способом, что очень важно, практически не содержит примесей. Однако сам процесс энергоемок и требует больших расходов электроэнергии.
Реакция гидрирования
Примером гетерогенной каталитической реакции, характерной для непредельных углеводородов с тройной связью между атомами углерода, может служить взаимодействие их с водородом. Нагревание и наличие никелевого катализатора – это главные условия проведения гидрирования. Как мы уже говорили ранее, для химических свойств ацетилена присущи реакции присоединения. Они проходят в два этапа.

Сначала происходит разрыв одной пи-связи и к свободным валентностям углеродных атомов присоединяются два атома водорода. Образуется алкен, в данном случае – этилен. Затем происходит разрушение одной непредельной связи в его молекуле и возникает предельное соединение – этан. Ацетилен, как мы видим, в результате гидрирования полностью утратил двойные связи и превратился в насыщенный углеводород.
Качественная реакция на этин
В органической химии применяют реакции, с помощью которых определяют присутствие в веществе определенного комплекса атомов или вида химической связи. Они называются качественными. Чтобы доказать в молекулах алкинов наличие двух непредельных пи-связей, используют такой реактив, как бромная вода. Ацетилен пропускают через бурый раствор Br2 и наблюдают его обесцвечивание. Получают продукт – тетрабромэтан, который относится к веществам – галогенопроизводным насыщенных углеводородов.
Поливинилхлоридные смолы
Важное практическое значение имеет реакция присоединения к этину хлороводорода, которая на первой стадии завершается образованием хлорвинила. Его молекулы сохраняют в своем составе двойную связь, что обеспечивает их способность к соединению друг с другом и формированию полимера.

Химические свойства ацетилена, в особенности реакция полимеризации его производного – хлорвинила, обеспечили возможность создания целой группы веществ с уникальными техническими характеристиками. Например, термовиль и фибровиль – волокна, применяемые для получения сверхпрочных тканей, используемых в пошиве спецодежды. Современные строительные, дренажные и отделочные работы невозможно представить без поливинилхлоридных труб, пенопластов и напольных покрытий. Они легкие, прочные, устойчивые к коррозии и значительно дешевле изделий из натуральных материалов: металла или древесины.
Реакция М. Г. Кучерова
Говоря о хорошо известных химических свойствах вещества, например, реакциях полимеризации, присоединения или горения ацетилена, мы упоминали о том, что газ практически нерастворим в воде. Однако в присутствии нитрата или сульфата ртути в качестве катализатора происходит реакция, впервые проведенная еще в XIX веке известным российским ученым М. Г. Кучеровым. В ней продуктом взаимодействия между водой и этином является уксусный альдегид. Он, в свою очередь, относится к соединениям, наиболее востребованным в промышленности, так как служит сырьем для получения этилового спирта в реакции восстановления.

Если же ацетальдегид окислить, то получим еще одно важное органическое вещество – уксусную кислоту. В последнее время реакция М. Г. Кучерова применяется в меньших масштабах по причине токсичности используемого катализатора. Сейчас все чаще в качестве исходного сырья используют этан. Ацетилен получают в результате его дегидрогенизации.
В нашей статье мы рассмотрели основные химические свойства и получение ацетилена, а также его применение в промышленности.
fb.ru
Ацетилен — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
| Ацетилен | |
| 200x300px | |
| 200px 200px | |
| Систематическоенаименование | Этин |
| Традиционные названия | Ацетилен |
| Хим. формула | C2h3 |
| Молярная масса | 26,038[1] г/моль |
| Плотность | 1,0896 г/л |
| Т. плав. | -80,8 1277 мм Hg °C |
| Т. кип. | −83,6 °C |
| Тройная точка | −80,55 |
| Кр. точка | 35,2°С; 6,4 МПа |
| Мол. теплоёмк. | 44,036 Дж/(моль·К) |
| Энтальпия образования | -227,4 кДж/моль |
| pKa | 25 |
| Растворимость в воде | 10018 мл/100 мл |
| Растворимость в этаноле | 60018 мл/100 мл |
| Гибридизация | sp |
| Рег. номер CAS | 74-86-2 |
| PubChem | Ошибка Lua в Модуль:Wikidata на строке 170: attempt to index field 'wikibase' (a nil value). |
| Рег. номер EINECS | Ошибка Lua в Модуль:Wikidata на строке 170: attempt to index field 'wikibase' (a nil value). |
| SMILES |
[http://chemapps.stolaf.edu/jmol/jmol.php?model=C%23C C#C] |
| InChI |
[http://chemapps.stolaf.edu/jmol/jmol.php?&model=InChI=%3Cstrong%20class%3D%22error%22%3E%3Cspan%20class%3D%22scribunto-error%22%20id%3D%22mw-scribunto-error-11%22%3E%D0%9E%D1%88%D0%B8%D0%B1%D0%BA%D0%B0%20Lua%3A%20callParserFunction%3A%20function%20%26quot%3B%23property%26quot%3B%20was%20not%20found.%3C%2Fspan%3E%3C%2Fstrong%3E Ошибка Lua: callParserFunction: function "#property" was not found.] [https://www.ncbi.nlm.nih.gov/sites/entrez?cmd=search&db=pccompound&term=%22%3Cstrong%20class%3D%22error%22%3E%3Cspan%20class%3D%22scribunto-error%22%20id%3D%22mw-scribunto-error-14%22%3E%D0%9E%D1%88%D0%B8%D0%B1%D0%BA%D0%B0%20Lua%3A%20callParserFunction%3A%20function%20%26quot%3B%23property%26quot%3B%20was%20not%20found.%3C%2Fspan%3E%3C%2Fstrong%3E%22%5BInChIKey%5D Ошибка Lua: callParserFunction: function "#property" was not found.] |
| Кодекс Алиментариус | Ошибка Lua в Модуль:Wikidata на строке 170: attempt to index field 'wikibase' (a nil value). |
| RTECS | Ошибка Lua в Модуль:Wikidata на строке 170: attempt to index field 'wikibase' (a nil value). |
| Номер ООН | 1001 |
| ChemSpider | Ошибка Lua в Модуль:Wikidata на строке 170: attempt to index field 'wikibase' (a nil value). |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Ацетиле́н (по ИЮПАК — этин) — непредельный углеводород C2h3. Имеет тройную связь между атомами углерода, принадлежит к классу алкинов. При нормальных условиях — бесцветный газ.
Получение
В лаборатории
В лаборатории, а также в газосварочном оборудовании, ацетилен получают действием воды на карбид кальция[2] (Ф. Вёлер, 1862 год),
Невозможно разобрать выражение (Выполняемый файл <code>texvc</code> не найден; См. math/README — справку по настройке.): \mathsf{CaC_2 + 2H_2O \rightarrow Ca(OH)_2 + C_2H_2\uparrow}а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
Невозможно разобрать выражение (Выполняемый файл <code>texvc</code> не найден; См. math/README — справку по настройке.): \mathsf{2CH_4 \rightarrow C_2H_2 + 3H_2}В промышленности
В промышленности ацетилен получают из карбида кальция и пиролизом углеводородного сырья — метана или пропана с бутаном. В последнем случае ацетилен получают совместно с этиленом. Карбидный метод позволяет получать чистый ацетилен, но требует высокого расхода электроэнергии. Пиролиз менее энергозатратен, но образующийся ацетилен имеет низкую концентрацию в газовом потоке и требует выделения. Экономические оценки обоих методов многочисленны, но противоречивы[3][:стр. 274].
Получение пиролизом
Электрокрекинг
Метан превращают в ацетилен и водород в электродуговых печах (температура 2000—3000 °С, напряжение между электродами 1000 В). Метан при этом разогревается до 1600 °С. Расход электроэнергии составляет около 13000 кВт•ч на 1 тонну ацетилена, что относительно много (примерно равно затрачиваемой энергии по карбидному методу) и потому является недостатком процесса. Выход ацетилена составляет 50 %.
Регенеративный пиролиз
Иное название — Вульф-процесс. Сначала разогревают насадку печи путём сжигания метана при 1350—1400 °С. Далее через разогретую насадку пропускают метан. Время пребывания метана в зоне реакции очень мало и составляет доли секунды. Процесс реализован в промышленности, но экономически оказался не таким перспективным, как считалось на стадии проектирования.
Окислительный пиролиз
Метан смешивают с кислородом. Часть сырья сжигают, а образующееся тепло расходуют на нагрев остатка сырья до 1600 °С. Выход ацетилена составляет 30—32 %. Метод имеет преимущества — непрерывный характер процесса и низкие энергозатраты. Кроме того, с ацетиленом образуется еще и синтез-газ. Этот процесс (Заксе-процесс или BASF-процесс) получил наиболее широкое внедрение.
Гомогенный пиролиз
Является разновидностью окислительного пиролиза. Часть сырья сжигают с кислородом в топке печи, газ нагревается до 2000 °С. Затем в среднюю часть печи вводят остаток сырья, предварительно нагретый до 600 °С. Образуется ацетилен. Метод характеризуется большей безопасностью и надёжностью работы печи.
Пиролиз в струе низкотемпературной плазмы
Процесс разрабатывается с 1970-х годов, но, несмотря на перспективность, пока не внедрён в промышленности. Сущность процесса состоит в нагреве метана ионизированным газом. Преимущество метода заключается в относительно низких энергозатратах (5000—7000 кВт•ч) и высоких выходах ацетилена (87 % в аргоновой плазме и 73 % в водородной).
Карбидный метод
Этот способ известен с XIX века, но не потерял своего значения до настоящего времени. Сначала получают карбид кальция, сплавляя оксид кальция и кокс в электропечах при 2500—3000 °С:
Невозможно разобрать выражение (Выполняемый файл <code>texvc</code> не найден; См. math/README — справку по настройке.): \mathsf{CaO + 3C \rightarrow CaC_2 + CO}Известь получают из карбоната кальция:
Невозможно разобрать выражение (Выполняемый файл <code>texvc</code> не найден; См. math/README — справку по настройке.): \mathsf{CaCO_3 \rightarrow CaO + CO_2}Далее карбид кальция обрабатывают водой:
Невозможно разобрать выражение (Выполняемый файл <code>texvc</code> не найден; См. math/README — справку по настройке.): \mathsf{CaC_2 + 2H_2O \rightarrow C_2H_2 + Ca(OH)_2}Получаемый ацетилен имеет высокую степень чистоты 99,9 %. Основным недостатком процесса является высокий расход электроэнергии: 10000—11000 кВт•ч на 1 тонну ацетилена.
Физические свойства
При нормальных условиях — бесцветный газ, легче воздуха. Чистый 100 % ацетилен не обладает запахом, однако технический ацетилен содержит примеси, которые придают ему резкий запах[4]. Малорастворим в воде, хорошо растворяется в ацетоне. Температура кипения −83,6 °C[5]. Тройная точка −80,55 °C при давлении 961,5 мм рт. ст., критическая точка 35,18 °C при давлении 61,1 атм[6].
Ацетилен требует большой осторожности при обращении. Может взрываться от удара, при нагреве до 500 °C или при сжатии выше 0,2 МПа[7] при комнатной температуре. Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки. Для хранения ацетилена используются специальные баллоны, заполненные пористым материалом, пропитанным ацетоном[8].
Ацетилен обнаружен на Уране и Нептуне.
Химические свойства
Для ацетилена (этина) характерны реакции присоединения:
HC≡CH + Cl2 -> ClCH=СНСl
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³ (50,4 МДж/кг). При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в ~500 °C. В присутствии катализаторов, например, трикарбонил(трифенилфосфин)никеля, температуру реакции циклизации можно снизить до 60-70 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так, ацетилен вытесняет метан из эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра и одновалентной меди.
Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.):
Реакции ацетилена-1
Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации, сводная таблица 2.):
Реакции ацетилена-2
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Реагирует с аммиачными растворами солей Cu(I) и Ag(I) с образованием малорастворимых, взрывчатых ацетиленидов — эта реакция используется для качественного определения ацетилена и его отличия от алкенов (которые тоже обесцвечивают бромную воду и раствор перманганата калия).
История
Открыт в 1836 году Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. Бертло (1862 год).
Применение
Ацетилен используют:
- для газовой сварки и резки металлов,
- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидная лампа),
- в производстве взрывчатых веществ (см. ацетилениды),
- для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
- для получения технического углерода
- в атомно-абсорбционной спектрофотометрии при пламенной атомизации
- в ракетных двигателях (вместе с аммиаком)[9]
Безопасность
Поскольку ацетилен нерастворим в воде, и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций, его нельзя собирать в газометры.
Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3—80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном.
При длительном соприкосновении ацетилена с медью и серебром образуются ацетилениды меди и серебра, которые взрываются при ударе или повышении температуры. Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов).
Ацетилен обладает незначительным токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м³ согласно гигиеническим нормативам ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населённых мест».
ПДКр.з. (рабочей зоны) не установлен (по ГОСТ 5457-75 и ГН 2.2.5.1314-03), так как концентрационные пределы распределения пламени в смеси с воздухом составляет 2,5—100 %.
Хранят и перевозят его в заполненных инертной пористой массой (например, древесным углём) стальных баллонах белого цвета (с красной надписью «А») в виде раствора в ацетоне под давлением 1,5—2,5 МПа.
Напишите отзыв о статье "Ацетилен"
Примечания
- ↑ [http://protect.gost.ru/document.aspx?control=7&id=162285 ГОСТ 5457-75. Ацетилен растворённый и газообразный технический. Технические условия]
- ↑ [http://www.youtube.com/watch?v=6ei5LGn165M Видео данного процесса]
- ↑ Лапидус А. Л., Голубева И. А., Жагфаров Ф. Г. Газохимия. Учебное пособие. — М.: ЦентрЛитНефтеГаз, 2008. — 450 с. — ISBN 978-5-902665-31-1.
- ↑ [http://www.ngpedia.ru/id31656p1.html Большая энциклопедия нефти и газа. Неприятный запах — ацетилен]. Проверено 10 октября 2013.
- ↑ Корольченко. Пожаровзрывоопасность веществ, 2004, с. 198.
- ↑ Миллер. Ацетилен, его свойства, получение и применение, 1969, с. 72.
- ↑ Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
- ↑ [http://www.it-gas.ru/acetilen.html Ацетилен]. Проверено 10 октября 2013.
- ↑ [http://www.izvestia.ru/news/523787 В России разработали ракетный двигатель на аммиаке — Известия]
Литература
- Миллер С. А. Ацетилен, его свойства, получение и применение. — Л.: Химия, 1969. — Т. 1. — 680 с.
- Корольченко А. Я., Корольченко Д. А. Пожаровзрывоопасность веществ и материалов и средства их тушения. Справочник: в 2-х частях. Часть 1. — М.: Ассоциация «Пожнаука», 2004. — 713 с. — ISBN 5-901283-02-3.
Ссылки
Отрывок, характеризующий Ацетилен
– Ты, как всегда, права, – улыбнулась подружке я. Мы медленно «плыли» по серебристой дорожке, стараясь не тревожить чужую печаль и дать каждому насладиться покоем после всего пережитого в этот кошмарный день. Детишки потихонечку оживали, восторженно наблюдая проплывавшие мимо них дивные пейзажи. И только Арно явно был от нас всех очень далеко, блуждая в своей, возможно, очень счастливой памяти, вызвавшей на его утончённом, и таком красивом лице, удивительно тёплую и нежную улыбку... – Вот видишь, он их наверняка очень сильно любил! А ты говоришь – рано!.. Ну, давай поищем! – никак не желала успокоиться Стелла. – Ладно, пусть будет по твоему, – легко согласилась я, так как теперь уже и мне это казалось правильным. – Скажите, Арно, а как выглядела ваша жена? – осторожно начала я. – Если вам не слишком больно об этом говорить, конечно же. Он очень удивлённо взглянул мне в глаза, как бы спрашивая, откуда вообще мне известно, что у него была жена?.. – Так уж получилось, что мы увидели, но только самый конец... Это было так страшно! – тут же добавила Стелла. Я испугалась, что переход из его дивных грёз в страшную реальность получился слишком жестоким, но «слово не птичка, вылетело – не поймаешь», менять что-то было поздно, и нам оставалось только ждать, захочет ли он отвечать. К моему большому удивлению, его лицо ещё больше осветилось счастьем, и он очень ласково ответил: – О, она была настоящим ангелом!.. У неё были такие дивные светлые волосы!.. И глаза... Голубые и чистые, как роса... О, как жаль, что вы её не увидели, мою милую Мишель!.. – А у вас была ещё дочь? – осторожно спросила Стелла. – Дочь? – удивлённо спросил Арно и, поняв, что мы видели, тут же добавил. – О, нет! Это была её сестра. Ей было всего шестнадцать лет... В его глазах вдруг промелькнула такая пугающая, такая жуткая боль, что только сейчас я вдруг поняла, как сильно страдал этот несчастный человек!.. Возможно, не в силах перенести такую зверскую боль, он сознательно отгородил себя стеной их былого счастья, стараясь помнить только светлое прошлое и «стереть» из своей памяти весь ужас того последнего страшного дня, насколько позволяла ему это сделать его раненая и ослабевшая душа... Мы попробовали найти Мишель – почему-то не получалось... Стелла удивлённо на меня уставилась и тихо спросила: – А почему я не могу её найти, разве она и здесь погибла?.. Мне показалось, что нам что-то просто мешало отыскать её в этом «этаже» и я предложила Стелле посмотреть «повыше». Мы проскользнули мысленно на Ментал... и сразу её увидели... Она и вправду была удивительно красивой – светлой и чистой, как ручеёк. А по её плечам золотым плащом рассыпались длиннющие золотые волосы... Я никогда не видела таких длинных и таких красивых волос! Девушка была глубоко задумчивой и грустной, как и многие на «этажах», потерявшие свою любовь, своих родных, или просто потому, что были одни... – Здравствуй, Мишель! – не теряя времени, тут же произнесла Стелла. – А мы тебе подарок приготовили! Женщина удивлённо улыбнулась и ласково спросила: – Кто вы, девочки? Но ничего ей не ответив, Стелла мысленно позвала Арно... Мне не суметь рассказать того, что принесла им эта встреча... Да и не нужно это. Такое счастье нельзя облачить в слова – они померкнут... Просто не было, наверное, в тот момент счастливее людей на всём свете, да и на всех «этажах»!.. И мы искренне радовались вместе с ними, не забывая тех, кому они были обязаны своим счастьем... Думаю, и малышка Мария, и наш добрый Светило, были бы очень счастливы, видя их сейчас, и зная, что не напрасно отдали за них свою жизнь... Стелла вдруг всполошилась и куда-то исчезла. Пошла за ней и я, так как здесь нам делать больше было нечего... – И куда же вы все исчезли? – удивлённо, но очень спокойно, встретила нас вопросом Майя. – Мы уже думали, вы нас оставили насовсем. А где же наш новый друг?.. Неужели и он исчез?.. Мы думали, он возьмёт нас с собой... Появилась проблема... Куда было теперь девать этих несчастных малышей – я не имела ни малейшего понятия. Стелла взглянула на меня, думая о том же самом, и отчаянно пытаясь найти какой-то выход. – Придумала! – уже совсем как «прежняя» Стелла, она радостно хлопнула в ладошки. – Мы им сделаем радостный мир, в котором они будут существовать. А там, гляди, и встретят кого-то... Или кто-то хороший их заберёт. – А тебе не кажется, что мы должны их с кем-то здесь познакомить? – пытаясь «понадёжнее» пристроить одиноких малышей, спросила я. – Нет, не кажется, – очень серьёзно ответила подружка. – Подумай сама, ведь не все умершие малыши получают такое... И не обо всех здесь, наверное, успевают позаботиться. Поэтому будет честно по отношению к остальным, если мы просто создадим им здесь очень красивый дом, пока они кого-то найдут. Ведь они втроём, им легче. А другие – одни... Я тоже была одна, я помню... И вдруг, видимо вспомнив то страшное время, она стала растерянной и печальной... и какой-то незащищённой. Желая тут же вернуть её обратно, я мысленно обрушила на неё водопад невероятных фантастических цветов... – Ой! – засмеялась колокольчиком Стелла. – Ну, что ты!.. Перестань! – А ты перестань грустить! – не сдавалась я. – Нам вон, сколько ещё всего надо сделать, а ты раскисла. А ну пошли детей устраивать!.. И тут, совершенно неожиданно, снова появился Арно. Мы удивлённо на него уставились... боясь спросить. Я даже успела подумать – уж не случилось ли опять чего-то страшного?.. Но выглядел он «запредельно» счастливым, поэтому я тут же отбросила глупую мысль. – А что ты здесь делаешь?!.. – искренне удивилась Стелла. – Разве вы забыли – я ведь детишек должен забрать, я обещал им. – А где же Мишель? Вы что же – не вместе? – Ну почему не вместе? Вместе, конечно же! Просто я обещал... Да и детей она всегда любила. Вот мы и решили побыть все вместе, пока их не заберёт новая жизнь. – Так это же чудесно! – обрадовалась Стелла. И тут же перескочила на другое. – Ты очень счастлив, правда же? Ну, скажи, ты счастлив? Она у тебя такая красивая!!!.. Арно долго и внимательно смотрел нам в глаза, как бы желая, но никак не решаясь что-то сказать. Потом, наконец, решился... – Я не могу принять у вас это счастье... Оно не моё... Это неправильно... Я пока его не достоин. – Как это не можешь?!.. – буквально взвилась Стелла. – Как это не можешь – ещё как можешь!.. Только попробуй отказаться!!! Ты только посмотри, какая она красавица! А говоришь – не можешь... Арно грустно улыбался, глядя на бушующую Стеллу. Потом ласково обнял её и тихо, тихо произнёс: – Вы ведь несказанное счастье мне принесли, а я вам такую страшную боль... Простите меня милые, если когда-нибудь сможете. Простите... Стелла ему светло и ласково улыбнулась, будто желая показать, что она прекрасно всё понимает, и, что прощает ему всё, и, что это была совсем не его вина. Арно только грустно кивнул и, показав на тихо ждущих детишек, спросил: – Могу ли я взять их с собой «наверх», как ты думаешь? – К сожалению – нет, – грустно ответила Стелла. – Они не могут пойти туда, они остаются здесь. – Тогда мы тоже останемся... – прозвучал ласковый голос. – Мы останемся с ними. Мы удивлённо обернулись – это была Мишель. «Вот всё и решилось» – довольно подумала я. И опять кто-то чем-то добровольно пожертвовал, и снова побеждало простое человеческое добро... Я смотрела на Стеллу – малышка улыбалась. Снова было всё хорошо. – Ну что, погуляешь со мной ещё немножко? – с надеждой спросила Стелла. Мне уже давно надо было домой, но я знала, что ни за что её сейчас не оставлю и утвердительно кивнула головой...Настроения гулять у меня, честно говоря, слишком большого не было, так как после всего случившегося, состояние было, скажем так, очень и очень «удовлетворительное... Но оставлять Стеллу одну я тоже никак не могла, поэтому, чтобы обоим было хорошо хотя бы «посерединушке», мы решили далеко не ходить, а просто чуточку расслабить свои, почти уже закипающие, мозги, и дать отдохнуть измордованным болью сердцам, наслаждаясь тишиной и покоем ментального этажа... Мы медленно плыли в ласковой серебристой дымке, полностью расслабив свою издёрганную нервную систему, и погружаясь в потрясающий, ни с чем не сравнимый здешний покой... Как вдруг Стелла восторженно крикнула: – Вот это да! Ты посмотри только, что же это там за красота такая!.. Я огляделась вокруг и сразу же поняла, о чём она говорила... Это и правда было необычайно красиво!.. Будто кто-то, играясь, сотворил настоящее небесно-голубое «хрустальное» царство!.. Мы удивлённо рассматривали невероятно огромные, ажурные ледяные цветы, припорошенные светло-голубыми снежинками; и переплёты сверкающих ледяных деревьев, вспыхивающих синими бликами при малейшем движении «хрустальной» листвы и высотой достигавших с наш трёхэтажный дом... А среди всей этой невероятной красоты, окружённый вспышками настоящего «северного сияния», гордо возвышался захватывающий дух величавый ледяной дворец, весь блиставший переливами невиданных серебристо голубых оттенков... Что это было?! Кому так нравился этот холодный цвет?.. Пока почему-то никто нигде не показывался, и никто не высказывал большого желания нас встречать... Это было чуточку странно, так как обычно хозяева всех этих дивных миров были очень гостеприимны и доброжелательны, за исключением лишь тех, которые только что появились на «этаже» (то есть – только что умерли) и ещё не были готовы к общению с остальными, или просто предпочитали переживать что-то сугубо личное и тяжёлое в одиночку. – Как ты думаешь, кто живёт в этом странном мире?.. – почему-то шёпотом спросила Стелла. – Хочешь – посмотрим? – неожиданно для себя, предложила я. Я не поняла, куда девалась вся моя усталость, и почему это я вдруг совершенно забыла данное себе минуту назад обещание не вмешиваться ни в какие, даже самые невероятные происшествия до завтрашнего дня, или хотя бы уж, пока хоть чуточку не отдохну. Но, конечно же, это снова срабатывало моё ненасытное любопытство, которое я так и не научилась пока ещё усмирять, даже и тогда, когда в этом появлялась настоящая необходимость... Поэтому, стараясь, насколько позволяло моё измученное сердце, «отключиться» и не думать о нашем неудавшемся, грустном и тяжёлом дне, я тут же с готовностью окунулась в «новое и неизведанное», предвкушая какое-нибудь необычное и захватывающее приключение... Мы плавно «притормозили» прямо у самого входа в потрясающий «ледяной» мир, как вдруг из-за сверкавшего искрами голубого дерева появился человек... Это была очень необычная девушка – высокая и стройная, и очень красивая, она казалась бы совсем ещё молоденькой, почти что если бы не глаза... Они сияли спокойной, светлой печалью, и были глубокими, как колодец с чистейшей родниковой водой... И в этих дивных глазах таилась такая мудрость, коей нам со Стеллой пока ещё долго не дано было постичь... Ничуть не удивившись нашему появлению, незнакомка тепло улыбнулась и тихо спросила: – Что вам, малые? – Мы просто рядом проходили и захотели на вашу красоту посмотреть. Простите, если потревожили... – чуть сконфузившись, пробормотала я.
o-ili-v.ru


























