Гидратация пропилена: уравнение реакции. Пропилен вода
Гидратация пропилена: уравнение реакции
Органические вещества занимают важное место в нашей жизни. Они являются основной составляющей полимеров, которые окружают нас повсюду: это и полиэтиленовые пакеты, и резина, а также множество других материалов. Полипропилен занимает в этом ряду не последнюю ступень. Он также входит в состав различных материалов и применяется в ряде отраслей, таких как строительство, имеет бытовое применение в качестве материала для пластиковых стаканчиков и прочих мелких (но не по масштабам производства) нужд. Прежде чем поговорить о таком процессе, как гидратация пропилена (благодаря которому, кстати, мы можем получить изопропиловый спирт), обратимся к истории открытия этого необходимого для промышленности вещества.
История
Как таковой даты открытия пропилен не имеет. Однако его полимер - полипропилен -был фактически открыт в 1936 году известным немецким химиком Отто Байером. Конечно, теоретически было известно, как можно получить столь важный материал, но практически сделать это не удавалось. Удалось это только в середине двадцатого века, когда немецкий и итальянский химики Циглер и Натт открыли катализатор полимеризации непредельных углеводородов (имеющих одну и более кратных связей), который впоследствии так и назвали: катализатор Циглера-Натта. До этого момента решительно невозможно было сделать так, чтобы реакция полимеризации таких веществ пошла. Были известны реакции поликонденсации, когда без воздействия катализатора вещества соединялись в полимерную цепь, образуя при этом побочные вещества. Но с непредельными углеводородами это сделать не удавалось.
Ещё одним важным процессом, связанным с этим веществом, была его гидратация. Пропилена в годы начала его применения было достаточно много. И всё это благодаря изобретённым разными нефте- и газоперерабатывающими компаниями способам излечения пропена (так иногда тоже называют описываемое вещество). При крекинге нефти он был побочным продуктом, а когда оказалось, что его производное, изопропиловый спирт, является основой для синтеза множества полезных для человечества веществ, многие фирмы, такие как BASF, запатентовали свой способ его производства и начали массовую торговлю этим соединением. Гидратация пропилена была опробована и применена раньше полимеризации, именно поэтому ацетон, пероксид водорода, изопропиламин начали производить раньше полипропилена.
Очень интересен процесс выделения пропена из нефти. Именно к нему мы сейчас и обратимся.
Выделение пропилена
На самом деле в теоретическом понимании основным способом является лишь один процесс: пиролиз нефти и попутных газов. Но вот технологических реализаций - просто море. Дело в том, что каждая компания стремится получить уникальный способ и защитить его патентом, а другие такие же компании также ищут свои способы, чтобы всё-таки производить и продавать пропен как сырьё или же превращать его в различные продукты.
Пиролиз ("пиро" - огонь, "лиз" - разрушение) - химический процесс распада сложной и большой молекулы на более мелкие под действием высокой температуры и катализатора. Нефть, как известно, представляет собой смесь углеводородов и состоит из лёгких, средних и тяжёлых фракций. Из первых, самых низкомолекулярных, и получают пропен и этан при пиролизе. Проводят этот процесс в специальных печах. У самых передовых фирм-производителей этот процесс технологически различается: одни используют песок в качестве теплоносителя, другие - кварц, третьи - кокс; можно также разделить печи по их строению: бывают трубчатые и обычные, как их называют, реакторы.
Но процесс пиролиза позволяет получить недостаточно чистый пропен, так как, кроме него, там образуется огромное множество углеводородов, которые потом приходится разделять достаточно энергозатратными способами. Поэтому для получения более чистого вещества для последующей гидратации применяют также дегидрирование алканов: в нашем случае - пропана. Так же, как и полимеризация, вышеописанный процесс просто так не происходит. Отщепление водорода от молкулы предельного углеводорода происходит под действием катализаторов: оксида трёхвалентного хрома и оксида алюминия.
Ну а прежде чем перейти к рассказу о том, как происходит процесс гидратации, обратимся к строению нашего непредельного углеводорода.
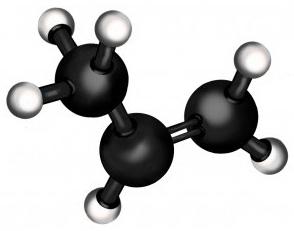
Особенности строения пропилена
Пропен сам по себе - лишь второй член ряда алкенов (углеводороды с одной двойной связью). По лёгкости он уступает лишь этилену (из которого, как можно догадаться, делают полиэтилен - самый массовый полимер в мире). В обычном состоянии пропен - газ, как и его "родственник" из семейства алканов, пропан.
Но существенное отличие пропана от пропена - в том, что последний имеет в своём составе двойную связь, которая коренным образом меняет его химические свойства. Она позволяет присоединять к молекуле непредельного углеводорода другие вещества, в результате чего получаются соединения с совершенно другими свойствами, зачастую очень важными для промышленности и быта.
Пришло время поговорить о теории реакции, которой, собственно, и посвящена эта статья. В следующем разделе вы узнаете, что при гидратации пропилена образуется один из самых промышленно важных продуктов, а также то, как происходит эта реакция и какие в ней есть нюансы.

Теория гидратации
Для начала обратимся к более общему процессу - сольватации, - который включает в себя также и описанную выше реакцию. Это химическое превращение, которое заключается в присоединении молекул растворителя к молекулам растворённого вещества. При этом они могут образовывать новые молекулы, или же так называемые сольваты, - частицы, состоящие из молекул растворённого вещества и растворителя, связанных электростатическим взаимодействием. Нас интересует только первый вид веществ, ведь при гидратации пропилена преимущественно образуется именно такой продукт.
При сольватации вышеописанным способом молекулы растворителя присоединяются к растворённому веществу, получается новое соединение. В органической химии при гидратации преимущественно образуются спирты, кетоны и альдегиды, однако есть и несколько других случаев, например образование гликолей, но их мы касаться не будем. На самом деле этот процесс очень прост, но в то же время достаточно сложен.
Механизм гидратации
Двойная связь, как известно, состоит из двух видов соединения атомов: пи- и сигма-связей. Пи-связь при реакции гидратации разрывается всегда первой, так как она менее прочная (обладает меньшей энергией связи). При её разрыве образуются две вакантные орбитали у двух соседних атомов углерода, которые могут образовать новые связи. Молекула воды, существующая в растворе в виде двух частиц: гидроксид-иона и протона, способна присоединяться по разорвавшейся двойной связи. При этом гидроксид-ион присоединяется к центральному атому углерода, а протон - ко второму, крайнему. Таким образом, при гидратации пропилена преимущественно образуется пропанол 1, или изопропиловый спирт. Это очень важное вещество, так как при его окислении можно получить ацетон, массово используемый в нашем мире. Мы сказали, что он образуется преимущественно, однако это не совсем так. Надо сказать так: единственный продукт образуется при гидратации пропилена, и это - изопропиловый спирт.
Это, конечно, всё тонкости. На самом деле всё можно описать гораздо проще. И сейчас мы узнаем, как же в школьном курсе записывают такой процесс, как гидратация пропилена.
Реакция: как она происходит
В химии всё принято обозначать просто: с помощью уравнений реакций. Вот и химическое превращение обсуждаемого вещества можно описать таким способом. Гидратация пропилена, уравнение реакции которой очень простое, проходит в две стадии. Сначала разрывается пи-связь, входящая в состав двойной. Затем молекула воды в виде двух частиц, гидроксид-аниона и катиона водорода, подходит к молекуле пропилена, имеющей на данный момент два вакантных места для образования связей. Гидроксид-ион образует связь с менее гидрогенизированным атомом углерода (то есть с таким, к которому присоединено меньшее количество атомов водорода), а протон, соответственно, - с оставшимся крайним. Таким образом, получается один-единственный продукт: предельный одноатомный спирт изопропанол.
Как записать реакцию?
Сейчас мы узнаем, как химическим языком записать реакцию, отражающую такой процесс, как гидратация пропилена. Формула, которая нам пригодится: Ch3 = CH - Ch4. Это формула исходного вещества - пропена. Как можно видеть, у него есть двойная связь, обозначенная знаком "=", и именно в это место будет присоедняться вода, когда будет происходить гидратация пропилена. Уравнение реакции можно записать так: Ch3 = CH - Ch4 + h3O = Ch4 - CH(OH) - Ch4. Гидроксильная группа в скобочках означает, что эта часть находится не в плоскости формулы, а ниже или выше. Тут мы не можем показать углы между тремя группами, отходящими от среднего атома углерода, но скажем, что они примерно равны между собой и составляют по 120 градусов.
Где это применяется?
Мы уже говорили, что получаемое в ходе реакции вещество активно используется для синтеза других жизненно важных нам веществ. Оно очень похоже по строению на ацетон, от которого отличается только тем, что вместо гидроксогруппы там стоит кетогруппа (то есть атом кислорода, соединённый двойной связью с атомом азота). Как известно, сам ацетон находит применение в растворителях и лаках, но, кроме этого, он применяется в качестве реагента для дальнейшего синтеза более сложных веществ, таких как полиуретаны, эпоксидные смолы, уксусный ангидрид и так далее.
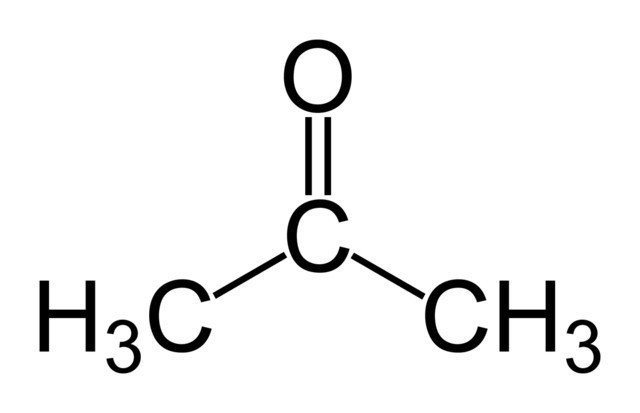
Реакция получения ацетона
Думаем, нелишним будет описать превращение изопропилового спирта в ацетон, тем более что реакция эта не так сложна. Для начала пропанол испаряют и при 400-600 градусах по Цельсию оксиляют кислородом на специальном катализаторе. Очень чистый продукт получается при проведении реакции на серебряной сетке.

Уравнение реакции
Не будем вдаваться в подробности механизма реакции окисления пропанола в ацетон, так как он очень сложен. Ограничимся обычным уравнением химического превращения: Ch4 - CH(OH) - Ch4 + O2 = Ch4 - C(O) - Ch4 + h3O. Как видно, на схеме всё достаточно просто, но стоит углубиться в процесс, и мы столкнёмся с рядом трудностей.
Заключение
Вот мы и разобрали процесс гидратации пропилена и изучили уравнение реакции и механизм её протекания. Рассмотренные технологические принципы лежат в основе реальных процессов, происходящих в производстве. Как оказалось, они не очень сложны, однако имеют реальную пользу для нашей повседневной жизни.
fb.ru
Пропилен воды гидратация - Справочник химика 21
Реакция образования этиленовых углеводородов из спиртов дает возможность превращать первичные спирты во вторичные или третичные. Напомним, что реакция гидратации идет по правилу Марковникова (см. стр. 78). Так, например, отнимая воду от первичного пропилового спирта, можно получить пропилен, а присоединением молекулы воды к пропилену получают изопропиловый спирт [c.142] Прямую гидратацию пропилена ведут в более мягких условиях однако в принципе этот процесс не отличается от описанного выше. Температура реакции составляет 150—220 °С, давление —до 3,5 МН/м (35 атм). При данной температуре равновесие гидратации менее благоприятно для образования спирта, чем в случае этилена. Однако это компенсируется тем, что при низких температурах пропилен гидратируется быстрее, чем этилен. При 200°С константа равновесия приблизительно равна 1 10 Н -м2. Вследствие понижения температуры для предотвращения конденсации воды приходится применять более низкое давление по сравнению с процессом гидратации этилена. В итоге достигаемая степень конверсии пропилена за один проход близка к степени конверсии этилена. [c.188]Результаты, полученные Рунге при гидратации пропилена в газовой фазе, представлены в табл. 7. Из таблицы видно, что конверсия пропилена увеличивается при повышении давления и соотношения вода пропилен. Однако уровень нужного давления зависит от уровня температуры, так как для достижения максимальной конверсии давление должно лежать лишь немного ниже точки насыщения на основании законов термодинамики. Высший предел температуры опять же зависит от активности катализатора. [c.63]
На разных предприятиях применяются различные методы очистки сточных вод. На нефтехимических комбинатах (при производстве синтетического спирта, фенола, ацетона, синтетических жирных кислот, каучука и др.) основными местами образования загрязненных сточных вод являются цехи пиролиза углеводородов, гидратации этилена и ректификации спирта. Сточные воды цеха пиролиза углеводородов содержат этилен, пропилен, бутан, изобутан, бензол, толуол, ксилол, нафталин. В сточных водах цеха гидратации этилена и ректификации спирта присутствуют спирты, ацетальдегид, продукты полимеризации, смола. При применении биологических методов очистки содержание органических веществ (бензола, толуола, ксилола, нафталина и др.) в сточных водах значительно снижается. [c.16]
Глицерин получают из пропилена и кислорода, при этом в качестве побочного продукта образуется ацетон. Процесс проходит в несколько стадий. Пропилен окисляют до акролеина при температуре 300—400 °С и давлении от 1 до 10 ат на катализаторе— закиси меди, нанесенной на 81С. Одновременно получают изопро-панол путем гидратации пропилена серной кислотой. Акролеин и. изопропанол образуют аллиловый спирт в присутствии катализатора из необожженной MgO, смешанной с 2пО, при температуре 400°С. Наконец, при реакции аллилового спирта с водой получают глицерин. Катализатором этой реакции является 0,2%-ный раствор первольфрамовой кислоты в 2 М водном растворе перекиси водорода. Температура процесса 60—71 °С, время контактирования 2ч. [c.332]
Отсюда видно, что концентрация изопропилового спирта растет с увеличением парциального давления водяных паров, а следовательно, с ростом температуры и общего давления. Показано, что при молярном соотношении пропилен вода, равном 1 1, атмосферном давлении и темнературе 150° С концентрация спирта составляет лишь 0,2%. Реакция гидратации в присутствии любого катализатора протекает при температурах от 200 до 300° С и давлении от 80 до 200 ат. [c.441]
Увеличивая содержание воды, можно повысить конверсию пропилена, но вследствие увеличения побочных реакций селективность падает. Если увеличивается концентрация пропилена, селективность растет. Так, при гидратации смеси, богатой пропиленом (молярное соотношение пропилен вода = 15,1), при 270° С и [c.443]
Синтез спиртов из алкенов. Выше уже было указано, что спирты могут быть получены каталитическим присоединением воды к этиленовым углеводородам (реакция гидратации см.). Этот способ применяют в промышленности для синтеза этилового, изопропилового, бутиловых и других спиртов. Необходимые для синтеза исходные алкены (этилен, пропилен, бутилены) являются доступным сырьем они, например, содержатся в газах крекинга (см.), т. е. представляют собой отходы нефтеперерабатывающей промышленности, а также могут быть получены из предельных углеводородов, содержащихся в природных газах. [c.124]
Молярное соотношение бепзол пропилен Вода для гидратации катализатора, % вое. от [c.643]
С, г ш. 127,2 °С d / 0,8116, /г ° 1,4007 плохо раств. в воде, раств. в орг. р-рителях КПВ 1,2—8%. Получ. Гидратация гексина-1 дегидрирование гексанола-2 конденсация ацетона с пропиленом. Р ритель лаков и красок. МЕТИЛ-трет-БУТИЛОВЫЙ ЭФИР (трет бутилмети-ловый эфир) СНзОС(СНз)з, IKim 54—55 С/764 мм рт. ст. [c.330]
За последние годы в технологию процесса внесены некоторые изменения, уменьшающие закоксовывание катализатора благодаря сокращению перепада температуры по высоте слоя и улучшенной очистке сырья от вредных примесей. Предложено разбавлять катализатор инертным силикагелевым носителем или фосфорнокислотным катализатором прямой гидратации этилена с целью удлинения срока службы катализатора и облегчения его выгрузки. Подобран оптимальный режим ввода воды в катализатор для предотвращения его дегидратации. Созданы установки сравнительно большой мощности, в которых используется реактор башенного типа. Схемы этих установок предусматривают возможность рециркуляции сырья и части продуктов реакции и обеспечивают производство тримеров и тетрамеров пропилена, димеров бутенов или кумола (алкилированием бензола пропиленом на том же фосфорнокислотном катализаторе). [c.326]
При условии добавления небольших количеств воды для гидратации катализатора продолжительность его жизни достигает 700 ч 1 кг катализатора дает около 750—800 л кумола. Исходный бензол и пропилен должны быть очищены от серы. Содержание тиофена в бензоле допускается до 0,14%. Бензол предварительно очищается серной кислотой. [c.269]
Получают спирты различными методами, в частности гидролизом галогенопроизводных, о чем говорилось выше, или гидратацией алкенов. Например, пропилен взаимодействует с водой в присутствии серной кислоты с образованием спирта [c.412]
Из этого уравнения при 7=298 К константа равновесия равна /Ср=46,1. Учитывая, что опытное равновесие реакции гидратации пропилена осложнено побочными реакциями, совпадение констант равновесия можно считать удовлетворительным. Если же учесть возможность конденсации воды во время проведения экспериментов по изучению равновесия и взаимодействие жидкой воды с пропиленом, то получим, что УСр=1,42. Это практически совпадает с предыдущим значением константы равновесия. [c.218]
Газофазная гидратация пропилена на фосфорнокислотном катализаторе аналогична описанной для синтеза этилового спирта. Пропилен более реакционноспособен, поэтому температура и давление реакции несколько ниже 200 °С, 2—3 МПа. Для предотвращения образования диизопропилового эфира конверсию водяных паров поддерживают не выше 4—5%, что позволяет после конденсации получать 15—20%-ный спирт. Конверсия пропилена может быть значительно более высокой. Это достигается регулированием состава исходной смеси. При синтезе изопропилового спирта в отличие от гидратации этилена используют избыток водяного пара и доводят конверсию пропилена до 10— 12%. Мольное соотношение вода пропилен принимают равным (04 0,5) 1. [c.220]
За рубежом в качестве катализатора реакции гидратации пропилена применяют окись вольфрама УОз, промотированную окисью цинка. Катализатор и промотор наносят на носитель — силикагель. Реакция гидратации протекает при температуре 230—240 °С и давлении 200—250 аг молярное отношение воды к пропилену 10 1. При однократном проходе через реактор конверсия пропилена составляет 50%. Спирт получается в виде 20%-ного водного раствора. Общий выход спирта составляет 95% в расчете на пропилен. [c.218]
Различные производства применяют разные методы очистки сточных вод. На нефтехимических производствах (синтетического спирта, фенола, ацетона, синтетических жирных кислот, синтетического каучука и др.) используется биологическая очистка в аэротенках стоков, загрязненных органическими веществами [44]. Основными местами загрязнения являются цехи пиролиза углеводородов, гидратации этилена и ректификации спирта. В цехе пиролиза углеводородов сточные воды содержат этилен, пропилен, бутан, изобутан, бензол, толуол, ксилол, нафталин. В цехе гидратации этилена и ректификации спирта стоки содержат диэтиловый эфир, этиловый и изопропиловый спирты, ацетальдегид, продукты полимеризации, смолу. Применяемая на этих производствах биологическая очистка значительно снижает содержание в сточных водах бензола, толуола, ксилола, нафталина, ослабляет запах. По данным [0-27], на нефтеперерабатывающем заводе биохимическая очистка стоков снижает содержание нефтепродуктов на 40%, нерастворенных веществ на 96%, уменьшает БПКб на 50% и ХПК на 70%. По данным [45], на нефтеперерабатывающем заводе в результате применения новейшей конструкции деэмульгаторов содержание нефти в сточны.х водах уменьшилось в 4—5 раз. На заводе химического волокна флотационная очистка снижает содержание нерастворенных веществ на 70—80% [0-27]. [c.8]
В Советском Союзе процесс прямой гидратации пропилена разработан с теми же катализаторами, которые применяются для гидратации этилена, т. е. с катализаторами на основе фосфорной кислоты. Так, в присутствии катализатора фосфорная кислота на силикагеле при температуре 170°С, давлении 7—9 ат, молярном отношении воды к пропилену 0,7—1 1 кон- [c.218]
Рунге и его сотрудники установили [138], что в присутствии вольфрамовых катализаторов при 260—320° С и 80—200 атм пропилен, насыщенный парами воды, за один проход конвертируется на 8,8%. При этом выход изопропилового спирта составляет 94% на прореагировавший пропилен, полученный конденсат содержит 20% изопропилового спирта. Срок службы катализатора превышает 1000 час. По патентным данным [139] оптимальными условиями прямой гидратации на фосфорной кислоте, нанесенной на пористые носители (силикагель, кизельгур и др.), являются температура 180° С, давление 18 атм. Конверсия пропилена в этих условиях достигает 4—5%, выход спирта доходит до 200 л катализатора в час. [c.140]
При синтезе таких каучуков, как дивинилстирольный, дивинил-нитрильный, хлоропреновый, и ряда других применяются процессы эмульсионной полимеризации с использованием воды в качестве дисперсионной среды. Ряд промышленных процессов, к которым относятся, например, производство дивинила из нефтяных газов (бутана, бутиленов), производство изоп рена методом каталитического дегидрирования изопентана, производство стирола и метилстирола алкилированием бензола соответственно этиленом или пропиленом, гидратация ацетилена в ацетальдегид осуществляются в присутствии большого избытка водяного пара. В присутствии водяного пара протекает также процесс пиролиза углеводородов при производстве этилена и пропилена. [c.12]
Наиболее широко используемый процесс получения спиртов из олефинов — абсорбция олефина серной кислотой с последующим добавлением воды для гидролиза образующегося сульфата. Ион карбония может атаковать воду с непосредственным образованием спирта. Абсорбция пропилена проходит более легко, чем этилена, а изобутилен абсорбируется еще легче. Концентрация используемой серной кислоты зависит от природы гидратируемого олефина. Способ гидратации олефина может быть выбран на основании относительной устойчивости ионов карбония, образующихся при протонировании. Пропилен и изобутилен дают изопропиловый и трет-бутиловый спирты соответственно [c.132]
Наибольшее применение получили методы синтеза пропилен-гликоля, основанные на гидратации пропиленоксида. В молекуле пропиленоксида имеется замещенный атом углерода, поэтому реакционная способность этого соединения выше и процесс гидратации протекает с большей скоростью, чем в случае получения этиленгликоля гидратацией этиленоксида. Состав продуктов реакции определяется соотношением воды и пропиленоксида [c.227]
Гидратация олефинов. Ст. 1 Действие вод. растворов серной кислоты ва пропилен в условиях высокоинтенспв. контакта / В. С. Гутыря, В. JI. Буйницкая / Азерб. нефт. хоз-во.— № 1.— С, 50—57. [c.365]
Первый метод в принципе похож на процесс гидратации этилена. Пропилен или содержащие его газы нри 20" пропускают под давлением в 92%-ную серную кислоту. Реакционную смссь, состоящую иа моно- и диизопро-пилсульфата, разбаиляют водой, гидролизуют и отгоняют острым паром изопропиловый спирт вместо с побоч]пям продуктом — диизопропиловым )фиром. Отработанную кпслоту укрепляют и возвращают в процесс. [c.461]
В последнее время Рунге с сотрудниками [59] подробно исследовали процесс каталитической гидратации пропилена. Они показали, что, пропуская над определенными вольфрамовыми катализаторами при 260—320° и 80—200 ат пропилен, почти насыщенный нарами воды, можно достигнуть 8,8%-ной степени превращения при однократном прохождении газов через контакт нри этом выход изопропилового спирта из пропилена составляет 94%. Если применить некоторые другие промоторы, в продуктах реакции появляется к-пропиловый спирт в количестве, находящемся в прямой зависимости от концентрации промотора. [c.470]
На предприятиях нефтехимии (синтетического спирта, фенола, ацетона, интетических жирных кислот, синтетического каучука и др.)используется биохимический метод очистки в аэротенках стоков, загрязненных органическими веществами [35]. Основными местами загрязнения являются цехи пхфолиза углеводородов, гидратации этилена и ректификации спирта. В цехе гидролиза углеводородов сточные воды содержат этилен, пропилен, бутан, изобутан, бензол, толуол, ксилол, нафталин. В цехе гидратации этилена и ректификации спирта стоки содержат диэтиловый эфир, этиловый и изопропиловый спирты, ацетальдегид, продукты полимеризации, смолу. Применяемая на этих предприятиях биохимическая очистка значительно снижает содержание в сточных водах бензола, толуола, ксилола, нафталина, ослабляет запах. [c.8]
Прямую гидратацию пропилеиа можно проводить на вольфрам-содержащнх катализаторах при мольном соотношении пропилен вода =1 10. Применяемый катализатор содержит 22 % W2O3 и 5 % ZnO. Смесь пропилена и водяных паров пропускают над твердым катализатором при 230—240°С и 20—25 МПа. Степень превращения пропилена за проход достигает 50 % выход спирта 95%. В конденсате содержится 20 7о-ный изопропанол. С 1 м катализатора получается 15—30 кг изопропилового спирта в час. Согласно результатам более поздних исследований, давление при работе на вольфрамовом катализаторе можно снизить до 8 МПа. [c.373]
Прямую гидратацию пропилена проводят на вольфрамсодержащих катализаторах при мольном отношении пропилен вода = = 1 10. Применяемый катализатор содержит 22% V2O3 и 5% 2пО. Смесь пропилена и водяных паров пропускают над твердым катализатором при 230—240 °С и 200—250 кгс/см (19,6— 24,6 МН/м ). Степень превращения пропилена за проход достигает 50% выход спирта 95%. В конденсате содержится 20%-ный изопропиловый спирт. С 1 м катализатора получается 15--30 кг изо- [c.36]
Легкость присоединения воды к низкомолекулярным олефинам возрастает по мере увеличения числа углеродных атомов в молекуле другими словами, если для гидратации этилена требуется серная кислота с концентрацией более 90 %, то для гидратации пропилена достаточно применять 50—90%-ную кислоту, для гидратации нормальных бутенов 75—85%-ную кислоту и для гидратации изобутена -60—65%-ную кислоту. Гидратация высших олефинов протекает по той же принципиальной схеме, что и гидратация отилспа, по проблема регенерации кислоты не представляет особых трудностей, и поэтому в качестве сырья могут использоваться газы с меньшей концентрацией олефина. В определенных условиях пропилен можно гидратировать 60—70%-ной кислотой, что соответственно снижает расходы на регенерацию кислоты [16]. Имеются предложения применять для гидратации пропилена сильно разбавленную серную кислоту, например 27—65%-ную, без разбавления ее после стадии адсорбции, однако в этом случае возникают сложные проблемы, связанные с коррозией аппаратуры, так как эту особенно сильную кислоту приходится применять при повышенных температуре и давлении. Ни одного промышленного процесса, основанного на этом методе, не известно. [c.58]
Впоследствии в ГИВД была проведена работа по выявлению оптимальных условий гидратации пропилена над теми же катализаторами, которые применялись для гидратации этилена. Данные ГИВД легли в основу работ на полузаводской установке завода АзСК [31]. В результате были выявлены следуюш,ие оптимальные условия гидратации пропилена катализатор — фосфорная кислота на угле, температура реакции 200°, объемная скорость циркуляции пропилена 3500 л л катализатора в час, молярное отношение воды к пропилену 0,75 1, парциальное давление пропилена 6 ат, конверсия пропилена за проход 1,7%, длительность эффективной работы катализатора 200—250 час. [c.261]
Б. открыл явление полимеризации изобутилена. Б. детально исследовал реакции присоединения воды к ненасыщенным углеводородам (этилен, пропилен и др.) в присутствии серной кислоты с образованием 9ТИЛОВОГО и других спиртов. Эти реакции (полимеризации и гидратации олефинов) в настоящее время лежат в основе новых крупных производств. [c.156]
Исследована гидратация пропилена на вольфрамовом катализаторе в жидкой фазе. На лабораторной установке с загрузкой 100 мл катализатора изучено влияние темиературы (160—220°), давления (80—300 ат) и молярного отношения воды к пропилену (5—50). Оптимальными условиями гидратации пропилена являются давление 150 ат, температура 180° и молярное отношенпе воды к нропн,л(Я1у 30—40. При этих условиях съем сиирта составляет 300—400 г/л, х атализатора час, превращение пронилена — 50—60% при концентрац]1И спирта 4—5%. Катализатор работает 600 час. без большого снижения активности. [c.547]
В течение ряда лет процесс получения этанола из этилена коксового газа методом сернокислотной гидратации изучался УХИНом в лабораторных условиях и на опытных полузавод-ских установках [130, 132]. Разработка процесса велась в двух вариантах — при обычном давлении и под давлением 5, 10 и 15 ат. Сущность процесса состоит в том, что коксовый газ, освобожденный от серы и остатков бензола и содержащий этилен, сжимается до 5—15 аг, после чего подвергается осушке и очистке от высших гомологов этилена (пропилен, бутилен и др.). Осушенный и очищенный коксовый газ промывается в этиленовых абсорберах в противотоке смесью этилсерной и серной кислот и затем, после нейтрализации от следов ЗС , направляется на дальнейшее использование. Этилсерная кислота подвергается гидролизу путем разбавления водой и нагревания паром. В результате гидролиза образуются спиртоводная смесь и отработанная серная кислота (45—47%-я). Из спиртоводной смеси отгоняется спирт-сырец, который после нейтрализации паров подвергается ректификации. Отработанная серная кислота поступает на реконцентрацию, где упаривается до 92%. Часть этой чки лоты 420 9 > подается на улавливание ла хаза пропилен а, а основное количество укрепляется до 97—98% и затемх возвращается в цикл улавливания этилена. Укрепление 92%-й кислоты цроизводится парами ЗОз, получаемыми от сжигания серы, извлеченной из газа в цехе сероочистки. [c.164]
ТА воздушный термостат, в котором температура поддерживалась постоянной с точностью 0,2°. Концентрация кислоты в пленке могла меняться посредством впуска разных количеств воды из колбы 5, в которой находилась вода, предварительно очищенная от летучих примесей тщательной откачкой. После достижения нужной концентрации кислоты, о чехм судили по установлению соответствующей упругости пара, в опытах по гидратации в реакционную колбу впускался из газометра пропилен, а в опытах по дегидратации из колбы 6 — впускался предварительно тщательно абсолютированный металлический натрием или кальцием изопропиловый спирт. Колбы 5 VI 6 помещались в нагретую водяную баню. Давлепие реагентов измерялось ртутным манометром 7. За ходом процесса следили по росту давления при дегидратации и по уменьшению давления при гидратации. Изменение давления измерялось при помощи дифференциального манометра 8. При изучении кинетики гидратации, где изменения давления малы, использовался манометр с расширенным коленом, что позволяло делать отсчеты через 1 мм. При малых изменениях давлепия отсчеты производились при помощи катетометра. По окончании опыта продукты реакции конденсировались в охлаждаемой жидким азотом ловушке 10. [c.590]
Описан процесс прямой гидратации пропилена в жидкой фазе с использованием катионообменной смолы в качестве катализатора. Механизм реакции аналогичен механизму прямой гидратации на других катализаторах кислотного типа. В качестве сырья используется 92 %-ный пропилен. Температура реакции сравнительно низкая (130—150°С), что термодинамически выгодно. По мере дезактивации катализатора температуру несколько повышают. Давление в реакторе от 5,9 до 10 МПа. С повышением давления возрастают количество пропилена, растворенного в жидкой фазе, и степень конверсии его в спирт. Мольное соотношение вода пропилен колеблется от 12,5 1 до 15 1. В этих условиях степень конверсии пропилена достигает 75%, а количество побочных продуктов (диизопропилового эфира и полимеров) очень мало. Благодаря высокой степени конверсии пропилена количество непрореагировавшего газа невелико, и его не возвращают в процесс, а направляют на концентрирование пропилена. [c.373]
Пример. Прямую гидратацию пропилена в изоиропанол осуществляют в четырехполочном реакторе внутренним диаметром 1600 мм. На каждой полке расположен сульфокатионитный катализатор слоем высотой 1,8 м. Вода и пропилен поступают на гидратацию в мольном соотношении 14,5 1, причем вода расходуется только на образование изопропанола. Определить массовую долю изопропанола в воде на выходе из реактора, если производительность 1 катализатора равна 100 кг изопропанола в час, степень конверсии пропилена 75%, а селективность по изопропанолу 96,4%- [c.111]
Уменьшение количества водяных паров, содержащихся в исходной смеси, также приводит к снижению степени превращения этилена в спирт, но одновременно повышается концентрация спирта в получаемом спиртоводяном конденсате, что имеет существенное значение при промышленном осуществлении реакции прямой гидратации. Аналогичные закономерности наблюдаются при термодинамическом расчете реакции присоединения воды к пропилену при получении изопропилового спирта. [c.83]
chem21.info
Пропилен - это... Что такое Пропилен?
Пропиле́н (пропен) СН2=СН-СН3 — непредельный (ненасыщенный) углеводород ряда этилена, горючий газ, является изологом пропана.
Вещество с наркотическим действием более сильным, чем у этилена. Класс опасности - четвертый.[1].Физические свойства
Пропилен представляет собой газообразное вещество с низкой температурой кипения tкип= -47,7 °C и температурой плавления tпл= −187,6 °C, оптическая плотность d204=0,5193.
Химические свойства
Обладает значительной реакционной способностью. Его химические свойства определяются двойной углерод-углеродной связью. p-связь, как наименее прочная и более доступная, при действии реагента разрывается, а освободившиеся валентности углеродных атомов затрачиваются на присоединение атомов, из которых состоит молекула реагента. Все реакции присоединения протекают по двойной связи и состоят в расщеплении π-связи алкена и образовании на месте разрыва двух новых σ-связей.
Чаще реакции присоединения идут по гетеролитическому типу, являясь реакциями электрофильного присоединения.
Присоединение галогенов (галогенирование)
Реакцию галогенирования обычно проводят в растворителе при обычной температуре. Галогены легко присоединяются по месту разрыва двойной связи с образованием дигалогенопроизводных. Легче идет присоединение хлора и брома, труднее — йода. Фтор взаимодействует со взрывом.

Присоединение водорода (реакция гидрирования)
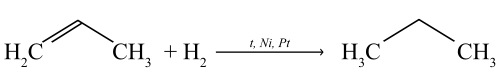
Присоединяя водород в присутствии катализаторов (Pt, Pd, Ni), пропен переходит в предельный углеводород — пропан.
Присоединение воды (реакция гидратации)
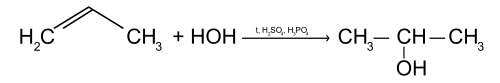
Пропилен реагирует с водой с образованием одноатомного спирта изопропанола, при этом двойная связь раскрывается.
Присоединение галогеноводородов (HHal)
Происходит по правилу Марковникова. Водород кислоты HHal присоединяется к наиболее гидрированному атому углерода при двойной связи. Соответственно остаток Hal связывается с атомом углерода, при котором находится меньшее число атомов водорода.
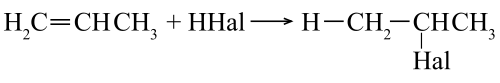
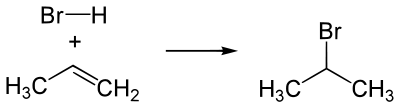
Пример гидрогалогенирования — получение бромпроизводного пропана при реакции бромоводорода и пропилена.
Горение на воздухе
При поджигании горит на воздухе: 2СН2=СНСН3 + 9О2 → 6СО2 + 6Н2О.
С кислородом воздуха газообразный пропилен образует взрывчатые смеси.
В слабощелочной или нейтральной водной среде пропилен окисляется перманганатом калия, что сопровождается обесцвечиванием раствора KMnO4 и образованием гликолей (соединений с двумя гидроксильными группами при соседних атомах углерода). Эта реакция получила название реакции Вагнера.
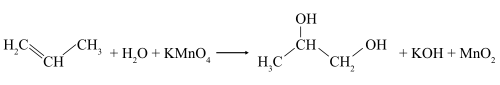
Полимеризация
Условия реакции: нагревание, присутствие катализаторов. Соединение молекул происходит путем расщепления внутримолекулярных π-cвязей и образования новых межмолекулярных σ-cвязей.

Окисление кислородом воздуха в пропиленоксид
При нагревании в присутствии серебряных катализаторов:

Получение
В лаборатории
1. Отщепление галогеноводорода от галогеналкилов при действии на них спиртового раствора щелочи:
h3C—CH – Ch4 → h3C=CH–Ch4 + KCl + h3O | | Cl H K — ОH2. Гидрирование пропина в присутствии катализатора (Pd):
H—C≡C—Ch4 + h3 → h3C=CH—Ch4
3. Дегидратация изопропилового спирта (отщепление воды). В качестве катализатора используют кислоты (серную или фосфорную) или Аl2O3:
Н2С—СН — Ch4 → Н2С=СН — Ch4 + Н2О | | H OH4. Отщепление двух атомов галогена от дигалогеноалканов, содержащих галогены при соседних атомах С. Реакция протекает под действием металлов (Zn и др.):
h3C-CH-Ch4+Zn → h3C=CH-Ch4+ZnBr2| | Br BrВ промышленности
Обычно пропилен выделяют из газов нефтепереработки (при крекинге сырой нефти в кипящем слое (процесс фирмы BASF), пиролизе бензиновых фракций) или попутных газов, а также из газов коксования угля. Существует несколько видов пиролиза пропилена: пиролиз в трубчатых печах, пиролиз в реакторе с кварцевым теплоносителем (процесс фирмы Phillips Petroleum Co.), пиролиз в реакторе с коксовым теплоносителем (процесс фирмы Farbewerke Hoechst), пиролиз в реакторе с песком в качестве теплоносителя (процесс фирмы Lurgi), пиролиз в трубчатой печи (процесс фирмы Kellogg), процесс Лавровского — Бродского, автотермический пиролиз по Бартоломе. В промышленности пропилен получают также дегидрированием алканов в присутствии катализатора (Сr2О3, Аl2О3).
Промышленным способом получения пропилена наряду с крекингом служит дегидратация пропанола над оксидом алюминия:

Применение
Для производства оксида пропилена, получения изопропилового спирта и ацетона, для синтеза альдегидов, для получения акриловой кислоты и акрилонитрила, полипропилена, пластмасс, каучуков, моющих средств, компонентов моторных топлив, растворителей.
Производство
Большая часть производственных мощностей по пропилену сосредоточена в Европе, Северной Америке и Азии. В настоящее время за год в мире производится более 50 миллионов тонн пропилена полимерного и химического сортов (PG/CG). Большая часть выпуска пропилена этих сортов приходится на долю установок пиролиза, где пропилен — побочный продукт производства этилена. Установками термического крекинга вырабатывается более 60 % такого пропилена. Нефтеперерабатывающими FCC-предприятиями выпускается 34 %. При дегидрогенизации или метатезисе пропана производится 3 % пропилена (в данном случае пропилен является целевым продуктом).


Пропилен нефтехимической чистоты (RG) производится на нефтеперерабатывающих предприятиях мира в количестве, равном 31,2 миллионам тонн. Большая часть такого пропилена вырабатывается на FCC-предприятиях, где пропилен — побочный продукт производства бензина и дистиллятов. Половина этих пропиленовых мощностей интегрирована с нефтехимическими предприятиями, на которых происходит алкилирование пропилена или смешивание LPG и пропана.
Источники
- http://www.ssa.ru
- http://chem.edu.ru
- А. И. Артеменко, Органическая химия, М.:Высшая школа — 1998
- Б. Д. Степин, А. А. Цветков, Органическая химия, М.:Высшая школа — 1994
Примечания
Ссылки
 |
dic.academic.ru
Полимеризация пропилена: схема, уравнение, формула
Что представляет собой полимеризация пропилена? Каковы особенности протекания данной химической реакции? Попробуем найти развёрнутые ответы на эти вопросы.

Характеристика соединений
Схемы реакций полимеризации этилена и пропилена демонстрируют типичные химические свойства, которыми обладают все представители класса олефинов. Такое необычное название данный класс получил от старого названия масла, используемого в химическом производстве. В 18 веке был получен хлористый этилен, который представлял собой маслянистое жидкое вещество.
Среди особенностей всех представителей класса непредельных алифатических углеводородов отметим наличие в них одной двойной связи.
Радикальная полимеризация пропилена объясняется именно присутствием в структуре вещества двойной связи.

Общая формула
У всех представителей гомологического ряда алкенов общая формула имеет вид СпН2п. Недостаточное количество водородов в структуре объясняет особенность химических свойств этих углеводородов.
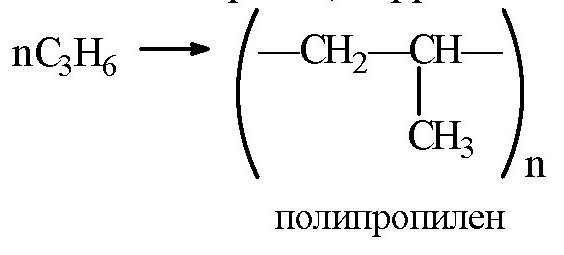
Уравнение реакции полимеризации пропилена является прямым подтверждением возможности разрыва по такой связи при использовании повышенной температуры и катализатора.
Непредельный радикал называется аллилом или пропенилом-2. Зачем проводится полимеризация пропилена? Продукт этого взаимодействия применяется для синтеза синтетического каучука, который, в свою очередь, востребован в современной химической промышленности.
Физические свойства
Уравнение полимеризации пропилена подтверждает не только химические, но и физические свойства данного вещества. Пропилен является газообразным веществом с невысокими температурами кипения и плавления. Данный представитель класса алкенов имеет незначительную растворимость воде.

Химические свойства
Уравнения реакции полимеризации пропилена и изобутилена показывают, что процессы протекают по двойной связи. В качестве мономеров выступают алкены, а конечными продуктами такого взаимодействия будут полипропилен и полиизобутилен. Именно углерод-углеродная связь при подобном взаимодействии будет разрушаться, и в конечном итоге будет образовываться соответствующие структуры.
По двойной связи происходит образование новых простых связей. Как протекает полимеризация пропилена? Механизм данного процесса аналогичен процессу, протекающему у всех остальных представителей данного класса непредельных углеводородов.
Реакция полимеризации пропилена предполагает несколько вариантов протекания. В первом случае процесс осуществляется в газовой фазе. По второму варианту реакция идет в жидкой фазе.
Кроме того, полимеризация пропилена протекает и по некоторым устаревшим процессам, предполагающим применение в качестве реакционной среды насыщенного жидкого углеводорода.

Современная технология
Полимеризация пропилена в массе по технологии Spheripol представляет собой совмещение суспензионного реактора для изготовления гомополимеров. Процесс предполагает применение газофазного реактора с псевдожидкостным слоем для создания блок-сополимеров. В подобном случае реакция полимеризации пропилена предполагает добавление в устройство дополнительных совместимых катализаторов, а также проведение предварительной полимеризации.

Особенности процесса
Технология предполагает перемешивание компонентов в специальном устройстве, предназначенном для предварительного превращения. Далее эту смесь добавляют в петлевые полимеризационные реакторы, туда поступает и водород, и отработанный пропилен.
Работа реакторов осуществляется при диапазоне температур от 65 до 80 градусов по Цельсию. Давление в системе не превышает 40 бар. Реакторы, которые располагаются последовательно, применяются на заводах, рассчитанных на большие объемы изготовления полимерной продукции.
Из второго реактора удаляют полимерный раствор. Полимеризация пропилена предполагает перенос раствора в дегазатор повышенного давления. Здесь осуществляется удаление порошкового гомополимера от жидкого мономера.
Производство блоксополимеров
Уравнение полимеризации пропилена Ch3= CH - Ch4 в данной ситуации имеет стандартный механизм протекания, есть отличия только в условиях осуществления процесса. Вместе с пропиленом и этеном порошок из дегазатора идет в газофазный реактор, работающий при температуре около 70 градусов по Цельсия и давлении не больше 15 бар.
Блок сополимеры после выведения из реактора поступают в специальную систему отведения от мономера порошкообразного полимера.
Полимеризация пропилена и бутадиенов ударопрочного вида допускает использование второго газофазного реактора. Он позволяет увеличивать уровень пропилена в полимере. Кроме того, возможно добавление в готовый продукт добавок, использование гранулирования, способствует повышению качества получаемого продукта.

Специфика полимеризации алкенов
Между изготовлением полиэтилена и полипропилена есть некоторые отличия. Уравнение полимеризации пропилена позволяет понять, что предполагается применение иного температурного режима. Кроме того, некоторые различия существуют и в конечной стадии технологической цепочки, а также в областях использования конечных продуктов.
Пероксид используют для смол, которые обладают отличными реологическими свойствами. У них повышенный уровень текучести расплавов, сходные физические свойства с теми материалами, которые имеют низкий показатель текучести.
Смолы, имеющие отличные реологические свойства, применяют в процессе литьевого формования, а также в случае изготовления волокон.
Для повышения прозрачности и прочности полимерных материалов производители стараются добавлять в реакционную смесь специальные кристаллизирующие добавки. Часть полипропиленовых прозрачных материалов замещают постепенно иными материалами в области выдувного формования и создания литья.
Особенности полимеризации
Полимеризация пропилена в присутствии активированного угля протекает быстрее. В настоящее время применяется каталитический комплекс углерода с переходным металлом, основанный на адсорбционной способности углерода. В результате полимеризации получается продукт, имеющий отличные эксплуатационные характеристики.
В качестве основных параметров процесса полимеризации выступает скорость реакции, а также молекулярный вес и стереоизомерный состав полимера. Значение имеет и физическая и химическая природа катализатора, полимеризационная среда, степень чистоты составных частей реакционной системы.
Линейный полимер получается и в гомогенной, и в гетерогенной фазе, если идет речь об этилене. Причина заключается в отсутствии у данного вещества пространственных изомеров. Чтобы получить изотактический полипропилен, стараются использовать твердые хлориды титана, а также алюминийорганические соединения.
При применении комплекса, адсорбированного на кристаллическом хлориде титана (3), можно получать продукт с заданными характеристиками. Регулярность решетки носителя не является достаточным фактором для приобретения катализатором высокой стереоспецифичности. Например, в случае выбора иодида титана (3) наблюдается получение большего количества атактического полимера.
Рассмотренные каталитические компоненты имеют льюисовский характер, поэтому связаны с подбором среды. Самой выгодной средой является применение инертных углеводородов. Так как хлорид титана (5) является активным адсорбентом, в основном выбирают алифатические углеводороды. Как протекает полимеризация пропилена? Формула продукта имеет вид (-СН2-СН2-СН2-)п. Сам алгоритм реакции аналогичен протеканию реакции у остальных представителей данного гомологического ряда.
Химическое взаимодействие
Проанализируем основные варианты взаимодействия для пропилена. Учитывая, что в его структуре есть двойная связь, основные реакции протекают именно с ее разрушением.
Галогенирование протекает при обычной температуре. По месту разрыва сложной связи происходит беспрепятственное присоединение галогена. В результате данного взаимодействия образуется дигалогенпроизводное соединение. Труднее всего происходит йодирование. Бромирование и хлорирование протекает без дополнительных условий и энергетических затрат. Фторирование пропилена протекает со взрывом.
Реакция гидрирования предполагает использование дополнительного ускорителя. В качестве катализатора выступает платина, никель. В результате химического взаимодействия пропилена с водородом, образуется пропан – представитель класса предельных углеводородов.
Гидратация (присоединение воды) осуществляется по правилу В. В. Марковникова. Суть его состоит в присоединении по двойной связи атома водорода к тому углероду пропилена, который имеет его максимальное количество. При этом галоген будет прикрепляться к тому С, который имеет минимальное число водорода.
Для пропилена характерно горение в кислороде воздуха. В результате этого взаимодействия будет получаться два основных продукта: углекислого газа, водяного пара.
При действии на данное химическое вещество сильных окислителей, например, перманганата калия, наблюдается его обесцвечивание. Среди продуктов химической реакции будет двухатомный спирт (гликоль).
Получение пропилена
Все способы можно разделить на две основные группы: лабораторные, промышленные. В лабораторных условиях можно получить пропилен при отщеплении галогеноводорода от исходного галогеналкила при воздействии на них спиртового раствора гидроксида натрия.
Пропилен образуется при каталитическом гидрировании пропина. В лабораторных условиях данное вещество можно получить при дегидратации пропанола-1. В данной химической реакции применяют в качестве катализаторов фосфорную либо серную кислоту, оксид алюминия.
Как получают пропилен в больших объемах? В связи с тем, что в природе данное химическое вещество встречается редко, были разработаны промышленные варианты его получения. Самым распространенным является выделение алкена из продуктов нефтепереработки.
Например, осуществляется крекинг сырой нефти в специальном кипящем слое. Пропилен получают путем пиролиза бензиново фракции. В настоящее время выделяют алкен и из попутного газа, газообразны продуктов коксования угля.
Есть разнообразные варианты пиролиза пропилена:
- в трубчатых печах;
- в реакторе с применением кварцевого теплоносителя;
- процесс Лавровского;
- автотермический пиролиз по методу Бартломе.
Среди отработанных промышленных технологий необходимо отметить и каталитическое дегидрирование насыщенных углеводородов.
Применение
Пропилен имеет различные области применения, поэтому и производится в больших масштабах в промышленности. Своим появлением данный непредельный углеводород обязан работам Натты. В середине двадцатого века он, пользуясь каталитической системой Циглера, разработал технологию полимеризации.
Натта сумел получить стереорегулярный продукт, который был им назван изотактическим, поскольку в структуре метильные группы были расположены с одной стороны цепочки. Благодаря такому варианту «упаковки» полимерных молекул, получаемое полимерное вещество имеет отличные механические характеристики. Полипропилен используется для изготовления синтетического волокна, востребован в качестве пластической массы.
Примерно десять процентов нефтяного пропилена потребляется для производства его оксида. До середины прошлого века данное органическое вещество получали хлоргидринным методом. Реакция протекала через образование промежуточного продукта пропиленхлоргидрина. У такой технологии есть определенные недостатки, которые связаны с использованием дорогостоящего хлора и гашеной извести.
В наше время на смену этой технологии пришел халкон-процесс. Он основывается на химическом взаимодействии пропена с гидропероксидами. Применяют оксид пропилена в синтезе пропиленглиголя, идущий на изготовление пенополиуретанов. Они считаются отличными амортизирующими материалами, поэтому идут на создание упаковок, ковриков, мебели, теплоизоляционных материалов, сорбирующих жидкостей и фильтрующих материалов.
Кроме того, среди основных сфер применения пропилена необходимо упомянуть синтез ацетона и изопропилового спирта. Изопропиловый спирт, являясь отличным растворителем, считается ценным химическим продуктом. В начале двадцатого века этот органический продукт получали сернокислотным методом.
Кроме того, отработана технология прямой гидратации пропена с введением в реакционную смесь кислых катализаторов. Около половины всего производимого пропанола уходит на синтез ацетона. Данная реакция предполагает отщепление водорода, проводится при 380 градусах по Цельсия. Катализаторами в этом процессе выступают цинк и медь.
Среди важных отраслей применения пропилена особое место занимает гидроформилирование. Пропен идет на производство альдегидов. Оксисинтез в нашей стране стали использовать с середины прошлого века. В настоящее время эта реакция занимает важное место в нефтехимии. Химическое взаимодействие пропилена с синтез-газом (смесью угарного газа и водорода) при температуре 180 градусов, катализаторе оксиде кобальта и давлении в 250 атмосфер наблюдается образование двух альдегидов. Один имеет нормальное строение, у второго – изогнутая углеродная цепочка.
Сразу после открытия данного технологического процесса, именно эта реакция стала объектом исследований для многих ученых. Они искали способы смягчения условий ее протекания, старались снизить процентное содержание в получаемой смеси альдегида разветвленного строения.
Для этого были придуманы экономичные процессы, предполагающие применение иных катализаторов. Удалось снизить температуру, давление, увеличить выход альдегида линейного строения.
Эфиры акриловой кислоты, которые также связаны с полимеризацией пропилена, применяют в качестве сополимеров. Около 15 процентов нефтехимического пропена применяют в качестве исходного вещества для создания акрионитрила. Этот органический компонент необходим для изготовления ценного химического волокна – нитрона, создания пластических масс, производства каучуков.
Заключение
Полипропилен считают в настоящее время крупнейшим производством нефтехимии. Спрос на этот качественный и недорогой полимер растет, поэтому он постепенно вытесняет полиэтилен. Он незаменим при создании жесткой упаковки, пластин, пленок, автомобильных деталей, синтетической бумаги, канатов, ковровых деталей, а также для создания разнообразного бытового оборудования. В начале двадцать первого века производство полипропилена занимало второе место в полимерной промышленности. Учитывая запросы различных отраслей промышленности, можно сделать вывод: в ближайшее время сохранится тенденция масштабного производства пропилена и этилена.
fb.ru
Формула Пропилена структурная химическая
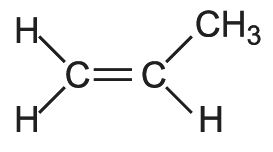
Структурная формула
 |
 |
Истинная, эмпирическая, или брутто-формула: C3H6
Химический состав Пропилена
| H | Водород | 1.008 | 6 | 14,4% |
| С | Углерод | 12.011 | 3 | 85,6% |
Молекулярная масса: 42,081
Пропиле́н (пропен) — СН2=СН-СН3 — непредельный (ненасыщенный) углеводород ряда этилена, горючий газ. Вещество с наркотическим действием более сильным, чем у этилена. Класс опасности — четвертый.
Физические свойства
Пропилен представляет собой газообразное вещество с низкой температурой кипения tкип= −47,6 °C и температурой плавления tпл= −187,6 °C, оптическая плотность d204=0,5193. плотность по воздуху=1.45(по справочнику Баратова).
Химические свойства
Обладает значительной реакционной способностью. Его химические свойства определяются двойной углерод-углеродной связью. p-связь, как наименее прочная и более доступная, при действии реагента разрывается, а освободившиеся валентности углеродных атомов затрачиваются на присоединение атомов, из которых состоит молекула реагента. Все реакции присоединения протекают по двойной связи и состоят в расщеплении π-связи алкена и образовании на месте разрыва двух новых σ-связей. Чаще реакции присоединения идут по гетеролитическому типу, являясь реакциями электрофильного присоединения.
Присоединение галогенов (галогенирование)
Реакцию галогенирования обычно проводят в растворителе при обычной температуре. Галогены легко присоединяются по месту разрыва двойной связи с образованием дигалогенопроизводных. Легче идет присоединение хлора и брома, труднее — йода. Фтор взаимодействует со взрывом.
Присоединение водорода (реакция гидрирования)
Присоединяя водород в присутствии катализаторов (Pt, Pd, Ni), пропилен переходит в предельный углеводород — пропан.
Присоединение воды (реакция гидратации)
Пропилен реагирует с водой с образованием одноатомного спирта изопропанола, при этом двойная связь раскрывается.
Присоединение галогеноводородов (HHal)
Происходит по правилу Марковникова. Водород кислоты HHal присоединяется к наиболее гидрированному атому углерода при двойной связи. Соответственно остаток Hal связывается с атомом углерода, при котором находится меньшее число атомов водорода. Пример гидрогалогенирования — получение бромпроизводного пропана при реакции бромоводорода и пропилена.
Горение на воздухе
При поджигании горит на воздухе. С кислородом воздуха газообразный пропилен образует взрывчатые смеси.
Окисление
В слабощелочной или нейтральной водной среде пропилен окисляется перманганатом калия, что сопровождается обесцвечиванием раствора KMnO4 и образованием гликолей (соединений с двумя гидроксильными группами при соседних атомах углерода). Эта реакция получила название реакции Вагнера.
Полимеризация
Условия реакции: нагревание, присутствие катализаторов. Соединение молекул происходит путём расщепления внутримолекулярных π-связей и образования новых межмолекулярных σ-связей.
Получение
В промышленности
Обычно пропилен выделяют из газов нефтепереработки (при крекинге сырой нефти в кипящем слое (процесс фирмы BASF), пиролизе бензиновых фракций) или попутных газов, а также из газов коксования угля. Существует несколько видов пиролиза пропилена: пиролиз в трубчатых печах, пиролиз в реакторе с кварцевым теплоносителем (процесс фирмы Phillips Petroleum Co.), пиролиз в реакторе с коксовым теплоносителем (процесс фирмы Farbewerke Hoechst), пиролиз в реакторе с песком в качестве теплоносителя (процесс фирмы Lurgi), пиролиз в трубчатой печи (процесс фирмы Kellogg), процесс Лавровского — Бродского, автотермический пиролиз по Бартоломе. В промышленности пропилен получают также дегидрированием алканов в присутствии катализатора (Сr2О3, Аl2О3). Промышленным способом получения пропилена наряду с крекингом служит дегидратация пропанола над оксидом алюминия. При выпуске с производства, при товарно-учетных операциях, при проверке его на соответствие нормативно-технической документации производится отбор проб пропилена по процедуре, описанной в ГОСТ 24975.0-89 "Этилен и пропилен. Методы отбора проб". Отбор пробы пропилена может производится и в газообразном и в сжиженном виде в специальные пробоотборники по ГОСТ 14921.
Применение
Для производства оксида пропилена, получения изопропилового спирта и ацетона, для синтеза альдегидов, для получения акриловой кислоты и акрилонитрила, полипропилена, пластмасс, каучуков, моющих средств, компонентов моторных топлив, растворителей.
Производство
Большая часть производственных мощностей по пропилену сосредоточена в Европе, Северной Америке и Азии. В настоящее время за год в мире производится более 50 миллионов тонн пропилена полимерного и химического сортов (PG/CG). Большая часть выпуска пропилена этих сортов приходится на долю установок пиролиза, где пропилен — побочный продукт производства этилена. Установками термического крекинга вырабатывается более 60 % такого пропилена. Нефтеперерабатывающими FCC-предприятиями выпускается 34 %. При дегидрогенизации или метатезисе пропана производится 3 % пропилена (в данном случае пропилен является целевым продуктом). Пропилен нефтехимической чистоты (RG) производится на нефтеперерабатывающих предприятиях мира в количестве, равном 31,2 миллионам тонн. Большая часть такого пропилена вырабатывается на FCC-предприятиях, где пропилен — побочный продукт производства бензина и дистиллятов. Половина этих пропиленовых мощностей интегрирована с нефтехимическими предприятиями, на которых происходит алкилирование пропилена или смешивание LPG и пропана.
formula-info.ru
Оглавление Физические свойства. 2 Химические свойства. 2 Получение пропилена. 4 Получение пропилена в лаборатории. 4 Получение пропилена в промышенности. 5 Применение: 6 Список литературы.. 9 Пропилен (пропен) Н3С—СН==СН2 относится к углеводородам ряда этилена (алкены или олефины). Алкены, или олефины (от лат. olefiant - масло — старое название, но широко используемое в химической литературе. Поводом к такому названию послужил хлористый этилен, полученный в XVIII столетии, — жидкое маслянист вещество.) — алифатические непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна двойная связь. Алкены содержат в своей молекуле меньшее число водородных атомов, чем соответствующие им алканы (с тем же числом углеродных атомов), поэтому такие углеводороды называют непредельными или ненасыщенными. Алкены образуют гомологический ряд с общей формулой Cnh3n. Непредельный (алкеновый) радикал называют тривиальным названием или по систематической номенклатуре: Н2С==CН—СН2 - аллил (пропенил-2) Пропилен служит сырьем для получения изопропилбензола, ацетона, фенола, полипропилена, глицерина, изопропилового спирта, синтетического каучука и других ценных органических продуктов. Физические свойства Пропилен представляет из себя газообразное вещество с низкой температурой кипения t кип=-47,7 °С и температурой плавления t пл= -187,6 °С, оптическая плотность d204 =0,5193. Химические свойства Пропен обладает значительной реакционной способностью. Его химические свойства определяются, главным образом, двойной углерод-углеродной связью. p-связь, как наименее прочная и более доступная, при действии реагента разрывается, а освободившиеся валентности углеродных атомов затрачиваются на присоединение атомов, из которых состоит молекула реагента.Все реакции присоединения протекают по двойной связи и состоят в расщеплении  -связи алкена и образовании на месте разрыва двух новых -связи алкена и образовании на месте разрыва двух новых  -связей. Чаще реакции присоединения идут по гетеролитическому типу, являясь реакциями электрофильного присоединения. Присоединение галогенов (галогенирование): -связей. Чаще реакции присоединения идут по гетеролитическому типу, являясь реакциями электрофильного присоединения. Присоединение галогенов (галогенирование):  Реакцию галогенирования обычно проводят в растворителе при обычной температуре. Галогены легко присоединяются по месту разрыва двойной связи с образованием дигалогенопроизводных. Легче идет присоединение хлора и брома, труднее — иода. Фтор взаимодействует со взрывом. Присоединение водорода (реакция гидрирования): Реакцию галогенирования обычно проводят в растворителе при обычной температуре. Галогены легко присоединяются по месту разрыва двойной связи с образованием дигалогенопроизводных. Легче идет присоединение хлора и брома, труднее — иода. Фтор взаимодействует со взрывом. Присоединение водорода (реакция гидрирования):  Присоединяя водород в присутствии катализаторов (Pt, Pd, Ni), пропен переходит в предельный углеводород — пропан. Присоединение воды (реакция гидратации): Присоединяя водород в присутствии катализаторов (Pt, Pd, Ni), пропен переходит в предельный углеводород — пропан. Присоединение воды (реакция гидратации):  Присоединение галогеноводородов (HHal) и воды происходит по правилу В.В.Марковникова (1869). Водород кислоты Hhal присоединяется к наиболее гидрированному атому углерода при двойной связи. Соответственно остаток Hal связывается с атомом С, при котором находится меньшее число атомов водорода. Присоединение галогеноводородов (HHal) и воды происходит по правилу В.В.Марковникова (1869). Водород кислоты Hhal присоединяется к наиболее гидрированному атому углерода при двойной связи. Соответственно остаток Hal связывается с атомом С, при котором находится меньшее число атомов водорода.  Горение на воздухе. При поджигании горит на воздухе: 2СН2=СНСН3 + 9О2 Горение на воздухе. При поджигании горит на воздухе: 2СН2=СНСН3 + 9О2 6СО2 + 6Н2О. С кислородом воздуха газообразные пропилен образует взрывчатые смеси. Пропилен окисляется перманганатом калия в водной среде, что сопровождается обесцвечиванием раствора KMnO4 и образованием гликолей (соединений с двумя гидроксильными группами при соседних атомах С). 6СО2 + 6Н2О. С кислородом воздуха газообразные пропилен образует взрывчатые смеси. Пропилен окисляется перманганатом калия в водной среде, что сопровождается обесцвечиванием раствора KMnO4 и образованием гликолей (соединений с двумя гидроксильными группами при соседних атомах С).  Окисление кислородом воздуха в пропиленоксид при нагревании в присутствии серебряных катализаторов: Окисление кислородом воздуха в пропиленоксид при нагревании в присутствии серебряных катализаторов:  Полимеризация– связывание множества молекул пропилена друг с другом. Условия реакции: нагревание, присутствие катализаторов. Соединение молекул происходит путем расщепления внутримолекулярных Полимеризация– связывание множества молекул пропилена друг с другом. Условия реакции: нагревание, присутствие катализаторов. Соединение молекул происходит путем расщепления внутримолекулярных  -cвязей и образования новых межмолекулярных -cвязей и образования новых межмолекулярных  -cвязей: -cвязей:  Получение пропилена Получение пропилена в лаборатории Из лабораторных способов получения пропилена можно отметить следующие: 1. Отщепление галогеноводорода от галогеналкилов при действии на них спиртового раствора щелочи: h3C—Ch3 – Ch4 = h3C==Ch3– Ch4 + KCl + h3O | | 2. Гидрирование пропина в присутствии катализатора (Pd): H—C≡C— Ch4 + h3 = h3C==CH— Ch4 3. Дегидратация пропилового спирта (отщепление воды). В качестве катализатора используют кислоты (серную или фосфорную) или А12O3: Н2С—СН2 — Ch4 = Н2С==СН — Ch4 + Н2О | | 4. Отщепление двух атомов галогена от дигалогеноалканов, содержащих галогены при соседних атомах С. Реакция протекает под действием металлов (Zn и др.): Получение пропилена Получение пропилена в лаборатории Из лабораторных способов получения пропилена можно отметить следующие: 1. Отщепление галогеноводорода от галогеналкилов при действии на них спиртового раствора щелочи: h3C—Ch3 – Ch4 = h3C==Ch3– Ch4 + KCl + h3O | | 2. Гидрирование пропина в присутствии катализатора (Pd): H—C≡C— Ch4 + h3 = h3C==CH— Ch4 3. Дегидратация пропилового спирта (отщепление воды). В качестве катализатора используют кислоты (серную или фосфорную) или А12O3: Н2С—СН2 — Ch4 = Н2С==СН — Ch4 + Н2О | | 4. Отщепление двух атомов галогена от дигалогеноалканов, содержащих галогены при соседних атомах С. Реакция протекает под действием металлов (Zn и др.):  Получение пропилена в промышенности В природе алкены встречаются редко. Обычно пропилен выделяют из газов нефтепереработки (при крекинге сырой нефти в кипящем слое (процесс фирмы BASF), пиролизе бензиновых фракций) или попутных газов, а также из газов коксования угля. Существует несколько видов пиролиза пропилена: пиролиз в трубчатых печах, пиролиз в реакторе с кварцевым теплоносителем (процесс фирмы Phillips Petroleum Co.), пиролиз в реакторе с коксовым теплоносителем (процесс фирмы Farbewerke Hoechst), пиролиз в реакторе с песком в качестве теплоносителя (процесс фирмы Lurgi), пиролиз в трубчатой печи (процесс фирмы Kellogg), процесс Лавровского — Бродского, автотермический пиролиз по Бартоломе. В промышленности пропилен получают также дегидрированием алканов в присутствии катализатора (Сr2 О3, Аl2О3). Промышленным способом получения пропилена наряду с крекингом служит дегидратация пропанола над оксидом алюминия: Получение пропилена в промышенности В природе алкены встречаются редко. Обычно пропилен выделяют из газов нефтепереработки (при крекинге сырой нефти в кипящем слое (процесс фирмы BASF), пиролизе бензиновых фракций) или попутных газов, а также из газов коксования угля. Существует несколько видов пиролиза пропилена: пиролиз в трубчатых печах, пиролиз в реакторе с кварцевым теплоносителем (процесс фирмы Phillips Petroleum Co.), пиролиз в реакторе с коксовым теплоносителем (процесс фирмы Farbewerke Hoechst), пиролиз в реакторе с песком в качестве теплоносителя (процесс фирмы Lurgi), пиролиз в трубчатой печи (процесс фирмы Kellogg), процесс Лавровского — Бродского, автотермический пиролиз по Бартоломе. В промышленности пропилен получают также дегидрированием алканов в присутствии катализатора (Сr2 О3, Аl2О3). Промышленным способом получения пропилена наряду с крекингом служит дегидратация пропанола над оксидом алюминия:  Применение Пропилен находит свое применение в промышленном синтезе. Полипропилен. Производство полипропилена в промышленности началось в 1954 году благодаря работам Натты, который использовал для полимеризации пропилена каталитическую систему Циглера. Натта впервые получил стереорегулярный полимер, названный им изотактическим; в нем все метильные группы расположены по одну сторону цепи, что способствует благоприятной "упаковке" полимерных молекул и определяет хорошие механические свойства полипропилена: Применение Пропилен находит свое применение в промышленном синтезе. Полипропилен. Производство полипропилена в промышленности началось в 1954 году благодаря работам Натты, который использовал для полимеризации пропилена каталитическую систему Циглера. Натта впервые получил стереорегулярный полимер, названный им изотактическим; в нем все метильные группы расположены по одну сторону цепи, что способствует благоприятной "упаковке" полимерных молекул и определяет хорошие механические свойства полипропилена:  Полипропилен находит аналогичное полиэтилену применение — как пластик, для производства волокна и др. Оксид пропилена. Около 10% нефтехимического пропилена расходуется на производство оксида пропилена. До 1968 года оксид пропилена производился только хлоргидринным методом (промежуточно образовывался пропиленхлоргидрин ): Полипропилен находит аналогичное полиэтилену применение — как пластик, для производства волокна и др. Оксид пропилена. Около 10% нефтехимического пропилена расходуется на производство оксида пропилена. До 1968 года оксид пропилена производился только хлоргидринным методом (промежуточно образовывался пропиленхлоргидрин ):  Этот метод имеет недостатки, связанные с использованием дорогостоящих хлора и гидроксида кальция. Начиная с 1968 года появился альтернативный вариант, так называемый халкон-процесс, основанный на взаимодействии пропилена с гидропероксидами (например., третичным бутилпероксидом ): Этот метод имеет недостатки, связанные с использованием дорогостоящих хлора и гидроксида кальция. Начиная с 1968 года появился альтернативный вариант, так называемый халкон-процесс, основанный на взаимодействии пропилена с гидропероксидами (например., третичным бутилпероксидом ):  Вполне вероятно, что этот метод со временем полностью заменит хлоргидринный процесс. Оксид пропилена используется для синтеза пропиленгликоля, из которого далее получают взаимодействием с многоатомными спиртами (например, глицерином) пенополиуретаны, находящие применение в качестве амортизирующих материалов (коврики, мебель, упаковка), теплоизоляторов в строительстве, фильтрующих и сорбирующих жидкости материалов. Изопропиловый спирт и ацетон. Важнейшее применение пропилена связано с синтезом изопропилового спирта и ацетона. Как уже упоминалось, изопропиловый спирт, который используется как ценный растворитель, можно считать первым продуктом нефтехимии. Интересно, что большие количества его все еще получают, как в 1920 году, сернокислотным процессом: Вполне вероятно, что этот метод со временем полностью заменит хлоргидринный процесс. Оксид пропилена используется для синтеза пропиленгликоля, из которого далее получают взаимодействием с многоатомными спиртами (например, глицерином) пенополиуретаны, находящие применение в качестве амортизирующих материалов (коврики, мебель, упаковка), теплоизоляторов в строительстве, фильтрующих и сорбирующих жидкости материалов. Изопропиловый спирт и ацетон. Важнейшее применение пропилена связано с синтезом изопропилового спирта и ацетона. Как уже упоминалось, изопропиловый спирт, который используется как ценный растворитель, можно считать первым продуктом нефтехимии. Интересно, что большие количества его все еще получают, как в 1920 году, сернокислотным процессом:  Изопропиловый спирт также получают прямой гидратацией пропилена в присутствии кислых катализаторов: Изопропиловый спирт также получают прямой гидратацией пропилена в присутствии кислых катализаторов:  Почти 50% производимого изопропилового спирта расходуется на получение ацетона дегидрированием на медно-цинковом катализаторе или оксиде цинка при 380°С: Почти 50% производимого изопропилового спирта расходуется на получение ацетона дегидрированием на медно-цинковом катализаторе или оксиде цинка при 380°С:  Гидроформилирование. Особо хотелось обратить внимание на использование пропилена для синтеза альдегидов с помощью замечательной реакции гидроформилирования, или оксосинтеза, которая была открыта в 1938 году и стала одной из важнейших в нефтехимии. При взаимодействии пропилена (и других алкенов) с монооксидом углерода и водорода (такая смесь называется синтез-газом) в присутствии карбонилов кобальта Со2(СО)8 при температуре 150— 180°Си давлении 200 —250 атм образуются два альдегида — нормального и изостроения: Гидроформилирование. Особо хотелось обратить внимание на использование пропилена для синтеза альдегидов с помощью замечательной реакции гидроформилирования, или оксосинтеза, которая была открыта в 1938 году и стала одной из важнейших в нефтехимии. При взаимодействии пропилена (и других алкенов) с монооксидом углерода и водорода (такая смесь называется синтез-газом) в присутствии карбонилов кобальта Со2(СО)8 при температуре 150— 180°Си давлении 200 —250 атм образуются два альдегида — нормального и изостроения:  С момента открытия эта реакция являлась предметом интенсивных исследований ученых: необходимо было смягчить условия реакции, по возможности уменьшить долю менее ценных разветвленных альдегидов и избежать возможной реакции гидрирования двойной связи. Были разработаны более экономичные процессы, например, с использованием родиевых катализаторов, стабилизированных трифенилфосфином . В последнем случае удалось снизить температуру до 100°С, давление —до 20 атм и повысить выходы альдегидов нормального строения. Акриловая кислота и акрилонитрил. Теперь перейдем к продуктам, получаемым в результате реакций метильной группы пропилена. В этом ряду основное место без сомнения занимают процессы получения акриловой кислоты С момента открытия эта реакция являлась предметом интенсивных исследований ученых: необходимо было смягчить условия реакции, по возможности уменьшить долю менее ценных разветвленных альдегидов и избежать возможной реакции гидрирования двойной связи. Были разработаны более экономичные процессы, например, с использованием родиевых катализаторов, стабилизированных трифенилфосфином . В последнем случае удалось снизить температуру до 100°С, давление —до 20 атм и повысить выходы альдегидов нормального строения. Акриловая кислота и акрилонитрил. Теперь перейдем к продуктам, получаемым в результате реакций метильной группы пропилена. В этом ряду основное место без сомнения занимают процессы получения акриловой кислоты  и акрилонитрила и акрилонитрила  В 50-е годы эфиры акриловой кислоты стали широко использовать в промышленности в качестве ценных сополимеров. В 50-е годы эфиры акриловой кислоты стали широко использовать в промышленности в качестве ценных сополимеров.  Примерно 15% нефтехимического пропилена используется в качестве исходного продукта для производства акрилонитрила, из которого получают ценное волокно (нитрон), пластические массы (сополимер со стиролом), синтетические каучуки (сополимер с бутадиеном). Но в конце 50-х годов был разработан гораздо более дешевый способ — окислительный аммонолиз пропилена. Суть реакции заключается в окислении пропилена в присутствии аммиака: Примерно 15% нефтехимического пропилена используется в качестве исходного продукта для производства акрилонитрила, из которого получают ценное волокно (нитрон), пластические массы (сополимер со стиролом), синтетические каучуки (сополимер с бутадиеном). Но в конце 50-х годов был разработан гораздо более дешевый способ — окислительный аммонолиз пропилена. Суть реакции заключается в окислении пропилена в присутствии аммиака:  Список литературы 1 А.И. Артеменко, Органическая химия, М.:Высшая школа – 1998, 535 с. 2 Б.Д. Степин, А.А.Цветков, Органическая химия, М.:Высшая школа – 1994, 605 с. 3 http://chem..edu.ru Список литературы 1 А.И. Артеменко, Органическая химия, М.:Высшая школа – 1998, 535 с. 2 Б.Д. Степин, А.А.Цветков, Органическая химия, М.:Высшая школа – 1994, 605 с. 3 http://chem..edu.ru |
Реферат Пропен
скачатьРеферат на тему:
План:
- Введение
- 1 Физические свойства
- 2 Химические свойства
- 2.1 Присоединение галогенов (галогенирование)
- 2.2 Присоединение водорода (реакция гидрирования)
- 2.3 Присоединение воды (реакция гидратации)
- 2.4 Присоединение галогеноводородов (HHal)
- 2.5 Горение на воздухе
- 2.6 Полимеризация
- 2.7 Окисление кислородом воздуха в пропиленоксид
- 3 Получение
- 3.1 В лаборатории
- 3.2 В промышленности
- 4 Применение
- 5 Производство ИсточникиПримечания
Введение
Пропиле́н (пропен) СН2=СН-СН3 — непредельный (ненасыщенный) углеводород ряда этилена, горючий газ. Наркотик с наркотическим действием более сильным, чем у этилена. Класс опасности - четвертый.[1].
1. Физические свойства
Пропилен представляет из себя газообразное вещество с низкой температурой кипения tкип= -47,7 °C и температурой плавления tпл= −187,6 °C, оптическая плотность d204=0,5193.
2. Химические свойства
Обладает значительной реакционной способностью. Его химические свойства определяются двойной углерод-углеродной связью. p-связь, как наименее прочная и более доступная, при действии реагента разрывается, а освободившиеся валентности углеродных атомов затрачиваются на присоединение атомов, из которых состоит молекула реагента. Все реакции присоединения протекают по двойной связи и состоят в расщеплении π-связи алкена и образовании на месте разрыва двух новых σ-связей.
Чаще реакции присоединения идут по гетеролитическому типу, являясь реакциями электрофильного присоединения.
2.1. Присоединение галогенов (галогенирование)
Реакцию галогенирования обычно проводят в растворителе при обычной температуре. Галогены легко присоединяются по месту разрыва двойной связи с образованием дигалогенопроизводных. Легче идет присоединение хлора и брома, труднее — йода. Фтор взаимодействует со взрывом.
2.2. Присоединение водорода (реакция гидрирования)
Присоединяя водород в присутствии катализаторов (Pt, Pd, Ni), пропен переходит в предельный углеводород — пропан.
2.3. Присоединение воды (реакция гидратации)
Пропилен реагирует с водой с образованием одноатомного спирта изопропанола, при этом двойная связь раскрывается.
2.4. Присоединение галогеноводородов (HHal)
Происходит по правилу Марковникова. Водород кислоты HHal присоединяется к наиболее гидрированному атому углерода при двойной связи. Соответственно остаток Hal связывается с атомом углерода, при котором находится меньшее число атомов водорода.
Пример гидрогалогенирования — получение бромпроизводного пропана при реакции бромоводорода и пропилена.
2.5. Горение на воздухе
При поджигании горит на воздухе: 2СН2=СНСН3 + 9О2 → 6СО2 + 6Н2О.
С кислородом воздуха газообразный пропилен образует взрывчатые смеси.
В слабощелочной или нейтральной водной среде пропилен окисляется перманганатом калия, что сопровождается обесцвечиванием раствора KMnO4 и образованием гликолей (соединений с двумя гидроксильными группами при соседних атомах углерода). Эта реакция получила название реакции Вагнера.
2.6. Полимеризация
Условия реакции: нагревание, присутствие катализаторов. Соединение молекул происходит путем расщепления внутримолекулярных π-cвязей и образования новых межмолекулярных σ-cвязей.
2.7. Окисление кислородом воздуха в пропиленоксид
При нагревании в присутствии серебряных катализаторов:
3. Получение
3.1. В лаборатории
1. Отщепление галогеноводорода от галогеналкилов при действии на них спиртового раствора щелочи:
h3C—CH – Ch4 → h3C=CH–Ch4 + KCl + h3O | | Cl H K — ОH2. Гидрирование пропина в присутствии катализатора (Pd):
H—C≡C—Ch4 + h3 → h3C=CH—Ch4
3. Дегидратация изопропилового спирта (отщепление воды). В качестве катализатора используют кислоты (серную или фосфорную) или Аl2O3:
Н2С—СН2 — Ch4 → Н2С=СН — Ch4 + Н2О | | H -OH4. Отщепление двух атомов галогена от дигалогеноалканов, содержащих галогены при соседних атомах С. Реакция протекает под действием металлов (Zn и др.):
h3C-CH-Ch4+Zn → h3C=CH-Ch4+ZnBr2| | Br Br3.2. В промышленности
Обычно пропилен выделяют из газов нефтепереработки (при крекинге сырой нефти в кипящем слое (процесс фирмы BASF), пиролизе бензиновых фракций) или попутных газов, а также из газов коксования угля. Существует несколько видов пиролиза пропилена: пиролиз в трубчатых печах, пиролиз в реакторе с кварцевым теплоносителем (процесс фирмы Phillips Petroleum Co.), пиролиз в реакторе с коксовым теплоносителем (процесс фирмы Farbewerke Hoechst), пиролиз в реакторе с песком в качестве теплоносителя (процесс фирмы Lurgi), пиролиз в трубчатой печи (процесс фирмы Kellogg), процесс Лавровского — Бродского, автотермический пиролиз по Бартоломе. В промышленности пропилен получают также дегидрированием алканов в присутствии катализатора (Сr2О3, Аl2О3).
Промышленным способом получения пропилена наряду с крекингом служит дегидратация пропанола над оксидом алюминия:
4. Применение
Для производства оксида пропилена, получения изопропилового спирта и ацетона, для синтеза альдегидов, для получения акриловой кислоты и акрилонитрила, полипропилена, пластмасс, каучуков, моющих средств, компонентов моторных топлив, растворителей.
5. Производство
Большая часть производственных мощностей по пропилену сосредоточена в Европе, Северной Америке и Азии. В настоящее время за год в мире производится более 50 миллионов тонн пропилена полимерного и химического сортов (PG/CG). Большая часть выпуска пропилена этих сортов приходится на долю установок пиролиза, где пропилен — побочный продукт производства этилена. Установками термического крекинга вырабатывается более 60 % такого пропилена. Нефтеперерабатывающими FCC-предприятиями выпускается 34 %. При дегидрогенизации или метатезисе пропана производится 3 % пропилена (в данном случае пропилен является целевым продуктом).
Пропилен нефтехимической чистоты (RG) производится на нефтеперерабатывающих предприятиях мира в количестве, равном 31,2 миллионам тонн. Большая часть такого пропилена вырабатывается на FCC-предприятиях, где пропилен — побочный продукт производства бензина и дистиллятов. Половина этих пропиленовых мощностей интегрирована с нефтехимическими предприятиями, на которых происходит алкилирование пропилена или смешивание LPG и пропана.
Источники
- http://www.ssa.ru
- http://chem.edu.ru
- А. И. Артеменко, Органическая химия, М.:Высшая школа — 1998
- Б. Д. Степин, А. А. Цветков, Органическая химия, М.:Высшая школа — 1994
Примечания
- Газохроматографическое измерение массовых концентраций углеводородов: метана, этана, этилена, пропана, пропилена, нбутана, альфа-бутилена, изопентана в воздухе рабочей зоны. Методические указания. МУК 4.1.1306-03 (УТВ. ГЛАВНЫМ ГОСУДАРСТВЕННЫМ САНИТАРНЫМ ВРАЧОМ РФ 30.03.2003) - www.bestpravo.ru/fed2003/data07/tex22892.htm
wreferat.baza-referat.ru



















