Большая Энциклопедия Нефти и Газа. Этил вода
Этиловый спирт. Спирт этиловый медицинский
Этиловый спирт можно узнать по запаху. Впрочем, отличить его таким образом можно лишь от весьма далеких по структуре веществ. Что же касается соединений одной с ним группы, все сложнее. Но это и интереснее.
Состав и формула
Этанол - а именно так звучит одно из его официальных названий - относится к простым спиртам. Он знаком практически всем под теми или иными наименованиями. Часто его называют просто спиртом, иногда прибавляют прилагательные "этиловый" или "винный", химики могут также назвать его метилкарбинолом. Но суть одна - С2Н5ОН. Эта формула знакома, пожалуй, практически всем еще со школьных времен. И очень многие помнят, насколько это вещество подобно своему ближайшему родственнику - метанолу. Проблема лишь в том, что последний крайне токсичен. Но об этом позже, сначала стоит рассмотреть подробнее этанол.
Кстати, в химии есть много похожих терминов, так что не стоит путать этиловый спирт, например, с этиленом. Последний является бесцветным горючим газом и совсем не похож на прозрачную жидкость с характерным запахом. А еще есть газ этан, и его название тоже созвучно с наименованием "этанол". Но это тоже совсем разные вещества.
Метиловый и этиловый
Уже долгие годы остается актуальной проблема массовых отравлений в связи с невозжностью отличить в домашних условиях два спирта. Контрафактный алкоголь, подпольное или просто некачественное производство - все это повышает риск плохой очистки и пренебрежения технологическими условиями.

Все это усложняется тем, что по своим основным свойствам метиловый и этиловый спирты - практически идентичные вещества, и неспециалист без нужного оборудования просто не сможет отличить один от другого. При этом смертельная доза метанола - 30 граммов, тогда как в случае с обычным спиртом такой объем совершенно безопасен для взрослого человека. Именно поэтому, если нет уверенности в происхождении напитка, лучше его не употреблять.
Что любопытно, антидотом для технического спирта является как раз чистый метанол. Так что, заметив признаки острого отравления, необходимо ввести раствор последнего внутривенно или принять перорально. Важно при этом не перепутать состояние интоксикации метанолом с обычным сильным алкогольным опьянением или отравлением. В этом случае, а также при отравлении некоторыми другими веществами ни в коем случае нельзя принимать дополнительно спирт этиловый. Цена ошибки может быть очень высокой.
Физические и химические свойства
Этанолу присущи все общие характеристики и реакции спиртов. Он бесцветный, обладает характерными вкусом и запахом. В нормальных условиях он жидкий, переходит в твердую форму при температуре -114 оС, а кипит при +78 градусах. Плотность спирта этилового составляет 0,79. Хорошо смешивается с водой, глицерином, бензолом и многими другими веществами. Легко улетучивается, так что хранить его нужно в хорошо закрывающихся емкостях. Сам является прекрасным растворителем, а также обладает отличными антисептическими свойствами. Очень огнеопасен как в жидком, так и в парообразном состоянии.
Этанол является психоактивным и наркотическим веществом, входит в состав всех спиртных напитков. Смертельной дозой для взрослого человека является 300-400 миллилитров 96 % раствора спирта, употребленного в течение часа. Эта цифра довольно условна, поскольку зависит от большого количества факторов. Для детей достаточно уже 6-30 миллилитров. Так что этанол является и достаточно эффективным ядом. Тем не менее, он широко используется, поскольку обладает рядом уникальных свойств, делающих его универсальным.
Разновидности
Существует несколько видов этилового спирта, используемых для разных целей. В основном они отражают способы получения вещества, но часто говорят и о различных методах обработки.
Так, надпись на упаковке "Спирт этиловый ректификованный" говорит о том, что содержимое прошло специальную очистку от примесей. Полностью очистить, например, от воды его довольно сложно, но можно максимально уменьшить ее присутствие.
Еще спирт может быть денатурированным. В этом случае все наоборот: к этанолу добавляют трудноустранимые примеси, делающие его непригодным для употребления внутрь, но не усложняющие применение по основному назначению. Как правило, в роли денатурата выступает керосин, ацетон, метанол и т. д.
Кроме того, различают спирт этиловый медицинский, технический, пищевой. Для каждой из этих разновидностей существует строгий стандарт, предусматривающий определенные критерии. Но о них поговорим чуть позже.
Кроме всего прочего, на упаковке часто указывается процент содержания. Это актуально, опять же, в связи с тем, что этанол сложно полностью очистить от воды, да и обычно в этом нет серьезной необходимости.

Получение
Производство этилового спирта предусматривает использование одного из трех основных способов: микробиологического, синтетического или гидролизного. В первом случае имеем дело с процессом брожения, во втором, как правило, задействуются химические реакции с применением ацетилена или этилена, ну а третий говорит сам за себя. Каждый из способов имеет свои плюсы и минусы, сложности и преимущества.
Для начала расмотрим этиловый спирт, который производится только для пищевых целей. Для его производства используется только метод брожения. В ходе этого процесса виноградный сахар распадается на этанол и двуокись углерода. Этот метод известен с глубокой древности и является наиболее естественным. Но он требует и большего количества времени. Кроме того, полученное вещество не является чистым спиртом и требует достаточного большого количества операций по обработке и очистке.
Для получения технического этанола брожение нецелесообразно, так что производители прибегают к одному из двух вариантов. Первый из них - сернокислая гидратация этилена. Она выполняется в несколько этапов, но есть и более простой метод. Второй вариант - прямая гидратация этилена в присутствии фосфорной кислоты. Эта реакция обратима. Впрочем, оба этих способа также несовершенны, и полученное вещество требует дальнейшей обработки.

Гидролиз - относительно новый метод, позволяющий получать этиловый спирт из древесины. Для этого сырье измельчается и обрабатывается 2-5 % серной кислотой при температуре 100-170 градусов по Цельсию. Этот метод позволяет получать до 200 литров этанола из 1 тонны древесины. По разным причинам гидролизный способ не слишком популярен в Европе, в отличие от США, где открывают все новые и новые заводы, работающие по этому принципу.
Стандарты
Весь этанол, который производится на предприятиях, должен соответствовать определенным стандартам. Для каждого способа получения и обработки есть свой, в котором указываются основные характеристики, которыми должен обладать конечный продукт. Рассматривается очень много свойств, например, содержание примесей, плотность спирта этилового, предназначение. Для каждой разновидности есть свой стандарт.
Так, например, синтетический технический спирт этиловый - ГОСТ Р 51999-2002 - делится на два сорта: первый и высший. Очевидное различие между ними - объемная доля этанола, которая составляет 96 % и 96,2 % соответственно. В стандарте под этим номером указывается как ректификованный, так и денатурированный этиловый спирт, предназначенный для использования в парфюмерной промышленности.

Для более прозаичной цели - применения в качестве растворителя - существует свой ГОСТ: Р 52574-2006. Здесь речь идет только о денатурате с разной объемной долей этанола - 92,5 % и 99 %.
Что же касается такого вида, как пищевой этиловый спирт, то для него действует ГОСТ Р 51652-2000, и у него есть целых 6 сортов: первый (96 %), высшей очистки (96,2 %), "Базис" (96 %), "Экстра" (96,3 %), "Люкс" (96,3 %) и "Альфа" (96,3 %). Здесь уже речь идет в первую очередь о сырье и некоторых других сложных показателях. Например, продукт марки "Альфа" вырабатывается только из пшеницы, ржи или их смеси.
До сих пор многие проводят, так сказать, параллели между двумя понятиями: спирт этиловый - ГОСТ 18300-87, который был принят еще в СССР. Этот стандарт давно утратил силу, что, однако, не мешает строить производство в соответствии с ним до сих пор.
Использование
Пожалуй, затруднительно найти вещество, которое имеет столь же широкое применение. Этиловый спирт так или иначе используется в очень многих отраслях производства.
Прежде всего, это пищевая промышленность. Самые разные алкогольные напитки - от вин и ликеров до виски, водки и коньяка - соджержат в своем составе упомянутый спирт. Но сам по себе в чистом виде этанол не используется. Технология предусматривает закладку сырья, например, виноградного сока и инициацию процесса брожения, а на выходе получается уже готовый продукт.
Еще одна область широкого применения - это медицина. Этиловый спирт 95 % в данном случае используется чаще всего, ведь он обладает прекрасными антисептическими свойствами, а также растворяет многие вещества, что позволяет с его помощью делать эффективные настойки, микстуры и прочие препараты. Кроме того, при разных видах наружного применения он способен как эффективно согревать, так и охлаждать организм. Нанеся его на кожу, можно быстро сбить высокую температуру тела на градус-полтора. И наоборот, энергичные растирания помогут согреться. Кроме того, при хранении анатомических препаратов также используется спирт этиловый медицинский.
Разумеется, еще одна область применения - это техника, химия и все, что с этим связано. Речь идет о лакокрасочных покрытиях, растворителях, очистителях и пр. Кроме того, этанол используется в промышленном производстве многих веществ или является сырьем для них (диэтиловый эфир, тетраэтилсвинен, уксусная кислота, хлороформ, этилен, каучук и многие другие). Спирт этиловый технический, естественно, совершенно непригоден в пищу, даже если он очищен.
Разумеется, во всех этих случаях речь идет о совершенно разные разновидности, каждая из которых имеет свои особенности. Так, пищевой спирт этиловый ректификованный вряд ли будут использовать для технических целей, тем более, что он облагается акцизом, а значит, его стоимость гораздо выше по сравнению с неочищенным. Впрочем, о ценообразовании речь пойдет отдельно.

Применение в новых технологиях
Все чаще в последние годы говорят об использовании этанола в качестве топлива. Этот подход имеет своих противников и сторонников, особенно часто речь об этом заходит в США. Дело в том, что американские фермеры традиционно выращивают много кукурузы, которая теоретически может служить прекрасным сырьем для того, чтобы получить спирт этиловый. Цена такого топлива однозначно будет ниже стоимости бензина. Этот вариант снимает вопрос зависимости многих стран от поставок нефти и цен на энергоносители, ведь производство спирта может располагаться где угодно. Кроме того, это безопаснее с точки зрения экологии. Впрочем, уже сейчас можно заметить использование этанола в этом качестве, но в гораздо меньших масштабах. Это спиртовки - специальные химические нагреватели, домашние мини-камины, а также многие другие приборы.
Это может быть действительно перспективным направлением работы в поисках альтернативных, возобновляемых и достаточно дешевых источников энергии. Проблема для России здесь состоит в менталитете. Достаточно сказать, что спиртовые фонари в Москве продержались недолго - работники, которые занимались их работой, просто выпивали сырье. И даже если топливо будет содержать различные примеси, совсем избежать отравлений вряд ли удастся. Впрочем, для РФ есть и другие поводы не стремиться к таким изменениям, поскольку переход на такой вид энергии грозит для страны серьезным снижением объема экспорта энергоносителей.
Действие на человеческий организм
В классификации СанПин этанол относится к 4 классу, то есть малоопасным веществам. Сюда же, кстати, относятся керосин, аммиак, метан и некоторые другие элементы. Но это не значит, что не стоит относиться к алкоголю несерьезно.
Этиловый спирт при употреблении внутрьсерьезно влияет на центральную нервную систему всех животных. Он вызывает состояние, называемое алкогольным опьянением, характеризующееся неадекватным поведением, заторможенностью реакций, снижением восприимчивости к различного рода раздражителям и т. д. При этом все сосуды расширяются, увеличивается теплоотдача, учащается сердцебиение и дыхание. В состоянии небольшого опьянения ясно видно характерное возбуждение, при повышении дозы сменяющееся угнетением центральной нервной системы. Как правило, после этого появляется сонливость.

В более высоких дозах может наступить алкогольная интоксикация, серьезно отличающая от картины, описанной ранее. Дело в том, что этанол является наркотическим веществом, но не используется в этом качестве, поскольку для эффективного усыпления нужны дозы, крайне близкие к тем, при которым наступает паралич жизненно важных центров. Состояние алкогольной интоксикации - как раз та грань, когда без оказания экстренной помощи человек может умереть, поэтому так важно отличать это от опьянения. При этом наблюдается что-то вроде комы, дыхание редкое и пахнет спиртом, пульс учащенный, кожа бледная и влажная, температура тела понижена. Необходимо немедленно обратиться за медицинской помощью, а также попробовать промыть желудок.
Регулярное употребление этанола может вызвать пагубное пристрастие - алкоголизм. Оно характеризуется изменением и деградацией личности, также страдают различные системы органов, прежде всего это касается печени. Существует даже характерное для алкоголиков "со стажем" заболевание - цирроз. В некоторых случаях оно даже приводит к необходимости пересадки.
Что касается наружного применения, этиловый спирт раздражает кожу, одновременно являясь эффективным антисептиком. Он также уплотняет эпидермис, поэтому его используют для обработки пролежней и других повреждений.
Реализация и ее особенности
Стандарты - это не единственное, с чем имеют дело те, кто производят спирт этиловый. Цена на разные сорта, марки и разновидности очень разнится. И это неспроста, ведь то, что предназначего для употребления в пищу - подакцизный товар. Обложение этим дополнительным налогом делает стоимость соответствующего ректификата заметно выше. Это позволяет в известной степени контролировать оборот спирта этилового в продаже, а также стоимость алкогольной продукции.
Кстати, это еще и вещество, подлежащее строгому учету. Поскольку этанол используется при производстве лекарств, медицинских манипуляциях и т. д., он в той или иной форме хранится в аптеках, больницах, поликлиниках и прочих учреждениях. Впрочем, это не означает, что устроившись на работу по соответствующей специальности, можно легко и незаметно получить в пользование хоть какое-то количество вещества. Учет этилового спирта производится с помощью специального журнала, а нарушение процедур является административным правонарушением и наказывается штрафом. Что пропажу заметят в самые короткие сроки.
www.syl.ru
Синтезы органических соединений
Галогенирование
Реакция галогенирования. Получение галогенопроизводных прямым галогенированием. Галогенирование алканов, циклоалканов и гомологов бензола в боковую цепь. Условия и механизм цепных радикальных реакций.
Галогенирование непредельных углеводородов. Условия, способствующие протеканию ионных реакций. Механизм электрофильного присоединения галогенов, галогенводородов по кратной связи и системе сопряженных связей. Перекисный эффект. Радикальный механизм присоединения по кратной связи.
Галогенирование ароматических углеводородов (бензола, нафталина). Условия и механизм галогенирования как реакции электрофильного замещения. Применяемые катализаторы и их роль.
Непрямое галогенирование. Нуклеофильное замещение гидрокси-группы на галоген. Применяемые реагенты. Моно- и бимолекулярное нуклеофильное замещение (SN1 и SN2-механизмы реакций) у насыщенного углеродного атома, скорость реакции для первичных, вторичных и третичных спиртов.
Замещение диазогруппы на галоген. Применяемые реагенты и условия проведения реакций.
Замещение кислорода карбонильной группы на галоген. Применяемые реагенты.
Особенности получения иод- и фторпроизводных алифатических и ароматических углеводородов.
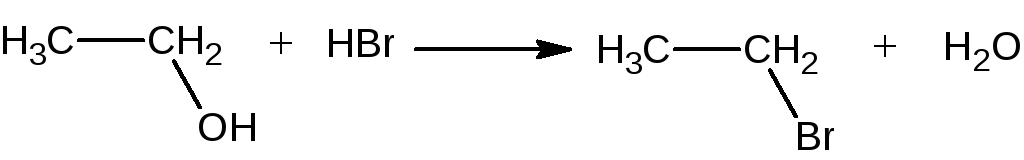
Синтез бромистого этила
Уравнения основных реакций:
Kbr + h3SO4 ——Hbr + KHSO4
Побочные реакции:
а) дегидратация спирта до простого эфира:
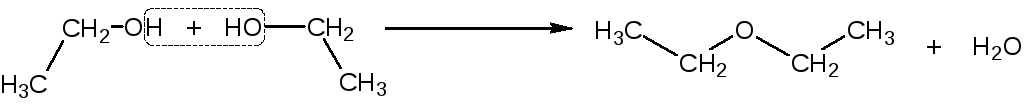
б) окисление спирта серной кислотой:
Ch4Ch3OH + 6 h3SO4 2 CO2 + 6 SO2 + 9 h3O
в) окисление бромистого водорода серной кислотой:
2 hbr + h3SO4 Br2 + SO2 + h3O
Реактивы
Основные
| Этиловый спирт | 29 см 3 |
| Бромистый калий | 30 г |
| Серная кислота ( | 32 см 3 |
Вспомогательные.
| Кальций хлорид безводный | |
| Дистиллированная вода | 20 см 3 |
Посуда и приборы
| Колбы круглодонные перегонные (100 и 300 см 3) | 2 шт. |
| Колбы конические приемные (50 или100 см 3) | 3 шт. |
| Холодильник Либиха | 1 шт. |
| Насадка Вюрца | 1 шт. |
| Дефлегматор | 1 шт. |
| Аллонж | 1 шт. |
| Воронка делительная | 1 шт. |
| Термометр (100-150С) | 1 шт. |
| Нагреватель (электроплитка с закрытой спиралью) | 1 шт. |
| Ванна со льдом | 1 шт. |
Выполнение синтеза
В реакционной колбе емкостью 300 см3смешивают 29 см3этилового спирта с 20 см3холодной воды, добавленной для уменьшения образования побочного продукта (диэтиловый эфир), сокращения потерь бромоводородной кислоты, которая обладает большей летучестью, и для частичного разбавления серной кислоты, чтобы избежать окислительно-восстановительной реакции образования брома. Для более полного использования образующейся бромоводородной кислоты спирт берут в избытке.
При постоянном перемешивании реакционной смеси и охлаждении колбы проточной водойк смеси осторожно добавляют 32 см3серной кислоты, а затем 30 г тонко растертого бромистого калия. Колбу соединяют с дефлегматором и длинным, хорошо действующим водяным холодильником, к которому присоединен аллонж (Приложение В, рис.1).
Реакционную смесь нагревают на песочной бане до тех пор, пока в приемник 6 не перестанут поступать не растворяющиеся в воде маслянистые капли, опускающиеся на дно. Если реакционная смесь в колбе начинает сильно пениться, то на короткое время прерывают нагревание. Перегонку ведут с такой скоростью, чтобы в приемник непрерывно поступали маслянистые капли бромистого этила, а жидкость из приемника не поднималась бы в холодильник.
Так как бромистый этил чрезвычайно летуч, то, для уменьшения потерь вследствие испарения, его собирают в ледяную воду. В приемник 6 наливают немного воды с несколькими кусочками льда и погружают в нее конец аллонжа. Иногда при перегонке налитая в приемник вода втягивается обратно в аллонж. В этом случае приемник опускают ниже, чтобы освободить конец аллонжа. Когда вода стечет, аллонж устанавливают в первоначальное положение.
После окончания реакции переливают содержимое приемника в делительную воронку, отделяют тяжелый (нижний) слой бромистого этила в коническую колбу емкостью 100 см3.
Для осушки бромистого этила (удаления воды) в колбу добавляют несколько кусочков прокаленного хлористого кальция и колбу закрывают пробкой. Через 30-40 мин. бромистый этил становится прозрачным и его перегоняют.
Неочищенный бромистый этил окрашен в желтый цвет. Это свидетельствует о наличии в нем примеси растворенного брома. Для очистки бромистый этил перегоняют в интервале температур 36-40С. Перегонку ведут на электроплитке из перегонной колбы емкостью 100 см3, в которую предварительно вносят «кипелки». Колбу снабжают термометром и водяным холодильником с аллонжем, который опускают в сухой приемник, охлажденный снаружи льдом (Приложение В, рис. 2).
Выход бромистого этила 22 г.
Аналогично можно получить бромистый пропил и бромистый изопропил.
Техника безопасности: особую осторожность следует проявлять при смешении бромида калия с концентрированной серной кислотой. Недопустим перегрев вследствие недостаточного охлаждения или слишком быстрого смешения. В этом случае возможно вскипание смеси, выделение ядовитых паров брома и даже выброс содержимого колбы наружу. Кислоту и бромид добавлять в реакционную колбу только небольшими порциями. Эту операцию проводить обязательно в защитных очках или маске.
studfiles.net
Пары - бромистый этил - Большая Энциклопедия Нефти и Газа, статья, страница 1
Пары - бромистый этил
Cтраница 1
Пары бромистого этила обладают хорошими огнетушащими свойствами. При температуре - 30 С давление насыщенных паров бромистого этила достаточно для создания огнетушащей концентрации. Однако при концентрациях 6 75 - 11 25 объемн. Поэтому он в чистом виде не применяется, а лишь входит основным компонентом в огнетушащие составы 3 5; БФ-1; БФ-2 и БМ. [1]
Пары бромистого этила вместе с парами спирта, воды, бромистым водородом, сернистым газом и другими примесями, образующимися в результате побочных процессов, направляют в фильтры, заполненные окисью железа ( окалиной) 103, где бромистый водород и двуокись серы вступают в реакцию с окисью железа. При этом образуется раствор бромистого и сернокислого железа, который стекает обратно в реактор. В дефлегматоре спирт и вода конденсируются и стекают обратно в реактор. Пары бромистого этила пропускают через промывалку с раствором щелочи для улавливания остатков бромистоводородной кислоты, а затем через дефлегматор направляют в прямой холодильник, где они конденсируются. Бромистый этил-сырец содержит примеси: диэтиловый эфир, спирт, воду. Для очистки от примесей его обрабатывают концентрированной серной килотой. Обычно примеси содержатся в последних фракциях отгоняемого бромистого этила. Поэтому эти фракции собирают отдельно и подвергают двукратной перегонке и очистке серной кислотой. Для получения более чистого продукта бромистый этил подвергают дополнительной ректификации. [2]
Пары бромистого этила обладают хорошими огнетушащими свойствами. При температуре - 30 С давление насыщенных паров бромистого этила достаточно для создания огнетушащей концентрации. Однако при концентрациях 6 75 - 11 25 объемн. Поэтому он в чистом виде не применяется, а лишь входит основным компонентом в огнетушащие составы 3 5; БФ-1; БФ-2 и БМ. [3]
Пары бромистого этила вместе с парами спирта, воды, бромистым водородом, сернистым газом и другими примесями, образующимися в результате побочных процессов, направляют в фильтры, заполненные окисью железа ( окалиной) 103, где бромистый водород и двуокись серы вступают в реакцию с окисью железа. При этом образуется раствор бромистого и сернокислого железа, который стекает обратно в реактор. В дефлегматоре спирт и вода конденсируются и стекают обратно в реактор. Пары бромистого этила пропускают через промывалку с раствором щелочи для улавливания остатков бромистоводородной кислоты, а затем через дефлегматор направляют в прямой холодильник, где они конденсируются. [4]
Хотя пары бромистого этила и вызывают раздражение, это соединение в отличие от бромистого метила не оказывает серьезного замедленного токсического действия на организм. [5]
Бромистый этил - жидкость с характерным запахом, практически неэлектропроводная, хорошо растворяет жиры и масла, обладает высокой смачивающей способностью, плохо растворим в воде, сильно корродирует алюминиевые и магниевые сплавы, разрушает резину. Коррозионному действию бромистого этила хорошо сопротивляются нержавеющие стали, медь, латунь, олово, а также сплавы олова и свинца. Пары бромистого этила обладают высокими огнетушащими свойствами. При температуре 243.15 К ( - 30 С) давление насыщенных паров бромистого этила достаточно для создания огнетушащей концентрации. Однако при концентрациях 6 75 - 11 25 % по объему бромистый этил способен воспламеняться от действия мощного источника воспламенения. Поэтому его в чистом виде не применяют. Он лишь входит основным компонентом в огнетушащие составы. [6]
Реакторы, предназначенные для получения бромистого этила, обычно футеруют кислотоупорными плитками или эмалируют. Они снабжены мешалками, а иногда паровыми рубашками. При прибавлении серной кислоты температура реакционной смеси повышается и пары бромистого этила начинают отгоняться. В дальнейшем реакционную смесь подогревают острым или глухим паром. [7]
Пары бромистого этила вместе с парами спирта, воды, бромистым водородом, сернистым газом и другими примесями, образующимися в результате побочных процессов, направляют в фильтры, заполненные окисью железа ( окалиной) 103, где бромистый водород и двуокись серы вступают в реакцию с окисью железа. При этом образуется раствор бромистого и сернокислого железа, который стекает обратно в реактор. В дефлегматоре спирт и вода конденсируются и стекают обратно в реактор. Пары бромистого этила пропускают через промывалку с раствором щелочи для улавливания остатков бромистоводородной кислоты, а затем через дефлегматор направляют в прямой холодильник, где они конденсируются. Бромистый этил-сырец содержит примеси: диэтиловый эфир, спирт, воду. Для очистки от примесей его обрабатывают концентрированной серной килотой. Обычно примеси содержатся в последних фракциях отгоняемого бромистого этила. Поэтому эти фракции собирают отдельно и подвергают двукратной перегонке и очистке серной кислотой. Для получения более чистого продукта бромистый этил подвергают дополнительной ректификации. [8]
Пары бромистого этила вместе с парами спирта, воды, бромистым водородом, сернистым газом и другими примесями, образующимися в результате побочных процессов, направляют в фильтры, заполненные окисью железа ( окалиной) 103, где бромистый водород и двуокись серы вступают в реакцию с окисью железа. При этом образуется раствор бромистого и сернокислого железа, который стекает обратно в реактор. В дефлегматоре спирт и вода конденсируются и стекают обратно в реактор. Пары бромистого этила пропускают через промывалку с раствором щелочи для улавливания остатков бромистоводородной кислоты, а затем через дефлегматор направляют в прямой холодильник, где они конденсируются. [9]
Бромистый этил также входит в состав огнетушащего средства 3 5, содержащего 70 вес. Обозначение 3 5 показывает, что огнету-шащая эффективность этого огнетушащего состава в 3 5 раза больше эффективности чистой двуокиси углерода. Этот состав можно применять при температурах от - 70 до 60 С, что позволяет использовать его в стационарных установках на борту самолета. Так как пары бромистого этила имеют пределы воспламенения 6 75 - 11 25 %, существует опасность взрыва, что вызывало сомнение в возможности его применения в качестве огнетушащего средства. Они показали, что воспламенение смесей может произойти лишь при наличии сильной искры, причем пламя распространяется только вверх. [10]
Страницы: 1
www.ngpedia.ru

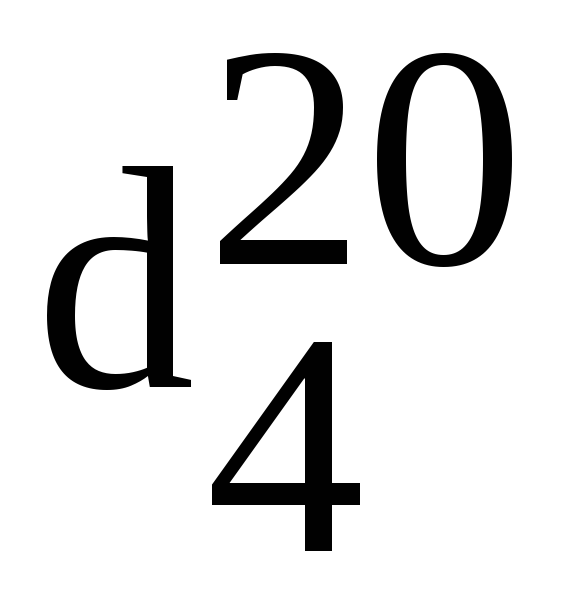 = 1,84 г/см3)
= 1,84 г/см3)