15.Химические свойства алкенов: реакции присоединения:. Алкадиен вода
Алкадиены: физические свойства, химические свойства и их применение. Физические свойства алкадиенов: таблица, фото, примеры
В зависимости от количества кратных связей между атомами углерода выделяют несколько классов углеводородов. Остановимся подробнее на диеновых соединениях, особенностях их строения, физических и химических свойствах.
Строение
Что собой представляют алкадиены? Физические свойства представителей этого класса органических соединений сходны с таковыми у алканов и алкенов. Диены имеют общую формулу СпН2п-2, сложные связи, поэтому относятся к непредельным углеводородам.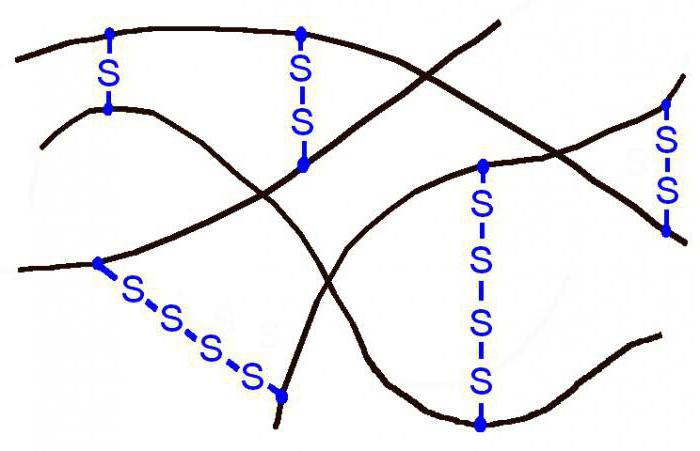
Эти связи могут располагаться в разных положениях, образуя разные варианты диенов:
- кумулированные, в которых кратные связи находятся с двух сторон от одного атома углерода;
- конъюгированные (сопряженные), в которых между двойными связями располагается одна одинарная;
- изолированные, в которых между двойными связями располагается несколько одинарных видов.
В таких веществах все углероды, стоящие при двойной связи, находятся в sp2-гибридном состоянии. Какие характеристики имеют алкадиены? Физические свойства таких соединений определяются именно особенностями их строения.
Номенклатура
Согласно систематической номенклатуре, диеновые углеводороды называют по тому же принципу, по которому дают название этиленовым соединениям. Есть некоторые отличительные характеристики, которые легко объяснить присутствием в их молекулах двух двойных связей.
Сначала необходимо выявить в углеродном скелете самую длинную углеродную цепочку, в составе которой есть две двойные связи. По числу углеродных атомов выбирается основа для названия, затем к нему добавляется суффикс –диен. Цифрами указывается положение каждой связи, начиная с наименьшего.
Например, по систематической номенклатуре вещество пентадиен-1, 3 имеет следующую структуру:
Н2С=СН—СН=СН—СН3.
В систематической номенклатуре есть некоторые сохранившиеся названия: аллен, дивинил, изопрен.
Виды изомерии
Алкадиены, физические свойства которых зависят от количества углеродных атомов в молекуле, имеют несколько видов изомерии:
- положения кратных связей;
- углеродного скелета;
- межклассового вида.
Остановимся теперь на вопросах, касающихся определения количества изомеров у диеновых углеводородов.
Задания на изомеры
"Определите количество изомерных соединений и назовите физические свойства алкадиенов" - в 10 классе по школьной программе на уроках органической химии учащимся предлагается много вопросов подобного характера. Кроме того, можно встретить задания, связанные с непредельными углеводородами, в едином государственном экзамене по химии.
Например, необходимо указать все изомеры состава С4Н6, а также дать им название по систематической номенклатуре. В первую очередь можно составить все алкадиены, физические свойства которых аналогичны этиленовым соединениям:
Н2С=СН—СН=СН2.
Данное соединение является газообразным веществом, которое нерастворимо в воде. По систематической номенклатуре оно будет иметь название бутадиен -1,3.
При перемещении кратной связи по структуре можно получить изомер следующего вида:
Н3С-СН=СН=СН2
Он имеет следующее название: бутадиен -1,2
Помимо изомеров положения кратной связи, для состава С4Н6 можно также рассматривать межклассовую изомерию, а именно представителей класса алкинов.
Особенности получения диеновых соединений
Как получают алкадиены? Физические и химические свойства представителей данного класса можно изучать в полной мере только при условии существования рациональных способов их лабораторного и промышленного получения.
Учитывая тот факт, что самыми востребованными в современном производстве являются дивинил и изопрен, рассмотрим варианты получения данных диеновых углеводородов.
В промышленности эти представители ненасыщенных соединений получают в процессе дегидрирования соответствующих алканов или алкенов над катализатором, в качестве которого выступает оксид хрома (3).
Сырье для данного процесса выделяют при переработке попутного газа или из продуктов нефтяной переработки.
Бутадиен-1,3 был синтезирован из этилового спирта в процессе дегидрирования и дегидратации академиком Лебедевым. Именно этот способ, предполагающий применением в качестве катализатора оксидов цинка или алюминия и протекающий при температуре 450 градусов по Цельсию, был взят в основу промышленного синтеза дивинила. Уравнение данного процесса имеет такой вид:
2C2H5OH ——————Н2С=СН—СН=СН2 + 2Н2O + Н2.
Кроме того, можно выделить изопрен и дивил в незначительных количествах путем пиролиза нефти.
Особенности физических характеристик
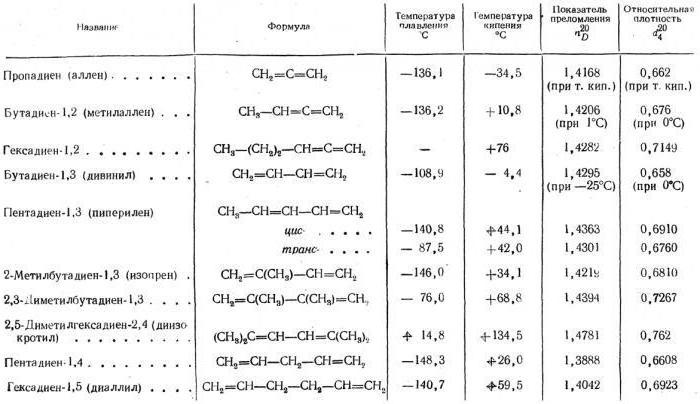
В каком агрегатном состоянии находятся алкадиены? Физические свойства, таблица которых содержит информацию о температурах плавления, кипения, свидетельствует о том, что низшие представители этого класса являются газообразными состояниями, имеющими невысокие температуры кипения и плавления.
С увеличением относительной молекулярной массы наблюдается тенденция возрастания этих показателей, переход с жидкому агрегатному состоянию.
Поможет вам детально изучить физические свойства алкадиенов таблица. Фото с изображением продуктов, получаемых из этих соединений, представлены выше.
Химические свойства
Если рассматривать изолированные (несопряженные) двойные связи, они обладают такими же возможностями, как типичные этиленовые углеводороды.
Мы проанализировали физические свойства алкадиенов, примеры их возможных химических взаимодействий рассмотрим на бутадиене -1,3.
Соединения, имеющие сопряженные двойные связи, имеют более высокую реакционную способность в сравнении с иными видами диенов.
Реакции присоединения
Для всех видов диенов характерны реакции соединения. Среди них отметим галогенирование. Эта реакция приводит к превращению диена в соответствующий алкен. Если водород берется в избыточном количестве, можно получить предельный углеводород. Представим процесс в виде уравнения:
Н3С-СН=СН=СН2 + 2Н2= Н3С-СН2-СН2-СН3.
Галогенирование предполагает взаимодействие диенового соединения с двухатомной молекулой хлора, йода, брома.
Реакция гидратации (присоединения молекул воды) и гидрогалогенирования (для диеновых соединений, имеющих двойную связь в первом положении) протекает по правилу Марковникова. Суть его состоит в том, что при разрыве связи атомы водорода будут присоединяться к тем углеродным атомам, которые имеют меньшее количество водородов, а атомы гидроксильной группы либо галогена будут прикрепляться к тем атомам С, при которых располагается меньшее количество водорода.
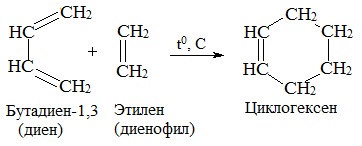
При диеновом синтезе происходит прикрепление молекулы этиленового соединения или алкина к диену, имеющему сопряженные двойные связи.
Эти взаимодействия применяют в производстве различных циклических соединений органического вида.
Полимеризация у представителей диеновых соединений имеет особое значение. Физические свойства алкадиенов и их применение связаны именно с этим процессом. При их полимеризации образуются каучукоподобные высокомолекулярные соединения. Например, из бутадиена-1,3 можно получить бутадиеновый каучук, имеющий широкое промышленное применение.
Характеристика отдельных диеновых соединений
Какие имеют алкадиены физические свойства? Кратко проанализируем особенности изопрена и дивинила.
Бутадиен -1,3 является газообразным газом, имеющим специфический резкий запах. Именно это соединение является исходных мономеров для производства латексов, синтетических каучуков, пластмасс, а также множества органических соединений.
2-метилбутадиен-1,3 (изопрен) - это бесцветная жидкость, являющаяся структурным компонентом природного каучука.
2-хлорбутадиен-1,3 (хлоропрен) представляет собой токсичную жидкость, являющуюся основой для изготовления винилацетилена, промышленного производства синтетического хлоропренового каучука.

Резины и каучуки
Резины и каучуки являются эластомерами. Существует подразделение всех каучуков на синтетические и природные.
Натуральный каучук является высокоэластичной массой, которую получают из млечного сока. Латекс - это взвесь мелких частичек каучука в воде, которая существует в таких тропических деревьях как гевея бразильская, а также в некоторых растениях.
Этот непредельный полимер имеет состав (С5Н8)п, у которого средняя молекулярная масса колеблется в диапазоне от 15000 до 500000.
В ходе исследований было установлено, что структурная единица натурального каучука имеет вид -СН2-С=СН-СН2-.
В качестве основных отличительных его характеристик можно отметить прекрасную эластичность, способность выдерживать существенные механические деформации, сохранять форму после растяжения. Натуральный каучук способен растворяться в некоторых углеводородах, образуя при этом вязкие растворы.
Аналогично диеновым соединениям, он способен вступать в реакции присоединения. В качестве разновидности изопренового полимера выступает гуттаперча. У этого соединения нет повышенной эластичности, так как у него есть отличия в строении макромолекул.
Изделия, изготовленные из каучука, обладают определенными недостатками. Например, в случае повышения температуры они становятся липкими, изменяют свою форму, при понижении температуры у них появляется чрезмерная хрупкость.
Для того чтобы избавиться от подобных недостатков, в промышленности прибегают к вулканизации каучука. Суть данного процесса заключается в придании ему термостойкости, эластичности при обработке серой.
Процесс проходит при температурах в диапазоне 140-180° С в специальных аппаратах. В итоге образуется резина, содержание серы в которой достигает 5 %. Она «сшивает» макромолекулы каучука, формируя сетчатую структуру. Помимо серы в составе резины есть также дополнительные наполнители: красители, пластификаторы, антиоксиданты.
В связи с высоким спросом в промышленности на изделия из каучука, основное его количество производится синтетическим способом.
fb.ru
Химические свойства алкадиенов - Абросимова Елена Владимировна учитель химии и биологии
Свойства сопряженных алкадиенов
Наибольшее практическое значение имеют дивинил или бутадиен-1,3 (легко сжижающийся газ, т.кип = – 4,5° ) и изопрен или 2-метилбутадиен-1,3 (жидкость с т.кип =34° С).
По химическим свойствам диеновые углеводороды подобны алкенам. Они легко окисляются и вступают в реакции присоединения. Однако сопряженные диены отличаются некоторыми особенностями, которые обусловлены делокализацией (рассредоточением) p -электронов.
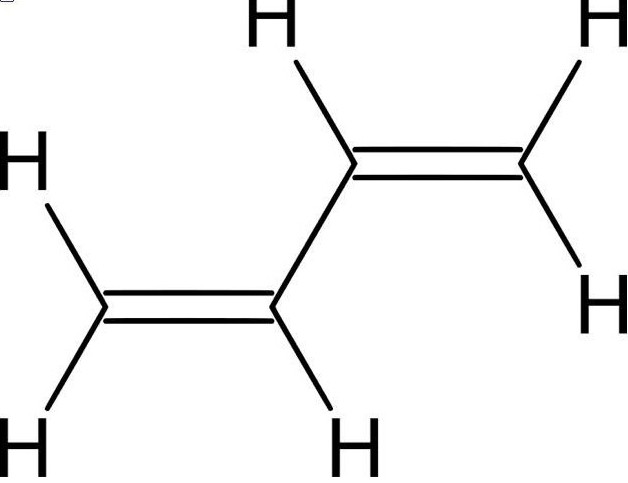
Молекула бутадиена-1,3 СН2=СН-СН=СН2 содержит четыре атома углерода в sp2-гибридизованном состоянии и имеет плоское строение.

p-Электроны двойных связей образуют единое p -электронное облако (сопряженную систему) и делокализованы между всеми атомами углерода.

Порядок связей (число общих электронных пар) между атомами углерода имеет промежуточное значение между 1 и 2, т.е. нет чисто одинарной и чисто двойных связей. Строение бутадиена более точно отражает формула с делокализованными связями.

Аналогично построены молекулы изопрена:

Образование единого p -электронного облака, охватывающего 4 атома углерода:
 приводит к возможности присоединения реагента по концам этой системы, т.е. к атомам С1 и С4. Поэтому дивинил и изопрен наряду с присоединением 1 моля реагента по одной из двойных связей (1,2- или 3,4-) вступают в реакции 1,4-присоединения. Соотношение продуктов 1,2- и 1,4- присоединения зависит от условий реакции (с повышением температуры обычно увеличивается вероятность 1,4-присоединения).
приводит к возможности присоединения реагента по концам этой системы, т.е. к атомам С1 и С4. Поэтому дивинил и изопрен наряду с присоединением 1 моля реагента по одной из двойных связей (1,2- или 3,4-) вступают в реакции 1,4-присоединения. Соотношение продуктов 1,2- и 1,4- присоединения зависит от условий реакции (с повышением температуры обычно увеличивается вероятность 1,4-присоединения).1. Реакции присоединения к сопряженным диенам
1. Гидрирование
При гидрировании бутадиена-1,3 получается бутен-2, т.е. происходит 1,4-присоединение. При этом двойные связи разрываются, к крайним атомам углерода С1 и С4 присоединяются атомы водорода, а свободные валентности образуют двойную связь между атомами С2 и С3:

В присутствии катализатора Ni получается продукт полного гидрирования:

2. Галогенирование
1,4-присоединение:

1,2-присоединение:

При избытке брома присоединяется еще одна его молекула по месту оставшейся двойной связи с образованием 1,2,3,4-тетрабромбутана.
Присоединение галогенов, галогеноводородов, воды и других полярных реагентов происходит по электрофильному механизму (как в алкенах).
К реакциям присоединения относятся реакции полимеризации, характерные для диенов. Этот процесс имеет важное значение в производстве синтетических каучуков.
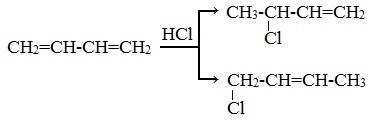
3. Взаимодействие с галогеноводородами.
1) по месту разрыва одной двойной связи (1,2-присоединение):

2) с присоединением к концам молекулы и разрывом двух двойных связей (1,4-присоединение):

Преимущественное протекание реакции по тому или иному пути зависит от конкретных условий.
sites.google.com
Химические свойства алкадиенов | Химия онлайн
Наибольшее значение имеют диены с сопряженными связями, так как они являются сырьем для получения каучуков. В химическом поведении этих диенов есть особенности, обусловленные наличием в их молекулах сопряжения. Для них характерны реакции присоединения по концам системысопряжённых связей и образование двойной связи между срединными атомами углерода (1,4-присоединение) или к одной из двойных связей (1,2-присоединение).
Реакции присоединения
1. Гидрирование
При гидрировании бутадиена-1,3 получается бутен-2, т.е. происходит 1,4-присоединение. При этом двойные связи разрываются, к крайним атомам углерода С1 и С4 присоединяются атомы водорода, а свободные валентности образуют двойную связь между атомами С2 и С3:
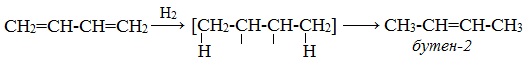
В присутствии катализатора Ni получается продукт полного гидрирования:
2. Галогенирование
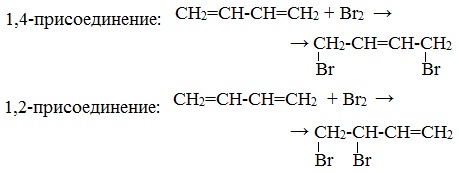
При избытке брома присоединяется еще одна его молекула по месту оставшейся двойной связи с образованием 1,2,3,4-тетрабромбутана.
3. Гидрогалогенирование
Присоединение галогенов, галогеноводородов, воды и других полярных реагентов происходит по электрофильному механизму (как в алкенах).
4. Реакции полимеризации
Важнейшее свойство диенов — их способность к полимеризации, которая используется для получения синтетических каучуков.
Полимеризация 1,3-диенов может протекать либо по типу 1,4-присоединения, либо по смешанному типу 1,2- и 1,4-присоединения. Направление присоединения зависит от условий проведения реакции.
При полимеризации бутадиена-1,3, которая протекает как 1,4-присоединение, получают бутадиеновый каучук.
Избирательное 1,4-присоединение происходит при использовании металлорганических катализаторов (например, бутиллития C4H9Li, который не только инициирует полимеризацию, но и определенным образом координирует в пространстве присоединяющиеся молекулы диена):
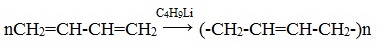
В упрощенном виде реакцию полимеризации бутадиена-1,3 по схеме 1,4 присоединения можно представить следующим образом: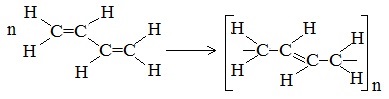
Элементная ячейка полибутадиена представляется следующим образом:
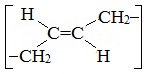
Как видно, образующийся полимер характеризуется транс-конфигурацией элементной ячейки полимера. Однако наиболее ценные в практическом отношении продукты получаются при стереорегулярной (иными словами, пространственно упорядоченной) полимеризации диеновых углеводородов по схеме 1,4-присоединения с образованием цис-конфигурации полимерной цепи.
Например, цис-полибутадиен: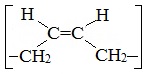
5. Диеновый синтез (реакция Дильса-Альдера)
В органическом синтезе широко применяется реакция присоединения к сопряженным диенам соединений, содержащих кратные связи (так называемых диенофилов). Реакция идет как 1,4-присоединение и приводит к образованию циклических продуктов:
Алкадиены
himija-online.ru
Химические свойства алкадиенов
Химические свойства алкадиенов
Свойства алкадиенов с изолированными двойными связями мало отличаются от свойств алкенов. Алкадиены с сопряженными связями обладают некоторыми особенностями.
Алкадиен с сопряженными связями :
СН2 = СН – СН = СН2
Алкадиен с изолированными связями:
СН2 = СН – СН2 – СН = СН2
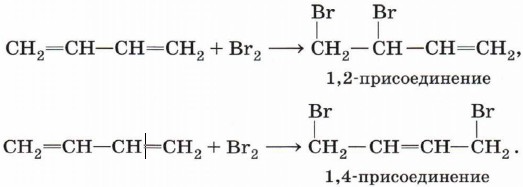
Алкадиены с сопряженными двойными связями способны присоединять молекулы галогенов как в положении 1 и 2 (1,2-присоединение) , так и в положения 1 и 4 (1,4-присоединение).
1. Реакция галогенирования.
СН2 = СН – СН = СН2 + Вr2 → СН2 – СН – СН = СН2
бутадиен-1,3
3,4-дибромбутен-1 (1,2-присоединение)
СН2 = СН – СН = СН2 + Вr2 → СН2 – СН = СН – СН2
1,4-дибромбутен-2
(1,4-присоединение)
При избытке брома к молекуле бутадиена-1,3 может быть присоединена еще одна молекула его по месту образовавшейся двойной связи. Продуктом реакции в этом случае будет – 1,2,3,4-тетрабромбутан.
СН2 – СН = СН – СН2 → СН2 – СН – СН – СН2
Таким образом, алкадиены также как и алкены способны обесцвечивать бромную воду.
2. Реакция полимеризации. Важной особенностью алкадиенов является большая легкость их к полимеризации. Эта реакция лежит в основе получения синтетических каучуков. Полимеризация сопряженных алкадиенов протекает как 1,4-присоединение.
n Н2С = СН – СН = СН2 → (…– Н2С – СН = СН – СН2 –…) n
бутадиен-1,3 (дивинил)
синтетический бутадиеновый каучук
3. Реакция гидрирования: продуктами являются алкены.
4. Реакция гидрогалогенирования: в случае алкадиенов с сопряженными двойными связями возможно 1,4-присоединение или 1,2-присоединение.
Получение алкадиенов
1. Дегидрирование алканов (отщепление водорода). Из н-бутана в результате каталитического дегидрирования получают бутадиен-1,3.
СН3 – СН2 – СН2 – СН3 → Н2С = СН – СН = СН2 + Н2 бутадиен-1,3
н-бутан
Эта реакция протекает в две стадии.
1 стадия: t=500-600о катализатор Аl2О3, Сr2О3
СН2 = СН – СН2 – СН3 + Н2
бутен-1
СН3 – СН2 – СН2 – СН3 на первой стадии образуется как бутен-1 так и бутен-2
н-бутан
СН3 – СН = СН – СН3 + Н2
бутен-2
2 стадия: t=500-600о катализаторы: МgО, ZnО
бутен-1
СН2 = СН – СН2 – СН3 → Н2С = СН – СН = СН2 + Н2 бутадиен-1,3
СН3 – СН = СН – СН3
бутен-2
2. Дегидрогалогенирование (отщепление галогеноводорода). При действии на дибромалканы спиртового раствора щелочи происходит отщепление двух молекул галогеноводорода с образованием соответствующего алкадиена.
СН2 – СН – СН – СН2 + 2КОН → СН2 = СН – СН = СН2 + 2КВr +2Н2О
бутадиен-1,3
1,4-дибромбутан
СН2 – СН – СН – СН2 + 2КОН → СН2 = СН – СН = СН2 + 2КВr +2Н2О
бутадиен-1,3
1,3-дибромбутан
Существенное значение имеет расположение галогенов в молекуле дигалогеналкана. Так, в случае 2,3-дибромбутана или 2,2-дибромпропана образуются соответствующие алкины.
3. Дегидрирование и дегидратация этилового спирта (метод Лебедева).
Катализаторы: Аl2О3, ZnО и t=425оС. В результате этой реакции этиловый спирт одновременно претерпевает и дегидратацию, и дегидрирование.
2 СН3 – СН2 – ОН → СН2 = СН – СН = СН2 + Н2 + 2Н2О
этиловый спирт
бутадиен-1,3
4. Получение изопрена. Катализаторы: Сr2О3, Аl2О3, tо.
СН3 – СН – СН2 – СН3 → СН2 = С – СН = СН2 + 2Н2
2-метилбутан
2-метилбутадиен-1,3 (изопрен)
Весь материал - в документе.
videouroki.net
Алкадиены: Химические свойства
Теперь мы переходим к рассмотрению химических свойств алкадиенов. В целом, для них возможны те же реакции, что и для алкенов, то есть реакции присоединения.
Первым в списке будет галогенирование, присоединение галогенов.
Здесь необходимо особо отметить, что такие реакции могут идти, во-первых, по двум направлениям, как 1,4-присоединение и как 1,2-присоединение. Обратите внимание, что в случае 1,4-присоединения кратная связь перемещается в центр молекулы, то есть во второе положение. В данном примере получается 1,4-дибромбутен-2.
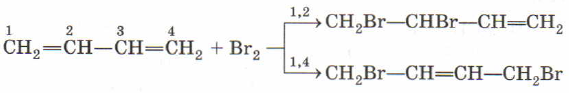
Направление реакции зависит в первую очередь от температуры, но для нас это не так важно. Если подобное уравнение встретится в цепочках превращений, то по продукту реакции, указанному в цепочке, будет понятно, по какому направлению пошло присоединение.
И вторая важная особенность этих реакций то, что они могут протекать по двум ступеням сначала присоединяется одна молекула реагента, затем вторая.
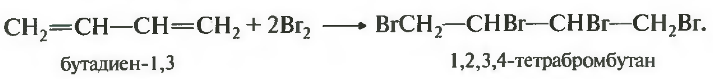
В таких случаях в цепочках обычно указывают над стрелкой, сколько моль реагента вступит в реакцию. Если один, то очевидно, что реакция пойдет только по одной ступени с сохранением одной двойной связи. Если будет указано два моля, то присоединение произойдет с разрушением обеих двойных связей.
Второе свойство гидрогалогенирование, присоединение галогеноводородов.
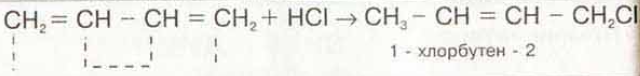
Здесь также возможно 1,4- или 1,2-присоединение. Главное, на что надо обратить внимание в случае 1,2-присоединения оно идет по правилу Марковникова. Атом водорода присоединяется к наиболее гидрированному атому углерода.
Третье свойство гидрирование, присоединение водорода.
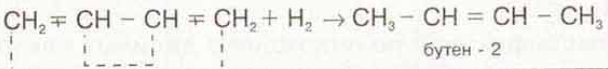
Здесь все просто катализатор платина, продукт предельный углеводород, в данном случае бутан.
Четвертое свойство, пожалуй, самое важное полимеризация.
Полимеризацией бутадиена и изопрена получают материал каучук, являющийся основой резиновых изделий, например, автомобильных покрышек и камер.
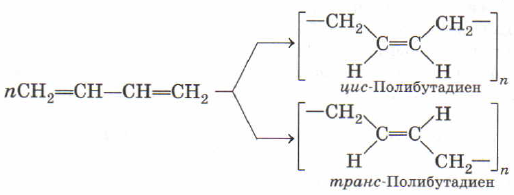
Из бутадиена-1,3 получают полимер полибутадиен, называемый бутадиеновый каучук.
Из изопрена получают изопреновый каучук, полиизопрен.
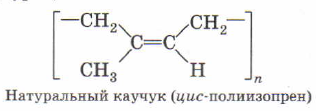
Обратите внимание, что в обоих случаях остается одна двойная связь и она перемещается в центр мономерного звена.
Вам нужно запомнить самое главное: бутадиеновый синтетический каучук, изопреновый природный, натуральный каучук. Этот вопрос может встретиться на ЕГЭ. Разумеется, в современной химической промышленности найдены способы получения изопренового каучука, не уступающего по качеству натуральному.
Качественный каучук имеет стереорегулярное строение, то есть образует цепи с цис-ориентацией, то есть цис-полиизопрен. Когда заместители расположены по одну сторону от двойных связей. Это обеспечивает характерную упругость резиновым изделиям, то есть способность возвращаться в первоначальную форму после деформации.
Для повышения прочности каучука проводят его вулканизацию, нагревание с серой. Сера создает мостики, между полимерными цепями, сшивая их между собой.
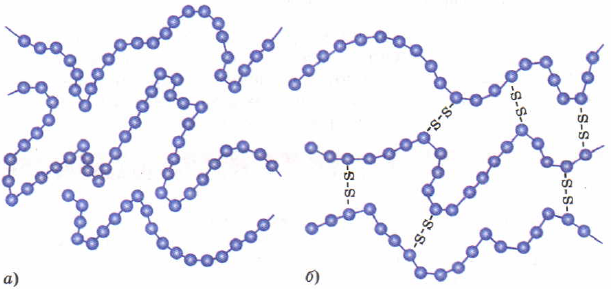
Строение каучука (а) и резины (б).
Вулканизированный каучук называется резиной. Чем больше будет таких дисульфидных мостиков, тем менее эластичным будет материал. В конце концов он станет твердым, такой материал называется эбонит. Помните из физики эбонитовая палочка, потертая о шерсть, заряжается отрицательно?
Дополнительно напомню про существование еще одного вида каучуков, который желательно помнить. Речь о хлоропреновом каучуке. Этот полимерный материал делается из 2-хлорбутадиена-1,3, имеющего тривиальное название хлоропрен.
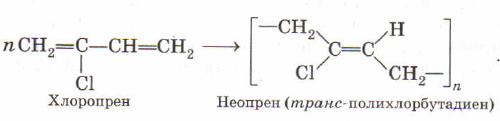
Предлагаю вспомнить два уравнения реакции, которые приводят к получению хлоропрена.
Во-первых, это димеризация ацетилена.
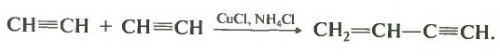
Катализаторы хлорид меди 1 и хлорид аммония. Чтобы вы не сильно боялись, отмечу, что знание этих катализаторов на экзамене у вас проверять не будут. Продукт реакции винилацетилен, имеющий и двойную, и тройную связь в составе углеродной цепи.
Вторая реакция присоединение хлороводорода к венилацетилену.
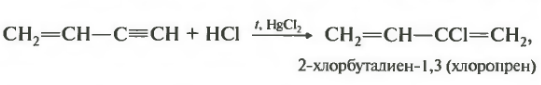
Здесь важным условием является наличие солей ртути. Напомню, что этот катализатор характерен для реакций гидрогалогенирования и гидратации для алкинов в целом.
В конце разговора о химических свойствах алкадиенов следует упомянуть о пятом свойстве в общем списке это горение, полное окисление.
Как и все углеводороды, диены сгорают до воды и углекислого газа. Уравнение реакции сгорания в общем виде будет аналогично уравнению сгорания алкинов. Как оно выводится, вы можете посмотреть в видео, посвященном химическим свойствам алкинов.
Мы рассмотрели пять химических свойств алкадиенов, обсудили особенности присоединения по двойным связям, поговорили о бутадиеновом, синтетическом, и изопреновом, натуральном, каучуках.
stepenin.ru
Химические свойства алкадиенов
1. Реакции присоединения для алкадиенов с сопряженными связями могут протекать по двум направлениям: 1,2- и 1,4-присоединение.
1,2-Присоединение - это присоединение молекулы реагента по одной из двух двойных связей; 1,4 - это присоединение молекулы реагента по краям сопряженной системы с переносом двойной связи в ее центр. Причем присоединение несимметричных реагентов происходит в соответствии с правилом Марковникова.
Реализация того или иного направления присоединения зависит от условий проведения реакции. При пониженных температурах в среде неполярных растворителей образуются преимущественно продукты 1,2-присоединения. При повышенных температурах в среде полярных растворителей - продукты 1,4-присоединения.
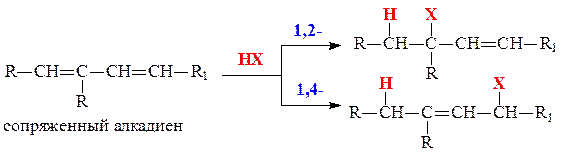
2. Реакции полимеризации сопряженных алкадиенов также могут протекать по схемам 1,2- или 1,4-присоединения:
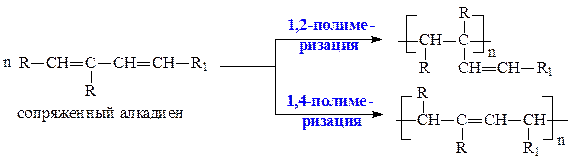
3. Реакции окисления алкадиенов
а) мягкое окисление реактивом Вагнера - образуются многоатомные спирты:
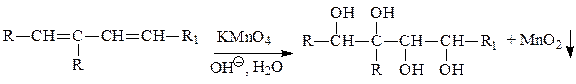
б) жесткое окисление перманганатом или дихроматом калия в кислой среде - образуются карбоновые кислоты и кетоны:
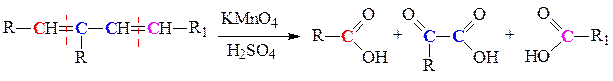
в) озонолиз - образуются альдегиды и кетоны:
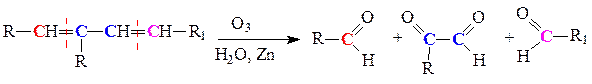
Решение
Приводим реакции 2,3-диметилгекса-2,4-диена с реагентами Б, ВиГ.
Пример решения задачи 13
Получите метилвтор-бутилацетилен дегидрогалогенированием соответствующего геминального или вицинального дигалогенопроизводного углеводорода.
Способы получения алкинов
1. Дегидрогалогенирование геминальных дигалогенопроизводных алканов – водород отщепляется по правилу Зайцева:
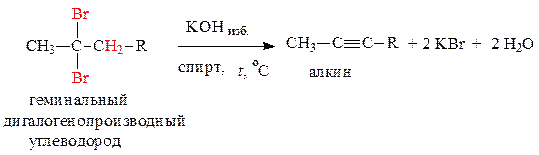
2. Дегидрогалогенирование вицинальных дигалогенопроизводных алканов – водород отщепляется по правилу Зайцева:
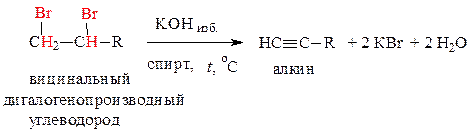
Решение
Получаем метилвтор-бутилацетилен:
а) из соответствующего геминального дигалогеналкана:
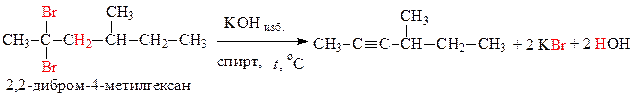
б) из соответствующего вицинального дигалогеналкана:
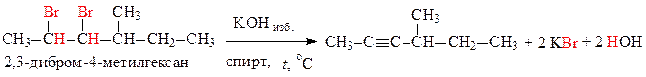
Пример решения задачи 14
Приведите для соединения метилвтор-бутилацетилен реакции с реагентами: 1) h3O, HgSO4, h3SO4, 2) K2Cr2O7, h3SO4, 3) HBr (2 моль). Назовите продукты реакций.
Химические свойства алкинов
1. Реакции присоединения электрофилов (AE) идут в соответсвии с правилом Марковникова, но медленнее, чем для алкенов, так как алкины труднее отдают свои π-электроны электрофилу ввиду того, что атомы углерода в sp-гибридизации сильнее удерживают электроны π-связи, чем в sp2-гибридизации. Это можно связать с большей электроотрицательностью атома С в sp-гибридизации, чем в sp2-гибридизации.
Присоединение галогенов и галогеноводородов:
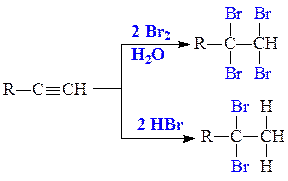
2. Реакции присоединения нуклеофилов АN. В качестве нуклеофилов используются: вода, спирты, анионы карбоновых кислот, циановодород. Реакции присоединения нуклеофилов идут в соответствии с правилом Марковникова, но труднее, чем реакции с электрофилами, и требуют применения катализаторов:
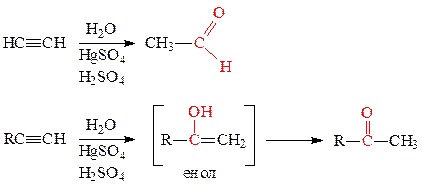
а) присоединение воды (реакция Кучерова) происходит в кислой среде в присутствии катализатора - солей двухвалентной ртути:
б) присоединение спиртов требует применения щелочного катализа:
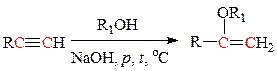
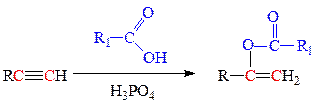
в) присоединение карбоновых кислот требует применения кислотного катализа:
г) присоединение синильной кислоты (циановодорода) в присутствии катализатора медь(I)-цианида:
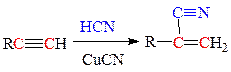
3. Реакции алкинов по концевой (терминальной) тройной связи (SE).
Алкины с концевой тройной связью обладают С-Н кислотностью, т. е. легко отщепляют водород, замещая его на катион одновалентных металлов: Na+, Cu+, Ag+ и др. Это качественные реакции на концевую тройную связь - наблюдается выпадение осадков ацетиленидов серебра (светло-желтый) или меди (красно-бурый). В случае взаимодействия с амидом натрия наблюдается выделение газообразного аммиака:
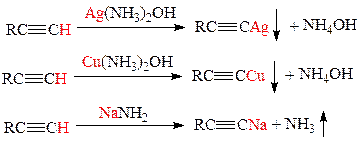
Ацетилениды металлов – сильные нуклеофильные реагенты. Их используют для введения тройной связи в молекулу галогеналкана, в результате углеродная цепь удлиняется:

4. Реакции окисления алкинов:
а) мягкое окисление реактивом Вагнера:
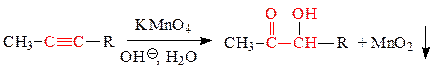
б) жесткое окисление:
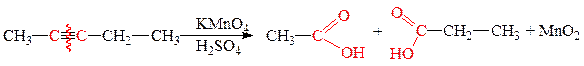
Решение
Приводим для соединения втор-бутилацетилен реакции с реагентами:
1. Реакция с h3O, HgSO4, h3SO4 идет по правилу Марковникова:
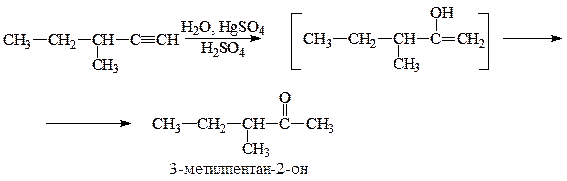
2. Реакция жесткого окисления K2Cr2O7, h3SO4:
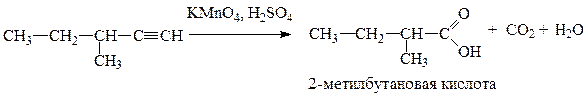
3. Реакция с HBr (2 моль) идет по правилу Марковникова:
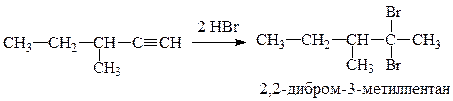
Пример решения задачи 15
Выполните схему превращений, назовите образующиеся на каждой стадии продукты реакций.
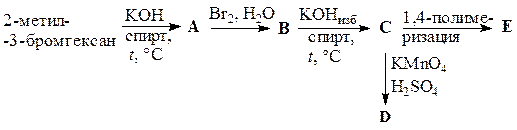
Для выполнения данной схемы необходимо знать основные способы получения и химические свойства непредельных соединений.
Выполнение схемы:
Пример решения задачи 17
infopedia.su
15.Химические свойства алкенов: реакции присоединения:
1) Галогенирование. Алкены обесцвечивают бромную воду:
СН2=СН2 + Вr2 → ВrСН2-СН2Вr.
Эта реакция является качественной на двойную связь.
2)Гидрирование. Присоединение водорода происходит под действием металлических катализаторов:
| t, Ni | ||
| СН3-СН=СН2 + Н2 | → | СН3-СН2-СН3 |
3)Гидрогалогенирование.
СН3-СН=СН2 + НВr СН3-СНВr-СН3.
Продукты реакции определяются правилом Марковникова.
4)Гидратация. При взаимодействии алкенов с водой в присутствии минеральных кислот (серной, фосфорной) образуются спирты. Минеральные кислоты выполняют роль катализаторов и являются источниками протонов. Присоединение воды также идет по правилу Марковникова:
СН3-СН=СН2 + НОН → СН3-СН(ОН)-СН3.
16.Особенности строения и свойств сопряженных алкадиенов. Реакции присоединения, полимеризации.
Алкадиены (диены, диеновые углеводороды) – соединения, в молекулах которых присутствуют две двойные связи. Общая формула Cnh3n-2.
Сопряженные диены – соединения, в молекулах которых две двойные связи разделены одной простой связью: СН2=СН–СН=СН–СН3 (пентадиен-1,3)
Изолированные диены – соединения, в молекулах которых две двойные связи разделены более чем одной простой связью. СН2=СН–СН2–СН=СН2 (пентадиен-1,4)
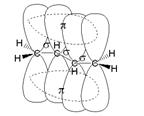 Рис. 1. Сопряжение орбиталей в бутадиене 1,3
Рис. 1. Сопряжение орбиталей в бутадиене 1,3
Рассмотрим строение сопряженного алкадиена бутадиена-1,3. Молекула имеет плоское строение. Рис. 1. Все 4 атома С в sp2-гибридизации, 2 двойных связи. Однако длина этих двойных связей (0,135 нм) больше, чем у алкена (0,133 нм), а простая связь между атомами углерода (0,146 нм) короче, чем связь С-С в алканах (0,154 нм).
Две сопряженных двойных связи в химических реакциях часто ведут себя, как единое целое. Почему?
Происходит частичное перекрывание π-электронных облаков между 2-м и 3-м атомами углерода, и четыре р-орбитали образуют единое π-электронное облако. Такой тип перекрывания орбиталей называют сопряжением. Четыре электрона не локализованы попарно на двойных связях, а распределены вдоль всей цепи – делокализованы. Рис. 2.
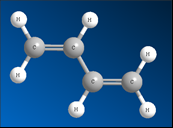 Рис. 2. Шаростержневая модель молекулы бутадиена-1,3
Рис. 2. Шаростержневая модель молекулы бутадиена-1,3
Типичные реакции – электрофильное присоединение.
Реакция с избытком брома:
СН2=CН–СH=СН2 + 2Вr2 ——® СН2Вr–CHВr–СHBr-СН2Br
При взаимодействии 1:1 образуется смесь.
Обычное присоединение:
СН2=CН–СH=СН2 + Вr2 ——® СН2Вr–CHВr–СH=СН2
Сопряженное присоединение:
СН2=CН–СH=СН2 + Вr2 ——® СН2Вr–СН=CH–СН2Вr
При сопряженном присоединении π-электронное облако диена участвует в реакции присоединения как единое целое.
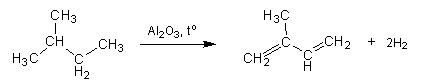
1. В промышленности бутадиен-1,3 и изопрен получают каталитическим дегидрированием бутана и 2-метилбутана, выделенных из фракций нефтеперегонки:
2. Бутадиен-1,3 в промышленности получают из этилового спирта по методу С.В.Лебедева:
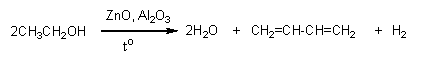
3. Лабораторный способ – реакции отщепления, например:
СН2Br-СН2-СН2-СН2Br + 2КОН ® СН2=СН-СН=СН2 + 2KBr + 2h3O
В промышленности диены используют для получения синтетического каучука.
Углеводороды, содержащие две и более двойные связи в молекуле – терпены – широко распространены в растительных организмах, часто обладают приятным запахом. Смеси терпенов используют в производстве духов и ароматических отдушек, а также в медицине.
Жизненно важен для человека b-каротин, который превращается в организме в витамин А, он содержится в красных и желтых плодах. Рис. 3. Красный цвет b-каротина обусловлен длинной цепочкой сопряженных двойных связей.
Реакции полимеризации. Важнейшим свойством диенов является способность полимеризоваться под воздействием катионов или свободных радикалов. Полимеризация этих соединений является основой получения синтетических каучуков:
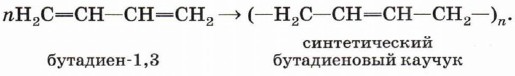
Полимеризация сопряжённых алкадиенов протекает как 1,4-присоединение. В этом случае двойная связь оказывается центральной в элементарном звене, а элементарное звено, в свою очередь, может принимать как цис-, так и транс-конфигурацию:

Реакции присоединения. Алкадиены способны присоединять водород, галогены, галогеноводороды.
Особенностью алкадиенов с сопряжёнными двойными связями является способность присоединять молекулы как в положения 1 и 2 (1,2-присоединение), так и в положения 1 и 4 (1,4-присоединение):
Рассмотрим причины, по которым в случае алкадиенов с сопряжёнными двойными связями возможно 1,4-присоединение на примере реакции гидробромирования (присоединения НВr). Реакция протекает по механизму электрофильного присоединения и начинаетс я с присоединения электрофильной частицы, катиона водорода, к молекуле алкадиена:
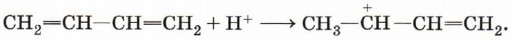
Присоединение к этому карбокатиону иона Вr- приведёт к продукту 1,2-присоединения:

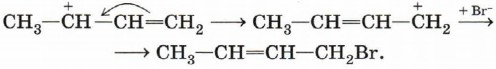
Положительный заряд на атоме углерода означает наличие незаполненной р-орбитали, которая может перекрываться с π-связью, перетягивая к себе электронную плотность. В результате этого происходит перемещение двойной связи в центр молекулы, а положительный заряд оказывается на крайнем атоме углерода. Присоединение к нему аниона брома приведёт к продукту 1,4-присоединения:
studfiles.net