Большая Энциклопедия Нефти и Газа. Бутилен вода
Что такое бутен и его применение в производстве полиэтилена
Бутилен, который также называют бутеном, является непредельным углеводородом. Это достаточно опасное вещество, которое имеет 4 класс опасности. По своим физическим свойствам, бутен и его производные изомеры (бутен 1, бутен 2, изобутен и др.) представляет собой бесцветный газ с ярко выраженным запахом, температура кипения которого составляет -6.6 оС. Плотность газа при нормальных атмосферных условиях составляет 2.5 кг/м3. Газ в сочетании с кислородом дает взрывоопасную смесь. Бутен обладает рядом химических свойств, которые обусловили его использование в производстве полиэтилена - сделаем подробный обзор химических особенностей данного вещества.
Общие сведения о бутене
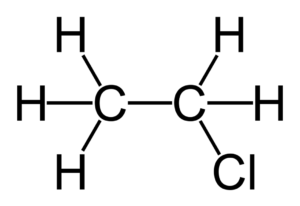
Бутен обладает свойствами, которые характерны для всех олефинов. Химическая формула бутена - С4Н8, также существуют множественные изомеры (в том числе альфа-бутилен, псевдобутилен или бета-бутилен, транс- и цис-изомеры бутена). Сам углеводород - это сополимер множества алкеновых углеводородов и их производных (пропен, пентен, гексен и т.д.).
Вещество очень плохо растворяется в воде, хорошо взаимодействует с органическими растворителями (эфиры и спирты). При присоединении молекул Н2 образуются галогеноводороды, при действии кислотных катализаторов с бутиленом образуются ароматические углеводороды и парафиновые производные, при окислительных реакциях с кислородом (при наличии катализаторов) бутен способен превращаться в эпоксиды, при щелочном воздействии получаются гликоли, а при взаимодействии с отдельными катализаторами можно получать изопропен, бутилкаучук и другие соединения.
Технология производства бутена
На сегодняшний день существует несколько способов промышленного получения бутена и (или) его производных:
- Олигомеризация этилена в присутствии катализатора - алюминия-3-этил;
- Димеризация при низких температурах этилена при наличии каталитических систем металлическо-органического типа на основе таких элементов, как цирконий, титан или никель;
- Получение вещества из углеводородных фракций на нефтехимических производствах;
- Проведение каталитического крекинга или пиролиза нефтяных газов или нефтепродуктов в жидком состоянии;
- Дегидрирование бутана и его производных изомеров при наличии алюмохромового катализатора.
Нельзя сказать наиболее распространенную процедуру получения бутена - все зависит от географии разработок и производства, а также от наличия возможностей работы с газом. В отечественных странах распространено получение бутилена с бутено-изобутеновых фракций, которые являются отработкой при производстве этилена и пропилена.
Использование бутена
Бутены широко используются для производства огромного количества веществ и материалов. Так, вещество применяют для производства бутадиена, полиизобутилена, каучука, антиоксидантов, алкиатов, полибутена, жидкого топлива, изопрена, полиэтилена. Наиболее распространена практика использования бутена для производства полиэтилена.
Полиэтилен высокой плотности является полиэтиленом, характерной особенностью которого является макромолекула со значительно разветвленной структурой и низкая плотность вещества. Изготовление проводится при очень высоком давлении. Чтобы изготовить такой полиэтилен, используется бутен 1, а также другие сополимеры этилена, благодаря которому достигаются необходимые химико-физические свойства конечного продукта. Для изготовления ЛПЭНП используются вещества, способные выстраивать линейную молекулу - этого возможно достичь за счет использования сополимеров, в отличие от гомополимеров при производстве ПЭВП.
Использование бутилена при изготовлении ЛПЭНП обуславливает его использование при производстве экструзивных продуктов (пленок, труб, кабельных изоляций, мембран и сеток), литьевых продуктов (в том числе товаров народного потребления, мебельной фурнитуры, ящиков, автомобильных комплектующих), а также ротоформированных продуктов (детских площадок, передвижных биотуалетов, эстакад, колодцев, различных емкостей наподобие мусорных баков и ведер, дорожных ограждений).
propolyethylene.ru
Бутилены
Вещество Пропилен Смесь бутана (80%) и бутилена (20%) 4 Диметило-вый эфир [c.170]
Бутилены. ... 1,534 Изобутилен. . . 1,934 Окись этилена.. 1,5 Бутадиен. ... 1,883 Пропан. .... 1.562 Хлористый метил 1,785 [c.165]
Положение осложнялось тем, что при разгерметизации трубопровода для бутан-бутилена жидкий продукт растекался в почве и, сравнительно медленно испаряясь, распространялся на большие расстояния от поврежденного участка. [c.28]
На некоторых заводах синтетического каучука дивинил получают путем каталитического дегидрирования бутиленов. Процесс дегидрирования производится в реакторах при температуре 580—630 °С. Поступающие со склада сжиженные бутилены (рис. 7) испаряются в испарителе 1, перегреваются в перегревателе 2, нагреваются в печи (на рисунке не показано) и подаются в реактор 3. В печи также перегревается водяной пар, который смешивается с бутиленами на входе в реактор 3. Контактный газ, который получается в процессе дегидрирования, проходит через котел-утилизатор [c.55]
Для ликвидации аварии немедленно был остановлен насос, который подавал бутилены с промежуточного склада, расположенного на расстоянии 500 м от установки дегидрирования, но продукт продолжал поступать за счет его наличия в трубопроводе, и пожар продолжался около часа. [c.57]
В производстве диметилдиоксана конденсацией из< бутилена с формальдегидом в кислой среде из произво] ственного цикла выводится большое количество ва содержащих серную кислоту и растворенные органик ские продукты. [c.170]
Сжиженные углеводородные газы получают путем разделения и очистки от сероводорода перечисленных газов на специальных заводах и установках методом абсорбции, ректификации или адсорбции. Непредельные углеводороды (этилен, пропилен, бутилены) содержатся исключительно в товарных смесях нефтеперерабатывающих заводов. [c.4]
Налив, слив и перевозка сжиженных углеводородных газов (пропана, бутана, пропилена, бутилена и их смесей) в железнодорожных цистернах регламентируются специальной инструкцией. [c.135]
Физические и химические свойства. Газы, известны все возможные изомеры (см. таблицу на стр. 19). Раств. в воде (3-Б, 0,2% (0°) хорошо растворяется во многих органических растворителях. Коэфф. раств. в воде 0,18620 (смесь а- и р-Б) в крови (бычьей дефибринированной) 0,481 0,267 (Р-Б.). Коэфф. распред. масло/вода 144—180 (20°) (смесь а- и р-Б.) 2500—3000 (37°) (p-изомер). При каталитическом окислении образуется окись бутилена. [c.22]
Получается из спирта по методу Лебедева, из бутилена (нефть) и ацетилена. Применяется в производстве СК. [c.24]
См. также Непредельные углеводороды с двойной связью, Бутилены. [c.26]
Действие на кожу и слизистые оболочки. При ежедневном (в течение 2 месяцев) нанесении на кожу морских свинок всех соединений только иодистый бутил и- октил вызывали воспаление. Признаки резорбтивного действия обнаружены при контакте кожи с иодистым бутилом, изобутилом и амилом. При аппликации последнего отмечена гибель животных. Легкое раздражение слизистой оболочки глаз кролика выявлено после внесения в конъюнктивальный мешок [c.280]
Получаются -Б. С. восстановлением кротонового альдегида, бутильно-ацето-новым брожением кукурузы, ячменя, отходов крахмально-паточного и сахарного производства, из отходов производства синтетического каучука, втор-Ъ. С. гидратацией бутилена, И. С. из сивушного масла или синтетически, трет-И. С. гидратацией изобутилена. [c.372]
Бутилены 19, 22 Бутилкарбинолы 364, 374 2-трет-Бутил-я-крезол 413 2-грег-Бутил-4-метилфенол 413 грег-Бутилперацетат 494 грег-Бутилпербензоат 495 трет-Бутилпероксид 494 я-грег-Бутилтолуол 109, 110 и-трет-Бутилфенол 412 Бутилцеллозольв 456 Бутин-2 30 [c.574]
Озокерит 53 Окись(и) аллилового спирта 479, 480 а- и -бутилена 485, 486 [c.580]
Экспериментально установлено, что величина У приблизительно одинакова для многих горючих газов и паров, в том числе для алканов, пропилена, бутилена, бензола, ацетона если инертный компонент азот, У = 11,0—13,5%. Для этилена и бутадиена У = 10,0— [c.65]
Извлечение изобутилена из газов дегидрирования бутилена [c.185]
В установке по извлечению изобутилена из газов дегидрирования бутилена должны быть выделены отделения приготовления кислоты и щелочи, насосная и помещение КИП. [c.185]
Все отдувки из аппаратов и емкостей, содержащие дивинил и бутилены, должны стравливаться в атмосферу через рассольный конденсатор и возвращаться в систему на циркуляцию (закрытые отдувки). [c.186]
В случаях, когда по условиям генерального плана завода или по другим соображениям возникает необходимость расположения цистерн с расходным количеством бутан-бутилена в помещении цеха, общая емкость их не должна превышать суточной потребности в сыром и суточной потребности в перегнанном бутан-бутилене. Емкости с бутан-бутиленом в этом случае должны располагаться непосредственно в реакторном отделении. [c.191]
Повышение температуры сырья на входе в реактор 0.1.0 Увеличение выхода кокса и глубины превращения 0.1.1 Падает уровень жидкой фазы в колонне К-201 0.1.3 Снижается выход бензина и увеличивается выход бутан-бутиле-новой фракции [c.265]
| Рис. 4.5. Вид здания насосного отделения после взрыва паров бутан-бутилено- |  |
В цехе экстрактивной дистилляции бутан-бутилено-вой фракции на одном заводе синтетического каучука сбрасывание с предохранительных клапанов, установленных на разделительных колоннах, производилось в атмосферу, в связи с чем часто создавалась загазованность углеводородами территории производства. [c.150]
В производственных условиях появления в воздухе значительных концентраций сжиженных газов при исправном содержании вентиляции и герметичности оборудования не наблюдается. Негёрметичность оборудования, допускаемая при эксплуатации, увеличивает содержание в воздухе сжиженных газов от нуля до нескольких тысяч миллиграммов на 1 м3 воздуха. Длительное пребывание человека в такой атмосфере оказывает вредное воздействие на его организм. Так, смесь, состоящая из пропана, бутана, пропилена, бутилена, изо-бутана с примесью дивинила, при концентрациях 100—314 мг/м3, а в единичных случаях при концентрациях 400—700 мг/м3 вызывала у работающих (после 2—5 лет работы) нарушение сна, головную боль, утомляемость, подавленное настроение.. Объективно установлено умеренное повышение сухожильных рефлексов ослабление конъюкти-вальных и роговичных рефлексов, дрожание век и языка, значительная вегетативно-сосудистая лабильность, красный дермографизм, повышение пиломоторного рефлекса, неустойчивость пульса при ортостатической пробе, а также снижение чувствительности в дистальных отделах конечностей, в некоторых случаях полиневриты. Состояние обследованных квалифицировалось как нев-ростенический синдром с сосудисто-вегетативными нарушениями. [c.21]
Человек. Ощущение запаха у человека при конц. Б. в воздухе 0,328 мг/л (Красовецкая, Малярова). У рабочих бутанового цеха (в воздухе, кроме Б., возможно наличие бутилена) — конъюнктивиты, снижение чувствительности роговицы. [c.14]
Общий характер действия. Действуют как сильные наркотики, хотя несколько слабее, чем метановые углеводороды. Действие усиливается с увеличением числа атомов углерода. Коэфф. раств. Н. У. в воде больше, чем метановых, поэтому наркотическое действие низших Н. У. при вдыхании сильнее, чем - метановых с тем же числом атомов углерода, хотя обнаруживается все же лишь при концентрациях порядка десятков процентов. Высшие члены ряда (гексилен, гептилен) обладают наряду с наркотическим судорожным действием, а также слабо раздражают дыхательные пути, что заметно уже при действии бутилена. Соединения с разветвленной цепью действуют слабее нормальных изомеров. Наркотическое действие снижается с удлинением углеродной цепи. [c.18]
Химический состав. В отличие от природного газа, Н. Г. содержат, кроме метана, большое количество высших предельных углеводородов, в них больше азота. Наиболее богаты метаном Н. Г. Кавказа (47,3—91,7%), больше всего его в Н. Г. Биби-Эйбатского -и Сураханского месторождений на долю углеводородов Сг—С)2 приходится все остальное количество содержание СОг достигает 5%. Примерно таков же состав Н. Г. Туркмении. Значительно больше высших углеводородов в Н. Г. Узбекистана, в них имеются также небольшие количества h3S. До 96,4% метана в Н. Г. Коми АССР. Значительно меньше его содержание в Н. Г. Татарской и Башкирской АССР, Оренбургской я Куйбышевской областей (30—70,9%). В этих Н. Г. содержится 0,1—2,5% HjS. В Н. Г. Ишимбаевских нефтей до 5% h3S. К- Г. и газы пиролиза содержат много непредельных углеводородов. В состав К. Г. входят, в зависимости от вида крекинга, 22—97% предельных ( i—С4), 15—27% непредельных (этилен — бутиле ) [c.81]
Первой публикацией, упомянувшей среди прочих данную аварию, стала работа [51аЫ,1949], она является важным материалом при изучении статистики аварий. В данной публикации говорится следующее "Совсем недавно в ходе событий последней войны, а именно 29 июля 1943 г., взрыв цистерны, содержащей 16,5 т смеси 80% бутадиена и 20% бутилена привел к гибели 57 чел. и ранению 439 чел. [c.313]
В работах [473—475] обнаружено, что при размораживании до — (40—80) °С твердых смесей пропилена и бутилена с двуокисью азота происходило их быстрое взаимодействие, способное принимать взрывной характер. Оставались однако невыясненными природа взрыва, причина протекания реакции только при размораживании, влияние состава на характер процесса и возможность эффективного предотвращения взрывов. Дальнейшие исследования показали, что реакция интенсивна только при определенных соотношениях содержаний компонентов. Так, для бурного взаимодействия пары СзН6+М02 наиболее благоприятно мольное соотношение 0=[С3Н6]/[Ш2]=ртах О,5. При отличии р от ртах в 2,5— 4 раза (в обе стороны) взаимодействие после размораживания теряет все черты взрывного. [c.286]
Несконденсировавшиеся пары углеводородов после разгонки бутан-бутилено-вой фракции должны стравливаться в общезаводскую топливную сеть или на факел. [c.192]
Взрывы и как их следствие пожары происходят на объектах, производящих взрывоопасные и химические вещества в системах и агрегатах, находящихся под большим давлением на газо- и продуктоводах и т.д. Наиболее взрыво- и пожароопасные смеси с воздухом образуются при истечении газообразных и сжижении углеводородных продуктов метана, пропана, бутана, этилена, пропилена, бутилена. Пожары на предприятиях возникают также вследствие повреждения электропроводки машин, наводящихся под напряжением топок и отопительных систем емкостей с легковоспламеняющимися жидкостями, нарушений правил техники безопасности. [c.219]
В производстве дивинилметилстирольного каучука на стадии синтеза в воздух производственных помещений выделяются пары предельных и непредельных углеводородов (бутан, изобутан, пропан, пентан, этан, этилен, пропилен, бутилен, изобутилен, дивинил). Конечные этапы этого производства характеризуются выделением паров дивинила, а-метилстирола, изопропил бензола,, уксусной кислоты. В производстве изопренового. каучука из изо-бутилена и формальдегида наблюдается выделение в воздух, диметилдиоксана и формальдегида. [c.422]
Для изготовления вентилей баллонов и заглушек применяются материалы, устойчивые против разрушительного воздействия газов, находящихся в баллонах. Например, вентили кислородного баллона и баллонов для азо-та, аргона, бутана, бутилена, водорода, воздуха, гелия, фреона, пропана, углекислоты, метана, этилена, хлор-метила и хлорэтила изготовляются из латуни, а не из стали, так как сталь быстро подвергается коррозии. Однако для таких газов, как хлор, фосген, аммиак и некоторые другие, корпуса вентилей применяются стальные, хотя возможен износ этих вентилей от коррозии, так как указанные выше газы при наличии влаги разъедающб действуют на металл. Это вызывает необходимость тщательной осушки аммиака, хлора и фосгена, а также самих баллонов и арматуры перед наполнением газами. Вентили баллонов для сернистого ангидрида по ГОСТ делаются стальные. [c.153]
ru-safety.info
Непредельные углеводороды. Алкены
Простейшим алкеном является этен C2h5.По номенклатуре IUPAC названия алкенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ен»; положение двойной связи указывается арабской цифрой.
Пространственная структура этилена
По названию первого представителя этого ряда - этилена - такие углеводороды называют этиленовыми.
Номенклатура и изомерия
Алкены простого строения часто называют, заменяя суффикс -ан в алканах на -илен : этан - этилен, пропан - пропилен и т.д.
По систематической номенклатуре названия этиленовых углеводородов производят заменой суффикса -ан в соответствующих алканах на суффикс -ен (алкан - алкен, этан - этен, пропан - пропен и т.д.). Выбор главной цепи и порядок названия тот же, что и для алканов. Однако в состав цепи должна обязательно входить двойная связь. Нумерацию цепи начинают с того конца, к которому ближе расположена эта связь. Например:


Иногда используют и рациональные названия. В этом случае все алкеновые углеводороды рассматривают как замещенные этилена:

Непредельные (алкеновые) радикалы называют тривиальными названиями или по систематической номенклатуре:
Н2С = СН - - винил (этенил)
Н2С = CН - СН2- -аллил (пропенил-2)
Для алкенов характерны два вида структурной изомерии. Кроме изомерии, связанной со строением углеродного скелета (как у алканов), появляется изомерия, зависящая от положения двойной связи в цепи. Это приводит к увеличению числа изомеров в ряду алкенов.
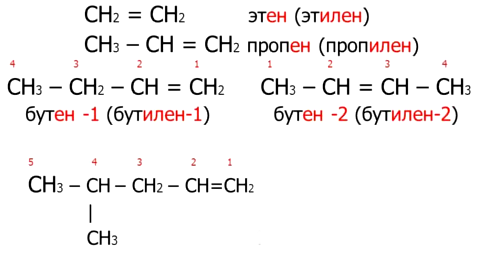
Первые два члена гомологического ряда алкенов -(этилен и пропилен) - изомеров не имеют и их строение можно выразить так:
h3C = Ch3 этилен (этен)
h3C = CH - Ch4 пропилен (пропен)
h3C = CH - Ch3 - Ch4 бутен-1
h4C - CH = CH - Ch4 бутен-2
Такая изомерия характерна для соединений с двойной связью.
Если простая σ -связь допускает свободное вращение отдельных звеньев углеродной цепи вокруг своей оси, то вокруг двойной связи такого вращения не происходит. Это и является причиной появления геометрических (цис-, транс-) изомеров.
Геометрическая изомерия - один из видов пространственной изомерии.
Изомеры, у которых одинаковые заместители (при разных углеродных атомах) расположены по одну сторону от двойной связи, называют цис-изомерами,а по разную - транс-изомерами:


Цис- и транс-изомеры отличаются не только пространственным строением, но и многими физическими и химическими свойствами. Транс-изомеры более устойчивы, чем цис-изомеры.
Получение алкенов
В природе алкены встречаются редко. Обычно газообразные алкены (этилен, пропилен, бутилены) выделяют из газов нефтепереработки (при крекинге) или попутных газов, а также из газов коксования угля.
В промышленности алкены получают дегидрированием алканов в присутствии катализатора (Сr2О3).
h4C - Ch3 - Ch3 - Ch4 → h3C = CH - Ch3 - Ch4 + h3↑ (бутен-1)
бутан
h4C - Ch3 - Ch3 - Ch4 → h4C - CH = CH - Ch4 + h3↑ (бутен-2)
Из лабораторных способов получения можно отметить следующие:
1. Отщепление галогеноводорода от галогеналкилов при действии на них спиртового раствора щелочи:


2. Гидрирование ацетилена в присутствии катализатора (Pd):
H-C ≡ C-H + h3 → h3C = Ch3
3. Дегидратация спиртов (отщепление воды). В качестве катализатора используют кислоты (серную или фосфорную) или Аl2O3:

В таких реакциях водород отщепляется от наименее гидрогенизированного (с наименьшим числом водородных атомов) углеродною атома (правило А.М.Зайцева):

Физические свойства
Физические свойства некоторых алкенов показаны в таблице ниже. Первые три представителя гомологического ряда алкенов (этилен, пропилен и бутилен) - газы, начиная с C5h20 (амилен, или пентен-1) - жидкости, а с С18Н36 - твердые вещества. С увеличением молекулярной массы повышаются температуры плавления и кипения. Алкены нормального строения кипят при более высокой температуре, чем их изомеры, имеющие изостроение. Температуры кипения цис-изомеров выше, чем транс-изомеров, а температуры плавления - наоборот.
Алкены плохо растворимы в воде (однако лучше, чем соответствующие алканы), но хорошо - в органических растворителях. Этилен и пропилен горят коптящим пламенем.
Название | Формула | t пл,°С | t кип,°С | d204 |
Этилен (этен) | С2Н4 | -169,1 | -103,7 | 0,5700 |
Пропилен (пропен) | С3Н6 | -187,6 | -47,7 | 0,5193* |
Бутилен (бутен-1) | C4H8 | -185,3 | -6,3 | 0,5951 |
Цис-бутен-2 | С4Н8 | -138,9 | 3,7 | 0,6213 |
Транс-бутен-2 | С4Н8 | -105,5 | 0,9 | 0,6042 |
Изобутилен (2-метилпропен) | С4Н8 | -140,4 | -7,0 | 0,5942* |
Амилен (пентен-1) | C5h20 | -165,2 | +30,1 | 0,6405 |
Гексилен (гексен-1) | С6Н12 | -139,8 | 63,5 | 0,6730 |
Гептилен (гептен-1) | C7h24 | -119 | 93,6 | 0,6970 |
Октилен (октен-1) | C8h26 | -101,7 | 121,3 | 0,7140 |
Нонилен (нонен-1) | C9h28 | -81,4 | 146,8 | 0,7290 |
Децилен (децен-1) | С10Н20 | -66,3 | 170,6 | 0,7410 |
* Жидкий
Алкены малополярны, но легко поляризуются.
Химические свойства
Алкены обладают значительной реакционной способностью. Их химические свойства определяются, главным образом, двойной углерод-углеродной связью.
π-Связь, как наименее прочная и более доступная, при действии реагента разрывается, а освободившиеся валентности углеродных атомов затрачиваются на присоединение атомов, из которых состоит молекула реагента. Это можно представить в виде схемы:

Таким образом, при реакциях присоединения двойная связь разрывается как бы наполовину (с сохранением σ-связи).
Для алкенов, кроме присоединения, характерны еще реакции окисления и полимеризации.
Реакции присоединения
Чаще реакции присоединения идут по гетеролитическому типу, являясь реакциями электрофильного присоединения.
1. Гидрирование (присоединение водорода). Алкены, присоединяя водород в присутствии катализаторов (Pt, Pd, Ni), переходят в предельные углеводороды - алканы:
Н2С = СН2 + h3→ Н3С - СН3 (этан)
этилен
2. Галогенирование (присоединение галогенов). Галогены легко присоединяются по месту разрыва двойной связи с образованием дигалогенопроизводных:
Н2С = СН2 + Cl2 → Clh3C - Ch3Cl (1,2-дихлорэтан)
Легче идет присоединение хлора и брома, труднее — иода. Фтор с алкенами, как и с алканами, взаимодействует со взрывом.
Сравните: у алкенов реакция галогенирования - процесс присоединения, а не замещения (как у алканов).
Реакцию галогенирования обычно проводят в растворителе при обычной температуре.
Присоединение брома и хлора к алкенам происходит по ионному, а не по радикальному механизму. Этот вывод следует из того, что скорость присоединения галогена не зависит от облучения, присутствия кислорода и других реагентов, инициирующих или ингибирующих радикальные процессы. На основании большого числа экспериментальных данных для этой реакции был предложен механизм, включающий несколько последовательных стадий. На первой стадии происходит поляризация молекулы галогена под действием электронов π-связи. Атом галогена, приобретающий некоторый дробный положительный заряд, образует с электронами π-связи нестабильный интермедиат, называемый π-комплексом или комплексом с переносом заряда. Следует отметить, что в π-комплексе галоген не образует направленной связи с каким-нибудь конкретным атомом углерода; в этом комплексе просто реализуется донорно-акцепторное взаимодействие электронной пары π-связи как донора и галогена как акцептора.

Далее π-комплекс превращается в циклический бромониевый ион. В процессе образования этого циклического катиона происходит гетеролитический разрыв связи Br-Br и пустая р-орбиталь sp2-гибридизованного атома углерода перекрывается с р-орбиталью "неподеленной пары" электронов атома галогена, образуя циклический ион бромония.

На последней, третьей стадии анион брома как нуклеофильный агент атакует один из атомов углерода бромониевого иона. Нуклеофильная атака бромид-иона приводит к раскрытию трехчленного цикла и образованию вицинального дибромида (vic-рядом). Эту стадию формально можно рассматривать как нуклеофильное замещение SN2 у атома углерода, где уходящей группой является Br+.

Результат этой реакции нетрудно предвидеть: анион брома атакует карбкатион с образованием дибромэтана.
Быстрое обесцвечивание раствора брома в СCl4 служит одним из простейших тестов на ненасыщенность, поскольку и алкены, и алкины, и диены быстро реагируют с бромом.
Присоединение брома к алкенам (реакция бромирования) - качественная реакция на предельные углеводороды. При пропускании через бромную воду (раствор брома в воде) непредельных углеводородов желтая окраска исчезает (в случае предельных - сохраняется).
3. Гидрогалогенирование (присоединение галогеноводородов). Алкены легко присоединяют галогенводороды:
h3С = СН2 + НВr → Н3С - Ch3Вr
Присоединение галогенводородов к гомологам этилена идет по правилу В.В.Марковникова (1837 - 1904): при обычных условиях водород галогенводорода присоединяется по месту двойной связи к наиболее гидрогенизированному атому углерода, а галоген — к менее гидрогенизированному:

Правило Марковникова можно объяснить тем, что у несимметричных алкенов (например, в пропилене) электронная плотность распределена неравномерно. Под влиянием метильной группы, связанной непосредственно с двойной связью, происходит смещение электронной плотности в сторону этой связи (на крайний углеродный атом).
Вследствие такого смещения p-связь поляризуется и на углеродных атомах возникают частичные заряды. Легко представить, что положительно заряженный ион водорода (протон) присоединится к атому углерода (электрофильное присоединение), имеющему частичный отрицательный заряд, а анион брома - к углероду с частичным положительным зарядом.
Такое присоединение является следствием взаимного влияния атомов в органической молекуле. Как известно, электроотрицательность атома углерода немного выше, чем водорода.
Поэтому в метильной группе наблюдается некоторая поляризация σ-связей С-Н, связанная со смещением электронной плотности от водородных атомов к углероду. В свою очередь это вызывает повышение электронной плотности в области двойной связи и особенно на ее крайнем, атоме. Таким образом, метильная группа, как и другие алкильные группы, выступает в качестве донора электронов. Однако в присутствии пероксидных соединений или О2 (когда реакция имеет радикальный характер) эта реакция может идти и против правила Марковникова.
По тем же причинам правило Марковникова соблюдается при присоединении к несимметричным алкенам не только галогеноводородов, но и других электрофильных реагентов (h3O, h3SО4, НОСl, ICl и др.).
4. Гидратация (присоединение воды). В присутствии катализаторов [h3SO4 (конц.) и др.] к алкенам присоединяется вода с образованием спиртов. Например:
h4C - CH = Ch3 + H - OH → h4C - CHOH - Ch4 (изопропиловый спирт)
Реакции окисления
Алкены окисляются легче, чем алканы. Продукты, образованные при окислении алкенов, и их строение зависят от строения алкенов и от условий проведения этой реакции.
1. Горение
Н2С = СН2 + 3O2 → 2СO2 + 2Н2O
2. Неполное каталитическое окисление

3. Окисление при обычной температуре. При действии на этилен водного раствора КМnO4 (при нормальных условиях, в нейтральной или щелочной среде - реакция Вагнера) происходит образование двухатомного спирта - этиленгликоля:
3h3C = Ch3 + 2KMnO4 + 4h3O → 3HOCh3 - Ch3OH (этиленгликоль)+ 2MnO2 + KOH
Эта реакция является качественной: фиолетовая окраска раствора перманганата калия изменяется при добавлении к нему непредельного соединения.
В более жестких условиях (окисление КМnO4 в присутствии серной кислоты или хромовой смесью) в алкене происходит разрыв двойной связи с образованием кислородсодержащих продуктов:
h4C - CH = CH - Ch4 + 2O2 → 2h4C - COOH (уксусная кислота)
Реакция изомеризации
При нагревании или в присутствии катализаторов алкены способны изомеризоваться - происходит перемещение двойной связи или установление изостроения.
Реакции полимеризации
За счет разрыва π-связей молекулы алкена могут соединяться друг с другом, образуя длинные цепные молекулы.

Нахождение в природе и физиологическая роль алкенов
В природе ациклические алкены практически не встречаются. Простейший представитель этого класса органических соединений - этилен C2h5 - является гормоном для растений и в незначительном количестве в них синтезируется.
Один из немногих природных алкенов - мускалур (цис-трикозен-9) является половым аттрактантом самки домашней мухи (Musca domestica).
Низшие алкены в высоких концентрациях обладают наркотическим эффектом. Высшие члены ряда также вызывают судороги и раздражение слизистых оболочек дыхательных путей
Отдельные представители
Этилен (этен) - органическое химическое соединение,описываемое формулой С2h5. Является простейшим алкеном . Содержит двойную связь и поэтому относится к ненасыщенным или непредельным углеводородам. Играет чрезвычайно важную роль в промышленности, а также является фитогормоном (низкомолекулярные органические вещества, вырабатываемые растениями и имеющие регуляторные функции).
Этилен - вызывает наркоз, обладает раздражающим и мутагенным действием.
Этилен - самое производимое органическое соединение в мире; общее мировое производство этилена в 2008 году составило 113 миллионов тонн и продолжает расти на 2-3% в год.
Этилен является ведущим продуктом основного органического синтеза и применяется для получения полиэтилена (1-е место, до 60 % всего объёма).
Полиэтилен - термопластичный полимер этилена . Самый распространенный в мире пластик.
Представляет собой воскообразную массу белого цвета (тонкие листы прозрачный бесцветны). Химически- и морозостоек, изолятор, не чувствителен к удару (амортизатор), при нагревании размягчается (80-120°С), при охлаждении застывает, адгезия (сцепление поверхностей разнородных твёрдых и/или жидких тел) - чрезвычайно низкая. Иногда в народном сознании отождествляется с целлофаном - похожим материалом растительного происхождения.
Пропилен - вызывает наркоз (сильнее, чем этилен), оказывает общетоксическое и мутагенное действие.
Устойчив к действию воды, не реагирует с щелочами любой концентрации, с растворами нейтральных, кислых и основных солей, органическими и неорганическими кислотами, даже концентрированной серной кислоты, но разлагается при действии 50%-ой азотной кислоты при комнатной температуре и под воздействием жидкого и газообразного хлора и фтора. Со временем, происходит термостарение.
- Полиэтиленовая плёнка (особенно упаковочных, например, пузырчатая упаковка или скотч ).
- Тара ( бутылки , банки , ящики , канистры , садовые лейки , горшки для рассады.
- Полимерные трубы для канализации , дренажа , водо-, газоснабжения.

- Электроизоляционный материал.
- Полиэтиленовый порошок используется как термоклей.

Бутен-2 - вызывает наркоз, обладает раздражающим действием.
examchemistry.com
Большая Энциклопедия Нефти и Газа, статья, страница 2
Бутилен
Cтраница 2
Бутилен, бутен-1, а-бутилен СНзСНгСН-СНг, бесцветный горючий газ. С; теплота сгорания 10800 ккал / кг; растворимость в воде незначительная. Минимальное взрывоопасное содержание кислорода при разбавлении бутилено-воздушных смесей углекислым газом 14 0 % объемн. Для предупреждения взрыва при аварийном истечении бутилена и тушения факела в закрытых объемах минимальная концентрация двуокиси углерода 33 % объемн. [16]
Бутилен по своей активности немногим отличается от псевдобутилена и со всеми кислотами дает тоже втор, бутиловые эфиры соответствующих кислот, но с более низкими выходами. Характер присоединения уксусной кислоты к этим двум нормальным бутиленам при одинаковых температурах имеет много общего. При 50 выход втор, бутилацетата непрерывно возрастает, не достигая максимума в течение 48 час. При 97 реакция эфирообразования вначале идет быстро, затем замедляется, выход втор, бутилацетата достигает 48 % для ас-бутилена в течение 8 час. [17]
Бутилен получают при каталитической дегидратации н-бутилового спирта над окисью алюминия на обычной каталитической установке при 360 - 370 и скорости подачи 0 6 мл спирта на 1 мл. Конец змеевика погружают почти до дна в точно так же охлаждаемую толстостенную бутылку ( из-под шампанского) с 75-процентной серной кислотой. В бутылку емкостью 0 8 л загружается 230 г 75-процентного раствора серной кислоты ( уд. Конец поглощения - бутилена определяется взвешиванием бутылки. Реакционная смесь разбавляется водой, пока KOHV центрация кислоты не достигнет 20 - 40 %, после чего можно отгонять спирт. [18]
Бутилен этот обладает неприятным запахом, близким к запаху светильного газа; сгорая, он дает сильно светящее, коптящее пламя; бром, крепкая серная кислота и дымящаяся иодоводородная кислота быстро поглощают его. При обыкновенной температуре ( 15 - 18) газ требует около 2 - 2J / 2 атмосфер давления для сгущения в жидкость. Сгущенный охлаждением, он кипит при - 7 - 8 под давлением ( редуцир. [19]
Бутилен, промытый сначала спиртом, потом водой, собирается в газометр. В промывном спирте каждый раз собирается немного эфирного продукта, который может быть выделен водой. Для превращения бутилена в триметилкар бинол посредством серной кислоты необходимо было найти возможность поглощать бутилен кислотой, настолько разведенной, чтобы образование маслообразных продуктов ( уплотнение бутилена. Смесь эта при простом пропускании в нее бутилена почти вовсе не поглощает его, но поглощение совершается довольно легко в описываемом снаряде. Снаряд имеет вид вертикально стоящего либиховского холодильника в 5 - 6 дециметр, длиною, внутренняя его трубка, шириной около центи-метра во внутреннем поперечнике, наполнена крупнотолченым стеклом. Оба конца этой трубки закрыты каучуковыми пробками. Сквозь нижнюю пробку проходят две тонкие трубочки. Первая из трубочек, приводящая газ, проникает в массу толченого стекла на дециметр от пробки, конец второй трубочки, служащей для постоянного стока кислоты, поглотившей бутилен, находится внутри снаряда наравне с внутренней поверхностью пробки; вне снаряда эта последняя трубка загибается кверху и, приподнявшись приблизительно на 8 центиметров, загибается немного книзу, оканчиваясь коротким крючком. Таким образом, она во все время опыта остается наполненная жидкостью и не пропустит газа. Сквозь верхнюю пробку проходят трубка, служащая для отвода непоглощенных газов, и конец трубчатой воронки, снабженной краном, сквозь которую медленно, по каплям, постоянно протекает кислота, смачивающая весь столб толченого стекла. Бутилен пропускается в снаряд высушенный, медленной струей; во все время поглощения в снаряде циркулирует охлаждающая вода. При таком расположении опыта кислота указанной выше концентрации поглощает бутилен почти сполна: при обработке приблизительно S1 / литров бутилена в шаровом снарядике, содержащем концентрированную иодоводородную кислоту и соединенном с отводящей трубкой поглотительного снаряда, образовалась только капля иодюра, а между тем известно, что бутилен чрезвычайно легко превращается в него. [20]
Бутилен хорошо поглощается серной кислотой ( 3 части кислоты и 1 часть воды): при перегонке с водою получается триметилкарбинол. [21]
Бутилен выделяют путем экстрактивной дистилляции с водным ацетоном. [22]
Бутилен, меченный С14 в положении 1, 210 - 220, 90 эти. [23]
Бутилен полимеризовался в значительно меньшей степени. [25]
Бутилен, полученный разложением нормального бутилового спирта ( Кальбаум) над АЬОз, очищенный от изобутилена многократным пропусканием через 70 % Ш304 и, после пропускания через раствор КОН и СаСЬ, многократно фракционированный в вакууме. [26]
Бутилен - газообразное вещество, а додекан представляет собой жидкость, кипящую при 216 С. [27]
Бутилен - 1 гари однократном пропускании через. Что касается первой фазы конденсации этилена, то, по Пизу, она состоит в том, что этилен превращается в бутилен. К сожалению, строение бутилена, полученного под атмосферным давлением, установлено не. [28]
Бутилен собирается в газометр. [29]
Бутилен растворим в воде. В 1 объеме воды растворяется при 0СС и парциальном давлении газа 760 мм рт. ст. 0 26 и при 20 С - 0 17 объемов - бутилена. [30]
Страницы: 1 2 3 4
www.ngpedia.ru
Вода изобутилена - Справочник химика 21
Гидратация изобутилена в т/)ет-бутиловый спирт идет в очень разбавленных растворах серной, соляной и азотной кислот, а также ив муравьиной, уксусной и щавелевой кислотах. Было определено равновесие между изобутиленом, т/)ет-бутиловым спиртом и водой [31, 42]. [c.355]Гидратацию изобутилена можно осуществить в разбавленных водных растворах сильных кислот (НС1, НВг) при комнатной температуре без катализатора. Кинетические определения показали, что скорость присоединения воды к изобутилену прямо пропорциональна концентрации ионов водорода в растворе, и гидратация протекает по следующей схеме, которая включает образование промежуточного карбокатиона [c.193]
Контактный газ поступает в каскад теплообменников 3, концевые аппараты которого охлаждаются рассолом, и практически полностью конденсируется. Конденсат, состоящий из двух фаз — органической и водной — расслаивается в емкости 4. Органическая фаза поступает в отмывочную колонну 5, где происходит извлечение растворенного формальдегида водой. Отмытый продукт направляют в ректификационную колонну 6, где изобутилен и изопрен с примесью некоторых низкокипящих продуктов отделяются от ДМД и других менее летучих веществ. [c.706]Регенерировать изобутилен из сернокислотного раствора можно различными способами. Один из них состоит в том, что серную кислоту разбавляют водой до такой концентрации, при которой образовавшийся в результате гидролиза трете-бутиловый спирт пе может дегидрироваться. Следовательно, перегнав с водяным паром продукты гидролиза, можно получить трет-бутиловый спирт, который затем легко дегидратируется в чистый изобутилен под действием катализаторов. Этот метод относительно дорог, требует особых материалов для изготовления аппаратуры, устойчивой к корродирующему действию разбавленной серной кислоты, но зато дает возможность получать весьма чистый изобутилен. [c.187]
Образующийся газ направляют через спиралеобразный стеклянный холодильник, погруженный в баню со льдом и солью, в котором отделяются спирт и вода. Изобутилен конденсируют при охлаждении смесью твердого диоксида [c.30]
Чтобы предотвратить попадание влаги в аппараты, необходимо материалы, используемые в синтезе ТИБА, освобождать от влаги. Например, изобутилен осушают в аппаратах, заполненных хлористым кальцием. По мере насыщения водой хлористый кальций заменяют свежим. Содержание влаги в изобутилене не должно превышать 0,001% (масс.). В трансформаторном и индустриальном, (веретенном) маслах, применяемых в производстве ТИБА в качестве тепло- и хладоносителей, а также в качестве разбавителя шлама, присутствие влаги не допускается. Замасленный шлам толуола после промывки аппаратов и трубопроводов и отработанное масло сжигают в печи, обогреваемой природным газом. Распыление продуктов сжигания осуществляется форсунками, в которые подается азот для обеспечения полного сгорания в печь-подают сжатый воздух. [c.153]
МПа. Реактор снабжен электрообогревом. Температуру замеряют термопарой и регулируют лабораторным трансформатором. Вначале изобутилен из баллона заливают в буфер (сосуд для сырья), откуда в реактор он вытесняется глицерином, подаваемым в буфер дозировочным насосом. В реактор подают также дистиллированную воду дозировочным насосом в мольном соотношении вода изобутилен— 1 4. В течение 1 ч подают 1 моль нзобутилена. При гидратации получают водные (10— 40 %-ные) растворы спирта. [c.120]
НОЙ температуре, дает высокие выходы сложных эфиров с камфеном и с некоторыми другими терпенами, а также дает хорошие выходы с третичными олефинами, как изобутилен и триметилэтилен. Бутилены и амилены нормального строения при нагревании с уксусной кислотой (содержащей 1% серной кислоты) при 100° дают 50—60% эфиров, однако этот процесс в промышленности успеха не имел. По-видимому, здесь сначала образуется алкилсульфат. Если сначала пропилен поглощается 88%-ной серной кислотой, а затем добавляется уксусная кислота, то при прибавлении воды можно получить изопропилацетат. Если же пропилен пропускается в смесь серной и уксусной кислот, то выход эфира может достигнуть 60%, но скорость поглощения значительно меньше, чем для одной серной кислоты [36]. [c.385]
Эта реакция может протекать в гомогенной газовой фазе, двухфазной системе изобутилен (газ) — вода (жидкость) и в системе изобутилен (жидкость) — вода (жидкость) [11]. Процесс выделения изобутилена по данному методу состоит из двух основных стадий 1) гидратации изобутилена в грет-бутиловый спирт и 2) дегидратация грег-бутилового спирта. - —------ [c.727]
Третичные спирты. Изобутилен активно поглощается 60—65%-ной серной кислотой, а под давлением — даже более слабым раствором кислоты, причем количество поглощенного изобутилена зависит скорее от наличия воды, чем от содержания кислоты. Например, при концентрации серной кислоты 35% поглощение может составлять до 7,2 моля изобутилена на 1 моль серной кислоты [250]. При этом очевидно, что олефин присутствует в растворе в виде спирта. Подобным образом пять эквивалентов триметилэтилена можно растворить в 46/6-ной кислоте [251]. Поскольку даже разбавленные кислотные растворы олефинов с третичным углеродным атомом выделяют олефин при нагревании, реакционную смесь обычно нейтрализуют перед ступенью гидролиза. [c.578]
Скорость гидратации олефинов Са—С4 в идентичных условиях возрастает с увеличением молекулярного веса углеводорода. Разветвленная структура обусловливает большую скорость реакции так, изобутилен присоединяет воду с заметно большей скоростью, чем линейные 1- и 2-бутены. Правда, при этом скорости побочных реакций тоже больше. [c.193]
Смеси, из которых получается бутадиен, состоят из большого числа веществ. Основными компонентами этих смесей являются изобутан, н-бутан, изобутилен, бутилен-1, бутилены-2 и бутадиен-1,3. Большое значение имеет также примесь ацетиленовых углеводородов, оказывающих вредное влияние в процессе полимеризации бутадиена. Выделение бутиленов и бутадиена из этих смесей методами обычной ректификации невозможно, поэтому разделение производится с использованием обычной, а также азеотропной и экстрактивной ректификации. Наибольшее затруднение вызывает разделение смесей н-бутана и бутиленов-2, изобутана и бутилена-1, а также бутадиена и бутена-1. Оно осуществляется с помощью экстрактивной ректификации. В качестве разделяющих агентов для последней было испытано большое число полярных веществ в чистом виде и с добавкой воды [291], а также смесей различных веществ [292]. Наибольшее практическое применение в настоящее время получили фурфурол [258, 293—296], ацетон [297] и фенол, содержащий от 2 до 10% воды [298]. [c.277]
Один или два момента заслуживают специального рассмотрения с точки зрения проведения эксперимента. При использовании хлорного олова возможно, что алкилгалогеииды все еще содержат следы воды, которые недостаточны для заметной полимеризации в четыреххлористом углероде, но достаточны для того, чтобы сделать полимеризацию заметной в полярных растворителях. При применении четыреххлористого титана маловероятно, чтобы при полимеризации изобутилеиа образовывалось какое-то вещество, которое ингибировало бы последующую полимеризацию стирола в условиях отсутствия влаги и не ингибировало ее, когда присутствовало достаточно воды для образования каталитического гидрата. Между наблюдаемыми фактами имеется кажущееся противоречие. С одной стороны, полимеризация стирола под действием четыреххлористого титана в хлористом метилене всегда протекает до конца, как бы мало воды ни присутствовало [271. Это означает, если вода является единственным присутствующим сокатализатором, что она не расходуется. С другой стороны, более раннее наблюдение свидетельствует о том, что скорость полимеризации последовательных порций стирола, прибавляемых к раствору четыреххлористого титана в дихлорэтане, постоянно уменьшается, указывая на расходование воды [33]. Различие, вероятно, обусловлено разложением четыреххлористого титана в результате гидролиза в более ранней работе, где количество присутствующей воды было относительно большим и температура значительно более высокой [37]. Все это иллюстрирует исключительную трудность убедительной демонстрации наличия сокаталитической активности в системах, где скорость реакции нельзя довести до нуля. Возможно, что найденное различие между хлорным оловом и четыреххлористым титаном действительно существует, однако было бы интересно применить методику, сходную с методикой удаления воды изобутиленом, к системам с хлорным [c.211]
Насыщенная изобутиленом серная кислота в дальнейшем подвергается гидролизу, отгонке изобутилена и образовавшегося триметилкарбинола и воды. [c.255]
В котором конденсируются вода и спирт. Газожидкостная смесь поступает в сепаратор И, откуда жидкость возвращается в дегидрататор 9, а газ поступает в скруббер 13. Из куба нижней части аппарата 9 выводится вода и димеры изобутилена. В отстойнике 12 углеводороды отслаиваются от воды и выводятся из системы. Вода подается на орошение скруббера 13, в котором производится отмывка изобутилена от трет-бутилового спирта. Отмытый изобутилен направляется на ректификацию с последующей азеотропной осушкой. [c.233]
Первая стадия процесса (конденсация изобутилена с формальдегидом) проводится в двух трубчатых реакторах 1 и 2, охлаждаемых водой. Изобутиленовая фракция и соединенный с ней возвратный (циркуляционный) изобутилен подаются в реактор 2 и из него в реактор 1, в который противотоком поступает водный раствор формальдегида, подкисленный серной кислотой. Верхние и нижние части реакторов работают как сепараторы, разделяя реакционную массу на углеводородный и водный слои. В углеводородный слой переходит ДМД, в водном [c.334]
Гидратация изобутилена на ионитах протекает по такому же механизму, что и гидратация пропилена (см. с. 231). Повышенная реакционная способность изобутилена позволяет проводить процесс в более мягких условиях при температуре не выше 90 С и давлении около 2,0 МПа. Для повышения растворимости изобутилена в воде в реакционную массу вводится полярный растворитель — этилцеллозольв (массовое соотношение вода/растворитель равно 1 1), а для создания устойчивой эмульсии вода—изобутилен используется неионоген-иый эмульгатор—синтанол ДС-10 в количестве 1% от массы воды. Мольное соотношение вода/изобутилен равно 28 1. [c.232]
Ди-/прет-бутилсульфоксид при 75° С разлагается, давая воду, изобутилен и 2-метил-пропил-2,2-метилпропан-2-тиосульфинат [37]. Авторы полагают, что разложение идет через циклическое переходное состояние, в котором распад С—S-связи происходит одновременно с переносом протона от Р-углерода к сульфоксид-ному кислороду (по механизму Ei — внутримолекулярного элиминирования)-- [c.158]
В опытах использовали изобутан 95%-ной чистоты (основной примесью был н-бутан, а пропан содержался в виде следов). Чистота бутена-1 превышала 99%, транс-бутт-2 был 92%-ный (остальное — цыс-бутен-2 и н-бутан), цыс-бутен-2 был примерно 80%-ный (остальное транс-бутен-2), изобутилен имел чистоту свыше 99% (со следами бутена-2), 2,2,4-триметилпентен-1 был 99,8%-ным. Для получения кислоты требуемой концентрации смешивали 95—96%-ную дымящую, использованную (или отработанную в процессе алкилирования) серную кислоту и воду. Отрабо- [c.88]
В других опытах [39] изобутилен пропускался в 67 %-ную серную кислоту при температуре ниже 20°. При этой температуре изобутилен поглощался с образованием т/гет-бутилового спирта, но образования полимера не наблюдалось. Полученная смесь затем нагревалась до 70—100° и реакция полимеризации происходила как в неразбавленной смеси, так и в разбавленном водой растворе серной кислоты с концентрацией последней, равной соответственно 66 и 58%. Во время нагревания часть изобутилена регенерировалась, причем количество регенерированного изобутилена было больше при большем насыщении им серной кислоты. При применении перемешивания или при добавлении к раствору твердого пористого материала количество регенерированного изобутилена увеличивалось. При разбавлении серной кислоты полимеризация тормозилась, но увеличивалось содержание диизобутилена в продукте полимеризации, а также повышалась степень регенерации изобутилена. Содержание диизобутилена увеличивалось также с повышением температуры реакции. Если раствор полимеризовался при комнатной температуре в течение длительного времени, то образовывались небольшие количества диизобутилена и большие количества триизобутилена. При исследовании продукта полимеризации в ходе этой реакции было замечено, что количество образовавшегося диизобутилена было значительно большим в начале реакции, т. е. когда раствор содержал больше 7ирет-бутилового спирта. [c.193]
О до 40° при перемешивании в автоклаве, охлаждаемом водой. Однако при добавлении таких более реакционноснособных олефинов, как изобутилен и изопентены, пропилен легко реагировал с олефинами изостроения с большим выходом гептеновой и октеновой фракций. Диоксифторборная кислота, таким образом, использовалась в качестве катализатора для сополимеризации пропилена с изопентеном, пропена с изобутиленом, бутена-1 с изобутиленом, бутена-2 с изобутиленом и смеси -бутиленов с изобутиленом при температурах от О до 40° и давлении от 3,4 до 8,5 ат. Полимеры гидрировались, подвергались фракционированной перегонке, а полученные фракции анализировались методом инфракрасной спектроскопии. Гидрирование сополимера пропилена и изобутилена давало продукт, содержавший 67 % гептановой фракции, состоявшей на 95 % из 2,3-диметилпентана. [c.201]
Дегидратация проводится в реакторе колонного типа, верхняя часть которого заполнена катализатором, а нижняя представляет собой исчерпывающую часть ректификационной колонны. Из верхней части дегидрататора выводится изобутилен, который после осушки и ректификации является готовым продуктом. Воду из нижней части дегидрататора подают в рецикл. Водный раствор растворителя и воду, возвращаемую в рецикл, подвергают ионито-вой очистке от ионов железа. [c.731]
В течение 4 ч 84 г технического третичного бутилоиого С1шрта (что соответствует 74 г абсолютного третичного бути юиого спирта). Образующийся изобутилен, пройдя обратный холодильник, две и-образные трубки, наполненные безводным зерненым хлористым кальцием (для освобождения от паров воды), и счетчик пузырьков газа, поступает в газометр (рис. 79). Образующиеся пары воды, конденсируясь в обратном холодильнике, возвраща- [c.348]
В реакционную колбу помещают 5 г м-толуолсульфокислоты и при 110 °С в колбу по каплям вносят до 10 моль технического тре-тично1 о бутилового спирта. Почти моментально спирт дегидратируется, и образовавшийся изобутилен, пройдя обратный холодильник, прямой холодильник, ловушку для воды, супшльпые колонки и счетчик пузырьков, поступает в газометр. [c.349]
Органический слой с верха сепаратора 12 подают последовательно в две ректификационные колонны. В первой (13) отгоняют образе вавшийся при разложении диоксана изобутилен, который возврз1цают на первую стадию синтеза. Затем в колонне 14 отделяют изопрен от более высококипящего остатка (непревращенный диоксан и побочные продукты). Для окончательной очистки изопрен громывают водой, осушают азеотропной перегонкой и прово- 1ят заключительную ректификацию. На этих стадиях к нему во из-Г)еж .11ие полимеризации добавляют ингибитор. [c.559]
В производстве ионола на стадии алкилирования фенола изобутиленом образуются сточные воды, содержащие алкилфенолы. Очистка сточных и ливневых вод от алкилфенолов производится их экстракцией диизо-пропиловым эфиром (ДИПЭ). Обесфеноленная вода в зависимости от анализов поступает на отпарку углеводородов или в химзаводскую канализацию. Используемая в качестве экстрактора тарельчатая колонна из-за недостаточно развитой поверхности контакта фаз, особенно при большом объеме ливневых вод, работает в напряженном режиме. В это время возможен проскок загрязнений со сбрасываемой водой. [c.12]
МПа и поступает в буфер-испаритель 3, в котором испаряются углеводороды С4, в том числе и непревращенный изобутилен. Из нижней части буфера 3 раствор /прт-бутилового спирта в водном этилцеллозольве поступает на питание ректификационной колонны 4, с верха которой отгоняют водный азеотроп спирта вместе с оставшимися легкими углеводородами. Этот поток направляют в колонну 5, погоном которой являются углеводороды С4, а кубовым продуктом —. водный азеотроп тргт-бутилового спирта. Кубовый продукт колонны 4, представляющий собой смесь воды, этилцеллозольва и эмульгатора, проходит теплообменники б и 7 и поступает в систему ионитных фильтров 8, в которых освобождается от ионов 50 и Ре , после чего возвращается на гидратацию. [c.232]
Водный азеотроп трет-бутиловото спирта, содержащий 88% (масс.) спирта, из куба колонны 5 подается в дегидрататор 9, состоящий из двух частей нижней, представляющей собой ректификационную колонну, и верхней, являющейся реактором и загруженной сульфокатионитом. Азеотроп вводится в верхнюю часть ректификационной колонны, в которой происходит отделение воды. На катализатор поступают пары с высокой концентрацией спирта. В слое катализатора поддерживается температура 80—90 Т. Из верхней части аппарата Р изобутилен вместе с парами непрореагировавшего спирта и воды поступает в конденсатор 10, [c.233]
Кроме диоксана и непрореагировавших реагентов, в продуктах реакции были обнаружены изопрен, триметилкарбинол (ТМК), полимеры изобутилена (ПИ), З-метил-З-бутен-1-ол и З-метил-2-бутен-1-ол (НС), не растворимый в воде и органике Ег — полиоксиметилен, смолообразные продукты (предположительно сополимеры изобутилена и триоксана). Выход 4,4-диметилдиоксана-1,3 в лучшем опыте t = 75°С, Н2304 = 26%, т = 42 мин) составил 65,2% в расчете на взятый триоксан при конверсии более 90% (молярное отношение изобутилен триоксан практически не оказывает влияния на выход диоксана, т. к. деполимеризация тримера происходит во времени и олефин всегда оказывается в избытке). Влияние температуры, продолжительности и количества катализатора однотипное при низких значениях этих параметров преобладает реакция образования полиоксиметиленов, при высоких— идет смолообразование. [c.144]
Сепарация олефинов основана на различии в летучести разных соединений. Она осуществляется так же, как и сепарация углеводородов парафинового ряда (табл. 48). Пропилен и бутилены могут быть разогнаны и сконденсированы при давлении около 1519,8 кПа и охлаждении водой, имеющей температуру окружающей среды. Оставшиеся этилен и легкие газы нуждаются в абсорбционно-рефрижерационном методе разгонки. Различные бутилены обычно сепарируются благодаря их химическому взаимодействию с растворяющими кислотами с водным раствором серной кислоты первым реагирует изобутилен, затем бутен-2 и бутен-1. Следовательно, для производства каждого из этих газов в относительно чистом виде может быть применен метод проти-воточной экстракции. [c.234]
chem21.info
Превращение - бутилен - Большая Энциклопедия Нефти и Газа, статья, страница 2
Превращение - бутилен
Cтраница 2
Таким образом, на хромовом катализаторе скорость прямого превращения бутана в дивинил не превышает 5 % от скорости превращения бутана в бутилен, а скорость превращения бутана в бутилен составляет около 2 % от скорости превращения бутилена в дивинил. Представлял ось интересным выяснить соотношение этих скоростей в условиях, более благоприятных превращению бутана в бутилен. [16]
Так, например, в работах, проведенных в лаборатории катализа ИХФ АН СССР, показано, что при введении ряда последовательных импульсов бутилена в газ-носитель - чистый гелий ( не содержащий даже следов кислорода) на железо-хромовом промотированном окисном катализаторе уже при 80 в первых импульсах наблюдались высокие степени превращения бутилена в дивинил без одновременного выделения водорода. [17]
Составить материальный баланс установки алкилирования бутан-бу-тиленовой фракции производительностью 60000 т / год, если известно: состав сырья ( в % масс.): С3Н8 2 9; u30 - Cth20 37 0; я - и изо - С4Н8 24 5; я - С4Н о 23 2; CsHio 5 5; СбН12 6 9; глубина превращения бутиленов 100 % и амиленов 95 %; алкилат состоит из 95 % авиаалкилата и 5 % автоалкилата; общая масса изо-бутана, вступающего в реакцию, 102 % от бутиленов. [18]
Выступление Бутлерова подробно развито в статье О бутилене из бутилыюго алкоголя брожения ( см. наст, том, стр. Превращение бутилена в кротонилен описано Бутлеровым в статье О химическом строении некоторых непредельных углеводородов ( см. наст, том, стр. [19]
Низкомолекулярные алкены ( этилен, пропилен, бутилен) мало изменяются при 400 С в присутствии алюмосиликатного катализатора. При 500 С глубина превращения бутилена увеличивается; наблюдается его распад, изомеризация, перераспределение водорода и полимеризация. В продуктах крекинга содержится большое количество изобутилена и до 21 % жидких углеводородов. С увеличением молекулы алкена требуется меньшая температура для протекания реакции полимеризации и распада. В присутствии катализаторов превращение высокомолекулярных алкенов начинается при комнатной температуре. При сравнительно низкой температуре алкены превращаются в полимеры, а при высокой температуре они распадаются. [20]
В интервале температур 410 - 490 С скорость основной и побочных реакций не зависит от концентрации кислорода, если парциальное давление его выше 0 03 атм, и от концентрации водяного пара, если содержание его выше 10 мол. Снижение концентрации водяного пара приводит к уменьшению скорости превращения бутилена и избирательности, что связано с увеличением скорости глубокого окисления углеводородов. Продукты реакции - бутадиен и углекислый газ - практически не оказывают тормозящего влияния на скорость процесса. [21]
С целью определения пригодности различных материалов в качестве носителя катализатора проведены сравнительные опыты по окислению бутилена кислородом на кварце, силикагеле КСК, диатомите и окиси алюминия. На рис. 2 представлены данные о зависимости степени превращения бутилена на различных носителях от температуры, из которых видно, что степень превращения на всех применяемых материалах увеличивается с увеличением их поверхности и температуры контактирования. При 550 и 650 конверсия бутилена на кварце составляла соответственно 18 и 40 %, на силикагеле ( 5УД 330 м2 / г) она увеличивалась до 27 и 57 %, а на диатомовом носителе ( 5УД 7 м2 / г) кривая занимает промежуточное положение. Относительное количество дивинила ( образующегося из превращенного бутилена) и продуктов глубокого окисления уменьшается с увеличением температуры, в то время как продукты крекинга и кислородсодержащие соединения ( рис. 3), а также степень превращения кислорода возрастают с повышением температуры. Окись алюминия катализирует главным образом процесс полного окисления бутиленов. [23]
Количество энергии, необходимое для разрыва связи С-С, понижается с увеличением длины цепи углеводорода и составляет при расщеплении бутана на этан и этилен 32 ккал / моль, декана на пентан и пентен 29 ккал / моль, эйкозана на декан и децен 12 ккал / моль. Расщепление олефинов требует большей затраты энергии, например, для превращения бутилена в этилен нужно 41 ккал / моль, а децена в пентен 30 ккал / моль. [24]
Правда, при получении бутилена мне не удалось обойти употребления иодюра, но зато превращение бутилена в триметилкарбинол достигается удобно посредством серной кислоты при соблюдении некоторых особых приемов. [25]
На - рис. представлена зависимость общей конверсии бутилена и выходов дивинила на пропущенный и разложенный бутилен от концентрации водяных паров в реакционной смеси. Максимум на кривых - выхода дивинила на пропущенный бутилен и конверсии бутилена наступает одновременно, что, по-видимому, объясняется снижением конверсии главным образом за счет торможения водяными парами полезного превращения бутилена. При этом, как видно из хода кривой селективности, ослабляется и протекание реакций глубокого окисления. [26]
Бутилен, промытый сначала спиртом, потом водой, собирается в газометр. В промывном спирте каждый раз собирается немного эфирного продукта, который может быть выделен водой. Для превращения бутилена в триметилкар бинол посредством серной кислоты необходимо было найти возможность поглощать бутилен кислотой, настолько разведенной, чтобы образование маслообразных продуктов ( уплотнение бутилена. Смесь эта при простом пропускании в нее бутилена почти вовсе не поглощает его, но поглощение совершается довольно легко в описываемом снаряде. Снаряд имеет вид вертикально стоящего либиховского холодильника в 5 - 6 дециметр, длиною, внутренняя его трубка, шириной около центи-метра во внутреннем поперечнике, наполнена крупнотолченым стеклом. Оба конца этой трубки закрыты каучуковыми пробками. Сквозь нижнюю пробку проходят две тонкие трубочки. Первая из трубочек, приводящая газ, проникает в массу толченого стекла на дециметр от пробки, конец второй трубочки, служащей для постоянного стока кислоты, поглотившей бутилен, находится внутри снаряда наравне с внутренней поверхностью пробки; вне снаряда эта последняя трубка загибается кверху и, приподнявшись приблизительно на 8 центиметров, загибается немного книзу, оканчиваясь коротким крючком. Таким образом, она во все время опыта остается наполненная жидкостью и не пропустит газа. Сквозь верхнюю пробку проходят трубка, служащая для отвода непоглощенных газов, и конец трубчатой воронки, снабженной краном, сквозь которую медленно, по каплям, постоянно протекает кислота, смачивающая весь столб толченого стекла. Бутилен пропускается в снаряд высушенный, медленной струей; во все время поглощения в снаряде циркулирует охлаждающая вода. При таком расположении опыта кислота указанной выше концентрации поглощает бутилен почти сполна: при обработке приблизительно S1 / литров бутилена в шаровом снарядике, содержащем концентрированную иодоводородную кислоту и соединенном с отводящей трубкой поглотительного снаряда, образовалась только капля иодюра, а между тем известно, что бутилен чрезвычайно легко превращается в него. [27]
Метод очистки, разработанный Дреннаном [25] в 1947 г., устранил опасность введения примесей, препятствующих полимеризации, например сероводорода, безводных галоидоводородов и других соединений. По этому методу смесь бутиленов пропускают через катализатор изомеризации, причем бутилен превращается в псевдобутилен. В качестве катализатора рекомендуется прокаленный брусит ( гидрат окиси магния) при 93 - 200 и давлении, необходимом для сохранения жидкой фазы во всей зоне превращения. Главной реакцией является 90-процентное превращение бутилена в псевдобутилен, который может быть легко удален из смеси фракционированием. [28]
Дегидрогенизация бутана с получением бутиленов протекает в присутствии катализаторов с хорошим выходом и достаточно быстро. Этот процесс, широко применяемый в промышленности, протекает при 600 в присутствии, например, окислов алюминия и хрома. Для дальнейшей дегидрогенизации бутиленов с получением бутадиена необходима более высокая температура - около 650 при тех же катализаторах. Так как степень превращения бутиленов в бутадиен за один проход незначительна, применяют циркуляционный метод. [29]
Йодистый третичный бутил весьма легко отдает свой иод и обнаруживает значительное стремление к распадению на описанный ниже бутилен и иодоводород. Раствор едкого кали в крепком алкоголе [ начинает действовать на него уже при небольшом нагревании и ] разлагает его легко и быстро: преимущественно - в этом последнем направлении. Раствор едкого кали в весьма слабом алкоголе дает, напротив, много тримэфилкарбинола и мало бутилена; так же, хотя медленнее, действует и водный щелок едкого кали. На сухую окись серебра иодангидрид действует почти со взрывом, а при сбалтывании с окисью серебра и водою немедленно превращается в тримэфилкарбинол, производя в то же время и некоторое количество бутилена. Легкое и постоянное образование этого углеводорода как побочного продукта при двойных разложениях йодистого третичного бутила и описанное ниже превращение бутилена обратно в иодангидрид делают тримэфилкарбинол близко аналогичным с так называемыми гидратами амилена, бутилена, представляющими вторичные алкоголи. [30]
Страницы: 1 2
www.ngpedia.ru