Определение временной, или карбонатной жесткости воды в аквариуме. Буферность воды
Редокс-буферность природных вод
Наряду с редокс-уровнем 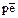 природные воды характеризуются понятием редокс-буферности (или редокс-емкости), аналогичным понятию кислотно-основной буферности. Говорят, что система является «забуференной» относительно редокс-процессов, если в ней присутствуют соединения, способные окисляться или восстанавливаться, что препятствует значительным изменениям
природные воды характеризуются понятием редокс-буферности (или редокс-емкости), аналогичным понятию кислотно-основной буферности. Говорят, что система является «забуференной» относительно редокс-процессов, если в ней присутствуют соединения, способные окисляться или восстанавливаться, что препятствует значительным изменениям 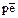 при добавлении небольших количеств сильно окисляющих или восстанавливающих агентов.
при добавлении небольших количеств сильно окисляющих или восстанавливающих агентов.
Анализ зависимости величины окислительно-восстановительного потенциала от рН раствора и от парциального давления кислорода в равновесном воздухе показывает, что редокс-уровень системы слабо зависит от содержания кислорода в воздухе.Пока в системе есть свободный кислород, величина 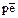 остается высокой. Поэтому в природных водах, контактирующих с атмосферным воздухом или с почвенным воздухом, содержащим кислород, значение
остается высокой. Поэтому в природных водах, контактирующих с атмосферным воздухом или с почвенным воздухом, содержащим кислород, значение 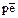 практически всегда остается высоким (Примеры 21 и 22). Природныеводы обладают буферной редокс-емкостью, связанной с присутствием кислородав равновесном с ними воздухе. Однако необходимо отметить, что для природныхвод, контактирующих с воздухом, содержащим кислород, не принято давать точной оценки величины
практически всегда остается высоким (Примеры 21 и 22). Природныеводы обладают буферной редокс-емкостью, связанной с присутствием кислородав равновесном с ними воздухе. Однако необходимо отметить, что для природныхвод, контактирующих с воздухом, содержащим кислород, не принято давать точной оценки величины 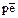 системы даже при фиксированном значении рН. Это связало стем, что полное восстановление кислорода по реакции (81) по существу происходит не в виде одной ступени, а как две последовательныереакции:
системы даже при фиксированном значении рН. Это связало стем, что полное восстановление кислорода по реакции (81) по существу происходит не в виде одной ступени, а как две последовательныереакции:
 O2 + 2 H+ + 2
O2 + 2 H+ + 2 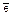 h3O2 (92)
h3O2 (92)
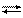 h3O2 + 2Н+ + 2
h3O2 + 2Н+ + 2 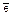 2h3O (93)
2h3O (93)
Лимитирующей при этом является реакция (92). Значение ре этой реакции при рН 7 равно 4,5. в то время как 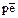 реакции (81) при рН 7 равно 13,8. Некоторые реальные природные редокс-системы ведут себя так, как будто величину
реакции (81) при рН 7 равно 13,8. Некоторые реальные природные редокс-системы ведут себя так, как будто величину 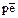 определяет реакция (81), а другие – (92). Поэтому для вод, контактирующих с кислородом, лучше характеризовать значение
определяет реакция (81), а другие – (92). Поэтому для вод, контактирующих с кислородом, лучше характеризовать значение 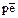 термином «высокое» без точного числового значения.
термином «высокое» без точного числового значения.
Однако если контакт природных вод с воздухом, содержащим кислород, будет нарушен, достаточно быстро может резко измениться редокс-состояние воды. Как показано в Примере 23, в случае отсутствия поступления кислорода при температуре 298 К в воде может быть окислено не более 7,9 мг/л органических веществ, если их молекулярную формулу принять как {СН2О}. При этом весь кислород будет израсходован.
В случае, если восстановители, например органические соединения, продолжают поступать, в системе начинают происходить окислительно-восстановительные реакции без участия кислорода. При этом редокс-уровень системы снизится. Рассмотрим реакции, наиболее важные с точки зрения редокс-буферности и состояния водных экосистем в целом.
Денитрификация.Роль реакции состоит в превращении нитрата (важного компонента питания) в биологически инертный молекулярный азот. При этом бактерии используют для окисления органического вещества до СО2 кислород нитратных ионов:
2,5Cоpr + 2NO 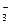 + 2H+ ® N2 + 2,5CO2 + Н2О (94)
+ 2H+ ® N2 + 2,5CO2 + Н2О (94)
В процессе динитрификации помимо азота могут образоваться гемиоксид, оксид и диоксид азота, которые играют важную роль в процессах, протекающих в тропосфере (оксид и диоксид азота) и стратосфере (гемиоксид азота). В то же время, поскольку концентрация нитрат-ионов в природных водах достаточно низкая (исключение могут составлять лишь почвенные воды), эти ионы не оказывают влияния на редокс-буферность природных вод.
Восстановление сульфатов, или сульфат-редукция.Это реакции, в которых бактерии используют для окисления органического вещества кислород сульфатных ионов, образуя в качестве продуктов жизнедеятельности сульфидные формы:
2Cоpr + SO 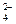 + 2h3O ® h3S + 2HCO
+ 2h3O ® h3S + 2HCO 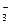 (94)
(94)
Если рН воды выше 7, образуется главным образом ион HS–, а в присутствии любых способных к реакциям соединений железа сульфидные формы будут реагировать с ними, образуя осадки в виде сульфидов. Восстановление сульфатов оказывает существенное влияние на состояние экосистем водоемов. Для большинства компонентов флоры и фауны h3S является высокотоксичным. Превращение оксидов железа в сульфиды обычно вызывает изменение цвета воды от красноватого или коричневатого до черного или серого. Вещества, сорбированные ранее на гидроксиде Fe(III) (например, ионы тяжелых металлов или фосфат-ионы), будут выделяться в раствор. При этом многие тяжелые металлы (например, Си, Zn, Mo, Pb, Hg), которые в окисленных водах были представлены относительно растворимыми соединениями (при не очень высоких рН), образуют малорастворимые сульфиды.
Поскольку сульфат-ионы относятся к главным ионам природных вод, имеют широкое распространение и содержатся в природных йодах вомногих случаях в достаточно больших концентрациях, oни способны на некоторое время стабилизировать редокс-уровень системы, несмотря на возможное поступление восстановителей. При этом системы будет отрицательным, поскольку при рН 7 для реакции (94) 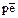 равно – 4,5.
равно – 4,5.
Ферментация. Протекающий при участии микроорганизмов процесс разрушения органических веществ приводит к появлению новых, более простых органических соединений. Брутто-уравнение бактериальной ферментации выглядит следующим образом:
[Органическое соединение А] ® [органическое соединение В] + СО2 (96)
Самой простой и одной in наиболее важных реакций этого типа является образование метана:
Сорг + 2Н2О ® СО2 +СН4. (97)
Процессы ферментации протекают при значениях 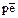 < –4,5 вплоть до границы устойчивости поды.
< –4,5 вплоть до границы устойчивости поды.
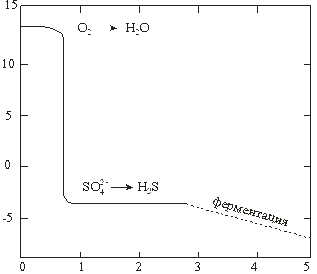
Количество окисленного углерода, моль/л
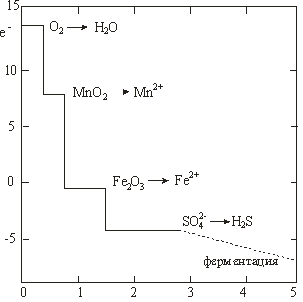
Рис. 5. Изменение  пресной воды
пресной воды
(исходные значения [O2] = 10 мг/л, [SO  ]= 96 мг/л)
]= 96 мг/л)
в зависимости от концентрации разложившегося органического вещества
(в пересчете на углерод) при рН 7.
На рисунке 5 представлена зависимость изменения редокс-уровня системы в зависимости от количества поступающих в нее восстановителей (Сорг), которая наглядно демонстрирует уровни, отвечающие «забуференным» состояниям, характерным для большинства природных вод. Предполагается, что вода первоначально была в равновесии с атмосферным кислородом, но дополнительное поступление кислорода в процессе разложения – органического вещества отсутствовало. Кроме того, реакции, включающие соединения азота, создают лишь небольшую буферность между уровнями О2/Н2О и SO  /h3S.
/h3S.
Обычно значения 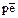 в природных водах в основном соответствуют «забуференным» состояниям, так как незабуференные состояния неустойчивы. Единственным местом, где можно ожидать сохранения «незабуференного»
в природных водах в основном соответствуют «забуференным» состояниям, так как незабуференные состояния неустойчивы. Единственным местом, где можно ожидать сохранения «незабуференного» 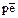 , является область, в которой
, является область, в которой 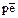 контролируется диффузией между анаэробной водой (например, поровой водой осадков) и аэробной (например, не насыщенной кислородом водой озера или океана).
контролируется диффузией между анаэробной водой (например, поровой водой осадков) и аэробной (например, не насыщенной кислородом водой озера или океана).

Количество окисленного углерода, усл. ед.
Рис. 6.Изменение 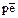 пресной воды, находящейся в контакте с осадком,
пресной воды, находящейся в контакте с осадком,
в зависимости от концентрации разложившегося органического вещества;
рН = const = 7
В подземных водах, находящихся в контакте с осадками, редокс-реакции с участием твердой фазы могут также «забуферивать» 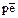 (рисунок 6). Показанные на рисунке длины различных горизонтальных участков являются произвольными и зависят от количества участвующих в реакции твердых фаз.
(рисунок 6). Показанные на рисунке длины различных горизонтальных участков являются произвольными и зависят от количества участвующих в реакции твердых фаз.
Хотя восстанавливающим агентом в природных водах обычно является органическое вещество, снижение 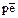 может быть вызвано также окислением минералов, содержащих Fe(II) или восстановленные формы серы. Например, из воды некоторых источников, выходящих из ультраосновных пород (состоящих главным образом из силикатов магния и железа), выделяются пузырьки водорода, что является результатом восстановления воды минералами закисного железа.
может быть вызвано также окислением минералов, содержащих Fe(II) или восстановленные формы серы. Например, из воды некоторых источников, выходящих из ультраосновных пород (состоящих главным образом из силикатов магния и железа), выделяются пузырьки водорода, что является результатом восстановления воды минералами закисного железа.
stydopedia.ru
20. Буферные растворы, природные буферные системы. Расчёт pH буферных систем, буферная ёмкость.
БУФЕРНЫЕ РАСТВОРЫ – растворы, концентрация ионов водорода (рН) которых не изменяется от прибавления ограниченных количеств сильной кислоты или щелочи (см. водородный показатель). Б.р. состоят из смеси раствора слабой кислоты и ее соли сильного основания или, наоборот, — слабого основания и его соли сильной кислоты.
Многие природные жидкости обладают буферными свойствами. Примером может служить вода в океане, буферные свойства которой во многом обусловлены растворенным углекислым газом и гидрокарбонат-ионами НСО3–. Источником последних, помимо СО2, являются огромные количества карбоната кальция в виде раковин, меловых и известняковых отложений в океане. Интересно, что фотосинтетическая деятельность планктона – одного из основных поставщиков кислорода в атмосферу, приводит к повышению рН среды. Происходит это в соответствии с принципом Ле Шателье в результате смещения равновесия при поглощении растворенного углекислого газа. Когда в ходе фотосинтеза из раствора удаляется СО2, равновесие смещается вправо и среда становится более щелочной. В клетках организма гидратация СО2 катализируется ферментом карбоангидразой.
Клеточная жидкость, кровь также являются примерами природных буферных растворов. Так, кровь содержит около 0,025 моль/л углекислого газа, причем его содержание у мужчин примерно на 5% выше, чем у женщин. Примерно такая же в крови концентрация гидрокарбонат-ионов (их тоже больше у мужчин).
Расчет рН буферных систем.
для кислотных буферных систем: рН = рК(кислоты) + lg 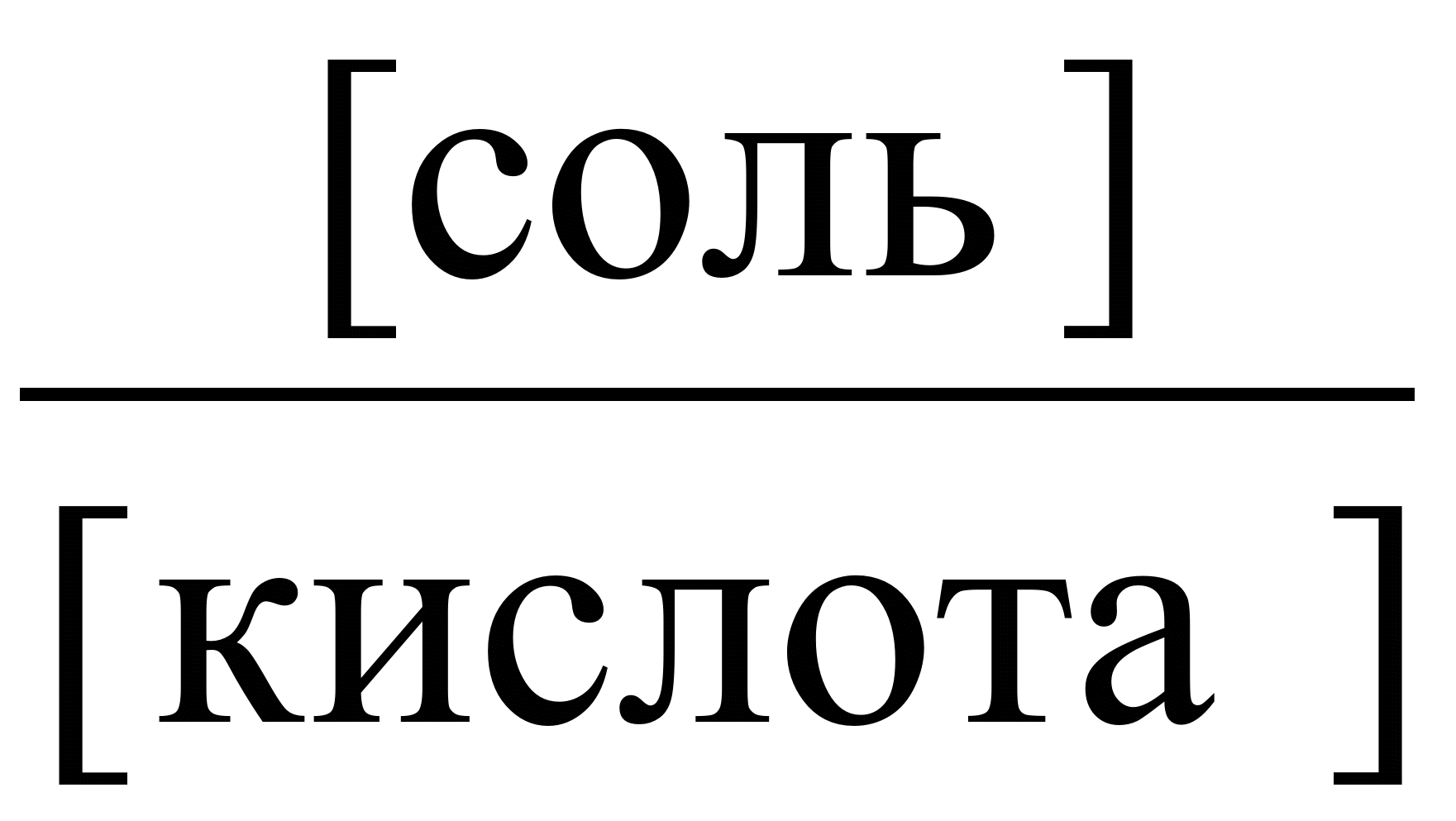 .
.
Для основных буферных систем: рН =14 – рК(основания) – lg  где рК(кислоты), рК(основания) - отрицательный десятичный логарифм константы электролитической диссоциации слабой кислоты; слабого основания. Из этих уравнений видно, что рН кислотной (основной) буферной системы зависит от природы слабого электролита (рК(кислоты), рК(основания)) и от соотношения концентраций соли и кислоты (основания).
где рК(кислоты), рК(основания) - отрицательный десятичный логарифм константы электролитической диссоциации слабой кислоты; слабого основания. Из этих уравнений видно, что рН кислотной (основной) буферной системы зависит от природы слабого электролита (рК(кислоты), рК(основания)) и от соотношения концентраций соли и кислоты (основания).
Буферная ёмкость раствора — способность раствора сохранять постоянной концентрацию определённых ионов (обычно применяется к ионам H+).
21. Кислоты и основания по Льюису.
Определение Льюиса. Льюис предложил более общее определение: кислота — это вещество, которое акцептирует электронную пару; основание — это вещество, которое предоставляет электронную пару.
Взаимодействие между кислотой и основанием, согласно этому определению, заключается в возникновении ковалентной связи по донорно-акцепторному механизму:
На основании определений Льюиса все обычные лиганды (Nh4, CN-, F-, Cl- и др.) можно рассматривать как основания, а все ионы металлов — как кислоты. Степень сродства иона металла к лиганду называют льюисовской кислотностью, а тенденция лиганда образовывать связи с ионом металла называется льюисовской основностью. Силы кислот и оснований Льюиса могут меняться в зависимости от природы партнера.
22. Гетерогенные равновесия. Произведение растворимости.
Равновесие в гетерогенной системе
в системе при условиях возможен переход вещества из одной фазы в другую. Признаком того, что система также находится в равновесии, т. е. не происходит перехода какого-либо компонента из одной фазы в другую, является равенство удельных химических потенциалов данного компонента в рассматриваемых фазах.
Одним из важнейших законов гетерогенного равновесия является правило фаз. Оно оперирует с основными понятиями о компоненте, фазе и числе степеней свободы. Два первых понятия определены выше.
Под термодинамическими степенями свободы подразумеваются независимые параметры системы, находящиеся в термодинамическом равновесии, которые могут принимать произвольные значения в определенном интервале, причем число фаз не изменяется.
Число степеней свободы (вариантность системы) – это число, указывающее, скольким параметрам, характеризующим состояние равновесной системы, можно давать произвольные значения без того, чтобы число фаз в системе изменилось.
Правило фаз: В изолированной равновесной системе число фаз плюс число степеней свободы равно числу компонентов плюс 2
φ + V = k + 2
Произведение растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
studfiles.net
5.3. Редокс-буферность природных вод
Наряду с редокс-уровнем 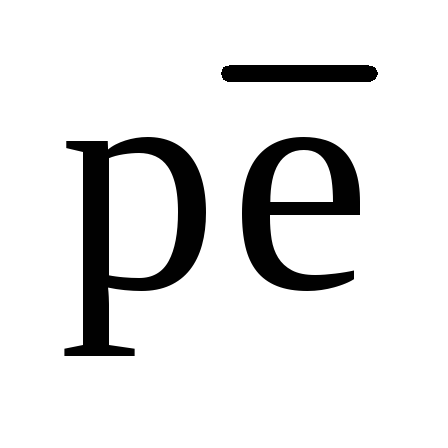 природные воды характеризуются понятием редокс-буферности (или редокс-емкости), аналогичным понятию кислотно-основной буферности. Говорят, что система является «забуференной» относительно редокс-процессов, если в ней присутствуют соединения, способные окисляться или восстанавливаться, что препятствует значительным изменениям
природные воды характеризуются понятием редокс-буферности (или редокс-емкости), аналогичным понятию кислотно-основной буферности. Говорят, что система является «забуференной» относительно редокс-процессов, если в ней присутствуют соединения, способные окисляться или восстанавливаться, что препятствует значительным изменениям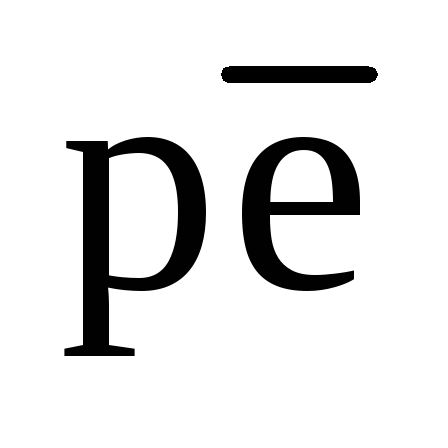 при добавлении небольших количеств сильно окисляющих или восстанавливающих агентов.
при добавлении небольших количеств сильно окисляющих или восстанавливающих агентов.
Анализ зависимости величины окислительно-восстановительного потенциала от рН раствора и от парциального давления кислорода в равновесном воздухе показывает, что редокс-уровень системы слабо зависит от содержания кислорода в воздухе. Пока в системе есть свободный кислород, величина 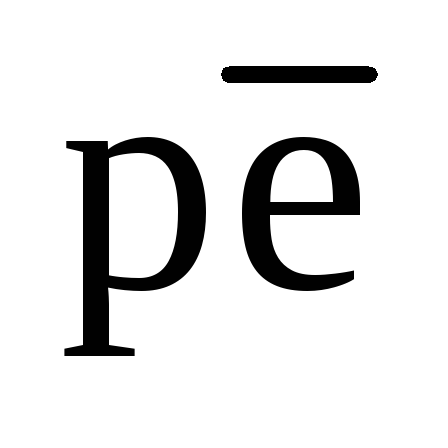 остается высокой. Поэтому в природных водах, контактирующих с атмосферным воздухом или с почвенным воздухом, содержащим кислород, значение
остается высокой. Поэтому в природных водах, контактирующих с атмосферным воздухом или с почвенным воздухом, содержащим кислород, значение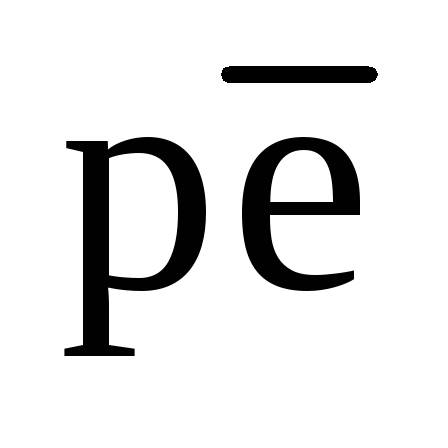 практически всегда остается высоким (Примеры 21 и 22).Природные воды обладают буферной редокс-емкостью, связанной с присутствием кислорода в равновесном с ними воздухе. Однако необходимо отметить, что для природных вод, контактирующих с воздухом, содержащим кислород, не принято давать точной оценки величины
практически всегда остается высоким (Примеры 21 и 22).Природные воды обладают буферной редокс-емкостью, связанной с присутствием кислорода в равновесном с ними воздухе. Однако необходимо отметить, что для природных вод, контактирующих с воздухом, содержащим кислород, не принято давать точной оценки величины 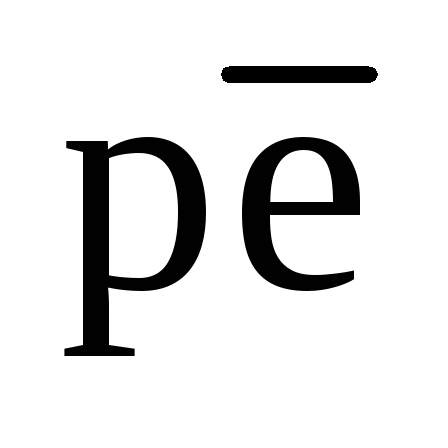 системы даже при фиксированном значении рН. Это связалос тем, что полное восстановление кислорода по реакции (81) по существу происходит не в виде одной ступени, а как две последовательные реакции:
системы даже при фиксированном значении рН. Это связалос тем, что полное восстановление кислорода по реакции (81) по существу происходит не в виде одной ступени, а как две последовательные реакции:
O 2 + 2 H + + 2
2 + 2 H + + 2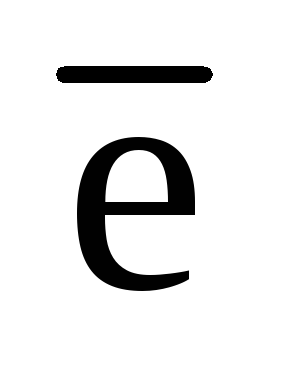 h3O2 (92)
h3O2 (92)
H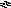 2O2 + 2Н+ + 2
2O2 + 2Н+ + 2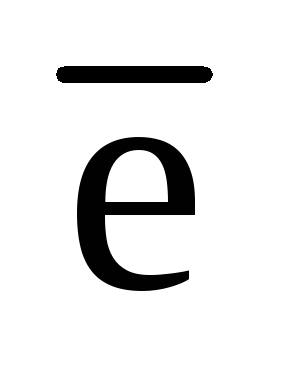 2h3O (93)
2h3O (93)
Лимитирующей при этом является реакция (92). Значение ре этой реакции при рН 7 равно 4,5. в то время как  реакции (81) при рН 7 равно 13,8. Некоторые реальные природные редокс-системы ведут себя так, как будто величину
реакции (81) при рН 7 равно 13,8. Некоторые реальные природные редокс-системы ведут себя так, как будто величину 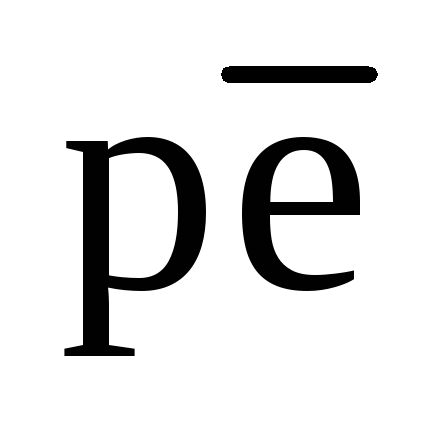 определяет реакция (81),а другие – (92). Поэтому для вод, контактирующих с кислородом, лучше характеризовать значение
определяет реакция (81),а другие – (92). Поэтому для вод, контактирующих с кислородом, лучше характеризовать значение 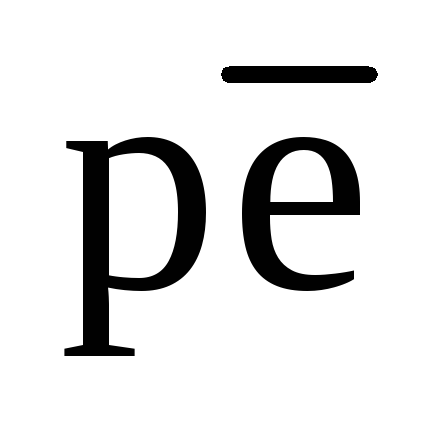 термином «высокое» без точного числового значения.
термином «высокое» без точного числового значения.
Однако если контакт природных вод с воздухом, содержащим кислород, будет нарушен, достаточно быстро может резко измениться редокс-состояние воды. Как показано в Примере 23, в случае отсутствия поступления кислорода при температуре 298 К в воде может быть окислено не более 7,9 мг/л органических веществ, если их молекулярную формулу принять как {СН2О}. При этом весь кислород будет израсходован.
В случае, если восстановители, например органические соединения, продолжают поступать, в системе начинают происходить окислительно-восстановительные реакции без участия кислорода. При этом редокс-уровень системы снизится. Рассмотрим реакции, наиболее важные с точки зрения редокс-буферности и состояния водных экосистем в целом.
Денитрификация. Роль реакции состоит в превращении нитрата (важного компонента питания) в биологически инертный молекулярный азот. При этом бактерии используют для окисления органического вещества до СО2 кислород нитратных ионов:
2,5Cоpr + 2NO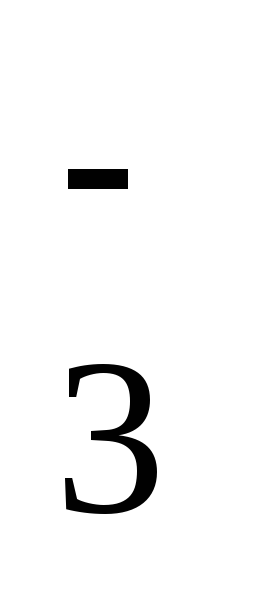 + 2H+ N2 + 2,5CO2 + Н2О (94)
+ 2H+ N2 + 2,5CO2 + Н2О (94)
В процессе динитрификации помимо азота могут образоваться гемиоксид, оксид и диоксид азота, которые играют важную роль в процессах, протекающих в тропосфере (оксид и диоксид азота) и стратосфере (гемиоксид азота). В то же время, поскольку концентрация нитрат-ионов в природных водах достаточно низкая (исключение могут составлять лишь почвенные воды), эти ионы не оказывают влияния на редокс-буферность природных вод.
Восстановление сульфатов, или сульфат-редукция. Это реакции, в которых бактерии используют для окисления органического вещества кислород сульфатных ионов, образуя в качестве продуктов жизнедеятельности сульфидные формы:
2Cоpr + SO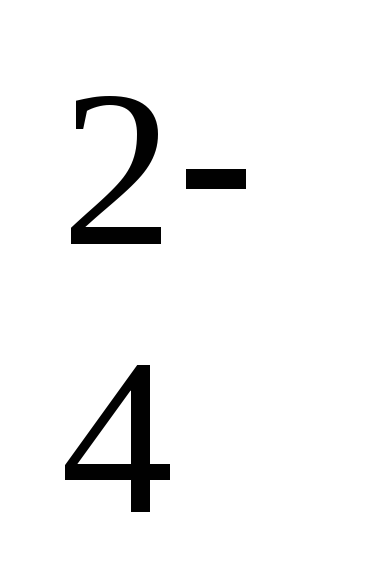 + 2h3O h3S + 2HCO
+ 2h3O h3S + 2HCO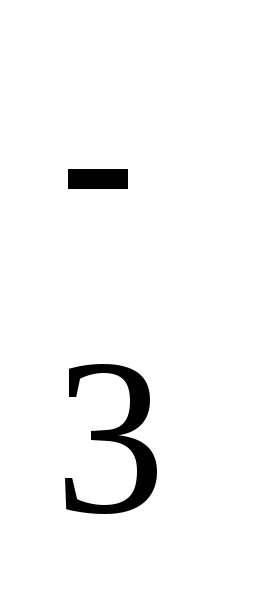 (94)
(94)
Если рН воды выше 7, образуется главным образом ион HS–, а в присутствии любых способных к реакциям соединений железа сульфидные формы будут реагировать с ними, образуя осадки в виде сульфидов. Восстановление сульфатов оказывает существенное влияние на состояние экосистем водоемов. Для большинства компонентов флоры и фауны h3S является высокотоксичным. Превращение оксидов железа в сульфиды обычно вызывает изменение цвета воды от красноватого или коричневатого до черного или серого. Вещества, сорбированные ранее на гидроксиде Fe(III) (например, ионы тяжелых металлов или фосфат-ионы), будут выделяться в раствор. При этом многие тяжелые металлы (например, Си, Zn, Mo, Pb, Hg), которые в окисленных водах были представлены относительно растворимыми соединениями (при не очень высоких рН), образуют малорастворимые сульфиды.
Поскольку сульфат-ионы относятся к главным ионам природных вод, имеют широкое распространение и содержатся в природных йодах во многих случаях в достаточно больших концентрациях, oни способны на некоторое время стабилизировать редокс-уровень системы, несмотря на возможное поступление восстановителей. При этом системы будет отрицательным, поскольку при рН 7 для реакции (94) 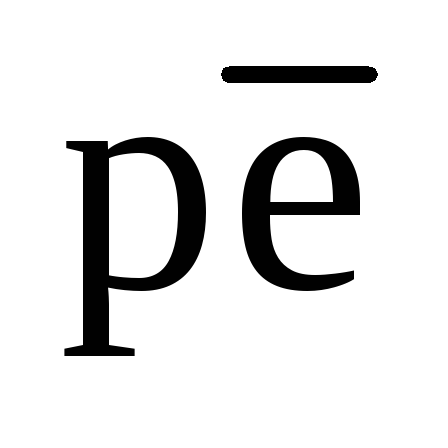 равно – 4,5.
равно – 4,5.
Ферментация. Протекающий при участии микроорганизмов процесс разрушения органических веществ приводит к появлению новых, более простых органических соединений. Брутто-уравнение бактериальной ферментации выглядит следующим образом:
[Органическое соединение А] [органическое соединение В] + СО2 (96)
Самой простой и одной in наиболее важных реакций этого типа является образование метана:
Сорг + 2Н2О СО2 +СН4. (97)
Процессы ферментации протекают при значениях  < –4,5 вплоть до границы устойчивости поды.
< –4,5 вплоть до границы устойчивости поды.
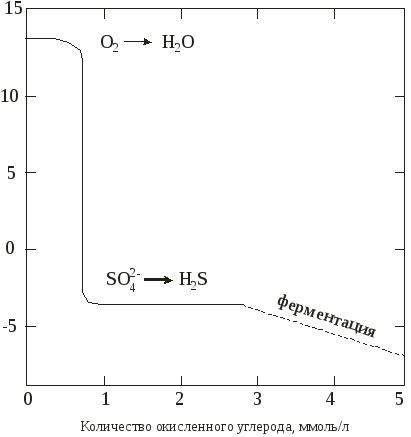
Количество окисленного углерода, моль/л
Рис. 5. Изменение 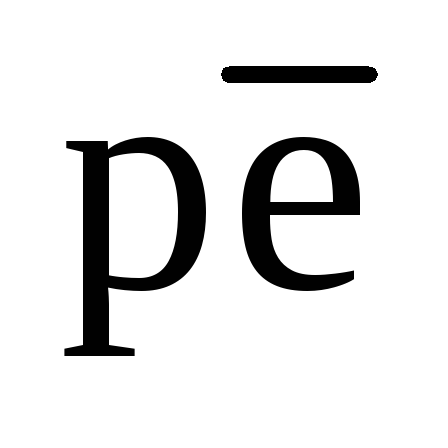 пресной воды
пресной воды
(исходные значения [O2] = 10 мг/л, [SO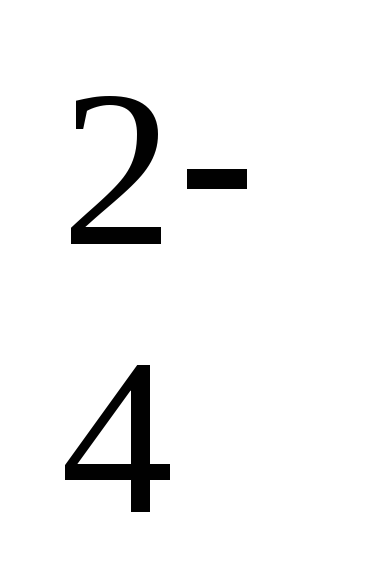 ]= 96 мг/л)
]= 96 мг/л)
в зависимости от концентрации разложившегося органического вещества
(в пересчете на углерод) при рН 7.
На рисунке 5 представлена зависимость изменения редокс-уровня системы в зависимости от количества поступающих в нее восстановителей (Сорг), которая наглядно демонстрирует уровни, отвечающие «забуференным» состояниям, характерным для большинства природных вод. Предполагается, что вода первоначально была в равновесии с атмосферным кислородом, но дополнительное поступление кислорода в процессе разложения – органического вещества отсутствовало. Кроме того, реакции, включающие соединения азота, создают лишь небольшую буферность между уровнями О2/Н2О и SO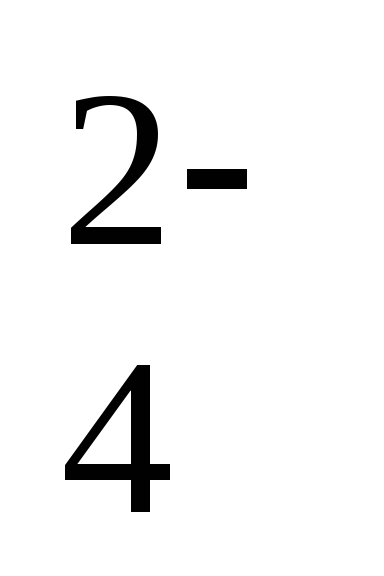 /h3S.
/h3S.
Обычно значения 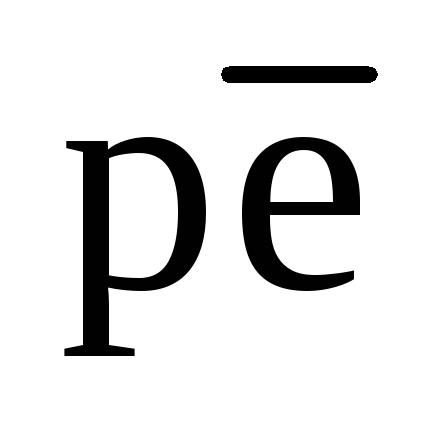 в природных водах в основном соответствуют «забуференным» состояниям, так как незабуференные состояния неустойчивы. Единственным местом, где можно ожидать сохранения «незабуференного»
в природных водах в основном соответствуют «забуференным» состояниям, так как незабуференные состояния неустойчивы. Единственным местом, где можно ожидать сохранения «незабуференного»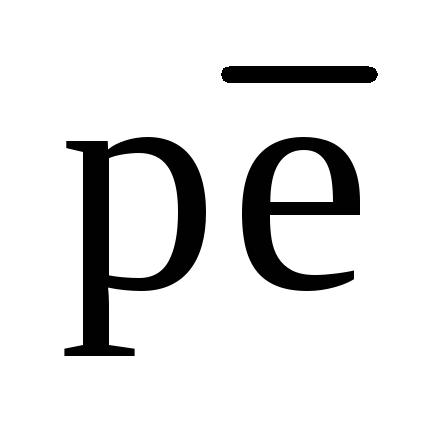 , является область, в которой
, является область, в которой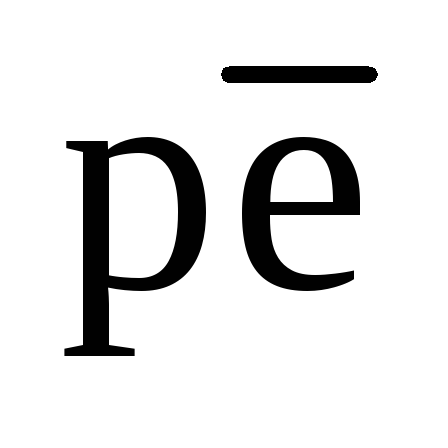 контролируется диффузией между анаэробной водой (например, поровой водой осадков) и аэробной(например, не насыщенной кислородом водой озера или океана).
контролируется диффузией между анаэробной водой (например, поровой водой осадков) и аэробной(например, не насыщенной кислородом водой озера или океана).
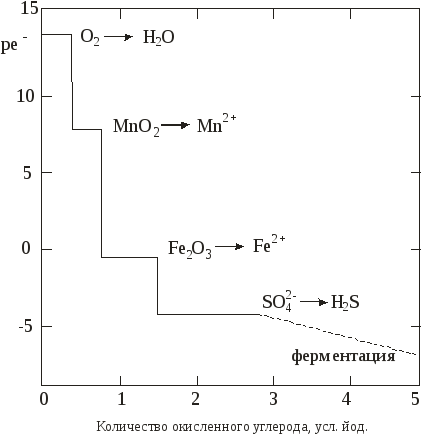

Количество окисленного углерода, усл. ед.
Рис. 6. Изменение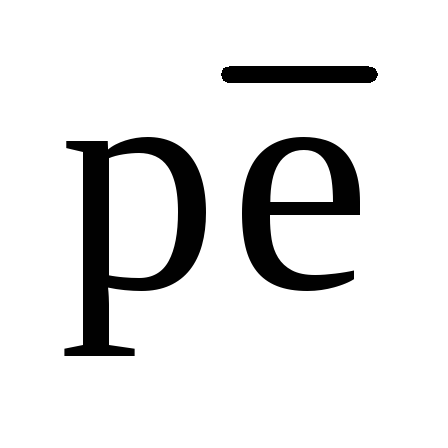 пресной воды, находящейся в контакте с осадком,
пресной воды, находящейся в контакте с осадком,
в зависимости от концентрации разложившегося органического вещества;
рН = const = 7
В подземных водах, находящихся в контакте с осадками, редокс-реакции с участием твердой фазы могут также «забуферивать» 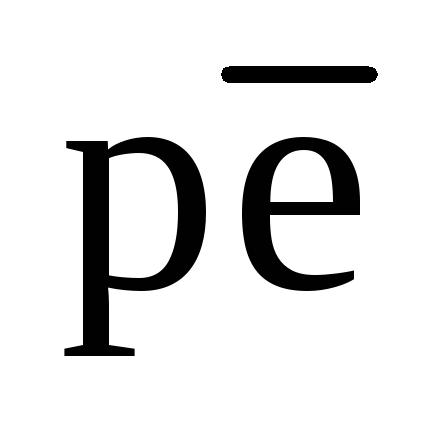 (рисунок 6). Показанные на рисунке длины различных горизонтальных участков являются произвольными и зависят от количества участвующих в реакции твердых фаз.
(рисунок 6). Показанные на рисунке длины различных горизонтальных участков являются произвольными и зависят от количества участвующих в реакции твердых фаз.
Хотя восстанавливающим агентом в природных водах обычно является органическое вещество, снижение 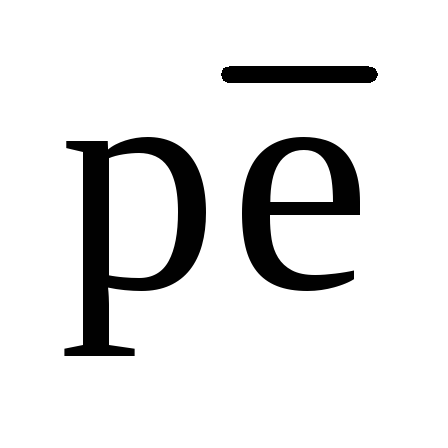 может быть вызвано также окислением минералов, содержащихFe(II) или восстановленные формы серы. Например, из воды некоторых источников, выходящих из ультраосновных пород (состоящих главным образом из силикатов магния и железа), выделяются пузырьки водорода, что является результатом восстановления воды минералами закисного железа.
может быть вызвано также окислением минералов, содержащихFe(II) или восстановленные формы серы. Например, из воды некоторых источников, выходящих из ультраосновных пород (состоящих главным образом из силикатов магния и железа), выделяются пузырьки водорода, что является результатом восстановления воды минералами закисного железа.
studfiles.net
Определение временной, или карбонатной жесткости воды в аквариуме
Что же на самом деле мы измеряем с помощью аквариумного KH-теста и что следует понимать под обозначением КН в аквариумистике?
О том, что такое "жесткость аквариумной воды, и в чем её выражают" мы уже писали. Но напомню вкратце, что жесткость подразделяют на постоянную и временную. Временная, она же карбонатная, она же устранимая жесткость связана с присутствием в воде наряду с катионами Ca2+ и Mg2+ гидрокарбонатных, или бикарбонатных анионов (HCO3-). При кипячении воды, гидрокарбонатные анионы вступают в реакцию с этими катионами и образуют с ними очень мало растворимые карбонатные соли, которые выпадают в осадок.
Ca2+ + 2HCO3- = CaCO3↓ + h3O + CO2↑
Временную жесткость можно устранить кипячением - отсюда и ее название. Аквариумисту невредно знать карбонатную жесткость воды в своих аквариумах. Это важный гидрохимический показатель, который часто приводится в справочной литературе, касающейся условий содержания и нереста рыб. Важно учитывать этот показатель и при выращивании многих аквариумных растений. Большинство аквариумистов уверенно, что с помощью продающихся в магазинах капельных тестов на карбонатную жесткость (КН) они определяют именно её. Но это забавное НЕДОРАЗУМЕНИЕ! Капельные тесты для аквариумистов-любителей, как в прочем и классический метод определения карбонатной жесткости путем титрования пробы воды соляной кислотой, измеряют вовсе не жесткость как таковую, то есть не концентрацию ионов кальция и магния, а щелочность - концентрацию в растворе гидрокарбонатных ионов*. Гидрокарбонатные ионы могли оказаться в воде не только при растворении солей кальция и магния, поэтому судить о наличии ионов Ca2+ и Mg2+ по содержанию гидрокарбонатных ионов можно далеко не всегда. Но, обо всем по порядку…
Если строго следовать определению карбонатной жесткости, то ее корректное измерение должно быть основано на кипячении заданного объема воды с последующим взвешиванием образовавшегося осадка (накипи). На практике это трудно выполнимо. Поэтому поступают иначе. Вот как определяют "карбонатную жесткость" с помощью общепринятой лабораторной методики. Определение карбонатной жесткости воды проводится путем её титрования соляной кислотой. Титрование - это добавление в исследуемую пробу раствора реагента, концентрация которого заранее известна. По расходу этого реагента - он взаимодействует с тем веществом, содержание которого хотят определить, рассчитывают концентрацию определяемого вещества. В данном тесте принято пользоваться 0.05М раствором соляной кислоты (о том, что означает сокращение "М" можно прочитать здесь). Кроме этого, понадобится индикатор метиловый оранжевый, который необходим для того, чтобы установить момент окончания титрования по резкому изменению цвета пробы. Для приготовления раствора индикатора небольшое его количество, 0.1 г растворяют в 100 мл дистиллированной воды. Точность здесь не требуется, можно все сделать на глазок. Как правило, эти реактивы есть в любой химической лаборатории.
Проведение лабораторного теста на карбонатную жесткость:
Точно отмеряют 50 мл исследуемой воды. Добавляют несколько капель раствора метилового оранжевого, столько, чтобы окраска пробы получилось такой как в левом стаканчике на приведенном ниже рисунке:

Далее проводят титрование пробы кислотой до изменения цвета индикатора (правый стаканчик).
При титровании в растворе произойдут следующие реакции:
H+ + HCO3- <–> h3CO3 <–> CO2 + h3O
Давайте сравним это и приведенное выше уравнение, которое показывало, что происходит с гидрокарбонатом кальция при кипячении. Как и при кипячении, конечными продуктами этих реакций являются вода и углекислый газ. Только вот кальций никак тут не участвует. Это и понятно, ведь ионы водорода, которые поступают в тестируемую воду при добавлении туда соляной кислоты, вступают в реакцию не с ионами кальция, а именно с гидрокарбонатными ионами. Кислоту удобно набрать в шприц до отмеченного заранее деления и из него дозировано добавлять в раствор. Сначала порции кислоты могут быть относительно большими, но к концу титрования надо быть аккуратным и осторожным, цвет может поменяться буквально от одной капли. Способность тестируемой воды реагировать с ионами водорода по мере добавления кислоты будет постепенно уменьшаться и, наконец, окажется почти совсем исчерпанной - кончатся гидрокарбонатные ионы и последняя капля кислоты резко сместит рН в сторону кислых значений, так как связывать возникающие при ее диссоциации в воде ионы водорода уже будет "некому". При величине рН меньшей чем 4.3 гидрокарбонатных ионов в растворе уже нет (подробнее об этом рассказано в другой статье). Индикатор при этом значении рН изменит цвет раствора с желтого на оранжевый. Тут титрование надо будет прекратить. Титровать надо не торопясь, аккуратно перебалтывая воду в стаканчике. Лучше проделать эту процедуру несколько раз, точно засекая какой объем кислоты был израсходован. Затем вычислить СРЕДНИЙ ОБЪЕМ пошедшей на титрование кислоты. Зная этот объем рассчитывают карбонатную жесткость по формуле:
Жесткость карбонатная(мг-экв/л) = (1000*Скислоты*Vкислоты):Vводы
Где Скислоты - концентрация кислоты в молях (М/л), Vкислоты - объем раствора кислоты использованный при титровании (мл), Vводы - объем пробы воды, взятой для титрования (мл).
Если Скислоты = 0.05 М, а Vводы = 50 мл, то
Жесткость карбонатная(мг-экв/л) = (1000*0.05*Vкислоты):50 = Vкислоты
То есть если вы титровали 50 мл воды 0.05 М соляной кислотой, то в этом случае карбонатная жесткость в мг-экв/л будет численно равна объему кислоты (в мл), израсходованному для титрования. Например, если на титрование ушло 1.5 мл раствора кислоты, то карбонатная жесткость воды равна 1.5 мг-экв/л. Для перевода в градусы KH значение в мг-экв/л надо умножить на 2.804: 1.5*2.804=4.2°KH. Хочу еще раз обратить ваше внимание на то, что описанный здесь метод анализа воды, обычно называют методом определения "карбонатной жесткости". На самом деле этим методом мы определили ЩЕЛОЧНОСТЬ воды, то есть ее способность связывать ионы водорода, которые образуются при диссоциации в воде сильной кислоты. Покупные капельные тесты для аквариумной воды (KH-test, или тест на КН) также основаны на титровании воды кислотой и так же, как и описанный выше лабораторный тест, определяют щелочность. Надо полагать, что указанные в справочной литературе величины КН отражают не содержание в воде бикарбонатов кальция и магния, как об этом принято писать во всех аквариумных книжках, а именно щелочность, то есть любых бикарбонатов и других анионов, способных реагировать с ионами водорода. Хорошо это, или плохо? Скорее - хорошо. Для аквариумиста как раз важно знать насколько вода в его аквариуме способна противостоять закислению (нейтрализовывать поступающие в нее ионы водорода). А сколько осадка такая вода даст на стенках труб в системе отопления, снизив при этом теплоотдачу, волнует его не сильно, если конечно он не теплотехник. Вспомним, что жесткость воды понятие не научное, а чисто утилитарное, но об этом уже было написано ранее.
Как мы уже отмечали, гидрокарбонатный ион может поступать в воду не только при растворении карбонатов кальция и магния, но и при растворении иных солей. Всем известная питьевая сода являет собой пример такого соединения: NaHCO3. Если внести питьевую соду в аквариум, то растворившись она даст ионы натрия и гидрокарбоната (о том, как растворяются соли в воде рассказано в статье о минерализации воды). Гидрокарбонатные ионы, как мы уже знаем, присоединяют к себе ионы водорода, поэтому вода в аквариуме от внесения питьевой соды становится менее кислой или приобретает щелочную реакцию - тут все зависит от дозы. Вот Вам и средство рН+! Питьевой содой и на самом деле пользуются многие аквариумисты. Небольшие ее добавки действительно застрахуют от неожиданных скачков рН. Решить достаточно соды внесено или нет можно измерив щелочность. Зная щелочность, вы можете оценить насколько вода в вашем аквариуме способна противостоять закислению - как говорят оценить БУФЕРНОСТЬ. Если щелочность пресной воды низкая (менее 1 мг-экв/л, или 2.804о КН), то и буферность ее невелика. Такая вода может резко скиснуть, например при пропуске очередной подмены воды или при выключении аэрации на ночь. Интервал значений щелочности 1.2-1.8 мг-экв/л, или 3 - 5о КН пригоден для большинства рыб и растений. Буферность воды при этом будет вполне достаточной для поддержания стабильной активной реакции воды - рН. Обычно щелочность аквариумной воды как раз и оказывается в указанном интервале или даже имеет еще большие значения - 2.5 мг-экв/л, или 7о КН и выше (в этом случае возможны проблемы с выращиванием многих растений и нашествия водорослей). Но в регионах с мягкой слабокислой водой она может быть очень низкой. Так, в большинстве районов Петербурга водопроводная вода имеет щелочность 0.5 мг-экв/л. Поэтому многие любители африканских цихлид, для которых кислая вода - это нож острый, искусственно ее поднимают с помощью питьевой соды. Но! Если вы вносили в аквариум соду, чтобы поднять и стабилизировать рН, то вам не надо удивляться, если "карбонатная жесткость" вдруг превысит общую. Кстати, есть и природные воды с карбонатной жесткостью, превышающей общую, например, вода озера Танганьика. Этот результат может удивить, если не знать, что на самом деле определяет тест на карбонатную жесткость. Если вы вносили в воду аквариума NaHCO3, то есть не связанные с кальцием и магнием гидрокарбонатные ионы, то, естественно, их будет больше, чем ионов Са2+ и Мg2+. Вот в этом и состоит суть парадокса, когда вполне логичная формула:
Общая жесткость = Постоянная жесткость + Временная жесткость не выполняется из-за того, что временная больше общей.
Понимание сути вещей порой позволяет творить чудеса, по крайней мере в глазах человека несведущего. Приносят нам как-то аквариумную воду на анализ. Надо мол разобраться рыбки всё дохнут и дохнут. На вопрос, измеряли ли рН? Нас заверили, что с рН совершенно точно все нормально. Ладно. Начали с измерения общей жесткости, потом карбонатную определили. Получилось, что карбонатная в несколько раз общую превосходит. Тут все уже ясно. Спрашиваем - зачем столько соды в аквариум насыпаете? Очень удивились, как мы про соду узнали. Оказывается добавление соды при каждой подмене воды - это де секретный и особо эффективный метод подсказанный по знакомству одним знатоком. Он, мол, гарантирует неизменно замечательный и оптимальный рН. Даже если чистить аквариумы редко, то вода не закиснет. Закиснуть-то она не закиснет. Но каково значение рН? Вы измеряли? Он же у вас больше 8 будет. А рыбки не только от кислой воды мрут**. Нет отвечают, мы не измеряли. Сделали тест на рН. Он и в самом деле показал значение больше 8!
А Вы измеряете рН в своем аквариуме, или он у Вас и так"хороший"?
В. Ковалёв, Е. Ковалёва.
* Здесь мы несколько упростили ситуацию. Все сказанное верно, если рН аквариумной воды 8.3 и ниже. Если же этот показатель выше значения 8.3, то в воде возможно присутствие не только гидрокарбонатов, но еще и карбонатов и даже гидроксидов щелочных металлов. В этом случае при добавлении кислоты в воду будут последовательно происходить следующие реакции: OH- + H+ –> h3O CO32- + H+ –> HCO3- HCO3- + H+ –> h3CO3 Щелочность воды, таким образом, здесь будет обеспечена присутствием в ней гидроксидного, карбонатного и бикарбонатного ионов. Назад к тексту
** О том, почему в аквариуме умирают рыбки написана отдельная статья. А при редких подменах воды в аквариуме накапливаются нитраты и фосфаты, которые при определенных концентрациях становятся токсичными для рыб.Назад к тексту

aquariumok.ru
Взаимосвязь между углекислым газом, рН и кН
Аквариумисту следует понимать взаимосвязь между жесткостью воды, водородным показателем и углекислым газом.
Углекислый газ — это кислотное вещество, которое всегда присутствует в воздухе и вырабатывается в любом биотопе рыбами, бактериями и др. Данное вещество воздействует на рН и понижает ее уровень, если оно не употреблено и не удалено.Как правило, в пресноводных аквариумах испытывается недостаток СО2, так как животные гидробионты производят его в недостаточных для роста растений количествах, что приводит к увеличению показателя рН.
В случае недостатка СО2 в воде растения ведут себя по-разному. Некоторые из них прекращают свой рост, другие же начинают поглощать из воды гидрокарбонаты кальция (что видно по пятнам на них — это выпадает карбонат кальция), в результате чего уровень рН снова возрастает.Как известно, большинство тропических растений живут в нейтральной или слегка кислой воде. Те же из них, которые приспособились к жизни в щелочной воде, могут выделять СО2 из гидрокарбонатов кальция.С другой стороны, чем выше в аквариуме карбоновая жесткость, тем больше необходимо СО2 для поддержания гидрокарбонатов кальция в растворенном состоянии, то есть для предохранения от выпадения осадка.
Карбоновая жесткость характеризует способность воды противостоять изменениям рН при внесении в воду щелочных или кислотных растворов. Так вот, при значениях карбоновой жесткости ниже 2, вода обладает очень низкой стабильностью к колебаниям рН, и ежесуточные колебания рН в ней могут быть очень высоки, что крайне негативно сказывается на гидробионтах.В свою очередь вода с карбоновой жесткостью выше 15 также представляет собой крайне негативную среду для гидробионтов, т.к. показатели рН в ней абсолютно стабильны и не поддаются регулированию.
Показатель рН зависит от содержания в воде ионов Н+ и ОН-, вместе с тем кН, характеризующий буферность воды, зависит от содержания в воде карбонов кальция и магния. При увеличении тем или иным способом кислотности/щелочности воды, соли будут вступать в химическую реакцию с Н+ или ОН-. В зависимости от того увеличилась ли кислотная составляющая, либо щелочная, в реакции будут участвовать либо Н+, либо ОН-. В свою очередь, в зависимости от количества растворенных солей (показателя кН) будет зависеть то, насколько изменится рН.Поэтому показатель кН и показывает, насколько вода готова к изменению своего водородного показателя.
Следующая таблица демонстрирует оптимальные сочетания рН и кН:
| Карб. жестк. KH | 0,5 | 1 | 2 | 3 | 4 | 5 | 6-7 | 8-9 | 10-11 | 12-15 |
| мг/экв | 0,18 | 0,36 | 0,71 | 1,07 | 1,43 | 1,78 | 2,14-2,5 | 2,85-3,21 | 3,57-3,92 | 4,28-5,35 |
| min pH для рыб | 5,8 | 6,1 | 6,3 | 6,5 | 6,7 | 6,8 | 6,8-6,9 | 7,0 | 7,1 | 7,1-7,2 |
| max pH для растений | 6,4 | 6,7 | 7 | 7,1 | 7,3 | 7,4 | 7,4-7,5 | 7,6 | 7,6-7,7 | 7,7-7,8 |
Если карбоновая жесткость в биотопе очень высокая, а именно в этом случае возможны прыжки рН за опасные пределы 7.8 — 8.0, держите наготове средство по снижению рН или кислоту.
Рассмотрим все это еще на одном примере.
Вы залили в устоявшийся биотоп новую мягкую воду, с гораздо более низким значением карбоновой жесткости, но гораздо более щелочную, с более высоким значением рН (либо по каким-нибудь другим причинам вода стала мягкой и щелочной). Что при этом произойдет?
Высокое значение рН означает преобладание в воде ионов ОН- над ионам Н+. Мягкость воды означает ее неспособность «защищаться» изменениям рН. То есть ОН- будет вступать в активную реакцию с растворенными в воде карбонами, с выпадением щелочей в осадок.При том, что вода у Вас очень мягкая (то есть в ней недостаток солей кальция и магния), анионы ОН- быстро вступят в реакцию с растворенными солями, и ситуация нормализуется, рН пойдет вниз. Но этот скачок pH может быть очень чувствительным для гидробионтов.
Если же Вы добавите жесткую и щелочную воду (такая вода преобладает в водопроводной системе России), то все может быть более плачевно. Высокая карбоновая жесткость воды говорит о наличие в ней большого количества карбонов, готовых вступать в реакцию с ионами ОН- , также обильно занесенными Вами с новой водой, очень долго. И как следствие, это приведет к тому, что Ваша вода будет долго оставаться щелочной и жесткой.
Строгая взаимосвязь между карбоновой жесткостью, рН и углекислым газом является комплексом химических процессов. Уменьшая тем или иным способом в сложившемся сбалансированном биотопе содержание СО2, можно вызвать рост рН, который может быть весьма долгим и необратимым при высоких значениях карбоновой жесткости. При низких значениях он будет резким и ощутимым для гидробионтов.
www.aqualover.ru
Углекислый газ и карбонатная система воды
Многим аквариумистам известны рекомендации по использованию для размножения рыб воды, более мягкой и кислой, по сравнению с аквариумной. Удобно пользоваться для этой цели дистиллированной водой, мягкой и слабокислой, смешивая ее с водой из аквариума. Но оказывается, что при этом жесткость исходной воды уменьшается пропорционально разведению, а рН практически не изменяется. Свойство сохранять значение показателя рН независимо от степени разведения, называется буферностью. В этой статье мы познакомимся с основными компонентами буферных систем аквариумной воды: кислотностью воды - рН, содержанием углекислого газа - СО2, карбонатной «жесткостью» - dКН (эта величина показывает содержание в воде гидрокарбонат-ионов НСО3-; в рыбохозяйственной гидрохимии этот параметр называют щелочностью), общей жесткостью – dGН (для упрощения принимается, что ее составляют только ионы кальция – Са++). Обсудим их влияние на химический состав природной и аквариумной воды, собственно буферные свойства, а также механизм воздействия рассматриваемых параметров на организм рыб. Большинство химических реакций, рассматриваемых ниже, являются обратимыми, поэтому вначале важно познакомиться с химическими свойствами обратимых реакций; это удобно сделать на примере воды и показателя рН.
ОГЛАВЛЕНИЕ
Далее - смотри вторую часть
- 6. СО2 и физиология дыхания аквариумных рыб
- 7. Мини-практикум
- 8. Использованная литература
1. О ХИМИЧЕСКИХ РАВНОВЕСИЯХ, ЕДИНИЦАХ ИЗМЕРЕНИЯ И pН
Вода является хотя и слабым, но все же электролитом, т. е. способна к диссоциации, описываемой уравнением
Н2О↔Н+ +ОН-
Этот процесс обратим, т.е.
Н++ОН-↔Н2О
C химической точки зрения ион водорода Н+ всегда является кислотой. Ионы, способные связывать, нейтрализовывать кислоту (Н+), являются основаниями. В нашем примере это – гидроксил-ионы (ОН-), но в аквариумной практике, как будет показано ниже, доминирующим основанием является гидрокрабонат-ион НСО3-, ион карбонатной «жесткости». Обе реакции протекают с вполне измеримыми скоростями, определяемыми концентрацией: скорости химических реакций пропорциональны произведению концентраций реагирующих веществ. Так для обратной реакции диссоциации воды Н++ОН->Н2О ее скорость выразится следующим образом:
Vобр = Кобр[Н+][OH-]
К – коэффициент пропорциональности, называемый константой скорости реакции.[ ]-квадратные скобки обозначают молярную концентрацию вещества, т.е. количество молей вещества в 1 литре раствора. Моль можно определить как вес в граммах (или объем в литрах - для газов) 6•1023 частиц (молекул, ионов) вещества - число Авогадро. Число, показывающее вес 6•1023 частиц в граммах равно числу, показывающему вес одной молекулы в дальтонах.
Так, например, выражение [h3O] обозначает молярную концентрацию водного раствора … воды. Молекулярный вес воды составляет 18 дальтон (два атома водорода по 1д, плюс атом кислорода 16д), соответственно 1 моль (1М) Н2О – 18 грамм. Тогда 1 литр (1000 грамм) воды содержит 1000:18=55,56 молей воды, т.е. [h3O]=55,56М=const.
Поскольку диссоциация – процесс обратимый (Н2О-Н++ОН-), то при условии равенства скоростей прямой и обратной реакции (Vпр=Vобр), наступает состояние химического равновесия, при котором продукты реакции и реагирующие вещества находятся в постоянных и определенных соотношениях: Кпр[h3O] = Kобр[H+][OН-]. Если константы объединить в одной части уравнения, а реагенты в другой, то получим
Кпр/Кобр = [H+][OH-]/[h3O] = К
где К также является постоянной величиной и называется константой равновесия.
Последнее уравнение является математическим выражением т.н. закона действия масс: в состоянии химического равновесия отношение произведений равновесных концентраций реагентов является постоянной величиной. Константа равновесия показывает, при каких пропорциях реагентов наступает химическое равновесие. Зная значение К, можно предсказать направление и глубину протекания химической реакции. Если К>1, реакция протекает в прямом направлении, если К<1 – в обратном. Используя константу равновесия, с химическими уравнениями можно обращаться как с алгебраическими и производить соответствующие вычисления. Точность их не очень высока, но они относительно просты и наглядны, что позволяет глубже понять смысл рассматриваемых процессов. Численное значение константы равновесия индивидуально и постоянно для каждой обратимой химической реакции. Оно определяется экспериментально, и эти значения приводятся в химических справочниках.
В нашем примере К= [H+][OН-]/[h3O] = 1,8•10-16. Поскольку [h3O] =55,56 =const, то ее можно объединить с К в левой части уравнения. Тогда:
К[h3O]=[H+][OH-]=(1,8•10-16)•(55,56)=1•10-14= const. = Кw
Преобразованное в такую форму уравнение диссоциации воды называется ионным произведением воды и обозначается Кw. Значение Кw остается постоянным при любых значениях концентраций Н+ и ОН-, т.е. с увеличением концентрации ионов водорода Н+, уменьшается концентрация ионов гидроксила – ОH- и наоборот. Так, например, если [H+] = 10-6, то [OH-] = Kw/[H+] = (10-14)/(10-6)=10-8. Но Кw = (10-6).(10-8) =10-14 = const. Из ионного произведения воды следует, что в состоянии равновесия [H+] = [OH-] = √Кw = √1•10-14 = 10-7М.
Однозначность связи между концентрацией ионов водорода и гидроксила в водном растворе позволяет для характеристики кислотности или щелoчности среды пользоваться одной из этих величин. Принято пользоваться величинoй концентрации ионов водорода Н+. Поскольку величинами порядка 10-7 оперировавть неудобно, в 1909 году шведский химик К.Серензен предложил использовать для этой цели отрицательный логарифм концентрации водородных ионов Н+ и обозначил его рН, от лат. potentia hydrogeni – сила водорода: рН = -lg[H+]. Тогда выражение [H+]=10-7 можно записать коротко как pH=7. Т.к. предложенный параметр не имеет единиц измерения, он называется показателем (рН). Удобство предложения Серензона вроде бы очевидно, но он подвергался критике современников за непривычную обратную зависимость между концентрацией ионов водорода Н+ и значением показателя рН: с увеличением концентрации Н+, т.е. с увеличением кислотности раствора, значение показателя рН уменьшается. Из ионного произведения воды следует, что показатель рН может принимать значения от 0 до 14 с точкой нейтральности рН=7. Органы вкуса человека начинают различать кислый вкус со значения показателя рН=3,5 и ниже.
Для аквариумистики актуален диапазон рН 4,5-9,5 (ниже будет рассматриваться только он) и традиционно принята следующая шкала с непостоянной ценой деления:
- рН<6-кислая
- рН 6,0-6,5 – слабокислая
- рН 6,5-6,8 – очень слабокислая
- рН 6,8-7,2 –нейтральная
-
рН 7,2-7,5 – очень слабощелочная
-
рН 7,5-8,0 - слабощелочная
-
рН>8 – щелочная
На практике в большинстве случаев гораздо информативнее оказывается более грубая шкала с постоянной ценой деления:
- рН=5±0,5 – кислая
- рН=6±0,5 – слабокислая
- рН=7±0,5 – нейтральная
- рН=8±0,5 – слабощелочная
- рН>8,5 – щелочная
Среды с рН<4,5 и рН>9,5 являются биологически агрессивными, и их следует считать непригодными для жизни обитателей аквариума. Поскольку показатель рН является логарифмической величиной, то изменение рН на 1 единицу означает изменение концентрации ионов водорода в 10 раз, на 2 – в 100 раз и т.д.. Изменение концентрации Н+ вдвое приводит к изменению значения показателя рН лишь на 0,3 единицы.
Многие аквариумные рыбы без особого вреда для здоровья переносят и 100-кратные (т.е. на 2 единицы рН) изменения кислотности воды. Разводчики харациновых и других т.н. мягководных рыб, перекидывают производителей из общего аквариума (часто со слабощелочной водой) в нерестовик (со слабокислой) и обратно без промежуточной адаптации. Практика также показывает, что большинство обитателей биотопов с кислой водой в неволе лучше чувствует себя в воде с рН 7,0-8,0. С. Спотт считает рН 7,1-7,8 оптимальным для пресноводного аквариума.
Дистиллированная вода имеет рН 5,5–6,0, а не ожидаемое рН=7. Чтобы разобраться с этим парадоксом, необходимо познакомиться с «благородным семейством»: СО2 и его производными.
2. СО2 СО ТОВАРИЩИ, pН, И СНОВА ЕДИНИЦЫ ИЗМЕРЕНИЯ
Согласно закону Генри содержание газа воздушной смеси в воде пропорционально его доле в воздухе (парциальному давлению) и коэффициенту абсорбции. Воздух содержит до 0,04% СО2, что соответствует его концентрации до 0,4 мл/л. Коэффициент абсорбции СО2 водой=12,7. Тогда 1 литр воды может растворить 0,6 – 0,7 мл СО2 (мл, а не мг!). Для сравнения, его биологический антипод – кислород, при 20%-ном содержании в атмосфере и коэффициенте абсорбции 0,05 обладает растворимостью 7 мл/л. Сравнение коэффициентов абсорбции показывает, что при прочих равных растворимость СО2 значительно превышает растворимость кислорода. Попробуем разобраться, за что же такая несправедливость.
В отличие от кислорода и азота, углекислый газ - СО2, является не простым веществом, а химическим соединением – оксидом. Как и другие оксиды, он взаимодействует с водой с образованием гидратов оксидов и, как и у других неметаллов, его гидроксидом является кислота (угольная):
СО2+Н2О = Н2СО3.
В итоге большей относительной растворимостью углекислый газ обязан химическому связыванию его водой, чего не происходит ни с кислородом, ни с азотом. Рассмотрим внимательнее кислотные свойства угольной кислоты, применив закон действия масс и приняв во внимание, что [h3O] = const:
СО2+Н2О=Н++НСО3-; К1 = [Н+][HCO3-]/[CO2] = 4•10-7НСО3-=Н++СО3--; К2 = [H+][CO3--]/[HCO3-] = 5,6•10-11
здесь К1 и К2 – константы диссоциации угольной кислоты по 1 и 2-ой ступени.
Ионы НСО3- называются гидрокарбонатами (в старой литературе бикарбонатами), а ионы СО3-- - карбонатами. Порядок величин К1 и К2 говорит о том, что угольная кислота является весьма слабой кислотой (К1<1 и К2 <1), а сравнение величин К1 и К2 – о том, что в ее растворе доминируют гидрокарбонат-ионы (К1>К2).
Из уравнения К1 можно рассчитать концентрацию ионов водорода Н+:
[H+] = K1[CO2]/[HCO3-]
Если выразить концентрацию Н+ через рН, как это в свое время сделали Хендерсон и Хассельбальх для теории буферных растворов, то получим:
рН = рК1 – lg[CO2]/[HCO3-]или удобнеерН = рК1 + lg[HCO3-]/[CO2]
где, по аналогии с рН, рК1 = -lgК1 =-lg4•10-7 = 6,4 = const. Тогда pH=6,4 + lg[HCO3-]/[CO2]. Последнее уравнение известно как уравнение Хендерсона – Хассельбальха. Из уравнения Хендерсона – Хассельбальха следуют по крайней мере два важных вывода. Во-первых, для анализа величины показателя рН необходимо и достаточно знания концентраций компонентов только СО2-системы. Во-вторых, значение показателя рН определяется отношением концентраций [HCO3-]/[CO2], а не наоборот.
Поскольку содержание [HCO3-] неизвестно, для вычисления концентрации Н+ в дистиллированной воде можно воспользоваться принятой в аналитической химии формулой [H+] = √K1[CO2]. Тогда рН = -lg√K1[CO2]. Чтобы оценить интересующую нас величину показателя рН, вернемся к единицам измерения. Из закона Генри известно, что концентрация СО2 в дистиллированной воде составляет 0,6мл/л. Выражение [CO2] означает молярную концентрацию (см. выше) углекислого газа. 1М СО2 весит 44 грамма, и при нормальных условиях занимает объем 22,4 литра. Тогда для решения задачи необходимо определить, какую долю от 1М, т.е. от 22,4 литров, составляют 0,6 мл. Если концентрация СО2 выражена не в объемных, а в весовых единицах, т.е. в мг/л, то искомую долю необходимо считать от молярного веса СО2 – от 44 грамм. Тогда искомая величина составит:
[CO2] = x•10-3/22,4 = y•10-3/44
где х – объемная (мл/л), у – весовая (мг/л) концентрация СО2. Простейшие вычисления дают приблизительную величину 3•10-5М СО2, или 0,03mM. Тогда
рН = -lg√K1[CO2] = -lg√(4•10-7)(3•10-5) = -lg√12•10-12 = -lg(3,5•10-6) = 5,5
что вполне согласуется с измеряемыми значениями.
Из уравнения Хендерсона-Хассельбальха видно, как величина показателя рН зависит от отношения [НСO3-]/[СО2]. Приблизительно можно считать, что если концентрация одного компонента превышает концентрацию другого в 100 раз, то последней можно пренебречь. Тогда при [НСО3-]/[СО2] = 1/100 рН = 4,5, что можно считать нижним пределом для СО2-системы. Меньшие значения показателя рН обусловлены присутствием не угольной, а других минеральных кислот, например серной, соляной. При [НСО3-]/[СО2] = 1/10, рН = 5,5. При [НСО3-]/[СО2] = 1, или [НСО3-] = [СО2], рН = 6,5. При [НСО3-]/[СО2] = 10, рН = 7,5. При [НСО3-]/[СО2] =100, рН = 8,5. Считается, что при рН>8,3 (точка эквивалентности фенолфталеина) свободная углекислота в воде практически отсутствует.
3. ПРИРОДНАЯ ВОДА И УГЛЕКИСЛОТНОЕ РАВНОВЕСИЕ
В природе атмосферная влага, насыщаясь СО2 воздуха и выпадая с осадками, фильтруется через геологическую кору выветривания. Принято считать, что там она, взаимодействуя с минеральной частью коры выветривания, обогащается т.н. типоморфными ионами: Ca++, Mg++, Na+, SO4--, Сl- и формирует свой химический состав.
Однако работами В.И. Вернадского и Б.Б. Полынова показано, что химический состав поверхностных и грунтовых вод регионов с влажным и умеренно влажным климатом формирует в первую очередь почва. Влияние же коры выветривания связано с ее геологическим возрастом, т.е. со степенью выщелоченности. Разлагающиеся растительные остатки поставляют в воду СО2, НСО3- и зольные элементы в пропорции, соответствующей их содержанию в живом растительном веществе: Cа>Na>Mg. Любопытно, что практически во всем мире питьевая вода, используемая и в аквриумистике, в качестве доминирующего аниона содержит гидрокарбонат-ион НСО3-, а из катионов – Ca++, Na+, Mg++, нередко с некоторой долей Fe. А поверхностные воды влажных тропиков вообще удивительно однообразны по химическому составу, отличаясь лишь степенью разведения. Жесткость таких вод крайне редко достигает значений (8° dGH), удерживаясь обычно на уровне до 4°dGН. Ввиду того, что в таких водах [CO2]=[HCO3-], они имеют слабокислую реакцию и значение показателя рН 6,0-6,5. Обилие листового опада и активно идущее его разрушение при большом количестве осадков могут приводить к весьма высокому содержанию в таких водах СО2 и гумусовых веществ (фульвокислот) при почти полном отсутствии зольных элементов. Таковы т.н. «черные воды» Амазонии, в которых значение показателя рН может опускаться до 4,5 и дополнительно удерживаться т.н. гуматным буфером.
На содержание СО2 в природных водах оказывает влияние и их подвижность. Так в проточных водах СО2 содержится в концентрации 2 – 5 мг/л (до 10), тогда как в стоячих водах болот и прудов эти величины достигают значения 15 – 30 мг/л .
В засушливых и бедных растительностью регионах на формирование ионного состава поверхностных вод заметное влияние оказывает геологический возраст горных пород, слагающих кору выветривания и их химический состав. В них рН и пропорции типоморфных ионов будут отличаться от приведенных выше. В результате формируются воды с заметным содержанием SО4— и Сl-, а из катионов могут преобладать Nа+ с заметной долей Mg++. Возрастает и общее содержание солей – минерализация. В зависимости от содержания гидрокарбонатов, значение показателя рН таких вод колеблется в среднем от рН 7±0,5 до рН 8±0,5, а жесткость всегда выше 10°dGH. В стабильно щелочных водах, при рН>9, основными катионами всегда будут Mg++ и Na+ с заметным содержанием калия, поскольку Са++ осаждается в форме известняка. В этом плане особенно интересны воды Великой Африканской рифтовой долины, которая характеризуется т.н. содовым засолением. При этом даже воды таких гигантов, как озера Виктория, Малави и Танганьика отличаются повышенной минерализацией и таким высоким содержанием гидрокарбонатов, что карбонатная «жесткость» в их водах превышает жесткость общую: dKH>dGH.
Содержащиеся в воде СО2 и его производные – гидрокарбонаты и карбонаты, связаны между собой т.н. углекислотным равновесием:
СО2 + Н2О↔Н++НСО3-↔2Н+ + СО3--
В тех регионах, где кора выветривания молодая и содержит известняк (СаСО3), углекислотное равновесие выражается уравнением
СаСО3 + СО2 + Н2О = Cа++ + 2НСО3-
Применив к этому уравнению закон действия масс (см. выше) и приняв во внимание, что [h3O]=const и [CaCO3]=const (твердая фаза), получаем:
[Ca++][HCO3-]2/[CO2] = КСО2
где КСО2 – константа углекислотного равновесия.
Если концентрации действующих веществ выражены в миллимолях (mM,10-3М), то КСО2 = 34,3. Из уравнения КСО2 видна неустойчивость гидрокарбонатов: в отсутствие СО2, т.е. при [CO2]=0, уравнение не имеет смысла. При отсутствии углекислого газа гидрокарбонаты разлагаются до СО2 и подщелачивают воду: НСО3-→ОН-+СО2. Содержание свободной СО2 (для «неживой» воды весьма незначительное), которое обеспечивает устойчивость данной концентрации гидрокарбонатов при неизменном рН, называется равновесной углекислотой - [CO2]р. Она связана как с содержанием углекислого газа в воздухе так и с dКН воды: с ростом dКН увеличивается и количество [СО2]р. Содержание СО2 в природных водах как правило близко к равновесной и именно эта их особенность, а не значения dKH, dGН и рН чаще всего отличает состояние природных вод от аквариумной воды. Решив уравнение КСО2 относительно СО2, можно определить концентрацию равновесной углекислоты:
[CO2]р = [Ca++][HCO3-]2/КСО2
Поскольку в пресноводной аквариумистике понятия общей жесткости, карбонатной «жесткости» и кислотности являются культовыми, то интересно, что уравнения:
К1 = [H+][HCO3-]/[CO2]иКСО2 = [Ca++][HCO3-]2/[CO2]
объединяют их в одну систему. Разделив КСО2 на К1, получим обобщенное уравнение:
КСО2/К1=[Ca++][HCO3-]/[H+]
Напомним, что [H+] и рН объединяет обратнопропорциональная зависимость. Тогда последнее уравнение показывает, что параметры: dGH, dKH и рН связаны прямопропорционально. Это значит, что в состоянии, близком к газовому равновесию, увеличение концентрации одного компонента приведет к увеличению концентрации остальных. Данное свойство хорошо заметно при сравнении химического состава природных вод разных регионов: более жесткие воды отличаются более высокими значениями рН и dКН.
Для рыб оптимальное содержание СО2 составляет 1–5мг/л. Концентрации более 15мг/л опасны для здоровья многих видов аквариумных рыб (см. ниже).
Таким образом, с точки зрения углекислотного равновесия, содержание СО2 в природных водах всегда близко к [CO2]р.
4. ОБ АКВАРИУМНОЙ ВОДЕ И ПРОИЗВЕДЕНИИ РАСТВОРИМОСТИ
Аквариумная вода не бывает равновесной по содержанию СО2 в принципе. Измерение содержания углекислоты с помощью СО2-теста позволяет определить общее содержание углекислого газа – [CO2]общ, значение которого, как правило, превышает концентрацию равновесной углекислоты – [CO2]общ>[CO2]р. Это превышение называется неравновесной углекислотой – [CO2]нер. Тогда
[CO2]нер = [CO2]общ – [CO2]р
Обе формы углекислоты – и равновесная и неравновесная, являются не измеряемыми, а только расчетными параметрами. Именно неравновесный углекислый газ обеспечивает активный фотосинтез водных растений и с другой стороны, может создавать проблемы при содержании отдельных видов рыб. В хорошо сбалансированном аквариуме естественные суточные колебания содержания углекислого газа не приводят к падению его концентрации ниже [CО2]ри не превышают возможностей буфера аквариумной воды. Как будет показано в следующей главе, амплитуда этих колебаний не должна превышать ±0,5[CO2]р. Но при увеличении содержания углекислого газа на более, чем 0,5[CO2]р, динамика заявленных компонентов СО2-системы – dGH, dKH и рН, будет сильно отличаться от природной: общая жесткость (dGH) в такой ситуации возрастает на фоне падения значений рН и dКН. Именно такая ситуация в корне может отличать аквариумную воду от природной. Происходит повышение dGH в результате растворения известняка грунта. В такой воде могут затрудняться жизненно важные процессы газообмена в организме рыб, в частности – выведение СО2, а формирующиеся ответные патологические процессы часто приводят к ошибкам при оценке ситуации (см ниже). В морских рифовых аквариумах такая вода может растворять свежеосажденный СаСО3 скелета жестких кораллов, в том числе на месте травмы, что может приводить к отслоению тела полипа от скелета и гибели животного при благополучии аквариума по другим параметрам.
При обилии водных растений, на свету возможна ситуация, когда [CO2]общ<[CO2]р. В этом случае растения будут влачить жалкое существование, а вода будет склонна к отложению СаСО3, особенно на зрелых листьях. Поэтому в аквариумах для выращивания водных растений рекомендуется поддерживать [CO2]нер< 3 – 5 мг/л. Последнее неравенство также характерно для морских вод коралловых рифов. В океанологии данная ситуация описывается т.н. индексом насыщенности вод карбонатом кальция. В такой обстановке фотосинтез симбионтных зооксантелл в телах коралловых полипов еще больше усиливает приведенное неравенство, что в итоге приводит к отложению СаСО3 и росту скелета полипа. К сожалению, в морской аквариумистике этот параметр применения пока не нашел. Ввиду такого важного значения растворимости известняка СаСО3, познакомимся с химией этого процесса подробнее.
Как известно, осаждение из раствора кристаллов любого вещества начинается при его т.н. насыщенных концентрациях, когда вода больше не способна вмещать в себе это вещество. Водный раствор над осадком (твердой фазой) всегда будет насыщен ионами вещества, независимо от его растворимости и будет находиться в состоянии химического равновесия с твердой фазой. Для известняка это выразится уравнением: СаСО3(тв.)=Са+++СО3--(р-р). Применив закон действия масс, получим: [Ca++][CO3--](р-р)/[CaCO3](тв.)=К. Поскольку [CaCO3](тв.)=const (твердая фаза), то тогда [Ca++][CO3--](р-р)=К. Т.к. последнее уравнение характеризует способность вещества растворяться, то такое произведение насыщенных концентраций ионов трудно растворимых веществ назвали произведением растворимости - ПР (ср. с ионным произведением воды Кw).
ПРСаСО3 = [Ca++][CO3--] = 5•10-9. Как и ионное произведение воды, ПРСаСО3 остается постоянным, независимо от изменения концентраций ионов кальция и карбонатов. Тогда при наличии в аквариумном грунте известняка, в воде всегда будут присутствовать карбонат-ионы в количестве, определяемом ПРСаСО3 и общей жесткостью:
[CO3--] = ПРСаСО3/[Ca++]
В присутствии в воде неравновесного углекислого газа происходит реакция:
СО3--+СО2+Н2О=2НСО3-
которая понижает насыщающую концентрацию карбонат-ионов [СО3--]. В результате в соответствии с произведением растворимости, в воду будут поступать компенсаторные количества СО3-- из СаСО3, т.е. известняк начнет растворяться. Поскольку СО2+Н2О=Н++НСО3-, смысл приведенного выше уравнения можно сформулировать точнее: СО3--+Н+=НСО3-. Последнее уравнение говорит о том, что карбонаты, находящиеся в воде в соответствии с ПРСаСО3, нейтрализуют кислоту (Н+), образующуюся при растворении СО2, в результате чего рН воды сохраняется неизменным. Таким образом, мы постепенно пришли к тому, с чего начинали разговор:
5. КАРБОНАТНАЯ БУФЕРНАЯ СИСТЕМА
Растворы называют буферными, если они обладают двумя свойствами:
А: Значение показателя рН растворов не зависит от их концентрации, или от степени их разведения.
Б: При добавлении кислоты (Н+), или щелочи (ОН-), величина их показателя рН мало изменяется, пока концентрация одного из компонентов буферного раствора не изменится более, чем наполовину.
Указанными свойствами обладают растворы, состоящие из слабой кислоты и ее соли. В аквариумной практике такой кислотой является углекислота, а ее доминирующей солью – гидрокарбонат кальция – Са(НСО3)2. С другой стороны, повышение содержания СО2 выше равновесного эквивалентно добавлению в воду кислоты - Н+, а понижение его концентрации ниже равновесного – равносильно добавлению щелочи - ОН- (разложение гидрокарбонатов - см. выше). Количество кислоты или щелочи, которое необходимо внести в буферный раствор (аквариумную воду), чтобы значение показателя рН изменилось на 1 единицу, называется буферной емкостью. Отсюда следует, что рН аквариумной воды начинает изменяться раньше, чем исчерпывается ее буферная емкость, но по исчерпании буферной емкости, рН изменяется уже эквивалентно количеству внесенной кислоты, или щелочи. В основе работы буферной системы лежит т.н. принцип Ле Шателье: химическое равновесие всегда смещается в сторону, противоположную приложенному воздействию. Рассмотрим свойства А и Б буферных систем.
А. Независимость рН буферных растворов от их концентрации выводится из уравнения Хендерсона-Хассельбальха: рН = рК1 +lg[HCO3-]/[CO2]. Тогда при разных концентрациях НСО3- и СО2 их отношение [HCO3-]/[CO2] может быть неизменным. Так, например, [HCO3-]/[CО2] = 20/8 = 10/4 = 5/2 = 2,5/1 = 0,5/0,2 = 2,5, - т.е. разные воды, отличающиеся значением карбонатной «жесткости» dКН и содержанием СО2, но содержащие их в одинаковой пропорции, будут иметь одинаковое значение показателя рН (см.также гл.2). Уверенно отличаться такие воды будут по своей буферной емкости: чем выше концентрация компонентов буферной системы, тем больше ее буферная емкость и наоборот.
Аквариумисты сталкиваются с данным свойством буферных систем обычно в периоды весеннего и осеннего паводка, если станции водозабора снабжаются поверхностной, а не артезианской водой. В такие периоды буферная емкость воды может уменьшаться настолько, что некоторые виды рыб не выдерживают традиционной плотной посадки. Тогда начинают появляться истории о загадочных болезнях, выкосивших например, скалярий, или меченосцев и против которых бессильны все лекарства.
Б. Можно говорить о трех буферных системах аквариумной воды, каждая из которых устойчива в своем диапазоне рН:
1. рН<8,3 СО2/НСО3- гидрокарбонатный буфер
2. рН=8,3 НСО3- гидрокарбонатный буфер
3. рН>8,3 НСО3-/СО3-- карбонатный буфер.
Рассмотрим свойсво Б в двух вариантах: вар. Б1 - при возрастании содержания СО2 и вар. Б2 – при уменьшении его содержания.
Б1. Концентрация СО2 увеличивается (плотная посадка, очень старая вода, перекорм).
Кислотные свойства СО2 проявляются в образовании ионов водорода Н+ при взаимодействии его с водой: СО2+Н2О→Н++НСО3-. Тогда увеличение концентрации СО2 равносильно увеличению концентрации ионов водорода Н+. Согласно принципа Ле Шателье это приведет к нейтрализации Н+. В этом случае буферные системы работают следующим образом.
Карбонатный буфер 3: при наличии карбонатного грунта ионы водорода будут поглощаться присутствующими в воде карбонатами: Н++СО3--→НСО3-. Следствием этой реакции будет растворение СаСО3 грунта (см. выше).
Гидрокарбонатный буфер 1 – 2: по реакции Н++НСО3-→CO2↑+Н2О. Стабильность рН будет достигнута за счет уменьшения карбонатной «жесткости» dКН, а удаление образующегося СО2 – либо за счет фотосинтеза, либо за счет диффузии его в воздух (при надлежащей аэрации).
Если источник избытка СО2 не будет устранен, то при уменьшении значения dКН вдвое от исходного, рН воды начнет понижаться при сопутствующем падении буферной емкости и увеличении общей жесткости. Когда величина показателя рН уменьшится на 1 единицу, емкость буферной системы будет исчерпана. При значении рН=6,5 содержание оставшихся гидрокарбонатов [HCO3-]=[CO2], а при рН<6 гидрокарбонаты будут присутствовать лишь в виде следа.
В итоге стабильность рН будет оплачена ценой понижения dКН, увеличения dGH и расходования буферной емкости воды. Такая вода уже будет сильно отличаться от природной (см. выше) и не всякая рыба сможет в ней выжить. В аквариумной практике принято считать нижней границей нормы количество гидрокарбонатов, соответствующее 4°dКН. Можно добавить, что для ряда видов аквариумных рыб (живородки, скалярии, атерины и др.) понижение карбонатной «жесткости» ниже 2°dКН может закончится трагично. Но в то же время, многие мелкие харациновые, расборы, радужницы такую воду переносят.
Б2. Противоположные процессы – подщелачивание воды вследствие уменьшения содержания СО2 в аквариуме ниже равновесного - возможны либо при активном фотосинтезе растений, либо при искусственном внесении в воду гидрокарбонатов в виде пищевой соды – NаНСО3. Тогда, согласно принципу Ле Шателье, это приведет к следующему противодействию со стороны буферных систем аквариумной воды.
Гидрокарбонатный буфер 1: стабильность рН будет удерживаться за счет диссоциации гидрокарбонатов: НСО3-→Н++СО3--. Тогда вслед за понижением содержания
СО2, будет пропорционально понижаться и количество гидрокарбонатов, а значение отношения [НСО3-]/[CO2] сохраняться постоянным (см. свойство А, уравнение Хендерсона-Хассельбальха). При падении содержания углекислоты менее 0,5[CO2]р, значение показателя рН начнет увеличиваться и может возрасти до рН=8,3. По достижении этого значения, гидрокарбонатный буфер 1 свои возможности исчерпывает, поскольку в такой воде СО2 практически отсутствует.
Гидрокарбонатный буфер 2 удерживает значение рН=8,3. Эта цифра следует из формулы [Н+]=√К1К2, где К1 и К2 – 1 и 2-ая константы диссоциации угольной кислоты (см. выше). Тогда:
рН = -lg√К1К2 = -lg√(4•10-7)(5,6•10-11) = 8,3
Т.е. значение рН растворов любых гидрокарбонатов постоянно, не превышает рН=8,3 и является следствием самой химической природы этих веществ.
В отсутствие СО2 гидрокарбонаты разлагаются по уравнению:
НСО3- →СО2+ОН-, подщелачивая воду и выделяя СО2, который потребляют растения. Но, тот же гидрокарбонат нейтрализует ОН- по схеме: НСО3-→СО3--+Н+; и Н++ОН-→Н2О. Поэтому значение показателя рН будет сохраняться стабильным, что отражает суммарное уравнение:
2НСО3-→СО3--+СО2+Н2О
Стабильность рН достигается опять же за счет уменьшения количества гидрокарбонатов, т.е. за счет понижения буферной емкости воды. Однако аквариумный тест dКН это уменьшение не чувствует в силу особенностей самого метода анализа.
Поскольку гидрокарбонат-ион обладает способностью к диссоциации как по кислотному, так и по основному типу, т.е: НСО3- →Н++СО3--и НСО3- →ОН-+СО2, то карбонатная «жесткость» dКН (содержание гидрокарбонатов), также является буферной системой.
Искусственное внесение в воду гидрокарбонатов (обычно в виде пищевой соды) иногда практикуется при содержании цихлид из Великих Африканских озер и в морской аквариумистике. При этом реализуются две стратегии: увеличение буферной емкости аквариумной воды и повышение значения показателя рН до 8,3.
Если количество СО2 в аквариумной воде будет уменьшаться и далее, то при падении его содержания вдвое, по сравнению с равновесным, рН воды начнет возрастать. По превышении показателем рН значения рН=8,3, углекислый газ из воды исчезает, и неорганический углерод представлен только гидрокарбонатами и карбонатами.
Карбонатный буфер 3. По превышении карбонатами концентрации, соответствующей произведению растворимости [CO3--]=ПРСаСО3/[Cа++], в воде начнут образовываться кристаллы СаСО3. Поскольку основным и единственным потребителем СО2 в пресноводном аквариуме являются водные растения, то рассматриваемые процессы происходят преимущественно на поверхности зеленого листа. При возрастании рН>8,3 поверхность зрелых листьев начнет покрываться известковой коркой, которая является замечательным субстратом для роста водорослей. Связывая карбонаты СО3--, образующийся СаСО3 также поддерживает стабильность рН. Однако в отсутствие ионов Са++ (в очень мягкой воде), при активном фотосинтезе рост концентрации карбонатов будет повышать значение показателя рН вследствие гидролиза карбонатов: СО3--+Н2О→ОН-+НСО3-.
При увеличении значения показателя рН на 1 единицу, по сравнению с исходным, буферная емкость воды будет исчерпана, и при продолжающемся падении содержания СО2, значение показателя рН может быстро повыситься до рискованного рН>8,5. В итоге падение содержания СО2 в аквариумной воде приведет к росту значения показателя рН при некотором уменьшении общей жесткости. В такой воде (также сильно неравновесной, как и в варианте Б1) весьма дискомфортно будут себя чувствовать многие мягководные рыбы.
Таким образом карбонатная буферная система воды объединяет в себе традиционные аквариумные гидрохимические параметры: жесткость общую и карбонатную, рН, а также содержание СО2. В ряду dGH – pH - dKH – CO2самым консервативным параметром является dGH, а самым изменчивым – СО2. По степени изменения dGH, pH и особенно dKH по сравнению с отстоянной, проаэрированной водопроводной водой можно судить о степени напряженности процессов дыхания и фотосинтеза в аквариуме. Исчерпание буферной емкости аквариумной воды как в ту, так и в другую сторону, настолько изменяет ее способность поглощать СО2, что именно это свойство зачастую превращает ее в сильно неравновесную по содержанию СО2 и кардинально отличает от природной. Изменение способности аквариумной воды поглощать выдыхаемый рыбами СО2, может превышать физиологические возможности организма рыб по его выведению. Поскольку это отражается на здоровье рыбного населения аквариума, то следует познакомиться с особенностями физиологического действия СО2 на организм рыб.
© Александр Яночкин, 2005 г.© Аква Лого, 2005 г.
(Продолжение - Часть 2 >>)
Поля, отмеченные знаком *, обязательны для заполнения.
www.aqualogo.ru
Буферные растворы | Равновесие в водных растворах
В лабораторной практике очень часто приходится работать с растворами, которые должны иметь определенную величину рН. Для этого готовят так называемые буферные растворы. Это растворы, рН ‘которых практически не меняется при разведении, а также при добавлении небольших количеств кислот или щелочей.
Буферные растворы обычно представляют собой смесь растворов:
а) слабая кислота и соль этой кислоты и сильногооснования, например Ch4COOH + Ch4COONa;
б) слабое основание и соль этого основания и сильной кислоты, например Nh50H+Nh5C1;
>в) смесь средних и кислых солей, например Na3P04+Nah3P04.
Меняя концентрацию и соотношение растворов, мы можем получить буферные растворы с различным рН.
Разберемся, на чем основаны свойства буферных растворов, на примере буферной смеси уксусной кислоты и ацетата натрия.
1. Разбавление водой. Уксусная кислота — кислотаслабая, кроме того, ее диссоциация еще уменьшаетсяблагодаря присутствию ацетата натрия (влияние одноименного иона).
Предположим, что рассматриваемый раствор разбавляют водой в 10 или в 20 раз. Казалось бы, вследствие сильного уменьшения концентрации уксусной кислоты концентрация ионов Н+ должна уменьшиться, но этого не происходит, потому что с разбавлением увеличивается степень диссоциации уксусной кислоты, так ,каж уменьшается концентрация ацетата натрия, подавляющего диссоциацию уксусной кислоты этого раствора. Следовательно, при разбавлении водой рН практически не изменится.
2. Прибавление сильной кислоты. При добавлениик буферной смеси небольшого количества сильной кислоты, например, соляной, происходит реакция:
Ch4COONa + НС1 = NaCl + СН3СООН.
Ионы Н+, поступающие в раствор, будут связываться в молекулы уксусной кислоты с малой степенью диссоциации. Таким образом, концентрация ионов Н+ почти не увеличится и рН раствора практически не изменится
Если такое же количество кислоты прибавить в чистую воду, все ионы Н+ останутся в растворе, концентрация ионов водорода увеличится во много раз и рН раствора заметно изменится. А водород, как известно — Самый распространенный химический элемент
3. Прибавление небольшого количества щелочи. Прибавленная в буферную смесь щелочь вступает-в реакцию с уксусной кислотой:
СН3СООН + NaOH = Ch4COONa + Н20.
Ионы ОН~ связываются ионами Н+ уксусной кислоты в недиссоциированные молекулы воды. Однако убыль этих ионов пополняется в результате диссоциации молекул уксусной кислоты. Таким образом, рН раствора после прибавления щелочи практически не изменится.
Если лее прибавить щелочь в чистую воду, все ионы ОН» останутся в растворе. Концентрация ионов ОН» резко возрастет, концентрация ионов Н+ соответственно уменьшится и рН раствора изменится заметно.
Аналогичные явления наблюдаются при добавлении небольших количеств кислот и щелочей к другим буферным смесям. Рассмотрим несколько примеров.
1. Прибавление щелочи к» буферной смеси Na3P04-f-Nah3P04. Прибавленная щелочь вступает в реакцию с дигидрофосфатом натрия
NaH,P04 + 2NaOH = Na3P04 + 2Н20
ионы ОН» связываются ионами Н+ в (молекулы воды.
2. Прибавление кислоты к буфернойсмеси h3C204+Na2C204. Происходит реакция междуоксалатом натрия и прибавленной кислотой.
Na2C204 + 2НС1 = 2NaCl + h3C204.
В результате ионы Н+ связываются ионами С2ОГ в сла-бодиссоциированные молекулы Н2С204.
Способность буферных смесей поддерживать практически постоянный рН основана на том, что отдельные компоненты смеси связывают ионы Н+ или ОН» вводимых в раствор кислот и оснований. Конечно эта возможность не безгранична. Всякая буферная смесь практически сохраняет постоянство рН только до прибавления определенного количества кислоты или щелочи, иначе говоря, каждый буферный раствор характеризуется определенной буферной емкостью. Буферной емкостью называется количество эквивалентов кислоты или щелочи,
при добавлении которых к 1 л буферного раствора его рН изменяется на единицу.
Буферные растворы широко применяются в аналитической химии. Многие процессы осаждения труднорастворимых электролитов проходят при определенном значении рН раствора. Например, при осаждении катионов II группы [мы применяем буферную смесь Nh5OH + +.Nh5CI, создавая тем самым рН»8,5, при котором основной карбонат магния не осаждается.
Буферные растворы играют огромную роль в жизни организмов, обеспечивая постоянство рН крови и лимфы.
505days.com



















