Справочник химика 21. Азот вода
Азот и вода - Справочник химика 21
Реакции аминов с азотистой кислотой. Первичные амины при взаимодействии с азотистой кислотой (НМОа) образуют спирты, при этом выделяется газообразный азот и вода [c.274]Сырьем для производства аммиака является смесь азота и водо рода. Эту смесь получают разными способами. Наиболее распространенные из них газификация твердого и жидкого топлив с последующей конверсией окиси углерода, конверсия метана и других углеводородных газов, комплексная переработка природного газа в ацетилен и синтез-газ, фракционное разделение горючих газов, в частности коксового, методом глубокого охлаждения, разделение воздуха на азот и кислород с применением для этого глубокого холода и электрохимический способ получения водорода и кислорода. [c.151]
Какое количество электронных пар принимает участие Б образовании молекул брома, кислорода, азота и воды [c.68]Промышленные производства нитрата аммония полагались на исключении исходных веществ, возможности получения которых очень ограничены (аммиак с газового завода, натриевая селитра), и замене их основными исходными веществами, запасы которых практически неограничены (кислород, азот и вода), а также на нахождении такого решения, при котором используется теплота, выделяющаяся при проведении экзотермической реакции взаимодействия аммиака с азотной кислотой, для упаривания раствора нитрата аммония. [c.53]
При термическом разложении бихромата аммония образуется оксид хрома(III), выделяется азот и вода [c.93]
При взаимодействии олова с азотной кислотой образуются оловянная кислота, двуокись азота и вода. Написать уравнение реакции. [c.113]
Решение. Принимаем следующие упрощения 1) содержание примесей в расчете опускается 2) летучие части содержат только углерод (пренебрегаем содержанием водорода, кислорода, азота и воды в угле) 3) воздух состоит [c.124]
Обслуживающий персонал должен знать, что при истечении газов через неплотности в аппаратах и трубопроводах необходимо немедленно отключить поврежденные участки, чтобы предотвратить загорание и взрыв газа. В случае загорания газа, вытекающего в помещение через поврежденные трубопроводы и различного рода неплотности, запрещается сбивать пламя любыми средствами и способами, в том числе паром, двуокисью углерода, азотом и водой. [c.108]
В присутствии катализатора окисляется до оксида азота и воды [c.157]
Полное исключение токсичных выбросов возможно на установках каталитической очистки, когда в присутствии газа-восстановителя (водорода, природного газа и др.) происходит восстановление окислов азота до азота и воды, не загрязняющих атмосферу. При этом степень очистки составляет 98%. [c.211]
Формула (7.57) получена аналитически и откорректирована по экспериментальным данным при пленочном кипении углеводородов, азота и воды. [c.236]
При сгорании некоторого веш,ества в кислороде образуются углекислый газ, азот и вода. О присутствии каких химических элементов в веществе свидетельствует этот факт [c.8]
Почему хлорид и фосфат аммония прн нагревании разлагаются с образованием аммиака и соответствующей кислоты, а нитрат аммония — с образованием закиси азота и воды [c.74]
Запись данных опыта. Написать уравнение реакции разложения, учитывая, что одновременно образуются азот и вода. Указать окислитель и восстановитель. К какому типу окислительновосстановительных реакций относится данная реакция [c.230]
Дихромат аммония при нагревании до 200 С разлагается с образованием оксида хрома (III), азота и воды. Составьте уравнение этой реакции и укажите, к какому типу превращений она относится. [c.126]
Все платиновые металлы во многом сходны между собой. Это — благородные металлы, малораспространенные в природе. Встречаются только в самородном состоянии. Химически очень стойки. На воздухе и во влажных средах не тускнеют и не корродируют. Кислоты (НС1, НзЗО на них не действуют. Большинство платиновых металлов не растворяется даже в царской водке только платина в ней растворяется, а палладий растворим также и в НЫОз-Как и все металлы УИ1 группы, платина и ее аналоги — комплексообразователи и активные катализаторы. Как правило, они проявляют способность поглощать значительные количества газообразных На и Оа, переводя последние в химически активное состояние. Эта способность особенно сильно проявляется именно у платиновых металлов. Указанное явление носит название окклюзии-, оно имеет большое значение для катализации процессов гидрогенизации (присоединения водорода) или окисления. Так, например, Ре, Ки и Оз энергично катализируют процесс синтеза ЫНз чз азота и водо- [c.553]
При растворении свинца в концентрированной азотной кислоте образуются нитрат свинца, двуокись азота и вода. Написать уравнение реакции. [c.113]
Осмий в виде порошка взаимодействует с концентрированной дымящей азотной кислотой, образуя 0504, двуокись азота и воду. Написать уравнение реакции. [c.114]
При взаимодействии металлического магния с разбавленной азотной кислотой образуются нитрат магния, закись азота и вода. Написать уравнение. [c.59]
Амины на воздухе горят с выделением оксида угле- рода (IV), азота и воды, например [c.253]
Физические свойства. Азот — газ без цвета, запаха и вкуса, легче воздуха. Растворимость в воде меньше, чем у кислорода при 20°С в 1 л воды растворяется 15,4 мл азота (кислорода 31 мл). Поэтому в воздухе, растворенном в воде, содержание кислорода по отношению к азоту больше, чем в атмосфере. Малая растворимость азота в воде, а также его очень низкая температура кипения объясняются весьма слабыми межмолекулярными взаимодействиями как между молекулами азота и воды, так и между молекулами азота. [c.188]
Горение аммиака при обычных условиях приводит к образованию молекулярного азота и воды [c.81]
Малая растворимость азота в воде, а также его очень низкая температура кипення объясняются весьма слабыми межмолекулярными силами как между молекулами азота и воды, так и между молекулами азота. [c.105]
Определите, в какую сторону смещается равновесие реакции между двуокисью азота и водой при изменении температуры. [c.54]
Удельная поверхность окиси алюминия под действием температур в результате постепенного спекания мелких жается со 160—330 м /г свежего катализатора до 80—100 Количество перерабатываемого сырья на 1 кг катализа" ,ц ставляет от 70 до 200 м и более. Современные катализато Р со-форминга, содержащие рений, выдерживают многократнук Д ри-600 раз и более) регенерацию. Значительно менее требов З— к содержанию в сырье серы, азота и воды катализаторы, з 1>ны рых платина введена в цеолит. Катализаторы риформинга пр Т о рируют осушенными дымовыми газами, содержащими 0,5-- о/ Не лорода. Выгорание кокса происходит при равных условиях > цс ростью, значителшо большей (до двух порядков), чем при пр Но рации алюмосиликатов, так как платина является активнь Че [c.255]
Аммиак сгорает в кислороде и в воздухе (предварительно подогретом) с образованием азота и воды [c.191]
Амины горят на воздухе с выделением оксидам углерода (IV), азота и воды, например [c.241]
Наряду с жидкими и газообразными окислителями для очистки сточных вод применяются и твердые оксиды и гидроксиды металлов переменной валентности (никеля, кобальта, меди, железа, марганца). Гидроксид никеля высшей валентности легко окисляет тидразингидрат, спирты, альдегиды, алифатические и ароматические амины. Продуктами окисления являются в основном карбонаты, азот и вода. Метод рекомендуется для обезвреживания сточных вод с концентрацией токсичных соединений до 0,5 г/л, что является его недостатком. [c.494]
Как получить Nh5NO3, воспользовавшись в качестве исходных веществ атмосферным азотом и водой [c.231]
Реактор для производства концентрированной азотной кислоты из жидких окислов азота. Жидкие окислы азота и воду перемешивают с газообразным кислородом под давлением. Азотная кислота образуется по следуюпцей экзотермической реакции [c.172]
Реакции окисления—типичные высокоэкзотермические реакции — могут привести к выходу либо очень стабильных продуктов (например, превращение аммиака в азот и воду), либо промежуточных продуктов — селективное окисление (например, превращение аммиака в окислы азота, метана в формальдегид и пропилена в акролеин). [c.14]
При определенных условиях подачи тока на электродах электролизера возникают пузырьки газа, обеспечивающие реализацию электрофлотации, так, нахгример, если ввести в воду безбалластный реагент — нитрат аммония — в электролизере произойдет его разложение на азот и воду, что увеличивает количество флотирующего агента и интенсифицирует процесс (табл. 1.3). [c.17]
Установите формулу некоторого водородного соеди-иення азота, если при сжигании его образуются азот и вода в весовом отнощении соответственно 7 9. 320 мл паров исходного вещества при давлении 1 атм и температуре 117°С весят 0,32 г. [c.39]
Этот метод и до сих пор применяется на станциях малой мощности. Однако при сульфитной обработке воды повышается солесодержание, что недопустимо на электростанциях, работающих при высоком давлении пара. На таких станциях кислород удаляют при помощи гидразина ЫгН4,являющегося сильным восстановителем. При взаимодействии гидразина с кислородом образуются азот и вода по уравнению реакции [c.346]
Платина растворяется в царской водке (смесь кислот азотной и соляной). Образуются гексахлороплатиновая кислота, в которой окислительное число платины равно +6, окись азота и вода. Написать уравнение реакции. [c.114]
Поскольку азот в аммиаке имеет низшую степень окисления (—3), то последний проявляет восстановительные свойства. Так, аммиак реагирует с кислородом с образованием азота и воды 4Nh4 + 30, = 2Mj + 6H,0 [c.108]
Решая систему уравнений (а), (б) и (в), находим, что п(К)= 2 моль, п(П) = 4 моль, п(0) = 2 моль, т.е. формула соединения N211402 или Nh5N02. При нагревании этой соли образуются азот и вода [c.144]
Наконец, в пятую пробирку внести 6—8 капель концентрированной азотной кислоты (пл. 1.4). Наблюдать выпадение белого осадка. Написать уравнение реакции с учетом образования р-оло-вяной кислоты НзЗпОз, двуокиси азота и воды. [c.223]
Нитриты разрушают при осторожном нагревании их насыщенных растворов с твердым Nh5 I или (Nh5) .S04. При этом нон N0 реагирует с ионом NH.I, образуя свободный азот и воду [c.259]
chem21.info
Публикации компании "Гидрология"
Добавлено: 28.03.2014
Каждый владелец искусственного водоёма, населённого рыбой, желает, чтобы он был максимально похож на естественный, но при этом вода в искусственном пруду была прозрачной, высшие водные растения вокруг росли нормально, а водоросли, наоборот, чтобы сильно не развивались, рыба была здоровой. Поэтому основная задача каждого владельца искусственного водоёма, чтобы пруд выглядел замечательно – добиться баланса замкнутой экосистемы водоёма.
Почему нарушается баланс азота в искусственном водоёме??
В воду искусственного пруда постоянно попадает корм и продукты жизнедеятельности рыб. В процессе разложения этих остатков в воде образуется большое количество фосфора (P) и азота (N) в виде аммиака (Nh4). Аммиак, в процессе окисления кислородом, преобразуется в нитрат (NO3). Фосфор и нитрат – это питательные вещества для растений. Правильное планирование искусственного водоёма позволяет удерживать количество нитратов и фосфатов в воде близким к нулю – и ваш искусственный водоём чувствует себя хорошо. Неправильное планирование приводит к сбою баланса и неспособности экосистемы искусственного пруда перерабатывать все поступающие питательные вещества. Происходит накопление их избытка и как следствие – неконтролируемый рост водорослей.
Эта опасность грозит любому виду искусственного водоёма – плавательному водоёму, декоративному водоёму, живому бассейну, садовому аквариуму, - неправильно спланированному и неправильно «настроенному» с точки зрения биологического баланса.
Азот.
Азот – важнейший элемент живой природы, поэтому важно правильно «настроить» его круговорот в любом искусственном водоёме.
Азот содержится в молекулах белка, пептидах, аминокислотах, в хлорофилле, в рибонуклеиновых кислотах, витаминах. Азот очень важен для жизни - без азота невозможен фотосинтез, образование хлорофилла, белка и продолжение рода. Азот в атмосфере находится в виде газа. Молекула азота состоит из двух атомов азота (N2) очень сильно связанных друг с другом. Редкие живые организмы имеют «механизм», позволяющий разорвать эту связь, поэтому газообразный азот, даже растворённый в воде не участвует в обороте питательных веществ. Вместо этого весь азот входит в оборот веществ в виде аммиака (Nh4).
Откуда азот берётся в воде искусственного водоёма?
Рыбы, поедая корм, загрязняют водоём экскрементами. 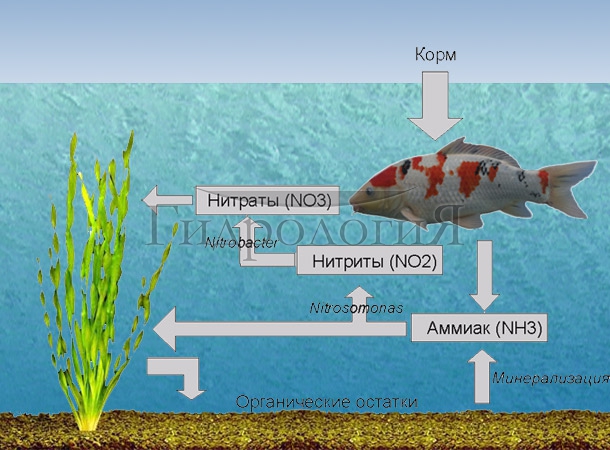 Растения обновляются, какие-то части их отмирают. В остатках корма, в продуктах жизнедеятельности рыб, в гниющих тканях растений, в прочих разлагающихся органических отложениях есть белок. Всё что содержит белок, содержит и азот. Бактерии минерализуют (минерализация это разрушение органической субстанции до неорганических веществ) все перечисленные органические остатки, в результате из белка получается аммиак (Nh4), который далее окисляется до аммония (Nh5+). Также, аммиак производится рыбами и выделяется в воду через их жабры, производится грибками и бактериями. Вообще аммиак это побочный продукт биологических процессов всех организмов. Азот в виде аммиака попадает в водоём и начинается процесс, который можно назвать «круговорот азота в природе» или азотный цикл.
Растения обновляются, какие-то части их отмирают. В остатках корма, в продуктах жизнедеятельности рыб, в гниющих тканях растений, в прочих разлагающихся органических отложениях есть белок. Всё что содержит белок, содержит и азот. Бактерии минерализуют (минерализация это разрушение органической субстанции до неорганических веществ) все перечисленные органические остатки, в результате из белка получается аммиак (Nh4), который далее окисляется до аммония (Nh5+). Также, аммиак производится рыбами и выделяется в воду через их жабры, производится грибками и бактериями. Вообще аммиак это побочный продукт биологических процессов всех организмов. Азот в виде аммиака попадает в водоём и начинается процесс, который можно назвать «круговорот азота в природе» или азотный цикл.
Круговорот азота в природе.
Круговорот азота состоит из двух частей – нитрификации и денитрификации.
Нитрификацией называется процесс, при котором аммиак (Nh4) преобразуется в нитрит (NO2), а нитрит преобразуется в нитрат (NO3).
Денитрификацией называется процесс, при котором нитрат (NO3) преобразуется в нитрит (NO2), а нитрит преобразуется в азот (N2).
Эти процессы в основном происходят в грунте искусственного водоёма.
Нитрификац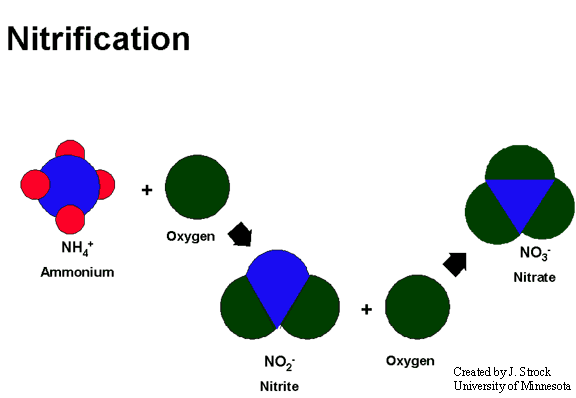 ия.
ия.
Находящиеся в водоёме нитрифицирующие бактерии окисляют аммоний до нитрита, в результате реакции помимо нитрита получается водород и вода и выделяется энергия. Эту энергию бактерии используют для своей жизнедеятельности. Полученный нитрит другие нитрифицирующие бактерии окисляют до менее токсичного нитрата. Оба процесса проходят в водной среде и в верхних слоях грунта, для обоих процессов нужно, чтобы в воде было большое количество кислорода. По этой причине нитрификация – это так называемый аэробный процесс.
Большинство получившегося нитрата потребляется растениями для своего роста, часть выводится с ежедневными подменами воды, а часть участвует во втором процесс – денитрификации.
Денитрификация.
Денитрификация – это процесс анаэробный, проходящий без потребления кислорода. Если нитрификация проходит в воде и в верхних слоях грунта, то денитрификация проходит в нижних слоях грунта водоёма, куда не попадает кислород. Одни микроорганизмы, находящиеся в грунте, преобразуют нитрат (NO3), полученный в процессе нитрификации, в нитрит (NO2). Другие, находящиеся в грунте микроорганизмы – денитрифицирующие, преобразуют нитриты в газообразный азот (N2), который покидает водоём. И те и другие бактерии в этих процессах получают из соединений азота кислород для своей жизнедеятельности.
Баланс разных культур бактерий в грунте.
В грунте живут культуры множества бактерий. Есть бактерии анаэробные, а есть те, что в зависимости от содержания кислорода в воде становятся  или аэробными, или анаэробными. Аэробные бактерии не только поставляют нитрат для анаэробных, но и благодаря большому потреблению кислорода создают умеренноанаэробные условия. Возникает взаимновыгодный обмен между двумя типами бактерий живущих в нескольких сантиметрах верхнего слоя грунта (поэтому беспокоить субстрат в водоёме чисткой грунта водным «пылесосом» крайне нежелательно). Анаэробные бактерии разлагают нитрат до газообразного оксида азота [NO] - безвредного газа. Он растворяется в воде и выветривается в атмосферу, завершая круговорот азота.
или аэробными, или анаэробными. Аэробные бактерии не только поставляют нитрат для анаэробных, но и благодаря большому потреблению кислорода создают умеренноанаэробные условия. Возникает взаимновыгодный обмен между двумя типами бактерий живущих в нескольких сантиметрах верхнего слоя грунта (поэтому беспокоить субстрат в водоёме чисткой грунта водным «пылесосом» крайне нежелательно). Анаэробные бактерии разлагают нитрат до газообразного оксида азота [NO] - безвредного газа. Он растворяется в воде и выветривается в атмосферу, завершая круговорот азота.
Часть нитрата превращается анаэробными бактериями обратно в нитрит и аммоний. Если азот в этом случае не будет употреблен корнями растений, он превращается бактериями в газ азот [N2], химически инертный и безвредный, который растворяется в воде и выветривантся обратно в атмосферу. Со временем процессы выравниваются, и денитрификация протекает одновременно с нитрификацией в грунте в анаэробных зонах.
Важно!
Корни водных растений способны доставлять кислород в грунт, уничтожая анаэробные зоны. В субстрате из крупного гравия вообще не будет анаэробных условий. В субстрате, составленном из гравия разного размера вероятнее всего будут образовываться локальные бескислородные зоны, в которых возможно протекание денитрификации.
Конкуренция за аммоний.
Лабораторные тесты показали, что растения и водоросли НЕ потребляют нитрат в заметных количествах пока есть аммоний. Не стоит беспокоиться о полной нитрификации потому что в водоёме с большим количеством растений, любая дополнительная конкуренция за азот (в составе аммония) будет ухудшать рост растений. Слишком активное преобразование бактериями аммония [Nh5+] в нитрит [NO2] отнимает основной источник азота для питания растений.
Влияние уровня pH воды на круговорот азота.
Уровень pH играет решающую роль в нитрификации: интенсивнее этот процесс протекает при pH более 7,2 и достигает своего максимума при pH=8,3. При pH менее 7,0 интенсивность нитрификации составляет 50%, при pH=6,5 только 30%. Таким образом в водоёме в котором pH=6.8-7.2 создаются благоприятные условия для потребления аммония [Nh5+] именно растениями, а не нитрифицирующими бактериями в грунте и фильтре.
Нитрифицирующие бактерии плохо конкурируют за кислород с бактериями разлагающими органику в грунте - теми, что образуют "биологическую потребность в кислороде", что еще больше увеличивает шансы растений употребить весь доступный аммиак [Nh4] раньше нитрифицирующих бактерий.
В искусственном водоёме с большим количеством растений при pH=6.8-7.2 почти весь образовавшийся аммоний будет потреблен растениями до того, как его успеют переработать нитрифицирующие бактерии. Этим растения способствуют снижению уровня нитратов. Позднее при подрезке растений азот (нитраты) выведется из водоёма.
Вред, наносимый аммиаком.
Аммиак (Nh4) ОЧЕНЬ токсичен для рыб, уже при содержании аммиака всего около 0,05% у рыб возникает хроническое поражение жабр. Со временем оно становится необратимым. Поэтому важно, чтобы как можно быстрее попавший в воду аммиак преобразовался бактериями во много раз менее токсичное соединение – аммоний (Nh5).
Процесс преобразования аммиака в аммоний зависит от pH фактора воды. С падением pH все больше аммиака превращается в нетоксичный аммоний, например, при понижении pH на один градус токсичного аммиака становится в десять раз меньше. При pH=7.0 аммиака примерно 0,33%, при pH=6.0 - только 0,03%.
На деятельность нитрифицирующих бактерий, которые окисляют аммиак, также влияют температура воды и концентрация в воде кислорода.
Чем выше температура - тем больше доля токсичного аммиака. При 28 градусах в воде содержится вдвое больше токсичного аммиака, чем при 20 градусах (при равном pH).
Нитрифицирующие бактерии требуют много кислорода. Для протекания нитрификации содержание кислорода в воде должно быть не менее 1 мг/л.
Для обогащения воды кислородом используются аэраторы, которые подбираются исходя из объёма искусственного водоёма.
Оценка количества, попадающего в воду, азота.
Белки в среднем содержат 16% Азота. Чтобы посчитать сколько Азота вы вносите в аквариум с кормом для рыб, посмотрите содержание белка в корме, посчитайте его массу и умножьте на 0,16. Вы получите количество азота в данном корме. Например, если на банке корма массой 1 кг. написано, что в корме содержится 48% белка, это значит, что в данной банке 1000 х 0,48 = 480 грамм белка, который содержит 16% азота, т. е. - 480 х 0,16 = 76,8 грамм азота.
Плюс к этому азот, получаемый из продуктов жизнедеятельности рыб и от гниющих остатков растений.
При неправильном планировании искусственного водоёма биологические процессы не нормализуются, и поступивший в пруд азот начинает потребляться водорослями. При этом, из 1 грамма азота получается до 3-х килограммов биологической массы. Ваш искусственный водоём быстро превращается в болото!
Подводя итоги.
Для того чтобы процессы в Вашем водоёме нормализовались быстрее необходимо учесть и провести следующие действия:
- запланировать достаточную зону регенерации – площадь зоны должна соответствовать площади открытой воды для купания
- при засыпке зоны регенерации использовать грунт разных фракций, для создания условий нормального существования анаэробных бактерий
- засадить зону регенерации достаточным количеством высших водных растений
- внести в воду комплекс прудовых бактерий
- создать условия для нормальной аэрации воды – фонтаны, аэраторы, циркуляция воды – ручьи, каскады
- не производить механическую очистку дна водоёма, чтобы не нарушить условия существования анаэробных бактерий
- вовремя осуществлять подрезку высших водных растений
- не добавлять в водоём химические вещества, применяемые для очистки воды в бассейнах.
- следить за pH фактором воды.


Ознакомьтесь также:
«Плавательный водоём: определение, состав, планирование, строительство»
«Растения в искусственном водоёме и вокруг него»
gidrologia.ru
Азот | Учеба-Легко.РФ - крупнейший портал по учебе
Свойства 7N.
| Атомная масса | 14,006 | кларк, ат.% (распространненость в природе) | 0,03 |
| Электронная конфигурация* | | Агрегатное состояние (н. у.). | газ |
| | 0,071 |
Цвет | бесцветный |
| | 0,015 | | -210,01 |
| Энергия ионизации |
14,53 | | -195,81 |
| Относительная электро-отрицательность |
3,0 | Плотность | 0,879 |
| Возможные степени окисления |
-3 ¸ +5 | Стандартный электродный потенциал |
¾ |
*Приведена конфигурация внешних электронных уровней атома элемента. Конфигурация остальных электронных уровней совпадает с таковой для благородного газа, завершающего предыдущий период и указанного в скобках.
Нахождение в природе. Азот в природе встречается главным образом в свободном состоянии. В воздухе объемная доля его составляет 78,09%, а массовая доля 75,6%. Соединения азота в небольших количествах содержатся в почвах. Азот входит в состав белковых веществ и многих естественных органических соединений.
Получение. В технике азот получают из жидкого воздуха. Как известно, воздух — это смесь газов, главным образом азота и кислорода. Сухой воздух у поверхности Земли содержит (в объемных долях): азота 78,09%, кислорода 20,95%, благородных газов 0,93%, оксида углерода (IV) 0,03%, а также случайные примеси — пыль, микроорганизмы, сероводород, оксид серы (IV) и др. Для получения азота воздух переводят в жидкое состояние, а затем испарением отделяют азот от менее летучего кислорода (т. кип. азота -195,8° С, кислорода -183° С). Полученный таким образом азот содержит примеси благородных газов (преимущественно аргона). Чистый азот можно получить в лабораторных условиях, разлагая при нагревании нитрит аммония:

Физические свойства. Азот в свободном состоянии — газ без цвета и запаха, состоящий из двухатомных молекул N2. Он является основным компонентом атмосферы Земли (78% по объему). Азот легче воздуха. Растворимость в воде меньше, чем у кислорода: при 20 °С в 1 л воды растворяется 15,4 мл азота (кислорода 31 мл). Поэтому в воздухе, растворенном в воде, содержание кислорода по отношению к азоту больше, чем в атмосфере. Малая растворимость азота в воде, а также его очень низкая температура кипения объясняются весьма слабыми межмолекулярными взаимодействиями как между молекулами азота и воды, так и между молекулами азота.
Природный азот состоит из двух стабильных изотопов с массовыми числами 14 (99,64%) и 15 (0,36%).
В молекуле N2 атомы связаны тремя ковалентными связями (две p -связи, одна s -связь), поэтому энергия диссоциации этой молекулы чрезвычайно велика:

Этим объясняется малая реакционная способность азота при обычной температуре (сравните с О2 и Cl2).
Химические свойства. Для того чтобы азот вступил в химическую реакцию, требуется предварительная активация его молекул нагреванием, облучением или другими способами.
Из металлов азот реагирует в обычных условиях только с литием, образуя нитрид:

С другими металлами он реагирует лишь при высоких температурах, образуя нитриды. С натрием, кальцием и магнием реакция идет только при нагревании:

Образующиеся нитриды полностью гидролизуются при контакте с водой:

С кислородом азот взаимодействует только в электрической дуге (3000-4000° С) (например, при грозовом разряде в атмосфере) или при очень сильном нагревании:

Поскольку на внешнем энергетическом уровне атома азота находится 5 электронов, азот проявляет степени окисления -3 и +5, а также +4, +3, +2, +1, -1 и -2.
Применение. В больших количествах азот употребляется для получения аммиака. Широко используется для создания инертной среды — наполнение электрических ламп накаливания и свободного пространства в ртутных термометрах, при перекачке горючих жидкостей. Им азотируют поверхность стальных изделий, т. е. насыщают их поверхность азотом при высокой температуре. В результате в поверхностном слое образуются нитриды железа, которые придают стали большую твердость. Такая сталь выдерживает нагревание до 500 °С без потери своей твердости.
Важное значение азот имеет для жизни растений и животных, поскольку он входит в состав белковых веществ. Соединения азота находят применение в производстве минеральных удобрений, взрывчатых веществ и во многих отраслях промышленности.
Аммиак. В огромных количествах азот используется для синтеза аммиака.
Реакция с водородом идет при нагревании (хотя процесс и экзотермический!) и очень высоком давлении и обязательно с катализатором:

Физические свойства. Аммиак — важнейшее соединение азота. В обычных условиях это — бесцветный газ, легче воздуха, с резким запахом. Аммиак сжижается при -33,35 °С и затвердевает при -77,7 °С.
Молекула аммиака имеет форму пирамиды, в основании которой лежит треугольник из атомов водорода, а в вершине — атом азота, в жидком аммиаке молекулы Nh4 связаны между собой водородными связями, обусловливая тем самым аномально высокую температуру кипения. Полярные молекулы Nh4 очень хорошо растворимы в воде (700 объемов Nh4 в одном объеме h3O).
Электронная формула молекулы аммиака такова:

Видно, что из четырех электронных пар при азоте три общие (связывающие) и одна неподеленная (несвязывающая).
Химическая связь N—Н полярная: положительный заряд сосредоточен на атомах водорода, отрицательный — на атоме азота. Вследствие этого между молекулами аммиака и образуется водородная связь, что можно изобразить так:

Благодаря водородным связям аммиак имеет сравнительно высокие температуры плавления и кипения, а также высокую теплоту испарения, он легко сжижается.
Раствор аммиака в воде представляет собой раствор гидроксида аммония, содержащий одновременно молекулярные частицы Nh4 и Nh5OH и ионы Nh5+ и ОН- :

Водный раствор аммиака обладает свойствами слабого основания, константа его диссоциации при 25 °С составляет 1,8 Ч 10-5.
Азот в аммиаке имеет наименьшую степень окисления и поэтому проявляет только восстановительные свойства. Так, например, при горении аммиака образуются азот и вода:

В присутствии катализатора аммиак может окисляться и до оксида азота NО:

При нагревании аммиака с галогенами, перокcидом водорода, оксидами тяжелых металлов образуется молекулярный азот:

Аммиак идет главным образом на производство азотной кислоты и различных удобрений — нитрата аммония Nh5NO3, карбамида (мочевины)(Nh3)2CO, аммофоса (смесь гидро- и дигидрофосфатов аммония (Nh5)2HPO4 и Nh5h3PO4).
Соли аммония. Продукты взаимодействия аммиака с кислотами представляют собой соли аммония:

Соли аммония по многим свойствам похожи на соли щелочных металлов, особенно на соли калия и рубидия. Такое сходство объясняется тем, что размер иона аммония (радиус 1,48 А) близок к размерам ионов К+ (1,33 Å) и Rb+ (1,48 Å).
Они проявляют общие свойства солей, т. е. взаимодействуют с растворами щелочей, кислот и других солей:

Все аммонийные соли растворимы в воде и при этом гидролизуются. Соли аммония термически неустойчивы и при нагревании разлагаются:


Оксиды азота. В оксидах азота степень его окисления меняется от 1+ до 5+. Оксиды N2O и NO—- бесцветные газы, оксид азота (IV) NO2 — бурый газ, получивший в промышленности название “лисий хвост”. Оксид азота (III) N2O3 — синяя жидкость, оксид азота (V) N2O5 при обычных условиях — прозрачные бесцветные кристаллы.
Оксиды N2O и NO не реагируют c водой и щелочами, тогда как N2O3 и N2O5, являясь ангидридами, при взаимодействии с водой дают соответствующие кислоты:

Азотистая кислота. HNO2 неустойчива, тогда как ее соли нитриты, устойчивы.
Оксид азота (IV) NO2 легко подвергается димеризации, уже при незначительном охлаждении образуя жидкость желто-зеленого цвета:

Оксид азота NO2 при растворении в воде обратимо диспропорционирует:

Поскольку образующаяся азотистая кислота неустойчива, то при нагревании реакция идет по-другому:

Если диоксид азота NO2 растворяют в воде в присутствии кислорода, то получают только азотную кислоту:

Последнюю реакцию используют в промышленности для получения азотной кислоты.
Азотная кислота. НNO3 в чистом виде — бесцветная жидкость с резким удушливым запахом, очень гигроскопична, “дымит” на воздухе. В небольших количествах она образуется при грозовых разрядах и присутствует в дождевой воде.
Химические свойства. Под действием света азотная кислота частично разлагается с выделением NО2 и за счет этого приобретает светло-бурый цвет:

Азотная кислота принадлежит к числу наиболее сильных кислот, и для нее характерны все реакции, в которые вступают кислоты, — с основаниями, основными оксидами и т. д.
Специфическим свойством азотной кислоты является ее ярко выраженная окислительная способность. Сущность окисления различных веществ азотной кислотой заключается в том, что ион NO3- , имеющий в своем составе азот в степени окисления 5+, в зависимости от условий (концентрации кислоты, природы восстановителя, температуры) может принимать от одного до восьми электронов. Восстановление аниона NO3- в связи с этим может протекать до различных веществ:

Какое из этих веществ образуется, т. е. насколько глубоко произошло восстановление азотной кислоты, в каждом конкретном случае зависит от природы восстановителя, от условий протекания реакции и от концентрации самой кислоты.
При прочих равных условиях образование тех или иных продуктов восстановления азотной кислоты зависит от концентрации. Азотная кислота обладает окислительной способностью при любой концентрации, при этом, однако, чем концентрированнее HNO3, тем менее глубоко она восстанавливается.
С одним и тем же восстановителем, например цинком, кислота, если она концентрированная, будет обязательно реагировать по схеме (1) с выделением NO2; если HNO3 разбавленная, то она может взаимодействовать с Zn по любой схеме (2—5), в зависимости от степени разбавления.
Чтобы восстановление HNO3 провести наиболее глубоко, необходимо использовать максимально разбавленную кислоту, применять сильный восстановитель и реакцию вести на холоде. При использовании более концентрированной кислоты низшие оксиды азота (образованные в ходе реакции) окисляются концентрированной кислотой до высших.
Азотная кислота взаимодействует со всеми металлами, за исключением Au, Pt, W. Концентрированная HNO3 не взаимодействует при обычных условиях также с Fe, Al и Сr, которые она пассивирует, однако при очень сильном нагревании HNO3 взаимодействует и с этими металлами.
Большинство неметаллов и сложных веществ восстанавливают HNO3, как правило, до NO (реже до NO2):

Азотная кислота окисляет при нагревании даже кремний:

Однако полного растворения образца кремния при этом не происходит, так как, едва начавшись, последняя реакция быстро прекращается, поскольку образующийся на поверхности кристаллический SiO2 (кислотный оксид с высшей степенью окисления кремния) препятствует дальнейшему протеканию реакции.
Если же взять смесь азотной и плавиковой кислот, то при нагревании происходит полное растворение образца кремния:

С помощью концентрированной HNO3 можно растворить также и золото. Для этого необходимо взять смесь, состоящую из одного объема концентрированной HNO3 и трех объемов концентрированной соляной кислоты (такую смесь называют царской водкой):

Действие царской водки объясняется тем, что концентрированная HNO3 окисляет НСl по реакции (*) до свободного хлора, который в момент выделения является очень сильным окислителем. По этой причине при растворении металлов в царской водке никогда не получаются соли азотной кислоты, а получаются соответствующие хлориды.
Разложение нитратов. При нагревании твердых нитратов практически все они разлагаются с выделением кислорода (единственным исключением является нитрат аммония), при этом все нитраты можно разделить на четыре группы.
Первую группу составляют нитраты щелочных металлов, которые при нагревании разлагаются на нитриты и кислород, например:

Вторую группу составляет большинство нитратов менее активных металлов (от щелочноземельных металлов до меди включительно), которые разлагаются на оксид металла, NO2 и кислород:


Третью группу составляют нитраты наиболее тяжелых металлов, разлагающиеся до свободного металла, NO2 и кислорода:

Четвертую группу составляет нитрат аммония.

Азотистая кислота. HNО2 принадлежит к слабым кислотам (К = 6Ч10-4 при 25 °С), она лишь немного сильнее уксусной. Азотистая кислота неустойчива и известна только в разбавленных растворах, в которых осуществляется равновесие

Нитриты, в отличие от самой кислоты, устойчивы даже при нагревании. Исключением является кристаллический нитрит аммония, который при нагревании разлагается на свободный азот и воду:

Применение. Большие количества азотной кислоты расходуются на приготовление азотных удобрений, взрывчатых и лекарственных веществ, красителей пластмасс, искусственных волокон и др. материалов. Дымящая азотная кислота применяется в ракетной технике в качестве окислителя ракетного топлива.
uclg.ru
ВОДА ПРИЙДЕТ – АЗОТ УВЕДЕТ
ВОДА ПРИЙДЕТ – АЗОТ УВЕДЕТ

Весна этого года была щедра на осадки и скупа на тепло. Поэтому вместо ожидаемой с нетерпением «пары дождиков в апреле, пары дождиков в маю» в апреле-мае на юге Украины осадков оказалось в два-три раза больше средней многолетней месячной нормы. Осадки были разные: снег, снег с дождем, дождь «грибной» и дождь проливной. В течение суток кое-где выпадало до 30-35 мм влаги. Вода не успевала впитываться и испаряться, поэтому многие посевы напоминали не поля в степи, а затопленные рисовые чеки. На некоторых затопленных полях посевы оказались под водой «с головой».
В многокомпонентной системе избыток одного компонента вызывает недостаток другого. Почва, как известно, состоит из трех фаз – твердой (минеральной), жидкой и газообразной.  Воздух и вода в почве занимают пространство между частицами твердой фазы. Поэтому влага обильных осадков вытесняет из почвы воздух. Часть кислорода почвенного воздуха растворяется в воде, но это – очень небольшая часть кислорода, необходимого для дыхания корневой системы растений. К тому же, чем выше температура почвы (и воды), тем меньше в воде растворенного кислорода, и тем выше в нем потребность растений. Поэтому переувлажнение почвы приводит к угнетению роста и развития растений, а в некоторых случаях – к гибели от удушья.
Воздух и вода в почве занимают пространство между частицами твердой фазы. Поэтому влага обильных осадков вытесняет из почвы воздух. Часть кислорода почвенного воздуха растворяется в воде, но это – очень небольшая часть кислорода, необходимого для дыхания корневой системы растений. К тому же, чем выше температура почвы (и воды), тем меньше в воде растворенного кислорода, и тем выше в нем потребность растений. Поэтому переувлажнение почвы приводит к угнетению роста и развития растений, а в некоторых случаях – к гибели от удушья.
Добро и зло – одна монета,А ляжет так, как повезло,Придя добром к кому-то где-то,Другому причиняет зло.(В. Поляков)
«Уход» воды с поверхности поля и подсыхание верхнего слоя почвы не гарантируют избавления от проблемы дефицита кислорода в почве. Высохшая поверхность затопленного поля часто покрывается плотной воздухонепроницаемой почвенной коркой, которая «не пускает» воздух в почву. Поэтому, кстати, подсохшую корку рекомендуется своевременно «разбивать» ротационными мотыгами или боронами. Ущерб от переувлажнения/затопления не ограничивается только дефицитом кислорода для растений. Существует еще одна «статья расходов», которая неизбежно активируется при выпадении обильных осадков. Вода растворяет минеральные удобрения. И уносит их с собой. Нитратный азот покидает корнеобитаемый слой как по вертикали (промывается при инфильтрации почвы), так и по горизонтали (смыв с поверхности почвы). Кроме того, в анаэробных условиях переувлажненной почвы нитратный азот подвергается денитрификации. То есть превращается в молекулярный азот и возвращается «в воздух».Как оценить вероятные потери? И что делать потом с этим знанием?
Ущерб от переувлажнения/затопления не ограничивается только дефицитом кислорода для растений. Существует еще одна «статья расходов», которая неизбежно активируется при выпадении обильных осадков. Вода растворяет минеральные удобрения. И уносит их с собой. Нитратный азот покидает корнеобитаемый слой как по вертикали (промывается при инфильтрации почвы), так и по горизонтали (смыв с поверхности почвы). Кроме того, в анаэробных условиях переувлажненной почвы нитратный азот подвергается денитрификации. То есть превращается в молекулярный азот и возвращается «в воздух».Как оценить вероятные потери? И что делать потом с этим знанием?
Нитраты! «На выход!»
День наступит – откроются люки,И вонючие руки утянут за брюки.И дурная вода унесёт нас туда,Где нам выпишут вечные муки…(В. Поляков)
Первой жертвой наводнения или переувлажнения становится наиболее мобильная форма азота – нитратная. В экстремальных условиях возможна потеря практически 100% нитратного азота, находящегося в корнеобитаемом слое почвы.Основным путем потерь нитратного азота на легких (песчаных и супесчаных почвах) является выщелачивание (промывание). Растворенные в воде нитраты мигрируют с потоком воды, опускаясь все ниже и ниже по мере инфильтрации почвы водой. Если на пути влаги не оказывается препятствий типа «плужной подошвы», то нитраты покидают пределы корнеобитаемого слоя и двигаются дальше. Кстати, при выращивании риса «плужная подошва» создается искусственно – для того, чтобы «не дать смыться» азотным удобрениям.Чем выше водопроницаемость почвы и чем хуже ее водоудерживающие свойства, тем больше потери нитратного азота от промывания. На плотных почвах тяжелого механического состава, хорошо удерживающих и плохо пропускающих влагу, потери нитратов от промывания возможны только при длительном периоде избыточного увлажнения. Потери нитратов в результате инфильтрации с влагой в нижние горизонты тяжелой суглинистой почвы примерно в 4-5 раз меньше, чем на легкой песчаной при сопоставимом количестве выпавших осадков.Плотные тяжелые почвы хорошо удерживают влагу, поэтому вода, залившая «с верхом» глинистое поле, долго не покидает такую «гостеприимную» почву. Из-за этого почву начинает покидать азот. Не через «дно» пахотного слоя, а через его «верх». И не с водой, а с воздухом. В результате процесса денитрификации.
Нитрификация с приставкой «де»
В моей частичке de знак чванства,Я слышу, видят: вот беда!«Так вы из древнего дворянства?»Я? Нет… куда мне, господа!(Пьер-Жан де Беранже)
Соединения азота трансформируются и «переформатируются» обитающими в почве микроорганизмами. В анаэробных условиях при достаточно высокой температуре и щелочной реакции почвы создаются условия для денитрификации – преобразования микрофлорой почвы нитратов в газообразные оксиды и молекулярный азот. В природе денитрификация имеет широкие масштабы. В результате в атмосферу ежегодно поступает 270-330 млн т N2, т.е. этот процесс сравним с азотфиксацией. Большая часть этого азота – потери из почвы. Первый этап денитрификации – переход нитратов в нитриты – способны осуществлять не только бактерии, но водоросли, грибы и дрожжи. На заключительном этапе денитрификации (до молекулярного азота) участвуют только прокариоты. Большинство из них – факультативные анаэробы, которые заменяют отсутствующий в анаэробных условиях кислород нитратами.Процесс денитрификации вполне корректно называют анаэробным нитратным дыханием. Нитраты в анаэробных условиях выполняют функцию акцепторов электронов, поступающих с окисляемого субстрата. Соответственно, субстрат окисляется, а нитраты восстанавливаются в последовательности: NO- –>NO- –>NO –>N2O –>N2. Энергетический выход при переносе электронов к NO- и N2O приблизительно одинаков и в сумме составляет около 70% энергетического выхода при дыхании с участием свободного кислорода. То есть нитратное дыхание на треть менее эффективно, чем «традиционное», с использованием кислорода. Поэтому микрофлора почвы использует нитраты только при дефиците азота. Соответственно, восстановление доступа кислорода в почву (аэрация) прекращает процесс денитрификации. Рыхление почвы (разрушение почвенной корки), например, не только улучшает снабжение корневой системы растений кислородом, но прекращает «вредительскую» деятельность нитрифицирующих бактерий.О том, что бактерия участвует в денитрификации, красноречиво свидетельствует ее «фамилия» с аристократической приставкой «де»: Thiobacillus denitriflcans, Thiomicrospira denitrificans, Paracoccus denitrificans Paracoccus denitrificans. Но есть бактерии (Pseudomonas studzeri, Pseudomonas fluorescens), «ФИО» которых не указывает на их потенциальные денитрифицирующие свойства.
Первый этап денитрификации – переход нитратов в нитриты – способны осуществлять не только бактерии, но водоросли, грибы и дрожжи. На заключительном этапе денитрификации (до молекулярного азота) участвуют только прокариоты. Большинство из них – факультативные анаэробы, которые заменяют отсутствующий в анаэробных условиях кислород нитратами.Процесс денитрификации вполне корректно называют анаэробным нитратным дыханием. Нитраты в анаэробных условиях выполняют функцию акцепторов электронов, поступающих с окисляемого субстрата. Соответственно, субстрат окисляется, а нитраты восстанавливаются в последовательности: NO- –>NO- –>NO –>N2O –>N2. Энергетический выход при переносе электронов к NO- и N2O приблизительно одинаков и в сумме составляет около 70% энергетического выхода при дыхании с участием свободного кислорода. То есть нитратное дыхание на треть менее эффективно, чем «традиционное», с использованием кислорода. Поэтому микрофлора почвы использует нитраты только при дефиците азота. Соответственно, восстановление доступа кислорода в почву (аэрация) прекращает процесс денитрификации. Рыхление почвы (разрушение почвенной корки), например, не только улучшает снабжение корневой системы растений кислородом, но прекращает «вредительскую» деятельность нитрифицирующих бактерий.О том, что бактерия участвует в денитрификации, красноречиво свидетельствует ее «фамилия» с аристократической приставкой «де»: Thiobacillus denitriflcans, Thiomicrospira denitrificans, Paracoccus denitrificans Paracoccus denitrificans. Но есть бактерии (Pseudomonas studzeri, Pseudomonas fluorescens), «ФИО» которых не указывает на их потенциальные денитрифицирующие свойства. Более того, известный азотфиксатор Azospirillum lipoferum при наличии нитратов в анаэробных условиях проводит денитрификацию, а в аэробных – ассимилирует нитрат. Это вполне объяснимо. Ферменты азотного цикла (нитрогеназа азотфиксаторов, нитритоксидоредуктаза нитрификаторов, ассимиляторная и диссимиляторная нитратредуктазы) имеют общий «структурный элемент» — низкомолекулярный молибденсодержащий кофактор. Он может «переустанавливаться» микроорганизмом с одного фермента на другой, в зависимости от ситуации. Таким образом, процессы нитратредукции, азотфиксации и денитрификации взаимно связаны и могут осуществляться одними и теми же бактериями, но в разных условиях.
Более того, известный азотфиксатор Azospirillum lipoferum при наличии нитратов в анаэробных условиях проводит денитрификацию, а в аэробных – ассимилирует нитрат. Это вполне объяснимо. Ферменты азотного цикла (нитрогеназа азотфиксаторов, нитритоксидоредуктаза нитрификаторов, ассимиляторная и диссимиляторная нитратредуктазы) имеют общий «структурный элемент» — низкомолекулярный молибденсодержащий кофактор. Он может «переустанавливаться» микроорганизмом с одного фермента на другой, в зависимости от ситуации. Таким образом, процессы нитратредукции, азотфиксации и денитрификации взаимно связаны и могут осуществляться одними и теми же бактериями, но в разных условиях.
«Райдер» денитрифицирующих бактерий
Не жертвуй светом, добывая свет!Ведь ты не знаешь, что творишь на деле.Цель средства не оправдывает… Нет!У жизни могут быть иные цели.(Н. Коржавин)
На интенсивность денитрификации влияет:1. Продолжительность «безвоздушного» периода в переувлажненных, переуплотненных или заиленных почвах. Содержание кислорода в основном зависит от влажности почвы, которая, в свою очередь, определяется механическим составом и плоностью.2. Температурный режим. Скорость денитрификации увеличивается экспоненциально в интервале от 15°C до 30°C, максимальные потери нитратного азота отмечаются при температуре почвы от 23°C до 27°C.3. Содержание нитратов и органических веществ. Бактерии нуждаются в источнике легкодоступных органических веществ. Поэтому денитрификация интенсивно происходит на богатых органикой почвах. Запаханные растительные остатки и органические удобрения стимулируют процесс. И, конечно же, должно быть необходимое количество нитратов.4. рН почвы. Процесс денитрификации интенсивно происходит в щелочных почвах, в кислых почвах денитрификация очень медленная.Для того, чтобы начался интенсивный процесс денитрификации на затопленных почвах, требуется от двух до трех дней. За день теряется в среднем от 3% до 4% азота. При высокой температуре почвы (более 23°С) ежедневные потери от денитрификации могут «умножать на ноль» до 5-6% нитратного азота. Потери от 25% до 50% нитратного азота – вполне обычная «дань», которую аграрии платят почвенной микрофлоре. В США, например, средние ежегодные потери нитратного азота при выращивании кукурузы составляют 40-75 кг д.в/га за год.Можно сделать простой, и в какой-то мере правильный вывод: «Долой нитратные удобрения!». Но, как и любые громкие лозунги и скоропалительные выводы, он содержит только часть правды. И не содержит приемлемой альтернативы. Нитратная форма азота – это «быстрый» азот, поэтому ее целесообразно использовать при «быстром» получении всходов и высоких темпах роста культуры. То есть для внесения под предпосевную культивацию/посев при относительно поздних сроках посева, при минимальной вероятности проливных дождей. Либо для подкормок вегетирующей кукурузы или подсолнечника с заделкой в почву междурядий.Заранее вносить большое количество нитратных форм азота под пропашные культуры – неоправданный риск «потерять» (более точное определение – сами знаете какое) большую часть нитратов еще до того, как культура будет готова их усвоить.До фазы 6 листка ни кукуруза, ни подсолнечник не потребляют сколь-нибудь значимых (около 5%) количеств азотных удобрений. При раннем посеве (в первой декаде апреля) всходы появляются не ранее, чем через 15-18 дней. Темпы развития в условиях холодной весны замедлены (как в этом году), поэтому интервал от появления всходов до 6-8 листка составляет около 3 недель. Итого – 1,5 месяца удобрения «легли и просят», пока до них доберутся корни культуры. А за это время шансы азота «промыться» и «испариться» становятся настолько велики, что практически гарантированы. Посевы в период интенсивного роста останутся «голодными»,а карманы агрария по итогам сезона – пустыми.
Нитратная форма азота – это «быстрый» азот, поэтому ее целесообразно использовать при «быстром» получении всходов и высоких темпах роста культуры. То есть для внесения под предпосевную культивацию/посев при относительно поздних сроках посева, при минимальной вероятности проливных дождей. Либо для подкормок вегетирующей кукурузы или подсолнечника с заделкой в почву междурядий.Заранее вносить большое количество нитратных форм азота под пропашные культуры – неоправданный риск «потерять» (более точное определение – сами знаете какое) большую часть нитратов еще до того, как культура будет готова их усвоить.До фазы 6 листка ни кукуруза, ни подсолнечник не потребляют сколь-нибудь значимых (около 5%) количеств азотных удобрений. При раннем посеве (в первой декаде апреля) всходы появляются не ранее, чем через 15-18 дней. Темпы развития в условиях холодной весны замедлены (как в этом году), поэтому интервал от появления всходов до 6-8 листка составляет около 3 недель. Итого – 1,5 месяца удобрения «легли и просят», пока до них доберутся корни культуры. А за это время шансы азота «промыться» и «испариться» становятся настолько велики, что практически гарантированы. Посевы в период интенсивного роста останутся «голодными»,а карманы агрария по итогам сезона – пустыми.
Денитрификация аммонийного азота
Дорогу свою выбирая,О лишних шагах не жалей,Короче – конечно прямая,Кривая, зато, – веселей…(В. Поляков)
При высоком риске затопления лучше использовать аммонийную или амидную формы азота. В тех регионах, где существует риск наводнений и затопления посевов, предпочитают использовать КАС, карбамид, сульфат аммония. Например, в северо-восточной части «болотного» штата Луизиана традиционно используют гранулированную мочевину (46-0-0) или КАС (32-0-0) в качестве основного источника азота. А при выращивании риса основными источниками азота являются сульфат аммония и карбамид.Это позволяет существенно сократить потери, но не избежать их полностью. Нитратная форма в КАСе, например, промывается и денитрифицируется так же легко, как и любой другой нитрат. Поэтому 25% азота из КАСа при затоплении поля исчезают в течение считанных дней.Аммиачная и амидная формы азота прочно удерживаются в почве, но в результате трансформаций со временем превращаются в нитратный азот. Выпадение обильных осадков через день-два после внесения КАСа или карбамида приводит к минимальным потерям азота.Но после нитрификации (перехода азота из аммиачной формы в нитратную) в течение 1-2 месяцев, затопление поля приведет к потере более 50% внесенного минерального азота. Чем больше интервал между внесением аммонийного азота и затоплением поля, тем больше аммония превратится в нитрат.Превращение аммония в нитрат являются результатом деятельности обитающих в почве нитрифицирующих бактерий. Для нитрификации очень важна температура почвы (быстрее проходит в «теплых» почвах, медленнее – в холодных) и наличие воздуха (аэробные условия). Гранулированная мочевина преобразовывается в аммонийную форму в процессе гидролиза. Поэтому карбамид превращается в нитрат медленнее, чем КАС.Средняя скорость нитрификации при температуре почвы 14-18°С составляет около 2,5%в день, а при более высокой температуре почвы превышает 4,5-5 % в день.Например, при внесении 200 кг д.в азота/га в форме КАС (32%) за три недели до «потопа», при температуре почвы около 15°С, в нитратную форму перейдет около 120 кг д.в азота (200 x 0,6). А при внесении того же количества азота в той же форме за неделю до затопления поля, в нитратную форму перейдет только 50 кг азота в д.в. (200 x 0,25). Сотрудниками университета штата Айова Р. Дж. Килдорном и С. Е. Тейлором была разработана компьютерная программа, прогнозирующая поведение внесенного в почву безводного аммиака. Эта программа позволяет рассчитать процент нитрификации внесенного азота в аммиачной/аммонийной форме при различных условиях. Например, при внесении аммонийного азота в почву в период с 1 октября до 1 ноября, по данным предварительных расчетов, к 1 мая весь азот преобразуется в нитратную форму.Использование ингибитора N-Serve существенно замедляет процесс нитрификации.Например, при внесении аммиака с ингибитором нитрификации 1 октября, в почве к 1 мая сохранится около 35% азота в аммонийной форме, а при внесении удобрений 1 ноября – 50%.Из этих предварительных расчетов можно сделать вывод: чем ближе к посеву вносятся азотные удобрения, тем больше шансов их «целевого использования» культурными растениями и меньше вероятность потерь. Это правило касается и КАСа, и карбамида, и сульфата магния.
Сотрудниками университета штата Айова Р. Дж. Килдорном и С. Е. Тейлором была разработана компьютерная программа, прогнозирующая поведение внесенного в почву безводного аммиака. Эта программа позволяет рассчитать процент нитрификации внесенного азота в аммиачной/аммонийной форме при различных условиях. Например, при внесении аммонийного азота в почву в период с 1 октября до 1 ноября, по данным предварительных расчетов, к 1 мая весь азот преобразуется в нитратную форму.Использование ингибитора N-Serve существенно замедляет процесс нитрификации.Например, при внесении аммиака с ингибитором нитрификации 1 октября, в почве к 1 мая сохранится около 35% азота в аммонийной форме, а при внесении удобрений 1 ноября – 50%.Из этих предварительных расчетов можно сделать вывод: чем ближе к посеву вносятся азотные удобрения, тем больше шансов их «целевого использования» культурными растениями и меньше вероятность потерь. Это правило касается и КАСа, и карбамида, и сульфата магния.
Занимательная арифметика
Как здоровье, так и счастье,Если есть – не замечаем,Лишь когда придут напастиИх нехватку ощущаем…(В. Поляков)
На потери от промывания и нитрификации существенно влияет содержание в удобрении нитратного, аммонийного и амидного азота. При этом необходимо предусмотреть трансформацию аммонийных/амидных форм в нитратную на протяжении периода от внесения удобрения до затопления поля.Процесс нитрификации зависит от внешних условий. Температура и влажность почвы важны для прогноза степени преобразования аммонийного или амидного азота в мобильную нитратную форму.Количество выпавших осадков и продолжительность затопления позволяют определить количество промытого нитратного азота и потери от денитрификации.Алгоритм расчетов можно продемонстрировать на примерах.Пример №1. Под предпосевную культивацию внесли 350 л КАС, то есть 100 кг азота д.в /га. Через 10 дней после посева выпали обильные осадки, затопившие поле на 2 дня. Температура почвы в этот период была около 17°С. Сколько было потеряно?Решение: При затоплении теряется азот в нитратной форме. Поэтому 25% азота КАС, то есть та часть, которая находится в нитратной форме, гарантированно теряется. Кроме того, теряется часть азота, который образовался в результате нитрификации аммонийного и амидного азота. Процесс нитрификации продолжался 10 дней, за день нитрификации подвергалось примерно 2,5% аммонийного азота.Таким образом, потери азота составят:(0,25 * 100 кг N д.в / га) + (10 дней * 0,025 * 75 кг N д.в / га) = 25 + 18,75 = 43,75 кг д.в N /га.То есть при заданных условиях ожидаются потери более 40% от внесенного с удобрением азота.Пример № 2. Под предпосевную культивацию внесли 175 кг д.в N / га в форме карбамида. Почва плохо дренированная. Через три недели после внесения удобрения поле было затоплено на протяжении семи дней. Сколько азота было потеряно?Решение: Определяем количество азота в форме нитрата. Согласно таблице, 50% мочевины будут в форме NO3-N. Через три недели после внесения карбамида 50% азота перешло в нитратную форму. То есть 175 кг д.в N x 50% = 88 кг д.в N.Чтобы бактерии начали процесс денитрификации, необходимо минимум два дня. Поэтому денитрификация происходила в течение пяти дней, каждый день терялось 4% нитратного азота. То есть за 5 дней потеряно 20% от общего количества азота в нитратной форме. Это составило 88 x 20% = 18 кг д.в N потеряно. При этом в почве осталось 157 кг азота в д.в. Кукуруза после такого продолжительного пребывания в затопленном состоянии, скорее всего, погибла бы. Подобная методика оценки потерь азота не претендует на точность, но дает хотя бы приблизительное представление о ущербе.Для получения точных данных о наличии азота необходимо провести анализ почвы.В почве достаточно доступного для растений азота, если почва содержит более 25 ppm нитратного азота. В такой ситуации проведение подкормок не является жизненно необходимым.Если содержание нитратного азота составляет от 11 до 25 ppm (частей на миллион), то целесообразно проведение подкормки азотными удобрениями в норме 30-100 кг д.в/азота /га.Если уровень нитратного азота в почве находится в интервале 18- 11 ppm, то необходимо вносить как минимум 50-70 кг д.в азота/га. При более высоком содержании нитратов можно обойтись внесением 30-40 кг д.в азота/га.Если содержание нитратов составляет менее 11 частей на миллион, целесообразно внести в виде подкормки от 100 до 150 кг д.в азота/ га.
Подобная методика оценки потерь азота не претендует на точность, но дает хотя бы приблизительное представление о ущербе.Для получения точных данных о наличии азота необходимо провести анализ почвы.В почве достаточно доступного для растений азота, если почва содержит более 25 ppm нитратного азота. В такой ситуации проведение подкормок не является жизненно необходимым.Если содержание нитратного азота составляет от 11 до 25 ppm (частей на миллион), то целесообразно проведение подкормки азотными удобрениями в норме 30-100 кг д.в/азота /га.Если уровень нитратного азота в почве находится в интервале 18- 11 ppm, то необходимо вносить как минимум 50-70 кг д.в азота/га. При более высоком содержании нитратов можно обойтись внесением 30-40 кг д.в азота/га.Если содержание нитратов составляет менее 11 частей на миллион, целесообразно внести в виде подкормки от 100 до 150 кг д.в азота/ га.
Компенсация потерь: чем, когда и как
Всё закончится очень удачно.Так пророчил восточный мудрец.Если в данный момент что-то мрачно,Значит это – ещё не конец(В. Поляков)
Способы компенсации потерянного при «потопе» азота можно рассмотреть на примере кукурузы.Кукуруза до стадии V6 потребляет примерно 5% азота от общей сезонной потребности. Но от стадии V6 до VT (появление метелки) у кукурузы «появляется аппетит», и она за месяц поглощает примерно 60% от сезонной нормы азота. То есть примерно 100-120 кг д.в азота/га. Период быстрого роста культуры продолжается около месяца, и если на протяжении этого периода кукуруза останется «недокормленной», то к уборке она «отомстит» существенным недобором урожая.Обильные осадки активно сокращают запасы азота, «промывая» нитратный азот из удобрений, внесенных до посева. Потери могут составлять 30-50%, то есть кукуруза остается на урезанном, «половинном пайке» азота. С вполне ожидаемыми последствиями в виде резкого уменьшения урожайности.Может ли подкормка компенсировать «потерянный» азот? По данным американских исследователей, дефицит азота в фазу V6 удавалось компенсировать подкормкой до фазы R1. Дефицит азота удается успешно «догнать» без уменьшения урожайности при внесении азотных удобрений до стадии роста V11. Применение азотных удобрений в фазу от V12 до V16 сопровождалось снижением урожайности на 3% -по сравнению с вариантом, где весь азот вносился при посеве и не был потерян. Лучшие результаты обеспечивало внесение разбрасывателем карбамида, обработанного ингибитором уреазы. При быстром подсыхании поверхности поля на легких, хорошо дренированых почвах целесообразно внесение аммиачной селитры в междурядья при высоте растений около 30 см.Тяжелые почвы после выпадения осадков остаются влажными на протяжении длительного времени. Поэтому внесение минеральных удобрений с заделкой в междурядья в таких условиях нецелесообразно: вовремя – невозможно, а поздно – напрасные траты. Поэтому для оперативного возмещения потерянного азота приходится полагаться на поверхностное внесение гранулированных минеральных удобрений: сульфата аммония (21-0-0-24) и мочевины (46-0-0).В пересчете на стоимость 1 кг д.в азота мочевина дешевле, чем сульфат аммония. Но газообразные потери азота (в виде аммиака) из карбамида могут достигать 20-30%, а сульфат аммония более стабилен.Мочевина, внесенная на сухую почву, начинает постепенно улетучиваться. Скорость испарения достигает максимума примерно через три дня после внесения и зависит от типа почвы и ее влажности. Как правило, на щелочных почвах газообразные потери азота выше, чем в кислых. А при внесении мочевины на поверхность влажной почвы потери азота существенно выше, чем при разбрасывании по сухой почве.Потери азота при поверхностном внесении мочевины можно сократить за счет обработки гранулированной мочевины ингибитором уреазы (NBPT или NPPT). Ингибитор уреазы временно замедляет превращение мочевины микроорганизмами в аммонийную форму (гидролиз мочевины) и поэтому сокращает потери от улетучивания аммиака (конверсия амидной формы азота в газообразный аммиак). Ингибиторы уреазы уменьшают потери аммиака в течение 10 дней при нанесении на сухую почву. При внесении на влажную почву время защитного действия сокращается вдвое (максимум до 5 дней), а при попадании карбамида в воду ингибиторы уреазы теряют свои свойства.Ингибиторы нитрификации (действующие вещества нитрапирин или DCD) временно препятствуют процессу нитрификации. Исследования на северо-востоке Луизианы показали, что ингибиторы нитрификации могут приостановить этот процесс в течение 10-30 дней, в зависимости от факторов окружающей среды и почвы.Если почва слишком влажная для внесения минеральных удобрений в междурядья, а кукуруза остро нуждается в азоте, то придется делать выбор между поверхностным внесением гранулированного сульфата аммония или карбамида. При внесении карбамида лучше подождать, пока поверхность почвы подсохнет. Карбамид, обработанный ингибитором уреазы, можно внести на влажную поверхность почвы без значительных потерь азота в течение нескольких дней.
РЕКОМЕНДАЦИИ ПО АЗОТНОМУ ПИТАНИЮ ПРОПАШНЫХ КУЛЬТУР ПРИ ВЫСОКОЙ ВЕРОЯТНОСТИ ЗАТОПЛЕНИЯ
Правда конца – это тоже возможность начала.Кто осознал пораженье, – того не разбили…Самое страшное – это инерция стиля.(Н. Коржавин)
— Вносить удобрения, содержащие преимущественно аммонийный или амидный азот. То есть использовать безводный аммиак, аммиачную воду, карбамид, сульфат аммония или КАС.— Вносить удобрения непосредственно перед посевом для исключения нитрификации аммонийного азота и его преобразования в мобильную нитратную форму.— При высокой вероятности обильных осадков после посева заранее планировать дробное внесение азотных удобрений. При использовании нитратных удобрений (аммиачной или кальциевой селитры) их целесообразно вносить в междурядья вегетирующей кукурузы до формирования на растениях 6 листьев.— При затоплении или переувлажнении поля необходимо оценить потери азота в зависимости от сложившихся условий (продолжительность периода переувлажнения, температура почвы и воздуха, степень дренирования почвы), а также количества и формы внесенного в минеральных удобрениях азота.— При необходимости срочно компенсировать дефицит азота целесообразно провести поверхностную подкормку разбрасывателем. Можно использовать гранулированный сульфат аммония или карбамид. При внесении карбамида на влажную почву оправдано использование ингибиторов уреазы.— На быстро высыхающих полях целесообразно компенсировать потерянный азот за счет внесения в междурядья КАС или аммиачной селитры.
Александр Гончаров специально для «Инфоиндустрии»
infoindustria.com.ua
Азот - безжизненный газ, который так необходим для жизни
Азот химический элемент, атомный номер 7, атомная масса 14,0067. В воздухе свободный азот (в виде молекул N2) составляет 78,09%. Азот немного легче воздуха, плотность 1,2506 кг/м3 при нулевой температуре и нормальном давлении. Температура кипения -195,8°C. Критическая температура -147°C и критическое давление 3,39 МПа. Азот бесцветный, без запаха и вкуса, нетоксичен, невоспламеняемый, невзрывоопасен и не поддерживающий горение газ в газообразном состоянии при обычной температуре обладает высокой инертностью. Химическая формула - N. В обычных условиях молекула азота двухатомная - N2.Производство азота в промышленных масштабах основано на получении его из воздуха (см. Способ получения азота).
До сих пор ведутся споры о том, кто был первооткрывателем азота. В 1772 г. шотландский врач Даниель Резерфорд (Daniel Rutherford) пропуская воздух через раскаленный уголь, а потом через водный раствор щелочи - получил газ, который он назвал «ядовитый газ». Оказалось, что горящая лучинка, внесенная в сосуд, наполненный азотом, гаснет, а живое существо в атмосфере этого газа быстро гибнет.
Данный опыт можно посмотреть на видео: Горящая лучинка в азоте гаснет.
В тоже время, проводя подобный опыт, азот получили британский физик Генри Кавендшин (Henry Cavendish) назвав его «удушливый воздух», британский естествоиспытатель Джозеф Пристли (Joseph Priestley) дал ему имя «дефлогистированный воздух», шведский химик Карл Вильгельм Шееле (Carl Wilhelm Scheele) - «испорченный воздух».
Окончательное имя «азот» данному газу дал французский ученый Антуан Лоран Лавуазье (Antoine Laurent de Lavoisier). Слово «азот» греческого происхождения и означает «безжизненный».Как мы уже писали в статье «Карбид кальция и ацетилен - друзья не разлей вода!» - азот довольно легко поглощается раскаленным карбидом кальция, образуя при этом важный технический продукт - цианамид кальция.
Жидкий азот бесцветная жидкость без запаха с температурой кипения -195,8°C при давлении 101,3 кПа и удельным объемом 1,239 дм3/кг при температуре -195,8°C и давлении 101,3 кПа. Жидкий азот используется как хладагент. Жидкий азот может вызвать обморожение кожи и поражение слизистой оболочки глаз. Закись азота бесцветный газ, имеет сладковатый вкус и слабый, приятный запах. Свойства этого газа были изучены английским химиком Гемфри Дэви (Humphry Davy) в 1799 году. Интересуясь действием различных газов на организм человека, Дэви обычно испытывал их на себе. При вдыхании закиси азота, он пришел в возбужденное состояние, сопровождаемое смехом. За эти свойства закись азота была названа им - веселящим газом. В дальнейшем было установлено, что при более длительном вдыхании закиси азота наступает потеря сознания. Закись азота - окисел, не дающий кислот, он относится к несолеобразующим окислам.Закись азота (N2O) не может быть получена из газообразного кислорода и азота, она образуется из азотно-кислой соли аммония, которая при осторожном нагревании разлагается на закись азота и воду по реакции:
Nh5NO3 = N2O + 2h3O
Газообразный азот относительно инертный по своим свойствам газ без цвета и запаха плотностью 1,25046 кг/м3 при 0°C и давлении 101,3 кПа. Удельный объем газообразного азота равен 860,4 дм3/кг при давлении около 105 Па и температуре 20°C.В отличие от кислорода, который взаимодействует почти со всеми элементами, встречающимися в природе, газообразный азот при комнатной температуре соединяется с единственным элементом - литием, образуя при этом нитрид лития:
N2 + 6Li = 2Li3N
Но при высоких температурах ряд металлов (титан, молибден и др.) с азотом образуют нитриды, снижающие механические свойства металла и поэтому его концентрацию в зоне плавления стремятся ограничить.
Газообразный азот чаще всего применяют:
- для создания инертной атмосферы при производстве, хранении и транспортировке легко окисляемых продуктов;
- при высокотемпературных процессах (например - сварка и резка) обработки металлов, не взаимодействующих с азотом;
- для консервации замкнутых металлических сосудов и трубопроводов.
Азот является инертным по отношению к меди и ее сплавам (он не растворяется в меди и не реагирует с ней) даже при высоких температурах. Поэтому его используют, как в чистом виде, так и в составе защитного газовой смеси с аргоном Ar (70-90%) + N2 (30-10%).
Также газообразный азот используют для сварки аустенитных нержавеющих сталей - исключительно как компонент защитной газовой смеси с аргоном.
Возникает логичный вопрос: «Если азот образует карбиды, какой смысл его использовать для сварки нержавеющих сталей, в составе которых есть карбидообразующие элементы?»
Все дело в том, что даже сравнительно небольшое содержание азота увеличивает тепловую мощность дуги. Из-за этой особенности, азот чаще всего используют не для сварки, а для плазменной резки.
Азот относится к нетоксичным газам, но может действовать как простой асфиксант (удушающий газ). Удушье наступает тогда, когда уровень азота в воздухе сокращает содержание кислорода на 75% или ниже нормальной концентрации.
Выпускают азот по ГОСТ 9293 газообразным и жидким. Для сварки и плазменной резки применяют газообразный азот 1-го (99,6% азота) и 2-го (99,0% азота) сортов.
Хранят и транспортируют его в сжатом состоянии в стальных баллонах по ГОСТ 949. Баллоны окрашены в черный цвет и надписью желтыми буквами «АЗОТ» на верхней цилиндрической части.

Коэффициенты перевода объема и массы газа при Т=15°C и Р=0,1 МПа
1,170 | 1 | 1,447 |
0,809 | 0,691 | 1 |
1 | 0,855 | 1,237 |
Коэффициенты перевода объема и массы газа при Т=0°C и Р=0,1 МПа
1,251 | 1 | 1,548 |
0,809 | 0,646 | 1 |
1 | 0,799 | 1,237 |
Газ в баллоне
40 | 7,37 | 6,3 |
Давление газа в баллоне при различной температуре окружающей среды
-40 | 11,2 |
-30 | 11,9 |
-20 | 12,6 |
-10 | 13,4 |
0 | 14,0 |
+10 | 14,7 |
+20 | 15,3 |
+30 | 15,9 |
weldering.com


























