Аморфные тела: характеристика, описание и свойства. Аморфная вода
Свойства метастабильных форм воды: новая интерпретация эксперимента
А.Н. Невзоров, кандидат физико-математических наук ЦАО Росгидромета, г. Долгопрудный, Московская обл.
Оставим в стороне порождённую незнанием легенду о мистических свойствах воды – пока хватает и чисто физических проблем. На наш взгляд, сегодня наименее (наименее адекватно) исследованными остаются полиморфные, т.е. различающиеся по внутренней структуре и свойствам формы воды, существующие в метастабильном состоянии при температурах ниже 0°С.
Метастабильным называется такое состояние вещества, которое, будучи потенциально неустойчивым, способно к неопределённо длительному существованию благодаря отсутствию внешнего воздействия, “запускающего” процесс самопроизвольного перехода вещества в устойчивое состояние. Предметом нашего рассмотрения служат те полиморфные формы вещества h3O – воды, чьи состояния при T < 0°C являются метастабильными в отношении спонтанного фазового перехода в кристаллический лёд. Самым простым “пусковым механизмом” этого перехода служит контакт метастабильной воды с кристаллическим льдом или с гетерогенным (инородным) центром кристаллизации. Известно [1], что вода склонна к полиморфизму в твёрдом состоянии, где образует около 10 форм кристаллического льда. Хорошо известному природному льду с плотностью 0,92 г·см-3 присвоено имя лёд I; остальные льды образованы при сверхвысоких давлениях и имеют более высокую плотность – до 1,6 г·см-3.
Вместе с тем науке известны и такие формы h3O, которые способны сохранять при отрицательных температурах жидкое или консистентное состояние и при этом легко превращаться в лёд I. Сюда входят: – обычная жидкая вода с плотностью ~1 г·см-3, которую для краткости будем именовать водой-1. Её жидкое состояние при T < 0°C принято называть переохлаждённой водой;
– модификация h3O, получаемая в лабораторных условиях в виде твёрдого либо вязкого стеклообразного продукта конденсации водяного пара на подложке при сверхнизких (100…150 K) температурах [2–4]. В отличие от кристаллического льда и воды-1, не обнаруживает признаков внутреннего порядка по данным структурно-чувствительного анализа (рентгеноскопического, электронографического и др.). Вопрос о структуре и свойствах этого аморфного конденсата [2], или аморфного льда [3], или аморфной воды [4], ещё недостаточно ясен;
– так называемая А-вода, обладающая плотностью около 2,1 г·см-3, обнаруженная в виде жидкокапельной фракции в природных облаках [5–8]. В литературе упоминаются и другие жидкие формы воды, не подпадающие под приведённое выше определение метастабильности. Это “незамерзающая” вода, содержащаяся в биологических тканях [3], а также “капиллярная” вода с плотностью около 1,4 г·см-3, сохраняющая жидкое состояние до -90°С даже в контакте с кристаллическим льдом [9]. Не исключено, что обе формы имеют общую природу. Низкая устойчивость метастабильных форм в контакте с инородными телами является серьёзным препятствием к исследованию их характеристик традиционными методами, пригодными для жидкости, заключённой в сосуде. На практике приходилось
Самое обычное и распространённое на Земле вещество с простой химической формулой h3O – вода во всех её формах – привлекает пристальное внимание исследователей различных направлений. В попытках углубления наших знаний об этом веществе обнаруживаются всё новые, своеобразные и загадочные его свойства, природа которых ещё нуждается в осмыслении.
Рис. 1 Геометрия молекулы воды. В центре – атом кислорода, на линиях связи – протоны. В плоскости XY валентные связи, в плоскости XZ – водородные (пунктир)
прибегать к косвенным методам измерений [2–4]. К сожалению, физическая интерпретация и оценка достоверности их результатов по существу оставались за пределами понимания, так же, как их основа – принципы внутреннего строения воды. Как показано далее, это породило ряд неопределённостей и недоразумений в сложившихся представлениях о свойствах метастабильных форм воды.
Строение молекулы и межмолекулярные водородные связи
Необычные свойства Н2О, включая ярко выраженный полиморфизм, связаны с особенностями строения её молекулы, составленной из уникальных по свойствам атомов водорода и кислорода. Водород не только самый лёгкий из элементов Периодической системы, но и единственный из них, который способен “внедряться” в электронную оболочку более тяжёлого атома и присоединять к себе один из её электронов. Если при этом он соединён валентной (химической) связью с другим инородным атомом, то образует так называемую водородную связь между обоими атомами. В свою очередь внешняя электронная оболочка атома кислорода (О-атома) имеет две “вакансии” для присоединения валентных электронов, а также содержит пару электронов, способных участвовать в водородных связях.
В свободной молекуле воды каждый из двух атомов водорода, или протонов, соединён с атомом кислорода валентной связью, образованной “обобществлением” электрона из атома водорода. Угол между линиями связи протонов с ядром О-атома равен 104,6 град. Такая величина молекулярного угла резко выделяет воду из смежного гомологического ряда соединений – гидридов элементов 6-й группы Периодической системы (где этот угол составляет от 92 град. для h3S до 90 град. для h3Se и h3Te), позволяя ей создавать различные формы с уникальным внутренним строением. Линии водородных связей каждой молекулы Н2О разделены тем же углом, что и линии валентных связей; биссектрисы обоих углов направлены в прямо противоположные стороны, а их плоскости развёрнуты на 90 град. относительно друг друга (рис. 1). С протонами, “присоединёнными” к данному О-атому, аналогично могут находиться в химической и водородной связи другие О-атомы и т.д. Каждая линия О–Н···О (точками обозначена водородная связь) упруго стремится быть прямой, но может и несколько изогнуться под воздействием сторонних факторов.
Самой простой и наглядной выглядит межмолекулярная структура льда I [1]. В ней задействованы все четыре водородные связи на каждую молекулу, так что все молекулы оказываются жёстко соединенными между собой системой связей в виде регулярной пространственной решётки. В структуре обычного, так называемого гексагонального льда Ih (названного так по конфигурации одной из проекций решётки) водородные связи изогнуты таким образом, что О-атомы, связанные с отдельной молекулой, составляют вершины правильного тетраэдра (рис. 2). Похожей структурой обладает мало устойчивый кубический лёд Iс.
Структурным отличием жидкой воды-1 от кристаллического льда является хаотическая пространственно-временная незавершённость системы связей. В каждый момент времени в ней присутствуют молекулы, охваченные всеми возможными (от нуля до четырёх) количествами водородных связей [10]. Такое статически неустойчивое строение воды-1 с непрерывно мигрирующими водородными связями придаёт ей свойство текучести, определяющее жидкое состояние. Структурный анализ обнаруживает сходство усреднённого “ближнего порядка” структуры воды-1 с элементом решетки льда Ih (см. рис. 2) [11].
Для объяснения известных и вновь выявляемых аномалий в свойствах воды-1 примем во внимание тот незаметный и, казалось бы, малозначительный факт, что водородные связи отдаляют друг от друга охваченные ими молекулы по сравнению с колебательными связями, свойственными простым жидкостям [1].
Именно поэтому плотность воды-1 с её частично реализованными водородными связями оказывается уникально выше плотности льда Ih с его полностью водородосвязанной структурой. Здесь мы приходим к важному основополагающему выводу о том, что истинная плотность воды в некристаллической форме находится в обратной зависимости от удельной концентрации водородных связей в её структуре. Максимальной плотностью должна обладать структура, полностью лишённая водородных связей. Этот вывод не распространяется на кристаллические льды, составленные из водородосвязанных решёток различной конфигурации [1].
Кристаллизация метастабильной воды
В экспериментальном определении характеристик воды в метастабильном состоянии часто используются эффекты, связанные с её кристаллизацией (замерзанием) [2, 4]. При этом не учитывается такой неизбежный фактор, как испарение части воды под действием выделяющейся энергии фазового перехода. Справедливости ради отметим, что решение этой задачи на основе существующих знаний далеко не тривиально. Предлагаемый физический подход к внутреннему процессу кристаллизации [12–14] обеспечивает простое её объяснение.
Как известно [3], в основе процесса кристаллизации метастабильной жидкой воды лежит продвижение границы раздела фаз, или фронта кристаллизации. При различии плотностей фаз по обе стороны фронта, как в случае с водой-1 и тем более А-водой, замерзающая частица, казалось бы, должна изменять свою форму или разрушаться от внутреннего напряжения. В действительности, согласно многочисленным опытам, при замерзании сферическая капля воды-1 сохраняет свою форму. В случае с А-водой этот эффект проявляется в картине “обзернения” облачных кристаллов сферическими ледяными частицами [15, 16]. Попытки объяснить этот парадокс образованием ледяной корки на поверхности капли либо “складчатым” фронтом замерзания [3] лишены физического основания.
Второй парадокс фронтальной кристаллизации происходит от того общепринятого положения, что скрытая энергия фазового перехода высвобождается в чисто тепловой форме. По логике, эта теплота должна выделяться непосредственно на фронте образования ледяной структуры. Однако при этом, согласно простой оценке [12–14], новообразованный лёд должен испытать начальный прирост температуры не менее 100°С при замерзании переохлаждённой воды-1 и 1100°С при кристаллизации А-воды, т.е. в течение конечного времени температурной релаксации лёд лишён условий для физического существования. Этот парадокс также не получил внятного физического объяснения.
Между тем изложенные представления о молекулярной структуре воды предлагают единое объяснение обоих парадоксов, которое заключается в следующем. Непрерывное продвижение поверхности раздела фаз в процессе кристаллизации обусловлено последовательным присоединением молекул из жидкости к жёсткой кристаллической решётке льда. Сохраняющиеся и вновь образующиеся водородные связи служат соединительными звеньями между обеими фазами, обеспечивая их постоянное сцепление. Последнее исключает возможность скольжения вдоль фронтальной поверхности прилегающего к ней слоя жидкости. По этой причине жидкость, захватываемая движущимся фронтом, не испытывает деформации по отношению к твёрдой ледяной основе, в результате чего новообразованная ледяная фаза с самого начала сохраняет исходный геометрический объём жидкой фазы. Но поскольку плотность льда меньше плотности жидкости, на фронте кристаллизации высвобождается избыточная относительно льда масса воды, принимающая форму свободных молекул. Выделяющаяся на фронте энергия передаётся непосредственно этим молекулам, превращаясь в их кинетическую энергию. Отторгнутые от фронта молекулы покидают конденсат через жидкую фазу аналогично тому, как это происходит в процессе спокойного кипения. Тот факт, что капли переохлаждённой воды могут быстро замерзать при температуре, сколь угодно близкой к 0°С, означает, что процесс кристаллизации обладает пространственно-временной изотермией и свободные молекулы не передают жидкости сколько-нибудь заметной энергии. Доля воды, обращающейся при кристаллизации в пар, поддаётся элементарному расчёту из разности плотностей жидкости и льда.
Важно отметить, что полученные здесь выводы касаются также вязкого метастабильного состояния аморфного конденсата при температурах между 135 К и ~150 К. Экспериментальным подтверждением тому может служить, например, упоминаемое в [3] выделение “неопознанного газа” при его кристаллизации.
По всем очевидным соображениям, этим газом может
Рис. 2 Конфигурация ближнего порядка пространственной решётки льда I. Пунктир – водородная связь
Рис. 3 Зависимость разности плотностей воды-1 и льда I от температуры
быть только водяной пар, что, как ни странно, осталось без внимания. Более полная, построенная на экспериментальных фактах аргументация деталей описанного механизма кристаллизации содержится в работах [12–14].
Некоторые свойства переохлаждённой воды-1
Как известно, вероятность замерзания переохлаждённой воды-1 с превращением в лёд I быстро растёт с понижением температуры, а также с увеличением вероятности контакта с инородными зародышами (ядрами) кристаллизации. Вот почему сохранить и изучить её жидкое состояние в сосуде удалось только до -34°С [3]. Зато она способна легко сохраняться в природных облаках и лабораторных туманах в виде взвешенных в воздухе капель. Температура -39°С, при которой безусловно замерзают все взвешенные в воздухе мельчайшие капельки, признана нижним пределом существования воды-1.
В объяснении и уточнении некоторых характеристик воды-1 примем во внимание “расширительный” эффект водородных связей. Этим эффектом легко объясняется уникальная аномалия в плотности воды-1 – максимум при температуре +4°С и прогрессирующее уменьшение с понижением отрицательной температуры [3]. Дело в том, что удельная концентрация действующих водородных связей в воде-1 испытывает обратную зависимость от энергии их “разрушителей” – тепловых колебаний молекул. Поэтому с понижением температуры плотность воды-1 должна, с одной стороны, увеличиваться за счёт ослабления тепловых колебаний молекул, как в обычных веществах, а с другой – уменьшаться за счёт увеличения концентрации водородных связей, отдаляющих молекулы друг от друга. При температурах выше 4°С преобладает первая тенденция, ниже – вторая.
На рис. 3 показана зависимость плотности переохлаждённой воды-1 от температуры, экспериментально определённая вплоть до -34°С [3] и продолженная нами в область более низких температур на основании следующих соображений. Уменьшение плотности воды-1 означает приближение её структуры к структуре кристаллического льда по удельной концентрации водородных связей и соответственно по относительному суммарному объёму мгновенных льдоподобных включений. При этом повышается вероятность возникновения активного зародыша льдообразования – начала превращения в лёд всего образца (капельки) жидкости. То, что при -39°С эта вероятность становится единицей, означает достижение тождественности воды-1 со льдом по плотности и, естественно, по внутренней энергии. Последнее означает, что в этой точке скрытая энергия замерзания воды-1 должна обратиться в нуль. На рис. 4 показано, как должна качественно выглядеть температурная зависимость этого параметра. Между тем в официальных справочниках, например [17], приводятся значения скрытой теплоты замерзания воды, выведенные из линейной аппроксимации экспериментальной зависимости для температур выше -30°С и её линейной экстраполяции в область более низких температур, согласно данным рис. 4.
Доля воды-1, обращающейся в пар при кристаллизации, зависит от её температуры в соответствии с температурной зависимостью плотности (см. рис. 3). Согласно расчёту при -1°С она составляет 8,3%, при -35°С – 5,2%, а с приближением к -39°С всё быстрее спадает до нуля. Эффективная скорость истечения молекулярного пара оценивается в 60…70 м·с-1 независимо от температуры [12–14].
Рис. 4 Справочная (пунктир) и концептуальная модели температурной зависимости энергии кристаллизации переохлаждённой воды-1 (смотрите на предыдущей странице)
Низкотемпературный аморфный конденсат
Многочисленными опытами установлено, что продуктом конденсации чистого водяного пара на подложке при температурах 100…150 К является стеклообразное вещество, в отличие от льда I и воды-1 лишённое сколько-нибудь упорядоченной внутренней структуры по данным структурно-чувствительного анализа [2–4]. При T > 135 К этот аморфный, по определению, конденсат, чаще именуемый аморфным льдом или аморфной водой, переходит из твёрдого в вязкое (консистентное) состояние. С ростом температуры вязкость аморфного конденсата экспоненциально уменьшается, при этом быстро растёт вероятность его спонтанной кристаллизации с превращением в кубический лёд Ic и затем в гексагональный лед Ih. Устойчивость вязкого состояния зависит от материала подложки конденсата и степени её чистоты. При 150…160 К аморфный конденсат приобретает свойство текучести и не удерживается на подложке, при этом полностью теряя устойчивость к кристаллизации. Поэтому жидкий расплав конденсата оказался недоступным для исследований и под вопросом оставалось даже его существование [4, 18].
Из-за сложности прямых измерений почти все известные оценки плотности аморфного конденсата основывались на определении относительного изменения его объема после превращения в лёд I. Итоговый результат выразился в значительном разбросе данных. В обобщающем обзоре [4] случаи с измеренной плотностью 0,94…1 г·см-3 отнесены к “низкоплотной” (low-dense) аморфной воде, а с плотностью между 1,2 и 1,6 ·см-3 – к “высокоплотной” (high-dense). По скачку температуры оценивалась скрытая теплота кристаллизации, полученная также со значительным разбросом результатов – от 30 до 100 кДж·кг-1. В качестве объяснения подобного разброса в [4] допускается существование различных аморфных форм (“полиаморфизм”) воды. Мы предлагаем иное, более обоснованное объяснение:
1. Жёсткая геометрия линий связи молекулы воды (см. рис. 1) исключает полностью хаотическое взаиморасположение молекул, систематически охваченных водородными связями, но обусловливает его регулярность в осреднённом ближнем порядке, как в случае с водой-1 [11]. Отсутствие такой регулярности в инструментальных показаниях означает отсутствие структурообразующих водородных связей в исследуемом конденсате. Отсюда следует, что все исследования аморфной воды фактически относятся к одной и той же форме, структура которой организована без участия водородных связей.
2. Судя по всему, плотность аморфного конденсата заведомо превосходит плотность льда. Поэтому образовавшийся при кристаллизации лёд I должен сохранять объём и температуру исходного образца с выделением излишка массы в виде пара. Пренебрежение этим фактором приводит к занижению оценки измеряемого значения плотности. Однако одновременно возникает пересыщение пара в рабочей камере экспериментальной установки и как результат обратная конденсация некоторой доли его пересыщающего избытка на образовавшийся лед, которая несколько увеличивает его объём. Доля вторично сконденсированного пара зависит от эффективности отвода выделившегося пара от образца.
Чем по условиям эксперимента сильнее отток пара, тем меньшая доля пара “вернётся” к образцу и соответственно тем ниже оказывается расчётная величина плотности аморфной воды. Очевидно, что отмеченный выше разброс данных происходит в результате конструктивных различий экспериментальной техники.
3. Повышение температуры образца при его кристаллизации является результатом не кристаллизации аморфной воды, а вторичной конденсации пара на лёд. В более ранней работе [19] сообщается о получении и исследовании “сверхплотного льда”, сконденсированного при ~100 К. Его плотность 2,32 ± 0,17 г·см-3 определена по геометрическому объёму образца и расходу водяного пара как затрачиваемого на его конденсацию, так и выделившегося при испарении. В отличие от описанного выше косвенного метода данный метод является абсолютным и свободным от ошибок принципиального характера, чем обеспечил получение гораздо более достоверного результата.
“Необычная” жидкая вода в холодных облаках
В отличие от лабораторных условий в атмосферных облаках при T < 0°C (холодных облаках – ХО) жидкая вода существует далеко не как исключение. Eё длительная жизнеспособность в виде скопления капель обусловлена достаточной вероятностью отсутствия центра кристаллизации в отдельной капле. По этим соображениям облака способны служить более благоприятной, чем лаборатория, базой для экспериментальных исследований различных свойств воды при отрицательных температурах.
За многие десятилетия изучения физического строения и эволюции облаков с самолётов-лабораторий замечено, что жидкая дисперсная фаза в ХО ведёт себя неоднозначно. В одних случаях она, как свойственно переохлаждённой воде-1, испаряется в присутствии ледяной дисперсной фазы, поскольку та снижает парциальное давление пара ниже насыщающего над нею. В других, далеко не редких случаях она аномально длительно, с точки зрения названной конденсационной неустойчивости, сосуществует с ледяной фазой. Более того, наши измерения с помощью уникальных фазовоизбирательных приборов с высокой чувствительностью [20, 21] показали, что вопреки ожиданиям, жидкокапельная вода – практически неизменный атрибут облаков любых форм, содержащих ледяную фазу, в том числе с температурами ниже -39°С. Она не только не испаряется в присутствии льда, а, напротив, содержится преимущественно в значительно более крупных (до сотен микрометров) каплях, чем капли типичных водяных облаков [5, 6, 20, 22, 23], и при этом её удельное содержание (водность) положительно коррелирует на непрерывных записях с содержанием дисперсного льда. Всё сказанное содержит полный набор признаков широкотемпературного конденсационного равновесия со льдом некоей жидкой формы воды, отличной от воды-1 по физико-химическим свойствам. Положительные результаты воздействия льдообразующим реагентом на облака смешанной фазы [24] позволяют отнести эту форму к метастабильным.
Обнаруженная таким образом жидкая полиморфная форма воды названа нами А-водой. Её основные физические характеристики были оценены в [5] путём сравнительных измерений микрофизических параметров жидкой фазы в смешанном облаке. Измерения выполнялись с помощью комплекса приборов, градуировочные характеристики которых зависят от разных физических свойств вещества капель – показателя преломления n, плотности ρ, теплоты испарения L – и изначально установлены применительно к воде-1. При этом результаты расчёта оптического показателя ослабления (коэффициента экстинкции) по измеренным спектрам размеров частиц систематически превосходили результаты прямых измерений в 7 раз, а для жидкокапельной составляющей водности – примерно в 40 раз. Подобные расхождения не поддаются объяснению приборными и методическими погрешностями. Согласно детальному анализу, проведённому в [5], удовлетворительное согласие данных при Т ≈ -30° обеспечивается градуировочными характеристиками приборов для значений n = 1,8…1,9, ρ = 2,1…2,2 г·см-3 (согласно расчёту из n по формуле Лоренц – Лорентца [11]) и L ≈ 550 Дж·г-1. Очевидно, что эти значения представляют собой физические характеристики А-воды.
Независимым подтверждением устойчивого существования А-воды в ХО послужило оптическое явление глории, имеющее вид радужного кольца вокруг солнечной тени самолёта на облаке (рис. 5). Общепризнано, что глория формируется в результате обратного рассеяния света на сферических частицах, поэтому само по себе её наличие должно служить индикатором присутствия жидких капель в облаке. Она наблюдается при отрицательной температуре на верхней границе облака [25] и стойко удерживается на облаках верхней тропосферы, в том числе с температурами ниже -39°С.
Вопрос о природе глории детально рассмотрен в работах [22, 23]. Несколько похожее явление может, хотя и с малой вероятностью, возникать в облаках, состоящих из капель воды-1 (n = 1,33). Однако только при условии, что объектом рассеяния света являются прозрачные сферические частицы с показателем преломления n = 1,81…1,82 и с размерами свыше 20 мкм, расчётная (по теории немецкого учёного Г. Ми) модель углового рассеяния полностью идентична по всем свойствам природному явлению глории на ХО. На рис. 6 сопоставлены зависимости углового радиуса жёлтого кольца глории от показателя преломления рассеивающих сферических частиц, рассчитанные на основе теории Ми и геометрической теории радуги. Здесь “геометрическая” кривая наглядно занимает место асимптотической зависимости при увеличении размеров частиц.
Рис. 5 Фото глории с близко пролетающего самолета
Рис. 6 Расчётные зависимости углового радиуса радуги рассеяния от показателя преломления и диаметра рассеивающих сфер в пределах углов, включающих глорию
ность аморфной воды более чем в 2 раза превышает плотность льда I, в процессе кристаллизации в пар обращается 55…60% её массы [12–14], что, естественно, не принималось в расчёт при измерениях её плотности наиболее распространённым способом.
Конденсационное равновесие А-воды с кристаллическим льдом I при недосыщении пара над водой-1 [26] подтверждает высказанное в [27] предположение о том, что так называемая “квазижидкая” плёнка, покрывающая ледяную поверхность [16, 28], имеет аморфную структуру. Иначе говоря, эта плёнка, в действительности проявляющая свойства жидкости и делающая лёд уникально скользким, состоит из А-воды. Это служит одним из доказательств [6, 8, 12, 14] того, что аморфная вода выполняет функцию промежуточной фазы в конденсационном льдообразовании в соответствии с правилом “ступенчатых переходов” Оствальда [29] и способна сохраняться в метастабильном состоянии при отсутствии льдообразующего центра. При таянии льда образуется нерастворимая взвесь обрывков плёнки А-воды в талой воде-1 [8, 12–14], чем, очевидно, и обусловлена известная биологическая активность последней.
Подытожим и сравним между собой экспериментально установленные характеристики свойств обеих метастабильных форм – воды-1 и аморфной воды, заимствованные из различных источников (см. таблицу).
Литература
1. Зацепина Г.Н. Физические свойства и структура воды. – М.: Изд-во MГУ, 1998. – 172 с. 2. Скрипов В.П., Коверда В.П. Спонтанная кристаллизация переохлаждённых жидкостей. – М.: Наука, 1984. – 231 с. 3. Вода и водные растворы при температурах ниже 0°С / Пер. с англ. Под ред. Ф. Франкса. – Киев: Наукова думка, 1985. – 388 с. 4. Angell, C.A. Amorphous water. Annu. Rev. Phys. Chem., 55, 559–583, 2004. 5. Невзоров А.Н. Исследования по физике жидкой фазы в льдосодержащих облаках // Метеорология и гидрология. – 1993. – № 1. – С. 55–68. 6. Nevzorov A.N. Cloud phase composition and phase evolution as deduced from experimental evidence and physicochemical concepts. – 13th Int. Conf. on Clouds and Precipitation, Reno, Nevada, USA, 2000, 728–731. 7. Невзоров А.Н. Из чего состоят облака // Химия и жизнь. – 2006. – № 10. – С. 41–45. 8. Невзоров А.Н. Биморфизм и свойства жидкокапельной воды в холодных облаках // Вопросы физики облаков. – М.: Метеорология и гидрология, 2008. – С. 268–298. 9. Дерягин Б.В., Чураев Н.В. Новые свойства жидкостей. – М.: Наука, 1971. – 176 с. 10. Stillinger F.H. Water revisited. – Science, 209, № 4455, 1980, 451–457. 11. Эйзенберг Д., Кауцман В. Структура и свойства воды / Пер. с англ. – Л.: Гидрометеоиздат, 1975. – 280 с. Такой результат убеждает в том, что глория оптически формируется как радуга на достаточно крупных каплях А-воды, подобно тому, как хорошо знакомая дождевая радуга – на каплях воды-1. Анализ явления глории позволил несколько уточнить значение показателя преломления А-воды в оптическом диапазоне и соответственно оценить её плотность величиной около 2,1 г·см-3 с точностью до адекватности формулы Лоренц – Лорентца применительно к данному случаю. А-вода – жидкая аморфная субстанция Итак, с помощью существенно различающихся методов получены довольно близкие оценки плотности воды, находящейся в формально непохожих состояниях. С одной стороны, это лабораторный твёрдый конденсат с температурой около -170°С и достовернее всего измеренной плотностью ~2,3 г·см-3 [19]. С другой стороны, это жидкокапельная А-вода, присутствующая в холодных тропосферных облаках со средней температурой порядка -20°С, плотность которой по косвенной аналитической оценке составляет около 2,1 г·см-3. Напомним, что согласно [1] плотностью свыше 2 г·см-3 должна обладать единственная полиморфная форма воды, межмолекулярная структура которой организована без участия водородных связей. Знак разности упомянутых значений плотности на краях примерно 150-градусного температурного интервала соответствует положительному тепловому расширению, свойственному необозримому классу веществ с неводородосвязанной структурой. Всё сказанное выше, включая свойство постепенного плавления аморфного льда при его нагревании [2], заставляет заключить, что в данном случае мы имеем дело с одной и той же структурной формой воды, находящейся в разных агрегатных состояниях. А именно, А-вода представляет собой жидкий расплав твёрдой аморфной воды (аморфного льда). Именно она служит той субстанцией, которая восполняет пробел в знаниях о состоянии воды при отрицательных температурах выше ~ -120°С. Условимся по-прежнему называть А-водой аморфную воду в жидком состоянии. Изучение её свойств в необычных условиях самолётного натурного эксперимента позволило дополнить список известных свойств и уточнить другие свойства собственно аморфной фазы воды. Установлено [22, 23], что аморфная вода обладает высоким показателем преломления 1,81…1,82 в жёлтом свете при -30°С, что создает возможность её обнаружения оптическими методами. Исключительно низкая теплота испарения аморфной воды – около 550 ккал·кг-1 при -30°С [5] – облегчает и ускоряет процессы её конденсации и испарения по сравнению с обычной водой-1 и кристаллическим льдом. Вследствие того что плот-мир измерений 8/2009 45 Ранее известные и полученные автором характеристики метастабильных форм воды Характеристика Вода-1 Аморфная вода Температурные пределы метастабильного состояния 234…273 К 135…273 К Вероятность кристаллизации Растёт с понижением температуры Растёт с повышением температуры Температура затвердевания/размягчения – 135 К Температура перехода из вязкого в жидкое состояние – 150…160 К Температура гомогенной кристаллизации 234 К – Плотность (здесь и везде при данной температуре), г⋅см-3 0,92…1 (234…273 К) (согласно рис. 3) 2,3 (∼100 К) 2,1 (243 К) Показатель преломления в жёлтом свете 1,33 (273 К) 1,81…1,82 (243 К) Энергия испарения, кДж⋅кг-1 2570 (243 К) ∼550 (243 К) Скрытая энергия кристаллизации, кДж⋅кг-1 0 (234 К) 260 – 320 (>243 К) (согласно рис. 4) ∼2290 (243 К) (разность энергий испарения льда и А-воды) Выход пара при кристаллизации (расчёт по [12–14]), % от исходной массы 0 (234 К) 5,2 (238 К) 8,3 (272 К) 55…60 Теплоёмкость, кДж⋅кг-1 К-1 4,22…4,77 (273…234 К) Не определена Парциальное давление насыщенного пара Справочное для воды [17] Справочное для льда [17] *** Данное исследование, затрагивающее проблемы физической химии воды, было инициировано необходимостью решения ряда проблем физики двухфазных, или льдосодержащих, холодных облаков. Детальное описание приложения полученных результатов в физике облаков выходит за рамки настоящей статьи. Отметим только, что обе метастабильные формы воды встречаются в природе Земли практически лишь в составе облаков и туманов, где каждая играет собственную определённую роль в образовании и формировании микроструктуры ледяной фракции и определяет своим присутствием специфику макроскопических (оптических, радиационных, химических, осадкообразующих и др.) свойств облака. Нам представляется, что полученные результаты могут найти применение в исследовании присутствия воды в атмосферах и на поверхностях других, более холодных, планет. 12. Невзоров А.Н. О внутреннем механизме кристаллизации метастабильной жидкой воды и об его эффектах, влияющих на внутриоблачные процессы // Изв. АН РАН Физ. Атм. и Океана. – 2006. – Т. 42. – № 6. – С. 830–838. / Nevzorov A.N. Internal Mechanism of Metastable Liquid Water Crystallization and Its Effects on Intracloud Processes. Izvestiya, Atm. and Ocean Phys., 2006, vol. 42, № 6, 765–772. 13. Nevzorov A.N. Some properties of metastable states of water. Physics of Wave Phenomena, 2006, № 1, с. 45–57. 14. Nevzorov A.N. Liquid-state water bimorphism in cold atmospheric clouds. In: Atmospheric Science Research Progress, Nova, New York (to be printed). 15. Заморский А.Д. Атмосферный лёд. – М.: Изд-во АН СССР, 1955. – 377 с. 16. Pruppacher H.R., Klett J.D. Microphysics of clouds and precipitation. – D. Reidel Publ. Co., Dordrecht, Holland, 1978. – 714 р. 17. Мазин И.П., Хргиан А.Х. (ред.). Облака и облачная атмосфера: Справочник. – Л.: Гидрометеоиздат, 1989. – 647 с. 18. Mishima O., Stanley H.E. The relationship between liquid, supercooled and glassy water. – Nature. – 1998. – 396. – 329–335. 19. Delsemme A.H., Wenger A. Superdense water ice // Science. – 1970. – 167. – № 3914. – P. 44–45. 20. Невзоров А.Н., Шугаев В.Ф. Экспериментальные исследования фазово-дисперсного строения облаков слоистых форм при отрицательных температурах // Метеорология и гидрология. – 1992. – № 8. – С. 52–65. 21. Nevzorov A.N. An experience and promising results of advanced measurements into microphysics of cold clouds. – WMO Workshop on Measurements of Cloud Properties for Forecasts of Weather and Climate, Mexico City, 1997, 173– 182. 22. Nevzorov A.N. Glory phenomenon informs of presence and phase state of liquid water in cold clouds // Atmospheric Research. – 2006. – Vol. 82. – P. 367–378. 23. Невзоров А.Н. Явление глории и природа жидкокапельной фракции в холодных облаках // Оптика атмосферы и океана. – 2007. – № 8. – С. 674–680. 24. Половина И.П. Экспериментальные исследования процесса искусственной кристаллизации и рассеяния переохлаждённых слоистообразных облаков и туманов // Вопросы физики облаков. – Л.: Гидрометеоиздат, 1987. – С. 65–73. 25. Миннарт M. Свет и цвет в природе / Пер. с англ. – M.: Наука, 1969. – 344 с. 26. Мезрин М.Ю., Миронова Г.В. Некоторые результаты исследования влажности воздуха в слоистообразных облаках // Тр. Центр. аэролог. обсерв. – Вып. 178. – 1991. – С. 125– 132. 27. Fletcher N.H. The chemical physics of ice. – Cambr. Univ. Press, 1970. – 271 p. 28. Jellinek H. H. G. Liquid-like (transition) layeron ice // J. Colloid and Interface Sci. – 1967. – V. 25. – № 2. – P. 192–197. 29. Урусов В.С. Теоретическая кристаллохимия. – М.: Изд-во МГУ, 1987. – 275 с.
Материал подготовлен Мосиным Олегом.
www.o8ode.ru
Получение аморфного льда
 Аморфный лёд - вода в форме твердого аморфного вещества, у которого молекулы воды расположены случайным образом, наподобие атомов в обычном стекле. Чаще всего в природе лёд находится в поликристаллическом состоянии.
Аморфный лёд - вода в форме твердого аморфного вещества, у которого молекулы воды расположены случайным образом, наподобие атомов в обычном стекле. Чаще всего в природе лёд находится в поликристаллическом состоянии.
Аморфный лед отличается тем, что у него отсутствует дальний порядок кристаллической структуры.
Аморфный лед получают путем чрезвычайно быстрого охлаждения жидкой воды (со скоростью порядка 1 000 000 К в секунду), так что молекулы не успевают сформировать кристаллическую решётку.
Точно так же, как существует много кристаллических форм льда (в настоящее время известны пятнадцать модификаций), есть также разные формы аморфного льда, отличающихся главным образом плотностью.
Способы получения
Почти любое кристаллическое вещество можно быстрым охлаждением из расплава перевести в метастабильное аморфное состояние. Поэтому ключом к получению аморфного льда являются темпы охлаждения. Жидкую воду надо охладить до температуры её стеклования (около 136 К или −137 °C) в течение нескольких миллисекунд, чтобы избежать спонтанного зарождения кристаллов.
Давление служит ещё одним важным фактором в получении аморфного льда. Кроме того, меняя давление, можно превращать одну разновидность аморфного льда в другую.
К воде можно добавлять специальные химические вещества - криопротекторы, которые понижают температуру её замерзания и увеличивают вязкость, что препятствует образованию кристаллов. Стеклование без добавления криопротекторов достигается при очень быстром охлаждении. Эти методы используют в биологии для криоконсервации клеток и тканей.
Разновидности аморфного льда
Аморфный лёд существует в трех главных формах: аморфный лёд низкой плотности (АЛНП или LDA), который образуется при атмосферном давлении и ниже, аморфный лёд высокой плотности (АЛВП или HDA) и аморфный лёд очень высокой плотности (АЛОВП или VHDA).
Аморфный лёд низкой плотности
При осаждении водяного пара на медную пластинку, охлаждённую ниже 163 К, впервые был получен аморфный лёд с плотностью 0,93 г/см³, он же аморфная твёрдая вода, или стеклообразная вода. Сейчас в лабораториях получают АЛНП тем же методом при температуре ниже 120 К. Очевидно, в космосе такой лёд возникает подобным же способом на разных холодных поверхностях, например, частицах пыли. Предполагают, что этот лёд вполне обычен для состава комет и присутствует на внешних планетах.
Если менять температуру подложки и скорость осаждения, то можно получать лёд другой плотности. Так, при 77 К и скорости осаждения 10 мг в час получается лёд плотности 0,94 г/см³, а при 10К и скорости 4 мг в час - 1,1 г/см³, причём его структура, хоть и лишённая дальнего порядка, оказывается гораздо сложнее, чем у предыдущего аморфного льда. До сих пор неясно: одна и та же модификация аморфного льда (с плотностью 0,94 г/см³) образуется при нагревании АЛВП и при осаждении из пара или они различаются.
Аморфный лёд высокой плотности
Аморфный лёд высокой плотности можно получить, сдавливая лёд Ih при температурах ниже ~140 К. При температуре 77 K, АЛВП образуется из обычного природного льда Ih при давлениях около 1,6 ГПа, а из АЛНП при давлении около 0,5 ГПа. При температуре 77 К и давлении 1 ГПа плотность АЛВП равна 1,3 г/см³. Если сбрость давление до атмосферного, плотность АЛВП уменьшится с 1,3 г/см³ до 1,17 г/см³, но при температуре 77 К он сохраняется сколь угодно долго.
Если же лёд высокой плотности нагреть при нормальном давлении, он не превратится в исходный лёд Ih, а вместо этого станет ещё одной модификацией аморфного льда, на сей раз с низкой плотностью, 0,94 г/см³.Этот лёд при дальнейшем нагревании в районе 150 К закристаллизуется, но опять не в исходный лёд Ih, a примет кубическую сингонию льда Ic.
Аморфный лёд очень высокой плотности
АЛОВП был открыт в 1996 г., когда обнаружили, что если нагреть АЛВП до 160 К при давлении в диапазоне от 1 до 2 ГПа, то он становится плотнее, и при атмосферном давлении его плотность равна 1,26 г/см³.
Некоторые особенности
Тяжёлые аморфные льды вполне могли бы утонуть в обычной воде, но этого не случается: слегка нагревшись, они превратятся в кристаллический лёд, плотность которого окажется меньше водяной, и тот, не успев растаять, всплывёт вверх. Строго говоря, слово «плавление» к аморфному льду неприменимо, поскольку этот процесс происходит в интервале температур, что по-английски называется «softening» (размягчение).
С таянием аморфных льдов связана одна из нерешенных проблем. На фазовой диаграмме состояния льда граница между аморфными льдами низкой и высокой плотностей протягивается и в область жидкой фазы. Из этого следует, что при плавлении каждого из этих льдов должна получаться соответственно менее и более плотная вода, причём разница удельных объёмов у этих двух вод может достигать 20 %. Температура же этого плавления лежит в интервале от 130 до 200 К (в зависимости от давления). Можно предположить, что есть ещё точка, где сосуществуют три жидких фазы: две соответствуют размягчённым АЛНП и АЛВП, и одна - обычной жидкой. Её координаты на фазовой диаграмме - 0,1 ГПа и 200 К. К сожалению, довести аморфные льды до прямого превращения в жидкость не удаётся; при нагреве до примерно 150 К они становятся кристаллическим льдом. А он тает при гораздо более высокой температуре.
Применение
Аморфный лед используют в некоторых научных экспериментах, особенно электронной криомикроскопии, которая позволяет исследовать биологические молекулы в том состоянии, которое близко к их естественному состоянию в жидкой воде.
vodopad-lednik.ru
Аморфный лёд — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
Аморфный лёд — вода в форме твердого аморфного вещества, у которого молекулы воды расположены случайным образом, наподобие атомов в обычном стекле. Чаще всего в природе лёд находится в поликристаллическом состоянии. Аморфный лед отличается тем, что у него отсутствует дальний порядок кристаллической структуры.
Аморфный лёд получают путём чрезвычайно быстрого охлаждения жидкой воды (со скоростью порядка 1 000 000 К в секунду), так что молекулы не успевают сформировать кристаллическую решётку.
Точно так же, как существует много кристаллических форм льда (в настоящее время известны шестнадцать модификаций), есть также разные формы аморфного льда, отличающихся главным образом плотностью.
Способы получения
Почти любое кристаллическое вещество можно быстрым охлаждением из расплава перевести в метастабильное аморфное состояние. Поэтому ключом к получению аморфного льда являются темпы охлаждения. Жидкую воду надо охладить до температуры её стеклования (около 136 К или −137 °C) в течение нескольких миллисекунд, чтобы избежать спонтанного зарождения кристаллов.
Давление служит ещё одним важным фактором в получении аморфного льда. Кроме того, меняя давление, можно превращать одну разновидность аморфного льда в другую.
К воде можно добавлять специальные химические вещества — криопротекторы, которые понижают температуру её замерзания и увеличивают вязкость, что препятствует образованию кристаллов. Стеклование без добавления криопротекторов достигается при очень быстром охлаждении. Эти методы используют в биологии для криоконсервации клеток и тканей.
Разновидности аморфного льда
Аморфный лёд существует в трёх главных формах: аморфный лёд низкой плотности (АЛНП или LDA), который образуется при атмосферном давлении и ниже, аморфный лёд высокой плотности (АЛВП или HDA) и аморфный лёд очень высокой плотности (АЛОВП или VHDA).
Аморфный лёд низкой плотности
При осаждении водяного пара на медную пластинку, охлаждённую ниже 163 К, впервые был получен аморфный лёд с плотностью 0,93 г/см³, он же аморфная твёрдая вода, или стеклообразная вода. Сейчас в лабораториях получают АЛНП тем же методом при температуре ниже 120 К. Очевидно, в космосе такой лёд возникает подобным же способом на разных холодных поверхностях, например, частицах пыли. Предполагают, что этот лёд вполне обычен для состава комет и присутствует на внешних планетах.[1]
Если менять температуру подложки и скорость осаждения, то можно получать лёд другой плотности. Так, при 77 К и скорости осаждения 10 мг в час получается лёд плотности 0,94 г/см³, а при 10К и скорости 4 мг в час — 1,1 г/см³, причём его структура, хоть и лишённая дальнего порядка, оказывается гораздо сложнее, чем у предыдущего аморфного льда. До сих пор неясно: одна и та же модификация аморфного льда (с плотностью 0,94 г/см³) образуется при нагревании АЛВП и при осаждении из пара или они различаются.
Аморфный лёд высокой плотности
Аморфный лёд высокой плотности можно получить, сдавливая лёд Ih при температурах ниже ~140 К. При температуре 77 K, АЛВП образуется из обычного природного льда Ih при давлениях около 1,6 ГПа[2], а из АЛНП при давлении около 0,5 ГПа[3]. При температуре 77 К и давлении 1 ГПа плотность АЛВП равна 1,3 г/см³. Если сбросить давление до атмосферного, плотность АЛВП уменьшится с 1,3 г/см³ до 1,17 г/см³[2], но при температуре 77 К он сохраняется сколь угодно долго.
Если же лёд высокой плотности нагреть при нормальном давлении, он не превратится в исходный лёд Ih, а вместо этого станет ещё одной модификацией аморфного льда, на сей раз с низкой плотностью, 0,94 г/см³. Этот лёд при дальнейшем нагревании в районе 150 К закристаллизуется, но опять не в исходный лёд Ih, a примет кубическую сингонию льда Ic.
Аморфный лёд очень высокой плотности
АЛОВП был открыт в 1996 году, когда обнаружили, что если нагреть АЛВП до 160 К при давлении в диапазоне от 1 до 2 ГПа, то он становится плотнее, и при атмосферном давлении его плотность равна 1,26 г/см³[4][5].
Некоторые особенности
- Тяжёлые аморфные льды вполне могли бы утонуть в обычной воде, но этого не случается: слегка нагревшись, они превратятся в кристаллический лёд, плотность которого окажется меньше водяной, и тот, не успев растаять, всплывёт вверх. Строго говоря, слово «плавление» к аморфному льду неприменимо, поскольку этот процесс происходит в интервале температур, что по-английски называется «softening» (размягчение).
- С таянием аморфных льдов связана одна из нерешённых проблем. На фазовой диаграмме состояния льда граница между аморфными льдами низкой и высокой плотностей протягивается и в область жидкой фазы. Из этого следует, что при плавлении каждого из этих льдов должна получаться соответственно менее и более плотная вода, причём разница удельных объёмов у этих двух вод может достигать 20 %. Температура же этого плавления лежит в интервале от 130 до 200 К (в зависимости от давления). Можно предположить, что есть ещё точка, где сосуществуют три жидких фазы: две соответствуют размягчённым АЛНП и АЛВП, и одна — обычной жидкой. Её координаты на фазовой диаграмме — 0,1 ГПа и 200 К. Довести аморфные льды до прямого превращения в жидкость не удаётся; при нагреве до примерно 150 К они становятся кристаллическим льдом. А он тает при гораздо более высокой температуре.
Применение
Аморфный лёд используют в некоторых научных экспериментах, особенно электронной криомикроскопии, которая позволяет исследовать биологические молекулы в том состоянии, которое близко к их естественному состоянию в жидкой воде[6].
Напишите отзыв о статье "Аморфный лёд"
Примечания
- ↑ [www.sciencemag.org/cgi/content/abstract/294/5550/2335 Estimation of water-glass transition temperature based on hyperquenched glassy water experiments] из Science (нужна регистрация).
- ↑ 1 2 O. Mishima and LD Calvert, and E. Whalley, Nature 310, 393 (1984)
- ↑ O. Mishima, LD Calvert, and E. Whalley, Nature 314, 76 (1985).
- ↑ O.Mishima, Nature, 384, 6069 pp 546—549 (1996).
- ↑ Loerting, T., Salzmann, C., Kohl, I., Mayer, E., Hallbrucker, A., A 2nd distinct structural state of HDA at 77 K and 1 bar, PhysChemChemPhys 3:5355-5357. (2001).
- ↑ Dubochet, J., M. Adrian, J. J. Chang, J. C. Homo, J. Lepault, A. W. McDowell, and P. Schultz. Cryo-electron microscopy of vitrified specimens. Q. Rev. Biophys. 21:129-228. (1988).
Ссылки
- [wsyachina.narod.ru/physics/aqua_3.html Популярно о разновидностях льда, включая аморфный]. статья С. М. Комарова — Ледяные узоры высокого давления.
- Chaplin, Martin. [www.lsbu.ac.uk/water/amorph.html Amorphous Ice and Glassy Water]. Water Structure and Science (23 июня 2008). Проверено 22 февраля 2009. [www.webcitation.org/66QtGn82v Архивировано из первоисточника 25 марта 2012].
- [www.aip.org/pnu/2002/split/612-3.html Об исследованиях АЛОВП (англ.)]
- [adsbit.harvard.edu/cgi-bin/nph-iarticle_query?1995ApJ%2E%2E%2E455%2E%2E389J АЛВП в космосе (англ.)]
- [exobiology.arc.nasa.gov/ice/high.html Структуры АЛВП (англ.)]
Отрывок, характеризующий Аморфный лёд
– Стало быть вы служите? – Служу. – Он помолчал немного. – Так зачем же вы служите? – А вот зачем. Отец мой один из замечательнейших людей своего века. Но он становится стар, и он не то что жесток, но он слишком деятельного характера. Он страшен своей привычкой к неограниченной власти, и теперь этой властью, данной Государем главнокомандующим над ополчением. Ежели бы я два часа опоздал две недели тому назад, он бы повесил протоколиста в Юхнове, – сказал князь Андрей с улыбкой; – так я служу потому, что кроме меня никто не имеет влияния на отца, и я кое где спасу его от поступка, от которого бы он после мучился. – А, ну так вот видите! – Да, mais ce n'est pas comme vous l'entendez, [но это не так, как вы это понимаете,] – продолжал князь Андрей. – Я ни малейшего добра не желал и не желаю этому мерзавцу протоколисту, который украл какие то сапоги у ополченцев; я даже очень был бы доволен видеть его повешенным, но мне жалко отца, то есть опять себя же. Князь Андрей всё более и более оживлялся. Глаза его лихорадочно блестели в то время, как он старался доказать Пьеру, что никогда в его поступке не было желания добра ближнему. – Ну, вот ты хочешь освободить крестьян, – продолжал он. – Это очень хорошо; но не для тебя (ты, я думаю, никого не засекал и не посылал в Сибирь), и еще меньше для крестьян. Ежели их бьют, секут, посылают в Сибирь, то я думаю, что им от этого нисколько не хуже. В Сибири ведет он ту же свою скотскую жизнь, а рубцы на теле заживут, и он так же счастлив, как и был прежде. А нужно это для тех людей, которые гибнут нравственно, наживают себе раскаяние, подавляют это раскаяние и грубеют от того, что у них есть возможность казнить право и неправо. Вот кого мне жалко, и для кого бы я желал освободить крестьян. Ты, может быть, не видал, а я видел, как хорошие люди, воспитанные в этих преданиях неограниченной власти, с годами, когда они делаются раздражительнее, делаются жестоки, грубы, знают это, не могут удержаться и всё делаются несчастнее и несчастнее. – Князь Андрей говорил это с таким увлечением, что Пьер невольно подумал о том, что мысли эти наведены были Андрею его отцом. Он ничего не отвечал ему. – Так вот кого мне жалко – человеческого достоинства, спокойствия совести, чистоты, а не их спин и лбов, которые, сколько ни секи, сколько ни брей, всё останутся такими же спинами и лбами. – Нет, нет и тысячу раз нет, я никогда не соглашусь с вами, – сказал Пьер.Вечером князь Андрей и Пьер сели в коляску и поехали в Лысые Горы. Князь Андрей, поглядывая на Пьера, прерывал изредка молчание речами, доказывавшими, что он находился в хорошем расположении духа. Он говорил ему, указывая на поля, о своих хозяйственных усовершенствованиях. Пьер мрачно молчал, отвечая односложно, и казался погруженным в свои мысли. Пьер думал о том, что князь Андрей несчастлив, что он заблуждается, что он не знает истинного света и что Пьер должен притти на помощь ему, просветить и поднять его. Но как только Пьер придумывал, как и что он станет говорить, он предчувствовал, что князь Андрей одним словом, одним аргументом уронит всё в его ученьи, и он боялся начать, боялся выставить на возможность осмеяния свою любимую святыню. – Нет, отчего же вы думаете, – вдруг начал Пьер, опуская голову и принимая вид бодающегося быка, отчего вы так думаете? Вы не должны так думать. – Про что я думаю? – спросил князь Андрей с удивлением. – Про жизнь, про назначение человека. Это не может быть. Я так же думал, и меня спасло, вы знаете что? масонство. Нет, вы не улыбайтесь. Масонство – это не религиозная, не обрядная секта, как и я думал, а масонство есть лучшее, единственное выражение лучших, вечных сторон человечества. – И он начал излагать князю Андрею масонство, как он понимал его. Он говорил, что масонство есть учение христианства, освободившегося от государственных и религиозных оков; учение равенства, братства и любви. – Только наше святое братство имеет действительный смысл в жизни; всё остальное есть сон, – говорил Пьер. – Вы поймите, мой друг, что вне этого союза всё исполнено лжи и неправды, и я согласен с вами, что умному и доброму человеку ничего не остается, как только, как вы, доживать свою жизнь, стараясь только не мешать другим. Но усвойте себе наши основные убеждения, вступите в наше братство, дайте нам себя, позвольте руководить собой, и вы сейчас почувствуете себя, как и я почувствовал частью этой огромной, невидимой цепи, которой начало скрывается в небесах, – говорил Пьер. Князь Андрей, молча, глядя перед собой, слушал речь Пьера. Несколько раз он, не расслышав от шума коляски, переспрашивал у Пьера нерасслышанные слова. По особенному блеску, загоревшемуся в глазах князя Андрея, и по его молчанию Пьер видел, что слова его не напрасны, что князь Андрей не перебьет его и не будет смеяться над его словами. Они подъехали к разлившейся реке, которую им надо было переезжать на пароме. Пока устанавливали коляску и лошадей, они прошли на паром. Князь Андрей, облокотившись о перила, молча смотрел вдоль по блестящему от заходящего солнца разливу. – Ну, что же вы думаете об этом? – спросил Пьер, – что же вы молчите? – Что я думаю? я слушал тебя. Всё это так, – сказал князь Андрей. – Но ты говоришь: вступи в наше братство, и мы тебе укажем цель жизни и назначение человека, и законы, управляющие миром. Да кто же мы – люди? Отчего же вы всё знаете? Отчего я один не вижу того, что вы видите? Вы видите на земле царство добра и правды, а я его не вижу. Пьер перебил его. – Верите вы в будущую жизнь? – спросил он. – В будущую жизнь? – повторил князь Андрей, но Пьер не дал ему времени ответить и принял это повторение за отрицание, тем более, что он знал прежние атеистические убеждения князя Андрея. – Вы говорите, что не можете видеть царства добра и правды на земле. И я не видал его и его нельзя видеть, ежели смотреть на нашу жизнь как на конец всего. На земле, именно на этой земле (Пьер указал в поле), нет правды – всё ложь и зло; но в мире, во всем мире есть царство правды, и мы теперь дети земли, а вечно дети всего мира. Разве я не чувствую в своей душе, что я составляю часть этого огромного, гармонического целого. Разве я не чувствую, что я в этом огромном бесчисленном количестве существ, в которых проявляется Божество, – высшая сила, как хотите, – что я составляю одно звено, одну ступень от низших существ к высшим. Ежели я вижу, ясно вижу эту лестницу, которая ведет от растения к человеку, то отчего же я предположу, что эта лестница прерывается со мною, а не ведет дальше и дальше. Я чувствую, что я не только не могу исчезнуть, как ничто не исчезает в мире, но что я всегда буду и всегда был. Я чувствую, что кроме меня надо мной живут духи и что в этом мире есть правда.
wiki-org.ru
Аморфный лёд - это... Что такое Аморфный лёд?
Аморфный лёд — вода в форме твердого аморфного вещества, у которого молекулы воды расположены случайным образом, наподобие атомов в обычном стекле. Чаще всего в природе лёд находится в поликристаллическом состоянии. Аморфный лед отличается тем, что у него отсутствует дальний порядок кристаллической структуры.
Аморфный лёд получают путём чрезвычайно быстрого охлаждения жидкой воды (со скоростью порядка 1 000 000 К в секунду), так что молекулы не успевают сформировать кристаллическую решётку.
Точно так же, как существует много кристаллических форм льда (в настоящее время известны пятнадцать модификаций), есть также разные формы аморфного льда, отличающихся главным образом плотностью.
Способы получения
Почти любое кристаллическое вещество можно быстрым охлаждением из расплава перевести в метастабильное аморфное состояние.
Поэтому ключом к получению аморфного льда являются темпы охлаждения. Жидкую воду надо охладить до температуры её стеклования (около 136 К или −137 °C) в течение нескольких миллисекунд, чтобы избежать спонтанного зарождения кристаллов.Давление служит ещё одним важным фактором в получении аморфного льда. Кроме того, меняя давление, можно превращать одну разновидность аморфного льда в другую.
К воде можно добавлять специальные химические вещества — криопротекторы, которые понижают температуру её замерзания и увеличивают вязкость, что препятствует образованию кристаллов. Стеклование без добавления криопротекторов достигается при очень быстром охлаждении. Эти методы используют в биологии для криоконсервации клеток и тканей.
Разновидности аморфного льда
Аморфный лёд существует в трёх главных формах: аморфный лёд низкой плотности (АЛНП или LDA), который образуется при атмосферном давлении и ниже, аморфный лёд высокой плотности (АЛВП или HDA) и аморфный лёд очень высокой плотности (АЛОВП или VHDA).
Аморфный лёд низкой плотности
При осаждении водяного пара на медную пластинку, охлаждённую ниже 163 К, впервые был получен аморфный лёд с плотностью 0,93 г/см³, он же аморфная твёрдая вода, или стеклообразная вода. Сейчас в лабораториях получают АЛНП тем же методом при температуре ниже 120 К. Очевидно, в космосе такой лёд возникает подобным же способом на разных холодных поверхностях, например, частицах пыли. Предполагают, что этот лёд вполне обычен для состава комет и присутствует на внешних планетах.[1]
Если менять температуру подложки и скорость осаждения, то можно получать лёд другой плотности. Так, при 77 К и скорости осаждения 10 мг в час получается лёд плотности 0,94 г/см³, а при 10К и скорости 4 мг в час — 1,1 г/см³, причём его структура, хоть и лишённая дальнего порядка, оказывается гораздо сложнее, чем у предыдущего аморфного льда. До сих пор неясно: одна и та же модификация аморфного льда (с плотностью 0,94 г/см³) образуется при нагревании АЛВП и при осаждении из пара или они различаются.
Аморфный лёд высокой плотности
Аморфный лёд высокой плотности можно получить, сдавливая лёд Ih при температурах ниже ~140 К. При температуре 77 K, АЛВП образуется из обычного природного льда Ih при давлениях около 1,6 ГПа[2], а из АЛНП при давлении около 0,5 ГПа[3]. При температуре 77 К и давлении 1 ГПа плотность АЛВП равна 1,3 г/см³. Если сбросить давление до атмосферного, плотность АЛВП уменьшится с 1,3 г/см³ до 1,17 г/см³[2], но при температуре 77 К он сохраняется сколь угодно долго.
Если же лёд высокой плотности нагреть при нормальном давлении, он не превратится в исходный лёд Ih, а вместо этого станет ещё одной модификацией аморфного льда, на сей раз с низкой плотностью, 0,94 г/см³. Этот лёд при дальнейшем нагревании в районе 150 К закристаллизуется, но опять не в исходный лёд Ih, a примет кубическую сингонию льда Ic.
Аморфный лёд очень высокой плотности
АЛОВП был открыт в 1996 г., когда обнаружили, что если нагреть АЛВП до 160 К при давлении в диапазоне от 1 до 2 ГПа, то он становится плотнее, и при атмосферном давлении его плотность равна 1,26 г/см³[4][5].
Некоторые особенности
- Тяжёлые аморфные льды вполне могли бы утонуть в обычной воде, но этого не случается: слегка нагревшись, они превратятся в кристаллический лёд, плотность которого окажется меньше водяной, и тот, не успев растаять, всплывёт вверх. Строго говоря, слово «плавление» к аморфному льду неприменимо, поскольку этот процесс происходит в интервале температур, что по-английски называется «softening» (размягчение).
- С таянием аморфных льдов связана одна из нерешённых проблем. На фазовой диаграмме состояния льда граница между аморфными льдами низкой и высокой плотностей протягивается и в область жидкой фазы. Из этого следует, что при плавлении каждого из этих льдов должна получаться соответственно менее и более плотная вода, причём разница удельных объёмов у этих двух вод может достигать 20 %. Температура же этого плавления лежит в интервале от 130 до 200 К (в зависимости от давления). Можно предположить, что есть ещё точка, где сосуществуют три жидких фазы: две соответствуют размягчённым АЛНП и АЛВП, и одна — обычной жидкой. Её координаты на фазовой диаграмме — 0,1 ГПа и 200 К. Довести аморфные льды до прямого превращения в жидкость не удаётся; при нагреве до примерно 150 К они становятся кристаллическим льдом. А он тает при гораздо более высокой температуре.
Применение
Аморфный лёд используют в некоторых научных экспериментах, особенно электронной криомикроскопии, которая позволяет исследовать биологические молекулы в том состоянии, которое близко к их естественному состоянию в жидкой воде[6].
Примечания
- ↑ Estimation of water-glass transition temperature based on hyperquenched glassy water experiments из Science (нужна регистрация).
- ↑ 1 2 O. Mishima and LD Calvert, and E. Whalley, Nature 310, 393 (1984)
- ↑ O. Mishima, LD Calvert, and E. Whalley, Nature 314, 76 (1985).
- ↑ O.Mishima, Nature, 384, 6069 pp 546—549 (1996).
- ↑ Loerting, T., Salzmann, C., Kohl, I., Mayer, E., Hallbrucker, A., A 2nd distinct structural state of HDA at 77 K and 1 bar, PhysChemChemPhys 3:5355-5357. (2001).
- ↑ Dubochet, J., M. Adrian, J. J. Chang, J. C. Homo, J. Lepault, A. W. McDowell, and P. Schultz. Cryo-electron microscopy of vitrified specimens. Q. Rev. Biophys. 21:129-228. (1988).
Ссылки
dvc.academic.ru
Воду разделили на две разные жидкости

Мы привыкли думать, что жидкая вода — это беспорядочное скопление молекул, которые быстро передвигаются в рамках некоторой структуры. Но ученые Стокгольмского университета обнаружили две фазы этой жидкости с большими различиями в структуре и плотности. Их результаты основаны на экспериментальных исследованиях с использованием рентгеновских лучей и были опубликованы в Трудах Национальной академии наук (PNAS).
Большинство из нас знает, что вода необходима для нашего существования на планете Земля. Но куда менее известно, что у воды есть много странных свойств, которые являются аномальными и не свойственны для других жидкостей. Например, температура плавления, плотность, теплоемкость — в общей сложности есть около 70 свойств воды, отличающих ее от других жидкостей. Эти аномальные свойства, кстати, стали предпосылкой для появления известной нам жизни.
«Новое свойство примечательно тем, что, как выяснилось, вода может существовать в виде двух различных жидкостей при низких температурах, когда лед медленно кристаллизуется», говорит Андерс Нильссон, профессор химической физики в Стокгольмском университете. Прорыв в понимании воды стал возможным благодаря сочетанию исследований с применением рентгенографии в Аргоннской национальной лаборатории возле Чикаго, которая выявила две различные структуры, и большой рентгеновской лаборатории DESY в Гамбурге, где исследовалась динамика и демонстрировалось жидкое состояние обеих фаз. Вода действительно может быть двумя разными жидкостями.
«Крайне интересно использовать рентгеновские лучи для определения относительных позиций молекул в разное время», говорит Фивос Перакис, профессор Стокгольмского университета с опытом работы в области сверхбыстрой оптической спектроскопии. «Мы, в частности, смогли отследить трансформацию образца при низких температурах из одной фазы в другую и показали, что имеет место характерная для жидкостей диффузия».
Когда мы задумываемся о льде, чаще всего он представляется как упорядоченная кристаллическая фаза воды, будто из холодильника, но самой распространенной формой льда в нашей планетарной системе является аморфная, то есть неупорядоченная форма. И существует две формы аморфного льда с низкой и высокой плотностью. Эти две формы могут переходить одна в другую, и были предположения, что они могут быть связаны с формами жидкой воды низкой и высокой плотности. Проверить эту гипотезу экспериментально пытались давно, и стокгольмской группе это, наконец, удалось.

«Я изучала аморфные льды долгое время, пытаясь определить, можно ли рассматривать их как стекловидное состояние, представленное замороженной жидкостью», говорит Катрин Аманн-Винкель, исследователь в области химической физики в Стокгольмском университете. «Мечта становится реальностью, когда я получаю возможность в мельчайших подробностях наблюдать, как стекловидная форма воды превращается в вязкую жидкость, которая, в свою очередь, почти мгновенно превращается в другую, еще более вязкую жидкость с меньшей плотностью».
То, что вода продолжает нас удивлять, совершенно невероятно. Чем еще могут быть обусловлены ее странные свойства, помимо перехода между разными фазами?
«Новые результаты говорят о том, что вода при комнатной температуре не может определиться, в какой из двух форм ей быть, высокой или низкой плотности, что приводит к локальным колебаниям между двумя фазами», говорит Ларс Петтерссон, профессор теоретической химической физики в Стокгольмском университете. «Короче говоря: вода — это не одна сложная жидкость, а две простых жидкости со сложными отношениями».
Эти новые результаты не только создают общее представление о воде при различных температурах и давлениях, но и о том, как на нее влияют соль и биомолекулы, необходимые для жизни. Кроме того, чем больше мы узнаем о воде, тем лучше понимаем, как ее очищать и опреснять в будущем. Эту проблемы было бы хорошо решить на фоне надвигающегося глобального климатического кризиса.
hi-news.ru
характеристика, описание и свойства :: SYL.ru
Нужно помнить, что не все тела, которые существуют на планете Земля, имеют кристаллическое строение. Исключения из правила получили название «аморфные тела». Чем же они отличаются? Исходя из перевода данного термина – аморфный – можно предположить о том, что такие вещества отличаются от других своей формой или видом. Речь идет об отсутствии так называемой кристаллической решетки. Процесс расщепления, при котором появляются грани, не происходит. Аморфные тела также отличаются тем, что не зависят от окружающей среды, и их свойства постоянны. Такие вещества называются изотропными.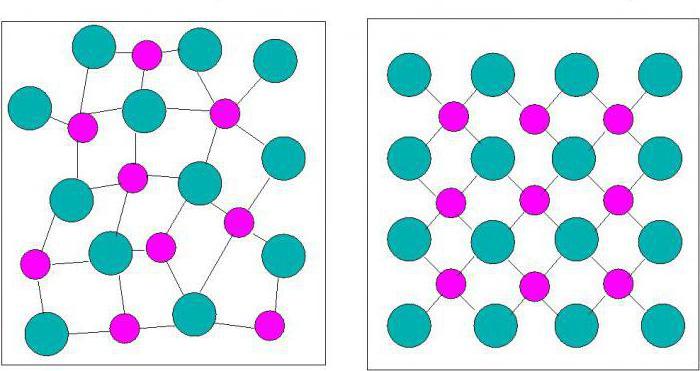
Небольшая характеристика аморфных тел
Из школьного курса физики можно вспомнить то, что аморфные вещества имеют такое строение, при котором атомы в них расположены в хаотичном порядке. Определенное место могут иметь лишь структуры-соседи, где такое расположение является вынужденным. Но все же проводя аналогию с кристаллами, аморфные тела не обладают строгой упорядоченностью молекул и атомов (в физике такое свойство получило название «дальний порядок»). В результате исследований было выяснено, что по своей структуре данные вещества схожи с жидкостями.
Некоторые тела (в качестве примера можно взять диоксид кремния, чья формула SiO2) могут одновременно находиться в аморфном состоянии и иметь кристаллическую структуру. Кварц в первом варианте обладает структурой неправильной решетки, во втором – правильного шестиугольника.
Свойство №1
Как уже говорилось выше, аморфные тела не обладают кристаллической решеткой. Их атомы и молекулы имеют ближний порядок размещения, что и будет первым отличительным свойством данных веществ.
Свойство №2
Текучестью данные тела обделены. Для того чтобы лучше объяснить второе свойство веществ, можно сделать это на примере воска. Ни для кого не секрет, что если налить воду в воронку, то она просто выльется из нее. То же самое будет и с любыми другими текучими веществами. А свойства аморфных тел не позволяют им проделывать такие «трюки». Если воск поместить в воронку, то он предварительно растечется по поверхности и лишь потом начнет стекать с нее. Это связано с тем, что молекулы в веществе перескакивают из одного положения равновесия в абсолютно другое, не имея основного местоположения.
Свойство №3
Пора поговорить о процессе плавления. Следует запомнить тот факт, что аморфные вещества не имеют определенной температуры, при которой начинается плавление. Во время поднятия градуса тело постепенно становится мягче и затем превращается в жидкость. Физики всегда делают упор не на температуре, при которой данный процесс начал происходить, а на соответствующем температурном интервале плавления.
Свойство №4
О нем уже было сказано выше. Аморфные тела изотропны. То есть их свойства в любом направлении неизменны, даже если условия пребывания в местах различны.
Свойство №5
Хоть раз каждый человек наблюдал, что с течением определенного промежутка времени стекла начинали мутнеть. Это свойство аморфных тел связно с повышенной внутренней энергией (она в разы больше, чем у кристаллов). Из-за этого данные вещества спокойно сами могут перейти в кристаллическое состояние.
Переход к кристаллическому состоянию
Спустя определенный промежуток времени любое аморфное тело переходит в кристаллическое состояние. Это можно наблюдать в привычной жизни человека. Например, если оставить леденец или мед на несколько месяцев, то можно заметить, что они оба потеряли свою прозрачность. Обычный человек скажет, что они просто засахарились. И правда, если разломать тело, то можно заметить наличие кристаллов сахара.
Итак, говоря об этом, необходимо уточнить, что самопроизвольное превращение в другое состояние связано с тем, что аморфные вещества неустойчивы. Сравнивая их с кристаллами, можно понять, что последние в разы «мощнее». Объяснить факт можно благодаря межмолекулярной теории. Согласно ей, молекулы постоянно перескакивают с одного места на другое, тем самым заполняя пустоты. Со временем образуется устойчивая кристаллическая решетка.
Плавление аморфных тел
Процессом плавления аморфных тел называется момент, когда с поднятием температуры все связи между атомами рушатся. Именно тогда вещество превращается в жидкость. Если условия плавления таковы, что давление одинаково на протяжении всего периода, то температура также должна быть фиксированной.
Жидкие кристаллы
В природе существуют тела, которые имеют жидкокристаллическую структуру. Как правило, они входят в перечень органических веществ, а их молекулы обладают нитевидной формой. Тела, о которых идет речь, обладают свойствами жидкостей и кристаллов, а именно текучестью и анизотропией.
В таких веществах молекулы располагаются параллельно друг другу, однако, между ними нефиксируемое расстояние. Они движутся постоянно, но ориентацию менять несклонны, поэтому постоянно находятся в одном положении.
Аморфные металлы
Аморфные металлы больше известны обычному человеку под названием металлические стекла.
Еще в 1940 году ученые заговорили о существовании данных тел. Уже тогда стало известно, что специально полученные вакуумным напылением металлы, не имели кристаллических решеток. И лишь через 20 лет было произведено первое стекло такого типа. Особого внимания у ученых оно не вызвало; и только спустя еще 10 лет о нем заговорили американские и японские профессионалы, а потом уже корейские и европейские.
Аморфные металлы отличаются вязкостью, достаточно высоким уровнем прочности и стойкостью к коррозии.
www.syl.ru
Аморфные тела
Аморфные тела (структура диоксида кремния)
Твердые тела разделяют на аморфные и кристаллические, в зависимости от их молекулярной структуры и физических свойств.
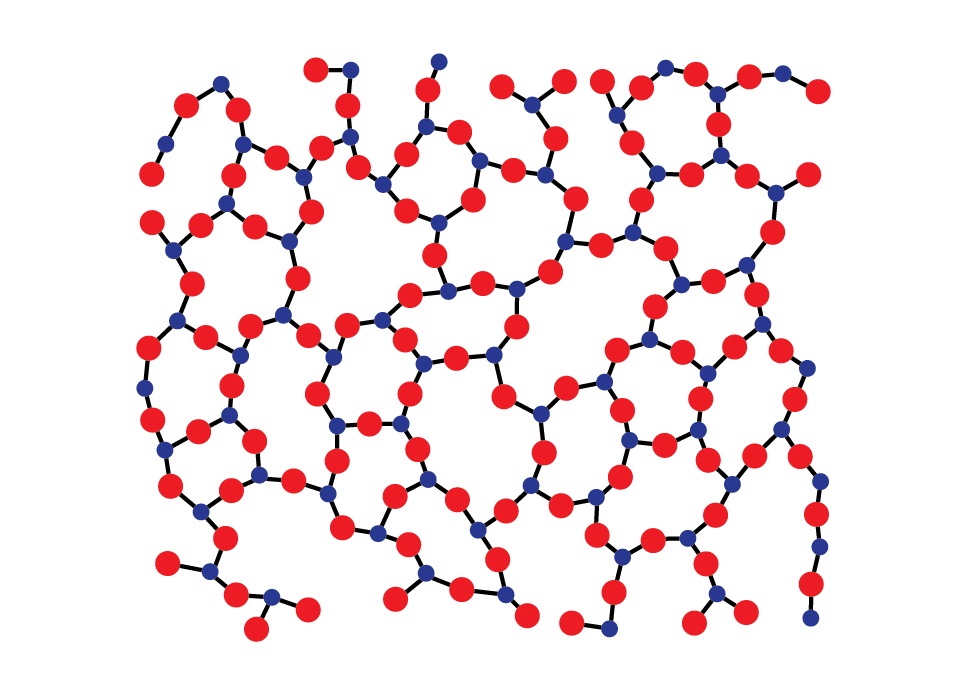
В отличие от кристаллов молекулы и атомы аморфных твердых тел не формируют решетку, а расстояние между ними колеблется в пределах некоторого интервала возможных расстояний. Иначе говоря, у кристаллов атомы или молекулы взаимно расположены таким образом, что формируемая структура может повторяться во всем объеме тела, что называется дальним порядком. В случае же с аморфными телами – сохраняется структура молекул лишь относительно каждой одной такой молекулы, наблюдается закономерность в распределении только соседних молекул – ближний порядок. Наглядный пример представлен ниже.
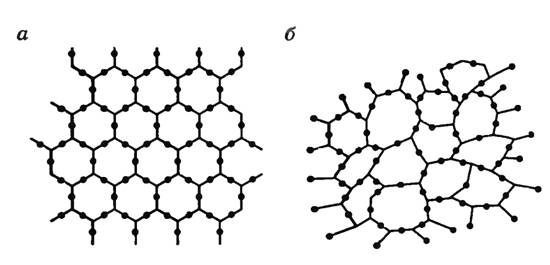
На рисунке слева (а) изображена решетка молекул кварца, а справа (б) расположение молекул кварцевого стекла, которое является аморфным телом.
К аморфным телам относится стекло и другие вещества в стеклообразном состоянии, канифоль, смолы, янтарь, сургуч, битум, воск, а также органические вещества: каучук, кожа, целлюлоза, полиэтилен и др.
Свойства аморфных тел
Особенность строения аморфных твердых тел придает им индивидуальные свойства:
- Слабо выраженная текучесть – одно из наиболее известных свойств таких тел. Примером будут потеки стекла, которое долгое время стоит в оконной раме.
- Аморфные твердые тела не обладают определенной температурой плавления, так как переход в состояние жидкости во время нагрева происходит постепенно, посредством размягчения тела. По этой причине к таким телам применяют так называемый температурный интервал размягчения.
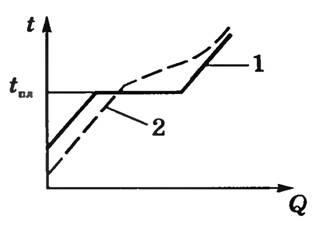
График перехода аморфного тела в жидкое состояние изображен пунктирной линией (2), а график перехода обычного твердого тела в жидкое состояние – сплошной (1).
- В силу своей структуры такие тела являются изотропными, то есть их физические свойства не зависят от выбора направления.
- Вещество в аморфном состоянии обладает большей внутренней энергией, нежели в кристаллическом. По этой причине аморфные тела способны самостоятельно переходить в кристаллическое состояние. Данное явление можно наблюдать как результат помутнения стекол с течением времени.
Стеклообразное состояние
В природе существуют жидкости, которые практически невозможно перевести в кристаллическое состояние посредством охлаждения, так как сложность молекул этих веществ не позволяет им образовать регулярную кристаллическую решетку. К таким жидкостям относятся молекулы некоторых органических полимеров.
Материалы по теме

Однако, при помощи глубокого и быстрого охлаждения, практически любое вещество способно перейти в стеклообразное состояние. Это такое аморфное состояние, которое не имеет явной кристаллической решетки, но может частично кристаллизироваться, в масштабах малых кластеров. Данное состояние вещества является метастабильным, то есть сохраняется при некоторых требуемых термодинамических условиях.
При помощи технологии охлаждения с определенной скоростью вещество не будет успевать кристаллизоваться, и преобразуется в стекло. То есть чем выше скорость охлаждения материала, тем меньше вероятность его кристаллизации. Так, например, для изготовления металлических стекол потребуется скорость охлаждения, равная 100 000 – 1 000 000 Кельвин в секунду.
В природе вещество существует в стеклообразном состоянии возникает из жидкой вулканической магмы, которая, взаимодействуя с холодной водой или воздухом, быстро охлаждается. В данном случае вещество зовется вулканическим стеклом. Также можно наблюдать стекло, образованная в результате плавления падающего метеорита, взаимодействующего с атмосферой – метеоритное стекло или молдавит.

Молдавит, естественное стекло, образованное ударом метеорита, из Беседин, Богемия, Чехия.
comments powered by HyperComments
Понравилась запись? Расскажи о ней друзьям!
Просмотров записи: 1255

spacegid.com

















