Алкины — номенклатура, получение, химические свойства. Алкин вода
Химические свойства алкинов. Строение, получение, применение
Алканы, алкены, алкины - это органические химические вещества. Все они построены из таких химических элементов, как карбон и гидроген. Алканы, алкены, алкины - это химические соединения, которые принадлежат к группе углеводородов.
В этой статье мы рассмотрим алкины.
Что это такое?
Эти вещества еще называются ацетиленовыми углеводородами. Строение алкинов предусматривает наличие в их молекулах атомов карбона и гидрогена. Общая формула ацетиленовых углеводородов такая: Cnh3n-2. Самым простый простой алкин - этин (ацетилен). Он обладает вот такой химической формулой - С2Н2. Также к алкинам относится пропин с формулой С3Н4. Кроме того, к ацетиленовым углеводородам можно отнести бутин (С4Н6), пентин (С5Н8), гексин (С6Н10), гептин (С7Н12), октин (С8Н14), нонин (С9Н16), децин (С10Н18) и т. д. Все виды алкинов обладают похожими характеристиками. Давайте рассмотрим их подробнее.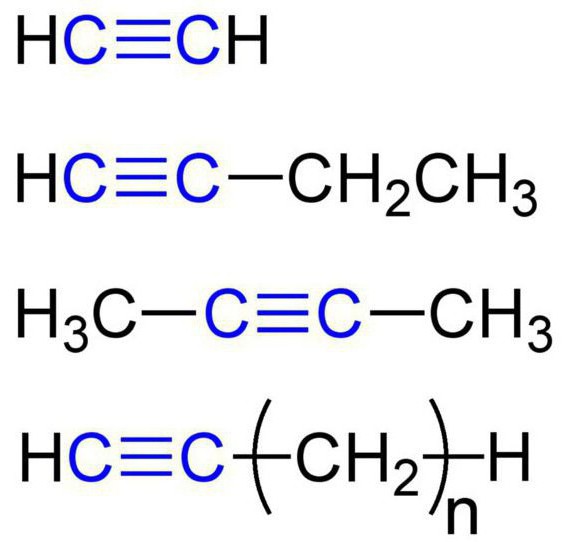
Физические свойства алкинов
По своим физическим характеристикам ацетиленовые углеводороды напоминают алкены.
В нормальных условиях алкины, в молекулах которых содержится от двух до четырех атомов карбона, обладают газообразным агрегатным состоянием. Те, в молекулах которых находится от пяти до 16 атомов карбона, при нормальных условиях жидкости. Те, в составе молекул которых от 17 и больше атомов этого химического элемента, - твердые вещества.
Плавятся и кипят алкины при более высокой температуре, чем алканы и алкены.
Растворимость в воде незначительная, но немного выше, чем у алкенов и алканов.
Растворимость в органических растворителях высокая.
Наиболее широко используемый алкин - ацетилен - обладает такими физическими свойствами:
- не имеет цвета;
- не имеет запаха;
- при нормальных условиях находится в газообразном агрегатном состоянии;
- обладает меньшей плотностью, чем воздух;
- температура кипения - минус 83,6 градусов Цельсия;
Химические свойства алкинов
В этих веществах атомы связаны тройной связью, чем и объясняются основные их свойства. Алкины вступают в реакции такого типа:
- гидрирование;
- гидрогалогенирование;
- галогенирование;
- гидратация;
- горение.
Давайте рассмотрим их по порядку.
Гидрирование
Химические свойства алкинов позволяют им вступать в реакции такого типа. Это вид химического взаимодействия, при котором молекула вещества присоединяет к себе дополнительные атомы водорода. Вот пример такой химической реакции в случае с пропином:
2Н2 + C3h5 = С3Н8
Эта реакция происходит в две стадии. На первой молекула пропина присоединяет два атома гидрогена и на второй - столько же.
Галогенирование
Это еще одна реакция, которая входит в химические свойства алкинов. В ее результате молекула ацетиленового углеводорода присоединяет атомы галогенов. К последним относятся такие элементы, как хлор, бром, иод и др.
Вот пример такой реакции в случае с этином:
С2Н2 + 2СІ2 = С2Н2СІ4
Такой же процесс возможен и с другими ацетиленовыми углеводородами.
Гидрогалогенирование
Это также одна из основных реакций, которая входит в химические свойства алкинов. Она заключается в том, что вещество взаимодействует с такими соединениями, как НСІ, НІ, HBr и др. Это химическое взаимодействие происходит в две стадии. Давайте рассмотрим реакцию такого типа на примере с этином:
С2Н2 + НСІ = С2Н3СІ
С2Н2СІ + НСІ = С2Н4СІ2
Гидратация
Это химическая реакция, которая заключается во взаимодействии с водой. Она тоже происходит в два этапа. Давайте рассмотрим ее на примере с этином:
h3O + С2Н2 = С2Н3ОН
Вещество, которое образуется после первого этапа реакции, называется виниловым спиртом.
В связи с тем, что согласно правилу Эльтекова функциональная группа ОН не может располагаться рядом с двойной связью, происходит перегруппировка атомов, в результате которой из винилового спирта образуется ацетальдегид.
Процесс гидратации алкинов еще называется реакцией Кучерова.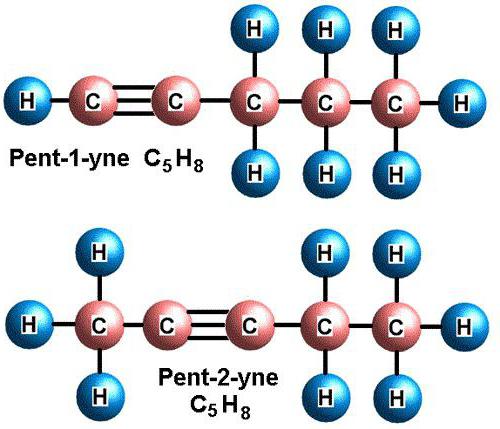
Горение
Это процесс взаимодействия алкинов с кислородом при высокой температуре. Рассмотрим горение веществ этой группы на примере с ацетиленом:
2С2Н2 +2О2 = 2Н2О + 3С + СО2
При избытке кислорода ацетилен и другие алкины горят без образования карбона. При этом выделяются только оксид карбона и вода. Вот уравнение такой реакции на примере с пропином:
4О2 + С3Н4 = 2Н2О + 3СО2
Горение других ацетиленовых углеводородов также происходит подобным образом. В результате выделяется вода и углекислый газ.
Другие реакции
Также ацетилены способны реагировать с солями таких металлов, как серебро, медь, кальций. При этом происходит замещение гидрогена атомами металла. Рассмотрим такой вид реакции на примере с ацетиленом и нитратом серебра:
С2Н2 + 2AgNO3 = Ag2C2 + 2Nh5NO3 + 2Н2О
Еще один интересный процесс с участием алкинов - реакция Зелинского. Это образование бензола из ацетилена при его нагревании до 600 градусов по Цельсию в присутствии активированного угля. Уравнение этой реакции можно выразить таким образом:
3С2Н2 = С6Н6
Также возможна полимеризация алкинов - процесс объединения нескольких молекул вещества в одну полимерную.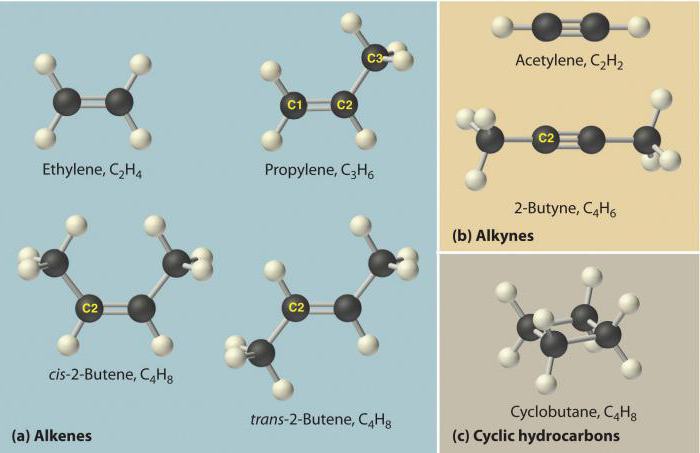
Получение
Алкины, реакции с которыми мы рассмотрели выше, получают в лаборатории несколькими методами.
Первый - это дегидрогалогенирование. Выглядит уравнение реакции таким образом:
C2h5Br2 + 2КОН = С2Н2 + 2Н2О + 2KBr
Для проведения такого процесса необходимо нагреть реагенты, а также добавить этанол в качестве катализатора.
Также есть возможность получения алкинов из неорганических соединений. Вот пример:
СаС2 + Н2О = С2Н2 + 2Са(ОН)2
Следующий метод получения алкинов - дегидрирование. Вот пример такой реакции:
2СН4 = 3Н2 + С2Н2
С помощью реакции подобного типа можно получить не только этин, но и другие ацетиленовые углеводороды.
Применение алкинов
Наибольшее распространение в промышленности получил самый простой алкин - этин. Он широко используется в химической отрасли.
- Нужен ацетилен и другие алкины для получения из них других органических соединений, таких как кетоны, альдегиды, растворители и др.
- Также из алкинов можно получить вещества, которые используются при производстве каучуков, поливинилхлорида и др.
- Из пропина можно получить ацетон в результате ракции Кучерова.
- Кроме того, ацетилен используется при получении таких химических веществ, как уксусная кислота, ароматические углеводороды, этиловый спирт.
- Еще ацетилен применяется в качестве топлива с очень высокой теплотой горения.
- Также реакция горения этина используется для сваривания металлов.
- Кроме того, с использованием ацетилена можно получить технический карбон.
- Также это вещество применяется в автономных светильниках.
- Ацетилен и ряд других углеводородов этой группы используются в качестве ракетного топлива благодаря своей высокой теплоте горения.
На этом применение алкинов заканчивается.
Заключение
В качестве завершающей части приводим краткую таблицу о свойствах ацетиленовых углеводородов и их получении.
| Название реакции | Пояснения | Пример уравнения |
| Галогенирование | Реакция присоединения молекулой ацетиленового углеводорода атомов галогенов (брома, иода, хлора и др.) | C4H6 + 2I2 = С4Н6І2 |
| Гидрирование | Реакция присоединения молекулой алкина атомов водорода. Происходит в две стадии. | C3h5 + Н2 = С3Н6 C3H6 + Н2 = С3Н8 |
| Гидрогалогенирование | Реакция присоединения молекулой ацетиленового углеводорода гидрогалогенов (НІ, НСІ, HBr). Происходит в две стадии. | C2h3 + НІ = С2Н3І С2Н3І + НІ = C2h5I2 |
| Гидратация | Реакция, в основе которой лежит взаимодействие с водой. Происходит в две стадии. | С2Н2 + h3O = С2Н3ОН C2h4OH = СН3-СНО |
| Полное окисление (горение) | Взаимодействие ацетиленовго углеводорода с кислородом при повышенной температуре. В результате образуется оксид карбона и вода. | 2C2H5 + 5О2 = 2Н2О + 4CO2 2С2Н2 + 2О2 = Н2О + CO2 + 3С |
| Реакции с солями металлов | Заключаются в том, что атомы металлов замещают атомы гидрогена в молекулах ацетиленовых углеводородов. | С2Н2 + AgNO3 = C2Ag2 + 2Nh5NO3 + 2Н2О |
Получить алкины можно в лабораторных условиях тремя методами:
- из неорганических соединений;
- путем дегидрирования органических веществ;
- способом дегидрогалогенирования органических веществ.
Вот мы и рассмотрели все физические и химические характеристики алкинов, способы их получения, области применения в промышленности.
fb.ru
Химические свойства алкинов - Абросимова Елена Владимировна учитель химии и биологии
Физические свойства. Температуры кипения и плавления ацетиленовых углеводородов увеличиваются с ростом их молекулярной массы. При обычных условиях алкины С2Н2-С4Н6 – газы, С5Н8-С16Н30 – жидкости, с С17Н32 – твердые вещества. Температуры кипения и плавления алкинов выше, чем у соответствующих алкенов (табл.6.4.1).
Алкины плохо растворимы в воде, лучше – в органических растворителях.
Химические свойства алкинов сходны с алкенами, что обусловлено их ненасыщенностью.Характеристики связей в алкинах:
Некоторые отличия в свойствах алкинов и алканов определяются следующими факторами.
I. Реакции присоединения к алкинам
1. Гидрирование
В присутствии металлических катализаторов (Pt, Ni) алкины присоединяют водород с образованием алкенов (разрывается первая
p-связь), а затем алканов (разрывается вторая p-связь):

При использовании менее активного катализатора[Pd/CaCO3/Pb(Ch4COO)2] гидрирование останавливается на стадии образования алкенов.
2. Галогенирование
Электрофильное присоединение галогенов к алкинам протекает медленнее, чем для алкенов (первая p-связь разрывается труднее, чем вторая):

Алкины обесцвечивают бромную воду (качественная реакция).
3. Гидрогалогенирование
Присоединение галогеноводородов также идет по электрофильному механизму. Продукты присоединения к несимметричным алкинам определяются правилом Марковникова:

Гидрохлорирование ацетилена используется в одном из промышленных способов получения винилхлорида:

Винилхлорид является исходным веществом (мономером) в производстве поливинилхлорида (ПВХ).
4. Гидратация (реакция Кучерова)
Присоединение воды происходит в присутствии катализатора соли ртути (II) и идет через образование неустойчивого непредельного спирта, который изомеризуется в уксусный альдегид (в случае ацетилена):
 или в кетон (в случае других алкинов):
или в кетон (в случае других алкинов):
5. Полимеризация
1. Димеризация под действием водно-аммиачного раствора CuCl:

2. Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского):


Возможно образование молекул, содержащих большее число звеньев ацетилена, как циклического, так и линейного строения
… -СН=СН-СН=СН-СН=СН-…(такие полимеры обладают полупроводниковыми свойствами).
Следует также отметить, что высокомолекулярное вещество – карбин (третья аллотропная модификация углерода) – образуется не в результате полимеризации ацетилена, а при окислительной поликонденсации ацетилена в присутствии CuCl:

II. Образование солей
Ацетилен и его гомологи с концевой тройной связью  (алкины-1) вследствие полярности связи С(sp)-Н проявляют слабые кислотные свойства: атомы водорода могут замещаться атомами металла. При этом образуются соли – ацетилениды :
(алкины-1) вследствие полярности связи С(sp)-Н проявляют слабые кислотные свойства: атомы водорода могут замещаться атомами металла. При этом образуются соли – ацетилениды :
 Ацетилениды щелочных и щелочноземельных металлов используются для получения гомологов ацетилена (раздел 6.5).
Ацетилениды щелочных и щелочноземельных металлов используются для получения гомологов ацетилена (раздел 6.5).При взаимодействии ацетилена (или  ) с аммиачными растворами оксида серебра или хлорида меди (I) выпадают осадки нерастворимых ацетиленидов:
) с аммиачными растворами оксида серебра или хлорида меди (I) выпадают осадки нерастворимых ацетиленидов:
 Образование белого осадка ацетиленида серебра (или красно-коричневого – ацетиленида меди
Образование белого осадка ацетиленида серебра (или красно-коричневого – ацетиленида меди  ) служит качественной реакциейна концевую тройную связь.Ацетилениды разлагаются при действии кислот:
) служит качественной реакциейна концевую тройную связь.Ацетилениды разлагаются при действии кислот: В сухом состоянии ацетилениды тяжелых металлов чувствительны к ударам и легко взрываются.
В сухом состоянии ацетилениды тяжелых металлов чувствительны к ударам и легко взрываются.Если тройная связь находится не на конце цепи, то кислотные свойства отсутствуют (нет подвижного атома водорода) и ацетилениды не образуются:

III. Окисление алкинов
Ацетилен и его гомологи окисляются перманганатом калия с расщеплением тройной связи и образованием карбоновых кислот:

Алкины обесцвечивают раствор KMnO4, что используется для их качественного определения.
При сгорании (полном окислении) ацетилена выделяется большое количества тепла:

Температура ацетиленово-кислородного пламени достигает 2800- 3000°С. На этом основано применение ацетилена для сварки и резки металла. Ацетилен образует с воздухом и кислородом взрывоопасные смеси. В сжатом, и особенно в сжиженном, состоянии он способен взрываться от удара. Поэтому ацетилен хранится в стальных баллонах в виде растворов в ацетоне, которым пропитывают асбест или кизельгур.
Окисление ацетилена и его гомологов протекает в зависимости от того, в какой среде протекает процесс.
а) В кислой среде процесс окисления сопровождается образованием карбоновых кислот:


В нейтральной и слабощелочной средах окисление ацетилена сопровождается образованием соответствующих оксалатов (солей щавелевой кислоты), а окисление гомологов – разрывом тройной связи и образованием солей карбоновых кислот:

Для ацетилена:
1) В кислой среде:
sites.google.com
Свойства алкинов | Дистанционные уроки
01-Дек-2012 | комментария 2 | Лолита Окольнова
Это вещества еще с меньшим количеством углерода, чем у алканов и алкенов. Тройная связь определяет и строение молекул, и общую формулу, и химические свойства алкинов.
Для атомов тройной связи характерна Sp-гибридизация. Т.е. тройная связь — это комбинация одной σ- и двух Π-связей:

молекулы линейные
Общая формула:

n = числу атомов углерода.
Название углеводородов строятся из двух частей.
Первая часть «говорит» о количестве атомов углерода, вторая — о тройной связи. У алкинов вторая часть — всегда -ин.
По правилам номенклатуры ИЮПАК:
- в качестве основной цепи выбирается та, в которой находится тройная связь, не зависимо от ее размера,
- нумерация идет с того конца, к которому ближе тройная связь
- после окончания -ин ставится номер атома, после которого идет тройная связь.
Изомерия
Соответственно, для алкинов характерны 2 вида изомерии:
- Структурная — изомерия положения тройной связи и изомерия радикалов
- Межклассовая — алкины изомерны акладиенам.
Химические свойства алкинов:
1. Тройная связь, как и двойная, все присоединяет, разрывается, образует двойную связь, если реагент дан в избытке, то реакция может идти до образования одинарной связи:
- галогенирование,
- гидрогалогенирование,
- гидрирование:

2. Гидратация — взаимодействие с водой — реакция Кучерова:

3. Качественные реакции алкинов:
Ацетилениды серебра и меди (I) легко образуются и выпадают в осадок при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди (I). Эта реакция служит для обнаружения алкинов с тройной связью на конце цепи:

4. Реакции окисления:
Алкины окисляются различными окислителями, в частности перманганатом калия. При этом раствор перманганата калия обесцвечивается, что служит указанием на наличие тройной связи. При окислении обычно происходит расщепление тройной связи и образуются карбоновые кислоты, перманганат восстанавливается до Mn(2+) — в кислой среде, MnO2 — в щелочной:
С4H6 + [O] → 2Ch4COOH
5. Реакции горения: как и все органические вещества, алкины сгорают с образованием углекислого газа и воды:
Сnh3n-2 + (3n-1)\2 O2 → nCO2 + (n-1) h3O
Здесь записано уравнение в общем виде, т.к. во многих задачах требуется определить состав углеводорода — в таких случаях любые реакции лучше записывать в таком — общем виде.
Получение алкинов:
- Из неорганических соединений: CaC2 + 2h3O → Ca(OH)2 + C2h3
- дегидрогалогенирование: Сh4-СHBr2 +2KOH (этанол, t) →C2h3 + 2KBr + 2h3O
Пример олимпиадного вопроса (2015 г)

Общая формула Сnh3n-2, что соответствует либо алкинам, либо алкадиенам
Структурные изомеры алкинов:
- СH≡С-Сh3-Сh4 бутин-1;
- Ch4-C≡C-Ch4 бутин-2;
Межклассовые — алкадиены:
- Сh3=СH-СH=Сh3 — бутадиен-1,3
- Ch3=C=CH-Ch4 — бутадиен-1,2
- в ЕГЭ это вопрос А13 и А14 — Строение и свойства углеводородов
- в ГИА (ОГЭ) это B2 — Первоначальные сведения об органических веществах: предельных и непредельных углеводородах
Категории: |
Обсуждение: "Свойства алкинов"
(Правила комментирования)distant-lessons.ru
Физические и химические свойства алкинов
Общая формула алкинов Cnh3n-2
Таблица 1. Гомологический ряд алкинов.
|
Этин (ацетилен) |
C2h3 (СH≡CH) |
|
Пропин (метилацетилен) |
C3h5 (СH≡C-Ch4) |
|
Бутин |
C4H6 |
|
Пентин |
C5H8 |
|
Гексин |
C6h20 |
|
Гептин |
C7h22 |
|
Октин |
C8h24 |
|
Нонин |
C9h26 |
|
Декин |
C10h28 |
Чтобы дать название алкину необходимо выбрать самую длинную углеводородную цепь, содержащую тройную связь. Нумерация цепи начинается с того края, ближе к которому находится тройная связь.
Атомы углерода тройной связи в молекулах алкинов находятся в sp-гибридизации: две σ-связи располагаются на одной линии под углом 180 С друг к другу, две π-связи образованы p-электронами соседних атомов углерода и располагаются во взаимно перпендикулярных плоскостях. Тройная связь является сочетанием одной σ- и двух π-связей.
С друг к другу, две π-связи образованы p-электронами соседних атомов углерода и располагаются во взаимно перпендикулярных плоскостях. Тройная связь является сочетанием одной σ- и двух π-связей.
Для алкинов, начиная с пентина, характерна изомерия углеродного скелета:
CH≡C-Ch3-Ch3-Ch4 (пентин-1)
CH≡C-CH(Ch4)-Ch4 (3-метилбутин1)
начиная с бутина, для всех алкинов характерна изомерия положения тройной связи:
CH≡C-Ch3-Ch4 (бутин-1)
Ch4-C≡C-Ch4 (бутин-2)
Для алкинов характерна межклассовая изомерия с алкадиенами, так веществу с составом C4H6, соответствует три разных вещества – бутин-1, бутин-2 и бутадиен-1,3.
Химические свойства алкинов
Для алкинов характерны реакции присоединения, протекающие по нуклеофильному механизму, такие как:
— гидрирование – присоединение воды в присутствии 18%-й серной кислоты, сульфата ртути (II) и нагревании до 90 С (реакция Кучерова), в результате чего образуются альдегиды
С (реакция Кучерова), в результате чего образуются альдегиды
СH≡CH +h3O → [Ch3 = CH-OH] → Ch4-CH = O
— галогенирование – присоединение галогенов, протекающее в две стадии
СH≡CH +Br2 →CHBr = CHBr + Br2 →CHBr2-CHBr2
— гидрогалогенирование – присоединение галогеноводородов, также, протекающее в две стадии и присоединение второй молекулы галогеноводорода протекает по правилу Марковникова (присоединение галогеноводородов к тройной связи протекает труднее, чем к двойной)
СH≡CH +HСl → Ch3 = CHCl + HCl → Ch4-CHCl2
Для алкинов, имеющий концевую тройную связь, характерно наличие слабых кислотных свойств. Такие алкины способны образовывать соли при взаимодействии с активными металлами:
2R-C≡C-H +2Na →2R-C≡C-Na + h3
Ацетилинид серебра легко образуется и выпадает в осадок при пропускании ацетилена через аммиачный раствор оксида серебра:
СH≡CH + Ag2O → Ag- С≡C-Ag↓ + h3O
Ацетилен способен тримеризоваться – при пропускании ацетилена над активированным углем при 600 С образуется бензол:
С образуется бензол:
3C2h3 → C6H6
Для алкинов характерны реакции окисления и восстановления. Так, алкины легко окисляются перманганатом калия. В результате этой реакции образуются карбоновые кислоты:
R- С≡C-R’ +[O] +h3O → R-COOH + R’-COOH
В присутствии металлических катализаторов алкины присоединяют молекулы водорода:
Ch4-C≡CH + h3 → Ch4-CH = Ch3 + h3 → Ch4-Ch3-Ch4
Качественными реакциями на тройную связь являются реакции обесцвечивания раствора бромной воды и перманганата калия, а также реакция с аммиачным раствором оксида серебра в случае концевого положения тройной связи.
Физические свойства алкинов
При обычных условиях C2-С4 – газы, С5-С16 – жидкости, начиная с С18 – твердые вещества. Температуры алкинов выше, чем у соответствующих алкенов.
Получение алкинов
Для получения алкинов чаще всего используют:
— реакции дегидрирования алканов и алкенов
Ch4-Ch4 → СH≡CH +2h3;
Ch3 = Ch3 → СH≡CH +h3.
— реакции элиминирования дигалогенпроизводных
(Ch4)3-CCl2-Ch4 +2KOH →(Ch4)3-C≡CH + 2KCl + 2h3O.
— реакции ацетиленидов с первичными галогеналканами
СH≡CNa + Ch4-Ch3-Ch3-Br →СH≡C-(Ch3)3-Ch4 + NaBr.
Примеры решения задач
ru.solverbook.com
Непредельные углеводороды. Алкины
Строение алкинов
Первым и основным представителем гомологического ряда алкинов является ацетилен (этин) С2Н2. Строение его молекулы выражается формулами:
структурная формула
Н - С ≡ С - Н
или
электронная формула
Н:С:::С:Н
По названию первого представителя этого ряда - ацетилена - эти непредельные углеводороды называют ацетиленовыми.
В алкинах атомы углерода находятся в третьем валентном состоянии (sp-гибридизация). В этом случае между углеродными атомами возникает тройная связь, состоящая из одной σ - и двух π -связей. Длина тройной связи равна 0,12 нм, а энергия ее образования составляет 830 кДж/моль.
Номенклатура
Простейшим алкином является этин (ацетилен С2Н2). По номенклатуре IUPAC названия алкинов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ин»; положение тройной связи указывается арабской цифрой.
Углеводородные радикалы, образованные от алкинов имеют суффикс «-инил», так CH-C- называется «этинил».
Гомологический ряд
Этин:C2h3 Пропин: C3h5 Бутин: C4H6 Пентин: C5H8 Гексин: C6h20 Гептин: C7h22 Октин: C8h24 Нонин: C9h26 Децин: C10h28
Изомерия
Изомерия алкиновых углеводородов (как и алкеновых) определяется строением цепи и положением в ней кратной (тройной) связи:
(такая же как у алканов и алкенов)
 З-метилбутин-1
З-метилбутин-1
Н - С ≡ С - СН2 - СН2 - СН3 пентин-1
Н3С - С ≡ С - СН2 - СН3 пентин-2
Алкины являются изомерами с алкадиенами.

Физические свойства алкинов
Алкины по своим физическим свойствам напоминают соответствующие алкены. Низшие (до С4) - газы без цвета и запаха, имеющие более высокие температуры кипения, чем аналоги в алкенах. Алкины плохо растворимы в воде, лучше - в органических растворителях.

Плохо растворимы в воде.
Химические свойства
Химические свойства алкинов определяются тройной связью, особенностями ее строения. Алкины способны вступать в реакции присоединения, замещения, полимеризации и окисления.
Будучи непредельными соединениями, алкины вступают в первую очередь в реакции присоединения. Эти реакции протекают ступенчато: с присоединением одной молекулы реагента тройная связь вначале переходит в двойную, а затем, по мере дальнейшего присоединения, - в одинарную.

Казалось бы, алкины, обладая двумя π-связями, гораздо активнее должны вступать в реакции электрофильного присоединения. Но это не совсем так. Углеродные атомы в молекулах алкинов расположены ближе друг к другу, чем в алкенах, и обладают большей электроотрицательностью. Это связано с тем, что электроотрицательность атома углерода зависит от его валентного состояния. Поэтому p-электроны, находясь ближе к ядрам углерода, проявляют несколько меньшую активность в реакциях электрофильного присоединения. Кроме того, сказывается, близость положительно заряженных ядер атомов, способных отталкивать приближающиеся электрофильные реагенты (катионы). В то же время алкины могут вступать в реакции нуклеофильиого присоединения (со спиртами, аммиаком и др.).
Реакция протекает в тех же условиях, что и в случае алкенов (катализаторы Pt, Pd, Ni). При восстановлении алкинов вначале образуются алкены, а затем - алканы:
HC ≡ CH + h3 → h3C = Ch3 + h3 → h4C—Ch4
ацетилен → этилен → этан
Эта реакция протекает с меньшей скоростью, чем в ряду этиленовых углеводородов. Реакция также проходит ступенчато:
HC ≡ CH + Br2 → CHBr = CHBr + Br2 → CHBr2 - CHBr2
ацетилен → 1,2-дибромэтан → 1,1,2,2-тетрабромэтан
Качественная реакция; бромная вода обесцвечивается.
Реакции присоединения галогеноводородов, как и галогенов, идут в основном по механизму электрофильного присоединения:
HC ≡ CH + HCl → h3C = CHCl → h4C - CHCl2
ацетилен → хлорэтен → 1,1-дихлорэтан
Вторая молекула галогеноводорода присоединяется в соответствии с правилом Марковникова.
Образуется ацетальдегид в случае С2Н2 и кетоны - в случае гомологов ацетилена.
Катализатор - соль ртути: HgSO4

HC ≡ CH + HCN кат.→ h3C = CH - CN (акрилонитрил)
Акрилонитрил - ценный продукт. Он используется в качестве мономера для получения синтетического волокна - нитрон.
В результате этой реакции образуются простые виниловые эфиры (реакция А. Е.Фаворского):
HC ≡ CH + HO - C2H5KOH→ h3C = CH - O - C2H5 (этилвиниловый эфир)
Присоединение спиртов в присутствии алкоголятов - типичная реакция нуклеофильного присоединения.
Водородные атомы в ацетилене способны замещаться на металлы (реакция металлирования). В результате образуются металлические производные ацетилена - ацетилениды. Такую способность ацетилена можно объяснить следующим образом. Углеродные атомы ацетилена, находясь в состоянии sp-гибридизации, отличаются, как известно, повышенной электроотрицательностью (по сравнению с углеродами в других гибридных состояниях). Поэтому электронная плотность связи С-H несколько смещена в сторону углерода и атом водорода приобретает некоторую подвижность:
d+ d- d- d+
H→C≡C←H
Образуются нерастворимые соли - ацетилениды. Возможны только для алкинов, содержащих этинильную группу -С=СН (т. н. терминальные алкины).
HC ≡ CH + 2CuCl → Cu - C ≡ C - Cu↓ + HCl
этин → ацетиленид меди(I) двузамещенный
Ch4 - C ≡ CH + CuCl → Ch4 - C ≡ C- Cu↓ + HCl
пропин → метилацетиленид меди (I)
Образование темно-красных осадков ацетиленидов меди - качественная реакция на этинильную группу, позволяющая отличить терминальные алкины от других непредельных углеводородов.


С ацетиленидами в сухом виде следует обращаться очень осторожно: они крайне взрывоопасны.
Ацетиленовые углеводороды, как алканы и алкены, способны к изомеризации с перемещением тройной связи:
Н3С - СН2- С ≡ СН Na(спирт р-р)→ Н3С - С ≡ С - СН3
бутин-1 → бутин-2

Из винилацетилена присоединением HCl получают хлоропрен, при полимеризации которого образуется хлоропреновый каучук:



Полимеризация для алкинов малохарактерна.

Ацетилены легко окисляются. При этом происходит разрыв молекулы по месту тройной связи. Если ацетилен пропускать через окислитель (водный раствор перманганата калия), то раствор быстро обесцвечивается. Эта реакция является качественной на кратные (двойные и тройные) связи:
3НC ≡ СН + 10KMnO4 + 2h3O → 6CO2 + 10КОН + 10MnO2
Ацетилен горит коптящим пламенем.
При полном сгорании ацетилена на воздухе образуются два продукта оксид углерода (IV) и вода:
2НС ≡ СН + 5O2 → 4СO2 + 2Н2O
При неполном сгорании образуется углерод (сажа):
НС ≡ СН + O2 → С + СО + Н2О
Способы получения
Ацетилен в промышленности и в лаборатории можно получать следующими способами:
Разложением водой карбида кальция СаС2, который получают спеканием негашеной извести СаО с коксом:
СаО + 3C 2500°C→ CaC2 + CO
СаС2 + 2Н2O → НС ≡ СН + Са(ОН)2
2СН41500°C→ НС ≡ СН + 3Н2
или этана:
С2Н61200°C→ НС ≡ СН + 2Н2
Из дигапогеналканов, содержащих атомы галогена у двух соседних атомов углерода, например:

Из дигалогеналканов, содержащих два атома галогена у одного атома углерода, например:

Качественные реакции
Качественной реакцией на алкины с концевой тройной связью является взаимодействие с аммиакатом серебра или меди.
Для подтверждения наличия тройной связи в соединении используют методы спектроскопии.
Применение
Из всех ацетиленовых углеводородов серьёзное промышленное значение имеет только ацетилен, который является важнейшим химическим сырьём. Его применяют:
- для сварки и резки металлов;

- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды;
- в производстве взрывчатых веществ ацетиленидов (соли ацетилена и его производных, в котором один или два атома водорода замещены атомами элементов, более электроположительных, чем углерод;
Ацетилениды тяжелых металлов обладают значительной химической неустойчивостью, при незначительных внешних воздействиях (удар, трение) разлагаются со взрывом. Наиболее известны как инициирующие взрывчатые вещества (ВВ) ацетилениды серебра Ag2C2 и меди Cu2C2. Также следует отметить сильнейшие взрывчатые способности ацетеленида ртути. Очень сильными взрывчатыми свойствами обладает ацетеленид золота.
- для получения уксусной кислоты, этилового спирта;
- для получения растворителей - индивидуальное химическое соединение или их смесь, способная растворять различные вещества, то есть образовывать с ними однородные системы переменного состава двух или большего числа компонентов;

- для получения пластических масс - органические материалы, основой которых являются синтетические или природные высокомолекулярные соединения (полимеры). Исключительно широкое применение получили пластмассы на основе синтетических полимеров.
Название «пластмассы» означает, что эти материалы под действием нагревания и давления способны формироваться и сохранять после охлаждения или отвердения заданную форму. Процесс формования сопровождается переходом пластически деформируемого (вязкотекучего) состояния в стеклообразное состояние.

- для получения каучука - натуральные или синтетические эластомеры, характеризующиеся эластичностью, водонепроницаемостью и электроизоляционными свойствами, из которых путём вулканизации получают резины и эбониты.

Нахождение в природе и физиологическая роль алкинов
В природе алкины практически не встречаются. В некоторых видах грибов Basidiomycetes были обнаружены в крайне малом количестве соединения содержащие полиацетиленовые структуры.
Ацетилен обнаружен в атмосфере Урана, Юпитера и Сатурна.
Алкины обладают слабым наркозным действием. Жидкие алкины вызывают судороги.
examchemistry.com
Получение. Свойства - HimHelp.ru
Физические свойства алкинов похожи на свойства алканов и алкенов. При обычных условиях (С2 – С4) — газы, (C5 – C16) — жидкости, начиная с C17 — твердые вещества. Температуры кипения алкинов выше, чем у соответствующих алкенов. Так, этилен имеет tкип = -103 °С, ацетилен кипит при -83,6 °С; пропен и пропин соответственно при -47 °С и -23 °С.
Растворимость низших алкинов в воде несколько выше, чем алкенов и алканов, однако она все же очень мала. Алкины хорошо растворимы в неполярных органических растворителях.
Получение. 1. Общий способ получения алкинов — отщепление двух молекул галогеноводорода от дигалогеналканов, которые содержат два атома галогена либо у соседних, либо у одного атома углерода, под действием спиртового раствора щелочи.
| С2Н5ОН | ||
| СН2Вr — СН2Вr + 2КОН | → | НС ≡ СН + 2КВr + 2Н2О, |
| С2Н5ОН | |||
| СН3 — СВr2 — СН3 + 2КОН | → | СН3-С ≡ СН + 2КВr + 2Н2О, |
2. Гомологи ацетилена можно также получать, действуя галогеналканами на соли ацетиленовых углеводородов (ацетилениды):
Ch4 — C ≡ CNa + I-R → CHg — C ≡ C-R + NaI.
Эта реакция представляет собой пример нуклеофильного замещения, а нуклеофилом в ней является ацетиленидный карбанион
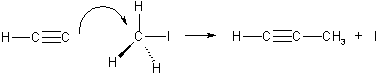
3. Ацетилен получают в промышленности путем высокотемпературного крекинга метана:
| 1500°С | ||
| 2СН4 | → | CH ≡ NCH + ЗН2 |
или его ближайших гомологов — этана и пропана, причем в этом случае ацетилен образуется при более низких температурах:
| 1200°С | 1200°С | ||||
| C2Hg | → | C2Hg + 2Н2, | 2С3Н8 | → | ЗС2Н2 + 5Н2 |
Сырьем в этих способах служит природный газ или нефть.
В лабораторных условиях ацетилен получают гидролизом карбида кальция:
СаС2 + 2Н2О = Са(ОН)2 + С2Н2 ↑
Химические свойства алкинов обусловлены наличием в их молекулах тройной связи. Типичными реакциями для ацетилена и его гомологов являются реакции электрофильного присоединения АE. Отличие алкинов от алкенов заключается в том, что реакции присоединения могут протекать в две стадии. На первой стадии идет присоединение к тройной связи с образованием двойной связи, а на второй стадии — присоединение к двойной связи. Реакции присоединения для алкинов протекают медленнее, чем для алкенов. Это объясняется тем, что p-электронная плотность тройной связи расположена более компактно, чем в алкенах, и поэтому менее доступна для взаимодействия с различными реагентами.
1. Галогенирование. Галогены присоединяются к алкинам в две стадии. Например, присоединение брома к ацетилену приводит к образованию дибромэтена, который, в свою очередь, реагирует с избытком брома с образованием тетрабромэтана:
| Вr2 | Вr2 | |||
| СН ≡ СН | → | СНВr = СНВr | → | СНВr 2— СНВr2 |
Алкины, так же, как и алкены, обесцвечивают бромную виду.
2. Гидрогалогенирование. Галогеноводороды присоединяются к тройной связи труднее, чем к двойной. Для активации галогеноводорода используют АlСl3 — сильную кислоту Льюиса. Из ацетилена при этом можно получить винилхлорид (хлорэтен), который используется для получения важного полимера поливинилхлорида.
| АlСl3 | ||
| СН ≡ СН + HCI | → | СН2 = СНСl |
В случае избытка галогеноводорода происходит полное гидрогалогенирование, причем для несимметричных алкинов на каждой стадии присоединение идет по правилу Марковникова, например:
| Аl Вr3 | ||
| СН3 — С ≡ СН + 2НВr | → | СН3 — СВr2 — СН3 . |
3. Гидратация. Присоединение воды к алкинам катализируется солями ртути (II)’
| Hg2+. H+ | ||||||
| CH | ≡ | СН + Н2О | → | [СН2 = СН — ОН] | ≡ | СН3 – СН = О |
На первой стадии реакции образуется непредельный спирт, в котором гидроксильная группа находится непосредственно у атома углерода при двойной связи. Такие спирты принято называть виниловыми или енолами.
Отличительной чертой енолов является их неустойчивость. В момент образования они изомеризуются в более стабильные карбонильные соединения (альдегиды или кетоны) за счет переноса протона от гидроксильной группы к соседнему атому углерода при двойной связи. При этом p-связь между атомами углерода разрывается, и образуется p-связь между атомом углерода и атомом кислорода. Причиной изомеризации является большая прочность двойной связи С = О по сравнению с двойной связью С = С.
В результате реакции гидратации только ацетилен превращается в альдегид; гидратация гомологов ацетилена протекает по правилу Марковникова;, и образующиеся енолы изомеризуются в кетоны. Так, например, пропин превращается в ацетон:
| Hg2+ | ||
| СН3 – СН ≡ СН + Н2О | → | [СН3 — С(ОН) = СН2] → СН3 – СО — СН3. |
Реакция гидратации алкинов была открыта М.Г. Кучеровым (1881 г.) и носит название реакции Кучерова.
4. Кислотные свойства. Особенностью алкинов, имеющих концевую тройную связь, является их способность отщеплять протон под действием сильных оснований, т.е. проявлять слабые кислотные свойства. Возможность отщепления протона обусловлена сильной поляризацией s-связи: ≡ С← Н. Причиной поляризации является высокая электроотрицательность атома углерода в sp-гибридном состоянии. Поэтому алкины, в отличие от алкенов и алканов, способны образовывать соли, называемые ацетиленидами:
R — C ≡ C—H + NaH → R—C ≡ C — Na + Н2
Ацетилениды серебра и меди (I) легко образуются и выпадают в осадок при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди (I). Эти реакции служат для обнаружения алкинов с тройной связью на конце цепи.
| НС ≡ СН + 2[Ag(Nh4)2]OH → Ag—C ≡ C—Ag | ↓ | + 2Nh4 + Н2O |
| белый осадок |
| R-C ≡ CH + [Cu(Nh4)2]Cl → R—C ≡ C— Cu | ↓ | + Nh5Cl + Nh4. |
| красный осадок |
Ацетилениды серебра и меди как соли очень слабых кислот легко разлагаются при действии хлороводородной кислоты с выделением исходного алкина:
R-C = C-Cu + HCl → R-C = CH + CuCl.
Таким образом, используя реакции образования и разложения ацетиленидов, можно выделять алкины из смесей с другими углеводородами.
5. Полимеризация. В присутствии катализаторов алкины могут реагировать друг с другом, причем в зависимости от условий образуются различные продукты. Так, под действием водного раствора CuCl и Nh5Cl ацетилен димеризуется, давая винилацетилен:
НС = СН + НОСH → СН2 = СН-ОСН.
Винилацетилен обладает большой реакционной способностью; присоединяя хлороводород, он образует хлоропрен, используемый для получения искусственного каучука:
СН2 = СН-С = СН + HCl → СН2 = СН – ССl = СН2.
При пропускании ацетилена над активированным углем при 600 °С происходит тримеризация ацетилена с образованием бензола:
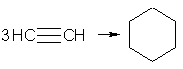
В аналогичные реакции тримеризации могут вступать также и ближайшие гомологи ацетилена, например:
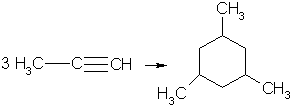
6. Реакции окисления и восстановления. Алкины легко окисляются различными окислителями, в частности перманганатом калия. При этом раствор перманганата калия обесцвечивается, что служит указанием на наличие тройной связи. При окислении обычно происходит расщепление тройной связи, и образуются карбоновые кислоты:
R — C ≡ C—R‘ + 3[О] + Н2О → R — COOH + R‘ — COOH.
В присутствии металлических катализаторов алкины восстанавливаются путем последовательного присоединения молекул водорода, превращаясь сначала в алкены, а затем в алканы:
| Н2 | Н2 | |||
| СН3 — С ≡ СН | → | СН3 — СН — СН2 | → | СН3 — СН2 — СН3. |
Применение. На основе ацетилена развились многие отрасли промышленности органического синтеза. Выше уже отмечена возможность получения уксусного альдегида из ацетилена и различных кетонов из гомологов ацетилена по реакции Кучерова. в свою очередь, большой интерес представляют реакции алкинов с кетонами. Например, реакцией ацетилена с ацетоном можно получить изопрен — исходный продукт для получения синтетического каучука. Хлоропрен также получают из винилаиетилена. Ацетилен используется для сварки (кислородноацетиленовая сварка) металлов, поскольку при его горении развивается высокая температура.
www.himhelp.ru
Алкины — номенклатура, получение, химические свойства » HimEge.ru
Алкины — ациклические углеводороды, содержащие в молекуле помимо одинарных связей, одну тройную связь между атомами углерода и соответствующие общей формуле СпН2n-2.
 Атомы углерода, между которыми образована тройная связь, находятся в состоянии sр — гибридизации. Это означает, что в гибридизации участвуют одна s- и одна р-орбиталь, а две р-орбитали остаются негибридизованными. Перекрывание гибридных орбиталей приводит к образованию σ — связи, а за счет негибридизованных р-орбиталей соседних атомов углерода образуются две π — связи. Таким образом, тройная связь состоит из одной σ -связи и двух π -связей.
Атомы углерода, между которыми образована тройная связь, находятся в состоянии sр — гибридизации. Это означает, что в гибридизации участвуют одна s- и одна р-орбиталь, а две р-орбитали остаются негибридизованными. Перекрывание гибридных орбиталей приводит к образованию σ — связи, а за счет негибридизованных р-орбиталей соседних атомов углерода образуются две π — связи. Таким образом, тройная связь состоит из одной σ -связи и двух π -связей.
Все гибридные орбитали атомов, между которыми образована двойная связь, а также заместители при них (в случае этина — атомы водорода) лежат на одной прямой, а плоскости л-связей перпендикулярны друг другу.
Тройная углерод-углеродная связь с длиной 0,12 нм короче двойной, энергия тройной связи больше, т. е. она является более прочной.
Гомологический ряд этина
Неразветвленные алкины составляют гомологический ряд этина (ацетилена): С2Н2 — этин, С3Н4 — пропин, С4Н6 — бутин, С5Н8 — пентин, С6Н10 — гексин и т. д.
Изомерия и номенклатура алкинов
Для алкинов характерна структурная изомерия: изомерия углеродного скелета и изомерия положения кратной связи. Простейший алкин, для которого характерны структурные изомеры положения кратной связи класса алкинов, — это бутин:

Изомерия углеродного скелета у алкинов возможна, начиная с пентина:

Так как тройная связь предполагает линейное строение углеродной цепи, геометрическая (цис-, транс-) изомерия для алкинов невозможна.
Наличие тройной связи в молекулах углеводородов этого класса отражается суффиксом — ин, а ее положение в цепи — номером атома углерода. Например:

Алкинам изомерны соединения некоторых других классов. Так, химическую формулу С6Н10 имеют гексин (алкин), гексадиен (алкадиен) и циклогексен (циклоалкен):

Физические свойства алкинов
Температуры кипения и плавления алкинов, так же как и алкенов, закономерно повышаются при увеличении молекулярной массы соединений. Алкины имеют специфический запах. Они лучше растворяются в воде, чем алканы и алкены.
Химические свойства алкинов
Химические свойства алкинов сходны с алкенами, что обусловлено их ненасыщенностью.
1) p-Электроны более короткой тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью (подвижностью). Поэтому реакции электрофильного присоединения к алкинам протекают медленнее, чем к алкенам.
2) Связь атома водорода с углеродом в sp-гибридизованном состоянии значительно более полярна по сравнению с С-Н-связями в алканах и алкенах. Это объясняется различным вкладом в гибридизованное состояние s-орбитали, которая более прочно, чем р-АО, удерживает электроны (сравните форму и энергию s- и р-АО). Доля s-АО в sp3-состоянии составляет 25%, в sp2- 33%, а в sp- 50%. Чем больше вклад s-АО, тем выше способность атома удерживать внешние электроны, т.е. его электроотрицательность. Повышенная полярность связи С(sp)-Н приводит к возможности ее гетеролитического разрыва с отщеплением протона Н+.
Таким образом, алкины с концевой тройной связью (алкины-1) проявляют кислотные свойства и способны, вступая в реакции с металлами, образовывать соли







Получение алкинов


Применение алкинов
Наибольшее практическое значение имеют ацетилен и винилацетилен. Ацетилен используется для получения самых разнообразных веществ: уксусной кислоты, поливинилхлорида, синтетического каучука. Винилацетилен является важным промежуточным продуктом в производстве масло- и бензостойкого синтетического хлоропренового каучука.
himege.ru



















