Ацетон: формула, особенности свойств, применение. Ацетон вода
Формула ацетона в химии
Определение и формула ацетона
Химическая формула – 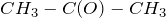
Молярная масса равна  г/моль.
г/моль.
Физические свойства – это прозрачная подвижная жидкость с характерным резким запахом, достаточно летучая. С водой, низшими спиртами и эфирами смешивается неограниченно. Температура плавления и кипения равны соответственно 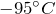 и
и 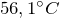 , плотность при комнатной температуре 0,7899 г/см
, плотность при комнатной температуре 0,7899 г/см .
.
Химические свойства ацетона
Ацетон, являясь кетоном, взаимодействует с атомарным водородом в момент его выделения с образованием пинакона, с синильной кислотой с образованием 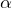 -оксинитрила, с гидросульфитом натрия с образованием гидросульфитного производного ацетона, с гидроксиламином с образованием ацетоноксима, с гидразином с образованием гидразона и азима, со спиртами с образованием полуацеталя и ацеталя, с бромом и йодом с замещением атома водорода на атом галогена, с самим собой в реакциях конденсации в щелочной среде с образованием
-оксинитрила, с гидросульфитом натрия с образованием гидросульфитного производного ацетона, с гидроксиламином с образованием ацетоноксима, с гидразином с образованием гидразона и азима, со спиртами с образованием полуацеталя и ацеталя, с бромом и йодом с замещением атома водорода на атом галогена, с самим собой в реакциях конденсации в щелочной среде с образованием 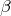 -кетоноспирта и далее непредельного кетона. Приведём некоторые реакции:
-кетоноспирта и далее непредельного кетона. Приведём некоторые реакции:
- Взаимодействие с гидросульфитом натрия:
![Rendered by QuickLaTeX.com \[ (CH_3)_2CO + NaHSO_3 \rightarrow (CH_3)_2C(OH)SO_3Na \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-2ba892844a9ea64d9d75b90bb23c3f79_l3.png)
- Альдольная конденсация:
![Rendered by QuickLaTeX.com \[ 2(CH_3)_2CO \rightarrow (CH_3)_2C(OH)CH_2C(O)CH_3 \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-5e2187c38fc6e11a3a733caa8467a771_l3.png)
- Взаимодействие с синильной кислотой:
![Rendered by QuickLaTeX.com \[ (CH_3)_2CO + HCN \rightarrow (CH_3)_2C(OH)CN \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-b2414e0c52c80907432124cc9ba957b1_l3.png)
Получение
Ацетон получают окислением изопропанола кислородом при 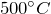 с катализатором (медь, серебро, платина, никель):
с катализатором (медь, серебро, платина, никель):
![Rendered by QuickLaTeX.com \[ (CH_3)_2CHOH + O_2 \rightarrow (CH_3)_2CO + H_2O_2 \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-92774bc48a465c6fc9ba44ffc3fa53a7_l3.png)
Также ацетон получают окислением пропена:
![Rendered by QuickLaTeX.com \[ CH_3-CH=CH_2 + PdCl_2 + H_2O \rightarrow (CH_3)_2CO + Pd + 2HCl \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-2e3fe9395caaefb077c6977417d54537_l3.png)
Качественная реакция
Качественной реакцией на ацетон является интенсивно-красное окрашивание при взаимодействии нитропруссидом натрия в щелочной среде:
![Rendered by QuickLaTeX.com \[ (CH_3)_2CO + Na_2[Fe(CN)_5NO] + 2NaOH \rightarrow Na_4[Fe(CN)_5ON=CHCO_2H_3] + 2H_2O \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-b9ea4143d0751e37bbe0139f73539920_l3.png)
Применение
Ацетон имеет широкое применение как прекурсор для синтеза многих важных веществ (уксусный ангидрид, кетен, окись мезитила, метилизобутилкетон, метилметакрилат, дифенилпропан и так далее). Также применяется как растворитель, для мытья и быстрой сушки лабораторной посуды.
Примеры решения задач

| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Ацетон растворимость в воде - Справочник химика 21
Классификация двухкомпонентных растворов летучих жидких веществ. Основные признаки идеальных и предельно разбавленных растворов. Жидкие вещества при обычных условиях могут смешиваться друг с другом в любых соотношениях или ограниченно. В данной главе преимущественно будут рассмотрены законы равновесия между жидкой и паровой фазами систем, образованных двумя достаточно летучими и неограниченно растворимыми друг в друге компонентами. Раствор ацетона в воде-—пример подобной двойной (бинарно й 1 ж и д к о й системы. [c.179] Если растворитель не образует с водой азеотропных смесей и разница между температурами их кипения достаточна, то их можно разделять фракционной перегонкой (например, смесь ацетона с водой). Растворители, образующие азеотропную смесь с водой, но обладающие относительно невысокой растворимостью в воде и воды в них (дихлорэтан, нитробензол и др.), можно легко регенерировать из водных растворов. Ббльшая часть избирательных растворителей, используемых в практике очистки нефтепродуктов, от-.носится к третьей группе растворителей, образующих с водой смесь с постоянной температурой кипения и имеющих относительно высокую растворимость в воде и воды в них (крезолы, фурфурол, фенол, метилэтилкетон и др.). Для их разделения пользуются значительной разницей в концентрациях растворителя в парах азеотропной смеси и в жидкой фазе охлажденного конденсата, состоя- [c.106]Растворимый полиакриламид с высоким молекулярным весом получают также полимеризацией акриламида в смеси растворителей, состоящей из ацетона и воды, содержание которой в смеси должно быть не более 10 %. Концентрация мономера в смеси растворителей составляет 10-25 %. Полимеризацию проводят в присутствии перекиси циклогексанона или гидроперекиси кумола. Например, в автоклаве емкостью 1000 л в смеси, состоящей из 510 кг ацетона и 30 кг воды, растворяют 60 кг акриламида и при температуре 30 °С под давлением азота 1-2 ат вводят 120 мл 50 %-го раствора циклогексана в циклогексаноне и 2,4 л 10 %-го кислого сернокислого натрия. Добавление инициатора повторяют ежечасно. После четырехчасового индукционного периода начинается полимеризация, которая заканчивается через 4 ч. Во время полимеризации температуру поддерживают равной 40 С. Полимер выпадает в виде мелких зерен и полностью растворяется в воде. [c.58]
Карамелизация (разложение) наступает при нагревании свыше 200 °С. Хорошо растворяется в воде. Растворимость с повышением температуры возрастает. В метиловом, этиловом спиртах и неполярных растворителях не растворяется. Умеренно растворим в этилацетате, пиридине, анилине, жидком аммиаке, смесях ацетона с водой. [c.40]
Второй существенной особенностью органических осадителей является нередко малая растворимость самих реактивов в воде и значительная растворимость образующихся осадков в органических растворителях. Так, а-нитрозо-р-нафтол в воде почти нерастворим, диметилглиоксим и оксихинолин мало растворимы и т. д. Поэтому многие органические осадители применяют в виде растворов в неводных растворителях (спирт, ацетон и т. д.). Однако при введении вместе с реактивом больших количеств спирта или ацетона растворимость образующихся осадков увеличивается. [c.105]
Добавка органического компонента (ацетона) к воде резко и по-разному для каждого электролита понижает его растворимость в обеих фазах. Следовательно, в системе набухший ионит — равновесный бинарный раствор почти для любой пары электролитов могут быть достигнуты резко различающиеся значения коэффициентов распределения при соответствующим образом подобранной концентрации органического компонента в бинарном растворителе. [c.153]
Иодбензол по мере образования удаляют из смеси перегонкой с водяным паром. Иодобензол представляет собой бесцветное твердое вещество, которое плавится, разлагаясь со взрывом, при 237 °С. Он практически нерастворим в бензоле и ацетоне, растворимость в воде прн 100 °С составляет 12 г л. Иодобензол может быть получен и путем окисления хлористого иодбензола раствором гипохлорита натрия (выход 87- 92%). [c.339]
В связи с этим исследовали растворимость воды в растворителе ацетон-МТБЭ (30 70) и этого растворителя в воде. Из справочных данных известно, что ацетон и вода взаимно растворимы в любых соотношениях, а МТБЭ растворяет при температуре 20°С около 1,5% воды и вода - около 4,8% МТБЭ. [c.11]
Представляет собой белый (иногда слегка желтоватый) кристаллический порошок, хорошо растворяющийся в этиловом и метиловом спиртах и ацетоне. Растворимость в 100 г воды составляет при 20° С 144 г, а при 100° С — 208 г. [c.121]
Диизопропиловый эфир можно заменить диэтиловым эфиром, однако недостатком этого растворителя является большая растворимость его в воде. После выпаривания соединенных органических слоев в вакууме при температуре ниже 40° остается в количестве около 5% (считая на серный ангидрид) 2,4-дифенил-бутан-1,4-сультон, который можно очистить (выход 60%) перекристаллизацией из смеси ацетона и воды т, пл. 147—149°. Выход сультона можно повысить примерно до 25%, считая на чистый препарат, если взять 3 моля стирола на 1 моль серного ангидрида. [c.60]
Если очищаемое вещество хорошо растворяется при нагревании в одном растворителе, но не кристаллизуется из него при охлаждении, а в другом растворяется очень плохо, то следует пробовать кристаллизовать вещество из смеси этих растворителей Для этого вещество растворяют в небольшом количестве первого растворителя при нагревании. Затем к горячему раствору прибавляют второй до тех пор, пока не появится помутнение. Эту смесь нагревают до исчезновения помутнения и сильно охлаждают Выделяется чистое вещество, которое отфильтровывают. Часто используют следующие смеси взаимно растворимых веществ этиловый спирт и вода, этиловый спирт и бензол, бензол и петролейный эфир, ледяная уксусная кислота и вода, этиловый спирт и эфир, ацетон и вода, ацетон и петролейный эфир, эфир и петролейный эфир и др. [c.20]
Растворитель ацетон-МТБЭ обладает большой гигроскопичностью. Известно, что влияние воды увеличивается с повышением растворимости воды в применяемом растворителе. Снижение растворяющей способности растворителей в присутствии воды объясняется уменьшением действия дисперсионных сил вследствие образования водородных связей. [c.14]
Учитывая большую гигроскопичность растворителя ацетон-МТБЭ по отношению к растворителю МЭК-толуол, были проведены эксперименты по снижению его растворяющей способности к воде добавлением толуола. В табл. 12 представлены результаты растворимости воды в растворителе ацетон-МТБЭ-толуол (32 48 20) и в растворителе МЭК-толуол (40 60). Содержание воды определялось по методу Карла-Фишера. [c.17]
Растворимость гексогена в смеси ацетона и воды при 20° [c.389]
Однако весьма важное промышленное значение имеют и многие пары жидкостей, частично растворимых друг в друге и образующих растворы, относящиеся ко второй группе, например фенол и вода, фурфурол и вода, ацетон и вода, изо-бутиловый спирт и вода, эфир и вода. [c.97]
Среднее из десяти определений ацетона, содержащего 2,0% воды, составило 2,02%, относительное стандартное отклонение равно 1,6% [30]. Относительное стандартное отклонение из десяти определений воды, проведенных путем измерения диэлектрической постоянной (см. гл. 2), в этом же образце ацетона равно 1,2%. Определенная описанным методом растворимость воды в метилизобутилкетоне при 25 °С составляет 1,87—1,93%. [c.365]
Хлористый аллил хорошо растворяется в спирте, эфире, толуоле, ацетоне, октане, четыреххлористом углероде. Растворимость хлористого аллила в воде при 20 составляет 0.36%, а растворимость воды в хлористом аллиле - 0.08%. [c.184]
Важное значение имеют смеси жидкостей, частично растворимых друг в друге. Такими смесями являются ацетон и вода, эфир и вода, изобутиловый спирт и вода и многие другие жидкости. [c.29]
Расчет коэффициентов активности из данных о взаимной растворимости компонентов р а с т в о р а22. По мере того как компоненты раствора химически все более различаются друг от друга, отклонения раствора от закона Рауля возрастают. Большие положительные отклонения приводят в конце концов к ограниченной взаимной растворимости компонентов. Так, в системах спирт — вода метиловый, этиловый и пропиловый спирты полностью смешиваются с водой однако растворы этих спиртов отличаются все увеличивающимися отклонениями от закона Рауля. Бутиловый спирт, для растворов которого в воде характерны очень большие отклонения от закона Рауля, растворяется в ней ограниченно. Аналогично ведут себя и системы кетон — вода. Ацетон и вода смешиваются полностью с умеренными отклонениями от идеальности, тогда как метилэтилкетон и вода ограниченно смешиваются и обнаруживают большие положительные отклонения от закона Рауля. [c.94]
Пример 111-13. Рассчитать распределение ацетона (С) между водой (Л) и хлороформом (В), пренебрегая взаимной растворимостью воды и хлороформа. [c.118]
Активности ацетона в этих бинарных системах изображены графически в координатах, показанных на рис. 63. Пренебрегая взаимной растворимостью воды и хлороформа, определяем, исходя из условия-равенства активностей ацетона, равновесные концентрации его в обеих фазах [c.119]
Рассчитанная кривая распределения вместе с экспериментальными данными Хэнда для температуры 25° С показана на рис. 64. Как видно из графика, хорошее соответствие с опытом достигается при низких концентрациях ацетона, но по мере увеличения взаимной растворимости воды и хлороформа с возрастанием концентрации ацетона расхождение увеличивается. Тем не менее можно сделать вывод, что распределение сильно сдвинуто в сторону хлороформа. Даже такой качественный вывод в ряде случаев может оказаться весьма полезным. [c.119]
Как было показано Г. М. Панченковым и В. И. Горшковым, обмен ионов водорода на катионы Li+, Na+ и К" " в ряду смесей спирта с водой линейно зависит ог / ). Эго является следствием того, что в этих смесях основность растворителя практически остается неизменной Обмен иона водорода на катион в этом случае, как следует из уравнения (8,96), становится подобным обмену двух катионов (уравнение 8,93). Следует заметить, что в смесях ацетона с водой эти авторы уже не наблюдали линейной зависимости. Это находится в согласии с влиянием смесей ацетона с водой на растворимые кислоты и связано с дифференцирующими свойствами ацетона. [c.689]
Давление пара, температуры кипения и азеотропы. Взаимодействие между молекулами в растворах может быть выявлено при построении зависимости давления пара или температур кипения от состава раствора. Отклонения от идеального поведения приводят к появлению на соответствующих кривых максимумов или минимумов. Точнее, положительные отклонения дают максимумы на кривых давления пара, минимумы на кривых температур кипения и азеотропы с минимальными температурами кипения при условии, что разница в температурах кипения компонентов раствора мала по сравнению с величиной отклонения или что разница в параметрах растворимости б достаточно велика. Противоположные закономерности наблюдаются при Отрицательных отклонениях. Смеси соединений, способных к образованию Н-связи, могут давать как положительные, так и отрицательные отклонения от закона Рауля в зависимости от относительной силы Н-связи между одинаковыми и неодинаковыми молекулами в растворе. Например, смесь ацетона с хлороформом дает азеотроп с максимумом температуры кипения, в то время как в случае смеси ацетона с водой было показано, что азеотроп либо вообще отсутствует, либо имеет весьма незначительно пониженную температуру кипения [959]. В первом случае в чистых компонентах Н-связь отсутствует и образуется только после смешения. Это ведет к отрицательным отклонениям от закона Рауля и появлению азеотропа с максимумом температуры кипения. Во втором случае ассоциация воды приводит к конкуренции между двумя типами равновесий. По-видимому, переход от связей вода — вода к связям вода — ацетон вызывает лишь малое суммарное изменение и отклонения, по существу, отсутствуют. Обзор проблемы межмолекулярных сил и обсуждение влияния Н-связи на свойства растворов были даны Роулинсоном [1751, стр. 187]. [c.41]
Вследствие небольшой растворимости диперекиси ацетона в воде мы применили при исследовании полярографического поведения последней водно-спиртовые смеси на основе этилового и изопропилового спиртов. [c.275]
Регенерация ацетон-бензол-толуолового растворителя. При регенерации ацетон-бензол-толуолрвого растворителя следует иметь в виду две особенности этого растворителя во-первых, полную растворимость ацетона в воде при весьма малой растворимостп в воде бензола и толуола и, во-вторых, значительную разницу между температурами кипения его компонентов (ацетона 50°, бензола 80,1°, толуола 110,6°). [c.240]
Эритромицин — белый или белый с кремовым оттенком кристаллический, гигроскопический порошок горького вкуса, без запаха, легко растворим в спирте, эфире, хлороформе, ацетоне. Растворимость его в воде резко снижается с повышением температуры. Наиболее устойчивы водные растворы при pH 7—8. При комнатной температуре в водных растворах при pH не ниже 6,3 и не выше 9,3 препарат устойчив в течение 2 суток. pH раствора определяют потенциометрически. Легко разрушается в растворах кислот и щелочей. Концентрированная серная кислота окращивается в красновато-коричневый цвет. Раствор в ацетоне окрашивается концентрированной соляной кислотой в оранжевый цвет, переходящий в красный н затем в фиолетово-красный. При прибавлении к полученной смеси хлороформа последний окращивается в фиолетовый цвет. [c.714]
Схема регенерации кетон-бензол-толуоловых растворителей, в которых в качестве кетона используют метилэтилкетон, аналогична описанной выше. При этом несколько изменяется режим процесса в сторону повышения температуры на первых ступенях отгона, поскольку температура кипения металэтилкетона выше, чем ацетона (79,6° при 760 мм рт. ст. против 56,1° для ацетона), г Если на депарафинизационной части установки применяют / МЭК в тех случаях, когда нельзя пользоваться влажным растворителем, операция осушки растворителя усложняется вследствие затруднений с получением безводного МЭК. Эти затруднения вызываются тем, что МЭК с водой образует азеотропную смесь, близкую по составу к насыщенному раствору воды в жидком МЭК. Так, количество воды в этой азеотропной смеси составляет 11,0%, а растворимость воды в жидком МЭК при 20" равна 9,9%. При такой близости составов азеотропной смеси и насыщенного раствора нельзя разделять эту азеотропную смесь при помощи процесса, рассмотренного для регенерации дихлор-этап-бензолового растворителя. Поэтому для выделения МЭК применяют другие методы разделения, в частности, орошение паров азеотропной смеси сырьем, поступающим на депарафинизационную часть установки, с целью абсорбции МЭК, хорошо растворимого в нефтяных продуктах. Возможна осушка смеси МЭК с бензолом и толуолом путем вымораживания влаги. [c.244]
Растворимость воды в кетш-толуоловых растворителях и растворяющая способность последних по отношению к маслам определяется условиями взаимной растворимости и фазовыми переходами системы масло-кетон-толуол-вода. Исследование таких систем было выполнено при температурах 20 и минус 20°С с растворителями ацетон - толуол и ЫЭК-толуол. В качестве масляного кшпонента взят образец депарафинированного масла фр.350-420°С с температурой застывания минус 16°С, полученный ва Кременчугском НШ. Выполненные исследования позволили сравнить растворяхщую способность сухих и влажных растворителей ацетон - толуол и МЭК - толуол по отношению к маслу при изменении концентрации кетона от 30 до 80 об. Изменение растворяющей способности насыщенных водой растворителей определяли по разности КТР масла во влажных и сухих растворителях при равных концентрациях кетонового компонента. [c.133]
Растворимость LI IO3 исключительно высока (в г на 100 г воды) 313,5 (18°), 500 (27°) [381. Известен кристаллогидрат хлората лития LI 103-I/2h3O, теряющий воду при 55° ПО]. В ацетоне растворимость мала, в этиловом спирте — значительная [38]. [c.17]
На рис. 21,6 показана диаграмма взаимной растворимости воды, хлорофо )ма и ацетона. Точки Л и Л соответствуют составам двух равновесных растворов ацетона в хлороформе (Л) и в воде (Л ). С увеличением содержания ацетона каждый из растворов становится трехкомпонентным из-за взаимной растворимости хлороформа и воды. Составам равновесных растворов отвечают точки В—В, С—С и т. д. В точке К эти растворы имеют одинаковый состав, т. е. система из гетерогенной превращается в гомогенную. Кривая АКА разделяет диаграмму на гетерогенную область, лежащую ниже этой кривой, и гомогенную, расположенную над ней. [c.64]
Из этого нельзя делать вывод, что при тушении растворимых в воде горючих жидк01стей водой горение прекратится. Опыты показывают, что при тушении метилового, этилового спиртов и ацетона распыленной водой разбавление происходит в первую очередь в верхнем слое горящей жидкости и горение ее прекращается, когда создается смесь, содержащая 25—10% горючей жидкости. [c.151]
Бензодиоксан-2-ил) -1 - (2,3-эпоксипропокси) этан, С13Н16О4, мол. вес 236,27—светло-коричневые кристаллы, хорошо растворимые в толуоле, метаноле, ацетоне, растворимые в эфире, бензоле и нерастворимые в воде, петролейном эфире. [c.14]
ФС Аморфное вещество, нерастворимое в воде и ацетоне, растворимое в кислотах, плохо - в Nh5 I и оксалате аммония. [c.80]
Фториды хорошо растворяются в воде, метаноле, гидразине, масляной н муравьиной кислотах, трехфтористом броме, практически нерастворимы в эфире, пиридине, нитробензоле и ацетоне. Растворимость (г безводной соли на 100 г воды) фторида рубидия при25°С составляет 289,8 г [126, 130]. а фторида цезия при 25, 50 и 75° С — 530 573 608 г соответственно [130, 131]. Некоторые физико-химические свойства фторидов рубидия и цезия в сравнении со свойствами фторида калия приведены в табл. 5. Фториды [c.93]
После отгонки 200 мл воды было получено 0,4% ацетона. остатка перегонки было выделено 0,01 г янтарного альдегида. В идентичном опыте с березовым уксуснокислотным лигнином (17% ОСНз) было получено 0,18% формальдегида и 0,5% ацетона. Из березового муравьинокислотного лигнина (ацетоно растворимая фракция с 21% ОСНз) было получено 0,7% ацетона. [c.277]
Аналогичный эксперимент был проведен с метанолом вместо этанола, при этом получался метаноллигнин эвкалипта с выходом 16,4% в расчете на древесину. Остаточная древесина возвращалась в количестве 487о и содержала 9,2% лигнина Класона. Очистка сырого лигнина дважды из ацетона и воды и пять раз из смеси диоксана и эфира давала 81,7% метаноллигнина А, нерастворимого в диоксане — эфире, и 15,8% лигнина Б, растворимого в диоксане—эфире, содержащего 62% углерода, 6,3% водорода, 29,5% алкоксилов. Анализы исходного метаноллигнина А и некоторых его производных представлены в табл. 5. [c.514]
Брукер и Эллисон [28] описали автоматическую методику, которая имеет особую ценность при определении растворимости воды в органических соединениях (твердых или жидких) в интервале 0,5—100 млн . Аппаратура, в которой использован абсорб-циометр типа Спеккер, показана на рис. 11-1. В общем варианте метода готовят 2%-ный раствор органического [ соединения в этаноле или ацетоне затем со скоростью 0,01 мл/мин добавляют деионизованную воду, содержащую поверхностно-активное вещество, например трагант (1 мл 0,01%-ного рас- I твора на 45 мл воды) до появления по- [ мутнения. Раствор исследуемого образца [c.539]
Из табл. 3 видно, что метилэтилкетон и его смесь е бензолом значительно лучпле растворяют масло, чем ацетон и смесь его е бензолом, что видно по температурам помутнения. Взаиморастворимость метилэтилкетона и воды значительно меньше, чем взаимораствори-мость ацетона и воды, а примесь воды в растворителе снижает растворимость масла, что видно по более высокой температуре помутнения раствора масла в растворителе, содержащем влагу. [c.215]
Кристаллическое веш,ество желтого цвета, из водного раствора выделяется в виде призм, из ацетонового — в виде ромбов. В ацетоне и воде лучше растворимо, чем хлоросоединение.Т. разл. 140-150° С. [c.195]
chem21.info
ПВС вода ацетон - Справочник химика 21
Б. Равновесия жидкость — жидкость в трехкомпонентных системах. Диаграммы растворимости с одной областью расслоения. Диаграммы взаимной растворимости жидкостей в трехкомпонентных системах характеризуются большим разнообразием. Особенно часто встречаются системы, в которых две жидкости обладают ограниченной взаимной растворимостью, а третья жидкость неограниченно смешивается с каждой из них. Это, например, системы вода —бензол — этиловый спирт, вода —хлороформ —уксусная кислота, вода — ацетон —четыреххлористый углерод. [c.424] Простая перегонка осуществляется путем постепенного испарения сточной воды. Образующиеся пары конденсируются и в виде жидкости — дистиллята — собираются в сборнике. В результате перегонки в кубе аппарата остается сточная вода с более низким содержанием вредных соединений, а в сборнике — дистилляте удаляемыми соединениями. Метод применяется для удаления из сточной воды соединений, имеющих температуру кипения ниже температуры кипения воды (ацетон, спирты и т. д.). С целью более полного удаления органических соединений и получения концентрированного дистиллята перегонку осуществляют с дефлегмацией. [c.489] В табл. 14—18 представлены результаты исследований теплоотдачи при турбулентном течении нескольких жидкостей воды, ацетона. бензола, керосина и бутилового спирта. [c.64]Вспомогательные материалы уксусный ангидрид, уксусная кислота, катализатор, вода, ацетон. [c.195]
Расчет противоточной многоступенчатой экстракции вода — ацетон — метилизобутилкетон по треугольной диаграмме (к примеру XII. 7). [c.408]
В барботажных колоннах диаметром 45,7 и 19 мм и высотой слоя соответственно 1,20 и 1,16 м исследовали [198] продольное перемешивание, применив в качестве трассера тепловой поток и определяя профиль температуры по высоте колонны. Газовой фазой служил азот, жидкой — вода, ацетон, четыреххлористый угле-1 род, циклогексанол, этанол, 10%-ный раствор этанола в воде и 50%-ный раствор сахара в воде. Газ распределялся через перфо- рированный диск и сопла. Колонна была снабжена вакуумной изоляцией. [c.199]
Уксусная кислота, будучи пропущена при,400° над порошком меди, диссоциирует на СОз и метан с образованием некоторого количества ацетона. При 600° с катализатором медь—алюминий получаются вода, ацетон и газ. Изомасля-ная кислота в тех же условиях дает таз и жидкость, состоящую из воды, изобу-тирона и небольшого количества го/рючего продукта, жадно поглощающего бром. [c.380]
Этанол—вода Ацетон—метанол [c.319]
По ходу реакции через определённые промежутки времени пробоотборником (а) отбирают пробы оксидата, в которых определяют содержание исходных веществ и продуктов реакции. Перед отбором пробы пробоотборник промывают с помощью резиновой груши содержимым реактора. По окончании опыта выключают последовательно обогрев, подачу кислорода, мешалку и реакционную массу выгружают в стакан через нижний штуцер реактора. Реактор, все детали реактора и обратный холодильник при работающей мешалке промывают несколько раз водой, ацетоном и дистиллированной водой и затем высушивают. [c.31]
НДА (ТУ 6-00-05808009-248-92) — нитрит дициклогексиламина. Это порошок белого цвета с желтоватым оттенком, растворимый в этаноле, метаноле, воде, ацетоне. Предназначен для долговременной (10—20 лет в зависимости от способа применения и условий хранения изделий) защиты от атмосферной и микробиологической коррозии изделий из стали, алюминия и его сплавов, никеля, хрома, кобальта. Ингибитор применяют в виде порошка, засыпаемого в сублиматор для получения ингибированного воздуха порошка для опудривания или напыления на зашитные поверхности спиртовых растворов ингибированной бумаги с содержанием ингибитора 14— 20 г/см1 [c.376]
Кривая / вода — ацетон —1,1,2-трихлорэтан [c.27]
П Хлорекс Вода Ацетон [c.81]
Точность определения зависит от чистоты сталагмометра, поэтому перед началом опыта нужно тщательно промыть его хромовой смесью, дистиллированной водой, ацетоном и вновь дистиллированной водой. Чистоту сталагмометра проверяют по числу капель вытекающей из него дистиллированной воды, которое постоянно для данного сталагмометра. [c.162]
Итак, любой раствор состоит, как минимум, из двух индивидуальных веществ, одно из которых считают растворителем, а другое — растворенным веществом. Однако такое деление очень условно, а для веществ, смешивающихся в любых соотношениях (вода — ацетон, золото — серебро), лишено смысла. [c.63]
Анализируемый раствор насыщенный водой ацетон с 1—3% воды. [c.196]
Этанол — вода Ацетон — вода Этанол — бензол Этиленгликоль — вода Труба (внутренний диаметр 4 мм) длина 60 мм 0,33—1,32 10-110 2,5—10 2—13 [13] [c.422]
Изопреновый каучук (СКИ) является по строению и свойствам синтетическим аналогом натурального каучука. Для изготовления резиновых смесей из СКИ используют те же ингредиенты, что и для НК. Для резин на основе изопренового каучука характерна низкая газопроницаемость, высокие упруго-прочностные показатели, достаточно высокая стойкость к действию воды, ацетона, этилового спирта. К недостаткам СКИ относят низкую стойкость к действию бензина, минеральных, растительных и животных масел, ароматических и хлорсодержащих углеводородов. Низка прочность при повышенных температурах, озоно- и атмосферостойкость плохая. [c.23]
Оно описывает данные по кризису для смесей этанол — вода, ацетон — вода, этанол — бензол и вода — этиленгликоль с разбросом 20%. Для азеотропных смесей рекомендуется брать равным Гза(, в при азеотроп-ном составе, так что т=анализом результатов для смесей бензол — этанол, представленных на рис. 3. [c.423]
Данные о фазовом равновесии системы вода — ацетон — хлорбензол (равновесные составы фаз в % масс.) приведены в табл. 58. [c.372]
Сведений о технологии утилизации и обезвреживания промышленных гипохлоритных сточных вод ацетоном с получением хлороформа, гидроокиси кальция, концентрированного раствора хлористого кальция и уксуснокислого кальция в литературе практически нет. Поэтому при разработке технологии утилизации гипохлоритных стоков ацетоном наряду с данными, полученными нами в лабораторных условиях, был учтен опыт ранее известных производств хлороформа [c.108]
На полупромышленной установке были изучены все стадии процесса обезвреживания и утилизации активного хлора, содержащегося в сточных водах, ацетоном. В качестве опытных сточных вод использовали гипохлоритные сточные воды цеха Стерлитамакского производственного объединения Каустик , содержащие гипохлорит и другие двухосновные соли кальция, и ацетон (марки ЧДА). [c.109]
Обмен хлора и брома на иод производится путем нагревания соединений с.иодидом калия, иодидом натрия или иодидом кальция либо в отсутствие растворителя, либо в воде, ацетоне или спирте. [c.101]
Обработанную таким образом губчатую массу промывают сначала теплой и холодной водой, затем 3—5%-ным раствором уксусной кислоты, снова водой, ацетоном с добавкой парахинона и сушат в вакуум-сушилке при 55—60 °С в течение нескольких часов. Парахинон защищает свинец от окисления при сушке и хранении на открытом воздухе в течение длительного времени. Полученный порошок черного цвета имеет средний размер частиц 2—5 мкм и содержит 8—10% окислов. [c.329]
Небольшое количество спирта (около 30 мл), загрязненного любой растворимой примесью (водой, ацетоном, пиридином и др.), очищают методом простой перегонки. Исходя из количеств взятого и очищенного спирта, рассчитайте процентный состав первоначальной смеси. Следует обратить внимание на показание термометра в процессе перегонки. Сохраняется ли оно все время постоянным [c.32]
Первые теплоты растворения (АНо) Nal в воде, ацетоне, этиленгликоле, этаноле и метаноле при 25 °С равны —7,57 —44,10 —33,89 —24,52 и —32,05 кДж/моль. [c.171]
Поливинилсульфонаты хорошо растворимы в хлороформе, дихлорэтане и нерастворимы в воде, ацетоне. Эти легко получаемые поливинильные соединения не менее легко гидролизуются при незначительном повышении температуры. Поливинилсульфонаты применяют в качестве промежуточных продуктов для [c.299]
Проведение опыта. В первую колонку вливают 6 мл Смеси фуксина и метиленовой сини. Смесь эту готовят сливанием по 1 мл исходных растворов красителей с доведением дистиллированной водой общего объема до 100 мл. Как только раствор полностью впитывается, в колонку медленно вливают при работе разрежающего насоса несколько миллилитров смеси вода — ацетон (в соотношении 1 1) [c.215]
Однако Еесьма важное промышленное значение имеют и многие пары жидкостей, частично растворимых друг в друге и образующих растворы, относящиеся ко второй группе, например, фенол и вода, фурфурол и вода, ацетон и вода, изобутиловый спирт н вода, эфир и вода. [c.10]
Результаты эксперимента на системах этанол - вода, ацетон -вода и др. показали, что в процессе ректификации фазы находятся в состоянии насыщения, и перефев пара не приводит к заметному увеличению скорости массопередачи. Перефев пара Д.1Я смеси этанол - вода составлял 10 С, рабочая разность тем- [c.145]
Анализ результатов показывает, что наблюдается определенное влияние растворимости веществ на протекание процесса десорбции. Для нерастворимого в воде -ксилола и труднорастворимого бутанола расчетные значения у превышают экспериментальные, а для бесконечно растворимых в воде ацетона и пропанола имеет место обратная картина — экспериментальные значения у выше расчетных. Это, очевидно, объясняется тем, что при расчете не принималось во внимание внутридиффузионное торможение, величина которого зависит от растворимости десорбируемого вещества в воде (для растворимых оно меньше, чем для нерастворимых). [c.103]
Для определения электропроводности по методу ASTMD3114 отбирают не менее 1 л пробы топлива в канистру с эпоксидным покрытием или в стеклянную бутыль. Тару, предназначенную для отбора пробы топлива, тщательно подготавливают — промывают последовательно горячей водой, холодной дистиллированной водой, ацетоном, хлороформом, продувают сухим азотом, ополаскивают несколько раз исследуемым топливом и затем отбирают пробу. Хранить пробы топлива отобранные для измерения электропроводности, не рекомендуется. Основным узлом прибора для определения по методу ASTMD3114 является электродная ячейка. В стакан из нержавеющей стали емкостью 250 мл помещены цилиндрические электроды. Расстояние между стенкам электродов должно быть не менее 1 мм. Электропроводность топлива измеряют при напряженности электрического поля от 0,8 до 1,6 В/мм. Переключением клеммы на ячейку от батареи подается напряжение 1,5 В, и в этот момент на приборе фиксируется величина электрического тока, проходящего через ячейку. Электропроводность топлива рассчитывают по закону Ома [c.130]
Растворитель обычно подбирается опытным путем с малым 1(оли-чесгвом пробы. Чаща всего в качестве растворителя иопользуют воду, ацетон, спирт, эфир, бензол и т.п. [c.51] Но предстоит еще разделить саму отогнанную азеотропную смесь на исходные составляющие. Это легко сделать, если уводитель растворяется в воде (например, если взять метанол или ацетон). Тогда полученный азеотроп смешивают с водой, ацетон [c.115]Растворители, применяющиеся в процессе дистекс , должны быть но природе полярными так, например, для этой цели используют фенол, анилин, воду, ацетон [42], фурфурол и др. Для очистки толуола применяют [c.195]
II. Жидкости, ограниченно взаимно растворимые. Двухкомпонентные системы ан.члин — вода, метиловый спирт — гексан и др. Трехкомпонептные системы вода—эфир — нитрил янтарной кислоты бензол — бромоформ — муравьиная кислота вода — ацетон — ксилол и др. Прп этом трехкомпоиентные системы могут образовать два или три равновесных жидких слоя. [c.99]
chem21.info
Ацетон
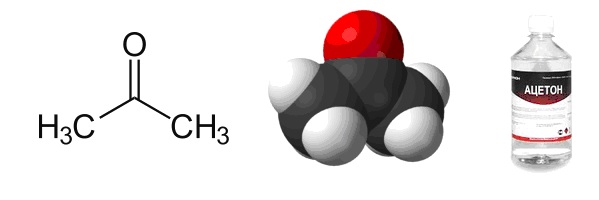
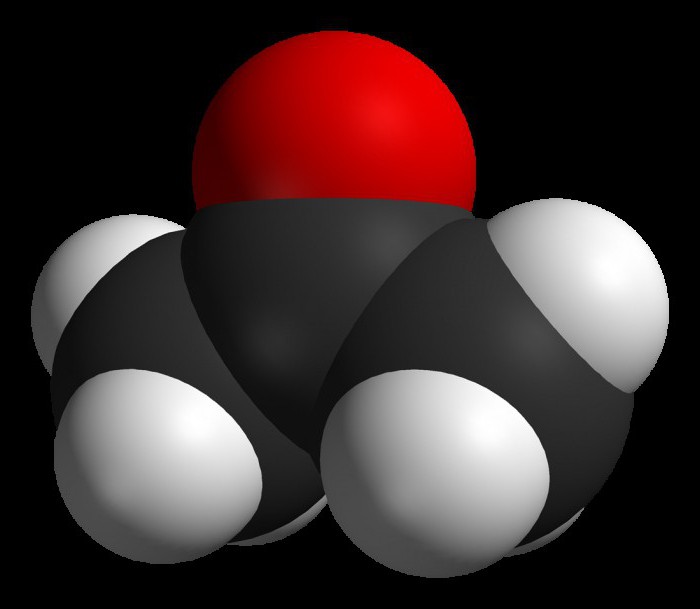
Ацето́н (диметилкето́н, 2-пропано́н) — органическое вещество, имеющее формулу Ch4—C(O)—Ch4, простейший представитель насыщенных кетонов.Своё название ацетон получил от лат. acetum — уксус. Это связано с тем, что ранее ацетон получали из ацетатов, а из самого ацетона получали синтетическую ледяную уксусную кислоту.
В России ацетон входит в таблицу III («прекурсоры, оборот которых в Российской Федерации ограничен и в отношении которых допускается исключение некоторых мер контроля») списка IV («Список прекурсоров, оборот которых в Российской Федерации ограничен и в отношении которых устанавливаются меры контроля») перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации (прекурсор). Оборот ацетона (концентрацией 60 % и более) в РФ ставится под контроль, на учёт прихода и расхода.
Содержание
- 1 Открытие
- 2 Физические свойства
- 3 Химические свойства
- 4 Получение
- 5 Применение
- 5.1 Лабораторное применение
- 6 Обнаружение
- 7 Пожароопасность
- 8 Метаболизм и токсикология
- 9 Примечания
- 10 Ссылки
Открытие
Андреас Либавиус — первым открыл ацетонОдин из простейших и в то же время важнейших кетонов — ацетон — впервые выявлен в 1595 году немецким химиком Андреасом Либавиусом (англ.) в процессе сухой перегонки ацетата свинца. Однако точно определить его природу и химический состав удалось только в 1832 году Жану-Батисту Дюма и Юстусу фон Либиху. До 1914 года ацетон получали практически исключительно коксованием древесины, однако повышенный спрос на него в годы Первой мировой войны очень быстро стимулировал создание новых методов производства.
Физические свойства
Ацетон — бесцветная подвижная летучая жидкость (при н.у.) с характерным резким запахом. Во всех соотношениях смешивается с водой, диэтиловым эфиром, бензолом, метанолом, этанолом, многими сложными эфирами и так далее.
Основные термодинамические свойства ацетона:
- Поверхностное натяжение (20 °C): 23,7 мН/м
- Стандартная энтальпия образования ΔH (298 К): −247,7 кДж/моль (ж)
- Стандартная энтропия образования S (298 К): 200 Дж/моль·K (ж)
- Стандартная мольная теплоемкость Cp (298 К): 125 Дж/моль·K (ж)
- Энтальпия плавления ΔHпл: 5,69 кДж/моль
- Энтальпия кипения ΔHкип: 29,1 кДж/моль
- Теплота сгорания Qp: 1829,4 кДж/моль
- Критическое давление: 4,7 МПа
- Критическая плотность: 0,273 г/см3
- Динамическая вязкость жидкостей и газов:
- 0,36 мПа·с (10 °C)
- 0,295 мПа·с (25 °C)
- 0,28 мПа·с (41 °C)
Термохимические свойства:
- Температура вспышки в воздухе: −17,778 °C (-18 °C)
- Температура самовоспламенения на воздухе: 465 °C
- Пределы взрывоопасных концентраций: 2,6-12,8 %
Оптические свойства:
- Показатель преломления (для D-линии натрия):
- 1,3591 (20 °C)
- 1,3588 (25 °C)
- Показатель диссоциации: pKa = 20 (20 °C, вода)
- Диэлектрическая проницаемость (20 °C): 20,9
- Дипольный момент молекулы (20 °C): 2,84 Дебай
Ацетон хорошо растворяет многие органические вещества, в частности, ацетил- и нитроцеллюлозы, воски, алкалоиды и так далее, а также ряд солей.
Ацетон образуется при ацетоновом (ацетон-бутиловом) брожении углеводов, вызываемом Bacillus acetobutylicus. В результате образуется ацетон и бутанол, а также ряд побочных примесей. В качестве промышленного такой метод получения ацетона был популярен в XIX — начале XX вв., но был вытеснен технологиями химического синтеза.
Химические свойства
Ацетон является одним из наиболее реакционноспособных кетонов. Так, он один из немногих кетонов образует бисульфитное соединение
Под действием щелочей вступает в альдольную самоконденсацию, с образованием диацетонового спирта.
Восстанавливается цинком до пинакона.
При пиролизе (700 °C) образует кетен:
Легко присоединяет циановодород с образованием ацетонциангидрина.
Атомы водорода в ацетоне легко замещаются на галогены. Под действием хлора (иода) в присутствии щёлочи образует хлороформ (йодоформ).
Получение
Мировое производство ацетона составляет более 6,9 миллионов тонн в год (по данным на 2012 г.) и устойчиво растёт.
В промышленности получается напрямую или косвенно из пропена.
Кумольный способОсновную часть ацетона получают как сопродукт при получении фенола из бензола по кумольному способу. Процесс протекает в 3 стадии:
На первой стадии бензол алкилируется пропеном с получением кумола, на второй и третьей (реакция Удриса — Сергеева) полученный кумол окисляется кислородом воздуха до гидропероксида, который при действии серной кислоты разлагается на фенол и ацетон:
Из изопропанолаПо данному методу изопропанол окисляют в паровой фазе при температурах 450—650 °C на катализаторе (металлические медь, серебро, никель, платина). Ацетон с высоким выходом (до 90 %) получают на катализаторе «серебро на пемзе» или на серебряной сетке:
Метод окисления пропенаАцетон получают также прямым окислением пропена в жидкой фазе в присутствии PdCl2 в среде растворов солей Pd, Cu, Fe при температуре 50-120 °C и давлении 50-100 атм:
Некоторое значение имеет метод брожения крахмала под действием бактерий Clostridium acetobutylicum с образованием ацетона и бутанола. Метод характеризуется малыми выходами. Используются также методы получения из изопропилового спирта и ацетилена.
Применение
Ацетон применяется как сырьё для синтеза многих важных химических продуктов, таких как уксусный ангидрид, кетен, диацетоновый спирт, окись мезитила, метилизобутилкетон, метилметакрилат, дифенилпропан, изофорон, бисфенол А и так далее; пример:
Последний широко применяется при синтезе поликарбонатов, полиуретанов и эпоксидных смол.
Ацетон также является популярным растворителем, значительно превосходящим в плане безопасности уайт-спирит, скипидар и отчасти керосин. В частности он используется как растворитель
- в производстве лаков;
- в производстве взрывчатых веществ;
- в производстве лекарственных препаратов;
- в составе клея для киноплёнок как растворитель ацетата целлюлозы и целлулоида;
- компонент для очистки поверхностей в различных производственных процессах;
- как очиститель инструмента и поверхностей от монтажной пены — в аэрозольных баллонах.
Без ацетона невозможно хранить в компактном (сжиженном и в баллоне) состоянии ацетилен, который под давлением в чистом виде крайне взрывоопасен. Для этого используют ёмкости с пористым материалом, пропитанные ацетоном. 1 литр ацетона растворяет до 250 литров ацетилена.
Ацетон используется также при экстракции многих растительных веществ.
Ацетон служит также сырьём для синтеза уксусного ангидрида, кетена, диацетонового спирта и многих других соединений.
Лабораторное применение
В органической химии ацетон применяется в качестве полярного апротонного растворителя, в частности, в реакции алкилирования
для окисления спиртов в присутствии алкоголятов алюминия по Оппенауэру
Ацетон применяется для приготовления охлаждающих бань в смеси с «сухим льдом» и жидким аммиаком (охлаждает до температуры −78 °C).
В лабораториях используется для мытья химической посуды благодаря низкой цене, малой токсичности, высокой летучести и лёгкой растворимости в воде, а также для быстрой сушки посуды и неорганических веществ.
Для очистки в лабораторных условиях ацетон перегоняют в присутствии небольшого количества перманганата калия (до слабо-розовой окраски раствора).
Обнаружение
В химико-токсикологическом анализе для обнаружения ацетона применяют реакции с растворами йода, нитропруссида натрия, фурфурола, ο-нитробензальдегида и метод микродиффузии.
Реакция на образование йодоформа.
При взаимодействии ацетона с раствором йода в щелочной среде образуется трииодметан (йодоформ):
К 1 мл исследуемого раствора прибавляют 1 мл 10%-го раствора аммиака и несколько капель раствора йода в йодиде калия (йодной настойки). В присутствии йода образуется желтый осадок трииодметана с характерным запахом, а его кристаллы имеют характерную гексалучевую форму. Предел обнаружения — 0,1 мг ацетона в пробе.
Реакция с нитропруссидом натрия.
Ацетон с нитропруссидом натрия в щелочной среде дает интенсивно-красную окраску. При подкислении уксусной кислотой окраска переходит в красно-фиолетовую. Кетоны, в молекулах которых отсутствуют метильные группы, непосредственно связанные с кетоновыми (СО—) группами, не дают такой реакции. Соответственно такие кетоны как метилэтилкетон, метилпропилкетон и другие — также дадут красную окраску с нитропруссидом.
К 1 мл исследуемого раствора прибавляют 1 мл 10%-го раствора гидроксида натрия и 5 капель 1%-го свежеприготовленного раствора нитропруссида натрия. При наличии ацетона в пробе появляется красная или оранжево-красная окраска. При прибавлении 10%-го раствора уксусной кислоты до кислой реакции через несколько минут окраска переходит в красно-фиолетовую или вишнёво-красную. Следует заметить, что бутанон дает аналогичную окраску с нитропруссидом натрия.
Пожароопасность
Одна из основных опасностей при работе с ацетоном — его легковоспламеняемость. Температура самовоспламенения +465 °C, температура вспышки −19 °C. Воздушные смеси, содержащие от 2,5 % до 12,8 % (по объёму) взрывоопасны. С этим необходимо считаться, так как ацетон быстро испаряется, и образующееся облако может распространиться до места воспламенения (нагрев или искра) вдали от места работы с ним.
Метаболизм и токсикология
Ацетон является естественным метаболитом, производимым организмами млекопитающих, в том числе и человеческим организмом. Некоторое количество вещества выводится с выдыхаемым воздухом и выделениями кожи, некоторое — с мочой. В медицине ацетон относят к кетоновым телам. Нарушение нормального метаболизма, например, при сахарном диабете, приводит к так называемой ацетонурии — избыточному образованию и выведению ацетона.
В крови в норме содержится 1-2 мг/100 мл ацетона, в суточном количестве мочи — 0,01-0,03 г. При нарушениях обмена веществ, например, при сахарном диабете, в моче и крови повышается содержание ацетона. Незначительная часть ацетона превращается в оксид углерода (IV), который выделяется с выдыхаемым воздухом. Некоторое количество ацетона выделяется из организма в неизменном виде с выдыхаемым воздухом и через кожу, а некоторое — с мочой.
Ацетон малотоксичен (класс опасности IV, категория безопасности для здоровья по NFPA — 1). Сильно раздражает слизистые оболочки: длительное вдыхание больших концентраций паров приводит к возникновению воспаления слизистых оболочек, отёку лёгких и токсической пневмонии. Пары оказывают слабое наркотическое действие, сопровождаемое, чаще всего, дисфорией. При попадании внутрь вызывает состояние опьянения, сопровождаемое слабостью и головокружением, нередко — болями в животе; в существенных количествах возникает выраженная интоксикация, хотя, как правило, отравления ацетоном не смертельны. Возможно поражение печени (токсический гепатит), почек (уменьшение диуреза, появление крови и белка в моче) и коматозное состояние. При ингаляционном воздействии ацетон выводится гораздо медленнее (в течение нескольких часов), чем поступает, и поэтому может накапливаться в организме.
Примечания
- ↑ 1 2 Химическая энциклопедия. — М: Советская энциклопедия, 1988. — Т. 1. — С. 230. — 625 с.
- ↑ Постановление Правительства РФ № 681 от 30 июня 1998 г.
- ↑ 1 2 Рабинович В. А., Хавин З. Я. Краткий химический справочник: Справ. изд. / Под ред. Потехина А. А., Ефимова А. И.. — Издание 3-е, переработанное и дополненное. — Л.:: Химия, 1991. — С. 328-329. — 432 с. — ISBN 5-7245-0703-X.
- ↑ 1 2 3 Lewis R.J. Sax's Dangerous Properties of Industrial Materials. — 11ed.. — Wiley-interscience, 2004. — С. 22-23.
- ↑ 1 2 http://www.newchemistry.ru/printletter.php?n_id=4886 ПРОИЗВОДСТВО АЦЕТОНА: получение, применение, рынок по данным АКПР (Академии конъюнктуры промышленных рынков)
- ↑ Химическая энциклопедия. М. 1988, Т1, стр. 230
- ↑ http://kodomo.cmm.msu.ru/~ramil.mintaev/projects/C.acetobutylicum/index.php Ацито-бутановая бактерия
- ↑ Ацетон // Фотокинотехника: Энциклопедия / Главный редактор Е. А. Иофис. — М.: Советская энциклопедия, 1981.
- ↑ 1 2 Крамаренко В. Ф. Токсикологическая химия. — К.: Выща шк. Головное изд-во, 1989. — С. 146-149. — 447 с. — ISBN 5-11-000148-0.
Ссылки
- Ацетон // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907.
- Ацетонемия // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907.
- Ацетоновая кислота // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907.
- ГОСТ 2768-84. Ацетон технический. Технические условия.
| ||||||||||||
| ||||||||||||
| Фарнезилпирофосфат · Сквален · 2,3-Оксидосквален · Ланостерол Ланостерол · Латостерол · 7-Дегидрохолестерол · Холестерин Ланостерол · Зимостерол · 7-Дегидродесмостерол · Десмостерол · Холестерин | ||||||||||||
| ||||||||||||
| ||||||||||||
| см. также ферменты, заболевания | ||||||||||||
Ацетон Информация о
АцетонАцетонАцетон Информация Видео
Ацетон Просмотр темы.Ацетон что, Ацетон кто, Ацетон объяснение
There are excerpts from wikipedia on this article and video
www.turkaramamotoru.com
формула, особенности свойств, применение :: SYL.ru
Что собой представляет ацетон? Формула этого кетона рассматривается в школьном курсе химии. Но далеко не все имеют представление о том, как опасен запах данного соединения и какими свойствами обладает это органическое вещество.

Особенности ацетона
Ацетон технический является самым распространенным растворителем, применяемым в современном строительстве. Так как данное соединение имеет невысокий уровень токсичности, его также применяют в фармацевтической и пищевой промышленности.
Ацетон технический используется в качестве химического сырья при производстве многочисленных органических соединений.
Медики считают его наркотическим веществом. При вдыхании концентрированных паров ацетона возможно серьезное отравление и поражение центральной нервной системы. Данное соединение представляет серьезную угрозу для подрастающего поколения. Токсикоманы, которые используют пары ацетона для того, чтобы вызвать состоянием эйфории, сильно рискуют. Медики опасаются не только за физическое здоровье детей, но и за их психическое состояние.
Смертельной считается доза от 60 мл. При попадании в организм значительного количества кетона наступает потеря сознания, а через 8-12 часов - смерть.

Физические свойства
Данное соединение при нормальных условиях находится в жидком состоянии, не имеет цвета, обладает специфическим запахом. Ацетон, формула которого имеет вид СН3СНОСН3, обладает гигроскопическими свойствами. Данное соединение в неограниченных количествах смешивается с водой, этиловым спиртом, метанолом, хлороформом. У него невысокая температура плавления.
Особенности использования
В настоящее время область применения ацетона достаточно широка. Его по праву считают одним из самых востребованных продуктов, применяемых при создании и производстве лакокрасочных материалов, в отделочных работах, химической промышленности, строительстве. Все в большем количестве ацетон применяют для обезжиривания меха и шерсти, удаления из смазочных масел воска. Именно этим органическим веществом пользуются маляры и штукатуры в своей профессиональной деятельности.
Как сохранить ацетон, формула которого СН3СОСН3? Для того чтобы защитить это летучее вещество от негативного воздействия ультрафиолетовых лучей, его помещают в пластиковые, стеклянные, металлические флаконы подальше от УФ.
Помещение, где предполагается размещение существенного количества ацетона, необходимо систематически проветривать и установить качественную вентиляцию.

Особенности химических свойств
Название данное соединение получило от латинского слова «ацетум», означающее в переводе «уксус». Дело в том, что химическая формула ацетона C3H6O появилась гораздо позже, чем было синтезировано само вещество. Его получали из ацетатов, а затем использовали для изготовления ледяной синтетической уксусной кислоты.
Первооткрывателем соединения считают Андреаса Либавиуса. В конце XVI века путем сухой перегонки ацетата свинца ему удалось получить вещество, химический состав которого был расшифрован только в 30-х годах XIX века.
Ацетон, формула которого СН3СОСН3, до начала XX века получали путем коксования древесины. После повышения спроса во время Первой мировой войны на это органическое соединение, стали появляться новые способы синтеза.
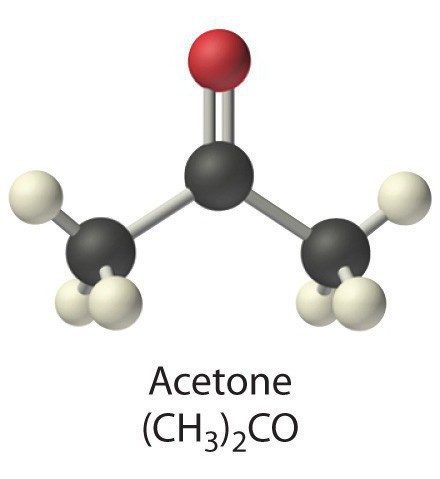
Ацетон (ГОСТ 2768-84) является технической жидкостью. По химической активности данное соединение является одним из самых реакционноспособных в классе кетонов. Под воздействием щелочей наблюдается адольная конденсация, в результате которой образуется диацетоновый спирт.
При пиролизе из него получают кетен. В реакции с циановодородом образуется ацетонцианидангидрин. Для пропанона характерно замещение атомов водорода на галогены, происходящее при повышенной температуре (либо в присутствии катализатора).
Способы получения
В настоящее время основное количество кислородсодержащего соединения получают из пропена. Технический ацетон (ГОСТ 2768-84) должен обладать определенными физическими и эксплуатационными характеристиками.
Кумольный способ состоит из трех стадий и предполагает производство ацетона из бензола. Сначала путем его алкилирования с пропеном получают кумол, затем окисляют полученный продукт до гидропероксида и расщепляют его под воздействием серной кислоты до ацетона и фенола.
Кроме того, это карбонильное соединение получают при каталитическом окислении изопропанола при температуре около 600 градусов по Цельсия. В качестве ускорителей процесса выступают металлическое серебро, медь, платина, никель.
Среди классических технологий производства ацетона особый интерес представляет реакция прямого окисления пропена. Данный процесс осуществляется при повышенном давлении и присутствии в качестве катализатора хлорида двухвалентного палладия.
Также можно получить ацетон путем брожения крахмала под воздействием бактерий Clostridium acetobutylicum. Кроме кетона среди продуктов реакции будет присутствовать бутанол. Среди недостатков этого варианта получения ацетона отметим несущественный процентный выход.
Заключение
Пропанон является типичным представителем карбонильных соединений. Потребители знакомы с ним как с растворителем и обезжиривателем. Он незаменим при изготовлении лаков, лекарственных препаратов, взрывчатых веществ. Именно ацетон входит в состав клея для кинопленки, является средством для очистки поверхностей от монтажной пены и суперклея, средством промывки инжекторных двигателей и способом повышения октанового числа горючего, и т.п.
www.syl.ru
Основные свойства ацетона и сфера его применения
Что представляет собой ацетон?
Ацетон является одним из простейших представителей кетонов и представляет собой жидкость с достаточно резким запахом, которая не имеет цвета, отличается высокими показателями летучести и легкоподвижности. Ацетон легко смешивается с большинством растворителей органической природы и водой, с легкостью растворяет воск, резину, нитроцеллюлозу, ацетилцеллюлозу и другие органические вещества, а также иодид калия, хлорид кальция и ряд солей. Стоит также отметить, что ацетон может производиться человеческим организмом.
Как правило, ацетон смешивается с водой и растворителями органической природы в любых количествах. Вещество может смешиваться с этанолом, метанолом, эфирами (с простыми и сложными).
Температура плавления вещества составляет -95,35 градусов по Цельсию, температура кипения, в свою очередь - 56,24 градуса по Цельсию. Стоит отметить, что температура кипения ацетона несколько ниже, чем метилэтилектона.
В производстве ацетон в чистом виде применяется не так часто: основная проблема состоит в повышенной испаряемости этого вещества, которая приводит к существенным потерям. Зачастую состав этого растворителя в ходе производственного применения изменяется с целью изменения его некоторых свойств.
Температура самовоспламенения ацетона составляет 465 градусов по Цельсию. Температура вспышки ацетона в воздухе - -18 градусов. Теплота сгорания данного вещества - 1829,4кДж/моль.
Применение ацетона
Ацетон зачастую используется в производстве в качестве растворителя. Это вещество позволяет справляться с задачами обезжиривания поверхностей, растворения хлоркаучука, полиакрилатов, сополимеров винилхлорида, эпоксидных смол, полистирола, масел, природных смол, различных органических веществ. Именно ацетон используется с целью растворения ацетатов целлюлозы и нитратов.
В пищевой промышленности ацетон также нашел свое применение: в сравнении со многими растворителями он не обладает сильной токсичностью. В фармацевтической промышленности ацетон используется в виде основного сырья для синтеза ацетонциангидрина, метилметакрилата, дифенилопропана, изофорна, окиси мезитила, кетона, уксусного ангидрида, диацетонового спирта, метилизобутилкетона, а также большого числа иных соединений.
Данное вещество входит в состав растворителей смесевого типа: Р-648, Р-647, Р-646, Р-5 и Р-5А, Р-4 и Р-4А и пр. Нередко ацетон используется с целью растворения хлоркаучука, полиакрилатов, полистирола, диацетата целлюлозы, масел и природных смол.
Ацетон часто становится средством для обезжиривания поверхностей. В чистом виде это вещество может быть использовано для растворения Винэп ЭП-438, ЭП-437, ХС-510, эмалей ХС-436, Эвинал-28, Эвинал-21, грунтовок ЭП-0263, ЭП-0199, различных лаков и др.
Что можно сказать об относительной плотности ацетона?
Относительная плотность ацетона по отношению к воде (вода равна 1) составляет 0,8. Плотность смеси пар-воздух при температуре в 20 градусов по Цельсию (воздух равен 1) относительно воздуха - 1,2. Относительная плотность паров ацетона (если воздух равен 1) составляет 2,0
Еще несколько интересных фактов об ацетоне
Помимо того, что ацетон активно используется сегодня в процессе синтеза эпоксидных смол, полиуретанов и поликарбонатов, он также применяется в промышленном производстве для создания лекарственных препаратов, лаков и даже некоторых взрывчатых веществ.
В качестве растворителя ацетата целлюлозы ацетон присутствует с составе специального клея, используемого для кинопленок.
Кроме того, ацетон активно применяется для хранения ацетилена, поскольку последний обладает повышенной взрывоопасностью и не может храниться в чистом виде под давлением. Ацетилен погружают в специальные емкости, в которых присутствует материал с пористой структурой, полностью пропитанной ацетоном.
freezante.ru
Ацетон - это... Что такое Ацетон?
Ацето́н (диметилкето́н, систематическое наименование: пропан-2-о́н) — простейший представитель кетонов. Формула: Ch4-C(O)-Ch4. Бесцветная легкоподвижная летучая жидкость с характерным запахом. Полностью смешивается с водой и большинством органических растворителей. Ацетон хорошо растворяет многие органические вещества (ацетилцеллюлозу и нитроцеллюлозу, воск, резину и др.), а также ряд солей (хлорид кальция, иодид калия). Является одним из метаболитов, производимых человеческим организмом.
Получение
Мировое производство ацетона составляет более 6,9 миллионов тонн в год (по данным на 2012 г.[1]) и устойчиво растёт.[1]
В промышленности
В промышленности получается напрямую или косвенно из пропена.
Основную часть ацетона получают как сопродукт при получении фенола из бензола по кумольному способу, заключающемуся в следующих трёх этапах:[2]
- Бензол алкилируется пропеном с получением кумолаC6H6+ Ch4CH=Ch3 → C6H5CH(Ch4)2
Следующие два этапа известны как реакция Удриса-Сергеева
- Полученный кумол окисляется кислородом воздуха до гидропероксидаC6H5CH(Ch4)2 + O2 → C6H5C(OOH)(Ch4)2
- Гидропероксид разлагается в присутствии серной кислоты на фенол и ацетонC6H5C(OOH)(Ch4)2 → C6H5OH + OC(Ch4)2
Прямым окислением пропена в жидкой фазе в присутствии PdCl2 в среде растворов солей Pd, Cu, Fe при температуре 50-120 °C и давлении 50-100 атм:
Ch4CH=Ch3 + PdCl2 + h3O → Ch4C(O)Ch4 + Pd + 2HCl
Pd+2HCl + 0.5O2 → PdCl2 + h3O
Некоторое значение имеет метод брожения крахмала под действием бактерий Clostridium acetobutylicum с образованием ацетона и бутанола[3]. Метод характеризуется малыми выходами. Используются также методы получения из изопропилового спирта и ацетилена.
Химические свойства
Ацетон является одним из наиболее реакционноспособных кетонов. Так, он один из немногих кетонов образует бисульфитное соединение
Ch4C(O)Ch4 + NaHSO3 → (Ch4)2C(OH)-SO3Na
Вступает в альдольную самоконденсацию под действием щелочей, с образованием диацетонового спирта.
2Ch4C(O)Ch4 → (Ch4)2C(OH)Ch3C(O)Ch4
Восстанавливается цинком до пинакон.
2Ch4C(O)Ch4 + Zn → (Ch4)2C(OH)C(OH)(Ch4)2
При пиролизе (700 °C) образует кетен.
Ch4C(O)Ch4 → Ch3=C=O + 2h3
Легко присоединяет циановодород с образованием ацетонциангидрина.
Ch4C(O)Ch4 + HCN → (Ch4)2C(OH)CN
Атомы водорода в ацетоне легко замещаются на галогены. Под действием хлора (иода) в присутствии щёлочи образует хлороформ (йодоформ).
Ацетон, как и другие кетоны, в щелочной среде способен изомерироваться в пропаналь, последний — до пропенового спирта. В кислой среде и в присутствии ионов двухвалентной ртути, пропеновый спирт изомерируется сразу в ацетон. Между этими веществами всегда существует таутомерное равновесие:
Ch4C(O)Ch4 ↔ С2Н5СОН ↔ СН2=С(ОН)-СН3

 Диметилкетон
Диметилкетон Биохимия
В крови в норме содержится 1-2 мг/100 мл ацетона, в суточном количестве мочи — 0,01-0,03 г. При нарушениях обмена веществ, например, при сахарном диабете, в моче и крови повышается содержание ацетона. Незначительная часть ацетона превращается в оксид углерода (IV), который выделяется с выдыхаемым воздухом. Некоторое количество ацетона выделяется из организма в неизменном виде с выдыхаемым воздухом и через кожу, а некоторое — с мочой.
Применение
Ацетон применяется как сырьё для синтеза многих важных химических продуктов, таких как уксусный ангидрид, кетен, диацетоновый спирт, окись мезитила, метилизобутилкетон, метилметакрилат, дифенилпропан, изофорон, бисфенол А и др.; пример:
(Ch4)2CO + 2 C6H5OH → (Ch4)2C(C6h5OH)2 + h3O.Последний широко применяется при синтезе поликарбонатов, полиуретанов и эпоксидных смол.
Ацетон также является популярным растворителем, значительно превосходящим в плане безопасности бензин, скипидар и отчасти керосин. В частности как растворитель используется он:
Без ацетона невозможно хранить в компактном (сжиженном и в баллоне) состоянии ацетилен, который не может храниться под давлением в чистом виде из-за опасности взрыва. Для этого используют ёмкости с пористым материалом, пропитанные ацетоном. 1 литр ацетона растворяет до 250 литров ацетилена.
Лабораторное применение
В органической химии ацетон применяется в качестве полярного апротонного растворителя, в частности в реакции алкилирования
ArOH + RHal + K2CO3 → ArOR + KHal + KHCO3,для окисления спиртов в присутствии алкоголятов алюминия по Оппенауэру
RR`CHOH + Ch4C(O)Ch4 → RR`C=O + Ch4CH(OH)Ch4,Также незаменим для приготовления охлаждающих бань в смеси с «сухим льдом» и жидким аммиаком (охлаждает до температуры −78 °C).
Очень полезен для мытья химической посуды, благодаря низкой цене, малой токсичности, высокой летучести и лёгкой растворимости в воде, а также для быстрой сушки посуды и неорганических веществ.
Для очистки в лабораторных условиях ацетон перегоняют в присутствии небольшого количества перманганата калия (до слабо-розовой окраски раствора).
Безопасность
Пожароопасность =
Одна из основных опасностей при работе с ацетоном — его легковоспламеняемость. Температура воспламенения +465 °C, температура замерзания ~+ −20 °C. Воздушные смеси, содержащие от 2,5 % до 12,8 % (по объёму) взрывоопасны. С этим необходимо считаться, так как ацетон быстро испаряется, и образующееся облако может распространиться до места воспламенения (нагрев или искра) вдали от места работы с ним.
Токсичность
Считается, что ацетон малотоксичен, также считается, что он не вызывает хронических болезней при использовании основных методов предосторожностей при работе с ним. Ацетон обладает возбуждающим и наркотическим действием (что особенно хорошо проявляется при хроническом воздействии на людей, часто работающих с ацетоном как с растворителем), поражает центральную нервную систему, способен накапливаться в организме[источник не указан 64 дня], в связи с чем токсическое действие зависит не только от его концентрации, но и от времени воздействия на организм. ЛД50 для мышей при вдыхании в течение 4-х часов — 44 г/м³. Для человека ЛД50 оценивается в 1,159 г/кг. ПДК 200 мг/м³.
Ацетон при высоких концентрациях (при более чем кратковременном воздействии) раздражает органы дыхания и вызывает жжение в глазах, при более длительном воздействии происходит кратковременный глазной отёк. Вероятно, способен вызывать головокружение, тошноту и дезориентацию при воздействии паров высоких концентраций.
Экология
Из-за высокой летучести, значительная часть ацетона испаряется в атмосферу, где период полураспада под действием ультрафиолета составляет 22 дня. ЛД50 для рыб 8,3 г/л в течение 96 часов, а период полураспада в данной среде от 1 до 10 суток. Ацетон может вызывать значительное понижение уровня кислорода в воде из-за потребления его микроорганизмами.[источник не указан 64 дня]
Однако ацетон в небольших концентрациях, быстро поглощается рядом бактерий, использующих его в качестве питательной среды.
Примечания
Ссылки
dic.academic.ru