Оксид серы в природе и жизни человека. So2 вода
Сернистый газ — физические свойства, получение и применение :: SYL.ru
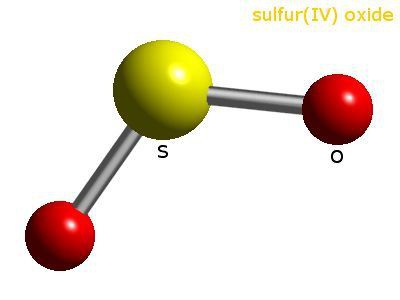
Сернистый газ имеет молекулярное строение, аналогичное озону. Атом серы, находящийся в центре молекулы, связан с двумя атомами кислорода. Этот газообразный продукт окисления серы не имеет цвета, издает резкий запах, при изменении условий легко конденсируется в прозрачную жидкость. Вещество хорошо растворимо в воде, обладает антисептическими свойствами. В больших количествах получают SO2 в химической промышленности, а именно в цикле сернокислотного производства. Газ широко используется для обработки сельскохозяйственных и пищевых продуктов, отбеливания тканей в текстильной промышленности.
Систематические и тривиальные названия вещества
Необходимо разобраться в многообразии терминов, относящихся к одному и тому же соединению. Официальное название соединения, химический состав которого отражает формула SO2, — диоксид серы. ИЮПАК рекомендует использовать этот термин и его английский аналог — Sulfur dioxide. Учебники для школ и ВУЗов чаще упоминают еще такое название — оксид серы (IV). Римской цифрой в скобках обозначена валентность атома S. Кислород в этом оксиде двухвалентен, а окислительное число серы +4. В технической литературе используются такие устаревшие термины, как сернистый газ, ангидрид сернистой кислоты (продукт ее дегидратации).
Состав и особенности молекулярного строения SO2
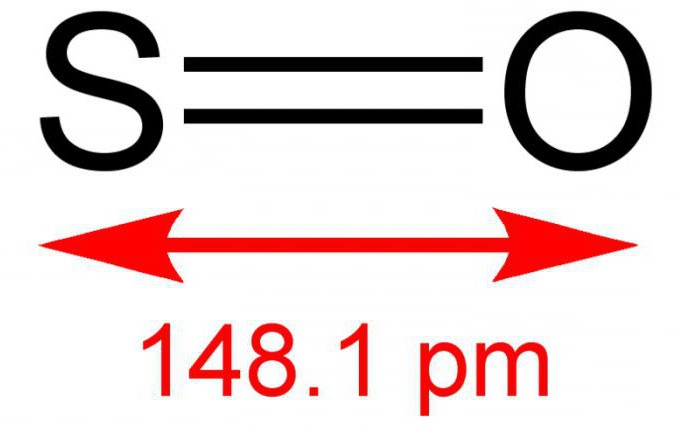
Молекула SO2 образована одним атомом серы и двумя атомами кислорода. Между ковалентными связями имеется угол, составляющий 120°. В атоме серы происходит sp2-гибридизация — выравниваются по форме и энергии облака одного s и двух p-электронов. Именно они участвуют в образовании ковалентной связи между серой и кислородом. В паре О—S расстояние между атомами составляет 0,143 нм. Кислород более электроотрицательный элемент, чем сера, значит, связывающие пары электронов смещаются от центра к внешним углам. Вся молекула тоже поляризована, отрицательный полюс — атомы О, положительный — атом S.
Некоторые физические параметры диоксида серы
Оксид четырехвалентной серы при обычных показателях окружающей среды сохраняет газообразное агрегатное состояние. Формула сернистого газа позволяет определить его относительную молекулярную и молярную массы: Mr(SO2) = 64,066, М = 64,066 г/моль (можно округлять до 64 г/моль). Этот газ почти в 2,3 раза тяжелее воздуха (М(возд.) = 29 г/моль). Диоксид обладает резким специфическим запахом горящей серы, который трудно перепутать с каким-либо другим. Он неприятный, раздражает слизистые покровы глаз, вызывает кашель. Но оксид серы (IV) не такой ядовитый, как сероводород.
Под давлением при комнатной температуре газообразный сернистый ангидрид сжижается. При низких температурах вещество находится в твердом состоянии, плавится при –72…–75,5 °C. При дальнейшем повышении температуры появляется жидкость, а при –10,1 °C вновь образуется газ. Молекулы SO2 являются термически устойчивыми, разложение на атомарную серу и молекулярный кислород происходит при очень высоких температурах (около 2800 ºС).

Растворимость и взаимодействие с водой
Диоксид серы при растворении в воде частично взаимодействует с ней с образованием очень слабой сернистой кислоты. В момент получения она тут же разлагается на ангидрид и воду: SO2 + Н2О ↔ Н2SO3. На самом деле в растворе присутствует не сернистая кислота, а гидратированные молекулы SO2. Газообразный диоксид лучше взаимодействует с прохладной водой, его растворимость понижается с повышением температуры. При обычных условиях может раствориться в 1 объеме воды до 40 объемов газа.
Сернистый газ в природе
Значительные объемы диоксида серы выделяются с вулканическими газами и лавой во время извержений. Многие виды антропогенной деятельности тоже приводят к повышению концентрации SO2 в атмосфере.

Сернистый ангидрид поставляют в воздух металлургические комбинаты, где не улавливаются отходящие газы при обжиге руды. Многие виды топливных ископаемых содержат серу, в результате значительные объемы диоксида серы выделяется в атмосферный воздух при сжигании угля, нефти, газа, полученного из них горючего. Сернистый ангидрид становится токсичным для человека при концентрации в воздухе свыше 0,03 %. У человека начинается одышка, могут наступить явления, напоминающие бронхит и воспаление легких. Очень высокая концентрация в атмосфере диоксида серы может привести к сильному отравлению или летальному исходу.
Сернистый газ — получение в лаборатории и в промышленности
Лабораторные способы:
- При сжигании серы в колбе с кислородом или воздухом получается диоксид по формуле: S + O2 = SO2.
- Можно подействовать на соли сернистой кислоты более сильными неорганическими кислотами, лучше взять соляную, но можно разбавленную серную:
- Na2SO3 + 2HCl = 2NaCl + h3SO3;
- Na2SO3 + h3SO4 (разб.) = Na2SO4 + h3SO3;
- h3SO3 = Н2О + SO2↑.
3. При взаимодействии меди с концентрированной серной кислотой выделяется не водород, а диоксид серы:
2h3SO4 (конц.) + Cu = CuSO4 + 2h3O + SO2↑.
Современные способы промышленного производства сернистого ангидрида:
- Окисления природной серы при ее сжигании в специальных топках: S + О2 = SO2.
- Обжиг железного колчедана (пирита).
Основные химические свойства диоксида серы
Сернистый газ является активным соединением в химическом плане. В окислительно-восстановительных процессах это вещество чаще выступает в качестве восстановителя. Например, при взаимодействии молекулярного брома с диоксидом серы продуктами реакции являются серная кислота и бромоводород. Окислительные свойства SO2 проявляются, если пропускать этот газ через сероводородную воду. В результате выделяется сера, происходит самоокисление-самовосстановление: SO2 + 2h3S = 3S + 2h3O.
Диоксид серы проявляет кислотные свойства. Ему соответствует одна из самых слабых и неустойчивых кислот — сернистая. Это соединение в чистом виде не существует, обнаружить кислотные свойства раствора диоксида серы можно с помощью индикаторов (лакмус розовеет). Сернистая кислота дает средние соли - сульфиты и кислые — гидросульфиты. Среди них встречаются стабильные соединения.
Процесс окисления серы в диоксиде до шестивалентного состояния в ангидриде серной кислоты — каталитический. Получившееся вещество энергично растворяется в воде, реагирует с молекулами Н2О. Реакция является экзотермической, образуется серная кислота, вернее, ее гидратированная форма.
Практическое использование сернистого газа
Основной способ промышленного производства серной кислоты, для которого нужен диоксид элемента, насчитывает четыре стадии:
- Получение сернистого ангидрида при сжигании серы в особых печах.
- Очищение полученного диоксида серы от всевозможных примесей.
- Дальнейшее окисление до шестивалентной серы в присутствии катализатора.
- Абсорбция триоксида серы водой.
Ранее почти всю двуокись серы, необходимую для производства серной кислоты в промышленных масштабах, получали при обжиге пирита как побочный продукт сталеплавильного производства. Новые виды переработки металлургического сырья меньше используют сжигание руды. Поэтому основным исходным веществом для сернокислотного производства в последние годы стала природная сера. Значительные мировые запасы этого сырья, его доступность позволяют организовать широкомасштабную переработку.

Диоксид серы находит широкое применение не только в химической промышленности, но и в других отраслях экономики. Текстильные комбинаты используют это вещество и продукты его химического взаимодействия для отбеливания шелковых и шерстяных тканей. Это один из видов бесхлорного отбеливания, при котором волокна не разрушаются.
Диоксид серы обладает отличными дезинфицирующими свойствами, что находит применение в борьбе с грибками и бактериями. Сернистым ангидридом окуривают хранилища сельскохозяйственной продукции, винные бочки и подвалы. Используется SO2 в пищевой промышленности как консервирующее и антибактериальное вещество. Добавляют его в сиропы, вымачивают в нем свежие плоды. Сульфитизация сока сахарной свеклы обесцвечивает и обеззараживает сырье. Консервированные овощные пюре и соки тоже содержат диоксид серы в качестве антиокислительного и консервирующего агента.
www.syl.ru
Оксид серы в природе и жизни человека :: SYL.ru
В этой статье вы найдете информацию о том, что такое оксид серы. Будут рассмотрены его основные свойства химического и физического характера, существующие формы, способы их получения и отличия между собой. А также будут упомянуты области применения и биологическая роль данного оксида в его разнообразных формах.
Что представляет собой вещество
Оксид серы – это соединение простых веществ, серы и кислорода. Существует три формы оксидов серы, отличающиеся между собой степенью проявленной валентности S, а именно: SO (монооксид, моноокись серы), SO2 (серный диоксид или сернистый газ) и SO3 (триоксид или ангидрид серы). Все перечисленные вариации оксидов серы имеют схожие как химические, так и физические характеристики.

Общие данные о моноокисиде серы
Двухвалентный серный монооксид, или иначе серная моноокись – это неорганическое вещество, состоящее из двух простых элементов - серы и кислорода. Формула – SO. В условиях нормальной обстановки является газом без цвета, но с резким и специфическим запахом. Вступает в реакции с водным раствором. Довольно редкое соединение в земной атмосфере. К воздействию температур неустойчив, существует в димерной форме – S2O2. Иногда способен, взаимодействуя с кислородом, в результате реакции образовывать диоксид серы. Солей не образует.
Получают оксид серы (2) обычно при помощи сжигания серы или разложении ее ангидрида:
- 2S2+O2 =2SO;
- 2SO2 = 2SO+O2.
В воде вещество растворяется. В результате оксид серы образует тиосерную кислоту:
Общие данные о сернистом газе
Оксид серы – очередная форма оксидов серы с химической формулой SO2. Имеет неприятный специфический запах и не имеет цвета. Подвергаясь давлению, может зажигаться при комнатной температуре. При растворении в воде образует нестойкую сернистую кислоту. Может растворяться в растворах этанола и серной кислоты. Является компонентом вулканического газа.
В промышленности получают сжиганием серы или обжигом ее сульфидов:
В лабораториях, как правило, SO2 получают при помощи сульфитов и гидросульфитов, подвергая их воздействию сильной кислоты, а также воздействию на металлы с маленькой степенью активности концентрированной h3SO4.
Как и другие серные оксиды, SO2 является кислотным оксидом. Взаимодействуя со щелочами, образуя различные сульфиты, вступает в реакции с водой, создавая серную кислоту.
SO2 чрезвычайно активен, и это ярко выражается в его восстановительных свойствах, где окислительная степень оксида серы возрастает. Может проявлять свойства окислителя, если на него воздействует сильный восстановитель. Последнюю характерную особенность используют для производства фосфорноватистой кислоты, или для отделения S от газов металлургической области деятельности.
Оксид серы (4) широко используется человеком для получения сернистой кислоты или ее солей – это его основная область применения. А также он участвует в процессах виноделия и выступает там в роли консерванта (E220), иногда им протравливают овощехранилища и склады, так как он уничтожает микроорганизмы. Материалы, которые нельзя подвергать отбеливанию хлором, обрабатывают оксидом серы.

SO2 - довольно токсичное соединение. Характерные симптомы, указывающие на отравление им, - это откашливание, появление проблем с дыханием, как правило, в виде насморка, охриплости, появление необычного привкуса и першение в горле. Вдыхание такого газа может вызвать удушье, нарушение речевой способности индивида, рвоту, затруднение процесса глотания, а также легочный отек в острой форме. Максимально допустимой концентрацией этого вещества в рабочем помещении является 10мг/м3. Однако у различных людей организм может проявлять и разную чувствительность к сернистому газу.
Общие данные о серном ангидриде
Серный газ, или, как его называют, серный ангидрид, – это высший оксид серы с химической формулой SO3. Жидкость с удушливым запахом, легколетучая при стандартных условиях. Способна застывать, образовывая смеси кристаллического типа из его твердых модификаций, при температуре от 16.9 °C и ниже.
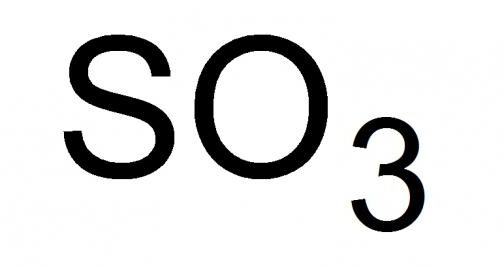
Детальный разбор высшего оксида
При окислении SO2 воздухом под воздействием высоких температур, необходимым условием является наличие катализатора, например V2O5, Fe2O3, NaVO3 или Pt.
Термическое разложение сульфатов либо взаимодействие озона и SO2:
- Fe2(SO4)3 = Fe2O3+3SO3;
- SO2+O3 = SO3+O2.
Окисление SO2 при помощи NO2:
К физическим качественным характеристикам относятся: наличие в состоянии газа плоского строения, тригонального типа и D3h симметрии, во время перехода от газа к кристаллу или жидкости образует тример циклического характера и зигзагообразную цепь, имеет ковалентную полярную связь.
В твердой форме SO3 встречается в альфа, бета, гамма и сигма формах, при этом он имеет, соответственно, разную температуру плавления, степень проявления полимеризации и разнообразную кристаллическую форму. Существование такого количества видов SO3 обусловлено образованием связей донорно-акцепторного типа.
К свойствам ангидрида серы можно отнести множество его качеств, основными из них являются:
Способность взаимодействовать с основаниями и оксидами:
- 2KHO+SO3 = K2SO4+h3O;
- CaO+SO3 = CaSO4.
Высший серный оксид SO3 имеет достаточно большую активность и создает серную кислоту, взаимодействуя с водой:
Вступает в реакции взаимодействия с хлороводородом и образует хлоросульфатную кислоту:
Для оксида серы характерным является проявление сильных окислительных свойств.
Применение серный ангидрид находит в создании серной кислоты. Небольшое его количество выделяется в окружающую среду во время использования серных шашек. SO3, образуя серную кислоту после взаимодействия с влажной поверхностью, уничтожает разнообразные опасные организмы, например грибки.
Подводя итоги
Оксид серы может находиться в разных агрегатных состояниях, начиная с жидкости и заканчивая твердой формой. В природе встречается редко, а способов его получения в промышленности довольно много, как и сфер, где его можно использовать. Сам оксид имеет три формы, в которых он проявляет различную степень валентности. Может быть очень токсичным и вызывать серьезные проблемы со здоровьем.
www.syl.ru
Соединения серы (IV)
SO2 - оксид серы (IV). Физические свойства.
SO2 - диоксид серы, сернистый газ, сернистый ангидрид. При обычной температуре - бесцветный газ с резким запахом, хорошо растворим в воде (в 1 л воды при 20°С растворяется - 40 л SO2).
Способы получения
1. Окисление кислородом серы, сероводорода, сульфидов
2. Термическое разложение сульфитов
CaSO3 = СаО + SO2↑
3.Действие сильных кислот на сульфиты
Na2SO3 + 2HCl = SO2 + Н2O + 2NaCI
4.Взаимодействие конц. h3SO4 с восстановителями, например:
2h3SO4 + Си = SO2↑ + CuSO4 + 2Н2O
Химические свойства
При растворении SO2 в воде происходит его частичное соединение с молекулами воды - об разуется слабая сернистая кислота.
SO2 + СаО = CaSO3 сульфит кальция
SO2 + NaOH = NaHSO3 гидросульфит натрия
SO2 + 2NaOH = Н2O + Na2SO3 сульфит натрия
Диоксид серы окисляется в газовой фазе до SO3:
2SO2 + O2 = SO3
SO2 + O3 = SO3+ O2
SO2+ NO2 = SO3 + NO
На свету легко окисляется хлором:
SO2 + Cl2 — SO2Cl2 хлористый сульфурил
В водных растворах при окислении SO2 образуется серная кислота h3SO4:
SO2 + 2HNO3 = h3SO4 + 2NO2
SO2 + Н2O2 = h3SO4
Обесцвечивание окрашенных окислителей (КМпO4 и Вr2) - качественная реакция для распознавания SO2 (например, отличие его от СO2, СО, СН4 и многих других газов):
SO2 + Вr2 + 2Н2О = h3SO4 + 2НВr
3SO2 + 2КМпO4 + 4Н2О = 3h3SO4 + 2MnO2↓ + 2КОН
Продуктом восстановления SO2 чаще всего является свободная сера.
SO2 + 2Н2S = 3S↓ + 2Н2О
SO2 + 2СО = S + 2CO2
h3SO3 - сернистая кислота
В свободном состоянии не выделена. Очень непрочное соединение. Образуется при растворении SO2 в воде. Обладает свойствами слабой кислоты.
Сульфиты и гидросульфиты
2-х основная сернистая кислота образует при взаимодействии со щелочами 2 ряда солей: нормальные (средние) - сульфиты Mex(SO3)y и кислые - гидросульфиты Me(HSO3)x.
Сульфиты щелочных Me и аммония растворимы в воде. Сульфиты остальных Me нерастворимы в воде (или не существуют).
Гидросульфиты Me хорошо растворимы в Н2O, некоторые из них существуют только в растворе, например, Ca(HSO3)2.
Водные растворы сульфитов вследствие гидролиза имеют щелочную среду (окрашивают лакмус в синий цвет).
SO3- + Н2O = HSO3- + ОН-
Na2SO3 + Н2O = NaHSO3 + NaOH
Химические свойства сульфитов
1. Взаимодействие с сильными кислотами:
Na2SO3 + 2HCl = 2NaCl + SO2↑ + Н2O
NaHSO3 + HCl = NaCl + SO2↑ + Н2O
Оба типа солей разлагаются сильными кислотами, при этом слабая сернистая кислота вытесняется в виде SO2 и Н2O.
2. Термическое разложение сульфитов:
CaSO3 = СаО + SO2↑
3. Нормальные сульфиты в водных растворах, содержащих избыток SO2, превращаются в гидросульфиты
CaSO3 + SO2 + Н2O = Ca(HSO3)sub>2
Благодаря этой реакции нерастворимые в воде сульфиты превращаются в растворимые гидросульфиты
4. Ионно-обменные реакции с другими солями, приводящие к образованию нерастворимых сульфитов:
Na2SO3 + ZnCl2 = ZnSO3↓ + 2NaCl
I. Сульфиты как восстановители.
Сульфиты, подобно SO2, могут быть и восстановителями, и окислителями, поскольку атомы серы в анионах SO3 находятся в промежуточной С.О. +4
В водных растворах и сульфиты, и гидросульфиты легко окисляются до сульфатов. Примеры реакций:
Na2SO3 + Вr2 + Н2O = Na2SO4 + 2НВr
5K2SO3 + 2КМпO4 + 3h3SO4 = 6K2SO4 + 2MnSO4 + 3Н2O
Даже твердые сульфиты при хранении на воздухе медленно окисляются до сульфатов:
2Na2SO3 + O2 = 2Na2SO4
II. Сульфиты как окислители.
Эти реакции не столь многочисленны. При нагревании сухих сульфитов с такими активными восстановителями, как С, Mg, Al, Zn, они переходят в сульфиды:
Na2SO3 + ЗС = Na2S + ЗСО
III. Диспропорционирование сухих сульфитов.
При нагревании до высоких температур сульфиты медленно превращаются в смесь сульфатов и сульфидов:
4K2SO3 = 3K2SO4 + K2S
examchemistry.com
оксид серы(IV) и три типа реакций
Оксид серы(IV) обладает кислотными свойствами, которые проявляются в реакциях с веществами, проявляющими основные свойства. Кислотные свойства проявляются при взаимодействии с водой. При этом образуется раствор сернистой кислоты:
SO2 + h3O=h3SO3
Степень окисления серы в сернистом газе (+4) обусловливает восстановительные и окислительные свойства сернистого газа:
вос-тель: S+4 – 2e => S+6
ок-тель: S+4 + 4e => S0
Восстановительные свойства проявляются в реакциях с сильными окислителями: кислородом, галогенами, азотной кислотой, перманганатом калия и другими. Например:
2SO2 + O2 = 2SO3
S+4 – 2e => S+6 2
O20 + 4e => 2O-2 1
С сильными восстановителями газ проявляет окислительные свойств. Например, если смешать сернистый газ и сероводород, то они взаимодействуют при обычных условиях:
2h3S + SO2 = 3S + 2h3O
S-2 – 2e => S0 2
S+4 + 4e => S0 1
Сернистая кислота существует только в растворе. Она неустойчива и разлагается на сернистый газ и воду. Сернистая кислота не относится к сильным кислотам. Она является кислотой средней силы и диссоциирует ступенчато. При добавлении к сернистой кислоте щёлочи образуются соли. Сернистая кислота даёт два ряда солей: средние – сульфиты и кислые – гидросульфиты.
Оксид серы(VI)
Триоксид серы проявляется кислотные свойства. Он бурно реагирует с водой, при этом выделяется большое количество теплоты. Эту реакцию используют для получения важнейшего продукта химической промышленности – серной кислоты.
SO3 + h3O = h3SO4
Поскольку сера в триоксиде серы имеет высшую степень окисления, то оксид серы(VI) проявляет окислительные свойства. Например, он окисляет галогениды, неметаллы с низкой электроотрицательностью:
2SO3 + C = 2SO2 + CO2
S+6 + 2e => S+4 2
C0 – 4e => C+4 2
Серная кислота вступает в реакции трёх типов: кислотно-основные, ионообменные, окислительно-восстановительные. Так же активно она взаимодействует с органическими веществами.
Кислотно-основные реакции
Серная кислота проявляет кислотные свойства в реакциях с основаниями и основными оксидами. Эти реакции лучше проводить с разбавленной серной кислотой. Поскольку серная кислота является двухосновной, то она может образовывать как средние соли (сульфаты), так и кислые (гидросульфаты).
Ионообменные реакции
Для серной кислоты характерны ионообменные реакции. При этом она взаимодействует с растворами солей, образуя осадок, слабую кислоту либо выделяя газ. Эти реакции осуществляются с большей скоростью, если брать 45%-ную или ещё более разбавленную серную кислоту. Выделение газа происходит в реакциях с солями неустойчивых кислот, распадающихся с образованием газов (угольной, сернистой, сероводородной) либо с образованием летучих кислот, таких как соляная.
Окислительно-восстановительные реакции
Наиболее ярко серная кислота проявляет свои свойства в окислительно-восстановительных реакциях, так как в её составе сера имеет высшую степень окисления +6. Окислительные свойства серной кислоты можно обнаружить в реакции, например, с медью.
В молекуле серной кислоты два элемента-окислителя: атом серы с С.О. +6 и ионы водорода H+. Медь не может быть окислена водородом в степени окисления +1, но сера может. Это является причиной окисления серной кислотой такого неактивного металла, как медь.
В разбавленных растворах серной кислоты окислителем является преимущественно ион водорода H+. В концентрированных растворах, особенно в горячих, преобладают окислительные свойства серы в степени окисления +6.
Нужна помощь в учебе?
 Предыдущая тема: Химические свойства кислорода и серы: реакции с металлами и неметаллами Следующая тема:   Свойства сложных веществ с содержанием азота: оксиды азота
Предыдущая тема: Химические свойства кислорода и серы: реакции с металлами и неметаллами Следующая тема:   Свойства сложных веществ с содержанием азота: оксиды азотаВсе неприличные комментарии будут удаляться.
www.nado5.ru
Сера
Российский Университет Дружбы Народов
Факультет иностранных языков и общеобразовательных дисциплин
Реферат
Сера. Ее использование в медицине.
Выполнила
студентка группы СВ-53
Руководитель семинаров по химии
Кафедры химии
Профессор В.Ф. Захаров
Москва, 2002
План
Нахождение серы в природе.
Физические свойства серы.
Химические свойства серы и ее соединений.
1) Свойства простого вещества.
Свойства оксидов:
Свойства кислот и их солей:
сернистая кислота и ее соли;
сероводород и сульфиды;
серная кислота и ее соли.
Использование серы в медицине.
Общая характеристика подгруппы кислорода
В подгруппу кислорода входят пять элементов: кислород, сера, селен, теллур и полоний (полоний – радиоактивный элемент). Это p-элементыVI группы периодической системы Д.И. Менделеева. Они имеют групповое название – халькогены, что означает «образующие руды».
Свойства элементов подгруппы кислорода
| Свойства | O | S | Se | Te | Po |
| Порядковый номер | 8 | 16 | 34 | 52 | 84 |
| Валентные электроны | 2s22p4 | 3s23s4 | 4s24s4 | 5s25s4 | 6s26s4 |
| Энергия ионизации атома, эВ | 13,62 | 10,36 | 9,75 | 9,01 | 8,43 |
| Относительная электроотрицательность | 3,50 | 2,6 | 2,48 | 2,01 | 1,76 |
| Степень окисления в соединениях | -1, -2, +2 | -2, +2, +4, +6 | -2, +4, +6 | -2, +4, +6 | -2, +2 |
| Радиус атома, нм | 0,066 | 0,104 | 0,117 | 0,137 | 0,164 |
У атомов халькогенов одинаковое строение внешнего энергетического уровня – ns2np4. Этим объясняется сходство их химических свойств. Все халькогены в соединениях с водородом и металлами проявляют степень окисления –2, а в соединениях с кислородом и другими активными неметаллами – обычно +4 и +6. для кислорода, как и для фтора, не типична степень окисления, равная номеру группы. Он проявляет степень окисления обычно –2 и в соединениях с фтором +2.
Водородные соединения элементов подгруппы кислорода отвечают формуле h3R(R– символ элемента): h3O, h3S, h3Se, h3Te. Они называются хальководородами. При растворении их в воде образуются кислоты (формулы те же). Сила этих кислот возрастает с ростом порядкового номера элемента, что объясняется уменьшением энергии связи в ряду соединенийh3R. Вода, диссоциирующая на ионыH+иОН-, является амфотерным электролитом.
Сера, селен и теллур образуют одинаковые формы соединений с кислородом типа RO2и RO3. Им соответствуют кислоты типаh3RO3иh3RO4. С ростом порядкового номера элемента сила этих кислот убывает. Все они проявляют окислительные свойства, а кислоты типаh3RO3также и восстановительные.
Закономерно изменяются свойства простых веществ: с увеличением заряда ядра ослабевают неметаллические и возрастают металлические свойства. Так, кислород и теллур – неметаллы, но последний обладает металлическим блеском и проводит электрический ток.
Нахождение серы в природе
Сера широко распространена в природе. Она составляет 0,05% массы земной коры. В свободном состоянии (самородная сера) в больших количествах встречается в Италии (остров Сицилия) и США. Месторождения самородной серы имеются в Куйбышевской области (Поволжье), в государствах Средней Азии, в Крыму и других районах.
Сера часто встречается в виде соединений с другими элементами. Важнейшими ее природными соединениями являются сульфиды металлов: FeS2– железный колчедан, или пирит;HgS – киноварь и др., а также соли серной кислоты (кристаллогидраты):CaSO4ּ2h3O – гипс,Na2SO4ּ10h3O– глауберова соль,MgSO4ּ7h3O– горькая соль и др.
Физические свойства серы
Природная сера состоит из смеси четырех устойчивых изотопов:  ,
, ,
, ,
, .
.
Сера образует несколько аллотропных модификаций. Устойчивая при комнатной температуре ромбическая серапредставляет собой желтый порошок, плохо растворимый в воде, но хорошо растворимый в сероуглероде, анилине и некоторых других растворителях. Плохо проводит теплоту и электричество. При кристаллизации из хлороформаCHCl3 или из сероуглеродаCS2 она выделяется в виде прозрачных кристаллов октаэдрической формы. Ромбическая сера состоит из циклических молекулS8, имеющих форму короны. При 1130Cона плавится, превращаясь в желтую легкоподвижную жидкость. При дальнейшем нагревании расплав загустевает, так как в нем образуются длинные полимерные цепочки. А если нагреть серу до 444,60С, она закипает. Выливая кипящую серу тонкой струйкой в холодную воду, можно получитьпластическую серу – резиноподобную модификацию, состоящую из полимерных цепочек. При медленном охлаждении расплава образуются темно-желтые игольчатые кристаллымоноклинной серы. (tпл=1190C). Подобно ромбической сере, эта модификация состоит из молекулS8. При комнатной температуре пластическая и моноклинная сера неустойчивы и самопроизвольно превращаются в порошок ромбической серы.
Химические свойства серы и ее соединений
Свойства простого вещества.
Атом серы, имея незавершенный внешний энергетический уровень, может присоединять два электрона и проявлять степень окисления –2. Такую степень окисления сера проявляет в соединениях с металлами и водородом (например, Na2Sиh3S). При отдаче или оттягивании электронов к атому более электроотрицательного элемента степень окисления серы может быть +2, +4 и +6.
Сера легко образует соединения со многими элементами. При сгорании ее на воздухе или в кислороде образуется оксид серы (IV)SO2и частично оксид серы (VI)SO3:
S + O2 = SO3
2S + 3O2 = 2SO3
Это наиболее важные оксиды серы.
При нагревании сера непосредственно соединяется с водородом, галогенами (кроме йода), фосфором, углем, а также со всеми металлами, кроме золота, платины и иридия. Например:
S + h3 = h3S
3S + 2P = P2S3
S + Cl2 = SCl2
2S + C = CS2
S + Fe = FeS
Как следует из примеров, в реакциях с металлами и некоторыми неметаллами сера является окислителем, в реакциях же с более активными неметаллами, как например, с кислородом, хлором, - восстановителем.
Свойства оксидов
Оксид серы (IV)
Сернистый газ SO2 – бесцветный газ с удушливым резким запахом. При растворении его в воде (при 00С 1 объем воды растворяет более 70 объемовSO2) образуется сернистая кислотаh3SO3, которая известна только в растворах.
В лабораторных условиях для получения SO2действуют на твердый сульфит натрия концентрированной серной кислотой:
Na2SO3 + 2h3SO4 = 2NaHSO4 + SO2 + h3O
В промышленности SO2получают при обжиге сульфидных руд, например пирита:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2,
или при сжигании серы. Сернистый газ является полупродуктом в производстве серной кислоты. Его используют также (вместе с гидросульфитами натрия NaHSO3 и кальцияCa(HSO3)2) для выделения целлюлозы из древесины. Этим газом окуривают деревья и кустарники, чтобы уничтожать вредителей сельского хозяйства.
Химические реакции, характерные для SO2, можно разделить на 3 группы:
Реакции, протекающие без изменения степени окисления, например:
SO2 + Ca(OH)2 = CaSO3 + h3O
Реакции, сопровождающиеся повышением степени окисления серы от 4+ до 6+, например:
2SO2 + O2 = 2SO3
Реакции, протекающие с понижением степени окисления серы, например:
SO2 + 2h3S = 3S + 2h3O
Таким образом, SO2может проявлять как окислительные, так и восстановительные свойства.
Оксид серы (VI)
Серный ангидрид SO3при комнатной температуре представляет собой бесцветную легко летучую жидкость (tкип=44,80С,tпл=16,80С), которая со временем переходит в асбестовидную модификацию, состоящую из блестящих шелковистых кристаллов. Волокна серного ангидрида устойчивы лишь в запаянном сосуде. Поглощая влагу воздуха, они превращаются в густую бесцветную жидкость – олеум (от лат.oleum– «масло»). Хотя формально олеум можно рассматривать как растворSO3 вh3SO4, на самом деле он представляет собой смесь различных пиросерных кислот:h3S2O7,h3S3O10и т.д. С водойSO3взаимодействует очень энергично: при этом выделяется так много теплоты, что образующиеся мельчайшие капельки серной кислоты создают туман. Работать с этим веществом нужно крайне осторожно.
Оксид серы (VI) получают окислениемSO2кислородом только в присутствии катализатора:
2SO2 + O2 2SO3 + Q.
Необходимость использования катализатора в этой обратимой реакции обусловлена тем, что хороший выход SO3(т.е. смещение равновесия вправо) можно получить только при понижении температуры, однако при низких температурах очень сильно падает скорость протекания реакции.
Оксид серы (VI) энергично соединяется с водой, образуя серную кислоту:
SO3 + h3O = h3SO4
Свойства кислот и их солей
Сернистая кислота и ее соли
Оксид серы (IV) хорошо растворим в воде (в 1 объеме воды при 200С растворяется 40 объемов SО2). При этом образуется существующая только в водном растворе сернистая кислота:
SO2 + Н2О = Н2SO3
Реакция соединения SO2с водой обратимая. В водном растворе оксид серы (IV) и сернистая кислота находятся в химическом равновесии, которое можно смещать. При связыванииН2SO3щелочью (нейтрализация кислоты) реакция протекает в сторону образования сернистой кислоты; при удаленииSO2(продувание через раствор азота или нагревание) реакция протекает в сторону исходных веществ. В растворе сернистой кислоты всегда имеется оксид серы (IV), который придает ему резкий запах.
Сернистая кислота обладает всеми свойствами кислот. В растворе Н2SO3диссоциирует ступенчато:
Н2SО3 H+ + HSO4 –
HSO3 - H+ + SO3 2-
Как двухосновная кислота она образует два ряда солей - сульфиты и гидросульфиты. Сульфиты образуются при полной нейтрализации кислоты щелочью:
Н2SO3 + 2NаОН = NаHSО4 + 2Н2О
Гидросульфиты получаются при недостатке щелочи (по сравнению с количеством, необходимым для полной нейтрализации кислоты):
Н2SO3 + NаОН = NаНSO3 + Н2О
Как и оксид серы (IV), сернистая кислота и ее соли являются сильными восстановителями. При этом степень окисления серы возрастает. Так, Н2SО3легко окисляется в серную кислоту даже кислородом воздуха:
2Н2SO3 + O2 = 2Н2SO4
Поэтому долго хранившиеся растворы сернистой кислоты всегда содержат серную кислоту.
Еще легче протекает окисление сернистой кислоты бромом и перманганатом калия:
Н2SО3 + Вr2 + Н2О = Н2SO4 + 2НВr
5Н2S03 + 2КмnО4 = 2Н2SO4 + 2МnSO4 + К2SО4 + 2Н2О
Оксид серы (IV) и сернистая кислота обесцвечивают многие красители, образуя с ними бесцветные соединения. Последние могут снова разлагаться при нагревании или на свету, в результате чего окраска восстанавливается. Следовательно, белящее действиеSO2 иН2SO4отличается от белящего действия хлора. Обычно оксидом серы (IV) белят шерсть, шелк и солому (хлорной водой эти материалы разрушаются).
Важное применение находит раствор гидросульфита кальция Ca(HSO3)2(сульфитный щелок), которым обрабатывают волокна древесины и бумажную массу.
Сероводород и сульфиды
Сероводород Н2S - бесцветный газ с запахом тухлых яиц. Он хорошо растворим в воде (при 20 °C в 1 объеме воды растворяется 2,5 объема сероводорода). Раствор сероводорода в воде называется сероводородной водой или сероводородной кислотой (она обнаруживает свойства слабой кислоты).
Сероводород - очень ядовитый газ, поражающий нервную систему. Поэтому работать с ним надо в вытяжных шкафах или с герметически закрывающимися приборами. Допустимое содержание Н2Sв производственных помещениях составляет 0,01 мг в 1 л воздуха.
Сероводород встречается в природе в вулканических газах и в водах некоторых минеральных источников, например Пятигорска; Мацесты. Он образуется при гниении серосодержащих органических веществ различных растительных и животных остатков. Этим объясняется характерный неприятный запах сточных вод, выгребных ям и свалок мусора.
Сероводород может быть получен непосредственным соединением серы с водородом при нагревании:
S + Н2 = h3S
Но обычно его получают действием разбавленной соляной или серной кислоты на сульфид железа (II):
2НСl + FеS = FеСl2 + Н2S
Эту реакцию часто проводят в аппарате Киппа.
Н2S- менее прочное соединение, чем вода. Это обусловлено большим размером атома серы по сравнению с атомом кислорода. Поэтому связь Н—0 короче и прочнее связи Н—S. При сильном нагревании сероводород почти полностью разлагается на серу и водород:
Н2S = S + Н2
Газообразный Н2Sгорит на воздухе голубым пламенем с образованием оксида серы (IV) и воды:
2Н2S + 3O2 = 2SO2 + 2Н2О
При недостатке кислорода образуются сера и вода:
2Н2S + O2 = 2S + 2Н2О
Этой реакцией пользуются для получения серы из сероводорода в промышленном масштабе.
Сероводород - довольно сильный восстановитель. Это его важное химическое свойство можно объяснить так. В растворе Н2Sсравнительно легко отдает электроны молекулам кислорода воздуха:
Н2S - 2е- = S + 2H + 2
O2 + 4е- = 2O 2- 1
В этом случае Н2Sокисляется кислородом воздуха до серы, которая делает сероводородную воду мутной. Суммарное уравнение реакции:
2Н2S + O2 = 2S + 2Н2O
Этим объясняется и тот факт, что сероводород не накапливается в очень больших количествах в природе при гниении органических веществ - кислород воздуха окисляет его в свободную серу.
Энергично реагирует сероводород с растворами галогенов. Например:
Н2S + I2 = 2HI + S
Происходит выделение серы и обесцвечивание раствора йода.
Сероводородная кислота как двухосновная образует два ряда солей - средние (сульфиды) и кислые (гидросульфиды). Например, Nа2S - сульфид натрия,NаНS- гидросульфид натрия. Гидросульфиды почти все хорошо растворимы в воде. Сульфиды щелочных и щелочно-земельных металлов также растворимы в воде, а остальных металлов практически нерастворимы или мало растворимы; некоторые из них не растворяются и в разбавленных кислотах. Поэтому такие сульфиды можно легко получить, пропуская сероводород через соли соответствующего металла, например:
СuSO4 + Н2S = CuS + h3SO4
Некоторые сульфиды имеют характерную окраску: CuSиРbS — черную,СdS— желтую,ZnS— белую,MnS— розовую,SnS— коричневую,Sb2S3— оранжевую и т. д. На различной растворимости сульфидов и различной окраске многих из них основан качественный анализ катионов.
Серная кислота и ее соли
Серная кислота — тяжелая бесцветная маслянистая жидкость. Крайне гигроскопична. Поглощает влагу с выделением большого количества теплоты, поэтому нельзя воду приливать к концентрированной кислоте — произойдет разбрызгивание кислоты. Для разбавления надо серную кислоту приливать небольшими количествами к воде.
Безводная серная кислота растворяет до 70% оксида серы (VI). При обычной температуре она не летуча и не имеет запаха. При нагревании отщепляет SO3до тех пор, пока не образуется раствор, содержащий 98,3%Н2SO4. Безводнаяh3SO4почти не проводит электрический ток.
Концентрированная серная кислота обугливает органические вещества — сахар, бумагу, дерево, волокна и т. д. отнимая от них элементы воды. При этом образуются гидраты серной кислоты. Обугливание сахара можно выразить уравнением
С12Н22О11 + nН2SO4 = 12С + Н2SO4 ּ nН2О
Образовавшийся уголь частично вступает во взаимодействие с кислотой:
С + 2Н2SO4 = СО2 + 2SO2 + 2Н2О
Поэтому кислота, которая идет в продажу, имеет бурый цвет от случайно попавших и обуглившихся в ней пыли и органических веществ.
На поглощении (отнятии) воды серной кислотой основана осушка газов.
Как сильная нелетучая кислота Н2SO4вытесняет другие кислоты из сухих солей. Например:
NаNОз + Н2SO4 = NаНSO4 + НNO3
Однако если Н2SО4добавляется к растворам солей, то вытеснения кислот не происходит.
Очень важное химическое свойство серной кислоты - отношение ее к металлам. Разбавленная и концентрированная серная кислота реагирует с ними различно. Разбавленная серная кислота окисляет только металлы, стоящие в ряду напряжений левее водорода, за счет ионовH+, например:
Zn + h3SO4 (разб) = ZnSO4 + h3
Концентрированнаясерная кислота при обычной температуре со многими металлами не реагирует. Поэтому безводную серную кислоту можно хранить в железной таре и перевозить в стальных цистернах. Однако при нагревании концентрированнаяН2SO4 взаимодействует почти со всеми металлами (кромеРt, Аuи некоторых других), а так же с неметаллами. При этом она выступает как окислитель, сама восстанавливается обычно доSO2. Водород в этом случае не выделяется, а образуется вода. Например:
Сu + 2Н2SO4 = СuSO4 + SO2 + 2Н2O
2Ag + 2h3SO4 = Ag2SO4 + SO2 + 2h3O
C + 2h3SO4 + = CO2 + 2SO2 + 2h3O
2P + 5h3SO4 = 2h4PO4 + 5SO2
Серная кислота обладает всеми свойствами кислот.
Серная кислота, будучи двухосновной, образует два ряда солей: средние, называемые сульфатами, и кислые, называемые гидросульфатами. Сульфаты образуются при полной нейтрализации кислоты щелочью (на 1 моль кислоты приходится 2 моля щелочи), а гидросульфаты — при недостатке щелочи (на 1 моль кислоты — 1 моль щелочи):
Н2SO4 + 2NаOH = Nа2SO4 + 2Н2О
Н2SO4 + NaOH = NаHSO4 + Н2О
Многие соли серной кислоты имеют большое практическое значение.
Большинство солей серной кислоты растворимо в воде. Соли СаSO4иРbSO4мало растворимы в воде, аВаSO4практически нерастворима как в воде, так и в кислотах. Это свойство позволяет использовать любую растворимую соль бария, напримерВаСl2, как реагент на серную кислоту и ее соли (точнее, на ионSO4 2-):
h3SO4 + BaCl2 = BaSO4+ 2HCl
NaSO4 + BaCl2 = BaSO4+ 2NaCl
При этом выпадает белый нерастворимый в воде и кислотах осадок сульфата бария.
Серная кислота является важнейшим продуктом основной химической промышленности, занимающейся производством неорганических кислот, щелочей, солей, минеральных удобрений и хлора.
По разнообразию применения серная кислота занимает первое место среди кислот. Наибольшее количество ее расходуется для получения фосфорных и азотных удобрений. Будучи нелетучей кислотой, серная кислота используется для получения других кислот - соляной, плавиковой, фосфорной, уксусной и т. д. Много ее идет для очистки нефтепродуктов - бензина, керосина и смазочных масел - от вредных примесей. В машиностроении серной кислотой очищают поверхность металла от оксидов перед покрытием (никелированием, хромированием и др.). Серная кислота применяется в производстве взрывчатых веществ, искусственного волокна, красителей, пластмасс и многих других. Ее употребляют для заливки аккумуляторов. В сельском хозяйстве она используется для борьбы с сорняками (гербицид).
Этим определяется значение серной кислоты в нашем народном хозяйстве.
Использование серы в медицине
Элементарная сера обладает выраженными антисептическими свойствами. Сера осажденная (Sulfurpraecipitatum) представляет собой мельчайший аморфный порошок бледно-желтого цвета без запаха. При взаимодейстии серы с органическими веществами образуются сульфиды и пентатионовая кислота, оказывающие противомикробное и противопаразитное действие. Серу применяют наружно в виде мазей (с концентрациями 5-, 10- или 20%) и присыпок при лечении кожных заболеваний: себореи, сикоза, псориаза и др. Применение серной мази является относительно простым и эффективным методом лечения чесотки.
Сера очищенная (Sulfurdepuratum) – мелкий порошок лимонно-желтого цвета – используется при энтеробиозе в качестве противоглистного средства. Она является также легким слабительным средством, входит в состав сложного порошка солодкового корня. Стерильный 1-2% раствор серы очищенной в персиковом масле (сульфозин) иногда применяют для пирогенной терапии при сифилисе.
Кроме того, соединения серы, как органические, так и неорганические, находят широкое применение в медицине. Атомы серы входят в состав множества препаратов самого различного действия. Поскольку охватить вниманием их все не представляется возможным, ограничимся несколькими примерами.
studfiles.net
Оксид серы - Знаешь как
Основное СераТекст на темуЗаголовок вкладкки
ОКСИД СЕРЫ. Кислотные соединения серы. У серы несколько соединений с кислородом , но важнейшие из них ( IV ) SO2 и ( VI ) SO3 .Оксиды серы ( IV ) получают при нагревании серы на воздухе :
S + O2 = SO2
В лаборатории её получают действием соляной кислоты на сульфиты :
Na2SO3 + 2HCl = SO2↑+ 2NaCl + h3O
или взаимодействием концентрированной серной кислоты с медью :
2h3SO4 + Cu = SO2↑ + CuSO4 + 2h3O
В сернокислотном производстве оксид серы ( IV ) получают обжигом пирита :
4FeS2 + 11O2 = 2Fe2O3 + 8SO2↑
Также оксид серы получают как побочный продукт при коксовании углей .
SO2 — бесцветный газ с запахом горящей серы , сжижается при -10,09°C , затвердевает при — 70°C . Он ядовит , вдыхание воздуха , содержание более 0,2% оксида серы ( IV ) вызывает заболевание .
Молекулы оксида серы ( IV ) не ассоциированы и построены аналогично молекуле озона . Атомы в молекуле SO2 образуют равнобедренный треугольник , в котором расстояние S-O равны 1,43 А , а угол O — S — O составляет 119 градусов .
Поскольку сера в степени окисления + 4 может терять два электрона или присоединять шесть электронов , оксид серы ( IV ) в одной реакции ведёт себя как восстановитель , а в других — как окислитель . Оксид серы ( IV ) обесцвечивает органические пигменты и его применяют иногда для отбеливания шёлка , шерсти и соломы , так как они разрушаются под воздействием хлора . Но в отличие от хлора оксид серы ( IV ) не разрушает красители , а лишь образует с ними непрочные , бесцветные соединения , которые разлагаются под действием тепла и света и первоначальная окраска растительного пигмента восстанавливается .
При 20°C в 1 объёме воды растворяется 39,4 объёма оксида серы ( IV ) , часть которой химически взаимодействует с водой и образуется двухосновная сернистая кислота средней силы :
SO2 + h3O ⇄ h3SO3 ⇄ H⁺ + HSO3 ⇄ 2H⁺ + SO3
Сернистая кислота нестойкая , существует только в водных растворах , при нагревании её раствора равновесие смещается влево и выделяется оксид серы ( IV ) .
В окислительно — восстановительных реакциях сернистая кислота обычно играет роль восстановителя и окисляется до серной кислоты :
+4 0 +6 — 1
h3SO3 + Cl2 + h3O = h3SO4 + 2HCl
Она постепенно окисляется до серной кислоты даже кислородом воздуха , но , взаимодействуя с более сильными восстановителями , например с сероводородом , сернистая кислота ведёт себя как окислитель и восстанавливается до свободной серы :
+4 -2 0
h3SO3 + 2h3S = 3S↓ + 3h3O
Средние соли сернистой кислоты называют сульфитами ( например , Na2SO3 — сульфит натрия ) , а кислые гидросульфитами ( NaHSO3 — гидросульфит натрия ) . Сульфиты — также активные восстановители .
Тиосерная кислота h3S2O3 — неустойчивая даже в водных растворах и считается производным серной кислоты , в молекуле которой один атом кислорода замещён атомом серы .
Соли тиосерной кислоты — тиосульфаты более стойки . При кипячении раствора сульфита натрия с серой получается тиосульфат натрия , который при понижении температуры выкристаллизовывается в виде Na2S2O3 · 2h3O Сильные кислоты ( соляная кислота ) вытесняют из тиосульфатов тиосерную кислоту :
Na2S2O3 + 2HCl = h3S2O3 + 2NaCl
Которая разлагается с выделением двуокиси серы и свободной серы :
h3S2O3 = S↓+ SO2↑ + h3O
Тиосульфат натрия или гипосульфит широко использовался в применении в фотографии . Действие его как закрепителя основано на свойстве растворять неразложившийся бромид серебра с образованием комплексной соли :
AgBr + 2Na2S2O3 + Na3[Ag( S2O3 )2] + NaBr
Тиосульфат натрия легко окисляется хлором и бромом , (а также другими сильными окислителями ) до серной кислоты ( или сульфатов ) :
Na2S2O3 + 4Cl2 + 5h3O = 2h3SO4 + 6HCl + 2NaCl
На этой реакции основано применение тиосульфата натрия для удаления остатков хлора , кроме того он использовался в ветеринарии и медицине .
Оксид серы (VI )
Окисление оксида серы ( IV ) SO2 до оксида серы ( VI ) SO3 при обычных условиях протекает медленно , однако эта реакция ускоряется при нагревании ( до 450°C ) в присутствии катализаторов ( мелко раздробленной платины , оксидов ванадия , хрома или железа ) .
Различают две модификации оксида серы ( VI ) .
Одна из них жидкая , плотностью 1,92 г/см³, кипит при 44,9°C , а при 16,8°C затвердевает в кристаллы , напоминающие лёд . Она состоит из ( SO3 )3 , т.е. состоит из циклических тримерных молекул и называется льдовидной модификацией , но при хранении SO3 полимеризуется :
xSO3 ⇄ ( SO3 )x
и получается асбестовидная модификация оксида серы ( VI ) , представляющие собой шелковистые кристаллы и состоящих из длинных цепей , образованных тетраэдрами SO4 .
Оксид серы ( VI ) жадно соединяется с водой , образуя серную кислоту :
SO3 + h3O = h3SO4
Также читают на тему Сера. Главная- СЕРА (Sulfur), S — хим. элемент, светло-желтые ромбические кристаллы. История- Одно из немногих веществ, которыми уже несколько тысяч лет назад первые химики Общие свойства- Лимонно-желтые кристаллы чистой серы полупрозрачны. Форма кристаллов Самородная сера- минерал класса самородных неметаллов. В природе встречается видах Самородная минералы- Моноклинная сера при охлаждении до температуры 95,5°С переходит в ромбическую Серная кислота- (Безводная) бесцветная маслянистая жидкость , застывающая в кристаллическую массу Соли, минералы. Оксид серы- У серы несколько соединений с кислородом , но важнейшие из них ( IV ) SO2 и ( VI ) SO3 Сероводород h3S- Важнейшее водородное соединение серы , в котором она проявляет степень окисления Пестициды- Термин пестициды ( от латинского pestis - разрушение , зараза и cide -убивать ) Сульфит натрия-Цинка сульфат-Натрия тиосульфат-Натрия сульфат-Гидросульфат натрия-Сульфат натрия-Тиосульфат натрия-Магния сульфат-Сульфат меди-Железа закисного сульфат Лекарственные препараты. Атропина сульфат-Блокирует м-холинореактивные системы, предотвращая взаимодействие ацетил-холином Сера осаждённая- Действие: противоглистное (при энтеробиозе), слабительное, кератопластическое Сера очищенная- Слабительное и противоглистное (при энтеробиозе , инвазии), кератопластическое С этим часто ищут. Кислород-Сера-Селен-Теллур-Полонийznaesh-kak.com


















