Оксид кремния (IV) и кремниевые кислоты. Органическое вещество питьевая вода крахмал азотная кислота оксид кремния
Органические вещества кремний - Справочник химика 21
Как углерод, входя в состав всех органических веществ, является важнейшим элементом растительного и животного царства, так кремний — главный элемент в царстве минералов и горных пород. [c.507]Химический сосгав твердых горючих веществ очень разнообразен. Большинство из них относится к классу органических веществ, состоящих в основном из углерода, водорода, кислорода и азота. В состав многих органических веществ входят также хлор, фтор, кремний и другие химические элементы.Значительно меньше твердых горючих веществ относится к классу неорганических веществ. Среди них металлы (калий, натрий, магний, алюминий, титан и др.), металлоиды (сера, фосфор, кремний), а также их соединения. [c.186]
Атомные кристаллы (рис. 1.9, а) построены из нейтральных атомов, между которыми возникает ковалентная связь. Это весьма прочный тип связи ее энергия составляет (8—12). 10 кДж/моль. Кроме того, ковалентная связь отличается направленностью , что сообщает телам, обладающим такой структурой, очень большую твердость, высокую температуру плавления, малые испаряемость и растворимость, низкие тепло- и электропроводности. Таковы углерод (алмаз), бор, кремний и некоторые органические вещества. [c.37]Эти факторы дополняются, как указывалось выше, биологическими особенностями микроорганизмов, а именно — их способностью приспосабливаться к окружающей среде. Микроорганизмы по-разному относятся к свету, температуре, кислороду, азоту, углероду, сере, кальцию, кремнию и к органическим веществам. У них может быть неодинаковая степень зависимости от того или другого фактора — сильная, средняя и слабая. [c.295]
Вулканическая деятельность во всех ее проявлениях играла в этом отношении выдающуюся роль. Обогащая обширные зоны поверхности, в том числе и те, которые граничили с водоемами, соединениями металлов, вулканы способствовали развитию каталитических реакций. Вещества, выбрасываемые во время извержений, получаются в активном состоянии это, например, оксид кремния (IV) в форме высокопористой массы —пемзы, образующейся при застывании кислых лав (ее пористость достигает 80%) и др. Другой важной породой, которая могла функционировать и как адсорбент, фиксирующий на своей поверхности разнообразные частицы, и как катализатор, является глина. Глины относят к числу древнейших пород. Глинистые минералы (например, монтмориллонит) имеют пластинчатое строение силикатные слои, максимальное расстояние между которыми равно приблизительно 1,4 нм, разделены слоями молекул воды толщина этих слоев может изменяться в широких пределах. Глины обратимо связывают катионы и таким образом могут служить в качестве регулятора солевого состава окружающей водной среды. Скопление органических веществ на поверхности глинистых минералов, возможно, сыграло решающую роль в появлении предбиологических структур и возникновении жизни (Д. Бернал). По Акабори, из формальдегида, аммиака и циановодорода в абиогенную эру образовался амино-ацетонитрил, который подвергался гидролизу и полимеризации на поверхности глин, образуя вещества, близкие к белкам. Акабори показал, что нагревание аминоацетонитрила с кислой глиной ведет к появлению продукта, дающего биуретовую реакцию (реакция на белок). Твердые карбонаты, которые входят в большом количестве в состав земной коры, вероятно, катализировали процесс образования углеводов. Гидроксид кальция также может служить катализатором в таких процессах. Исходным веществом для синтеза углеводов служит формальдегид. Прямым опытом доказано (Г. Эйлер и А. Эйлер), что гликолевый альдегид и пентозы получаются из формальдегида в присутствии карбоната кальция. Схему образования углеводов из простейших соединений предложил М. Кальвин. [c.377]
Элементный анализ проводят в основном так же, как и мономерных органических веществ. Обнаружение отдельных элементов (углерода, азота, хлора, фтора, серы, фосфора, кремния и др.) осуществляют с помощью качественных реакций (см. разд. 14.3). Ниже перечислены полимеры, которые можно идентифицировать по наличию гетероэлемента [c.222]
Асимметрический атом углерода — главная, но не единственная причина оптической активности органических веществ. Асимметрическими могут быть и атомы других элементов — кремния, азота, фосфора, мышьяка, серы и др. Оптическая активность может появиться и без асимметрического атома, за счет асимметрии всей молекулы в целом (молекулярная асимметрия). В комплексных соединениях асимметрия часто возникает в октаэдрической пространственной структуре. [c.42]
Загрязнения из резервуаров нефтеперерабатывающих заводов (табл. 18) характеризуются высокой зольностью, достигающей почти 80 %, относительно малым содержанием углерода, значительным — серы, азота и кислорода, железа. В меньших количествах обнаружены кремний (2—4 %), кальций (1—2,5 %), натрий (до 2 %). Остальные зольные элементы содержатся в количествах менее 1 %. В состав загрязнений входит 10—30 % органических веществ в виде-смолистых продуктов окисления. [c.54]
Таким образом, почва состоит из минеральной и органической (гумуса) частей. Минеральная часть составляет от 90 до 99 % и более от всей массы почвы. В ее состав входят почти все элементы периодической системы Д. И. Менделеева. Однако основными составляющими минеральной части почв являются связанные в соединения кислород, кремний, алюминий и железо. Эти четыре элемента занимают около 93 % массы минеральной части. Гумус является основным источником питательных веществ для растений. Благодаря жизнедеятельности населяющих почву микроорганизмов происходит минерализация органического вещества с освобождением в доступной для растений форме азота, фосфора, серы и других необходимых для растений химических элементов. Органическое вещество оказывает большое влияние на формирование почв и изменение ее свойств. При разложении органических веществ почвы выделяется углекислый газ, который пополняет приземную часть атмосферы и ассимилируется растениями в процессе фотосинтеза. Однако какой-бы богатой питательными веществами ни была почва, рано или поздно она начинает истощаться. Поэтому для поддержания плодородия в нее необходимо вносить питательные вещества (удобрения) органического или минерального происхождения. Кроме того, что удобрения поставляют растениям питательные вещества, они улучшают физические, физико-механические, химические и биологические свойства почв. Органические удобрения в значительной степени улучшают водно-воздушные и тепловые свойства почв. Способность почвы поглощать пары воды и газообразные вещества из внешней среды является важной характеристикой. Благодаря ей почва задерживает влагу, а также аммиак, образую- [c.115]
Обычно бывает невозможно рассчитать составляющую ионного обмена, относящуюся к глинистым минералам почв, поскольку значительную емкость катионного обмена имеют и другие почвенные компоненты, например аллофаны и органическое вещество (табл. 3.7). Аллофан представляет собой кремне-алюминиево-водный гель, состоящий из полых сфер диаметром 3—5 мм, стенки которых построены из подобного каолиниту материала. Позиции катионного обмена находятся внутри полых сфер, а емкость катионного обмена варьирует в зависимости от обменного катиона, его концентрации и pH почвенной влаги. Ионный обмен в почвенном органическом веществе в основном вызван диссоциацией карбоксильных групп при pH выще 5. [c.115]
Для характеристики черного щелока определяют плотность и массовую долю следующих веществ сухих, органических, минеральных, взвешенных, не растворимого в соляной кислоте остатка оксида кремния, золы, общей титруемой щелочи, сульфата натрия, эффективной и активной щелочи, оксидов алюминия и железа, оксида кальция, гидроксида, сульфида и карбоната натрия, натрия, связанного с органическими соединениями, серы, смолистых вешеств и лигнина. Массовая доля сухих вешеств в щелоке определяется высушиванием на бумажных фильтрах при 104—105 °С или сушкой после смешивания щелока с кварцевым песком при 105 3 °С до постоянной массы. В качестве быстрого метода используется способ высокочастотной сушки, при котором проба черного щелока высушивается в высокочастотном электрическом поле. Массовая доля золы в щелоке определяется озолением сухого остатка щелока при 600—650 °С. При этом в минеральной части щелока происходят качественные и количественные изменения. Поэтому состав и масса образовавшейся золы не равны массе и составу минеральной части исследуемого шелока. Массовую долю минеральных веществ щелока определяют как сумму масс следующих веществ гидроксида, сульфида и карбоната натрия, натрия, связанного с органическими соединениями, сульфата натрия, двуоксида кремния, оксида кальция, оксида железа и алюминия. При этом вводится поправка на карбонизацию и образование сульфатов при прокаливании сухого остатка. Массу органических веществ в щелоке находят по разности между массой сухих и минеральных веществ. [c.174]
Все эти формулы оказались неверными. Причина неудач заключалась в том, что в химию кремния были механически перенесены стереохи-мические схемы, заимствованные из области комплексных соединений (главным образом, платины и кобальта) и молекулярных органических веществ. Как в химии комплексных соединений, так и в органической химии заключения о строении делаются на основании изучения поведения веществ в жидком или растворенном состояниях. Такой подход к [c.333]
При разложении органического вещества сплавлением со щелочью в герметически закрытой бомбе, кроме серы, возможно также определение кремния, германия, галоидов [216]. [c.212]
Удаление органических паров из воздуха путем адсорбции на активированном угле, как область промышленного применения адсорбционных процессов, по своему значению уступает, вероятно, только осушке газа. Применение активированного угля для этих целей предпочтительно вследствие его высокой избирательности по отношению к органическим соединениям. Рассмотренные в предыдущем разделе адсорбенты на основе двуокиси кремния и окиси алюминия обладают значительно большей избирательностью по отношению к воде и поэтому используются главным образом для осушки, хотя силикагель находит ограниченное применение и в некоторых специальных процессах адсорбции органических веществ. [c.294]
Хлорная кислота и перхлораты широко применяются в химическом анализе. Одна из старейших областей употребления хлорной кислоты—использование се для осаждения калия при его количественном определении. Хлорная кислота (обычно совместно с азотной и серной кислотами) применяется для разрушения органических веществ (влажное сожжение). В неорганическом анализе ее употребляют в качестве агента и среды при экстрагировании, окислении и разделении многих руд, для обезвоживания при определении окиси кремния. [c.119]
Предварительная очистка морской воды, как показали длительные испытания опытно-промышленной обратноосмотической опреснительной установки [193], сложнее, чем предочистка солоноватых вод, несмотря на то, что при опреснении морской воды обычно нет необходимости в очистке ее от солей жесткости (так как по экономическим соображениям степень извлечения пресной воды из морской невелика — примерно 30—40% и, следовательно, концентрирование солей в исходной воде мало). Сложность очистки морской воды связана с высоким содержанием в ней органических веществ (водоросли, ил, микроорганизмы и т. п.) и коллоидов кремния, которые обычной фильтрацией практически не удаляются. Для максималыюго их удаления перед песчаным фильтром морскую воду следует обрабатывать коагулянтом. [c.297]
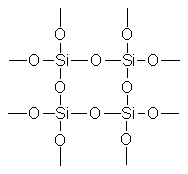
Высокая стойкость полисилоксанов к действию окислителей при высоких температурах объясняется прочностью силоксановых связей. Под влиянием повышенной температуры и кислорода происходит не разрыв макромолекулярных цепей, а отщепление углеводородных радикалов с образованием летучих низкомолекулярных органических веществ и соединение образовавшихся макрорадикалов. Укрупнение макромолекул затрудняет дальнейшую диффузию кислорода в глубь полимера, вследствие чего процесс деструкции замедляется. Термическая стойкость полиорга-носилокоаиов убывает в зависимости от характера замещающих радикалов, связанных с атомами кремния, в следующем порядке [c.485]
Начало исследованию кремнийоргАнических соединений было положено Д. И Менделеевым. В 1845 г французский химик Ж Эбельман получил первое органическое соединение кремнии — теграэтоксисилан 81(ОС2Н5)4, а в 1863 г. Фридель и Крафте синтезировали тетраэтилсилан 81(С2Н5)4. Первые результаты в области синтеза этих веществ были настолько обнадеживающими, что появилась идея на базе кремния создать новую органическую химию. Однако вскоре наступило разочарование кремний в отличие от углерода не образует длинных устойчивых полимерных цепей кремнийорганические соединения не обладают таким многообразием и многочисленностью, как соединения углерода. Поэтому интерес к химии кремния стал постепенно угасать. [c.179]
ПОЛУПРОВОДНИКИ — вещества с электронной проводимостью, величина электропроводности которых лежит между электропроводностью металлов и изоляторов. Характерной особенностью П. является положительный температурный коэффициент электропроводности (в отличие от металлов). Электропроводность П. зависит от температуры, количества и природы примесей, влияния электрического поля, света и других внешних факторов. К П. относятся простые вещества — бор, углерод (алмаз), кремний, германий, олово (серое), селен, теллур, а также соединения — карбид кремния, соединения типа filmen (инднй — сурьма, индий — мышьяк, галлий — сурьма, алюминий — сурьма), соединения двух или трех элементов, в состав которых входит хотя бы один элемент IV—VII групп периодической системы элементов Д. И. Менделеева, некоторые органические вещества — полицены, азоаромати-ческие соединения, фталоцианин, некоторые свободные радикалы и др. К чистоте полупроводниковых материалов предъявляют повышенные требования, например, в германии контролируют примеси 40 элементов, в кремнии — 27 элементов и т. д. Тем не менее некоторые примеси придают П. определенные свойства и тип проводимости, а потому и являются необходимыми. Содержание примесей не должно превышать 10 —Ш %. П. применяются в приборах в виде монокристаллов с точно определенным содержанием примесей. Применение П. в различных отраслях техники, в радиотехнике, автоматике необычайно возросло в связи с большими преимуществами полупроводниковых приборов — они экономичны, надежны, имеют высокий КПД, малые размеры и др. [c.200]
Согласно современным представлениям из молекул состоят вещества в газообразном и парообразном состоянии. В твердом состояни1г из молекул состоят лишь вещества, кристаллическая решетка которых имеет молекулярную структуру. Например, органические вещества, неметаллы (за небольшим исключением), оксид углерода (IV), вода. Большинство же твердых неорганических веществ не имеет молекулярной структуры их решетка состоит не из молекул, а из других частиц (ионов, атомов) они существуют в виде макротел (кристалл хлорида натрия, друза кварца, кусок меди и др.). Не имеют молекулярной структуры соли, оксиды металлов, алмаз, кремний, металлы. [c.11]
Опасность отравления тошппыми сазами м парами. При дуговой сварке качественными электродами с толстым слоем обмазки, содержащей марганец и органические вещества (крахмал, декстрин и др.), воздух загрязняется парами всех составных частей электродов и окислов, а также продуктами сгорания органических веществ. Значительное количество вредных газов, а также пыли выделяется и при автоматической дуговой сварке под слоем флюса. В частности, применение флюса ОСЦ-45 сопровождается выделением токсичного газа — фтористого кремния, [c.323]
Одни и те же ингибированные растворы применяются для эксплуатационных промывок котлов и для снятия карбонатных желе-зоокисных и железофосфатных отложений. Несколько усложняется технология очистки труб при наличии на их поверхности толстых плотных железоокисных отложений (600—800 г/м ), содержащих также органические вещества и соединения меди и кремния. При наличии силикатов в промывочные растворы вводят фториды, в случае присутствия меди и ее соединений — тиомочевину. [c.75]
В качестве наполнителей-модификаторов используют производные целлюлозы, органические производные кремния (аэросилы), НЧК, кислый гудрон, смолы ФР-12 и ТС-10. К стабилизаторам относят производные целлюлозы и поверхностно-актив-ные вещества типа ДС-РАС, КССБ и сульфанол. [c.47]
Использование метода электродиализа лля получения особо чистой поды пе считается экономически выгодным [34, 38—41]. После снижения солепой концентрации меньше 0,05°/о основ ач часть электроэнергии непромзводителыю затрачивается на электролиз воды. Но лаже продолжительный злектродиализ не позполяет получить поду с солевым остатком меньше 1 10 % и удельным сопротивлением болыне 0,1 Мом - см [38, 42, 43], К этому следует добавить, что примеси кремния и различных органических веществ из воды при злектродиилизе не удаляются [3, 34]. [c.377]
Полупроводники — вещества, по электропроводности промежуточные между проводниками и диэлектриками (изоляторами). Их электропроводность зависит от температуры, увеличиваясь при ее повышении (отличие от металлов), от количества и природы примесей, воздействия электрического поля, света и других внешних факторов, К П. принадлежат бор, углерод (алмаз), кремний, германий, олово (серое), селен и теллур, карбид кремния Si соединения типа (индий — сурьма, индий — мышьяк, галлий — сурьма, алюминий — сурьма), соединения двух или трех элементов, в состав которых входит хотя бы один из элементов IV—VH групп периодич. системы Д. И. Менделеева, органические вещества (полицены, азоарома-тические соединения, фталоцианины, некоторые свободные радикалы и др.). К чистоте полупроводниковых материалов предъявляют повышенные требования напр., в германии контролируют содержание примесей 40 эле.ментов, в кремнии — 27 элементов. Содержание примесей не должно превышать 10 — 10- %. П. имеют большое практическое значение. [c.107]
Химическая экология природных вод. Химический состав и классификация природных вод. Макрокомпоненты хлорид-, сульфат-, карбо-нат- и гидрокарбонат-ионы, катионы натрия, калия, магния, кальция. Ионы кремния, железа, алюминия, фосфора, азота в разных степенях окисления, органические вещества в природных водах. Микрокомноненты ионы лития, стронция, меди, серебра, хрома, марганца, бромид-, иодид-ионы и их способность к комилексообразовапию. Эколого-химические особенности загрязнения гидросферы. Металлы как загрязняющие вещества источники ностунления в воду, токсические эффекты, химическое состояние. Органические соединения - загрязнители вод разных типов хлорорганические, фосфорорганические соединения. Особенности нефтяного загрязнения. Детергенты в природных водах. Коллоидные ПАВ и их влияние на загрязнение природной воды. [c.4]
В естественных условиях существует динамическое равновесие внутриводоемных процессов, таких как образование и трансформация автохтонного органического вещества, осадконакоп-ление, баланс между поступлением и выносом биогенов. Эвтрофирование озер и водохранилищ обычно связано с поступлением из их водосборных бассейнов и накоплением в экосистемах биогенных элементов - азота, фосфора, серы, железа, калия, кремния и других. Для водоемов умеренной зоны решающую роль в эвтрофировании играет, очевидно, фосфор. [c.287]
Рассматривая любую пробу водорослей из пруда или аквариума под микроскопом, всегда можно обнаружить крошечные диатомеи, медленно, как лодочки, скользящие в воде. Диатомовые водоросли, относящиеся к группе СЬгу8орЬу1а, широко известны из-за наличия у них наружной раковины из двуокиси кремния. Эти кремниевые скелеты, ажурные, нередко поразительно красивые (рис. 1-9), отличаются чрезвычайной прочностью они образуют обширные древние отложения диатомовой земли . Передвигаются диатомеи очень медленно, причем самым необычным способом — посредством перетекания протоплазмы по желобку на поверхности клетки. Диатомовые водоросли составляют существенную часть морского планктона. По оценкам, три четверти органических веществ в мире продуцируется диатомовыми водорослями и панцирными жгутиковыми. Подобно бурым водорослям, хризофиты содержат пигмент фукоксантин. [c.49]
Бауман [1636] изучил относительные константы устойчивости анионных комплексов шестикоординированного кремния с некоторыми производными катехина. Он измерил константу химического равновесия К, а также значение pH, при котором 99 % всех атомов кремния в растворе, содержащем 0,006 % кремнезема в виде мономера, переходило в комплекс при концентрации органического вещества, равной 0,1 М [c.216]
Однако было выдвинуто предположение, что первоначально соединения кремния играли важную и, по всей вероятности, необходимую роль в происхождении жизни. Гамов [5] отмечал, что переход от неживой материи мог протекать очень постепенно. Опарин [6] выдвинул постулат, согласно которому жизнь возникла посредством ассоциации простых, встречающихся в природе углеродных соединений с неорганическими веществами в коллоидной форме. Бернал [7] предположил, что коллоидные силикаты, вероятно, играли каталитическую роль в процессах формирования сложных органических молеку/ из простых молекул. Он допускал также, что первоначальная атмосфера Земли (до возникновения жизни) должна была состоять нз таких водородных соединений, как метан, аммиак, сероводород и водяные пары. Как показал Миллер [8], аминокислоты могут образовываться из метана, азота и водяного пара под влиянием электрических разрядов, поэтому могли существовать разнообразные органические соединения. Бернал высказал предположение, что обогащение простых органических молекул могло происходить при их адсорбции на коллоидных глинистых минералах, имеющих очень больщое значение удельной поверхностн и сродство по отношению к органическим веществам. Он указал, что небольшие по размеру молекулы, присоединенные к поверхности глины, способны удерживаться на ней не беспорядочно, а в определенных положениях как по отношению к поверхности глины, так и друг к другу. Таким образом, вследствие упорядоченного расположения эти молекулы могут взаимодействовать между собой с образованием более сложных соединений, особенно в том случае, когда осуществляется подвод энергии за счет падающего на поверхность света. Согласно Берналу, вначале могло происходить формирование асимметричных молекул, которые характерны для живых организмов. Это могло осуществляться путем более предпочтительной попарной адсорбции асимметричных молекул на поверхности кварца, так как кварц — единственный общеизвестный минерал, обладающий асимметричной структурой. [c.1006]
Чтобы определить, ирисутствует ли кремний в виде органического комплекса, Холт и Йетс [414] добавляли к культуральной ткани растворимый кремнезем, меченный изотопом 51, а также вводили этот изотои в брющинную полость крысы с последующим выделением растворимых в спирте соединений, содержащих 51. Однако они отметили, что извлекаемый материал мог состоять из мицелл полимеров кремневой кислоты, покрытой органическими веществами. Больщая часть 51 в тка- [c.1093]
При использовании метода азеотропной ректификации для разделения указанной смеси применяются вспомогательные органические вещества —ацетонитрил СНдСК (т. кип. 81,5 °С) или акрило-нитрил СН2=СНС]Ч (т. кип. 79 °С), которые образуют с четыреххлористым кремнием и триметилхлорсиланом азеотропные смеси с различными температурами кипения. [c.51]
Известный немецкий химик родился в городе Эшерхейме недалеко от Франкфурта-на-Майне, в семье именитого бюргера. По настоянию родителей он окончил медицинский факультет Марбургского университета и в 1823 г. получил звание доктора медицины — хирурга. Однако юношу гораздо больше привлекала химия. Еще студентом-первокурсни-ком в химической лаборатории университета он получил цианид иода при взаимодействии сухого цианида калия с иодом. Хирургом он так и не стал, но заслуги его как химика неоспоримы ведь он первым получил в чистом виде алюминий, аморфный бор, бериллий, иттрий, карбид кремния и карбид кальция, силан и трихлорсилан. Он предложил новый способ получения белого фосфора нагреванием смеси фосфорита, угля и песка. Самым знаменитым его синтезом стало получение карбамида (МН2)2СО (мочевины) при упаривании раствора цианата аммония КН КСО — органического вещества из неорганического. Кто был этот химик [c.268]
В последующих исследованиях в Австралии довольно медленный процесс с использованием натриевого силиката был заменен методом с применением органических соединений кремния, главным образом тетраэтилортосиликата [10], из которого приготавливают суспензию в смеси воды и спирта. При добавлении аммиака к предварительно перемешанному (взбалтыванием) раствору в результате химической реакции образуются шарики кремнезема одинакового диаметра. Наиболее трудная задача—найти способ уплотнить шарики для того, чтобы уменьшить объем пустот между ними и таким образом улучшить прозрачность. Пропитка пластиком приводит к неравномерной усадке шариков при его затвердевании, поэтому применение таких веществ нежелательно, так как образующийся материал следует считать имитацией, а не синтетическим опалом. Едва ли можно полагать, что природный материал содержит пластик Поэтому предпочтительнее уплотнять шарики нагреванием при температурах между 500 и 800°С. Кристаллический кремнезем образуется при температурах выше 800°С, а опалы хорошей прочности и твердости получают нагреванием при более низких температурах. [c.119]
В большинстве случаев минеральный состав почвенного аэрозоля включает в себя кварц и другие соединения кремния, глиноземы, карбонаты и кальциты, окиси железа, гипс кроме того, почвенный аэрозоль содержит, как правило, определенное количество микроэлементов и сравнительно небольшое количество органических веществ. Обширный цикл исследований содержания различных веществ и элементов в почвенном аэрозоле выполнен сотрудниками ЛГУ [20, 25]. В табл. 1.7 приведены данные о содержании ряда элементов в аэрозоле приземного слоя воздуха в Репетеке и Анкате. [c.38]
В дальнейшем Зигмонди, Бахман и Стевенсон [281 установили, что степень сжатия геля зависит и от характера дисперсионной среды. Высушивание алкогеля и бензогеля двуокиси кремния сопровождается значительно меньшим сжатием геля по сравнению с гидрогелем. Иначе говоря, замена воды гидрогеля названными органическими веществами приводит к образованию продукта с большим размером капиллярных пустот. [c.10]
chem21.info
Оксид кремния (IV) и кремниевые кислоты - Кислородные соединения - Подгруппа углерода и кремния - Неорганическая химия
Оксид кремния SiO2 — твердое, очень тугоплавкое вещество (температура плавления более 1700 °С), широко распространенное в природе, где оно встречается главным образом в виде минерала кварца, а также кристобалита и тридимита.
При обычных температурах устойчивой модификацией является кварц, с ростом температуры наблюдаются полиморфные превращения:
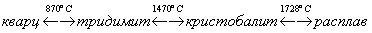
Кремнезем всех модификаций в виде мономера не существует; он всегда полимерен и «построен» из тетраэдров [SiO4], образующих очень прочную атомную решетку
Каждый атом кремния в кристаллах (SiO2)n тетраэдрически окружен четырьмя атомами кислорода, каждый из которых является мостиковым. Через общий атом кислорода тетраэдры [SiO4] под разными углами связываются друг с другом, образуя непрерывную трехмерную решетку; взаимное расположение тетраэдров [SiO4] в пространстве определяет ту или иную модификацию кремнезема.
В различных модификациях кремнезема прочность связей неодинакова. Это влияет на величину углов Si-О-Si и расстояний Si-О, например угол связи Si-О-Si в различных модификациях кремнезема изменяется от 120 до 180°. Переходы кварц-тридимит-кристобалит сопровождаются разрывом и преобразованием связей, что может происходить только при высоких температурах.
Кварц. Нередко встречается в природе в форме чрезвычайно хорошо образованных кристаллов, иногда значительной величины. Кристаллы образованы из тетраэдров, расположенных винтообразно вокруг центральной оси, в виде спирали. В одном и том же кристалле направление спирали может быть противоположным. Такие кристаллы являются оптическими изомерами. Они вращают плоскость поляризации света, причем могут быть как право-, так и левовращающими. Те и другие кристаллы отличаются как предмет от своего зеркального изображения.
Кварц используется в различных областях науки и техники, и его кристаллы часто выращиваются искусственно. Некоторые разновидности кварца носят особые названия. Прозрачные бесцветные кристаллы называют горным хрусталем. Встречаются и окрашенные разновидности кварца: розовый кварц, фиолетовый (аметист), темно-коричневый (дымчатый топаз), зеленый (хризопраз) и др. Мелкокристаллическая модификация кварца с примесями других веществ называется халцедоном. Разновидностями халцедона являются агат, яшма и др. Горный хрусталь и окрашенные разновидности кварца используют как драгоценные и полудрагоценные камни.
Тридимит встречается в вулканических породах, однако в очень небольших количествах. Известен тридимит и метеоритного происхождения.
Кристобалит в природе иногда встречается в виде мелких кристаллов, включенных в лаву, подобно тридимиту. Тридимит и кристобалит обладают более «рыхлой» структурой, нежели кварц. Так, плотность кристобалита, тридимита и кварца равна 2,32; 2,26 и 2,65 г/см3 соответственно.
Расплав кремнезема при медленном охлаждении легко образует аморфное кварцевое стекло. Кремнезем в виде стекла встречается и в природе. Плотность аморфного стекла равна 2,20 г/см3 — ниже, чем у всех кристаллических модификаций. Кварцевое стекло имеет незначительный температурный коэффициент расширения, поэтому из него готовят лабораторную посуду, устойчивую к резким изменениям температуры.
Все модификации кремнезема в воде практически нерастворимы (при температуре 25 °С растворимость кварца составляет 7, кристобалита — 12, тридимита — 16, кварцевого стекла — 83 мг/л). Поэтому при обычных условиях на них действуют лишь растворы щелочей и плавиковая кислота:
SiO2 + 2КОН = К2SiO3 + Н2О, (1)
SiO2 + 4НF = SiF4↑ + 2Н2О. (2)
Последняя реакция используется при «травлении» стекла.
Приставленый диоксид кремния реагирует с основными оксидами, щелочами (реакция (1)) и карбонатами с образованием силикатов:
SiO2 + СаО = СaSiO3, (3)
SiO2 + Na2СО3 = Nа2SiO3 + СО2. (4)
Реакции (3) и (4) лежат в основе промышленного получения различных стекол, а также цемента. Так, состав обычного стекла (например, оконного, для изготовления посуды) выражается формулой Na2О.СаО.6SiO2. Такое стекло получают сплавлением смеси соды, песка и известняка. Процесс проводят при температуре ~1400 °С до полного удаления газов:
Na2СО3 + СаСО3 + 6SiO2 = Nа2О.СаО.6SiO2 + 2СО2↑.
Для получения специальных сортов стекла — огнеупорного, «небьющегося» — при варке добавляют оксиды бария, свинца, бора. Для получения цветных стекол вносят также различные добавки, например добавка оксида кобальта Со2О3 дает синий цвет, оксида хрома Сr2О3 — зеленый, двуоксида марганца МnО2 — розовый.
Оксид SiO2 является ангидридом ряда кремниевых кислот, состав которых можно выразить общей формулой хSiO2∙yН2O, где х и у — целые числа: 1) х = 1, у = 1: SiO2.Н2О, т.е. Н2SiO3 — метакремниевая кислота; 1) х = 1, y = 2: SiO2.2Н2О, т.е. ортокремниевая кислота; 1) x = 2, у = 1: 2SiO2.Н2О, т.е. Н2Si2O5 – двуметакремниевая кислота.
Кислоты, молекулы которых содержат более одной молекулы SiO2, относятся к поликремниевым.
Самая простая из кремниевых кислот — Н2SiO3, которую часто называют просто кремниевой, а ее соли — силикатами. Из силикатов в воде растворимы только силикаты натрия и калия, остальные силикаты — тугоплавкие, нерастворимые в воде вещества.
Растворы силикатов мутнеют при стоянии на воздухе, так как находящийся в нем СО2 вытесняет кремниевую кислоту из ее солей (Н2SiO3 слабее угольной кислоты; константа диссоциации Н2SiO3 по первой ступени равна К1 = 2,2.10-10).
Н2SiO3 практически нерастворима в воде — это свойство используют как качественную реакцию для обнаружения силикат-ионов:
Na2SiO3 + СО2 + Н2О = Nа2СО3 + Н2SiO3↓.
Получают силикаты сплавлением SiO2 со щелочами или карбонатами.
Концентрированные растворы силикатов натрия и калия называют жидким стеклом, они имеют сильнощелочную реакцию вследствии того, что сильно гидролизованы:
К2SiO3 + Н2О  2КОН + Н2SiO3↓.
2КОН + Н2SiO3↓.
Жидкое стекло используют, например, для изготовления клея, водонепроницаемых тканей.
Цемент очень широко используется в строительстве как вяжущий материал, который при смешивании с водой затвердевает. Обычно цемент получают в больших вращающихся печах, где производят обжиг и размол различных силикатов (при температуре -1000 °С).
Различают несколько типов цементов, однако условно можно выделить два типа цементов по принципу их «свертывания» — обычный цемент и портландский цемент. Процесс «схватывания» обычного цемента, состоящего из силиката кальция, происходит вследствие образования карбоната кальция за счет углекислого газа воздуха:
СаО.SiO2 + СО2 + Н2О = СаСО3↓ + Н2SiO3↓.
При схватывании портландского цемента углекислота не участвует в процессе, а происходит гидролиз силикатов с последующим образованием нерастворимых кристаллогидратов:
Са3SiO5 + Н2О = Са2SiO4 + Са(ОН)2,
Са2SiO4 + 4Н2О = Са2SiO4.4Н2O↓.
www.himhelp.ru
химические свойства, получение, применение :: SYL.ru
Все химические соединения, существующие в природе, делятся на органические и неорганические. Среди последних выделяют следующие классы: оксиды, гидроксиды, соли. Гидроксиды подразделяются на основы, кислоты и амфотерные. Среди оксидов также можно выделить кислотные, основные и амфотерные. Вещества последней группы могут проявлять как кислотные, так и основные свойства.
Химические свойства кислотных оксидов
Такие вещества имеют своеобразные химические свойства. Кислотные оксиды способны вступать в химические реакции только с основными гидроксидами и оксидами. К этой группе химических соединений относятся такие вещества, как углекислый газ, диоксид и триоксид серы, триоксид хрома, гептаоксид марганца, пентаоксид фосфора, триоксид и пентаоксид хлора, тетра- и пентаоксид азота, диоксид кремния. Такого рода вещества называются еще ангидридами. Кислотные свойства оксидов проявляются прежде всего во время их реакций с водой. При этом образуется определенная кислородосодержащая кислота. К примеру, если взять триоксид серы и воду в равных количествах, получим сульфатную (серную) кислоту. Таким же образом можно синтезировать и фосфорную кислоту, добавив воды к оксиду фосфора. Уравнение реакции: Р2О5 + 3Н2О = 2Н3РО4. Точно таким же образом возможно получить такие кислоты, как нитратная, кремниевая и т. д. Также кислотные оксиды вступают в химическое взаимодействие с основными либо амфотерными гидроксидами. Во время такого рода реакций образуются соль и вода. Например, если взять триоксид серы и добавить к нему гидроксид кальция, получим сульфат кальция и воду. Если же добавить гидроксид цинка, получим сульфат цинка и воду. Еще одна группа веществ, с которыми взаимодействуют данные химические соединения — основные и амфотерные оксиды. При реакциях с ними образуется только соль, без воды. К примеру, добавив к триоксиду серы амфотерный оксид алюминия, получим сульфат алюминия. А если смешать оксид кремния с основным оксидом кальция, получим силикат кальция. Кроме того, кислотные оксиды реагируют с основными и нормальными солями. При реакции с последними образуются кислые соли. Например, если к углекислому газу добавить карбонат кальция и воду, можно получить гидрокарбонат кальция. Уравнение реакции: СО2 + СаСО3 + Н2О = Са(НСО3)2. При реакции кислотных оксидов с основными солями образуются нормальные соли.
Такого рода вещества называются еще ангидридами. Кислотные свойства оксидов проявляются прежде всего во время их реакций с водой. При этом образуется определенная кислородосодержащая кислота. К примеру, если взять триоксид серы и воду в равных количествах, получим сульфатную (серную) кислоту. Таким же образом можно синтезировать и фосфорную кислоту, добавив воды к оксиду фосфора. Уравнение реакции: Р2О5 + 3Н2О = 2Н3РО4. Точно таким же образом возможно получить такие кислоты, как нитратная, кремниевая и т. д. Также кислотные оксиды вступают в химическое взаимодействие с основными либо амфотерными гидроксидами. Во время такого рода реакций образуются соль и вода. Например, если взять триоксид серы и добавить к нему гидроксид кальция, получим сульфат кальция и воду. Если же добавить гидроксид цинка, получим сульфат цинка и воду. Еще одна группа веществ, с которыми взаимодействуют данные химические соединения — основные и амфотерные оксиды. При реакциях с ними образуется только соль, без воды. К примеру, добавив к триоксиду серы амфотерный оксид алюминия, получим сульфат алюминия. А если смешать оксид кремния с основным оксидом кальция, получим силикат кальция. Кроме того, кислотные оксиды реагируют с основными и нормальными солями. При реакции с последними образуются кислые соли. Например, если к углекислому газу добавить карбонат кальция и воду, можно получить гидрокарбонат кальция. Уравнение реакции: СО2 + СаСО3 + Н2О = Са(НСО3)2. При реакции кислотных оксидов с основными солями образуются нормальные соли. 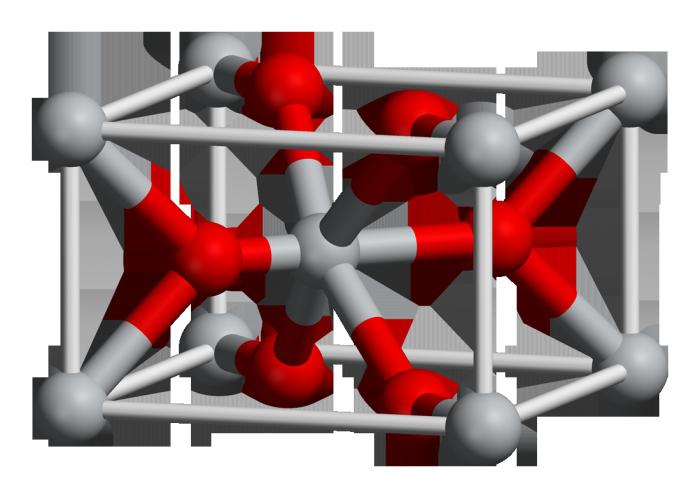 С кислотами и с другими кислотными оксидами вещества данной группы не взаимодействуют. Точно такие же химические свойства способны проявлять и амфотерные оксиды, только кроме этого они также взаимодействуют и с кислотными оксидами и гидроксидами, то есть сочетают в себе и кислотные, и основные свойства.
С кислотами и с другими кислотными оксидами вещества данной группы не взаимодействуют. Точно такие же химические свойства способны проявлять и амфотерные оксиды, только кроме этого они также взаимодействуют и с кислотными оксидами и гидроксидами, то есть сочетают в себе и кислотные, и основные свойства.
Физические свойства и применение кислотных оксидов
Существует довольно много различных по своим физическим свойствам кислотных оксидов, поэтому возможно их использование в самых разных сферах промышленности.
Триоксид серы
Чаще всего данное соединение используется в химической отрасли промышленности. Оно является промежуточным продуктом, образующимся в процессе получения сульфатной кислоты. Данный процесс заключается в том, что пирит железа сжигают, получая при этом диоксид серы, далее последний подвергают химической реакции с кислородом, вследствие которой образуется триоксид. Далее из триоксида путем добавления к нему воды синтезируют серную кислоту. При нормальных условиях это вещество представляет собой бесцветную жидкость с неприятным запахом. При температуре же ниже шестнадцати градусов по Цельсию триоксид серы застывает, образуя кристаллы.

Пентаоксид фосфора
Кислотные оксиды также включают в свой список пентаоксид фосфора. Он представляет собой белое снегообразное вещество. Применяют его как водоотнимающее средство из-за того, что он очень активно вступает во взаимодействие с водой, образуя при этом фосфорную кислоту (также он используется в химической промышленности для ее добывания).
Углекислый газ
Это самый распространенный в природе из кислотных оксидов. Содержание данного газа в составе атмосферы Земли — около одного процента. В нормальных условиях данное вещество представляет собой газ, не имеющий ни цвета, ни запаха. Диоксид углерода широко используется в пищевой промышленности: для производства газированных напитков, в качестве разрыхлителя теста, как консервант (под обозначением Е290). Сжиженный углекислый газ применяется для изготовления огнетушителей. Также данное вещество играет огромную роль в природе — для совершения фотосинтеза, в результате которого образуется жизненно важный для животных кислород. Растениям необходим именно углекислый газ. Данное вещество выделяется при горении всех без исключения органических химических соединений.

Диоксид кремния
В нормальных условиях имеет вид бесцветных кристаллов. В природе его можно встретить в виде множества разнообразных минералов, таких как кварц, хрусталь, халцедон, яшма, топаз, аметист, морион. Данный кислотный оксид активно используется в производстве керамики, стекла, абразивных материалов, бетонных изделий, волокно-оптических кабелей. Также данное вещество применяется в радиотехнике. В пищевой промышленности его применяют в виде добавки, зашифрованной под названием Е551. Здесь он используется для сохранения первоначальной формы и консистенции продукта. Данную пищевую добавку можно найти, к примеру, в растворимом кофе. Кроме того, диоксид кремния используют в производстве зубных паст.

Гептаоксид марганца
Данное вещество представляет собой буро-зеленую массу. Используется оно в основном для синтеза марганцевой кислоты путем добавления к оксиду воды.
Пентаоксид азота
Он представляет собой твердое бесцветное вещество, имеющее форму кристаллов. Применяют его в большинстве случаев в химической промышленности для получения азотной кислоты или других оксидов азота.
Триоксид и тетраоксид хлора
Первый представляет собой газ зелено-желтого цвета, второй — такой же расцветки жидкость. Используются они в основном в химической промышленности для получения соответствующих хлористых кислот.
Получение кислотных оксидов
Вещества данной группы возможно получить вследствие разложения кислот под воздействием высоких температур. В таком случае образуется нужное вещество и вода. Примеры реакций: Н2СО3 = Н2О + СО2; 2Н3РО4 = 3Н2О + Р2О5. Гептаоксид марганца можно получить в результате воздействия на перманганат калия концентрированного раствора сульфатной кислоты. Вследствие этой реакции образуются нужное вещество, сульфат калия и вода. Углекислый газ можно получить вследствие разложения карбоновой кислоты, взаимодействия карбонатов и гидрокарбонатов с кислотами, реакций пищевой соды с лимонной кислотой.
Заключение

Подведя итог всему написанному выше, можно сказать, что кислотные оксиды получили широкое применение в химической промышленности. Лишь некоторые из них используются также в пищевой и других отраслях.
Кислотные оксиды — это большая группа неорганических химических соединений, которые имеют большое значение и могут применяться для получения самых разнообразных кислородосодержащих кислот. Также в эту группу входят два важнейших вещества: углекислый газ и диоксид кремния, первый из которых играет огромную роль в природе, а второй представлен в форме многих минералов, часто использующихся в изготовлении украшений.
www.syl.ru











