ГОСТ 4245-72 Вода питьевая. Методы определения содержания хлоридов. Хлориды в питьевой воде
Примеси хлоридов в питьевой воде
Обзор характеристик воды с повышенным содержанием хлоридов (натрия, кальция), их норм примесей, а также раскрытие вопроса вредного воздействия на живые организмы, бытовую технику и коммуникации.

Хлориды – это соли соляной кислоты. Магматические породы с хлорсодержащими минералами (хлорапатит, содалит и др.), а также соленосные отложения (галит) являются первичными источниками данного элемента.
Все природные воды содержат в своем составе хлориды, чаще всего встречающиеся в виде натриевых, магниевых и кальциевых солей. Их естественное содержание в грунтовых и артезианских водах обусловлено вулканическими выбросами, а также результатами кругового взаимодействия атмосферных осадков с почвами и обмена через атмосферу с океаном.
Основные характеристики хлоридосодержащих вод
Хлориды, содержащиеся в значительном количестве в воде, могут быть следствием вымывания хлористых соединений или поваренной соли из пластов, соприкасающихся с водой.
Воды подземных источников, некоторых озер и морей в большом количестве содержат хлорид натрия (NaCl), присутствующий в воде хлорид кальция (CaCb) придает ей некарбонатную жесткость.
При оценке санитарного состояния водоема учитывают показатель содержания хлоридов в воде. Так, к примеру, незначительное содержание отмечается в водах северной части России, обычно, не выше 10 мг/л, тогда как соответствующий показатель, характерный для южных регионов, доходит до 10-100 мг/л.
Прослеживается тенденция заметных сезонных колебаний концентрации хлорид-ионов в поверхностных водах, что связано с коррелирующим изменением общей минерализации. Это обусловлено критерием загрязнения водоема из-за попадания в него хозяйственно-бытовых стоков.
Высокое содержание хлоридов заметно ухудшает вкусовые качества воды, делает ее соленой на вкус, а также практически непригодной для хозяйственных и технических нужд, в том числе для оросительных работ на сельскохозяйственных угодьях.
Нормы примесей в воде
ПДК (предельно допустимая концентрация) хлоридов в воде не должна превышать 350 мг/л, в противном случае вода будет неприятной по вкусу – чрезмерно соленой.
Соленые (хлоридные) воды содержат соли хлоридной группы. Чаще всего катионный состав таких вод представляет натрий, образующий в сочетании с хлором поваренную соль, чем и обеспечен их соленый вкус. Причем, хлористый натрий заметно доминирует относительно других солей практически во всех хлоридных водах.
Хлористый магний преобладает в горько-соленых водах, где его все равно намного меньше, чем поваренной соли. Превышает количество растворенной поваренной соли в некоторых случаях содержащийся хлористый кальций в водах хлоридно-кальциевого типа.
Отличием от карбонатных и сульфатных ионов является их не предрасположенность к созданию ионных ассоциированных пар. Слабо выраженная сорбция с взвешенными веществами, легкая растворимость и потребление водными организмами объясняется хорошей миграционной способностью хлоридных анионов.
Вред воды с повышенным содержанием хлоридов для здоровья человека
При попадании в организм человека, а также домашних животных воды, содержащей избыточное количество хлоридов:
- раздражаются слизистые оболочки, глаза, кожные покровы, дыхательные пути;
- проявляется негативное воздействие на секреторную деятельность желудка;
- ухудшается пищеварение;
- нарушается водно-солевой баланс;
- возникает вероятность развития заболеваний системы кровообращения;
- появляется склонность к возникновению новообразований мочеполовых органов, органов пищеварения, желудка, пищевода;
- избыточное поступление в организм хлористого натрия увеличивает частоту сердечно сосудистых заболеваний;
- появляется склонность к гипертензивным состояниям, повышенной реактивности сосудов;
- возникает вероятность желче- и мочекаменных заболеваний.
Вред хлоридосодержащей воды для бытового оборудования
- Ввиду агрессивности воды с избыточным содержанием хлоридов увеличивается интенсивность коррозии металлических поверхностей бытовых приборов;
- появление осадка на нагревательных элементах стиральных и посудомоечных машин, электрических бойлеров, электрочайников приводит эти бытовые электроприборы к несвоевременному выходу из строя;
- поломка бытовых электроприборов увеличивает затраты средств на восстановительный ремонт или их полную замену, вследствие их дальнейшей непригодности.
Воздействие на коммуникации
- Коррозия и появление темных пятен на поверхности нержавеющих раковин;
- растворенные в избыточном количестве соли кальция и магния придают воде повышенную жесткость, которая способствует возникновению накипи (осадка) в трубах и на стенках отопительных котлов;
- ввиду меньшей теплопроводности накипи, по сравнению с металлом, из которого изготовлены трубы и нагревательные приборы происходит большая затрата энергии и времени на подогрев воды. Как следствие – недостаточно горячие батареи в помещениях;
- низкая теплоотдача служит причиной перегрева нагревательных элементов, на которых появляются деформации, трещины и вздутия, ведущие к поломке оборудования;
- точечная коррозия (очаги ржавчины) – еще одна причина, обусловленная накипью и приводящая к разрушению стенок котлов и труб;
- создание частых аварийных ситуаций, существенное сокращение сроков между плановыми ремонтами, увеличение затрат на обслуживание и ремонт – итоги проявления взаимодействия оборудования с водой, содержащей избыточное количество хлоридов.
Сохраните статью в соцсети:
Alex, 28 апреля 2016.Задайте свой вопрос по статье
sistemyochistkivody.ru
содержание хлоридов
Содержание хлоридов в исследуемом растворе (рС1—) устанавливают по градуировочному графику.[ ...]
Содержание хлорид-ионов в воде природных водоемов варьирует в широких пределах. В речной и озерных водах, особенно в северных районах нашей страны (см. рис. 3.8), концентрация их невелика. Однако с увеличением минерализации воды абсолютное и относительное количество С1 возрастает;, в морях и большей части соляных озер он является главным анионом; в морской воде хлорид-ионы составляют 87% массы всех анионов. Объясняется это хорошей растворимостью хлоридов кальция, магния, натрия (см. п. 2.4.2.2) и малой растворимостью Са504 и СаС03. Поэтому с увеличением солесодержания в воде такие широко распространенные ионы, как БО и С03 (НСО ), достигая величин произведения растворимости в присутствии ионов Са2+ (см. п. 2.4.4), начинают выделяться в осадок, уступая» место иону С1 .[ ...]
Содержание хлорид-иона можно определять титрованием 0,05 н. раствором А§1 03, но лучше всего потенциометрически относительно серебряного электрода, покрытого хлоридом серебра. Предел обнаружения в зависимости от чувствительности титрования составляет 1—5 млн-1 в 60 л воздуха.[ ...]
Определение хлоридов служит контролем постоянства солевого фона сточной воды, изменяющейся во время очистки в органической части, и для суждения о «согласованности» анализируемых проб. Содержание хлоридов колеблется от 180 до 300 мг/л.[ ...]
Содержание хлоридов — ниже допустимой нормы, поэтому применение сточных вод в сельском хозяйстве при наличии достаточных площадей вполне возможно. Однако предварительно необходимо проверить, нужны ли и в какой степени мероприятия по уменьшению, а в некоторых случаях и уничтожению неприятного запаха.[ ...]
Содержание хлоридов в воде определяет и ее пригодность для питья. Для питьевой воды предельное значение составляет 200 мг/л. Вода с ббльшим содержанием либо солона, либо горька на вкус. Содержание хлоридов в воде также определяет возможность ее использования в сельском хозяйстве, в том числе для парников и оранжерей. В зависимости от вида растений предельная концентрация хлоридов составляет 50—300 мг/л.[ ...]
Хлориды являются составной частью большинства природных вод. Как и сульфаты, они определяют некарбонатную жесткость воды. Содержание хлоридов естественного происхождения имеет большой диапазон колебаний. Однако в воде рек концентрация хлоридов невелика — она не превышает обычно 10 мг/л, поэтому повышенное количество хлор-ионов указывает на загрязнение .источника сточными водами. В воде источников централизованного водоснабжения концентрация хлоридов не должна превышать 350 мг/л.[ ...]
Хлориды являются составной частью большинства природных вод. Большое содержание хлоридов геологического происхождения в поверхностных водах — явление редкое. Поэтому обнаружение большого количества хлоридов является показателем загрязнения воды бытовыми или некоторыми промышленными сточными водами. В промышленных сточных водах содержание хлоридов зависит от характера производства. Постепенное повышение содержания хлоридов в поверхностных водах может служить мерилом загрязнения водоемов сточными водами.[ ...]
Хлориды - главные ионы природных вод, обладают большой миграционной способностью, что объясняется их хорошей растворимостью, слабо выраженной способностью к сорбции на взвешенных веществах и к потреблению водными организмами. Хлориды ухудшают вкусовые качества воды и делают ее малопригодной для питьевого водоснабжения, поэтому контроль содержания хлоридов в воде водоемов имеет важное значение для оценки качества воды. Для рыбохозяйственных водных объектов ПДК хлоридов составляет 300 мг/л.[ ...]
Содержание хлоридов также более или менее постоянно. Изменение массы хлоридов указывает на примесь производственных сточных вод.[ ...]
Хлориды являются преобладающим анионом в высокоминерализованных водах. Концентрация хлоридов в поверхностных водах подвержена сезонным колебаниям, коррелирующим с изменением общей минерализации воды. В незагрязненных речных водах и водах пресных озер содержание хлоридов колеблется от долей миллиграмма до десятков и сотен, в подземных и морских водах - значительно выше.[ ...]
При содержании хлоридов менее 250 мг/л берут 100 мл фильтрованной испытуемой воды. При большем содержании хлоридов берут 10-50 мл. Испытуемую воду наливают в две конические колбы, доводят до 100 мл дистиллированной водой, прибавляют 5 капель раствора К2Сг04. Раствор в одной колбе титруют AgN03, а вторая колба используется для контроля.[ ...]
Помимо хлоридов кальция и магния в составе солей, растворенных в воде, присутствующей в сырье, находится хлорид натрия, который, как известно, гидролизу не подвергается, но существенно повышает проводимость коррозионной среды и за счет этого повышает ее агрессивность. С другой стороны, он способствует развитию питтинговой коррозии и коррозионному растрескиванию аустенит-ных сталей, так как, так же как хлориды магния и кальция, является поставщиком ионов хлора. Именно этим и объясняются, на наш взгляд, аномально высокие скорости коррозии верхних тарелок колонны, выполненных из стали 12Х18Н10Т в 1997 г., когда участились вынужденные остановки установки, а на завод поступала нефть с высоким содержанием хлоридов и воды. Как показано в отчетах главного технолога завода, всего после нескольких дней эксплуатации колонны в условиях образования аномально высокого содержания НС1 глубина поражения этих элементов достигла 0,5 мм. Таким образом, применявшиеся методы защиты (ингибирование, нейтрализация и использование тарелок из стали 12Х18Н10Т) не смогли привести к должному уровню надежности эксплуатации аппарата. Применение защитного колпака из стали 08Х17Н13М2Т можно считать лишь временной мерой, так как эта сталь, хоть и в меньшей мере, чем 12Х18Н10Т, все-таки подвержена питтинговой коррозии под действием хлоридов, особенно в кислой среде.[ ...]
Рио.35. Влияние содержания А1СЦ на величину pH и выход активного хлора в растворах с содержанием хлоридов 0.427 г-ион/л: I - выход активного хлора. 2 - напряжение, 3 - pH исходного электролита, 4 - pH электролита после электролиза.[ ...]
В питьевой воде содержание хлоридов не должно превышать 30—50 мг/л, а содержание сульфатов — 60 мг/л. Однако это не всегда достижимо в некоторых южных маловодных районах нашей страны (Туркмения, Казахстан и др.), где местные водоисточники сильно минерализованы.[ ...]
| Изменение . содержания хлоридов в растворах дихлоруксусной | 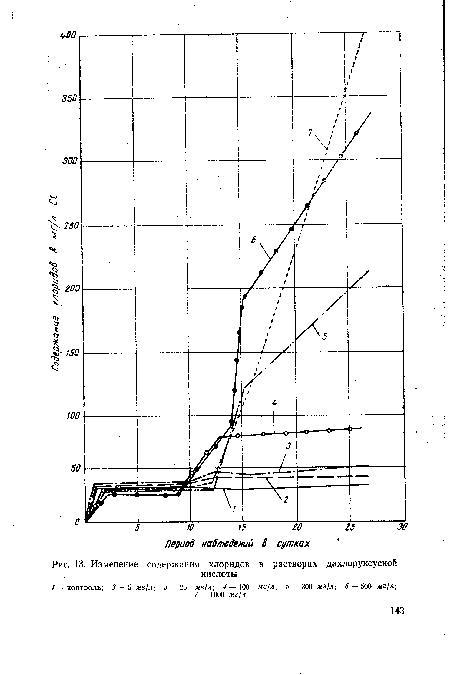 |
По ГОСТу предельное содержание сульфат-ионов в воде источников централизованного водоснабжения не должно превышать 500 мг/л, но, как правило, в речной воде концентрация сульфатов составляет 100—150 мг/л. Повышенная концентрация сульфатов может свидетельствовать о загрязнении источника сточными водами, в основном производственными. Хлориды являются составной частью большинства природных вод. Содержание хлоридов естественного происхождения имеет большой диапазон колебаний: Однако в воде рек концентрация хлоридов невелика — она превышает обычно 10—30 мг/л, поэтому повышенное количество хлор-ионов указывает на загрязнение источника сточными водами. В воде источников централизованного водоснабжения концентрация хлоридов не должна превышать 350 мг/л. Лимитирование верхнего предела концентраций сульфатов и хлоридов обусловлено тем, что более высокие концентрации этих ионов придают воде солоноватый привкус и могут вызывать нарушение в работе желудочно-кишечного тракта у людей. При некоторых соотношениях сульфатов и хлоридов вода становится агрессивной по отношению к различным типам бетона. Силикаты в растворе определяют лишь в тех природных водах, где их содержание зависит от геологическихусловий и присутствия некоторых организмов. Все эти кислоты при обычных для природных вод значениях pH малорастворимы и образуют в воде коллоидные растворы. Силикаты — нежелательная примесь в воде, питающей котлы, так как дает силикатную накипь на стенках котлов.[ ...]
Ход определения. Вносят в колбу несколько стеклянных бусинок, соединяют ее с обратным холодильником, нагревают содержимое колбы до кипения и кипятят 2 ч. Одновременно проводят холостое определение, взяв для него 25 мл дважды перегнанной (с добавлением перманганата в колбу для кипячения) воды. По охлаждении анализируемый раствор переносят в мерную колбу вместимостью 200 мл, стенки колбы при-, бора обмывают дважды перегнанной водой. Промывную - воду сливают в колбу и доводят той же водой анализируемый раствор до метки. Отобрав аликвотную порцию в 100 мл полученного раствора, переносят ее в стакан вместимостью 400—450 мл, разбавляют дистиллированной водой примерно до 300 мл и нейтрализуют 45%-ным раствором едкого натра: сначала приливают 30 мл этого раствора, потом после перемешивания прибавляют его по каплям до pH = 5—7. Нейтрализованный раствор нагревают до кипения, вносят 0,1 г прокаленной окиси магния и на-; гревают 20 мин при слабом кипении. Дают осадку собраться на дне стакана и фильтруют раствор через плотный фильтр, перенося осадок на фильтр к концу фильтрования. Осадок на фильтре промывают горячей водой до получения бесцветного фильтрата. Воронку с фильтром помещают на маленькую коническую колбу, в фильтре делают отверстие и через него смывают осадок горячей водой в колбу. Затем фильтр обрабатывают 3 мл 2 н. серной кислоты, обмывая ею предварительно стенки стакана. Фильтр и стакан хорошо промывают горячей водой, собирая промывные воды в ту же колбу и кипятят, содержимое колбы до полного растворения осадка. Полученный раствор переносят в мерную колбу вместимостью 100 мл, фильтруя его, если надо, через плотный фильтр. Приливают затем 5 мл 2 н. уксусной кислоты и смесь кипятят 5 мин. Охлаждают полученный ■ окрашенный раствор, разбавляют его дистиллированной водой до метки, перемешивают и измеряют его оптическую плотность при X = 536 нм в кювете с толщиной поглощающего слоя 5 см по отношению к раствору холостого опыта.[ ...]
Образцы для анализа на содержание органических веществ собирали в отмытые гексаном стеклянные бутылки вместимостью около 4 л, снабженные тефлоновыми пробками. Образцы для определения содержания хлоридов и взвешенных веществ отбирали в чистые полиэтиленовые литровые сосуды. Все образцы до анализа или экстрагирования хранили при 4 °С. Анализы и экстракцию взвешенных веществ проводили спустя 36 ч после отбора проб.[ ...]
Высокая растворимость хлоридов объясняет широкое распространение их во всех природных водах. В проточных водоемах содержание хлоридов обычно невелико (20-30мг/л). Незагрязненные грунтовые воды в местах с несолончаковой почвой обычно содержат до 30-50 мг/л хлор-иона. В водах, фильтрующихся через солончаковую почву, в 1 л могут содержаться сотни и даже тысячи миллиграммов хлоридов. Вода, содержащая хлориды в концентрации более 350 мг/л, имеет солоноватый привкус, а при концентрации хлоридов 500-1000 мг/л неблагоприятно влияет на желудочную секрецию. Содержание хлоридов является показателем загрязнения подземных и поверхностных водоисточников и сточных вод. Определение хлоридов ведется по методу Мора.[ ...]
Известно, что при растущем содержании хлоридов и сульфатов в бумаге, при уменьшающемся значении pH увеличивается корродирующее действие бумаги.[ ...]
Предварительные указания. Если содержание хлоридов во взятом объеме воды превышает 25 мг С1, то необходимо добавлять сульфат ртути. При наличии в воде других неорганических восстановителей следует внести поправку на потребление ими кислорода, которую устанавливают в 20 мл исследуемой воды путем ее титрования 0,0Ш раствором перманганата в слабокислой среде на холоде (см. «Определение перманганатной окисляемости»).[ ...]
Метод применяется для определения хлоридов при содержании их, превышающем 2 мг/л без разбавления можно титровать пробы с содержанием хлоридов до 400 мг/л. Точность определения +1—■ 3 мг/л. Для точного определения хлоридов при концентрациях меньше 10 мг/л пробы надо предварительно упаривать. В зависимости от концентрации хлоридов в пробе титруют 0,1 н., 0,05 н. или 0,02 н. раствором нитрата серебра.[ ...]
Наличие в сточных водах большого количества хлоридов отрицательно сказывается на процессе ионитовой очистки сточных вод. Следствием высокой концентрации хлор-ионов ¡в сточных водах являются низкая концентрация некаля в регенерате и большие расходы энергетических средств на его переработку. Содержание хлоридов в сточных водах ведет к снижению емкости поглощения ионита.[ ...]
При анализе целлюлоз, содержащих значительное количество хлоридов, может образоваться в колбе белый налет. В этом случае высушенный экстракт растворяют в 15 мл горячего спирта, добавляют 30 мл дистиллированной воды и определяют содержание хлоридов путем титрования 0,1 н. раствором AgNOз, используя в качестве индикатора К2СЮ4.[ ...]
При производстве калиевой селитры отходом является рассол с содержанием хлорида натрия 220—250 г/л. С вводом на заводе цеха утилизации хлорида натрия (рис. 1.12) содержание последнего в общем стоке снизилось с 4800 до 1200 мг/л. При этом ежегодно утилизируется свыше 3500 т хлорида натрия, 40 % которого выпускается в виде химической продукции реактивной чистоты.[ ...]
Между тем, расчетами по изменению солесодержания, в частности содержания хлоридов и солей жесткости, подтверждено уменьшение накипеобразования в 8—9 раз, т. е. примерно во столько же раз, как и при стендовых испытаниях.[ ...]
В работе [19] изучено также влияние низкомолекулярного электролита (хлорида натрия) на £-потенциал. При увеличении содержания хлорида натрия до 1,5 г/л и добавлении флокулянта отрицательный £■-потенциал резко уменьшался. При дальнейшем росте содержания хлорида натрия в сточной воде снижение £-потенциала замедлялось, оптимальная доза флокулянта увеличивалась, эффективность очистки ухудшалась. Это обусловлено уменьшением степени диссоциации ионогенных групп флокулянта, свертыванием макромолекул и снижением их суммарного положительного заряда.[ ...]
В ряде производств образуются жидкие и твердые отходы с высокой концентрацией хлорида натрия, а также органических и хлорорганических соединений. При огневой переработке этих отходов может быть получен продукт с высоким содержанием хлорида натрия, пригодный для дальнейшего использования.[ ...]
Биохимическое окисление 2,4-Д происходит с образованием хлор-ионов, причем повышение содержания хлоридов в пробах соответствует тому количеству хлор-ионов- которое содержится в 2,4-Д и высвобождается в процессе окисления.[ ...]
Настоящий стандарт распространяется на питьевую воду и устанавливает методы определения содержания хлоридов (хлор-иона).[ ...]
Основными показателями для характеристики состава очищенных сточных вод являются: остаток нефти или нефтепродуктов в воде (в мг/л), содержание взвешенных веществ по весу, высушенных при температуре 105°С (в мг/л). количество растворенного кислорода (в мг/л), прозрачность (в см), цветность (в град), окраска, содержание хлоридов и сероводорода (в мг/л), окисляемость (в мг02/л), активная реакция pH, биохимическая (ВПК) или химическая (ХПК) потребность в кислороде (в мг02/л). В особых случаях могут представлять интерес определение содержания сульфатов и сульфидов (в мг/л). Дополнительными показателями служат влажность и зольность осадка (в %). Определение влажности осадка должно производиться не реже одного раза в месяц.[ ...]
К настоящему времени качество подземных вод характеризуется следующим образом. В четвертичном горизонте в промышленных зонах увеличилось содержание хлоридов, сульфатов, сухого остатка и нитратов, концентрация последних превышает 50 мг/дм3.[ ...]
Основными проблемами угольных бассейнов являются очистка кислых и минерализованных сточных вод уральских месторождений и сточных вод с повышенным содержанием хлоридов и сульфатов Подмосковного бассейна, ликвидация мелких котельных и рекультивация земель для месторождений Восточной Сибири — очистка шахтных вод и хозяйственно-бытовых вод, рекультивация земель, для месторождений Дальнего Востока — строительство очистных сооружений для шахтных и карьерных вод, содержащих трудноосаждаемую дисперсную взвесь, повышение эффективности действующих сооружений и рекультивация земель.[ ...]
По данным табл.21, необходимую точность дозирования + 10% можно получить при учете двух вариантов работы ионатора: при работе на водах, не требующих добавления сульфата натрия (о содержанием хлоридов менее 10 к оумые анионов), режим приготовления 20 л концентрата - 6 мин электролиза при 3 А;, при работе с добавлением сульфата натрия режим приготовления - 7 мин электролиза при силе тока 3,2-3,4 А.[ ...]
В зависимости от результатов качественного определения отбирают 100 см3 испытуемой воды или меньший ее объем (10—50 см3) и доводят до 100 см3 дистиллированной водой. Без разбавления определяются хлориды в концентрации до 100 мг/дм3. pH титруемой пробы должен быть в пределах 6—10. Если вода имеет цветность выше 30°, пробу обесцвечивают добавлением гидроокиси алюминия. Для этого к 200 см3 пробы добавляют 6 см3 суспензии гидроокиси алюминия, а смесь встряхивают до обесцвечивания жидкости. Затем пробу фильтруют через беззольный фильтр. Первые порции фильтрата отбрасывают. Отмеренный объем воды вносят в две конические колбы и прибавляют по 1 см3 раствора хромовокислого калия. Одну пробу титруют раствором азотнокислого серебра до появления слабого оранжевого оттенка, вторую пробу используют в качестве контрольной пробы. При значительном содержании хлоридов образуется осадок А СЛ, мешающий определению. В этом случае к оттитрованной первой пробе приливают 2—3 капли титрованного раствора ЫаС1 до исчезновения оранжевого оттенка, затем титруют вторую пробу, пользуясь первой, как контрольной пробой.[ ...]
Контроль качества вода в емкости сезонного регулированйя постоянно показывает повышенный уровень минерализации этих вод, который зачастую превышает нормативы на 20-40 % и обусловливается. избыточным содержанием хлорида натрия. Основным источником его в сточных водах является регенерационный раствор, который используется для промывки ионообменных фильтров котельной.[ ...]
Отмеченное незначительное снижение количества гемоглобина у подопытных животных на 4-м месяце опыта по сравнению с контролем является статистически недостоверным. Содержание хлоридов и резервной щелочности в крови, а также хлоридов в моче во все сроки исследования не изменялось.[ ...]
Многие представители самого обширного в семействе рода парнолистник, насчитывающего около 100 видов, являются галофитами. Они населяют солончаки главным образом Азии, Африки и Австралии. Этот кустарник обладает небольшими мясистыми листьями и развивает мощный стержневой корень, который проникает до влажных горизонтов почвы.[ ...]
Известно, что чрезмерная соленость почвы характерна для многих горнорудных районов всего мира. В Германской Демократической Республике это является главным образом результатом добычи меди, сланца, поташа, бурого угля, а также производства соды. Большие количества хлоридов и солей, повышающих жесткость воды, попадают в реки с небольшим или средним расходом, вода которых используется для промышленных целей многими крупными коммерческими предприятиями. Даже после поглощения этих солей рекой (в Эльбе, например, в районе Магдебурга, в течение последних 20 лет среднегодовое содержание хлоридов составляло 77—423 мг/л и 9,9—20,5° общей жесткости) вредные последствия все же остаются значительными, что может быть продемонстрировано на следующих примерах.[ ...]
Количественный ионометрический экспресс-метод определения нитратов состоит в извлечении нитратов из материала раствором алюмокалиевых квасцов и последующим измерением нитрат-иона в вытяжке ионоселективным электродом. Метод непригоден для исследования продуктов, в которых содержание хлоридов превышает содержание нитратов более чем в 50 раз. Этот метод может быть использован только для анализа сырья.[ ...]
Имеются сообщения о возникновении гастроэнтеритов небактериального происхождения в Эссене (ФРГ) в 1959 г., которыми страдало около 7% населения (К. Im-hoff, 1970). Причиной было то, что засушливое лето 1959 г. обусловило значительное снижение расхода воды в реке Руре. Это снизило способность реки к разбавлению сточных вод. Содержание хлоридов в воде возросло со 100 до 507 мг/л, нитратов — до 24 мг/л, детергентов — до 1,2 мг/л. Частота повторного использования воды реки составила 0,9, что превышает допустимый предел (Н. Koenig et al„ 1970).[ ...]
Известен и нашел частичное применение в зарубежной практике [68] и метод разбрызгивания ОБР на пахотные земли после предварительной его нейтрализации. Однако использование указанного метода ограничивается типом и системой обработки бурового раствора. Этот метод не приемлем для минерализованных буровых растворов, т е , растворов с высоким содержанием хлоридов и других токсичных солевых компонентов. Но отсутствие в литературе сведений о нейтрализующих агентах не позволяет дать объективную оценку возможностей метода, а также практической и экономической целесообразности его применения.[ ...]
Известны отравляющие вещества самого различного действия, однако, попадая в воду, они ведут себя в основном как общеядовитые. На зараженность воды отравляющими веществами могут указывать некоторые внешние признаки и данные обычных методов контроля, так как наличие ОВ вызывает изменение многих показателей воды, например pH, окисляемости, хлоро-поглощаемости, содержания хлоридов и растворенного кислорода, а также данные биологических и бактериологических исследований. Поэтому все эти показатели в условиях возможного отравления воды ОВ должны определяться и фиксироваться систематически.[ ...]
При солянокислотном травлении стали взаимодействие 20%-ной кислоты с оксидами железа приводит к образованию хлористого и хлорного железа. Выводимый на регенерацию ОТР содержит, %: 5-10 HG1, 17-25 FeCl2, 0,4-0,8 FeClj. В многоступенчатых установках с противотоком обрабатываемого металла и травильного раствора в последнем могут быть получены очень низкая концентрация кислоты и весьма высокое содержание хлоридов железа (до 340 г/л). Продуктами регенерации являются соляная кислота, возвращаемая в травильную ванну, и оксид железа.[ ...]
Основным видом загрязнений является рудная и известняковая пыль. При контакте воды со шламом происходит выщелачивание извести и других компонентов, в результате чего солевой состав сточных вод претерпевает значительные изменения. Исследования показали, что pH воды возрастает с 7,5 до 12-13, щелочность с 1,3-3,6 до 21-22 мг-экв/дм3 в том числе гидратная от нуля до 17 мг-экв/дм3. Возрастает также содержание хлоридов и сульфидов.[ ...]
Загрязнение подземных вод в значительных объемах происходит за счет фильтрата —токсичной жидкости, выделяющейся со свалок твердых бытовых отходов. Только в черте города в Москве по официальным данным насчитывается более 100 свалок, а «полуночных»—вообще никогда не подсчитывалось. Состав фильтрата примерно может быть следующим и почти близким для всех свалок: повышенная до 10— 20 г/л минерализация, высокие содержания хлоридов и сульфатов, множество органических кислот (гуминовая, молочная, уксусная, пи-ровиноградная и др.), так называемые «ураганные» концентрации тяжелых металлов (в том числе и наиболее токсичных, таких, как ртуть), медикаментозные, санитарно-больничные, бактериологические и гель-минтозные загрязнения. Известно, что в теле свалок идут активные процессы брожения и гниения, т. е. разложения органики, конечным продуктом которых являются вода, тёпло, биогаз (диокси!д углерода и метан). Нередки случаи самовозгорания биогаза с негативными экологическими последствиями, так как многие свалки насыщены синтетическими пластмассами, горение которых в низкотемпературном режиме приводит к образованию диоксинов, попадающих в атмосферу, в гидросферу, а далее в трофические сети экосистем.[ ...]
Процесс реализуется в противоточном режиме в реакторе скруб-берного типа при 400°С. Его продуктами являются газ (около 7% HCl, 40 — водяных паров, 0,8-1,0% 02) и оксид железа. Основная масса последнего оседает в растворе, выделяется из него и отгружается потребителю: Газ очищается от остатков Fe203, охлаждается и отправляется в абсорбционную колонну, орошаемую водой из промывочных ванн. Из нижней ее части выводится 16-20%-ная соляная кислота с небольшим, около 2%, содержанием хлоридов железа. Газ после абсорбционной колонны освобождается от остатков хлористого водорода и других примесей в скруббере, орошаемом раствором каустической соды (NaOH), и выбрасывается в дымовую трубу.[ ...]
Воду с сухим остатком до 1000 мг/л называют пресной, свыше 1000 мг/л - минерализованной. Вода, содержащая избыточное количество минеральных солей, непригодна для питья, т.к. имеет соленый или горько-соленый вкус, а ее употребление (в зависимости от состава солей) приводит к различным неблагополучным физиологическим отклонениям в организме. С другой стороны, слабоминерализованная вода с сухим остатком ниже 50-100 мг/л неприятна на вкус, длительное ее употребление может привести также к некоторым неблагоприятным физиологическим сдвигам в организме (уменьшение содержания хлоридов в тканях и др.). Такая вода, как правило, содержит мало фтора и других микроэлементов.[ ...]
Данные, касающиеся окислительно-воостановительного потенциала проб, получены только для весны 1976 г. Исследовали воды скважины 12В; значения окислительно-восстановительного потенциала там изменялись от +100 до +150 мВ (максимум + 170 мВ). Неожиданно наиболее низкие значения ( + 55 и + 65 мВ) были зарегистрированы в скважинах 10 и 4 -соответственно. Вода скважины 7 имела окислительно-восстановительный потенциал +105 мВ. В ручье наблюдалось увеличениеокис-лительно-востановительного потенциала от +90 мВ (измерено выше по течению) до +107 мВ (измерено ниже по течению). За исключением летних и осенних данных анализа рроб из скважины 6А, наблюдается общая тенденция к уменьшению содержания хлоридов с увеличением расстояния от очистной станции [6]. Воды скважины 3 и высачиваний ниже дороги характеризуются высоким содержанием хлоридов, отражая поступления солей с дороги, как отмечалось ранее. Во всех случаях происходило небольшое увеличение содержания хлоридов в ручье Вест Брук из-за высачиваний.[ ...]
ru-ecology.info
Очистка воды от хлоридов
Если вы обустроили скважину и хотите получать чистую воду для питьевых и бытовых нужд, не скупитесь на ее анализ – нередко такая вода совсем не соответствует санитарным нормам, и употреблять ее (особенно в пищу) опасно для здоровья.
Причины такого несоответствия могут быть разными – например, повышенное содержание минеральных солей. Чаще всего такое свойство имеют воды, добываемые с большой глубины: чем дальше от поверхности залегает водный горизонт, тем интенсивнее происходит обмен веществами между водой и окружающими ее горными породами. Уровень солености такой воды может значительно превосходить нормативы, так что для использования воды не обойтись без качественной водоподготовки.
Что такое хлориды
Один из показателей, что вам точно потребуется очистка воды – это наличие в ней солей соляной кислоты, т.е. хлоридов. Источниками их появления в вашей воде из скважины могут быть магматические породы с хлорсодержащими минералами (хлорапатит, содалит и др.), а также соленосные отложения (галит). Важно понимать, что наличие натриевых, магниевых и кальциевых солей в грунтовых и артезианских водах является естественным в результате вулканических выбросов или круговорота атмосферных осадков с почвами. Конечно, хлориды могут появляться в воде и по техногенным причинам – например, при сбросе хозяйственно-бытовых стоков в местах водозабора или рядом с ними.
Какую опасность таят хлориды?
Допустимое содержание хлоридов в воде регламентировано документом «СанПиН 2.1.4.1175-02. Вода питьевая», и этот норматив – не более 350 мг/л. Если этот показатель превышен, то вода не может считаться пригодной ни для технических, ни для бытовых, ни тем более для питьевых нужд.
Давайте разберем на примерах, какое пагубное влияние может оказать вода с повышенным содержанием хлоридов при использовании для разного назначения.
Назначение: Приготовление пищи или употребление для питьяПоследствия: ущерб здоровью
- ухудшение секреторной деятельности желудка и работы пищеварительной системы
- риск развития болезней, связанных с системой кровообращения
- возможность появления новообразований на внутренних органах
- увеличивается частота сердечно-сосудистых заболеваний
- появляется риск заболеваний желчного пузыря и мочекаменных болезней
Назначение: Использование для мытья, приема душа и ванныПоследствия: 1) ущерб здоровью
- увеличивается риск проявлений аллергических реакций
- ухудшение состояния волос, кожи
- раздражение слизистых оболочек, в т.ч. глаз
2) ущерб для сантехнических изделий и бытовой техники
- солевой осадок провоцирует поломки и преждевременный выход техники из строя
- эстетический вид ванны, душевой кабины, фурнитуры будет испорчен белесыми разводами
- хлориды в воде приводя к коррозии металлов, с которыми взаимодействует эта вода (трубопровод, полотенцесушители), что может привести к протечкам
Очевидно, что система водоочистки, удаляющая хлориды из воды, не только сэкономит материальные средства, но и способствует сохранению вашего здоровья. Лучше предупредить проблемы, чем потом бороться с их последствиями.
Система обратного осмоса как наиболее эффективный способ удаления хлоридов
Наша многолетняя практика показывает, что наиболее эффективная очистка воды от хлоридов осуществляется посредством системы обратного осмоса.
Рассмотрим принцип работы этой системы, основанной на перетекании веществ через специальную полупроницаемую мембрану.Сначала неочищенная вода поступает в мембранный блок установки, где и находится вышеуказанная мембрана – она разделяет растворы разной концентрации. Затем со стороны потока повысительным насосом создается давление, большее, чем осмотическое. Хлориды и другие сконцентрированные примеси задерживаются мембраной и сливаются в дренаж, а фильтрат (обессоленная вода) поступает к потребителю. Удаление хлоридов может достигать 99,5%, а степень извлечения примесей определяется селективностью используемой обратноосмотической мембраны.
Метод обратного осмоса способен уменьшить концентрацию хлоридов от 5 г/л до нормативов питьевой воды. Такой метод эффективен не только для удаления из воды именно хлоридов, но и других солей, т.е. для обессоливания воды в общем. Чаще всего его применяют для водоочистки в коттеджах и на предприятиях.
Для оснащения вашего дома действительно качественной системой водоочистки, важно грамотно подобрать фильтр. Это поможет сделать точное знание предполагаемого расхода воды, т.к. нужно, чтобы он соответствовал пропускной способности фильтра. Если пропускная способность фильтра меньше или сильно больше расхода воды, то фильтр не будет справляться с очисткой или же будет работать вхолостую при более высокой стоимости оборудования.
Достоинства обратного осмоса для очистки воды от хлоридов
В первую очередь специалисты отмечают наиболее высокое качество очистки воды при использовании систем обратного осмоса по сравнению с другими способами. Еще один плюс – соответствие продуктивности и габаритов установки: несмотря на компактные размеры, система демонстрирует результат очистки от хлоридов сравнительный с ионным обменом, электродиализом, дистилляций или другими методами обессоливания.К достоинствам можно отнести и низкое энергопотребление установки.
В галерее выполненных работ вы можете ознакомиться с проектами (п. Аро и Лахта), в которых при повышенном содержании хлоридов, удалось обойтись без предварительной дорогостоящей водоподготовки перед системой обратного осмоса, что позволило значительно снизить затраты на установку системы очистки воды. Данные системы по сей день эффективно, стабильно и бесперебойно снабжают питьевой водой своих владельцев.
Компания «Фор-Ватер» специализируется на водоочистке, обладает большим опытом для надежного и качественного решения вопросов, в том числе в сфере очистки воды от хлоридов. Мы подберем необходимое оборудование по оптимальной цене, звоните: (812) 424-34-00, присылайте заявки на бесплатный расчет.
ОТВЕТИМ НА ВОПРОСЫ, подберём ОБОРУДОВАНИЕ, ПРИМЕМ ЗАКАЗ ПО ТЕЛЕФОНУ:
+7(812) 424-34-00 ЗАКАЗАТЬ ОБРАТНЫЙ ЗВОНОКООО «Фор-Ватер», телефон: 8 (812) 424-34-00; 8 (931) 251-01-39, e-mail: [email protected], г. Санкт-Петербург, ул. Ушинского, д. 4 корп. 3 лит.А, пом. 17Н. ИНН 7804530057 ОГРН 1147847118110
filter-spb.ru
ГОСТ 4245-72 Вода питьевая. Методы определения содержания хлоридов, ГОСТ от 09 октября 1972 года №4245-72
ГОСТ 4245-72
Группа Н09
ВОДА ПИТЬЕВАЯ
Drinking water. Methods for determination of chloride content
Дата введения 1974-01-01
1. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета стандартов Совета Министров СССР от 09.10.72
2. ВЗАМЕН ГОСТ 4245-48
3. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
4. Ограничение срока действия снято Постановлением Госстандарта СССР от 25.12.91 N 2121
5. ПЕРЕИЗДАНИЕ
Настоящий стандарт распространяется на питьевую воду и устанавливает методы определения содержания хлоридов (хлор-иона).Определение содержания хлор-иона в питьевой воде производят:при содержании хлор-иона от 10 мг/дм

1. МЕТОДЫ ОТБОРА ПРОБ
1.1. Отбор проб производят по ГОСТ 2874* и ГОСТ 24481**.________________* На территории Российской Федерации действует ГОСТ Р 51232-98.** На территории Российской Федерации действует ГОСТ Р 51593-2000.
1.2. Объем пробы воды для определения содержания хлоридов должен быть не менее 250 см
1.3. Пробы воды, предназначенные для определения хлоридов, не консервируют.
2. ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ХЛОР-ИОНА ТИТРОВАНИЕМ АЗОТНОКИСЛЫМ СЕРЕБРОМ
2.1. Сущность методаМетод основан на осаждении хлор-иона в нейтральной или слабощелочной среде азотнокислым серебром в присутствии хромовокислого калия в качестве индикатора. После осаждения хлорида серебра в точке эквивалентности образуется хромовокислое серебро, при этом желтая окраска раствора переходит в оранжево-желтую. Точность метода 1-3 мг/дм
2.2. Аппаратура, материалы и реактивы Посуда мерная стеклянная лабораторная по ГОСТ 1770, ГОСТ 29169, ГОСТ 29227, ГОСТ 29251, вместимостью: пипетки 100, 50 и 10 см






2.3. Подготовка к анализу
2.3.1. Приготовление титрованного раствора азотнокислого серебра.2,40 г химически чистого 

1 см

2.3.2. Приготовление 10%-ного раствора (подкисленного азотной кислотой) азотнокислого серебра
10 г 


2.3.3. Приготовление титрованного раствора хлористого натрия0,8245 г химически чистого 

1 см

2.3.4. Приготовление гидроокиси алюминия
125 г алюмокалиевых квасцов 


2.3.5. Приготовление 5%-ного раствора хромовокислого калия
50 г 

2.3.6. Установка поправочного коэффициента к раствору азотнокислого серебра.В коническую колбу вносят пипеткой 10 см




где 

2.4. Проведение анализа
2.4.1. Качественное определениеВ колориметрическую пробирку наливают 5 см
Характеристика осадка или мути | Содержание |
1. Опалесценция или слабая муть | 1-10 |
2. Сильная муть | 10-50 |
3. Образуются хлопья, осаждаются не сразу | 50-100 |
4. Белый объемный осадок | Более 100 |
2.4.2. Количественное определениеВ зависимости от результатов качественного определения отбирают 100 см











2.5. Обработка результатовСодержание хлор-иона (


где 









3. ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ХЛОР-ИОНА В ВОДЕ ТИТРОВАНИЕМ АЗОТНОКИСЛОЙ РТУТЬЮ В ПРИСУТСТВИИ ИНДИКАТОРА ДИФЕНИЛКАРБАЗОНА
3.1. Сущность методаХлориды титруют в кислой среде раствором азотнокислой ртути в присутствии дифенилкарбазона, при этом образуется растворимая, почти диссоциирующая хлорная ртуть. В конце титрования избыточные ионы ртути с дифенилкарбазоном образуют окрашенное в фиолетовый цвет комплексное соединение. Изменение окраски в эквивалентной точке выражено четко, в связи с этим конец титрования определяется с большой точностью. Точность метода 0,5 мг/дм
3.2. Аппаратура, материалы и реактивыПосуда мерная стеклянная лабораторная по ГОСТ 1770, ГОСТ 29169, ГОСТ 29251, вместимостью: пипетки 100 и 50 см



Бромфеноловый синий (индикатор). Дифенилкарбазон (индикатор).Все реактивы, используемые для анализа, должны быть квалификации чистые для анализа (ч.д.а.).
3.3. Подготовка к анализу
3.3.1. Приготовление 0,0141 н. раствора азотнокислой ртути 2,42 г 



1 см





3.3.2. Приготовление дифенилкарбазона, спиртового раствора смешанного индикатора0,5 г дифенилкарбазона и 0,05 г бромфенолового синего растворяют в 100 см
3.3.3. Приготовление 0,2 н. раствора азотной кислоты 12,8 см

3.4. Проведение анализаОтбирают 100 см








3.5. Обработка результатов Содержание хлор-иона (


где 







docs.cntd.ru
Хлориды.
Хлориды могут быть минерального и органического происхождения. Присутствие хлоридов в природных водах может быть связано с растворением отложений солей, загрязнением, обусловливаемым нанесением соли на дороги с целью борьбы со снегом льдом, сбросом стоков предприятиями химической промышленности, эксплуатацией нефтяных скважин, сбросом сточных вод, ирригационным дренажом, загрязнением в результате вымывания твердых отбросов и вторжения морской воды в прибрежные районы. Каждый из этих источников может вызвать загрязнение поверхностных и подземных вод. Высокая растворимость хлоридов объясняет широкое распространение их во всех природных водах.
Влияние на здоровье. Хлориды - наиболее распространенные в организме человека анионы и играют большую роль в осмотической активности внеклеточной жидкости; 88% хлоридов в организме находятся во внеклеточном пространстве. У здоровых людей происходит почти полное всасывание хлоридов.
Значение хлоридов:
ухудшаются органолептические свойства – вода приобретает солоноватый вкус и в связи с этим ограничивается водопотребление;
влияет на водно – солевой обмен; повышается уровень хлоридов в крови, что приводит к снижению диуреза и перераспределению хлоридов в органах и тканях;
вызывают угнетение желудочной секреции, в результате чего нарушается процесс переваривания пищи;
имеются данные о том, что хлориды оказывают гипертензивный эффект и у людей, страдающих гипертонической болезнью употребление воды с повышенным содержанием хлоридов может вызвать утяжеление течения заболевания;
являются показателем загрязнения подземных и поверхностных водоисточников, так как хлориды содержаться в сточных водах и физиологических выделениях человека.
Сульфаты.
Сульфаты поступают в водную среду со сточными водами многих отраслей промышленности. Атмосферная двуокись серы (SO2) , образующаяся при сгорании топлива и выделяющаяся в процессах обжига в металлургии, может вносить вклад в содержание сульфатов в поверхностных водах. Трехокись серы (SO3) , образующаяся при окислении двуокиси серы, в сочетании с парами воды образуют серную кислоту, которая выпадает в виде «кислого дождя» или снега. Большинство сульфатов растворимы в воде.
С сульфатом алюминия, который используется в качестве флоккулянта при очистке воды, в очищенную воду может дополнительно попадать 20-50 мг/л сульфатов. Сульфаты не удаляются из воды обычными методами очистки. Концентрация в большинстве пресных вод очень низкая.
Значение сульфатов:
сульфаты плохо всасываются из кишечника человека. Они медленно проникают через клеточные мембраны и быстро выводятся через почки. Сульфат магния действует как слабительное в концентрации выше 100 мг/л, приводя к очищению ЖКТ. Такой эффект возникает у людей, впервые использующих воду с высоким содержанием сульфатов (при переезде на новое место жительства, где употребляют сульфатную воду). Со временем человек адаптируется к такой концентрации сульфатов в воде.
ограничивается водопотребление, так как сульфаты придают воде горько-соленый вкус в концентрации свыше 500 мг/л.
неблагоприятно влияют на желудочную секрецию, приводя к нарушению процессов переваривания и всасывания пищи.
являются показателем загрязнения поверхностных вод производственными сточными водами и подземных вод водами вышележащих водоносных горизонтов.
studfiles.net
ГОСТ 4245-72 Вода питьевая. Методы определения содержания хлоридов

ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР
ВОДА ПИТЬЕВАЯ
Методы определения содержания хлоридов
ГОСТ 4245-72
ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР
|
ВОДА ПИТЬЕВАЯ Методы определения содержания хлоридов Drinking water. Method for determination of chloride content |
ГОСТ 4245-72 |
Дата введения 01.01.74
Настоящий стандарт распространяется на питьевую воду и устанавливает методы определения содержания хлоридов (хлор-иона).
Определение содержания хлор-иона в питьевой воде производят:
при содержании хлор-иона от 10 мг/дм3 и выше титрованием азотнокислым серебром в присутствии хромовокислого калия в качестве индикатора;
при содержании хлор-иона до 10 мг/дм3 титрованием азотнокислой ртутью в присутствии индикатора дифенилкарбазона.
1.1. Отбор проб производят по ГОСТ 2874 и ГОСТ 4979.
1.2. Объем пробы воды для определения содержания хлоридов должен быть не менее 250 см3.
1.3. Пробы воды, предназначенные для определения хлоридов, не консервируют.
2.1. Сущность метода
Метод основан на осаждении хлор-иона в нейтральной или слабощелочной среде азотнокислым серебром в присутствии хромовокислого калия в качестве индикатора. После осаждения хлорида серебра в точке эквивалентности образуется хромовокислое серебро, при этом желтая окраска раствора переходит в оранжево-желтую. Точность метода 1-3 мг/дм3.
2.2 Аппаратура, материалы и реактивы
Посуда мерная стеклянная лабораторная по ГОСТ 1770, ГОСТ 29227, ГОСТ 29251, вместимостью: пипетки 100, 50 и 10 см3 без делений; пипетка 1 см3 с делением через 0,01 см3; цилиндр мерный 100 см3; бюретка 25 см3 со стеклянным краном.
Колбы конические по ГОСТ 25336, вместимостью 250 см3.
Капельница по ГОСТ 25336.
Пробирки колориметрические с отметкой на 5 см3.
Воронки стеклянные по ГОСТ 25336.
Фильтры беззольные «белая лента».
Серебро азотнокислое по ГОСТ 1277.
Натрий хлористый по ГОСТ 4233.
Квасцы алюмокалиевые (алюминий-калий сернокислый) по ГОСТ 4329.
Калий хромовокислый по ГОСТ 4459.
Аммиак водный по ГОСТ 3760, 25 %-ный раствор.
Вода дистиллированная по ГОСТ 6709.
Все реактивы, используемые для анализа, должны быть квалификации чистые для анализа (ч. д. а.).
2.3. Подготовка к анализу
2.3.1. Приготовление титрованного раствора азотнокислого серебра.
2,40 г химически чистого AgNO 3 растворяют в дистиллированной воде и доводят объем раствора дистиллированной водой до 1 дм3.
1 см3 раствора эквивалентен 0,5 мг С l - .
Раствор хранят в склянке из темного стекла.
2.3.2. Приготовление 10%-ного раствора (подкисленного азотной кислотой) азотнокислого серебра
10 г AgNO 3 растворяют в 90 см3 дистиллированной воды и добавляют 1-2 капли HNO 3 .
2.3.3. Приготовление титрованного раствора хлористого натрия
0,8245 г химически чистого NaCl , высушенного при 105 °С, растворяют в дистиллированной воде и доводят объем раствора дистиллированной водой до 1 дм3.
1 см3 раствора содержит 0,5 мг С l - .
2.3.4. Приготовление гидроокиси алюминия
125 г алюмокалиевых квасцов [ AlK ( SO 4 )2 × 12h3O] растворяют в 1 дм3 дистиллированной воды, нагревают до 60 °С и постепенно прибавляют 55 см3 концентрированного раствора аммиака при постоянном перемешивании. После отстаивания в течение 1 ч осадок переносят в большой стакан и промывают декантацией дистиллированной водой до исчезновения реакции на хлориды.
2.3.5. Приготовление 5 %-ного раствора хромовокислого калия
50 г К2С r О4 растворяют в небольшом объеме дистиллированной воды и доводят объем раствора дистиллированной водой до 1 дм3.
2.3.6. Установка поправочного коэффициента к раствору азотнокислого серебра.
В коническую колбу вносят пипеткой 10 см3 раствора хлористого натрия и 90 см3 дистиллированной воды, добавляют 1 см3 раствора хромовокислого калия и титруют раствором азотнокислого серебра до перехода лимонно-желтой окраски мутного раствора в оранжево-желтую, не исчезающую в течение 15-20 с. Полученный результат считают ориентировочным. К оттитрованной пробе прибавляют 1-2 капли раствора хлористого натрия до получения желтой окраски. Эта проба является контрольной при повторном, более точном определении. Для этого отбирают новую порцию раствора хлористого натрия и титруют азотнокислым серебром до получения незначительной разницы оттенков слабо-оранжевого в титруемом растворе и желтого в контрольной пробе. Поправочный коэффициент (К) вычисляют по формуле
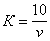 ,
,
где v - количество азотнокислого серебра, израсходованное на титрование, см3.
2.4. Проведение анализа
2.4.1. Качественное определение
В колориметрическую пробирку наливают 5 см3 воды и добавляют три капли 10 %-ного раствора азотнокислого серебра. Примерное содержание хлор-иона определяют по осадку или мути в соответствии с требованиями таблицы.
|
Характеристика осадка или мути |
Содержание С l-, мг/дм2 |
|
1. Опалесценция или слабая муть |
1-10 |
|
2. Сильная муть |
10-50 |
|
3. Образуются хлопья, осаждаются не сразу |
50-100 |
|
4. Белый объемный осадок |
Более 100 |
2.4.2. Количественное определение
В зависимости от результатов качественного определения отбирают 100 см3 испытуемой воды или меньший ее объем (10-50 см3) и доводят до 100 см3 дистиллированной водой. Без разбавления определяются хлориды в концентрации до 100 мг/дм3. p Н титруемой пробы должен быть в пределах 6-10. Если вода мутная, ее фильтруют через беззольный фильтр, промытый горячей водой. Если вода имеет цветность выше 30°, пробу обесцвечивают добавлением гидроокиси алюминия. Для этого к 200 см3 пробы добавляют 6 см3 суспензии гидроокиси алюминия, а смесь встряхивают до обесцвечивания жидкости. Затем пробу фильтруют через беззольный фильтр. Первые порции фильтрата отбрасывают. Отмеренный объем воды вносят в две конические колбы и прибавляют по 1 см3 раствора хромовокислого калия. Одну пробу титруют раствором азотнокислого серебра до появления слабого оранжевого оттенка, вторую пробу используют в качестве контрольной пробы. При значительном содержании хлоридов образуется осадок AgCl , мешающий определению. В этом случае к оттитрованной первой пробе приливают 2-3 капли титрованного раствора NaCl до исчезновения оранжевого оттенка, затем титруют вторую пробу, пользуясь первой, как контрольной пробой.
Определению мешают: ортофосфаты в концентрации, превышающей 25 мг/дм3; железо в концентрации более 10 мг/дм3. Бромиды и йодиды определяются в концентрациях, эквивалентных С l - . При обычном содержании в водопроводной воде они не мешают определению.
2.5. Обработка результатов.
Содержание хлор-иона (X), мг/дм3, вычисляют по формуле

где v - количество азотнокислого серебра, израсходованное на титрование, см3;
К - поправочный коэффициент к титру раствора нитрата серебра;
g - количество хлор-иона, соответствующее 1 см3 раствора азотнокислого серебра, мг;
V - объем пробы, взятый для определения, см3.
Расхождения между результатами повторных определений при содержании С l - от 20 до 200 мг/дм3 - 2 мг/дм3; при более высоком содержании - 2 отн. %.
3.1. Сущность метода
Хлориды титруют в кислой среде раствором азотнокислой ртути в присутствии дифенилкарбазона, при этом образуется растворимая, почти диссоциирующая хлорная ртуть. В конце титрования избыточные ионы ртути с дифенилкарбазоном образуют окрашенное в фиолетовый цвет комплексное соединение. Изменение окраски в эквивалентной точке выражено четко, в связи с этим конец титрования определяется с большой точностью.
Точность метода 0,5 мг/дм3.
3.2. Аппаратура, материалы и реактивы.
Посуда мерная стеклянная лабораторная по ГОСТ 1770, ГОСТ 29227, ГОСТ 29251, вместимостью: пипетки 100 и 50 см3 без делений, цилиндр мерный 100 см3 микробюретка 2 см3.
Колбы конические по ГОСТ 25336, вместимостью 250 см3.
Капельница по ГОСТ 25336.
Ртуть азотнокислая окисная по ГОСТ 4520.
Натрий хлористый по ГОСТ 4233.
Кислота азотная по ГОСТ 4461.
Спирт этиловый ректификованный по ГОСТ 5962.
Бромфеноловый синий (индикатор).
Дифенилкарбазон (индикатор).
Все реактивы, используемые для анализа, должны быть квалификации чистые для анализа (ч. д. а.).
3.3. Подготовка к анализу
3.3.1. Приготовление 0,0141 н. раствора азотнокислой ртути
2,42 г Hg ( N О3)2 × 1 /2Н2 O растворяют в 20 см3 дистиллированной воды к которой прибавлено 0,25 см3 концентрированной азотной кислоты, затем объем раствора доводят дистиллированной водой до 1 дм3.
1 см3 этого раствора эквивалентен 0,5 мг С l - .
Раствор устойчив в течение четырех месяцев.
Поправочный коэффициент к титру раствора азотнокислой ртути определяют титрованием 5 см3 хлористого натрия (1 см3 - 0,5 мг С l - ), разбавленного до 100 см3 дистиллированной водой, в тех же условиях, как при анализе пробы воды.
3.3.2. Приготовление дифенилкарбазона, спиртового раствора смешанного индикатора
0,5 г дифенилкарбазона и 0,05 г бромфенолового синего растворяют в 100 см3 95 %-ного этилового спирта. Хранят в склянке из темного стекла.
3.3.3. Приготовление 0,2 н. раствора азотной кислоты
12.8 мл концентрированной азотной кислоты разводят дистиллированной водой до 1 дм3
Все растворы готовят на дважды перегнанной дистиллированной воде.
3.4. Проведение анализа
Отбирают 100 см3 испытуемой воды, прибавляют 10 капель смешанного индикатора и по каплям 0,2 н. раствор HNO 3 до появления желтой окраски (рН 3,6), после чего прибавляют еще пять капель 0,2 н. раствора HNO 3 и титруют из микробюретки раствором азотнокислой ртути. К концу титрования окраска раствора приобретает оранжевый оттенок. Титрование продолжают медленно, по каплям добавляя раствор азотнокислой ртути, сильно взбалтывая пробу до появления слабо-фиолетового оттенка.
Для определения более четкого конца титрования используют контрольную пробу, в которой к 100 см3 дистиллированной воды прибавляют индикатор, 0,2 н. раствор азотной кислоты и одну каплю раствора азотнокислой ртути.
Метод может быть использован для определения и более высоких концентраций хлоридов в воде (более 10 мг/дм3). В этом случае отбирают меньший объем воды (содержание С l - в отобранном объеме должно быть не менее 10 мг) и разбавляют дистиллированной водой до 100 см3 прибавляют те же реактивы и в том же количестве и титруют из бюретки раствором азотнокислой ртути, как описано выше.
Определению не мешают цветность воды выше 30° и железо в концентрации, превышающей 10 мг/дм3. Йодиды и бромиды определяют в концентрациях, эквивалентных С l - .
3.5. Обработка результатов
Содержание хлор-иона (X) в мг/дм3 вычисляют по формуле
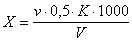 ,
,
где v - количество азотнокислой ртути, израсходованное на титрование, см3;
К - поправочный коэффициент к титру раствора азотнокислой ртути;
V - объем воды, взятый для определения, см3.
Расхождения между результатами повторных определений при содержании С l - в воде до 10 мг/дм3 - 0,5 мг/дм3.
ИНФОРМАЦИОННЫЕ ДАННЫЕ
1. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета стандартов Совета Министров СССР
2. ВЗАМЕН ГОСТ 4245-48
3. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
|
Обозначение НТД, на который дана ссылка |
Номер пункта |
|
ГОСТ 1277-75 |
2.2 |
|
ГОСТ 1770-74 |
2.2; 3.2 |
|
ГОСТ 2874-82 |
1.1 |
|
ГОСТ 3760-79 |
2.2 |
|
ГОСТ 4233-77 |
2.2; 3.2 |
|
ГОСТ 4329-77 |
2.2 |
|
ГОСТ 4459-75 |
2.2 |
|
ГОСТ 4461-77 |
3.2 |
|
ГОСТ 4520-78 |
3.2 |
|
ГОСТ 4979-49 |
1.1 |
|
ГОСТ 5962-67 |
3.2 |
|
ГОСТ 6709-72 |
2.2 |
|
ГОСТ 25336-82 |
2.2; 3.2 |
|
ГОСТ 29227-91 |
2.2; 3.2 |
|
ГОСТ 29251-91 |
2.2; 3.2 |
4. Ограничение срока действия снято Постановлением Госстандарта СССР от 25.12.91 № 2121
5. ПЕРЕИЗДАНИЕ
СОДЕРЖАНИЕ
|
1. Методы отбора проб . 1 2. Определение содержания хлор-иона титрованием азотнокислым серебром .. 1 3. Определение содержания хлор-иона в воде титрованием азотнокислой ртутью в присутствии индикатора дифенилкарвазона . 3 |
Похожие документы
znaytovar.ru
Определение хлоридов в воде
Цель: определить содержание хлоридов в воде по методу Мора и приближенным методом
Оборудование: а) метод Мора: конические колбы на 200 мл; пипетки на 10 мл; цилиндры мерные на 100 мл; бюретки для титрования; дистиллированная вода; 0,01 н раствор AgNO3; 0,01 н раствор NaCl; 5%-ный раствор К2СгО4; б) приближенный метод: пробирки, пипетки, азотная кислота (1: 3), 10%-й раствор нитрата серебра
Высокая растворимость хлоридов объясняет широкое их распространение во всех природных водах. Хлориды в воде могут быть минерального и органического происхождения и встречаться в форме солей — NaCl, KC1, MgCl2, СаС12. В южных регионах повышенное содержание хлоридов в воде обычно связано с засоленностью грунтов, богатых хлористыми соединениями. Такая вода не представляет опасности в санитарном отношении. Хлориды органического происхождения образуются при разложении органических веществ, преимущественно мочи, фекалий и др.
При централизованном и нецентрализованном водоснабжении содержание хлоридов в воде до 350 мг/л. В проточных водоемах концентрация хлоридов обычно невелика (20-30 мг/л). Незагрязненные грунтовые воды в местах с несолончаковой почвой обычно содержат до 30-50 мг/л хлор-иона. В водах, фильтрующихся через солончаковую почву, в 1 л могут быть сотни и даже тысячи миллиграммов хлоридов. Вода, содержащая хлориды в концентрации более 350 мг/л, имеет солоноватый привкус. При концентрации хлоридов 500-1000 мг/л вода неблагоприятно влияет на желудочную секрецию. Содержание хлоридов является показателем загрязнения подземных и поверхностных водоисточников и сточных вод.
Определение концентрации хлоридов в воде можно провести двумя способами:
а) методом Мора. Принцип метода Мора основан на осаждении хлоридов азотнокислым серебром в присутствии хромата калия К2СrO4. При наличии в растворе хлоридов AgNO3 связывается с ними, а затем образует хромат серебра оранжево-красного цвета.
NаCI + AgNO3 = > AgCl + NaNO3
2AgNO3 + K2CrO4 = > Ag2CrO4 + 2KNO3
б) приближенным методом. Он основан на осаждении хлоридов азотнокислым серебром, реакция протекает по уравнению:
NaCl + AgNO3 => AgCl + NaNO3
Порядок выполнения работы
I. Определение хлоридов в воде методом Мора
Установить титр AgNO3. Для этого в коническую колбу на 200 мл налить 10 мл раствора NaCl и 90 мл дистиллированной воды, прибавить 5 капель К2СrO4. Содержимое колбы оттитровать раствором AgNO3 до перехода лимонно-желтой окраски мутного раствора в оранжево-красную, не исчезающую в течение 15-20 с.
Рассчитать поправочный коэффициент к титру AgNO3 по результатам трех титрований.
K=30/(П1+П2+П3)
где П - объем в мл AgNO3, использованный на каждое титрование.
При содержании хлоридов менее 250 мг/л взять 100 мл фильтрованной испытуемой воды. При большем содержании хлоридов -10-50 мл. Испытуемую воду налить в две конические колбы, довести до 100 мл дистиллированной водой, прибавить 5 капель раствора К2СгО4. Раствор в одной колбе титровать AgNO3, а вторая колба используется для контроля.
Содержание хлор-иона в воде рассчитать по формуле
Х=(П*К*0,355*1000)/V
где X - содержание хлор-иона в мг/л; П - количество раствора AgNO3, истраченное на титрование, мл; К - поправочный коэффициент к титру; 0,355 - эквивалентное количество хлора, соответствующее 1 мл 0,01 н раствору AgNO3, мг; V - объем исследуемой пробы, мл.
studfiles.net











