Жесткость воды. Соли жесткости. Единицы измерения жесткости питьевой воды
Жёсткость воды - это... Что такое Жёсткость воды?
Жёсткость воды — совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния (так называемых «солей жёсткости»).
Жёсткая и мягкая вода
Вода с большим содержанием таких солей называется жёсткой, с малым содержанием — мягкой.
Различают временную (карбонатную) жёсткость, обусловленную гидрокарбонатами кальция и магния (Са(НСО3)2; Mg(НСО3)2), и постоянную (некарбонатную) жёсткость, вызванную присутствием других солей, не выделяющихся при кипячении воды: в основном, сульфатов и хлоридов Са и Mg (CaSO4, CaCl2, MgSO4, MgCl2).Жёсткая вода при умывании сушит кожу, в ней плохо образуется пена при использовании мыла. Использование жёсткой воды вызывает появление осадка (накипи) на стенках котлов, в трубах и т. п. В то же время, использование слишком мягкой воды может приводить к коррозии труб, так как, в этом случае отсутствует кислотно-щелочная буферность, которую обеспечивает гидрокарбонатная (временная) жёсткость. Потребление жёсткой или мягкой воды обычно не является опасным для здоровья,есть данные о том, что высокая жёсткость способствует образованию мочевых камней, а низкая — незначительно увеличивает риск сердечно-сосудистых заболеваний. Вкус природной питьевой воды, например, воды родников, обусловлен именно присутствием солей жёсткости.
Жёсткость природных вод может варьироваться в довольно широких пределах и в течение года непостоянна. Увеличивается жёсткость из-за испарения воды, уменьшается в сезон дождей, а также в период таяния снега и льда.
Единицы измерения
Для численного выражения жёсткости воды указывают концентрацию в ней катионов кальция и магния. Рекомендованная единица СИ для измерения концентрации — моль на кубический метр (моль/м³), однако, на практике для измерения жёсткости используются градусы жёсткости и миллиграммы эквивалента на литр (мг-экв/л).
В СССР до 1952 года использовали градусы жёсткости, совпадавшие с немецкими. В России для измерения жёсткости иногда использовалась нормальная концентрация ионов кальция и магния, выраженная в миллиграммах эквивалента на литр (мг-экв/л). Один мг-экв/л соответствует содержанию в литре воды 20,04 миллиграмм Ca2+ или 12,16 миллиграмм Mg2+ (атомная масса делённая на валентность).
С 1 января 2005 года в России введен новый Национальный стандарт Российской Федерации ГОСТ Р 52029-2003 «Вода. Единица жесткости»[1]. По новому ГОСТу жесткость выражается в градусах жесткости (°Ж). 1 °Ж соответствует концентрации щелочноземельного элемента, численно равной 1/2 его моля на литр (1 °Ж = 1 мг-экв/л).
Иногда указывают концентрацию, отнесённую к единице массы, а не объёма, особенно, если температура воды может изменяться или если вода может содержать пар, что приводит к существенным изменениям плотности.
В разных странах использовались (иногда используются до сих пор) различные внесистемные единицы — градусы жёсткости.
| Немецкий | °dH (degrees of hardness),°dGH (German (Deutsche) Hardness),°dKH (для карбонатной жёсткости) | 1 часть оксида кальция (СаО) или 0.719 частей оксида магния (MgO) на 100 000 частей воды | 0,3566 | 0,1783 |
| Английский | °e | 1 гран CaCO3 на 1 английский галлон воды | 0,2848 | 0.1424 |
| Французский | °TH | 1 часть CaCO3 на 100000 частей воды | 0,1998 | 0,0999 |
| Американский | ppm | 1 часть CaCO3 на 1 000 000 частей воды | 0,0200 | 0,0100 |
По величине общей жёсткости различают воду мягкую (до 2 °Ж), средней жёсткости (2-10 °Ж) и жёсткую (более 10 °Ж).
Жёсткость воды поверхностных источников существенно колеблется в течение года; она максимальна в конце зимы, минимальна — в период паводка (например, жёсткость волжской воды в марте — 4,3 °Ж, в мае — 0,5 °Ж [2]). В подземных водах жёсткость обычно выше (до 80-100 °Ж) и меньше изменяется в течение года.
Методы устранения
Термоумягчение. Основан на кипячении воды, в результате термически нестойкие гидрокарбонаты кальция и магния разлагаются с образованием накипи:
Ca(HCO3)2 → CaCO3↓ + CO2 + h3O.Кипячение устраняет только временную (карбонатную) жёсткость. Находит применение в быту.
Реагентное умягчение. Метод основан на добавлении в воду кальцинированной соды Na2CO3 или гашёной извести Ca(OH)2. При этом соли кальция и магния переходят в нерастворимые соединения и, как следствие, выпадают в осадок. Например, добавление гашёной извести приводит к переводу солей кальция в нерастворимый карбонат:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2h3OЛучшим реагентом для устранения общей жесткости воды является ортофосфат натрия Na3PO4, входящий в состав большинства препаратов бытового и промышленного назначения:
3Ca(HCO3)2 + 2Na3PO4 → Ca3(PO4)2↓ + 6NaHCO3 3MgSO4 + 2Na3PO4 → Mg3(PO4)2↓ + 3Na2SO4Ортофосфаты кальция и магния очень плохо растворимы в воде, поэтому легко отделяются механическим фильтрованием. Этот метод оправдан при относительно больших расходах воды, поскольку связан с решением ряда специфических проблем: фильтрации осадка, точной дозировки реагента.
Катионирование. Метод основан на использовании ионообменной гранулированной загрузки (чаще всего ионообменные смолы). Такая загрузка при контакте с водой поглощает катионы солей жёсткости (кальций и магний, железо и марганец). Взамен, в зависимости от ионной формы, отдавая ионы натрия или водорода. Эти методы соответственно называются Na-катионирование и Н-катионирование. При правильно подобранной ионообменной загрузке жёсткость воды снижается при одноступенчатом натрий-катионировании до 0,05-0,1 °Ж, при двухступенчатом — до 0,01 °Ж. В промышленности с помощью ионообменных фильтров заменяют ионы кальция и магния на ионы натрия и калия, получая мягкую воду.
Обратный осмос. Метод основан на прохождении воды через полупроницаемые мембраны (как правило, полиамидные). Вместе с солями жёсткости удаляется и большинство других солей. Эффективность очистки может достигать 99,9 %. Этот метод нашёл наибольшее применение в бытовых системах подготовки питьевой воды. В качестве недостатка данного метода следует отметить необходимость предварительной подготовки воды, подаваемой на обратноосмотическую мембрану.
Электродиализ. Основан на удалении из воды солей под действием электрического поля. Удаление ионов растворенных веществ происходит за счёт специальных мембран. Так же как и при использовании технологии обратного осмоса, происходит удаление и других солей, помимо ионов жёсткости.
Полностью очистить воду от солей жёсткости можно дистилляцией.
См. также
- Кислые соли
- Щелочи
- Сульфаты
- Хлораты
Ссылки
Примечания
dic.academic.ru
Жесткость воды - происхождение, виды, единицы измерения
Жесткость воды — это совокупность химических и физических свойств воды, связанных с содержанием в ней растворенных солей щелочноземельных металлов, главным образом, кальция и магния (так называемых «солей жесткости»).
Соли жесткости имеют разные свойства. Так, при нагреве воды, некоторые из них выпадают в осадок в виде накипи, а некоторые — не выпадают. По этому признаку их и начали разделять.
Соли, выпадающие в осадок, стали называть солями временной (или устранимой) жесткости, а соли, которые не выпадают в осадок при нагреве воды, солями постоянной жесткости.
Сульфаты, хлориды и нитраты магния и кальция, растворенные в воде, образуют постоянную (или некарбонатную) жесткость. Они выпадают в осадок исключительно при полном испарении воды.
Временная жесткость характеризуется присутствием в воде наряду с катионами Ca2+, Mg2+ и Fe2+ гидрокарбонатных, или бикарбонатных анионов (HCO3-).
При кипячении воды гидрокарбонаты разлагаются, образуя очень плохо растворимый карбонат кальция, углекислый газ и воду:
Ca2+ + 2HCO3- = CaCO3↓ + h3O + CO2↑
Общая жесткость складывается из постоянной и временной.

В данной таблице приведены основные катионы металлов, вызывающие жесткость, и главные анионы, с которыми они ассоциируются.
Катионы | Анионы |
Кальций (Ca2+) | Гидрокарбонат (HCO3-) |
Магний (Mg2+) | Сульфат (SO42-) |
Стронций (Sr2+) | Хлорид (Cl-) |
Железо (Fe2+) | Нитрат (NO3-) |
Марганец (Mn2+) | Силикат (SiO32-) |
На практике стронций, железо и марганец оказывают на жесткость столь небольшое влияние, что ими, как правило, пренебрегают. Алюминий (Al3+) и трехвалентное железо (Fe3+) также влияют на жесткость, но при уровнях рН, встречающихся в природных водах, их растворимость и, соответственно, «вклад» в жесткость ничтожно малы. Аналогично, не учитывается и незначительное влияние бария (Ва2+).
Жёсткость воды — происхождение
Ионы кальция (Ca2+) и магния (Mg2+), а также других щелочноземельных металлов, обуславливающих жесткость, присутствуют во всех минерализованных водах. Их источником являются природные залежи известняков, гипса и доломитов. Ионы кальция и магния поступают в воду в результате взаимодействия растворенного диоксида углерода с минералами и при других процессах растворения и химического выветривания горных пород. Источником этих ионов могут служить также микробиологические процессы, протекающие в почвах на площади водосбора, в донных отложениях, а также сточные воды различных предприятий.
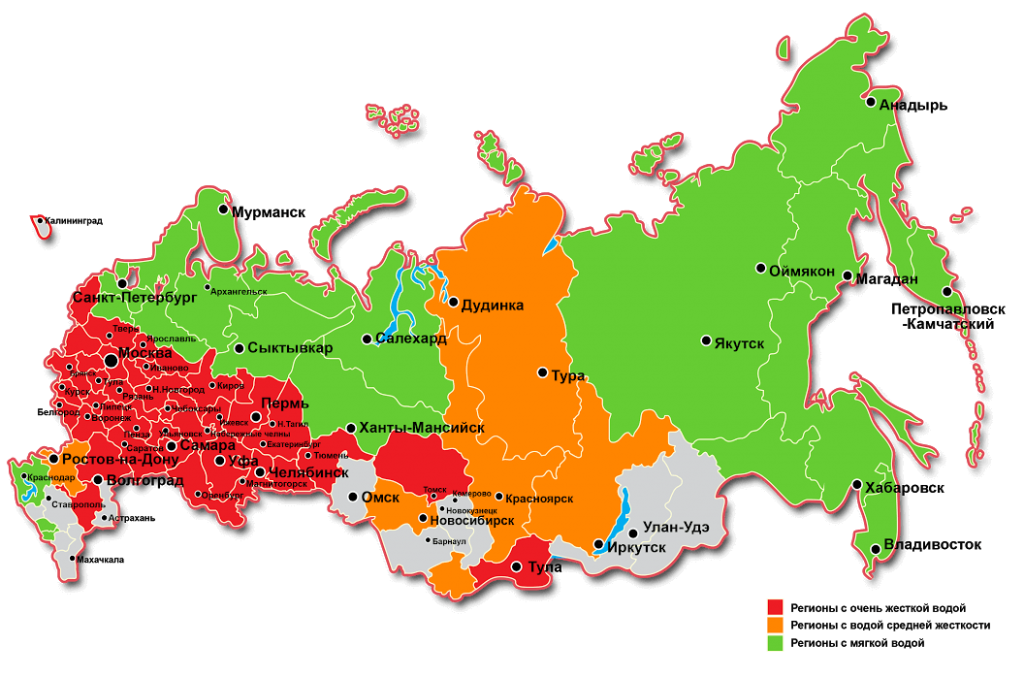
Обычно в маломинерализованных водах преобладает (до 70%-80%) жесткость, обусловленная ионами кальция (хотя в отдельных редких случаях магниевая жесткость может достигать 50-60%). С увеличением степени минерализации воды содержание ионов кальция (Са2+) быстро падает и редко превышает 1 г/л. Содержание же ионов магния (Mg2+) в высокоминерализованных водах может достигать нескольких граммов, а в соленых озерах — десятков граммов на один литр воды.
В целом, жесткость поверхностных вод, как правило, меньше жесткости вод подземных. Жесткость поверхностных вод подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период половодья, когда обильно разбавляется мягкой дождевой и талой водой. Морская и океанская вода имеют очень высокую жесткость (десятки и сотни мг-экв/дм3).
Жесткость воды — единицы измерения
С 1 января 2014 года в России введен межгосударственный стандарт ГОСТ 31865-2012 «Вода. Единица жесткости». По новому ГОСТу жесткость выражается в градусах жесткости (°Ж).
1 °Ж соответствует концентрации щелочноземельного элемента, численно равной 1/2 его миллимоля на литр (1 °Ж = 1 мг-экв/л). В разных странах использовались (иногда используются до сих пор) различные внесистемные единицы — градусы жёсткости.
За рубежом приняты другие единицы измерения жесткости воды, соотношение этих единиц представлено в таблице:
1°Ж = 20,04 мг Ca2+ или 12,15 Mg2+ в 1 дм3 воды;1°DH = 10 мг CaO в 1 дм3 воды;1°Clark = 10 мг CaCO3 в 0,7 дм3 воды;1°F = 10 мг CaCO3 в 1 дм3 воды;1 ppm = 1 мг CaCO3 в 1 дм3 воды.
Численные значения жесткости измеренные в мг-экв/л, моль/м3, и °Ж, несмотря на различия в обозначении, равны между собой.
По значению общей жесткости природные воды делят на группы:
- очень мягкая вода (0–1,5 мг-экв/л)
- мягкая вода (1,5–4 мг-экв/л)
- вода средней жесткости (4–8 мг-экв/л)
- жесткая вода (8–12 мг-экв/л)
- очень жесткая вода (более 12 мг-экв/л).
Нормативные требования и рекомендации
Рекомендации всемирной организации здравоохранения (ВОЗ) для питьевой воды:кальций – 20-80 мг/л; магний – 10-30 мг/л. Для жесткости какой-либо рекомендуемой величины не предлагается.
Российские нормативные документы (СанПиН 2.1.4.1074-01 и ГН 2.1.5.1315-03) для питьевой воды регламентируют:кальций – норматив не установлен; магний – не более 50 мг/л; жесткость — не более 7°Ж.
Норматив физиологической полноценности бутилированной воды (СанПиН 2.1.4.1116-02):кальций – 25-130 мг/л; магний – 5-65 мг/л; жесткость – 1,5-7°Ж.
По содержанию кальция и магния бутилированная вода высшей категории ничем не лучше воды из-под крана!
rapresol.ru
Определение жесткости воды: ГОСТ, приборы, методы
Определение жесткости воды в современном мире – это обязательное условие для обеспечения работоспособности всей техники, работающей с ней. Тем не менее нельзя сказать, что такая жидкость действительно вредна для человека. Всего должно быть в меру, ведь излишне мягкая вода наносит не меньше ущерба здоровью, чем жесткая.
Понятие жесткости воды
Начинать всегда следует с самых азов, чтобы было полное понимание проблемы. В нашем случае, прежде чем приступать к определению жесткости воды, сначала нужно понять, что она собой представляет. По результатам экспертизы, проведенной в 2011 на кафедре химии и экологии Новгородского университета им. Ярослава Мудрого, для природной натуральной воды жесткость является абсолютно нормальным явлением. Вплоть до момента появления современной техники этот вопрос вообще мало кого интересовал, тысячелетиями люди спокойно употребляли ее в том виде, в котором она есть. Придают воде жесткость растворенные в ней соли магния и кальция. Само понятие жесткости возникло по результатам ощущения людей, так как когда насыщенная этими солями и другими элементами вода вступает во взаимодействие с мылом, пена практически не образуется, затрудняя стирку или мытье.

Виды жесткости
Прежде чем понять, какую воду пить, следует учитывать тот факт, что жесткость не является однородной величиной. Есть как минимум две основные разновидности:
- Временная.
- Постоянная.
Зависят эти виды от типа растворенных солей, которые в любой жесткой воде присутствуют всегда вместе, составляя общую жесткость. Тем не менее разделять их можно и нужно. Временная жесткость напрямую зависит от наличия бикарбонатных и гидрокарбонатных анионов. Главная их особенность – разложение во время кипячения. В результате распада получается непосредственно сама вода, углекислый газ и карбонат кальция, который уже практически не растворяется. Получается, что от временной жесткости можно без особых проблем избавиться при помощи простого поднятия температуры воды до +100 градусов. В качестве примера можно привести любой чайник. После продолжительного использования можно обнаружить внутри осадок, который и является результатом описанного выше процесса распада. Все же, что не разлагается подобным образом, относится к постоянной жесткости, избавиться от которой без специальной обработки практически невозможно.

Зачем нужно знать жесткость воды
Это необходимо для того, чтобы понимать, какую воду пить можно без опаски, а также для того, чтобы любая техника, взаимодействующая с водой, не вышла из строя. Для человека излишне жесткая вода вредна. Но даже если этот параметр будет находиться на приемлемом для нашего организма уровне, все равно оборудование это не устроит. Аквариумы, кофейные, стиральные и посудомоечные машины, чайники, мультиварки и множество других вариантов техники требует воду строго определенной жесткости. Обычно справиться с этим помогают фильтры типа «Гейзер-3», однако зачастую такая мера может даже считаться излишней. Прежде чем тратить на них деньги, рекомендуется сначала провести тест на жесткость воды, ведь вполне возможно, что этот показатель и так на нормальном уровне.
Вред жесткой и мягкой воды
Как уже было сказано выше, в первую очередь ущерб человеку наносит не какой-то определенный тип воды, а полное отсутствие баланса в организме.
Эффекты от жесткой воды:
- Плохое растворение пищевых продуктов (связано с катионами Ca2+ и Mg2+).
- Кофе, чай и любые другие подобные напитки завариваются очень плохо.
- При длительном употреблении возможно расслабление желудка.
- Жесткая вода может стать причиной образования камней в почках.
- Насыщает организм требуемыми ему элементами.
- Улучшает состояние зубов, уменьшает вероятность возникновения кариеса.
- Жесткая вода является причиной поломки большинства видов техники.
Эффекты от мягкой воды:
- Выводит шлаки, но попутно вымывает полезные элементы (калий, магний и кальций). В результате кости становятся более хрупкими. Также не лучшим образом воздействует на сердечно-сосудистую систему.
- Негативно воздействует на гипофиз-адреналиновую систему.
- Оказывает плохое влияние на водно-солевой баланс организма.
Таким образом, определение жесткости воды должно производится не с целью избавиться от нее, а для того, чтобы свести негативное воздействие к минимуму и привести употребление такой жидкости к требуемому организмом балансу.

Правила отбора проб по ГОСТу
Согласно ГОСТу, питьевая вода должна проверяться на жесткость строго в лаборатории, посредством титриметрического анализа. Для этого сначала необходимо взять пробы, объем которых должен быть не менее 400 кубических сантиметров (0,4 литра). В качестве емкости, в которой будет производиться хранение, может использоваться любая тара, если она изготовлена из стекла или полимерного материала. Очень важно провести анализ не позднее чем через 24 часа после отбора пробы. В особых случаях, когда необходимо увеличить этот срок, производится подкисление жидкости посредством добавления соляной кислоты. В таком состоянии она может храниться уже около 1 месяца.
Титриметрический (лабораторный) анализ
Среди всех методов определения жесткости воды данный вариант заслуженно считается самым достоверным и комплексным. В его основе лежит процесс образования соединений трилона вместе со щелочноземельными элементами ионов. Минимальный показатель жесткости, который поддается определению при помощи этого способа, – 0,1 оЖ (нормой считается 7-10 оЖ). В качестве пробы может быть использована обычная вода из-под крана. Лучшим выходом в ситуации с подозрением на повышенную жесткость является сразу же посетить соответствующую лабораторию, так как никакие домашние методы не смогут выдать точные данные. Но о них - ниже.
Полностью описывать весь процесс нет никакого смысла, так как воспроизвести его самостоятельно, без нужных навыков и химических элементов и оборудования невозможно. Тем не менее можно выделить несколько основных принципов реакции, которые сохраняются в любой ситуации и присущи абсолютно всем вариантам:
- Всегда должен быть способ, позволяющий зафиксировать эквивалентность реакции, которая и является основой для определения жесткости.
- Анализ проводится очень быстро.
- Должно выполняться требование стехиометричности процесса. Проще говоря, это значит, что в процессе проведения реакции не должны образовываться никакие побочные продукты.
- С момента начала реакции ее невозможно повернуть вспять или остановить.

Тест-полоски
Для определения жесткости воды в домашних условиях можно использовать специальные приспособления, купить которые не составит особого труда (они не запрещены и общедоступны). Выглядят они как стандартные тестовые полоски. Для использования достаточно погрузить одну из них в воду, требующую проверки, на указанный в инструкции период времени. В результате изделие изменит свой цвет. При использовании таких полосок для определения жесткости воды главной проблемой является определить, каков именно показатель жесткости. Чтобы это сделать, нужно сравнивать цвет на полосе и примеры с описанием на упаковке. К сожалению, далеко не всегда можно сразу же понять, что именно показывает приспособление, и даже в более четкой ситуации точность данных оставляет желать лучшего. В целом такие тест-полоски подходят только для общего понимания того, насколько жесткая или мягкая вода.

Домашний анализ
Проверить воду из-под крана на жесткость также можно при помощи подручных средств. Правда, это скорее занимательный опыт для детей, чем действительно вариант тестирования показаний жидкости.
Необходимо взять:
- Банку емкостью 1 литр (или любую другую подобную емкость).
- Стакан в форме цилиндра.
- Любые весы (удобнее всего использовать электронные).
- Линейку.
- Мыло хозяйственное (72% или 60%).
- Дистиллированную воду.
Для проверки необходимо взять 1 грамм мыла, измельчить его и поместить в стакан. После этого следует подогреть дистиллированную воду, но не доводить до кипения. Ее следует налить в тот стакан, в котором уже лежит мыло. В итоге оно обязано растворится в воде. Следующий шаг – налить еще больше воды. После этого следует налить в банку обычной воды из-под крана и медленно вылить мыльную жидкость из стакана и перемешать (медленно). Если образуется пена, то это - показатель жесткости. К сожалению, более или менее четко сказать, каков именно ее уровень, при помощи такого метода практически невозможно.

TDS-анализ
Еще один вариант определения жесткости питьевой воды – воспользоваться специальным прибором – TDS-метром. В принципе, он предназначен для определения электропроводимости воды, на что влияют как непосредственно соли (создающие жесткость), так и множество других элементов, что не дает нужного уровня точности. Более того, показания прибора обычный человек, не умеющий их считывать, не поймет и скорее всего запутается. Попробуем упростить задачу. Подавляющее большинство таких устройств в качестве единиц измерения используется некие ppm. У нас же применяются другие варианты, основанные на эквиваленте миллиграмма на литр жидкости. В среднем, 1 наша единица (мг-экв/л) равняется 50,05 зарубежным ppm. По правилам, концентрация солей (т.е. жесткости) должна быть не более 350 ppm или же 7 мг-экв/л. На эти цифры и стоит ориентироваться. Если же прибор будет отечественным, все значительно облегчается. Хуже всего, когда подобное приспособление произведено где-то в Китае или другой подобной стране, где используются собственные единицы измерения. Тогда придется самостоятельно искать их эквивалент и переводить в привычные нам показания.
АКМС-1
Из других приборов, способных определять жесткость воды, отдельно следует отметить уникальное устройство АКМС-1. Это достаточно большой стационарный агрегат, сходный по размерам с фильтрами «Гейзер-3». Просто так в домашних условиях с его помощью проверять жидкость не представляется возможным. Именно поэтому такие приспособления используются в первую очередь на производстве, где жесткость воды может повлиять на работу дорогостоящей техники или нанести другой подобный вред. В отличие от всех остальных аналогов, АКМС-1 действительно быстро и точно показывает текущий уровень жесткости, позволяя оператору своевременно реагировать. При помощи этого приспособления можно как пускать воду к рабочим агрегатам напрямую, если она не представляет для них угрозы, так и предварительно ее фильтровать. Это, конечно же, выльется в дополнительные затраты, но зато поможет сэкономить на ремонте техники, который обойдется значительно дороже.

Итоги
Учитывая все указанное выше и требования ГОСТ, вода питьевая должна регулярно проверяться на уровень жесткости. Тем не менее принимать радикальные меры по ее умягчению не стоит, так как вредны оба состояния – слишком жесткая и слишком мягкая. Только в той ситуации, когда показатели действительно выше или ниже, стоит предпринимать какие-то действия. К слову, если с жесткостью регулярно борются, то про слишком мягкую воду практически не слышно, а ведь на это также нужно обращать не меньше внимания.
fb.ru
Жесткость воды | Info-Farm.RU
Жесткость воды (англ. Hardness of water, water hardness, hard of water, stiffness of water; нем. Härte f, Härte f des Wassers, Wasserhärte f) — совокупность свойств, обусловленных содержанием в воде катионов кальция и магния.
Общее описание
Жесткость воды определяют по количеству солей кальция и магния в ней. Если вода содержит значительные количества таких солей, то такую воду называют жесткой, а когда этих солей совсем нет, либо они содержатся в незначительных количествах, то — мягкой.
Различают временную, или карбонатную, жесткость воды и постоянную. Временная жесткость обусловливается наличием кислых карбонатов (гидрокарбонатов) кальция и магния: Ca (HCO 3) 2 и Mg (HCO 3) 2, а стала — наличием сульфатов и хлоридов кальция и магния: CaSO 4, MgSO 4, CaCl 2 и MgCl 2. Общая жесткость воды представляет собой сумму временной и постоянной жесткости.
Жесткая вода непригодна почти для всех отраслей производства. Так, например, жесткую воду нельзя использовать для стирки белья, мытья шерсти и окраски тканей, потому что в ней мыло теряет свою моющую способность. Это объясняется тем, что растворимый в воде стеарат натрия С 17 Н 35 COONa, который составляет главную составляющую часть мыла, переходит в нерастворимый стеарат кальция (или магния), образуя так называемое кальциевая (или магниевое) мыло:
- 2С 17 Н 35 COONa + CaSO 4 = Са (С 17 Н 35 СОО) 2 ↓ + Na 2 SO 4
При этом мыльная пена образуется только после полного осаждения ионов кальция и магния, на что непродуктивно расходуется много мыла. Кроме того, создаваемый осадок кальциевого и магниевого мыла прочно оседает на волокнах тканей и забрудюе их, а при окраске образует пятна.
Жесткая вода непригодна и для целого ряда других производств: бумажного, кожевенного, крахмального, спиртового и тому подобное. Она непригодна и для паросилового хозяйства, так как при кипячении воды образуется накипь, которая плохо проводит тепло, вследствие чего увеличивается расход топлива. Накипь вызывает интенсивное разрушение стенок котлов, что может привести к аварии.
Для приготовления пищи жесткую воду тоже не употребляют, потому что в ней плохо развариваются мясо и овощи. Для питья она тоже непригодна.
Методы определения жесткости воды
Жесткость воды чаще всего определяют титрованием раствором двунатриевая соли етилендиаминтетраацетатнаи кислоты (комплексоны ИИИ, трилон Б) в щелочной среде в присутствии индикатора хромоген черный специальный или эриохром черный. Пользуясь другим специальным индикатором — мурексид, определяют кальциевую Т.В .; магниевую Т.В. рассчитывают по разнице между результатами двух определений. Если содержание кальция и магния в воде было определено другими способами, общую Т.В. можно вычислить по формуле: Т = Са 2+ + Мg 2+, где Т — общая Т.В., ммоль / дм3; Са 2+ и Мg 2+ — концентрация кальция и магния, ммоль / дм3.
Классификация воды по твердости
Вода с Т. менее 4 ммоль / дм3 характеризуется как мягкая, от 4 до 8 ммоль / дм3 — средней жесткости, от 8 до 12 ммоль / дм 3 — твердая, более 12 ммоль / дм3 — очень жесткая.
По А. А. Алекиним:
- очень мягкая — до 1,5 ммоль / дм;
- мягкая — 1,5-3,0 ммоль / дм;
- умеренно жесткая — 3,0-6,0 ммоль / дм3;
- твердая — 6,0-9,0 ммоль / дм3;
- очень твердая — более 9,0 ммоль / дм3.
Единицы измерения
Для численного выражения жесткости воды указывают концентрацию в ней катионов кальция и магния. Рекомендуемая единица СИ для измерения концентрации — моль на кубический метр (моль / м³), но, на практике, для измерения твердости чаще используется миллимоль на литр (ммоль / л), ммоль / дм³.
В разных странах используются различные внесистемные единицы — градусы жесткости.
| Немецкий | ° dH (degrees of hardness), ° dGH (German (Deutsche) Hardness), ° dKH (для карбонатной жесткости) | 1 часть оксида кальция (СаО) или 0,719 частей оксида магния (MgO) на 100 000 частей воды | 0,3566 | 0,1783 |
| Английский | ° e | 1 гран CaCO 3 в 1 английский галлон воды | 0,2848 | 0,1424 |
| Французский | ° TH | 1 часть CaCO 3 на 100.000 частей воды | 0,1998 | 0,0999 |
| Американский | ppm | 1 часть CaCO 3 на 1.000.000 частей воды | 0,0200 | 0,0100 |
Способы устранения жесткости воды
Для устранения жесткости воды, то есть ее смягчения, из воды нужно удалить ионы Са 2+ и Mg 2+ в виде нерастворимых солей.
- Временную жесткость воды устраняют кипячением:
- Ca (HCO 3) 2 = СаСО3 ↓ + Н 2 О + СО 2
- Mg (HCO 3) 2 = MgCO 3 ↓ + Н 2 О + СО 2
При нагревании ионы Са 2+ и Mg 2+ выводятся из раствора в виде нерастворимых карбонатов. Именно легкость устранения временной жесткости воды при нагревании приводит название — «временная».
- Постоянную жесткость воды, обусловленную сульфатами и хлоридами кальция и магния, невозможно устранить кипячением, поскольку эти соли не разлагаются. Название «постоянная жесткость» происходит именно от того, что ее нельзя устранить простым нагревом воды. Ее устраняют введением в воду некоторых реагентов — натрий карбоната (кальцинированная сода), кальций гидроксида (известковая вода), натрий ортофосфата. Одновременно устраняется как временная, так и постоянная, то есть общая жесткость воды. К примеру:
- Ca (HCO 3) 2 + Са (ОН) 2 = 2СаСО 3 ↓ + 2Н 2 О
- MgSO 4 + Na 2 СО3 = MgCO 3 ↓ + Na 2 SO 4
- Ca (HCO 3) 2 + Na 2 СО3 =СаСО3 ↓ + 2NaHCO 3
- 3CaSO 4 + 2Na 3 РО4 = Са 3 (РО4) 2 ↓ + 3Na 2 SO 4
- Современный способ смягчения воды основан на использовании ионообменных смол — катионитов. Катиониты — это твердые вещества, нерастворимые в воде, в состав которых входят подвижные катионы Na + в виде солей органических кислот, зафиксированных на поверхности носителя. Упрощенно их обозначают так: Na 2 R. Катионы Na + могут обмениваться на катионы окружающей среды, например Са 2+ и Mg 2+. При пропускании жесткой воды через колонку с катионитом ионы Са 2+ и Mg 2+ задерживаются в нем, а катионы Na + из катионита переходят в воду:
- Na 2 R + Са 2+ = CaR + 2Na +
Катионит периодически регенерируют, промывая его концентрированным раствором натрия хлорида.
Твердость природной воды
- Твердость природной воды колеблется в широких пределах; она неодинакова в разных природных водах, в одном и том же водном объекте величина ее изменяется по временам года. В поверхностных водах Т. достигает наибольших величин в конце зимы, маленьких — в период половодья. В поверхностных водах обычно преобладает карбонатная Т. (70-80% общей). Магниевая Т.В. редко превышает 30% общей, однако в некоторых районах (Донбасс, Кривой Рог) достигает 60% общей. Т. подземных вод, особенно в артезианских колодцах, меньше изменяется в течение года.
- Твердость речных вод Украины, как и минерализация воды возрастает с северо-запада на юго-восток. В речных водах Полесья твердость составляет 2-3 ммоль / дм³, в Днепре — 4-5 ммоль / дм³, а в малых и средних реках Приазовья — 15-30 ммоль / дм³, что ограничивает возможности использования местных водных ресурсов.
- Твердость морской воды: Черное море — кальциевая 12,0 ммоль / дм 3, магниевая 53,5 ммоль / дм 3, общая 65,5 ммоль / дм3; Каспийское море — кальциевая 36,4 ммоль / дм 3, магниевая 30 ммоль / дм 3, общая 66,4 ммоль / дм3; океан — кальциевая 22,5 ммоль / дм 3, магниевая 108 ммоль / дм 3, общая 130,5 ммоль / дм3.
Твердость питьевой воды
В Украине согласно Государственных санитарных норм и правил «Гигиенические требования к воде питьевой, предназначенной для потребления человеком» (ГСанПиН 2.2.4-171-10), утвержденных Минздравом Украины 12.05. 2010, которые в целом регулируют качество питьевой воды — приняты следующие нормативы показателей твердости (жесткости) питьевой воды:
- вода водопроводная — до 6,5 ммоль / дм³ (в отдельных случаях с разрешения санитарных служб — до 10 ммоль / дм³)
- вода колодцев и каптажей источников — до 10 ммоль / дм;
- вода фасованная из пунктов разлива и с питьевых бюветов — 7 ммоль / дм³.
Видео по теме
Изображения по теме
info-farm.ru
Жесткость воды - это... Что такое Жесткость воды?
Жёсткость воды — совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния. Вода с большим содержанием таких солей называется жёсткой, с малым содержанием — мягкой. Различают временную жёсткость, образованную гидрокарбонатами и постоянную жёсткость, вызванную присутствием других солей. Временная жёсткость может быть устранена кипячением.
Жёсткая вода при умывании сушит кожу, в ней плохо образуется пена при использовании мыла. Использование жёсткой воды вызывает появление осадка (накипи) на стенках котлов, в трубах и т. п. В тоже время, использование слишком мягкой воды может приводить к коррозии труб, так как, в этом случае отсутствует кислотно-щелочная буферность, которую обеспечивает гидрокарбонатная (временная) жёсткость. Потребление жёсткой или мягкой воды обычно не является опасным для здоровья, хотя есть данные о том, что высокая жёсткость способствует образованию мочевых камней, а низкая — незначительно увеличивает риск сердечно-сосудистых заболеваний.
Жёсткость природных вод может варьироваться в довольно широких пределах и в течение года непостоянна. Увеличивается жёсткость из-за испарения воды, уменьшается в сезон дождей, а также в период таяния снега и льда.
Единицы измерения
Для численного выражения жёсткости воды указывают концентрацию в ней катионов кальция и магния.
Рекомендованная единица СИ для измерения концентрации — моль на кубический метр (моль/м3), однако, на практике для измерения жёсткости чаще используется миллимоль на литр (ммоль/л).В России для измерения жёсткости чаще используется нормальная концентрация ионов кальция и магния, выраженная в миллиграмм-эквивалентах на литр (мг-экв/л). Один мг-экв/л соответствует содержанию в литре воды 20,04 миллиграмм Ca2+ или 12,16 миллиграмм Mg2+ (атомная масса делённая на валентность).
Иногда указывают концентрацию, отнесённую к единице массы, а не объёма, особенно, если температура воды может изменяться или если вода может содержать пар, что приводит к существенным изменениям плотности.
В разных странах использовались (иногда используются до сих пор) различные внесистемные единицы — градусы жёсткости.
| Немецкий | °dH (dergees of hardness),°dGH (German (Deutsche) Hardness),°dKH (для карбонатной жёсткости) | 1 часть оксида кальция (СаО) или 0.719 частей оксида магния (MgO) на 100 000 частей воды | 0,357 | 0,179 |
| Английский | °e | 1 гран CaCO3 на 1 английский галлон воды | 0,285 | 0,142 |
| Французский | °TH | 1 часть CaCO3 на 100000 частей воды | 0,200 | 0,100 |
| Американский | 3 на 1 000 000 частей воды | 0,02 | 0,01 |
В СССР до 1952 года использовали градусы жёсткости, совпадавшие с немецкими.
По величине общей жёсткости различают воду мягкую (до 2 мг-экв/л), средней жесткости (2-10 мг-экв/л) и жёсткую (более 10 мг-экв/л). Жёсткость воды поверхностных источников существенно колеблется в течение года; она максимальна в конце зимы, минимальна — в период паводка (например, жёсткость волжской воды в марте — 4,3 мг-экв/л, в мае — 0,5 мг-экв/л[1]). В подземных водах жёсткость обычно выше (до 80-100 мг-экв/л) и меньше изменяется в течение года.
Методы устранения
Обратный осмос. Метод основан на прохождении воды через полупроницаемые мембраны (как правило, полиамидные). Вместе с солями жёсткости удаляется и большинство других солей. Эффективность очистки может достигать 99,9 %. Этот метод нашёл наибольшее применение в бытовых системах подготовки питьевой воды. В качестве недостатка данного метода следует отметить необходимость предварительной подготвки воды, подаваемой на обратноосмотическую мембрану.
Электродиализ. Основан на удалении из воды солей под действием электрического поля. Удаление ионов растворенных веществ происходит за счёт специальных мембран. Так же как и при использовании технологии обратного осмоса, происходит удаление и других солей, помимо ионов жёсткости.
Термический способ. Основан на нагреве воды, устраняет только временную (карбонатную) жёсткость. Находит применение в быту. В промышленности применяется, например, на ТЭЦ.
Реагентное умягчение. Метод основан на добавлении в воду соды или гашеной извести. При этом соли кальция и магния переходят в нерастворимые соединения и, как следствие, выпадают в осадок. Этот метод оправдан при относительно больших расходах воды, поскольку связан с решением ряда специфических проблем: фильтрации осадка, точной дозировки реагента.
Катионирование. Метод основан на использовании ионообменной гранулированной загрузки (чаще всего ионообменные смолы). Такая загрузка при контакте с водой поглощает катионы солей жёсткости (кальций и магний). Взамен, в зависимости от ионной формы, отдавая ионы натрия или водорода. Эти методы соответственно называются Na-катионирование и Н-катионирование. Как правило, жёсткость воды снижается при одноступенчатом натрий-катионировании до 0,05-0,1 мг-экв/л, при двухступенчатом — до 0,01 мг-экв/л.
Ссылки
Примечания
- ↑ Химическая энциклопедия. — М.: Советская энциклопедия, 1990. Т. 2. С. 145.
Wikimedia Foundation. 2010.
dic.academic.ru
Жесткость воды: определение и измерение

Самая наверное, животрепещущая проблема, требующая решения, если не немедленного, то обдуманного точно. Если у вас в доме используется вода низкого качества, то выбора у вас нет. Такую воду нужно умягчать, иначе последствия будут самыми затратными. Жаль, только, что мы как люди экономные, всегда ждем и надеемся на авось, в результате и приходим к мысли о снижении жесткости воды, только тогда, когда стиральная машинка выйдет из строя, или же в котельной трубы разорвет от перегрева.
Жесткой воду делают, как известно повышенное содержание всего двух солей. Это соли кальция и магния. Однако жесткость воды сама по себе может быть разной, также как и лишнее содержание солей может быть разным. Иногда жесткость может быть карбонатной, а может она быть и сульфатной. Но поскольку карбонатная жесткость составляет практически 98 процентов случаев, то варианты работы и будем разбирать на примерах данной некачественной воды. Разбираясь с проблемами некачественной воды, рассмотрим более подробно сами понятия.
Таблица. Виды жесткости воды
| Временная жесткость | Карбонатная жесткость |
| Кальций | Гидрокарбонат |
| Магний | Сульфат |
| Стронций | Хлорид |
| Железо | Нитрат |
| Марганец | Силикат |
Итак, согласно энциклопедии, жесткость воды – это растворенные в воде катионы кальция и магния. Если вода имеет высокий показатель жестковатости, то при нагреве эти соли образуют плотный налет на поверхностях оборудования. Не гнушается такой налет образовываться и в человеческом организме. Только там он принимает форму песка или камней в желчном пузыре, почках, печени. Показатель жесткости воды во многом определяет ее использование как на предприятиях, так и в быту. В любом случае, вы должны понимать, что степень жесткости воды обуславливает образование или необразование накипи в бытовых приборах или промышленном оборудовании.
Мы часто видим такое обозначение жесткости, как миллимоль на литр. Что это означает? Миллимоль – это единица обьема соли жесткости на литр некачественной воды. Один миллимоль – это такое количество вещества в граммах на литр, которое определяется молекулярной массой вещества, разделенной на его валентность. Если сказать проще, то один миллимоль на литр соли кальция составляет 20,04 миллиграмма этой соли, а вот содержание миллимоля магния, будет значительно меньше и составит 12,1 миллиграмм. Есть еще такое обозначение для жесткости, как миллиграмм на эквивалент литр и его смело можно приравнять к молю на метр кубический воды.
Но подобная классификация единиц измерения жесткости принята больше в странах бывшего советского союза, на территориях других стран используют другую. В германии степень жесткости воды определяют в немецких градусах. Во Франции это французский градус, есть еще американский градус. Поэтому всегда обращайте внимание на единицы измерения. Может случиться так, что фильтр для очень жесткой воды, который вы будете приобретать для своей квартиры, был выпущен за границей. Все единицы измерения там указанные, не относятся к постсоветскому пространству и придется корректировать их значения, чтобы понимать на какой оббьем воды рассчитаны подобные приборы.
Кроме разноплановости единиц измерения, жесткость воды подразумевает включение двух составляющих. Все дело в том, что жесткость образуют два подвида. Это временная и постоянная жесткость. Мы боремся и имеем дело с временной жесткостью воды, именно она образует накипь.
Карбонатную жесткость чаще всего временной жесткостью и называют. Это включения в воде в виде примесей кальция, магния, естественно, еще сюда можно отнести железистые отложения. Под постоянной жесткостью в воде понимают нитратные, а также сульфатные и хлоридные анионы. Их соли в воде растворяются.
Поскольку у жесткости есть единицы измерения, и мы знаем, что жесткая вода – это излишек двух солей в ней, соответственно должна быть и классификация степеней жесткости. Как же определить, что вода у вас плохого качества и ее следует умягчать?
Определение жесткости воды: методы
Если вы подозреваете, что ваша вода жесткая, то есть в наличии, хотя бы какие-то первичные признаки, в виде налета на нагревательном элементе чайника, барахлящего бойлера или отвратного качества стирки присутствуют, значит нужно проводить оценочный замер примесей в воде. Стоит подобная экспертиза определения жесткости воды недорого. Лаборатории, проводящие подобный анализ, сегодня есть, наверное, в любом мало-мальски большом городе.
Вы можете засомневаться, зачем проводить оценку воды, если итак наглядно видно, что степень жесткости у нее высокая? И, тем не менее, я думаю, никому не захочется переплачивать за мощность прибора, которая вам не нужна. Потому-то везде и советуют проводить определение жесткости воды, чтобы знать точно, какие приборы нужны для водоподготовки для частного дома в каждом конкретном случае.
Если вы решились и провели таки оценку своей воды, то вы должны знать ранжирование видов воды по степени жесткости. Мягкой будет считаться вода, у которой степень жесткости будет иметь показатель до 3 миллиграмм на эквивалент литр, средний показатель жесткости это предел 3-6 миллиграмм, свыше 6 – это уже жесткая вода и свыше 6 это очень жесткая.
Откуда же вода набирается всех этих примесей? Ведь не всегда используют близлежащие реки и озера в черте города. Часто используют артезианские скважины, в которых течет вполне чистая вода, иногда и полезная. Ведь сколько у нас разнообразных бюветов, в которых поставлены краны и мы ходим туда пить именно такую полезную воду. Способов умягчения жесткой воды сегодня множество. Какие-то способы эффективные, какие-то нет.
Но давайте подумаем, почему воду, которая считается полезной, разрешают пить только в определенных дозах? Каждому человеку, врач, который им занимается, назначает определенный рацион и говорит, сколько грамм подобной воды и по какому графику следует пить. Значит в воде слишком велико содержание определенных веществ. Раз ее нельзя пить сколько душе угодно. Да и что такое артезианская скважина? Наличие ее под землей еще не означает, что в нее не попадут вредные примеси. Под землей есть свои особенности. Множество методов определения жесткости, заставляет нас задуматься над выбором той или иной компании, предлагающей услугу химического анализа.
Как определить жесткость воды с максимальной точностью?
К счастью, придуман очень эффективный способ опреденить жесткость воды с максимальной точностью - титрование, это один из самых полезных и распространенных способов определения концентрации в воде солей магния и кальция. К плюсам данного метода относят его точность и не высокую стоимость при заказе.
.jpg) Существует и иные приборы, кроме титрования, способные максимально точно определить жесткость, но они либо дорогие, либо труднодоступные.
Существует и иные приборы, кроме титрования, способные максимально точно определить жесткость, но они либо дорогие, либо труднодоступные.
Где добывают все полезные ископаемые? В основном из земли, и откуда вода может быть чистой, если она протекает через землю, которая содержит все эти руды. Вода является одним из самых лучших природных растворителей, вот пока она дойдет до системы водозабора, она и потребляет в себя все примеси. Это известняк, доломиты, результаты выветривания горных пород. На степень жесткости воды оказывает влияние и степень минерализации воды. Если она составляет около 80 процентов, то вода становится жесткой за счет ионов кальция в основном. Только иногда и то очень редко, степень магниевой жесткости может составлять 50, а то и 60 процентов.
Но когда степень минерализации увеличивается, присутствие ионов кальция начинает резко сокращаться. В этом случае содержание кальция редко составляет выше одного грамма на литр. Количество магния наоборот растет. Чем больше степень минерализации воды, тем больше в ней магния. Этот показатель составляет несколько единиц, если это соленое озеро, то показатель магния там имеет отметку в районе десятки.
При всем при этом, хоть и кажется, что поверхностные воды значительно загрязненнее, тем не менее степень их жесткости, как правило ниже. Жесткость поверхностных вод имеет обыкновение в течении года прыгать. Так происходит потому, что наступает период таяния снегов, холода. Когда никто не купается, вода меньше загрязняется. Самый большой процент роста жесткости приходится на конец зимы и меньше всего этот показатель выпадает на период половодья, то есть в начале весны. В этот период еще часто идет дождь, и жесткость значительно разбавляется.
Самую высокую степень жесткости воды из природных видов воды имеет морская или океанская вода. Здесь показатель давно перевалил за 10 миллиграмм на эквивалент литр, иногда этот показатель переваливает и за сотню. И содержание кальция и магния в жесткой некачественной воде может быть самым разным.
Самый известный метод как определить жесткость, это сделать химический анализ воды. В России этой услугой занимаются множество компаний и стоит услуга определения жесткости воды не так дорого. При общих показателях жесткости, для питьевой воды есть свои требования. Кальций в воде начнет чувствоваться на вкус, если степень его включения в воде будет превышать 2-6 миллиграмм на эквивалент литр. Чтобы чувствовался магний, его в воде должно быть гораздо меньше. Хотя для магния бывает так, что в питье даже можно использовать воду с показателем до десятки.
Измерение жесткости воды
Теперь поговорим про измерение жесткости воды. Какие приборы используются для измерения жесткости воды? При этом важно в обязательном порядке выдерживать оптимальное содержание солей жесткости в воде. Если их убрать полностью, то такая вода тоже окажется вредной для человека. И впрочем не только на него. Низкое содержание карбонатных солей приводит к сердечно-сосудистым проблемам.
Что касается влияния на стенки оборудования, то у мягкой воды тоже есть недостаток. Она вызывает коррозионную активность. Поэтому, когда в теплоэнергетике проводят обработку поверхностей после работы с мягкой водой, обязательно в саму воду добавляют ингибиторы коррозии, чтобы тормозить ее развитие.
Как мы видим, вода имеет определенную степень жесткости по умолчанию. Нельзя, чтобы вода была слишком жесткой и слишком мягкой. К негативным последствиям ведет и тот, и другой вариант.
.jpg) Из-за использования некачественной воды, страдают не только материалы, вещи и здоровье. Есть еще оборудование и приборы, постоянно работающие с водой, есть еще и системы отопления и водоснабжения, где вода внутри оборудования есть всегда. В этих отраслях применение системы безреагентного умягчения воды необходимо, в обязательном порядке.
Из-за использования некачественной воды, страдают не только материалы, вещи и здоровье. Есть еще оборудование и приборы, постоянно работающие с водой, есть еще и системы отопления и водоснабжения, где вода внутри оборудования есть всегда. В этих отраслях применение системы безреагентного умягчения воды необходимо, в обязательном порядке.
Устранить накипь, после работы с подобной водой конечно можно. Но таким образом, вы потратите много времени на работы. Оборудование будет простаивать, вы будете нести убытки. Постоянные закупки средств для устранения налета. Раз в год глобальная очистка от накипи с помощью полного разбора оборудования. Обработку агрессивными средствами ни одна поверхность долго не выдержит. Поэтому при постоянных чистках, оборудование придется менять раньше, чем когда вы пользуетесь мягкой водой.
Не забываем и о плохой передаче тепла накипью. Получив в результате работы с лишней жесткостью воды, известковый налет на поверхностях, ваш прибор начинает плохо работать. КПД падает, качество нагрева воды тоже. Повышаются только расходы на топливо. С какой стороны не посмотри, но удаление выходит очень дорогим. Даже если сравнивать его за год работы с самым дорогим электромагнитным умягчителем воды - обратным осмосом.
Потом процесс устранения накипи никогда нельзя пускать на самотек. Нужно строго все контролировать и не допускать развития накипи до стадии известкового камня. В этом случае разрыв поверхностей и возможен, т.к. долго нагревать сам себя ни одна поверхность не сможет. Тепло потребует выхода.
Бороться с жесткостью воды можно и нужно. Только избрать для этого следует качественные приборы умягчения некачественной воды. Все фильтры, представленные на рынках сегодня можно разделить на две больших группы. О том, что выбрать, вы решаете сами, благо анализ воды, вы уже провели. Если результаты не сильно старые, и забор воды ведется не из первичных источников, то этот анализ поможет выбрать и правильный прибор для очищения воды.
Для собственного дома или квартиры сегодня все чаще рекомендуют использовать максимально простой в установке и эксплуатации электромагнитный умягчитель воды АкваЩит. Вы не будете маяться постоянным раскручиванием скручиванием. Вам не придется менять какие-либо запчасти или проверять состояние засыпки. В этом приборе все продумано для удобства пользователей. Во-первых, основу его составляют электрический процессор и мощные постоянные магниты. Применение электричества помогло многократно увеличить силу магнитного воздействия, а также дало возможность управлять силой данного воздействия. Частота генерируемых таким прибором электромагнитных волн может колебаться и соответственно корректироваться в пределах до 50 Кгц. Для этого в приборе есть небольшой блок управления.
Методы измерения жесткости воды:
- Химический анализ воды;
- Комплексонометрический метод показывающий карбонатную и временную жесткость;
- Метод атомной спектрометрии.
Работают подобные приборы для измерения жесткости воды с любыми поверхностями. Будь то металлопластик, чугун или сталь. Единственное важное условие – в обязательном порядке нужно будет устранить с внутренней части трубы старую накипь. Через нее даже мощные электромагнитные импульсы пробиться не в состоянии.
Такой прибор в состоянии измерить жесткости воды в течение 3-4 минут, и вам при этом ничего особенного делать не нужно. Вы просто покупаете и накручиваете прибор на трубу, даже врезание не нужно. Расход электричества при этом весьма щадящий. То есть из сопутствующих расходов будут только расходы на электроэнергию.
Выбирая прибор себе в дом, нужно помнить, да и понимать, что использование одного очистителя не гарантирует вам полную степень защиты от жесткости воды. Нельзя купить один фильтр-кувшин и потом в этой воде купаться. Не сможет подобный прибор очищать такое количество воды. Нельзя купить магнитное устройство и надеяться, что оно гарантирует качественную питьевую воду. Магнитная установка не очищает воду, она связывает соли жесткости, не дает отложиться на поверхностях. Впрочем, это грех всех безреагентных умягчителей. Поэтому для комплекса понадобиться приобрести специальный прибор для умягчения питьевой воды.
Лучше всего с измерением жесткости воды справляется прибор "ЗЕВС". Его основная задача отфильтровывать лишнее содержание солей жесткости. Для данного прибора для умягчения питьевой воды характерна высокая скорость очистки и простота замены картриджа. Работает прибор с помощью ионообменной смолы, которая отлично поглощает соли жесткости из воды, взамен отдавая полезный натрий.
Размер у таких установок отнюдь не маленький, т.к. в сам фильтр нужно куда-то засыпать средства для восстановления. В быту, чтобы вода не контактировала с вредным восстановителем, картридж меняют. В промышленности, картриджи стоят дорого и потому их восстанавливают, используя соль сверх очистки.
И еще одна особенность установки, характерная для промышленности. Здесь могут располагаться подряд и два, и три, и четыре прибора умягчения. Работает система так, что пока один прибор восстанавливают, нагрузка ложиться на другие приборы. Но зато восстанавливать приборы можно не разбирая и не останавливая каждый раз установку.
Жесткость воды как мы видим, присутствует в любой воде и с ней в обязательном порядке нужно «что-то делать». Если вы решились на такое приобретение, то лучше купить себе прибор, который прослужит года. Только в особенных требованиях, когда к воде предьявляются требования доочистки или сверх высокой степени очистки, тогда применяют другие виды устранения жесткости. Как правило, больше всего сегодня используют обратноосматические установки и ионообменные фильтры. Прежде чем паниковать, закажите измерение жесткости воды у профессионалов. В быту больше всего нашли себя безреагентные виды умягчителей.
vodopodgotovka-vodi.ru












