Когда нужна вода особой чистоты... Вода химически чистая
Химически чистая вода - Большая Энциклопедия Нефти и Газа, статья, страница 3
Химически чистая вода
Cтраница 3
Например, химически чистая вода, не содержащая растворенных газов, не подвергается разложению под действием радиации. Но присутствие в воде даже незначительных примесей способствует ее разложению под действием радиации на водород, кислород и перекись водорода. Радиолити-ческое окисление водных растворов солей позволяет определить дозировку ионизирующего излучения. [31]
Наличие у химически чистой воды незначительной электропроводности показывает, что молекулы воды диссоциируют на ионы. Все водные растворы из-за диссоциации воды содержат ионы водорода и гидроксила, которые находятся в равновесии. [32]
Как известно, химически чистая вода характеризуется высоким сопротивлением для прохождения электрического тока. С повышением концентрации веществ, растворенных в воде, электрическое сопротивление ее уменьшается, а электрслроводность увеличивается. На этой зависимости и основан принцип работы электрических солемеров. Определение солесодержания с применением электрического солемера производится по показаниям гальванометра с помощью предварительно построенной градуировочной кривой. Метод электропроводности для контроля качества пара является быстрым, точным и пригодным для регистрации на приборе. Основным недостатком этого метода является увеличение электропроводности пробы конденсата пара за счет присутствующих в пробе газов СОз и МН3, которые при конденсации проб растворяются, образуя угольную кислоту и гидроокись аммония, продукты электролитической диссоциации которых увеличивают электропроводность конденсата пара, завышая значение солесодержания в нем. Для того чтобы устранить это искажение, применяются солемеры, в которых сочетается предварительная дегазация пробы с ее упариванием в солеконденсаторе. При упаривании пробы ее солесодержание повышается в несколько раз по сравнению с действительным солесодержанием, в результате чего резко уменьшается влияние аммиака и углекислоты на точность показаний солемера. [33]
Рассмотрим сначала состояние химически чистой воды. [34]
Ранее было сказано, что химически чистая вода является очень слабым электролитом. [35]
Опыт показывает, что даже химически чистая вода проводит электрический ток, хотя и очень слабо. [36]
Концентрация водородных и гидроксильных ионов в химически чистой воде одинакова, благодаря чему вода инеет нейтральную реакцию. [37]
Концентрации водородных и гидроксильных ионов в химически чистой воде одинаковы, благодаря чему вода имеет нейтральную реакцию. [38]
Концентрация водородных и гидроксильных ионов в химически чистой воде одинакова, благодаря чему вода имеет нейтральную реакцию. [39]
Концентрация водородных я гидроксильных ионов в химически чистой воде одинакова, благодаря чему вода имеет нейтральную реакцию. [40]
Восполнение потерь пара и конденсата производится химически чистой водой или дистиллятом испарителей. Для барабанных котлов использование только химически чистой воды вызывает необходимость в периодических продувках барабана для удаления остатков. Для облегчения режима продувки используется дистиллят от специальной испарительной установки, которая снабжается автоматическим регулятором питания и уровня конденсата греющего пара. [41]
Например, объем и вес двух литров химически чистой воды равны сумме объемов и сумме весов двух порций той же воды, взятых при тех же условиях в количестве одного литра каждая. Но, как известно, такая аддитивность совершенно не наблюдается в случае так называемых интенсивных свойств; например, температура и давление двух соединенных объемов однородного газа не равны сумме значений этих свойств, какие были у частей газа до их соединения. Даже у экстенсивных свойств ( таких, как объем) аддитивность наблюдается ( да и то лишь в известных пределах), только для химически однородных частей вещества. Слияние же двух химически различных жидкостей как правило дает суммарный объем, отличный от точной суммы обоих исходных объемов, ибо возникшее взаимодействие между обеими жидкостями после их слияния всегда оказывает определенное влияние на их свойства, в том числе и на экстенсивные свойства, и изменяет их значения. [42]
Эти сравнительно небольшие различия в плотности образцов химически чистой воды различного происхождения уже явственно улавливаются измерительными приборами. [43]
Электропроводность твердой основы грунта в сухом состоянии ничтожна, химически чистая вода также обладает весьма высоким удельным сопротивлением. Однако содержащиеся в грунте различные соли и кислоты при наличии влаги создают электролиты, которые и определяют электропроводность грунта. Таким образом, удельное сопротивление грунта сильно зависит от его химического состава и влажности. [44]
Стандартная килокалория-количество тепла, необходимого для нагревания 1 кг химически чистой воды от 19 5 С до 20 5 С при нормальном атмосферном давлении ( 760 мм рт. ст.) на 45 параллели на уровне моря. [45]
Страницы: 1 2 3 4
www.ngpedia.ru
Питательная вода химически чистая - Справочник химика 21
Гидразин взаимодействует не только с той частью продуктов коррозии железа, которая находится во взвешенном состоянии в объеме воды, но и с теми окислами, которые находятся на поверхностях оборудования питательного тракта и поверхностях нагрева котла. Чем больше окислов железа на этих поверхностях, тем больше расход гидразина на их восстановление. При подаче гидразина в питательную воду вынос окислов железа из питательного тракта в котел в этом случае существенно возрастает. Не исключено, что даже при увеличенных дозах гидразина он может израсходоваться в питательном тракте полностью, не дойдя до котла. В подобных условиях процессы железоокисного накипеобразования в котле могут усилиться. Учитывая эту опасность, начинать гидразинную обработку питательной воды рекомендуется на чистом оборудовании после проведения водных и химических промывок или дозировать его в двух точках, т. е. также и перед котлом. [c.205] Среда Ресселя с мочевиной (по Равич-Биргер). К 4 г сухой питательной среды Гисса с индикатором ВР и лактозой прибавляют 0,1 г химически чистой глюкозы и 1 г мочевины, растворяют в 100 мл горячей дистиллированной воды, разливают в стерильные пробирки и стерилизуют текучим паром. Горячую среду скашивают, как среду Ресселя. Цвет готовой среды должен быть ярко-розовый. [c.189]Для подати химически чистой воды детали проточной части питательных насосов изготовляют из легированных сталей, стойких против окисления прп рабочих условиях. [c.199]
Сложившаяся практика классификации насосов отличается от приведенной выше. Насосы называют, например, по отрасли техники, в которой они используются насос теплоэнергетики, судовой насос, насос атомной промышленности, насос химический и т. д. шти по роду перекачиваемой жидкости для чистой воды, масляный, нефтяной, бензиновый по целевому назначению питательный, смесительный, дозировочный и т. д. [c.669]Внутрибарабанные сепарационные устройства, схему испарения, а также способ регулирования температуры перегретого пара парогенераторов выбирают с учетом получения чистого пара (отвечающего нормам ПТЭ), оптимальной схемы водоподготовки при максимально возможных добавках питательной воды для регулирования температуры перегретого пара и максимальном размере добавка химически обработанной или химически обессоленной воды. [c.116]
Питательные насосы предназначены для подачи химически чистой и аэрированной воды в котлы тепловых электрических станций. [c.199]
Газомазутные топки выполняют в виде параллелепипеда с подом в нижней части. Все стены и под плотно экранированы, т. е. покрыты трубной системой, в которой циркулирует питательная вода — конденсат отработанного в турбине пара с добавком химически очищенной воды в парогенераторах с естественной циркуляцией или чистого конденсата в прямоточных парогенераторах. На парогенераторах с естественной циркуляцией под выполняется наклонным (рис. 11-14), а на парогенераторах с принудительной циркуляцией под может выполняться и горизонтальным. [c.209]
Для получения пара требуемой чистоты в котлах высокого давления, питающихся со значительной добавкой химически очищенной воды, кроме обескремнивания добавочной воды, следует применять трехступенчатое испарение с выносными циклонами, надежной сепарацией и промывкой пара соленых и чистых отсеков питательной водой или конденсатом, при наличии раздельного питания котлов. [c.174]
В медицинской практике в качестве лекарств редко применяются чисто химические вещества. В него вводят различные ингредиенты, которые могут служить потенциальной питательной средой для размножения микроорганизмов. Это растворители, вспомогательные вещества, консерванты. При определенных условиях все они могут повреждаться бактериями, дрожжами и грибами. Микроорганизмы, находящиеся в сыром материале, воде, воздухе, проникнув в готовое лекарственное средство или его компонентьт, в различные стадии своей жизни погибают или остаются живыми и даже размножаются. В литературе имеются сведения о загрязненности готовых лекарственных средств и сырья различными видами бактерий и грибов, среди которьтх обнаруживаются виды, опасные в инфекционном отношении [I, 7, 9, 13, 27,30,33]. [c.520]
Положительное влияние подщелачивания котловой воды проверено нами и для котлов среднего давления одной электростанции. Подпитка котлов этой электростанции ведется химически очищенной водой, обработанной по прямоточной схеме последовательного Н—Ка-катионирования. Жесткость питательной воды на уровне 3—5 мкг-экв/кг, избыток фосфатов в чистой ступени 5—7 мг/кг Р04 , в солевой 30— 50 мг/кг. Исходная вода (особенно в паводковый период) имеет высокое содержание кремнекислых соединений. В этот период в котловой воде при относительно высокой общей щелочности значение гидратной щелочности оказывается недостаточным, чтобы все кремнекислые соединения, поступившие в котел с добавком химичес.ки очищенной воды и присосами сырой воды в конденсаторах, были переведены в силикат натрия. Такой режим приводил к интенсивному образованию на экранных трубах плотных силикатных отложений. Положение было исправлено после внедрения подщелачивания для создания в котловой воде избыточной гидратной щелочности, не связанной с фосфатом и кремнекислыми соединениями. Оптимальная избыточная гидратная щелочность составляет 0,1—0,2 мг-экв/кг. Для контроля щелочного режима котловой воды внедрено определение БЮг в котловой воде. Расчет избыточной гидратной щелочности, мг-экв/кг, выполняется по известной формуле [c.172]
Котлы с нагреванием электродным способом. Питательная вода для котлов. Проводимость. Для питания служит свежая вода и конденсат. Как общее правило, вода, лищенная жесткости химическим путей,— непригодна. Естественную вo y из источников, почвенную и поверхностную следует рассматривать как очень слабые растворы солей в зависимости от почвы, где вода нротекает, встречаются преимущественно соединения кальция (Са), магния (Mg) и щелочей. Так как все материалы для котлов и трубопроводов практически могут растворяться в воде, то то же относится и к конденсату. Химически чистая вода соверщенно не проводит тока проводимость воды обусловливается растворенными в ней солями. Проводимость зависит почти исключительно от количества растворенных веществ, о которых идет [c.1038]
В то время как в Леверкузене успешно применяют аммиак и гидразин, в Гамбурге имеется установка с котлом Бенсона, работающая без всяких химических добавок в течение 8 лет. О таком же успешном применении чистой воды сообщалось в Америке. Превосходные результаты, полученные в отсутствие химических добавок, вызвали некоторое удивление, и даже было высказано предположение, что в применявшейся в этом случае питательной воде при дистилляции мог образоваться какой-то летучий органический ингибитор. Каковы бы ни были причины достигнутых результатов, можно лишь поздравить тех, кто добился их. Тем не менее, если применение чистой воды найдет широкое распространение, будет необходимо привлечь к этой работе высококвалифицированных химиков. Сведения о применении чистой воды в Америке и Австралии приведены в литературе [83 ]. [c.427]
Действительные потребности растений в минеральных элементах можно установить только при выращивании их на искусственных питательных средах (водные и песчаные культуры). Для этого используют дистиллированную воду и химически чистые кварцевый песок, соли химически стойкие сосуды и посуду для приготовления и хранения растворов. [c.150]
Основными способами обезвреживания промышленных сто ков лесохимических предприятий являются их биохимическая очистка, выпаривание и сжигание Менее загрязненные про мышленные стоки отстаиваются, фильтруются, обрабатываются химикатами, разбавляются оборотной или условно чистой водой и направляются в биохимическую очистку Наиболее загрязнен ные стоки, не поддающиеся очистке (например различные кубо вые остатки), выпаривают или сжигают в различных печах Биохимическая очистка сточных вод Этот способ наиболее распространен Он предназначен для доочистки разбавленных сточных вод перед спуском их в водоемы Предварительная ме ханическая и химическая очистка стоков перед направлением на биохимическую очистку обязательна, чтобы снизить общую их загрязненность После этого они смешиваются с менее загрязненными промышленными стоками, хозяйственно бытовыми и фекальными водами, разбавляются возвратной водой до вели чины ХПК не более 1—2 тыс мг/л, обогащаются содержащими азот и фосфор питательными солями (растворами сульфата Щ [c.338]
Под стерилизацией понимают удаление всех форм живого с неживых объектов. Например, бывает необходимо обеспечить полное отсутствие микробов в воде, используемой для некоторых химических процессов или в жидкой питательной среде, приготовленной для выращивания чистых микробиологических культур. Стерилизации подвергают твердые объекты (например, хирургические инструменты и одежду) и целые помещения (например, операционные). Для этого используются следующие методы. [c.224]
Частота подкормок зависит от величины частиц инертного субстрата, времени года, погоды и фаз развития растений. На Киевской овоидной фабрике в период высадки рассады раствор подают дважды в день. По мере роста культур число подач раствора возрастает до 4—5 раз с интервалом 3—4 ч. Питательные растворы прн такой системе подачи используются 7—8 дней, затем периодически (раз в неделю) проводят полный химический анализ раствора и следят, чтобы его состав соответствовал рецепту. Обычно полностью заменяют раствор раз в месяц. Чтобы избежать засоления субстрата, его перед по,а,а-чей нового раствора промывают чистой водой. [c.347]
Химически чистый метафосфат кальция Са0-Р20в или Са(РОз)2 содержит 71,7% РгОв, технический продукт — до 65% усвояемой Р2ОВ. Высокая концентрация питательного элемента является главным достоинством этого удобрения. Метафосфат кальция растворим в нейтральном растворе лимоннокислого аммония. Под воздействием воды он медленно превращается в водорастворимый монокальцийфосфат 8. [c.251]
На формирование обрастаний, их характер и интенсивность влияют химический состав воды, ее температура, скорость потока, количество растворенного кислорода, содержание питательных веществ, свойства материала, контактирующего с водой. В чистых водах обрастания чаще всего обусловлены железобактериями, серобактериями, водорослями, моллюсками, губками, мшанками. При малом количестве питательных веществ в воде микроорганизмы планктона тоже вызывают обрастания. Теплообменная аппаратура, гидротехнические сооружения также подвержены обрастаниям железобактериями. Присутствие сероводорода в воде создает условия для развития серобактерий, окисляющих его до серы или сульфатов. Для полисапробной зоны характерно развитие зооглейных форм бактерий, образующих слизистые скопления. [c.252]
Чисто химическим методом является метод катионного обмена, так называемый метод натрийкатионирования. Этот метод основан на способности некоторых природных (глауконит) и искусственных (сульфоугли) материалов отдавать проходящей через них воде ионы натрия и присоединять к себе ионы кальция и магния. Этот процесс проводится в так называемых катионитовых фильтрах при температурах не выше 4-40° С. Расходующимся материалом нри этом является поваренная соль, которая необходима в виде 10—12%-ного раствора для регенерации катионита, т. е. введения в молекулу катионита ионов натрия после их израсходования. В этом случае из молекулы отработавшего катионита вытесняются ионы кальция и магния и удаляются из фильтра в виде хлористых солей. Этот метод ведет к более полному удалению ионов кальция и магния, но зато увеличивает щелочность питательной воды и общее солесодержание ее, все ионы угольной кислоты и кислород также остаются в питательной воде. [c.104]
Органически загрязненные и хозяйственно-бытовые сточные воды проходят раздельно механическую и химическую очистку, затем совместно очищаются биологическим методом и далее сбрасываются в буферный пруд. Условно-чистые и ливневые воды сбрасываются в пруд без очистки. После усреднения и отстоя сточные воды фильтруются и перекачиваются на глубокую доочистку методами абсорбции и ионообмена. Далее очищенные сточные воды пополняют системы оборотного водоснабжения. Опресненная вода, получаемая из сточных вод большой минерализации путем предварительной очистки и опреснения на многокорпусной выпарной установке, используется в качестве питательной воды на ТЭЦ и для технологических целей. При этом концентрированные рассолы направляются на подземное захоронение. [c.117]
Однако древесина является хорошей питательной средой для дереворазрушающих грибков и насекомых. Важным фактором для их развития является повышенная влажность. В настоящее время выявлено около loo видов таких грибков, разрушающих древесину. Поэтому перед химиками стоит важнейшая народнохозяйственная задача химическими средствами защитить древесину от разрушения. Для этой цели используют антисептики — препараты, уничтожающие микроорганизмы или задерживающие их размножение и развитие. Для защиты древесины антисептики должны отвечать ряду требований быть токсичными к дереворазрушающим грибкам и насекомым, но безвредными для человека и животных хорошо проникать в древесину и быть стойкими во времени не снижать прочность древесины и не портить ее внешнего вида не вымываться водой. Большинством из этих свойств обладают каменноугольные масла, образующиеся при коксовании каменных углей. Первые рекомендации по их использованию для пропитки древесины были даны еще в 1835—1838 гг. Несмотря на большое количество выявленных антисептиков, ни один из них не обладает столь широким комплексом необходимых свойств. Каменноугольные масла применяют в чистом виде или в смеси в разбавителями для защиты древесины, работающей в самых жестких условиях шпалы, подземная часть столбов, опоры мостов и др. Однако у каменноугольных пропиточных масел имеются и существенные недостатки. Они придают древесине повышенную горючесть, окрашивают ее в непривлекальный черный цвет и обусловливают неприятный запах. Пропитанную ими древесину нельзя склеивать. [c.86]
Классификация насосов по назначению не может быть строгой, т. к. одни и те же насосы применяются в энергетике, водоснабжении, в химическом производстве и т. д. Например, в теплоэнергетике все центробежные насосы разделяют на следующие фугшы 1) насосы для чистой воды 2) конденсатные (дая удаления конденсата с температурой до 393 К) 3) питательные (для подачи горячей воды в паровые котлы) 4) насосы для кислых сред (из нержавеющих сталей) 5) насосы для подачи смесей жидкостей и твердых частиц, в том числе песковые, шламовые (грязевые), земляные (землесосы) (для снижения износа проточная часть насосов выполнена из конструкционных или твердых белых чугу-нов). [c.364]
Отношение между глиною и песком в почвах, служащих для обработки под растения, чрезвычайно важно уже потому, что почва, богатая глиною, плотнее, тяжелее, ссыхается от жаров, в мокрую и очень сухую погоду трудно подцаегся пахотным орудиям, тогда как почва, богатая песком, рыхла, рассыпчата, легко выделяет из себя проникающую ее влагу, скоро высыхает, но обрабатывается сравнительно легче. Ни сыпучие пески, ни чистая глина не могут считаться хорошими культурными почвами. Различие в содержании глины и песку в почве имеет также значение чисто химическое. Песок легко проникается воздухом, потому что его частицы неплотно прилегают друг к другу. Оттого в песчаных почвах изменение удобрений совершается весьма легко. Но. с другой стороны, такие почвы не задерживают питательных начал, заключающихся в удобрении, а также, и воды, необходимой для питания, при посредстве корней, и сильно страдают от засухи. Растворы питательных веществ, содержащие соли калия, фосфорной кислоты и т. п., пропущенные чрез песок, оставляют в нем только смачивающие поверхность части раствора стоит промыть затем такой песок чистою водою, и эти прилипшие части раствора смоются водою. Не такова глина. Если чрез ее слой пропустить вышеназванные растворы, то задержка питательных веществ этих растворов будет весьма велика, отчасти вследствие огромной поверхности, которую имеюг мельчайшие частички глины. Растворенные в воде питательные начала особым образом удерживаются частицами глины, т.-е. поглотительная способность глины весьма велика сравнительна с песком, что имеет громадное значение в экономии природы (гл. 13) Понятно, что для наиболее удобными будут почвы, содержащие определенную смесь песка и глины, и действительно, лучшие почвы представляют именно такого рода состав. Исследование культурных почв, столь важное для анания естественных условий произведения питательных веществ, подробнее рассматривается в науке о сельском хозяйстве. В отношении к России проф. В. В. Докучаев положил начало подробному почвоведению. Лишь в виде примера приводим определение состава четырех почв 1) чернозема из Симбирской губернии 2) глинистой из Смоленской губ. 3) более песчанистой почвы из Московской губ. и [c.420]
Часто трудно провести четкую границу между чисто химическими, физическими и индуцированными микроорганизмами биохимическими процессами превращения действующих веществ в почве. Ярким примером служит превращение гербицида амитрола. Он очень быстро разлагается в условиях, при которых усиливается микробиологический обмен веществ оптимальные температуры, достаточ1ное увлажнение и высокое содержание органического вещества в почве. Амитрол хорошо растворяется в воде и, судя по химическому составу, должен представлять собой питательное вещество для микроорганизмов, Однако, как отмечает Кауфман [122], до [c.24]
chem21.info
Когда нужна вода особой чистоты...
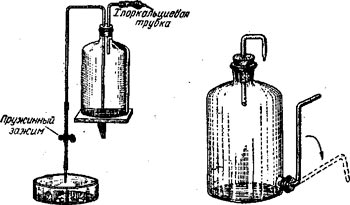 Вода – универсальный растворитель. Именно поэтому в химической лаборатории чистая вода используется в неисчислимом множестве случаев. И хотя водопроводных кранов в каждой лаборатории обычно вдосталь, для опытов чаще всего используется вода особой чистоты – дистиллированная и деминерализованная.
Вода – универсальный растворитель. Именно поэтому в химической лаборатории чистая вода используется в неисчислимом множестве случаев. И хотя водопроводных кранов в каждой лаборатории обычно вдосталь, для опытов чаще всего используется вода особой чистоты – дистиллированная и деминерализованная.
В силу недостаточной стойкости стекла к растворению в щелочных составах, при хранении (и тем более при продуцировании) химически чистой воды применение стеклянной посуды и приборов может оказаться затруднительным. Лучшие результаты дает использование алюминиевых емкостей (оксидная пленка на внутренней поверхности которых препятствует обогащению жидкости отщепленными молекулами металла), либо пластиковой посуды. Допускается выстилание стеклянных емкостей пластиковой пленкой.
Во избежание загрязнения дистиллированной и деминерализованной воды хранение ее запаса должно вестись в емкостях с герметически закрывающимися горловинами. Переливается химически чистая вода только в тщательно отмытую посуду. Поскольку длительное хранение особо чистой воды не допускается, каждую новую её партию следует проверять на чистоту.
 Приготовление особо чистой воды
Приготовление особо чистой воды
Дистиллированную и деминерализованную воду используют как основу для растворов, так и для подготовки лабораторной посуды к применению. Существуют, однако, сложности: вода, сконденсировавшаяся в холодильнике перегонного куба, не является химически чистой. В ней – пусть и в минимальных количествах – содержатся посторонние примеси. Это и частицы обычной бытовой пыли (как правило, органического состава), и продукты выщелачивания стекла, и соединения металла (если холодильник дистиллятора выполнен из меди или стали).
Помимо того, воде свойственно растворять газы (углекислый газ, соединения азота), соли и органические вещества. Удаление примесей требует от лаборанта дополнительных усилий. Следы металлов исчезают после обработки воды активированным углем с добавкой аммиака.
В качестве дополнительной меры используется очистка воды при помощи дитизона. Удобство данного метода состоит в способности препарата менять цвет при наличии загрязнителей. Как только раствор дифенилтиокарбазона перестанет реагировать на ионы металлов, и сохранит свой изначальный зеленый цвет, вода считается очищенной. Растворенный дитизон удаляется из воды прибавкой тетрахлорметана.
Важный этап приготовления особо чистой воды – удаление органики. Справиться с проблемой помогает вторичная перегонка дистиллированной воды, слегка подкисленной серной кислотой и марганцовокислым калием. Однако в данном случае холодильник дистиллирующего устройства должен быть выполнен из кварца либо посеребренного невыщелачивающегося стекла. Приемник готовой воды изолируют от атмосферы и принимают меры против загрязнения конденсата.
Проверить качество дистиллированной и деминерализованной воды можно замером ее электропроводности. Хорошо очищенная вода – прекрасный диэлектрик, ее удельное сопротивление не бывает ниже 50 тысяч ом∙см.
Приборы – помощники

В условиях современности делать последовательное очищение воды при помощи разнообразных реагентов – архаично. Производство деминерализованной воды, по чистоте сходной с водой двойной дистилляции, можно вести при помощи систем ионитовых фильтров. Последовательное прохождение воды через катиониты и аниониты, при условии достаточно длительного контакта жидкости с реагентами, дает весьма позитивные результаты.
Возможность восстановления работоспособности ионитных фильтров снижает стоимость готового продукта. Тем не менее, напрямую обрабатывать ионообменными смолами водопроводную воду не рекомендуется из-за быстрого насыщения фильтрующих слоев.
Прекрасно зарекомендовали себя и лабораторные мембранные фильтры. Вода, предварительно очищенная от относительно крупных частиц при помощи многослойных фильтров, очищается, просачиваясь через полимерную пленку с порами размером в десяти- и стомиллионные доли метра.
 Подобная миниатюризация пропускных отверстий фильтра дает возможность задерживать на поверхности полимерной пленки практически все частицы вещества – кроме молекул воды. И хотя мембранные фильтры, предназначенные для очистки воды – как и ионообменные смолы – способны к восстановлению работоспособности, их нужно тщательно оберегать от контактов с жировыми веществами и нефтепродуктами. Даже минимальные количества этих загрязнителей могут привести мембранный фильтр для воды в необратимо непригодное состояние.
Подобная миниатюризация пропускных отверстий фильтра дает возможность задерживать на поверхности полимерной пленки практически все частицы вещества – кроме молекул воды. И хотя мембранные фильтры, предназначенные для очистки воды – как и ионообменные смолы – способны к восстановлению работоспособности, их нужно тщательно оберегать от контактов с жировыми веществами и нефтепродуктами. Даже минимальные количества этих загрязнителей могут привести мембранный фильтр для воды в необратимо непригодное состояние.
Срок хранения особо чистой воды определяется экспериментальным путем. Однако многократный забор химически чистой воды из емкости постоянного хранения резко повышает возможность загрязнения остатка. Поэтому объем выработки дистиллированной и деминерализованной воды не должен превышать двух-трехсуточной потребности.
pcgroup.ru
Вода с точки зрения химии.
Огромная роль воды в жизни человека и природы послужила причиной того, что она была одним из первых соединений, привлекших внимание ученых. Тем не менее, изучение воды еще далеко не закончено.
Общие свойства воды.
Вода в силу популярности ее молекул способствует разложению контактирующих с ней молекул солей на ионы, но сама вода проявляет большую устойчивость и в химически чистой воде содержится очень мало ионов по H+ и OH-.
Вода – инертный растворитель; химически не изменяется под действием большинства технических соединений, которые не растворяет. Это очень важно для всех живых организмов на нашей планете, поскольку необходимые тканям питательные вещества поступают в водных растворах в сравнительно мало измененном виде. В природных условиях вода всегда содержит то или иное количество примесей, взаимодействуя не только с твердыми и жидкими веществами, но растворяя также и газы.
Даже из свежевыпавшей дождевой воды можно выделить несколько десятков миллиграммов различных растворенных в ней веществ на каждый литр объема. Абсолютно чистую воду никогда и никому еще не удавалось получить ни в одном из ее агрегатных состояний; химически чистую воду, в значительной мере лишенную растворенных веществ, производят путем длительной и кропотливой очистки в лабораториях или на специальных промышленных установках.
В природных условиях вода не может сохранить «химическую чистоту». Постоянно соприкасаясь со всевозможными веществами, она фактически всегда представляет собой раствор различного, зачастую очень сложного свойства. В пресной воде содержание растворенных веществ обычно превышает 1 г/л. От нескольких единиц до десятков граммов на литр колеблются содержание солей в морской воде: например, в Балтийском море их всего 5 г/л, в Черном – 18, а в Красном море – даже 41 г/л.
Солевой состав морской воды в основном на 89% слагается из хлоридов (преимущественно хлорида натрия, калия, кальция), 10% приходится на сульфаты (натрия, калия, магния) и 1% - на карбонаты (натрия, кальция) и другие соли. Пресные воды содержат обычно больше всего до 80% карбонатов (натрия, кальция), около 13% сульфатов (натрия, калия, магния) и 7% хлоридов (натрия и кальция).
Вода хорошо растворяет газы (особенно при низких температурах), главным образом кислород, азот, диоксид углерода, сероводород. Количество кислорода иногда достигает 6 мг/л. В минеральных водах типа нарзан общее содержание газов может составлять до 0,1%. В природной воде присутствуют гумусовые вещества – сложные органические соединения, образующиеся в результате неполного распада остатков растительных и животных тканей, а также соединения типа белков, сахаров, спиртов.
Вода обладает исключительно высокой теплоемкостью. Теплоемкость воды принята за единицу. Теплоемкость песка, например, составляет 0,2, а железа – лишь 0,107 теплоемкости воды. Способность воды накапливать большие запасы тепловой энергии позволяет сглаживать резкие температурные колебания на прибрежных участках Земли в различные времена года и в различную пору суток: вода выступает как бы регулятором температуры на всей нашей планете.
Следует отметить особое свойство воды – ее высокое поверхностное напряжение – 72,7 эрг/см2 (при 20С). В этом отношении из всех видов жидкостей вода уступает только ртути. Подобное свойство воды во многом обусловлено водородными связями между отдельными молекулами h3O. Особенно наглядно проявляется поверхностное напряжение в прилипании воды ко многим поверхностям – смачивании. Установлено, что вещества – глина, песок, стекло, ткани, бумага и многие другие, легко смачиваемые водой, непременно имеют в своем составе атомы кислорода. Такой факт оказался ключевым при объяснении природы смачивания: энергетически неуравновешенные молекулы поверхностного слоя воды получают возможность образовать дополнительные связи с «чужими» атомами кислорода.
Смачивание и поверхностное натяжение лежат в составе явления, названного капиллярностью: в узких каналах вода способна подниматься на высоту гораздо большую, чем та, которую «позволяет» сила тяжести для столбика данного сечения.
В капиллярах вода обладает поразительными свойствами. Б.В. Дерягин установил, что в капиллярах вода, сконденсировавшаяся из водяного пара, не замерзает при 0 и даже при снижении температуры на десятки градусов.
Молекулы воды отличаются большой термической устойчивостью, при деструкции по схеме: 2h3O 2h3 + O2 + 2245,6 КДж. Начинается при температурах выше 1000С, и при 2000С составляет лишь 1,8%. При 5000С водяной пар со взрывом нацело разлагается на водород и кислород.
Вода относится к слабым электролитам: h3O H+ + OH-
_ [H+] [OH-] _
Kдисс [h3O] 1, 810-16
Вода весьма реакционно-способное вещество: может проявлять как окислительные, так и восстановительные свойства. Так, под действием сильных восстановителей вода проявляет окислительные свойства: на холоде окисляет щелочные и щелочноземельные металлы, а при температуре накаливания – железо, углерод и др.
2Na + 2h3O 2NaOH + h3
2Fe + 4h3O Fe3O4 +4h3
Под действием сильных окислителей (фтор, хлор, электрический ток) воды проявляет восстановительные свойства. Так, реакцию взаимодействия со фтором можно представить следующим образом:
2F2 +2h3O 2h3F2 + O2
Существует три типа присоединения воды к молекулам других веществ: по ионному, координатному и адсорбционному типу.
Присоединение по ионному типу происходит к оксидам щелочных, щелочноземельных и редкоземельных металлов, а также к кислотным оксидам:
CaO + h3O Ca(OH)2
P2O5 + 3h3O 2h4PO4
Вода, присоединяемая по ионному типу, называется конституционной. Она удаляется при нагревании с большим трудом. Так отщепление от едкого натра начинается при 1388С:
2NaOH Na2O + h3O
К ионам металлов – комплексообразователей присоединение идет по координатному принципу:
CaCl2 + Ch3O [Ca(h3O)6]Cl2
Полученные соединения называются аквакомплексами, а вода, вошедшая в их состав, - кристаллизационной. Кристаллизационная вода удаляется легче, чем конституционная, например, при выветривании.
Различные вещества адсорбируют на своей поверхности некоторое количество воды за счет межмолекулярных сил притяжения. Вода, присоединенная по абсорбционному типу, называется гигроскопической; она удаляется легче, чем кристаллизационная.
Ионный состав природных вод.
Происходящее в почвах окисления органических веществ вызывают расход кислорода и выделение углекислоты, поэтому в воде при фильтрации её через почву возрастает содержание углекислоты, что приводит к обогащению природных вод карбонатами кальция, магния и железа, с образованием растворимых в воде кислых солей типа:
СаСО3 + h3O + СO2 Са(НСОз)2
Бикарбонаты присутствуют почти во всех водах в тех или иных количествах. Большую роль в формировании химического состава воды играют подстилающие почву грунты, с которыми вода вступает в соприкосновение, фильтруясь и растворяя некоторые минералы. Особенно интенсивно обогащают воды осадочные породы, такие, как известняки, доломиты, мергели, гипс, каменная соль и др. В свою очередь почва и породы обладают способностью адсорбировать из природной воды некоторые ионы (например, Са+2, Mg+2), замещая их эквивалентным количество других ионов (Na+, К+).
Подпочвенными водами легче всего растворяются хлориды и сульфаты натрия и магния, хлорид кальция. Силикатные и алюмосиликатные породы (граниты, кварцевые породы и т.д.) почти нерастворимы в воде и содержащей углекислоту и органические кислоты.
Наиболее распространенными в природных водах являются следующие ионы: С1-, SO4-, НСО3, СО3-, Na+, Mg2+, Са2+, H+.
Ион хлора присутствует почти во всех природных водоемах, причем его содержание меняется в очень широких пределах. Сульфат - ион также распространен повсеместно. Основным источником растворенных в воде сульфатов является гипс. В подземных водах с содержанием сульфат - иона обычно выше, чем в воде рек и озер. Из ионов щелочных металлов в природных водоемах в наибольших количествах находится ион натрия, который является характерным ионом сильноминерализованных вод морей и океанов.
Ионы кальция и магния в маломинерализованных водах занимают первое место. Основным источником ионов кальция является известняки, а магния - доломиты (MgCO3, СаСО3). Лучшая растворимость сульфатов и карбонатов магния позволяет присутствовать ионам магния в природных водах в больших концентрациях, чем ионов кальция.
Ионы водорода в природной воде обусловлены диссоциацией угольной кислоты. Большинство природных вод имеют рН в пределах 6,5 - 8,5. Для поверхностных вод, в связи с меньшим содержанием в них углекислоты, рН обычно выше, чем для подземных.
Соединения азота в природной воде представлены ионами аммония, нитритными, нитратными ионами за счет разложения органических веществ животного и растительного происхождения. Ионы аммония, кроме того, попадают в водоемы со сточными промышленными водами.
Соединения железа очень часто встречаются в природных водах, причем переход железа в раствор может происходить под действием кислорода или кислот (угольной, органических). Так, например, при окислении весьма распространенного в породах пирита получается сернокислое железо:
FeS2 + 4O2 Fe2+ + 2SO42-,
а при действии угольной кислоты – карбонат железа:
FeS2 + 2Н2СОз Fe2+ + 2НСОз + h3S + S.
Соединения кремния в природных водах могут быть в виде кремниевой кислоты. При рН 8 кремниевая кислота находится практически в недиссоциированном виде; при рН 8 кремниевая кислота присутствует совместно с HSiO3 , а при рН >П - только HSiOз . Часть кремния находится в коллоидном состоянии, с частицами состава HSiO2h3O , а также в виде поликремневой кислоты: XSiO2h3O. В природных водах присутствуют также Аl3+, Mg2+ и другие катионы.
Помимо веществ ионного типа природные воды содержат также газы и органические и грубодисперсные взвеси. Наиболее распространенными в природных водах газами являются кислород и углекислый газ. Источником кислорода является атмосфера, углекислоты - биохимические процессы, происходящие в глубинных слоях земной коры, углекислота из атмосферы.
Из органических веществ, попадающих извне, следует отметить гуминовые вещества, вымываемые водой из гумусовых почв (торфяников, сапропелитов и др.). Большая часть из них находится в коллоидном состоянии. В самих водоемах органические вещества непрерывно поступают в воду в результате отмирания различных водных организмов. При этом часть из них остается взвешенной в воде, а другая опускается на дно, где происходит их распад.
Грубодисперсные примеси, обуславливающие мутность природных вод, представляют собой вещества минерального и органического происхождения, смываемые с верхнего покрова земли дождями или талыми водами во время весенних паводков.
studfiles.net











