Содержание
Основные свойства воды — Всё самое интересное!
Продолжаем раздел «Вода» и подраздел «Теоретические основы» статьёй Основные свойства воды. Где рассмотрим основополагающие, можно сказать, краеугольные, качества воды. Кстати, в конце статьи есть ссылочка, по которой можно скачать презентацию для школы по данной теме.
Основные свойства воды — это интересная тема, которая изучается ещё в школе, на уроках природоведения. Однако, чаще всего она изучается в школе весьма запутанным способом, с нарушением всех правил обучения. И в результате детям приходится лишь недоумённо спрашивать у взрослых перед, скажем, контрольной работой, на эту тему: «О, мама (папа, дядя…) — какие основные свойства воды? А то у нас был урок, а завтра контрольная… А запомнилось только что-то про температуру, про солёность и про то, что в воде есть золото. Этих основных свойств то ли 3, то ли 5… Помогите!»
Что бывает чаще всего? Чаще всего эти вопросы остаются без ответа, потому что взрослые — это те же дети, которые в своё время точно так же почти ничего не запомнили после урока про основные свойства воды. И не могут назвать основные свойства воды.
И не могут назвать основные свойства воды.
Естественно, просто перечислить свойства воды, конечно, может любой, даже тот же школьник, не слушавший урок. Но вот выделить среди них основные… Вот задачка так задачка. И мы постараемся справиться с ней в данной статье. А для начала разберёмся со слововм «основные». Потому что, не зная, что такое «основные», выбрать основные свойства воды сложно.
Итак, согласно толковому словарю, основной — это «наиболее важный, главный, самый существенный».
Естественно, сразу возникает вопрос: «Основной, важный, главный, существенный — это для кого? Ведь для, скажем, Ираклия, важно одно, а для Петропавла существенно другое!» И это совершенно правильный вопрос. Потому что для того же Ираклия основным свойством воды будет «Она есть», а для, например, Петропавла — «Она есть в водке».
Ну, вообще-то, важность свойства определяется по тому, насколько это свойство может помочь решить какую-либо проблему. Но мы не будем углубляться в дебри, а останемся на поверхности, на уровне обычного пятого-шестого класса. И попробуем определиться с тем, что же считается основными свойствами воды в целом, для всех.
Но мы не будем углубляться в дебри, а останемся на поверхности, на уровне обычного пятого-шестого класса. И попробуем определиться с тем, что же считается основными свойствами воды в целом, для всех.
И когда мы так ставим вопрос, то тема немножко проясняется.
Получается, что когда нужно перечислить основные свойства воды, имеются в виду те свойства, которые важны для всех живых существ.
Можно сказать, для жизни в целом. Вот из этого мы и будем исходить в дальнейшем. Итак, возвращаемся к свойствам воды. Обычно среди свойств воды называются такие, как
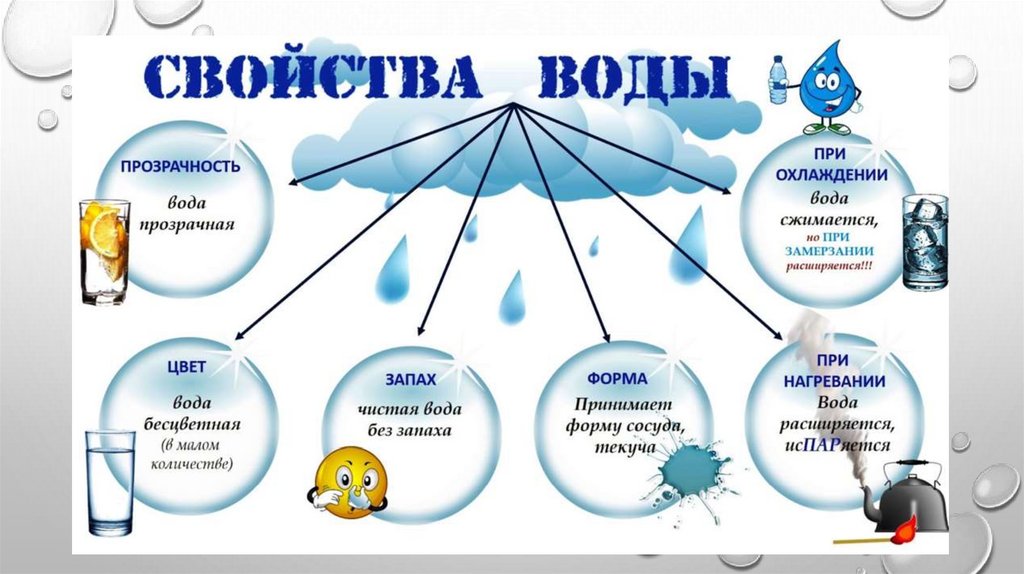
- прозрачная,
- бесцветная,
- текучая,
- без запаха,
- принимает любую форму, в которую её налить,
- растворяет вещества,
- может замерзать,
- может испаряться,
- вода расширяется и сжимается.
Возможно, кто-то вспомнит институтский курс и назовёт ещё парочку свойств, типа «молекула воды биполярна» или «вода состоит из 20 % водорода и 80 % кислорода, что-то около того», или «угол между двумя атомами водорода в молекуле воды равен 120 градусов» или ещё какие-нибудь похожие подробности.
Но обратите внимание, что эти подробности касаются строения воды. Тогда как вопрос детей (и наша с вами тема статьи) касается СВОЙСТВ воды. Естественно, свойства воды зависят от её структуры. Но когда спрашивают про свойства, нужно отвечать про свойства — иначе это не будет ответом на вопрос. Между прочим, отсутствие ответа на свой вопрос дети презирают 🙂
Итак, мы вспомнили, что у воды много свойств. И мы знаем, какие свойства воды нужно выбирать в категорию «основные свойства воды». Давайте разберёмся, какие из перечисленных и неперечисленных свойств воды действительно являются основными.
Начнём с того, что в воде хорошо растворяются разнообразные вещества — и поэтому в воде бывает много солей, в том числе, золото, серебро, платина (говорят, одна тонна морской воды содержит примерно грамм золота). Соответственно, чем больше солей, тем больше солёность воды. Чем меньше солей, тем меньше солёность воды.
Далее, нужно учитывать, что чем больше солей в воде, тем более вода тяжёлая. Чем вода тяжелее, тем быстрее она опускается на дно. Это позволяет организмам в океане жить именно в таких условиях, каких они живут. Если бы такого свойства воды не было, эволюция пошла бы по-другому. И мы с вами имели бы совершенно другой облик.
Чем вода тяжелее, тем быстрее она опускается на дно. Это позволяет организмам в океане жить именно в таких условиях, каких они живут. Если бы такого свойства воды не было, эволюция пошла бы по-другому. И мы с вами имели бы совершенно другой облик.
Далее, то, что в воде могут растворяться разнообразные вещества, очень большой плюс — иначе мы бы с вами не обладали кровеносной системой на основе воды. И, опять же, выглядели бы совершенно иначе. Если бы вообще возникли 🙂
Естественно, другая сторона медали — это то, что другие вещества в воде СОВЕРШЕННО не растворяются. И, возможно, это даже более основополагающее свойство, так как только благодаря нерастворению в воде жиров могут существовать клеточные мембраны — и жизнь.
Итак, то, что в воде хорошо / плохо растворяются разнообразные вещества, это очень основное свойство воды, потому что от него зависит жизнь в нынешней форме.
И если вода внезапно потеряет эти свойства, то будет очень и очень печально 🙂
Далее, мы все знаем, что когда вода замерзает, то она превращается в лёд. Но это не основополагающее свойство воды. По сути, что угодно жидкое при замерзании превращается в лёд. Намного важнее другое свойство воды: лёд оказывается ЛЕГЧЕ воды.
Но это не основополагающее свойство воды. По сути, что угодно жидкое при замерзании превращается в лёд. Намного важнее другое свойство воды: лёд оказывается ЛЕГЧЕ воды.
Благодаря этому основному свойству воды мы все живы — потому что иначе, если бы лёд был тяжелее воды, то он во время зимы опускался на дно рек и озёр, образовывался новый лёд, снова опускался на дно — и так далее, пока водоёмы не промёрзли бы до самого дна. Естественно, рыба и прочие живые существа в в таких условиях жить бы не смогли. Подробнее этот пункт освещается в уже опубликованной статье «Почему мы все живы?..»
Тогда как, вполне вероятно, вы помните, что у всех остальных веществ их твёрдая фаза тяжелее жидкой фазы.
Соответственно, хорошо, что лёд легче воды — и это также основное свойство воды, благодаря которому возможна жизнь в её нынешней форме.
Ну а если бы этого свойства воды не было, пришлось бы нам развиваться на основе, например, аммиака. То ещё удовольствие 🙂
Теперь остановим своё внимание на том, что вода может испаряться при кипении. Но это не основное свойство воды — так как практически любые вещества при кипении испаряются, и в этом нет ничего зазорного. Важно то, что вода испаряется и просто в жидком состоянии, и даже с поверхности льда. Почему это свойство более важно, чем испарение при кипении? А вот почему.
Но это не основное свойство воды — так как практически любые вещества при кипении испаряются, и в этом нет ничего зазорного. Важно то, что вода испаряется и просто в жидком состоянии, и даже с поверхности льда. Почему это свойство более важно, чем испарение при кипении? А вот почему.
То, что вода может испаряться не только при кипении — это основное свойство воды, поскольку из-за этого возможен круговорот воды в природе. Что однозначно хорошо, так как вода не накапливается в одном месте, а более менее равномерно расходится по всей планете. То есть, грубо говоря, в пустыне Сахара не так жарко и сухо, как могло бы быть, потому, что в Антарктиде вода испаряется с поверхности ледников. Ну и океаны в этом играют немаловажную роль.
Соответственно, без круговорота воды в природе жизнь бы сидела возле пары оазисов, а остальные места были бы засушливой пустыней, где нет ни капли влаги.
И поэтому свойство воды испаряться — это основное свойство воды.
Естественно, не только вода может испаряться не при кипении. Большинство ароматических соединений (спирты, эфиры, хлороформ и т.д.) испаряются не при кипении. Но у воды есть один немаловажный плюс, ещё одно основное свойство — вода не токсична для живых организмов. Тогда как спирты и эфиры токсичны. Кстати, подробнее про токсичность (и как с ней справиться) этилового спирта, то есть, водки, в статье «Положительные свойства структурированной водки«.
Большинство ароматических соединений (спирты, эфиры, хлороформ и т.д.) испаряются не при кипении. Но у воды есть один немаловажный плюс, ещё одно основное свойство — вода не токсична для живых организмов. Тогда как спирты и эфиры токсичны. Кстати, подробнее про токсичность (и как с ней справиться) этилового спирта, то есть, водки, в статье «Положительные свойства структурированной водки«.
Конечно, в современных условиях и вода может стать токсичной. Но с этим справляются фильтры для воды, и это не настолько большая проблема, чтобы с ней нельзя было справиться.
Итак, ещё одно основное свойство воды — это то, что она не токсична.
Иначе мы бы, опять же, были иными 🙂
И, наконец, основное свойство воды, которое важно не только для жизни, но и для промышленности: вода достаточно медленно нагревается и медленно остывает (то есть, может поглотить много тепла). Это свойство защищает людей и остальных животных, да и Землю, от перегрева. И переохлаждения. Именно поэтому живые организмы могут выживать при -50 градусах по Цельсию и при + 50 градусах. Если бы мы были устроены на основе другого вещества, такой диапазон температур нам был бы не по плечу.
И переохлаждения. Именно поэтому живые организмы могут выживать при -50 градусах по Цельсию и при + 50 градусах. Если бы мы были устроены на основе другого вещества, такой диапазон температур нам был бы не по плечу.
Кроме того, нужно учитывать, что тёплая и холодная вода имеют разный вес — тёплая вода легче, холодная вода тяжелее. Соответственно, в океане происходит расслоение воды — как по солёности, так и по температуре. И в океане возможна именно такая жизнь, как она сейчас организована. Ну а поскольку мы все вышли из океана, то если бы не это свойство воды, то мы бы также были совершенно другими.
Ну и, наконец, свойство воды поглощать тепло и находиться на поверхности в нагретом состоянии позволяет существовать таким штукам, как тёплые течения — и в частности, Гольфстриму. Который обогревает всю Европу, и без которого на месте Европы была бы тундра с тайгой, а не виноградники.
Возможно, вы назовёте какие-то другие основные свойства воды, но перечисленные выше, на мой взгляд, по-настоящему основополагающие, так как от них зависит существование жизни на планете именно в той форме, в которой существует жизнь. Надеюсь, эта информация вам пригодится, когда нужно будет отвечать на вопросы любопытных детей 🙂
Надеюсь, эта информация вам пригодится, когда нужно будет отвечать на вопросы любопытных детей 🙂
А вот и обещанная презентация на тему «Основные свойства воды » для скачивания: http://festival.1september.ru/articles/513123/
Итак, основные свойства воды — это свойства, благодаря которым мы все живы!
И имеем тот вид и форму, которые имеем 🙂
По материалам http://festival.1september.ru/articles/513123/
другие вещества в воде СОВЕРШЕННО не растворяютсяp
Ученые выяснили структуру воды и объяснили её аномальные свойства
https://ria.ru/20090812/180637381.html
Ученые выяснили структуру воды и объяснили её аномальные свойства
Ученые выяснили структуру воды и объяснили её аномальные свойства — РИА Новости, 12.08.2009
Ученые выяснили структуру воды и объяснили её аномальные свойства
Аномальные свойства воды, определяющие, в том числе, и наличие жизни на Земле — её переменная плотность, высокая теплоемкость и большое поверхностное натяжение, объясняются двумя типами структур, в которые самоорганизуются молекулы жидкости.
2009-08-12T15:22
2009-08-12T15:22
2009-08-12T15:22
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/17907/05/179070534_0:56:500:337_1920x0_80_0_0_7789f3f70b98577bb198b00663f5581f.jpg
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2009
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og. xn--p1ai/awards/
xn--p1ai/awards/
1920
1080
true
1920
1440
true
https://cdnn21.img.ria.ru/images/17907/05/179070534_0:0:500:375_1920x0_80_0_0_1c1ab57f349768665f6c771f10056762.jpg
1920
1920
true
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
экология
Экология, Наука
МОСКВА, 12 авг — РИА Новости. Аномальные свойства воды, определяющие, в том числе, и наличие жизни на Земле — её переменная плотность, высокая теплоемкость и большое поверхностное натяжение, объясняются двумя типами структур, в которые самоорганизуются молекулы жидкости, уверены авторы нового исследования, опубликованного в журнале Proceedings of the National Academy of Sciences.
Ученым давно были известны 66 необъяснимых свойств воды, отличающих её от большинства других химических веществ, встречающихся в жидком состоянии. Так, в отличие от всех известных жидкостей, плотность которых монотонно увеличивается с понижением температуры, плотность воды максимальна при 4 градусах Цельсия, а при дальнейшем понижении температуры вновь начинает убывать. Это уникальное свойство воды делает возможной жизнь в реках и озерах — в противном случае эти относительно мелкие водоемы неизбежно промерзали бы до дна в зимний период и были бы лишены всех живых организмов, за исключением, может быть, простейших бактерий экстремофилов.
Вода обладает огромной теплоемкостью — благодаря этому теплые океанические течения согревают многие северные регионы планеты, принося тепло из южных широт.
Аномально высокое поверхностное натяжение жидкой воды не только позволяет некоторым насекомым спокойно ходить по её поверхности, но и благодаря капиллярным силам обеспечивает поступление питательных веществ к кронам гигантских деревьев, достигающих нескольких десятков метров в высоту.
Объяснить эти свойства на основании лишь строения и химических параметров молекул воды ученые до последнего времени не могли. Секрет крылся в структуре, в которую самоорганизуются молекулы жидкой воды. Он долгое время оставался неразгаданным, так как изучить эту структуру теми же методами, что применяются для изучения строения твердых тел, практически невозможно.
Команда Андерса Нильсона (Anders Nilsson), ведущего специалиста Стенфордского центра синхротронного излучения (Stanford Synchrotron Radiation Lightsource), сумела преодолеть эти трудности благодаря новейшим методам изучения строения жидкостей с использованием мощного рентгеновского излучения, получаемого с помощью больших ускорителей элементарных частиц, называемых синхротронами. Один из использованных в работе синхротронов находится в Японии, а второй в США.
Ученые выяснили, что существовавшие до сих пор представления о молекулярной структуре воды были неверными — оказалось, что её молекулы формируют не одну структуру, а одновременно два типа структур, сосуществующих в жидкости вне зависимости от температуры. Один тип структуры формируется в виде сгустков примерно по 100 молекул, структура которых напоминает структуру льда. Второй тип структуры, окружающей сгустки, гораздо менее упорядочен.
Один тип структуры формируется в виде сгустков примерно по 100 молекул, структура которых напоминает структуру льда. Второй тип структуры, окружающей сгустки, гораздо менее упорядочен.
Увеличение температуры вплоть до точки кипения воды приводит к некоторому искажению структуры сгустков и уменьшению их количества и доминированию разупорядоченной структуры.
«Этот процесс можно представить как танцевальный клуб, где часть людей сидит за столиками, отражая упорядоченную компоненту воды, а часть находясь в толпе, непрерывно перемещается в танце, отражая разупорядоченную. Увеличение температуры воды в этом случае можно сравнить с всеобщим поднятием настроения и ускорением музыки, когда люди начинают вставать из-за столов и присоединяться к танцующим, а часть пустующих столов и вовсе убирается для высвобождения места. Охлаждение — обратный процесс, когда танцпол заполняется столами, и за них присаживаются утомленные танцами гости клуба. При этом при одной и той же «температуре» танцующие и сидящие люди постоянно меняются местами — некоторые присаживаются отдохнуть а некоторые наоборот идут танцевать, тогда как общее соотношение танцующих и сидящих остается прежним» — пояснил результаты работы Нильсон, слова которого приводит пресс-служба Стенфордского центра линейных ускорителей в США.
Это, в частности, объясняет нелинейную зависимость плотности воды от температуры — упорядоченные скопления молекул имеют меньшую плотность, чем неупорядоченные, и она мало меняется с изменением температуры, которую можно сравнить с постоянным размером столов, не зависящим от настроения собравшихся или громкости музыки в ресторане.
Свойства воды: объяснение, когезия и адгезия
Знаете ли вы, что вода — единственное вещество на Земле, которое в природе встречается во всех трех агрегатных состояниях? Несмотря на то, что вода не имеет запаха, вкуса и не имеет калорийности, она необходима для жизни, и мы не можем жить без нее. Он играет роль в фотосинтезе и дыхании, растворяет многие растворенные вещества в организме, обеспечивает сотни химических реакций и необходим для метаболизма и функции ферментов.
Однако это тоже необычная молекула. Несмотря на свой небольшой размер, он имеет странно высокие температуры плавления и кипения и образует прочные связи со многими другими молекулами, включая саму себя. В этой статье мы рассмотрим, почему это так, наряду с некоторыми из других свойства воды .
В этой статье мы рассмотрим, почему это так, наряду с некоторыми из других свойства воды .
- Эта статья представляет собой сфокусированный на химии обзор свойств воды .
- Начнем со структуры воды.
- Затем мы увидим, как это соотносится с его физическими свойствами, включая сцепление , адгезию и поверхностное натяжение .
- Мы также исследуем воду с высокой удельной теплоемкостью и температурами плавления и кипения .
- После этого мы рассмотрим почему лед менее плотный, чем вода и почему воду часто называют универсальным растворителем .
- Наконец, мы исследуем некоторые химические свойства воды: то, как она самоионизируется , и ее амфотерная природа .
Структура воды
Официальное название воды: дигидрогенмоноксид .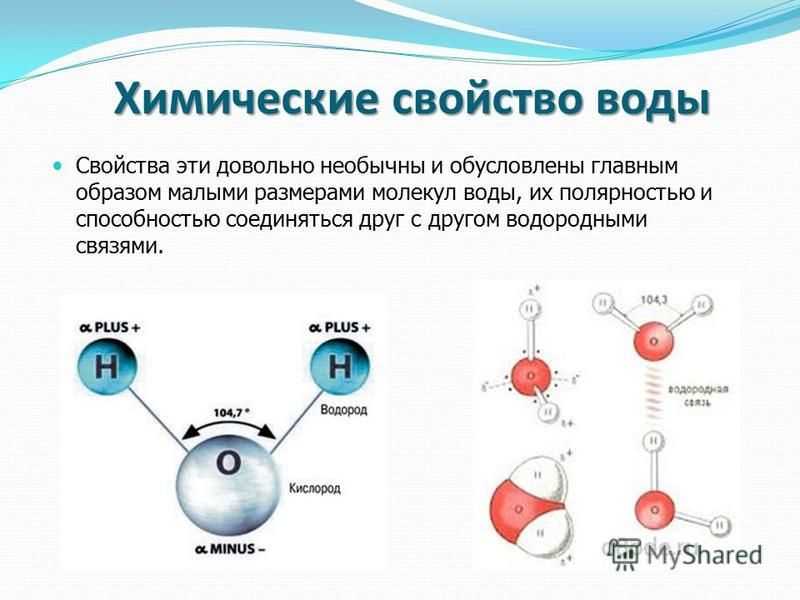 Более внимательное изучение этого имени дает нам представление о его структуре. -водород говорит нам, что он содержит атомы водорода, а ди- указывает на то, что их два. -оксид относится к атомам кислорода, а моно- говорит нам, что он имеет только один. Соедините все вместе, и у нас останется вода: H 2 O. Вот она, показанная ниже:
Более внимательное изучение этого имени дает нам представление о его структуре. -водород говорит нам, что он содержит атомы водорода, а ди- указывает на то, что их два. -оксид относится к атомам кислорода, а моно- говорит нам, что он имеет только один. Соедините все вместе, и у нас останется вода: H 2 O. Вот она, показанная ниже:
Рис. 1 – Молекула воды
Вода состоит из двух атомов водорода, соединенных с центральным атомом кислорода одинарные ковалентные связи . Атом кислорода имеет две неподеленных пар электронов . Они плотно сжимают две ковалентные связи, уменьшая валентный угол до 104,5° и превращая воду в молекулу v-образной формы .
Рис. 2. Валентный угол в воде
Для получения дополнительной информации о различных формах молекул и влиянии неподеленных пар электронов на валентные углы см. Формы молекул .
Связь в воде
Давайте теперь посмотрим, как структура воды влияет на ее связь.
Водородные связи относятся к типу межмолекулярная сила . Они возникают из-за разницы в электроотрицательности между водородом и чрезвычайно электроотрицательным атомом, таким как кислород.
Электроотрицательность — это способность атома притягивать связанную пару электронов. Это приводит к тому, что связывающие электроны находятся ближе к одному атому в ковалентной связи, чем к другому.
Если вы еще этого не сделали, рекомендуем прочитать Межмолекулярные силы . Он объяснит некоторые концепции, которые мы упоминаем здесь, более подробно.
Как мы знаем, вода содержит два атома водорода, связанные с центральным атомом кислорода ковалентными связями . Благодаря этому вы обнаружите водородных связей между соседними молекулами воды.
В случае воды кислород намного более электроотрицательный, чем водород. Это означает, что кислород притягивает связанную пару электронов, обнаруженную в каждой из связей кислород-водород, к себе и от водорода. Водород становится электрон-дефицитным , и мы говорим, что в целом молекула равна полярный .
Водород становится электрон-дефицитным , и мы говорим, что в целом молекула равна полярный .
Поскольку электроны имеют отрицательный заряд, кислород теперь заряжен слегка отрицательно, а водород — слегка положительно. Мы представляем эти частичные заряды дельта-символом , δ .
Рис. 3 – Полярность воды
Но как это приводит к образованию водородных связей? Ну, водород — это маленький атом. Фактически, это самый маленький атом во всей таблице Менделеева! Это означает, что его частичный положительный заряд плотно упакован в одно крошечное пространство. Мы говорим, что он имеет высокая плотность заряда . Поскольку он настолько положительно заряжен, его особенно притягивают отрицательно заряженные частицы, такие как другие электроны.
Что мы знаем об атоме кислорода в воде? Он содержит две неподеленные пары электронов! Это означает, что атомы водорода в молекулах воды притягиваются к неподеленным парам электронов в атомах кислорода в других молекулах воды.
Притяжение между плотно заряженным атомом водорода и неподеленной парой электронов кислорода известно как водородная связь .
Рис. 4 – Водородная связь между молекулами воды
Подводя итог, мы обнаруживаем водородную связь, когда имеем атомов водорода, ковалентно связанных с крайне электроотрицательным атомом с неподеленной парой электронов . Атом водорода становится электронодефицитным и притягивается к неподеленной паре электронов другого атома. Это водородная связь .
Только некоторые элементы обладают достаточной электроотрицательностью для образования водородных связей. Этими элементами являются кислород, азот и фтор. Хлор также теоретически достаточно электроотрицателен, но не образует водородных связей. Это потому, что это более крупный атом, и отрицательный заряд его неподеленных пар электронов распределен по большей площади. Плотность заряда недостаточно велика, чтобы должным образом притянуть частично заряженный атом водорода, поэтому он не образует водородных связей. Однако хлор испытывает постоянные диполь-дипольные силы.
Однако хлор испытывает постоянные диполь-дипольные силы.
Еще одно напоминание — мы более подробно рассмотрим эту тему в Межмолекулярные силы .
Физические свойства воды
Теперь, когда мы рассмотрели структуру и связь воды, мы можем исследовать, как это влияет на ее физические свойства. В следующем разделе мы рассмотрим следующие свойства:
- Когезия
- Адгезия
- Поверхностное натяжение
- Удельная теплоемкость
- Температура плавления и кипения
- Плотность
- Способность растворять
Когезионные свойства воды
Когезия — это способность частиц вещества прилипать друг к другу.
Если вы плеснете небольшое количество воды на поверхность, вы заметите, что она образует капли. Это пример сплоченности . Вместо того, чтобы распространяться равномерно, молекулы воды прилипают друг к другу в виде кластеров. Это связано с водородными связями между соседними молекулами воды.
Адгезионные свойства воды
Адгезия — это способность частиц одного вещества прилипать к другому веществу.
Когда вы наливаете воду в пробирку, вы заметите, что вода поднимается по краям сосуда. Он образует так называемый мениск . Когда вы измеряете объем воды, вы должны измерять от нижней части мениска, чтобы ваши измерения были полностью точными. это пример адгезия . Это происходит, когда вода образует водородные связи с другим веществом, например со стенками пробирки в данном случае.
Рис. 5 — Мениск
Не путайте когезию и адгезию. Когезия — это способность вещества прилипать к самому себе, тогда как адгезия — это способность вещества прилипать к другому веществу.
Поверхностное натяжение воды
Вы когда-нибудь задумывались, как насекомые могут ходить по поверхности луж и озер? Это из-за поверхностное натяжение .
Поверхностное натяжение описывает то, как молекулы на поверхности жидкости действуют как эластичный лист и пытаются занять наименьшую возможную площадь поверхности.
Это место, где частицы на поверхности жидкости сильно притягиваются к другим частицам в жидкости. Эти внешние частицы втягиваются в объем жидкости, заставляя жидкость принимать форму с наименьшей возможной площадью поверхности. Благодаря этому притяжению поверхность жидкости способна противостоять внешним силам, например весу насекомого. Вода имеет особенно высокое поверхностное натяжение из-за водородных связей между его молекулами. Это еще один пример связной природы воды.
Удельная теплоемкость воды
Удельная теплоемкость – это энергия, необходимая для повышения температуры одного грамма вещества на один градус Кельвина или один градус Цельсия.
Помните, что изменение на один градус Кельвина равносильно изменению на один градус Цельсия.
Изменение температуры вещества связано с разрывом некоторых связей внутри него. Водородные связи между молекулами воды очень прочны, поэтому для их разрыва требуется много энергии. Это означает, что вода имеет высокая удельная теплоемкость .
Это означает, что вода имеет высокая удельная теплоемкость .
Высокая удельная теплоемкость воды означает, что она дает много преимуществ живым организмам, поскольку вода устойчива к экстремальным колебаниям температуры. Это помогает им поддерживать постоянную внутреннюю температуру, оптимизируя активность ферментов.
Температура плавления и кипения воды
Вода имеет высокие температуры плавления и кипения из-за сильных водородных связей между ее молекулами, для преодоления которых требуется много энергии. Это становится очевидным, когда вы сравниваете воду с молекулами аналогичного размера, которые не имеют водородных связей. Например, метан (СН 4 ) имеет молекулярную массу 16 и температуру кипения -161,5 ℃, в то время как вода имеет аналогичную молекулярную массу 18, но гораздо более высокую температуру кипения ровно 100,0 ℃!
Плотность воды
Возможно, вы знаете, что большинство твердых тел более плотные, чем жидкости. А вот с водой немного необычно — все наоборот. Твердый лед намного менее плотный, чем жидкая вода , поэтому айсберги плавают на поверхности моря, а не тонут на дне океана. Чтобы понять почему, нам нужно более внимательно изучить структуру воды в двух состояниях.
А вот с водой немного необычно — все наоборот. Твердый лед намного менее плотный, чем жидкая вода , поэтому айсберги плавают на поверхности моря, а не тонут на дне океана. Чтобы понять почему, нам нужно более внимательно изучить структуру воды в двух состояниях.
Жидкая вода
В жидкости молекулы воды постоянно движутся . Это означает, что водородные связи между молекулами постоянно разрываются и снова восстанавливаются. Некоторые молекулы воды расположены очень близко друг к другу, а другие далеко друг от друга.
Твердый лед
В твердом состоянии молекулы воды зафиксированы в положении . Каждая молекула воды связана с четырьмя соседними молекулами воды водородными связями, удерживая ее в решетчатой структуре. Четыре водородные связи означают, что молекулы воды удерживаются на фиксированном расстоянии друг от друга. На самом деле, в этом твердом состоянии они находятся дальше друг от друга, чем в жидкой форме. Это делает твердый лед менее плотным, чем жидкая вода.
Это делает твердый лед менее плотным, чем жидкая вода.
Рис. 6. Ледяная решетка
Вода как растворитель
Последнее физическое свойство, которое мы сегодня рассмотрим, — это способность воды как растворителя .
Растворитель — это вещество, которое растворяет второе вещество, называемое растворенным веществом , с образованием раствора .
Воду часто называют универсальным растворителем . Это потому, что он может растворять широкий спектр различных веществ. На самом деле почти все полярные вещества растворяются в воде . Это потому, что молекулы воды также полярны. Вещества растворяются, когда притяжение между ними и растворителем сильнее, чем притяжение между молекулой растворителя и молекулой растворителя, молекулой растворенного вещества и молекулой растворенного вещества.
В случае воды отрицательный атом кислорода притягивается к любым положительно заряженным молекулам растворенного вещества, а положительные атомы водорода притягиваются к любым отрицательно заряженным молекулам растворенного вещества. Это притяжение сильнее, чем силы, удерживающие растворенное вещество вместе, поэтому растворенное вещество растворяется.
Это притяжение сильнее, чем силы, удерживающие растворенное вещество вместе, поэтому растворенное вещество растворяется.
Химические свойства воды
Все идеи, которые мы исследовали выше, были примерами физических свойств . Это свойства, которые можно наблюдать и измерять без изменения химического состава вещества. Например, молекулы воды в паре имеют точно такую же химическую идентичность, что и молекулы воды во льду, с той лишь разницей, что они состоят из вещества. Однако химических свойств — это свойства, которые мы наблюдаем, когда вещество подвергается химической реакции. В частности, мы собираемся сосредоточиться на двух химических свойствах воды.
- Способность к самоионизации
- Амфотерность
Самоионизация воды
Как жидкость вода существует в равновесии . Большинство его молекул находятся в виде нейтральных молекул H 2 O, но некоторые ионизируются в ионы гидроксония, H 3 O + , и ионы гидроксида, OH — . Молекулы постоянно переключаются между этими двумя состояниями вперед и назад, как показано в приведенном ниже уравнении:
Молекулы постоянно переключаются между этими двумя состояниями вперед и назад, как показано в приведенном ниже уравнении:
2H 2 O ⇋ H 3 O + + OH —
Это известно как самоионизация . Вода делает это сама по себе — ей не нужно другое вещество для реакции.
Амфотерная природа воды
Поскольку вода самоионизируется, как мы видели выше, она может действовать амфотерно .
Амфотерное вещество может действовать как кислота и как основание.
Помните, что кислота является донором протонов, тогда как основание является акцептором протонов. Протон — это просто ион водорода, H + .
Как это делает вода? Что ж, посмотрите на ионы, которые он образует при самоионизации: H 3 O + и OH — . Ион гидроксония, H 3 O + , может действовать как кислота, теряя протон с образованием H 2 O и H + . Ион гидроксида, OH — , может действовать как основание, принимая протон, снова образуя H 2 O.
Ион гидроксида, OH — , может действовать как основание, принимая протон, снова образуя H 2 O.
H 3 o + → H 2 O + H +
OH — + H + → H 2 O
IT AS AS AS AS AS AS AS AS AS AS AS AS AS AS AS AS AS AS AS AS AS AS AS AS AS AS AS 2 O. кислоты, отдавая протон. Если он реагирует с другими кислотами, он действует как основание, принимая протон. Можно сказать, что вода не привередлива — она просто хочет со всеми реагировать!
Свойства воды. Ключевые выводы
- Вода , H 2 O, состоит из одного атома кислорода, связанного с двумя атомами водорода с помощью ковалентных связей .
- Вода испытывает водородных связей между молекулами. Это влияет на его свойства.
- Вода когезивная , клейкая и имеет высокое поверхностное натяжение .

- Вода имеет высокую удельную теплоемкость и высокие температуры плавления и кипения .
- Твердый лед на менее плотный, чем жидкая вода .
- Воду часто называют универсальным растворителем .
- Вода самоионизируется в ионы гидроксония , H 3 O + , и ионы гидроксида 6 8 0 9 0 9 0 0 0 0 0 0 6 , OH
- Вода является амфотерным веществом.
Свойства воды
Свойства воды
Это вода
— Дэвид Фостер Уоллес, 2005 г.
Вода является одним из наиболее распространенных веществ, с которыми мы взаимодействуем, поэтому мы склонны не думать о ней и о том, насколько она особенная. Вода — важная молекула с некоторыми необычными свойствами. Без жидкой воды не было бы жизни, какой мы ее знаем. Жизнь возможна на Земле, потому что она существует в так называемой Зоне Златовласки, где не слишком жарко и не слишком холодно, но как раз то, что нужно для существования жидкой воды. В нашей Солнечной системе единственными другими местами, где жидкая вода может существовать в больших объемах, являются подо льдом спутников Юпитера и Сатурна, где гидротермальные жерла могут позволить происходить хемосинтезу.
Жизнь возможна на Земле, потому что она существует в так называемой Зоне Златовласки, где не слишком жарко и не слишком холодно, но как раз то, что нужно для существования жидкой воды. В нашей Солнечной системе единственными другими местами, где жидкая вода может существовать в больших объемах, являются подо льдом спутников Юпитера и Сатурна, где гидротермальные жерла могут позволить происходить хемосинтезу.
Планета Океан : Приблизительно 71% поверхности Земли покрыто водой, и большую ее часть составляет океан (соленая вода). Взрослые люди тоже примерно на 65% состоят из воды! Происхождение воды на Земле до конца не изучено, но большая часть воды, вероятно, поступила из внеземных источников. Ледяные шапки существуют на обоих полюсах, потому что они получают меньше солнечной радиации, чем экваториальные области, и ледяные шапки оказывают значительное влияние как на климат, так и на уровень моря. Появляется все больше свидетельств того, что ледяные шапки сокращаются в результате глобального изменения климата, вызванного деятельностью человека. Долгожданный Северо-Западный проход впервые в истории стал судоходным по крайней мере часть года.
Долгожданный Северо-Западный проход впервые в истории стал судоходным по крайней мере часть года.
Приливы : Гравитационное взаимодействие между водой Земли и Луной приводит к ежедневным приливам и отливам. Экстремальные приливы были намного сильнее в ранней истории Земли, когда Луна была вдвое меньше, чем сейчас, и есть предположение, что приливы могли инициировать или, по крайней мере, ускорить эволюцию жизни на Земле.
Молекулы воды притягиваются друг к другу из-за полярности.
Полярность : Хотя суммарный заряд молекулы воды равен нулю, вода полярна из-за своей формы. Водородные концы молекулы положительны, а кислородные — отрицательны. Это заставляет молекулы воды притягивать друг друга и другие полярные молекулы. Это притяжение между молекулами воды можно увидеть на гладкой поверхности, например, на стекле, где вода собирается в пузыри. Сцепление молекул воды друг с другом является важной частью процесса транспирации в тканях ксилемы сосудистых растений.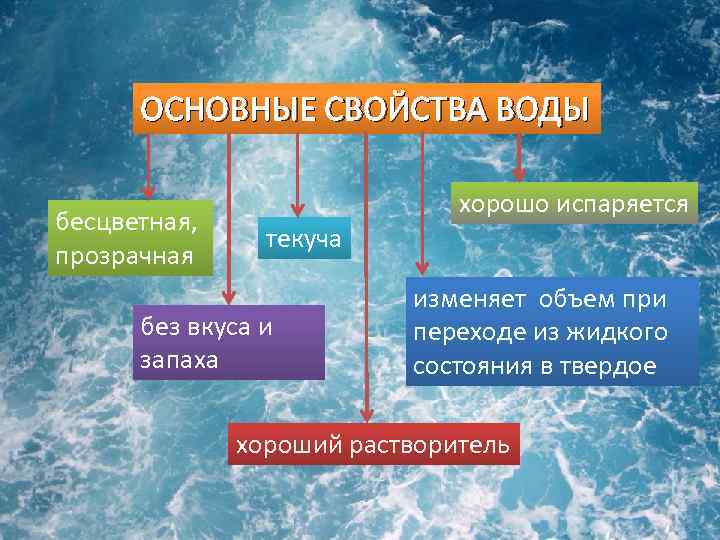 Вода также имеет высокое поверхностное натяжение из-за этой связи, и это причина, по которой водомерки могут кататься на коньках по воде.
Вода также имеет высокое поверхностное натяжение из-за этой связи, и это причина, по которой водомерки могут кататься на коньках по воде.
Растворитель : Воду иногда называют универсальным растворителем, потому что она может растворять широкий спектр химических веществ. Кислотно-основная химия зависит от воды. Кристаллические соли диссоциируют в воде с образованием положительных и отрицательных ионов.
Метрическая температура : Поскольку вода так важна для жизни, метрическая шкала температур была разработана с 0 градусами как точкой замерзания воды и 100 градусами как точкой кипения воды (на уровне моря).
Плотность : Необычной характеристикой воды является то, что, в отличие от большинства твердых тел, лед менее плотен, чем жидкая вода. По этой причине кубики льда плавают в стакане с водой, а не опускаются на дно стакана. Когда температура падает, вода в озере и океане замерзает сверху вниз, а слой льда плавает сверху, изолируя воду под ним от дальнейшего охлаждения. Если бы лед был более плотным, чем жидкая вода, озера замерзали бы снизу вверх, что было бы гораздо менее благоприятным для живых существ. Соленая вода более плотная, чем пресная, поэтому, если ее не сильно перемешивать, пресная вода может образовать линзу поверх соленой воды. Это обычное явление там, где реки впадают в океан или где пресная вода просачивается из родников на дне океана. Эти различия в плотности заставляют свет рассеиваться под разными углами, уменьшая видимость.
Если бы лед был более плотным, чем жидкая вода, озера замерзали бы снизу вверх, что было бы гораздо менее благоприятным для живых существ. Соленая вода более плотная, чем пресная, поэтому, если ее не сильно перемешивать, пресная вода может образовать линзу поверх соленой воды. Это обычное явление там, где реки впадают в океан или где пресная вода просачивается из родников на дне океана. Эти различия в плотности заставляют свет рассеиваться под разными углами, уменьшая видимость.
Удельная теплоемкость : Вода обладает очень высокой теплоемкостью. Это значит, что он долго сохраняет тепло относительно воздуха. Одним из важных результатов этого является то, что большие водоемы имеют умеренную температуру. Прибрежные районы имеют менее экстремальные летние и зимние температуры, чем внутренние массивы суши. Поскольку массивы суши теряют тепло быстрее, чем вода, земля имеет тенденцию быть теплее днем и холоднее ночью, чем океан, в результате чего утром дует бриз с берега, а вечером — с берега. Нагревание и охлаждение воды также может формировать конвекционные течения в океанах.
Нагревание и охлаждение воды также может формировать конвекционные течения в океанах.
Испарительное охлаждение : Когда вода испаряется с поверхности объекта, более быстро движущиеся молекулы с большей кинетической энергией улетучиваются в виде газа, а молекулы с более низкой энергией и меньшей кинетической энергией остаются в виде жидкости. Это снижает температуру поверхности, с которой испаряется жидкость. Потоотделение – это форма охлаждения за счет испарения. Испарительное охлаждение лучше всего работает при низкой влажности, поэтому болотные охладители получают высокие оценки в Аризоне, но не во Флориде.
Отражательная способность : Снег отражает так много света, что длительное воздействие может вызвать снежную слепоту и солнечные ожоги. Снег имеет альбедо от 0,8 до 0,9. Поскольку большая часть света отражается покрытой снегом поверхностью, поглощается мало тепла и таяние замедляется. Этот процесс, который может продлевать зимы и, возможно, даже способствовать ледниковым периодам, противоположен парниковому эффекту и является причиной, по которой салон вашего автомобиля должен быть белым, если вы живете в Финиксе.