Откуда на замёрзших планетах жидкая вода? Вода жидкая
Жидкая вода Википедия
| Вода | |
 | |
 | |
 | |
| Оксид водорода Вода[1] | |
| вода | |
| h3O | |
| жидкость | |
| 18,01528 г/моль | |
| 0,9982 г/см³ | |
| 1,5[3] | |
| 0,00101 Па·с | |
| 0,01012 см²/с (при 20 °C) | |
| (дистиллированная вода) 1348 м/с | |
| 273,1 K (0 ° C) | |
| 373,1 K (99,974 ° C) °C | |
| 273,2 K (0,01 ° C), 611,72 Па | |
| 647,1 K (374 ° C), 22,064 МПа | |
| 75,37 Дж/(моль·К) | |
| 0,56 Вт/(м·K) | |
| 2256,2 кДж/кг[2] | |
| 332,4 кДж/кг[2] | |
| 1,3945, 1,33432, 1,32612, 1,39336, 1,33298 и 1,32524 | |
| 7732-18-5 | |
| 962 | |
| 231-791-2 | |
| ZC0110000 | |
| 15377 | |
| 937 | |
 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
 71 % поверхности Земли покрывает вода
71 % поверхности Земли покрывает вода Вода́ (оксид водорода) — бинарное неорганическое соединение с химической формулой Н2O. Молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью. При нормальных условиях представляет собой прозрачную жидкость, не имеющую цвета (при малой толщине слоя), запаха и вкуса. В твёрдом состоянии называется льдом (кристаллы льда могут образовывать снег или иней), а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов (на гидрофильных поверхностях)[4][5].
Около 71 % поверхности Земли покрыто водой (океаны, моря, озёра, реки, льды) — 361,13 млн км2[6][7]. На Земле примерно 96,5 % воды приходится на океаны, 1,7 % мировых запасов составляют грунтовые воды, ещё 1,7 % — ледники и ледяные шапки Антарктиды и Гренландии, небольшая часть находится в реках, озёрах и болотах, и 0,001 % в облаках (образуются из взвешенных в воздухе частиц льда и жидкой воды)[8][9]. Бо́льшая часть земной воды — солёная, непригодная для сельского хозяйства и питья. Доля пресной составляет около 2,5 %, причём 98,8 % этой воды находится в ледниках и грунтовых водах. Менее 0,3 % всей пресной воды содержится в реках, озёрах и атмосфере, и ещё меньшее количество (0,003 %) находится в живых организмах[8].
Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Исключительно важна роль воды в глобальном кругообороте вещества и энергии[10], возникновении и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Вода является важнейшим веществом для всех живых существ на Земле[11].
Химические названия
С формальной точки зрения вода имеет несколько различных корректных химических названий:
- Оксид водорода: бинарное соединение водорода с атомом кислорода в степени окисления −2, встречается также устаревшее название окись водорода.
- Гидроксид водорода: соединение гидроксильной группы OH- и катиона (H+)
- Гидроксильная кислота: воду можно рассматривать как соединение катиона H+, который может быть замещён металлом, и «гидроксильного остатка» OH-
- Монооксид дигидрогена
- Дигидромонооксид
Образование воды
Известно, что 2 объема водорода взаимодействуют с 1 объемом кислорода с образованием воды. При реакции выделяется большое количество тепла, как и при горении свечи. Продукт реакции — вода не похожа на исходные вещества — водород и кислород. Следовательно, превращение, происходящее при взаимодействии водорода и кислорода, должно быть отнесено к химическим реакциям.
В соответствии с атомно-молекулярной теорией мы начинаем рассуждение, предполагая, что в реакции участвуют молекулы Н2 и О2. В результате реакции образуются молекулы воды. Связи между атомами в реагирующих веществах разрываются и атомы перегруппировываются. При этом возникают новые связи в молекулах продукта реакции. Эти превращения легко представить с помощью молекулярных моделей. Молекулярную модель можно представить как две молекулы Н2 (четыре атома) и одна молекула О2 (два атома). Если эти молекулы будут реагировать с образованием воды, то связи между атомами в молекулах водорода и кислорода должны разорваться. Затем «завязываются» новые связи и образуются две молекулы воды. Отметим, что в результате реакции происходит перегруппировка атомов, но общее число атомов при этом не изменяется.
Пример образования молекул воды
Один миллион молекул кислорода реагирует с достаточно большим количеством молекул водорода с образованием воды. Сколько молекул воды образуется? Сколько молекул водорода требуется для этой реакции?
Для получения 100 молекул воды расходуется 100 молекул водорода и 50 молекул кислорода. Таким образом, для получения 1 моля воды (6,02 · 1023 молекул) нам потребуется 1 моль водорода (6,02 · 1023 молекул) и 0,5 моля кислорода (3,01 · 1023 молекул). Результаты приведены в таблице:
| Водород | Кислород | Вода | |
| Число молекул | 2 | 1 | 2 |
| 4 | 2 | 4 | |
| 100 | 50 | 100 | |
| 6,02 · 1023 | 3,01 · 1023 | 6,02 · 1023 | |
| Число молей | 1 | 0,5 | 1 |
| 2 | 1 | 2 | |
| 10 | 5 | 10 |
Реакция между водородом и кислородом протекает намного быстрее, если эти газы смешать и затем поджечь смесь искрой. Происходит сильный взрыв. Тем не менее, на 1 моль реагирующего водорода образуется такое же количество продукта реакции — воды — и выделяется столько же тепла, как и при обычном горении.
Если реагируют 1 моль чистого водорода и 0,5 моля чистого кислорода, образуется 1 моль воды. Количество тепла, выделяющееся при образовании 1 моля воды, равно 68000 кал. Если же мы возьмем только 0,025 моля чистого водорода, то потребуется 0,5 · 0,025 моля кислорода. При этом образуется 0,025 моля воды. Если получено только 0,025 моля воды, то выделяется лишь 0,025 · 68 000 = 1700 кал тепла.
Источником этой тепловой энергии должны быть сами реагирующие вещества (водород и кислород), так как к системе извне подводится только тепло, необходимое для поджигания смеси. Отсюда можно сделать вывод, что вода содержит меньше энергии, чем реагирующие вещества, используемые для ее получения. Реакция, при которой выделяется тепло, называется экзотермической. Количество тепла, выделяющееся при сгорании 1 моля водорода (68 000 кал, или 68 ккал), называется молярной теплотой сгорания водорода.
Свойства
Физические свойства
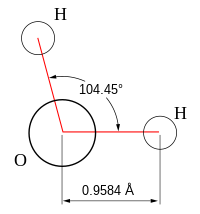
Вода при нормальных условиях находится в жидком состоянии, тогда как аналогичные водородные соединения других элементов являются газами (h3S, Ch5, HF). Атомы водорода присоединены к атому кислорода, образуя угол 104,45° (104°27′). Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По этой причине молекула воды обладает большим дипольным моментом (p = 1,84 Д, уступает только синильной кислоте). Каждая молекула воды образует до четырёх водородных связей — две из них образует атом кислорода и две — атомы водорода[12]. Количество водородных связей и их разветвлённая структура определяют высокую температуру кипения воды и её удельную теплоту парообразования[12]. Если бы не было водородных связей, вода, на основании места кислорода в таблице Менделеева и температур кипения гидридов аналогичных кислороду элементов (серы, селена, теллура), кипела бы при −80 °С, а замерзала при −100 °С[13].
При переходе в твёрдое состояние молекулы воды упорядочиваются, при этом объёмы пустот между молекулами увеличиваются, и общая плотность воды падает, что и объясняет меньшую плотность (больший объём) воды в фазе льда. При испарении, напротив, все водородные связи рвутся. Разрыв связей требует много энергии, отчего у воды самая большая удельная теплоёмкость среди прочих жидкостей и твёрдых веществ. Для того чтобы нагреть один литр воды на один градус, требуется затратить 4,1868 кДж энергии. Благодаря этому свойству вода нередко используется как теплоноситель. Помимо большой удельной теплоёмкости, вода также имеет большие значения удельной теплоты плавления (333,55 кДж/кг при 0 °C) и парообразования (2250 кДж/кг).
| -60 (лёд) | 1,64 |
| -20 (лёд) | 2,01 |
| -10 (лёд) | 2,22 |
| 0 (лёд) | 2,11 |
| 0 (чистая вода) | 4,218 |
| 10 | 4,192 |
| 20 | 4,182 |
| 40 | 4,178 |
| 60 | 4,184 |
| 80 | 4,196 |
| 100 | 4,216 |
Физические свойства разных изотопных модификаций воды при различных температурах[14]:
| Н2O | 3,9834 | 0,01 |
| D2O | 11,2 | 3,82 |
| T2O | 13,4 | 4,49 |
| Н218O | 4,3 | 0,31 |
Вода обладает также высоким поверхностным натяжением, уступая в этом только ртути[15][16][17]. Относительно высокая вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
Вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде[18]. Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Вода обладает отрицательным электрическим потенциалом поверхности.
 Капля, ударяющаяся о поверхность воды
Капля, ударяющаяся о поверхность воды Чистая вода — хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация протонов (точнее, ионов гидроксония h4O+) и гидроксильных ионов OH− составляет 10-7 моль/л. Но поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные соли, то есть присутствуют другие положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60 % парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи.
Агрегатные состояния
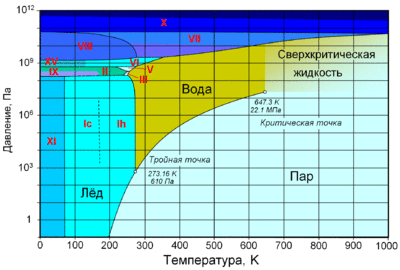
По состоянию различают:

При нормальном атмосферном давлении (760 мм рт. ст., 101 325 Па) вода переходит в твёрдое состояние при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C (значения 0 °C и 100 °C были выбраны как соответствующие температурам таяния льда и кипения воды при создании температурной шкалы «по Цельсию»). При снижении давления температура таяния (плавления) льда медленно растёт, а температура кипения воды — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такие давление и температура называются тройной точкой воды. При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки (сублимации) льда падает со снижением давления. При высоком давлении существуют модификации льда с температурами плавления выше комнатной.
С ростом давления температура кипения воды растёт[19]:
| 0,987 (105 Па — нормальные условия) | 99.63 |
| 1 | 100 |
| 2 | 120 |
| 6 | 158 |
| 218,5 | 374,1 |
При росте давления плотность насыщенного водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении и/или температуре исчезает разница между жидкой водой и водяным паром. Такое агрегатное состояние называют «сверхкритическая жидкость».
Вода может находиться в метастабильных состояниях — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, можно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Оптические свойства
Они оцениваются по прозрачности воды, которая, в свою очередь, зависит от длины волны излучения, проходящего через воду. Вследствие поглощения оранжевых и красных компонентов света вода приобретает голубоватую окраску. Вода прозрачна только для видимого света и сильно поглощает инфракрасное излучение, поэтому на инфракрасных фотографиях водная поверхность всегда получается чёрной. Ультрафиолетовые лучи легко проходят через воду, поэтому растительные организмы способны развиваться в толще воды и на дне водоёмов, инфракрасные лучи проникают только в поверхностный слой. Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света.
Изотопные модификации
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов водорода, входящих в молекулу, выделяют следующие виды воды:
Последние три вида возможны, так как молекула воды содержит два атома водорода. Протий — самый лёгкий изотоп водорода, дейтерий имеет атомную массу 2,0141017778 а. е. м., тритий — самый тяжёлый, атомная масса 3,0160492777 а. е. м. В воде из-под крана тяжелокислородной воды (h3O17 и h3O18) содержится больше, чем воды D2O16: их содержание, соответственно, 1,8 кг и 0,15 кг на тонну[13].
Хотя тяжёлая вода часто считается мёртвой водой, так как живые организмы в ней жить не могут, некоторые микроорганизмы могут быть приучены к существованию в ней[13].
По стабильным изотопам кислорода 16O, 17O и 18O существуют три разновидности молекул воды. Таким образом, по изотопному составу существуют 18 различных молекул воды. В действительности любая вода содержит все разновидности молекул.
Химические свойства
Вода является наиболее распространённым растворителем на планете Земля, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ.
Её иногда рассматривают, как амфолит — и кислоту и основание одновременно (катион H+анион OH−). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa ≈ 16.
Вода — химически активное вещество. Сильно полярные молекулы воды сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.Воду можно получать:
- в ходе реакций —
- Восстановлением водородом оксидов металлов —
Под воздействием очень высоких температур или электрического тока (при электролизе)[20], а также под воздействием ионизирующего излучения, как установил в 1902 году[21]Фридрих Гизель[en] при исследовании водного раствора бромида радия[22], вода разлагается на молекулярный кислород и молекулярный водород:
2h3O→2h3↑+O2↑{\displaystyle {\mathsf {2H_{2}O\rightarrow 2H_{2}\uparrow +O_{2}\uparrow }}}Вода реагирует при комнатной температуре:
2h3O+2Na→2NaOH+h3↑{\displaystyle {\mathsf {2H_{2}O+2Na\rightarrow 2NaOH+H_{2}\uparrow }}}- со фтором и межгалоидными соединениями
- с солями, образованными слабой кислотой и слабым основанием, вызывая их полный гидролиз
- с ангидридами и галогенангидридами карбоновых и неорганических кислот
- с активными металлорганическими соединениями (диэтилцинк, реактивы Гриньяра, метилнатрий и т. д.)
- с карбидами, нитридами, фосфидами, силицидами, гидридами активных металлов (кальция, натрия, лития и др.)
- со многими солями, образуя гидраты
- с боранами, силанами
- с кетенами, недоокисью углерода
- с фторидами благородных газов
Вода реагирует при нагревании:
4h3O+3Fe→Fe3O4+4h3{\displaystyle {\mathsf {4H_{2}O+3Fe\rightarrow Fe_{3}O_{4}+4H_{2}}}}h3O+C⇄ CO+h3{\displaystyle {\mathsf {H_{2}O+C\rightleftarrows \ CO+H_{2}}}}- с некоторыми алкилгалогенидами
Вода реагирует в присутствии катализатора:
- с амидами, эфирами карбоновых кислот;
- с ацетиленом и другими алкинами;
- с алкенами;
- с нитрилами.
Волновая функция основного состояния воды
В валентном приближении электронная конфигурация молекулы h3O{\displaystyle {\ce {h3O}}} в основном состоянии: (1a1)1(1b2)2(1b1)2(2b2)0(3a1)0.{\displaystyle (1a_{1})^{1}(1b_{2})^{2}(1b_{1})^{2}(2b_{2})^{0}(3a_{1})^{0}.} Молекула имеет замкнутую оболочку, неспаренных электронов нет. Заняты электронами четыре молекулярные орбитали (МО) — по два электрона на каждой МО ϕi{\displaystyle \phi _{i}}, один со спином α{\displaystyle \alpha }, другой со спином β{\displaystyle \beta }, или 8 спин-орбиталей ψ{\displaystyle \psi }. Волновая функция молекулы, Ψ{\displaystyle \Psi }, представленная единственным детерминантом Слэтера Ф, имеет вид
|ϕ1a1(1)α(1)ϕ1a1(1)β(1)ϕ1b2(1)α(1)...ϕ1b1(1)β(1)ϕ1a1(2)α(2)ϕ1a1(2)β(2)ϕ1b2(2)α(2)...ϕ1b1(2)β(2)ϕ1a1(3)α(3)ϕ1a1(3)β(3)ϕ1b2(3)α(3)...ϕ1b1(3)β(3)...............ϕ1a1(8)α(8)ϕ1a1(8)β(8)ϕb2(8)α(8)...ϕ1b1(8)β(8)|{\displaystyle {\begin{vmatrix}\phi _{1a_{1}}(1)\alpha (1)&\phi _{1a_{1}}(1)\beta (1)&\phi _{1b_{2}}(1)\alpha (1)&...&\phi _{1b_{1}}(1)\beta (1)\\\phi _{1a_{1}}(2)\alpha (2)&\phi _{1a_{1}}(2)\beta (2)&\phi _{1b_{2}}(2)\alpha (2)&...&\phi _{1b_{1}}(2)\beta (2)\\\phi _{1a_{1}}(3)\alpha (3)&\phi _{1a_{1}}(3)\beta (3)&\phi _{1b_{2}}(3)\alpha (3)&...&\phi _{1b_{1}}(3)\beta (3)\\...&...&...&...&...\\\phi _{1a_{1}}(8)\alpha (8)&\phi _{1a_{1}}(8)\beta (8)&\phi _{b_{2}}(8)\alpha (8)&...&\phi _{1b_{1}}(8)\beta (8)\end{vmatrix}}}
Симметрия этой волновой функции определяется прямым произведением НП, по которым преобразуются все занятые спин-орбитали
(a1)⊗(a1)⊗(b2)⊗(b2)⊗(a1)⊗(a1)⊗(b1)⊗(b1).{\displaystyle (a_{1})\otimes (a_{1})\otimes (b_{2})\otimes (b_{2})\otimes (a_{1})\otimes (a_{1})\otimes (b_{1})\otimes (b_{1}).}
Принимая во внимание, что:
- прямое произведение невырожденного НП самого на себя является полносимметричным НП.
- прямое произведение любого невырожденного представления Г на полносимметричное есть Г, получаем:
a1⊗a1⊗⏟A1b2⊗b2⏟A1⊗a1⊗a1⏟A1⊗b1⊗b1⏟A1⏟A1{\displaystyle \underbrace {\underbrace {a_{1}\otimes a_{1}\otimes } _{A_{1}}\underbrace {b_{2}\otimes b_{2}} _{A_{1}}\otimes \underbrace {a_{1}\otimes a_{1}} _{A_{1}}\otimes \underbrace {b_{1}\otimes b_{1}} _{A_{1}}} _{A_{1}}}
Виды
Вода на Земле может существовать в трёх основных состояниях:
- жидком,
- газообразном
- твёрдом.
Вода может приобретать различные формы, которые могут одновременно соседствовать и взаимодействовать друг с другом:
Вода способна растворять в себе множество органических и неорганических веществ. Из-за важности воды, «как источника жизни», её нередко подразделяют на типы по различным принципам.
Виды воды по особенностям происхождения, состава или применения:
по содержанию катионов кальция и магнияпо изотопам водорода в молекуледругие виды- Пресная вода,
- Дождевая вода,
- Морская вода,
- Подземные воды,
- Минеральная вода,
- Солоноватая вода,
- Питьевая вода и Водопроводная вода,
- Дистиллированная вода и деионизированная вода,
- Сточные воды,
- Ливневая вода или поверхностные воды,
- Апирогенная вода,
- Поливода,
- Структурированная вода — термин, применяемый в различных неакадемических теориях,
- Талая вода,
- Мёртвая вода и Живая вода — виды воды со сказочными свойствами,
- Святая вода — особый вид воды с мистическими свойствами (согласно религиозным учениям). По христианским представлениям святая вода — это вода, посвященная Богу. Никакие свойства воды как таковой при этом не меняются.
В природе
В атмосфере нашей планеты вода находится в виде капель малого размера, в облаках и тумане, а также в виде пара. При конденсации выводится из атмосферы в виде атмосферных осадков (дождь, снег, град, роса). В совокупности жидкая водная оболочка Земли называется гидросферой, а твёрдая — криосферой. Вода является важнейшим веществом всех живых организмов на Земле. Предположительно, зарождение жизни на Земле произошло в водной среде.
Мировой океан содержит более 97,54 % земной воды, подземные воды — около 0,63 %, ледники — 1,81 %, реки и озера — 0,009 %, материковые солёные воды — 0,007 %, атмосфера — 0,001 %[7].
Атмосферные осадки
Вода за пределами Земли
Вода — чрезвычайно распространённое вещество в космосе, однако из-за высокого внутрижидкостного давления вода не может существовать в жидком состоянии в условиях вакуума космоса, отчего она представлена только в виде пара или льда.
Одним из наиболее важных вопросов, связанных с освоением космоса человеком и возможности возникновения жизни на других планетах, является вопрос о наличии воды за пределами Земли в достаточно большой концентрации. Известно, что некоторые кометы более, чем на 50 % состоят из водяного льда. Не стоит, впрочем, забывать, что не любая водная среда пригодна для жизни.
В результате бомбардировки лунного кратера, проведённой 9 октября 2009 года НАСА с использованием космического аппарата LCROSS, впервые были получены достоверные свидетельства наличия на спутнике Земли водяного льда в больших объёмах[23].
Вода широко распространена в Солнечной системе. Наличие воды (в основном в виде льда) подтверждено на многих спутниках Юпитера и Сатурна: Энцеладе[24][25], Тефии, Европе, Ганимеде и др. Вода присутствует в составе всех комет и многих астероидов. Учёными предполагается, что многие транснептуновые объекты имеют в своём составе воду.
Вода в виде паров содержится в атмосфере Солнца (следы)[26], атмосферах Меркурия (3,4 %, также большие количества воды обнаружены в экзосфере Меркурия)[27], Венеры (0,002 %)[28], Луны[29], Марса (0,03 %)[30], Юпитера (0,0004 %)[31], Европы[32], Сатурна, Урана (следы)[33] и Нептуна[34] (найден в нижних слоях атмосферы).
Содержание водяного пара в атмосфере Земли у поверхности колеблется от 3—4 % в тропиках до 2·10−5% в Антарктиде[35].
Кроме того, вода обнаружена на экзопланетах, например HD 189733 A b[36], HD 209458 b[37] и GJ 1214 b[38].
Жидкая вода, предположительно, имеется под поверхностью некоторых спутников планет — наиболее вероятно, на Европе — спутнике Юпитера.
Биологическая роль
 Полный стакан с водой
Полный стакан с водойВода играет уникальную роль как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений.
Благодаря водородной связи, вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время.
Поскольку у льда плотность меньше, чем у жидкой воды, вода в водоёмах замерзает сверху, а не снизу. Образовавшийся слой льда препятствует дальнейшему промерзанию водоёма, это позволяет его обитателям выжить. Существует и другая точка зрения: если бы вода не расширялась при замерзании, то не разрушались бы клеточные структуры, соответственно замораживание не наносило бы ущерба живым организмам. Некоторые существа (тритоны) переносят замораживание/оттаивание — считается что этому способствует особый состав клеточной плазмы, не расширяющейся при замораживании.
Применение
В земледелииВыращивание достаточного количества сельскохозяйственных культур на открытых засушливых землях требует значительных расходов воды на ирригацию, доходящих до 90 % в некоторых странах.
Для питья и приготовления пищи
Живое человеческое тело содержит от 50 % до 75 % воды[39], в зависимости от веса и возраста. Потеря организмом человека более 10 % воды может привести к смерти. В зависимости от температуры и влажности окружающей среды, физической активности и т. д. человеку нужно выпивать разное количество воды. Ведётся много споров о том, сколько воды нужно потреблять для оптимального функционирования организма.
Питьевая вода представляет собой воду из какого-либо источника, очищенную от микроорганизмов и вредных примесей. Пригодность воды для питья при её обеззараживании перед подачей в водопровод оценивается по количеству кишечных палочек на литр воды, поскольку кишечные палочки распространены и достаточно устойчивы к антибактериальным средствам, и если кишечных палочек будет мало, то будет мало и других микробов. Если кишечных палочек не больше, чем 3 на литр, вода считается пригодной для питья[40][41].
Как растворительВода является растворителем для многих веществ. Она используется для очистки как самого человека, так и различных объектов человеческой деятельности. Вода используется как растворитель в промышленности.
В качестве теплоносителя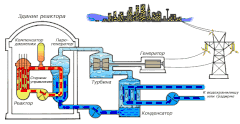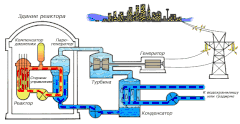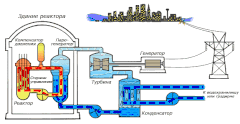 Схема работы атомной электростанции на двухконтурном водо-водяном энергетическом реакторе (ВВЭР)
Схема работы атомной электростанции на двухконтурном водо-водяном энергетическом реакторе (ВВЭР) Среди существующих в природе жидкостей вода обладает наибольшей теплоёмкостью. Теплота её испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь аммиаку. В качестве теплоносителя воду используют в тепловых сетях, для передачи тепла по теплотрассам от производителей тепла к потребителям. Воду в виде льда используют для охлаждения в системах общественного питания, в медицине. Большинство атомных электростанций используют воду в качестве теплоносителя.
Как замедлительВо многих ядерных реакторах вода используется не только в качестве теплоносителя, но и замедлителя нейтронов для эффективного протекания цепной ядерной реакции. Также существуют тяжеловодные реакторы, в которых в качестве замедлителя используется тяжёлая вода.
Для ПожаротушенияВ пожаротушении вода зачастую используется не только как охлаждающая жидкость, но и для изоляции огня от воздуха в составе пены, так как горение поддерживается только при достаточном поступлении кислорода.
В спортеМногими видами спорта занимаются на водных поверхностях, на льду, на снегу и даже под водой. Это подводное плавание, хоккей, лодочные виды спорта, биатлон, шорт-трек и др.
В качестве Инструмента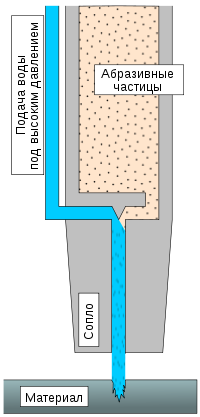
Вода используется как инструмент для разрыхления, раскалывания и даже резки пород и материалов. Она используется в добывающей промышленности, горном деле и в производстве. Достаточно распространены установки по резке водой различных материалов: от резины до стали. Вода, выходящая под давлением несколько тысяч атмосфер способна разрезать стальную пластину толщиной несколько миллиметров, или более при добавлении абразивных частиц.
Для смазкиВода применяется как смазочный материал для смазки подшипников из древесины, пластиков, текстолита, подшипников с резиновыми обкладками и др. Воду также используют в эмульсионных смазках[42].
Исследования
Происхождение воды на планете
Происхождение воды на Земле является предметом научных споров. Некоторые учёные считают, что вода была занесена астероидами или кометами на ранней стадии образования Земли, около четырёх миллиардов лет назад, когда планета уже сформировалась в виде шара. В настоящее время установлено, что вода появилась в мантии Земли не позже 2,7 миллиардов лет назад[43].
Гидрология
Гидроло́гия — наука, изучающая природные воды, их взаимодействие с атмосферой и литосферой, а также явления и процессы, в них протекающие (испарение, замерзание и т. п.).
Предметом изучения гидрологии являются все виды вод гидросферы в океанах, морях, реках, озёрах, водохранилищах, болотах, почвенных и подземных вод.
Гидрология исследует круговорот воды в природе, влияние на него деятельности человека и управление режимом водных объектов и водным режимом отдельных территорий; проводит анализ гидрологических элементов для отдельных территорий и Земли в целом; даёт оценку и прогноз состояния и рационального использования водных ресурсов; пользуется методами, применяемыми в географии, физике и других науках. Данные гидрологии моря используются при плавании и ведении боевых действий надводными кораблями и подводными лодками.
Гидрология подразделяется на океанологию, гидрологию суши и гидрогеологию.
Океанология подразделяется на биологию океана, химию океана, геологию океана, физическую океанологию, и взаимодействие океана и атмосферы.
Гидрология суши подразделяется на гидрологию рек (речную гидрологию, потамологию), озероведение (лимнологию), болотоведение, гляциологию.
Гидрогеология
Гидрогеоло́гия (от др.-греч. ὕδωρ «водность» + геология) — наука, изучающая происхождение, условия залегания, состав и закономерности движений подземных вод. Также изучается взаимодействие подземных вод с горными породами, поверхностными водами и атмосферой. В сферу этой науки входят такие вопросы, как динамика подземных вод, гидрогеохимия, поиск и разведка подземных вод, а также мелиоративная и региональная гидрогеология. Гидрогеология тесно связана с гидрологией и геологией, в том числе и с инженерной геологией, метеорологией, геохимией, геофизикой и другими науками о Земле. Она опирается на данные математики, физики, химии и широко использует их методы исследования. Данные гидрогеологии используются, в частности, для решения вопросов водоснабжения, мелиорации и эксплуатации месторождений.
Факты
 | Данный раздел имеет чрезмерный объём или содержит маловажные подробности. Если вы не согласны с этим, пожалуйста, покажите в тексте существенность излагаемого материала. В противном случае раздел может быть удалён. Подробности могут быть на странице обсуждения. |
- В среднем в организме растений и животных содержится более 50 % воды[44].
- В составе мантии Земли воды содержится в 10-12 раз больше, чем в Мировом океане[45].
- При средней глубине в 3,6 км Мировой океан покрывает около 71 % поверхности планеты и содержит 97,6 % известных мировых запасов свободной воды.[источник не указан 116 дней]
- Если бы на Земле не было впадин и выпуклостей, вода покрыла бы всю Землю слоем толщиной 3 км[46].
- При определённых условиях (внутри нанотрубок) молекулы воды образуют новое состояние, при котором они сохраняют способность течь даже при температурах, близких к абсолютному нулю[47].
- Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света.[источник не указан 116 дней]
- Синий цвет чистой океанской воды в толстом слое объясняется избирательным поглощением и рассеянием света в воде.[источник не указан 116 дней]
- С помощью капель воды из кранов можно создать напряжение до 10 киловольт, опыт называется «Капельница Кельвина».[источник не указан 116 дней]
- Вода — это одно из немногих веществ в природе, которые расширяются при переходе из жидкой фазы в твёрдую (кроме воды, таким свойством обладают сурьма[48], висмут, галлий, германий и некоторые соединения и смеси).
- Вода и водяной пар горят в атмосфере фтора фиолетовым пламенем. Смеси водяного пара со фтором в пределах взрывчатых концентраций взрывоопасны. В результате этой реакции образуются фтороводород и элементарный кислород.[источник не указан 116 дней]
См. также
Примечания
- ↑ англ. International Union of Pure and Applied Chemistry. Nomenclature of Inorganic Chemistry. IUPAC RECOMMENDATIONS 2005. RSC Publishing, 2005. — p. 306.
- ↑ 1 2 Маленков Г. Г. Вода // Физическая энциклопедия. — М.: Советская энциклопедия, 1988. — Т. I. Ааронова — Бома эффект — Длинные линии. — С. 294—297.
- ↑ Петрушевский Ф. Ф., Гершун А. Л. Лед, в физике // Энциклопедический словарь — СПб.: Брокгауз—Ефрон, 1896. — Т. XVII. — С. 471–473.
- ↑ Henniker, J. C. (1949). «The Depth of the Surface Zone of a Liquid». Reviews of Modern Physics (Reviews of Modern Physics) 21 (2): 322–341. DOI:10.1103/RevModPhys.21.322.
- ↑ Pollack, Gerald. Water Science. University of Washington, Pollack Laboratory. — «Water has three phases – gas, liquid, and solid; but recent findings from our laboratory imply the presence of a surprisingly extensive fourth phase that occurs at interfaces.». Проверено 5 февраля 2011. Архивировано 15 февраля 2013 года.
- ↑ CIA- The world fact book. Central Intelligence Agency. Проверено 20 декабря 2008.
- ↑ 1 2 Marine Science: An Illustrated Guide to Science
- ↑ 1 2 Gleick, P.H. Water in Crisis: A Guide to the World's Freshwater Resources. — Oxford University Press, 1993.
- ↑ Water Vapor in the Climate System (англ.). American Geophysical Union. Проверено 13 февраля 2013. Архивировано 15 февраля 2013 года.
- ↑ Криволуцкий А. Е. Голубая планета. Земля среди планет. Географический аспект. — М.: Мысль, 1985. — С. 212.
- ↑ United Nations. Un.org (22 марта 2005). Проверено 25 июля 2010. Архивировано 15 февраля 2013 года.
- ↑ 1 2 Ларионов А. К. Занимательная гидрогеология. — Москва: Недра, 1979. — С. 5—12. — 157 с.
- ↑ 1 2 3 Петрянов И.В. Самое необыкновенное вещество // Химия и жизнь. — 1965. — № 3. — С. 2—14.
- ↑ Physics of Ice (15 страница)
- ↑ Свойства воды. Физические свойства воды
- ↑ Основные физические свойства воды, водяного пара, льда, снега
- ↑ Коэффициенты поверхностного натяжения жидкостей
- ↑ Молекулярные преобразователи энергии в живой клетке (Тихонов А. Н., 1997)
- ↑ П. И. Воскресенский Техника лабораторных работ. 9-е изд. Л.: «Химия», 1970. С. 696—697
- ↑ Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. § 7. Атомы // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М.: Просвещение, 1987. — С. 15—18. — 240 с. — 1 630 000 экз.
- ↑ Радиационная химия // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика, 1990. — С. 200. — ISBN 5-7155-0292-6.
- ↑ Le Caër S. (2011). «Water Radiolysis: Influence of Oxide Surfaces on h3 Production under Ionizing Radiation». Water 3: 236.
- ↑ Вода на Луне: но откуда?
- ↑ NASA Space Assets Detect Ocean inside Saturn Moon. NASA (3 April 2014). Проверено 3 апреля 2014.
- ↑ (4 April 2014) «The Gravity Field and Interior Structure of Enceladus». Science (journal) 344: 78—80. DOI:10.1126/science.1250551. Проверено 3 April 2014.
- ↑ Solanki, S. K. (1994). «New Light on the Heart of Darkness of the Solar Chromosphere». Science 263 (5143): 64–66. DOI:10.1126/science.263.5143.64. PMID 17748350. Bibcode: 1994Sci...263...64S.
- ↑ MESSENGER Scientists 'Astonished' to Find Water in Mercury's Thin Atmosphere. Planetary Society (3 июля 2008). Проверено 5 июля 2008. Архивировано 17 января 2010 года.
- ↑ Bertaux, Jean-Loup (2007). «A warm layer in Venus' cryosphere and high-altitude measurements of HF, HCl, h3O and HDO». Nature 450 (7170): 646–649. DOI:10.1038/nature05974. PMID 18046397. Bibcode: 2007Natur.450..646B.
- ↑ Sridharan, R.; S.M. Ahmed, Tirtha Pratim Dasa, P. Sreelathaa, P. Pradeepkumara, Neha Naika, and Gogulapati Supriya (2010). «'Direct' evidence for water in the sunlit lunar ambience from CHACE on MIP of Chandrayaan I». Planetary and Space Science 58 (6). DOI:10.1016/j.pss.2010.02.013. Bibcode: 2010P&SS...58..947S.
- ↑ Donald Rapp. Use of Extraterrestrial Resources for Human Space Missions to Moon or Mars. — Springer, 28 November 2012. — P. 78–. — ISBN 978-3-642-32762-9.
- ↑ (2005) «Coupled Clouds and Chemistry of the Giant Planets — A Case for Multiprobes» (PDF). Space Science Reviews 116: 121–136. DOI:10.1007/s11214-005-1951-5. ISSN 0032-0633. Bibcode: 2005SSRv..116..121A.
- ↑ Hubble Sees Evidence of Water Vapor at Jupiter Moon. NASA (December 12, 2013). Проверено 12 декабря 2013.
- ↑ Encrenaz, 2003, p. 92.
- ↑ Hubbard, W. B. (1997). «Neptune's Deep Chemistry». Science 275 (5304): 1279–1280. DOI:10.1126/science.275.5304.1279. PMID 9064785.
- ↑ Земля (планета) — статья из Большой советской энциклопедии.
- ↑ Water Found on Distant Planet 12 July 2007 By Laura Blue, Time
- ↑ Water Found in Extrasolar Planet’s Atmosphere
- ↑ Атмосфера экзопланеты GJ 1214b переполнена водой. Компьюлента (24 февраля 2012). — «Новые наблюдения транзитов GJ 1214 b, удалённой от Земли на 40 световых лет, показали, что вода должна составлять не менее половины от всей массы атмосферы этой «суперземли»». Проверено 21 июля 2013. Архивировано 29 августа 2013 года.
- ↑ Watson, P. E. et al. (1980) Total body water volumes for adult males and females estimated from simple anthropometric measurements, The American Journal for Clinical Nutrition, Vol. 33, No 1, pp.27-39.
- ↑ Моргунова Г.С. Вода, которую мы пьём // Химия и жизнь. — 1965. — № 3. — С. 15—17.
- ↑ Sharma B.K. Water Pollution. — 1994. — P. 408—409.
- ↑ Воскресенский В. А., Дьяков В. И. Глава 2. Смазочные вещества и их физико-химические свойства // Расчет и проектирование опор скольжения (жидкостная смазка): Справочник. — М.: Машиностроение, 1980. — С. 15. — (Библиотека конструктора). — ISBN ББК 34.42, УДК 621.81.001.2 (031).
- ↑ Ученые: вода появилась в мантии Земли 2,7 млрд лет назад. ТАСС. Проверено 26 апреля 2016.
- ↑ Наука и техника. Книги. Загадки простой воды.
- ↑ Состав и природа мантии Земли
- ↑ Биосфера Земли
- ↑ Science Daily (англ.)
- ↑ Сурьма // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика, 1990. — С. 235. — ISBN 5-7155-0292-6.
Литература
Ссылки
Справочные материалыwikiredia.ru
Откуда на замёрзших планетах жидкая вода?
Солнечная система не устаёт удивлять нас, и, возможно, одной из самых больших неожиданностей стал тот факт, что Земля – не единственный мир, на поверхности которого есть жидкая вода.
Лучшие публикации в Telegram-канале Econet.ru. Подписывайтесь!
Да, конечно, на Марсе иногда появляется немного воды, но такие миры, как луна Юпитера Европа, луна Сатурна Энцелад и даже далёкий Плутон обладают огромными подповерхностными океанами, причём на некоторых из этих миров воды ещё больше, чем на Земле.

Высокая отражающая способность поверхности ледяной луны Сатурна, Энцелада, говорит о присутствии в большом количестве постоянно обновляющегося льда, чего не наблюдается ни на одной другой луне в Солнечной системе
Однако, в отличие от Земли или даже Марса, эти миры так далеко отстоят от Солнца и там так холодно, что даже самые высокие температуры на поверхности не добираются до температуры плавления льда. Так как же на них сохраняется жидкая вода?
Начнём с того, как ведёт себя вода у нас на Земле.
Вода в трёх состояниях: жидком, твёрдом (лёд) и газообразном (невидимый водяной пар в воздухе). Облака – это скопление водяных капель, сконденсировавшихся из насыщенного паром воздуха.
На Земле вода может существовать в трёх состояниях: твёрдом, жидком и газообразном, в зависимости от температуры. Ниже 0° C вода замерзает и превращается в лёд; выше этой точки и ниже 100° C вода жидкая; выше 100° C вода существует в виде газообразного пара. Именно так нас учат в школе, и по большей части это верно.
Но существуют некоторые условия, при которых вода может начать вести себя совсем по-другому. К примеру, если вы живетё на большой высоте, например, в Боготе (Колумбия), Кито (Эквадор), Эль-Альто (Боливия) – а в каждом из этих городов живёт более миллиона человек — то вода у вас кипит при гораздо меньшей температуре.
Фазовая диаграмма воды, с указанием различных видов льда, жидкого и газообразного состояний, и условий, при которых они возникают. Заметьте, что ниже -22° C жидкая вода существовать не может ни при каком давлении.
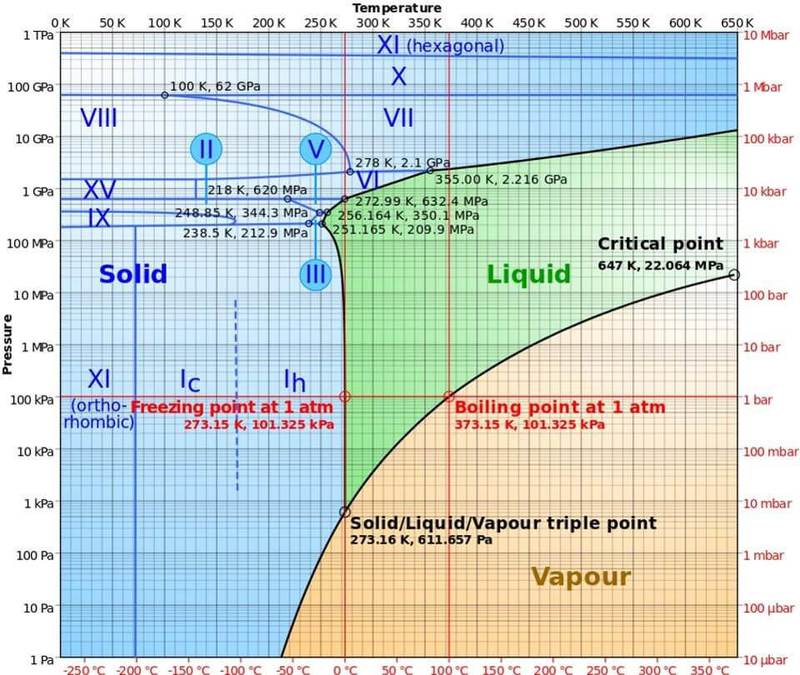
Всё оттого, что давление влияет как на точку кипения, так и на точку замерзания. В глубинах космоса без атмосферы жидкая вода существовать не может; она может существовать либо в твёрдой, либо в газообразной фазах. Но на Земле при пониженном давлении вода кипит при пониженной температуре, а если приложить достаточно большое давление, то лёд тает и становится жидким.
Последний факт часто удивляет людей, до тех пор, пока не просишь их вспомнить о коньках. Без коньков на льду очень скользко и вам трудно контролировать ваши движения или достичь трения; ваши ботинки скользят по замёрзшей поверхности льда. Но с коньками всё давление вашего веса концентрируется на лезвии, что увеличивает давление на лёд и заставляет его временно плавиться.

Фигуристы оставляют следы на льду, поскольку их коньки, скользя по поверхности, оказывают давление, достаточное для превращения льда в воду
Стоит учесть и ещё один факт: точка замерзания воды изменяется в зависимости от того, что в ней растворено. Если вы когда-нибудь клали водку в морозилку, вы знаете, что смесь воды и 40% алкоголя замерзает не при температуре замерзания воды, ей нужна температура гораздо ниже.
Наш океан с растворённой в нём солью тоже обладает пониженной точкой замерзания по сравнению с чистой водой: порядка -2° C при примерно 4% солёности. Поэтому можно опустить температуру ниже замерзания воды и всё равно остаться с жидкой водой – в зависимости от того, что в ней ещё есть. Это одна из наиболее удивительных особенностей Марса, где чистая жидкая вода вообще не должна существовать.
Потёки воды на склонах, вроде этих — на южном склона кратера на дне каньона Меласс — сначала постепенно вырастают, а потом исчезают, заполняясь пылью с марсианского ландшафта. Известно, что они являются следствием потоков жидкой солёной воды
При давлениях и температурах, существующих на поверхности Марса, жидкой воды физически не должно быть. Но благодаря высокому содержанию соли в некоторых видах марсианской почвы, вода, конденсируясь на поверхности, может существовать в жидкой фазе. Потоки воды, идущие вниз по склонам стенок кратеров, стали первым прямым свидетельством наличия жидкой воды вне Земли.
Но если заглянуть ещё дальше в Солнечную систему, посмотреть на миры вроде Европы, Энцелада, или даже на Плутон – там мы не найдём воды на поверхности.

Европа, одна из крупнейших лун Солнечной системы, движется по орбите вокруг Юпитера. Под её замёрзшей ледяной поверхностью находится жидкий океан, подогреваемый приливными силами Юпитера
Пристальное изучение этих миров открывает лишь лёд. Да, это водяной лёд, что даёт нам надежду, но температуры на этих мирах, расположенных в несколько раз дальше, чем Земля от Солнца, не только никогда не приближаются к показателю в 0° C — что необходимо для появления жидкой воды на поверхности Земли — но даже никогда не приближаются к температуре, позволившей бы жидкой воде существовать при любом давлении. И всё же, если на этих мирах углубиться под поверхность льда, мы приблизимся к ней, поскольку подо всем этим льдом существует огромное давление.

Плутон и Харон в отредактированном цвете; изображения получены с камеры межпланетной станции "Новые горизонты". Замёрзшая поверхность Плутона – это ещё не всё; на большой глубине у него есть подповерхностный океан жидкой воды
Требуется атмосфера толщиной в 100 км, чтобы создать атмосферное давление, которое мы ощущаем на уровне моря – однако чтобы удвоить это давление, нужно всего лишь 10 метров воды. На другом мире лёд легко может достигать тысячи метров в толщину, и создавать огромные давления, приближающие нас к жидкой фазе воды. Но даже при наличии солей во льду жидкая вода всё равно не появится без ещё одного дополнительного фактора: источника тепла. К счастью, у каждого из этих миров есть источник тепла: близко расположенная массивная планета-компаньон.
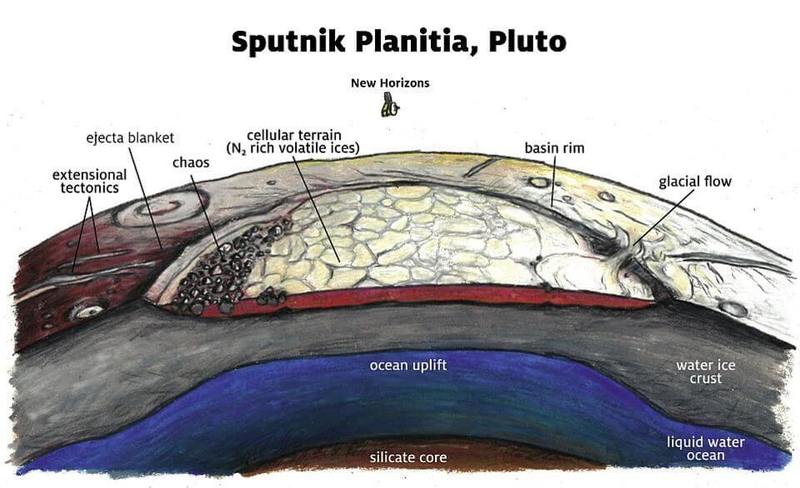
«Равнина Спутника» на Плутоне. Геологические особенности, выявленные станцией «Новые горизонты», говорят о наличии подповерхностного океана под обширной и глубокой ледяной коркой на поверхности Плутона, простирающейся по всей карликовой планете
У Европы есть Юпитер, у Энцелада есть Сатурн. У Плутона есть луна Харон. Вся эта троица, комбинируя крупную массу и относительно близкое расположение, оказывает весьма серьёзное приливное воздействие на эти миры. И эти силы не просто приводят к небольшим деформациям внешних слоёв – они растягивают, сжимают и раскалывают внутренности этих миров, из-за чего те разогреваются.
Если учесть количество приливного тепла и добавить оказываемое льдом давление и соль, существующую под внешними слоями льда, можно получить искомое: жидкий океан под ледяной поверхностью.

Приливных сил, действующих на луну Сатурна Энцелад, достаточно для того, чтобы разорвать ледяную корку и разогреть внутренности, что заставляет подповерхностный океан извергать в космос воду на высоту в сотни километров
Европа демонстрирует огромные трещины на поверхности, свидетельства тех моментов, когда там ломался лёд и на поверхность выступала вода. Подповерхностный океан Энцелада – наиболее зрелищный, жидкая вода извергается из него и поднимается в космос на сотни километров над поверхностью.
Эти водяные столбы Энцелада настолько сильны, что отвечают за образование одного из колец Сатурна – кольца Е. Наконец, под замёрзшей поверхностью Плутона, что, возможно, оказалось одним из самых неожиданных сюрпризов, имеется жидкий водяной океан. А если там есть вода, тепло и растворённые химические соединения, то вполне возможно – хотя пока лишь гипотетически – что под поверхностью этих миров можно найти что-то поинтереснее простой воды.
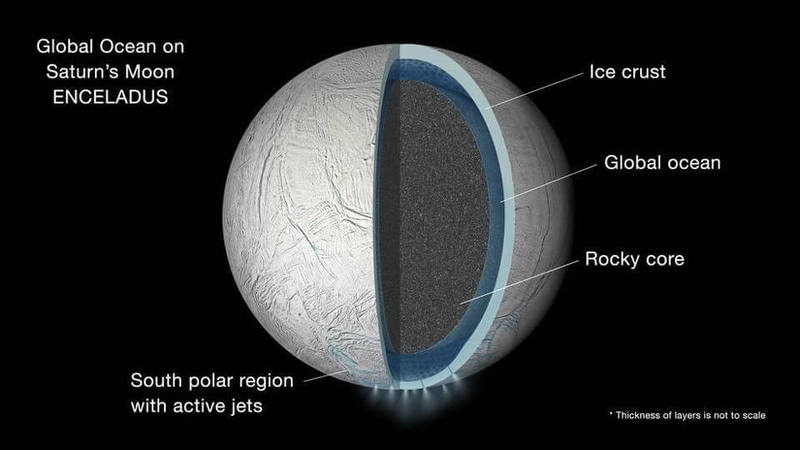
Иллюстрация внутренностей луны Сатурна Энцелада, где показан глобальный жидкий водяной океан, расположенный между скалистым ядром и ледяной коркой. Толщина слоёв не в масштабе.
Может ли существовать жизнь на мире, где солнечный свет никогда не достигает жидкого океана, способного служить домом для этой жизни? Это возможно, и потенциально проверить эту гипотезу можно будет сначала на Энцеладе. Наличие гейзеров даёт фактическую возможность солнечному свету катализировать некоторые из биохимических молекул, способных породить жизнь, перед тем, как они снова упадут на ледяную поверхность луны.
За достаточно долгое время над ними может скопиться достаточно льда, чтобы давление заставило лёд расплавиться – и этот процесс в принципе может создать долгосрочный цикл появления жизни на этом мире. И чтобы выяснить это, нам не придётся копать этот мир или втыкать в него зонд на большую глубину – нужно просто отправить космический корабль мимо одного из гейзеров Энцелада и взять из него пробу. Может ли жизнь за пределами Земли быть настолько легко доступной для нас внутри Солнечной системы? Возможно, если нам повезёт, когда-нибудь мы узнаем об этом. опубликовано econet.ru
Если у вас возникли вопросы по этой теме, задайте их специалистам и читателям нашего проекта здесь.
P.S. И помните, всего лишь изменяя свое потребление - мы вместе изменяем мир! © econet
econet.ru
откуда на замёрзших планетах жидкая вода? / Geektimes
 Высокая отражающая способность поверхности ледяной луны Сатурна, Энцелада, говорит о присутствии в большом количестве постоянно обновляющегося льда, чего не наблюдается ни на одной другой луне в Солнечной системе
Высокая отражающая способность поверхности ледяной луны Сатурна, Энцелада, говорит о присутствии в большом количестве постоянно обновляющегося льда, чего не наблюдается ни на одной другой луне в Солнечной системеСолнечная система не устаёт удивлять нас, и, возможно, одной из самых больших неожиданностей стал тот факт, что Земля – не единственный мир, на поверхности которого есть жидкая вода. Да, конечно, на Марсе иногда появляется немного воды, но такие миры, как луна Юпитера Европа, луна Сатурна Энцелад и даже далёкий Плутон обладают огромными подповерхностными океанами, причём на некоторых из этих миров воды ещё больше, чем на Земле. Однако, в отличие от Земли или даже Марса, эти миры так далеко отстоят от Солнца и там так холодно, что даже самые высокие температуры на поверхности не добираются до температуры плавления льда. Так как же на них сохраняется жидкая вода? Именно это хочет узнать наш читатель:
Я читал о луне Сатурна Энцеладе и о том, что учёные считают, что на ней существуют океаны жидкой воды под её ледяной коркой. Однако я также прочёл, что максимальная температура на поверхности составляет -90° С. Как же у этой луны может быть жидкая вода? При таких низких температуре и давлении на Энцеладе должны были быть только водяной лёд и пар, но не вода. Начнём с того, как ведёт себя вода у нас на Земле. Вода в трёх состояниях: жидком, твёрдом (лёд) и газообразном (невидимый водяной пар в воздухе). Облака – это скопление водяных капель, сконденсировавшихся из насыщенного паром воздуха.
Вода в трёх состояниях: жидком, твёрдом (лёд) и газообразном (невидимый водяной пар в воздухе). Облака – это скопление водяных капель, сконденсировавшихся из насыщенного паром воздуха.На Земле вода может существовать в трёх состояниях: твёрдом, жидком и газообразном, в зависимости от температуры. Ниже 0° C вода замерзает и превращается в лёд; выше этой точки и ниже 100° C вода жидкая; выше 100° C вода существует в виде газообразного пара. Именно так нас учат в школе, и по большей части это верно. Но существуют некоторые условия, при которых вода может начать вести себя совсем по-другому. К примеру, если вы живетё на большой высоте, например, в Боготе (Колумбия), Кито (Эквадор), Эль-Альто (Боливия) – а в каждом из этих городов живёт более миллиона человек — то вода у вас кипит при гораздо меньшей температуре.
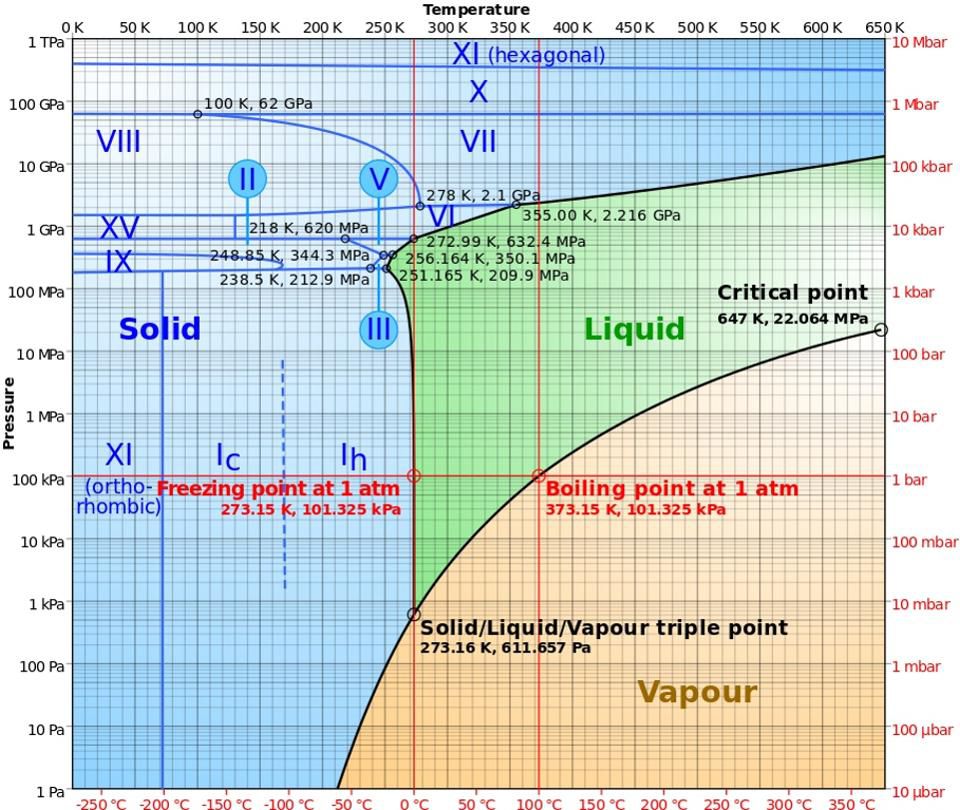 Фазовая диаграмма воды, с указанием различных видов льда, жидкого и газообразного состояний, и условий, при которых они возникают. Заметьте, что ниже -22° C жидкая вода существовать не может ни при каком давлении
Фазовая диаграмма воды, с указанием различных видов льда, жидкого и газообразного состояний, и условий, при которых они возникают. Заметьте, что ниже -22° C жидкая вода существовать не может ни при каком давлении
Всё оттого, что давление влияет как на точку кипения, так и на точку замерзания. В глубинах космоса без атмосферы жидкая вода существовать не может; она может существовать либо в твёрдой, либо в газообразной фазах. Но на Земле при пониженном давлении вода кипит при пониженной температуре, а если приложить достаточно большое давление, то лёд тает и становится жидким. Последний факт часто удивляет людей, до тех пор, пока не просишь их вспомнить о коньках. Без коньков на льду очень скользко и вам трудно контролировать ваши движения или достичь трения; ваши ботинки скользят по замёрзшей поверхности льда. Но с коньками всё давление вашего веса концентрируется на лезвии, что увеличивает давление на лёд и заставляет его временно плавиться.
 Фигуристы оставляют следы на льду, поскольку их коньки, скользя по поверхности, оказывают давление, достаточное для превращения льда в воду
Фигуристы оставляют следы на льду, поскольку их коньки, скользя по поверхности, оказывают давление, достаточное для превращения льда в воду
Стоит учесть и ещё один факт: точка замерзания воды изменяется в зависимости от того, что в ней растворено. Если вы когда-нибудь клали водку в морозилку, вы знаете, что смесь воды и 40% алкоголя замерзает не при температуре замерзания воды, ей нужна температура гораздо ниже. Наш океан с растворённой в нём солью тоже обладает пониженной точкой замерзания по сравнению с чистой водой: порядка -2° C при примерно 4% солёности. Поэтому можно опустить температуру ниже замерзания воды и всё равно остаться с жидкой водой – в зависимости от того, что в ней ещё есть. Это одна из наиболее удивительных особенностей Марса, где чистая жидкая вода вообще не должна существовать.
 Потёки воды на склонах, вроде этих — на южном склона кратера на дне каньона Меласс — сначала постепенно вырастают, а потом исчезают, заполняясь пылью с марсианского ландшафта. Известно, что они являются следствием потоков жидкой солёной воды.
Потёки воды на склонах, вроде этих — на южном склона кратера на дне каньона Меласс — сначала постепенно вырастают, а потом исчезают, заполняясь пылью с марсианского ландшафта. Известно, что они являются следствием потоков жидкой солёной воды.
При давлениях и температурах, существующих на поверхности Марса, жидкой воды физически не должно быть. Но благодаря высокому содержанию соли в некоторых видах марсианской почвы, вода, конденсируясь на поверхности, может существовать в жидкой фазе. Потоки воды, идущие вниз по склонам стенок кратеров, стали первым прямым свидетельством наличия жидкой воды вне Земли.
Но если заглянуть ещё дальше в Солнечную систему, посмотреть на миры вроде Европы, Энцелада, или даже на Плутон – там мы не найдём воды на поверхности.
 Европа, одна из крупнейших лун Солнечной системы, движется по орбите вокруг Юпитера. Под её замёрзшей ледяной поверхностью находится жидкий океан, подогреваемый приливными силами Юпитера
Европа, одна из крупнейших лун Солнечной системы, движется по орбите вокруг Юпитера. Под её замёрзшей ледяной поверхностью находится жидкий океан, подогреваемый приливными силами Юпитера
Пристальное изучение этих миров открывает лишь лёд. Да, это водяной лёд, что даёт нам надежду, но температуры на этих мирах, расположенных в несколько раз дальше, чем Земля от Солнца, не только никогда не приближаются к показателю в 0° C — что необходимо для появления жидкой воды на поверхности Земли — но даже никогда не приближаются к температуре, позволившей бы жидкой воде существовать при любом давлении. И всё же, если на этих мирах углубиться под поверхность льда, мы приблизимся к ней, поскольку подо всем этим льдом существует огромное давление.
 Плутон и Харон в отредактированном цвете; изображения получены с камеры межпланетной станции "Новые горизонты". Замёрзшая поверхность Плутона – это ещё не всё; на большой глубине у него есть подповерхностный океан жидкой воды.
Плутон и Харон в отредактированном цвете; изображения получены с камеры межпланетной станции "Новые горизонты". Замёрзшая поверхность Плутона – это ещё не всё; на большой глубине у него есть подповерхностный океан жидкой воды.
Требуется атмосфера толщиной в 100 км, чтобы создать атмосферное давление, которое мы ощущаем на уровне моря – однако чтобы удвоить это давление, нужно всего лишь 10 метров воды. На другом мире лёд легко может достигать тысячи метров в толщину, и создавать огромные давления, приближающие нас к жидкой фазе воды. Но даже при наличии солей во льду жидкая вода всё равно не появится без ещё одного дополнительного фактора: источника тепла. К счастью, у каждого из этих миров есть источник тепла: близко расположенная массивная планета-компаньон.
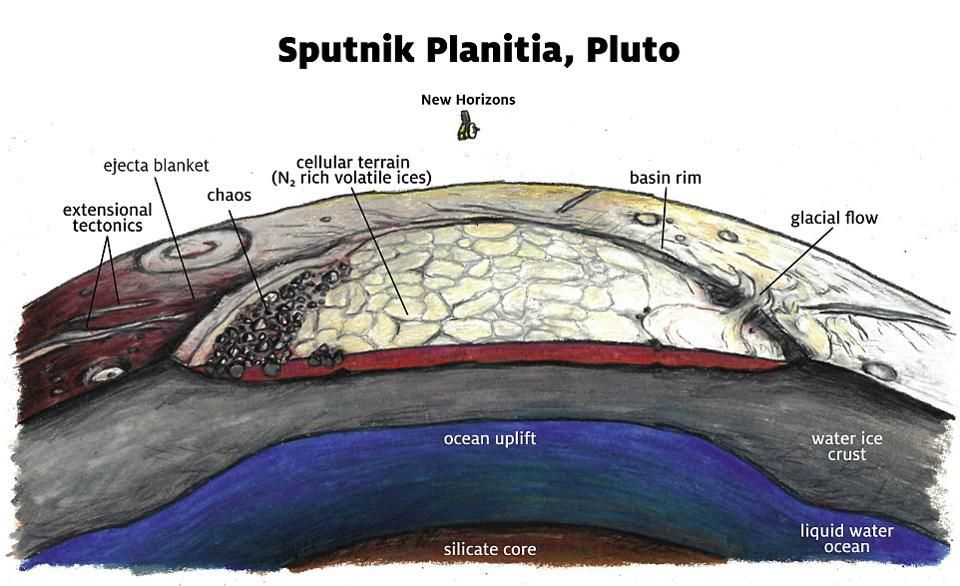 «Равнина Спутника» на Плутоне. Геологические особенности, выявленные станцией «Новые горизонты», говорят о наличии подповерхностного океана под обширной и глубокой ледяной коркой на поверхности Плутона, простирающейся по всей карликовой планете.
«Равнина Спутника» на Плутоне. Геологические особенности, выявленные станцией «Новые горизонты», говорят о наличии подповерхностного океана под обширной и глубокой ледяной коркой на поверхности Плутона, простирающейся по всей карликовой планете.
У Европы есть Юпитер, у Энцелада есть Сатурн. У Плутона есть луна Харон. Вся эта троица, комбинируя крупную массу и относительно близкое расположение, оказывает весьма серьёзное приливное воздействие на эти миры. И эти силы не просто приводят к небольшим деформациям внешних слоёв – они растягивают, сжимают и раскалывают внутренности этих миров, из-за чего те разогреваются. Если учесть количество приливного тепла и добавить оказываемое льдом давление и соль, существующую под внешними слоями льда, можно получить искомое: жидкий океан под ледяной поверхностью.
 Приливных сил, действующих на луну Сатурна Энцелад, достаточно для того, чтобы разорвать ледяную корку и разогреть внутренности, что заставляет подповерхностный океан извергать в космос воду на высоту в сотни километров
Приливных сил, действующих на луну Сатурна Энцелад, достаточно для того, чтобы разорвать ледяную корку и разогреть внутренности, что заставляет подповерхностный океан извергать в космос воду на высоту в сотни километров
Европа демонстрирует огромные трещины на поверхности, свидетельства тех моментов, когда там ломался лёд и на поверхность выступала вода. Подповерхностный океан Энцелада – наиболее зрелищный, жидкая вода извергается из него и поднимается в космос на сотни километров над поверхностью. Эти водяные столбы Энцелада настолько сильны, что отвечают за образование одного из колец Сатурна – кольца Е. Наконец, под замёрзшей поверхностью Плутона, что, возможно, оказалось одним из самых неожиданных сюрпризов, имеется жидкий водяной океан. А если там есть вода, тепло и растворённые химические соединения, то вполне возможно – хотя пока лишь гипотетически – что под поверхностью этих миров можно найти что-то поинтереснее простой воды.
 Иллюстрация внутренностей луны Сатурна Энцелада, где показан глобальный жидкий водяной океан, расположенный между скалистым ядром и ледяной коркой. Толщина слоёв не в масштабе.
Иллюстрация внутренностей луны Сатурна Энцелада, где показан глобальный жидкий водяной океан, расположенный между скалистым ядром и ледяной коркой. Толщина слоёв не в масштабе.
Может ли существовать жизнь на мире, где солнечный свет никогда не достигает жидкого океана, способного служить домом для этой жизни? Это возможно, и потенциально проверить эту гипотезу можно будет сначала на Энцеладе. Наличие гейзеров даёт фактическую возможность солнечному свету катализировать некоторые из биохимических молекул, способных породить жизнь, перед тем, как они снова упадут на ледяную поверхность луны. За достаточно долгое время над ними может скопиться достаточно льда, чтобы давление заставило лёд расплавиться – и этот процесс в принципе может создать долгосрочный цикл появления жизни на этом мире. И чтобы выяснить это, нам не придётся копать этот мир или втыкать в него зонд на большую глубину – нужно просто отправить космический корабль мимо одного из гейзеров Энцелада и взять из него пробу. Может ли жизнь за пределами Земли быть настолько легко доступной для нас внутри Солнечной системы? Возможно, если нам повезёт, когда-нибудь мы узнаем об этом.
Итан Сигель – астрофизик, популяризатор науки, автор блога Starts With A Bang! Написал книги «За пределами галактики» [Beyond The Galaxy], и «Трекнология: наука Звёздного пути» [Treknology].
ЧаВо: если Вселенная расширяется, почему не расширяемся мы; почему возраст Вселенной не совпадает с радиусом наблюдаемой её части
geektimes.ru
Открыта новая фаза воды — «жидкий кристалл»
Одна из базовых вещей, которые мы узнаем на уроках естествознания в школе, это то, что вода может существовать в трех разных состояниях: в виде твердого льда, жидкой воды или газообразного пара. Но недавно международная группа ученых обнаружила признаки того, что жидкая вода на самом деле может существовать в двух разных состояниях.
Проводя исследовательскую работу — результаты были опубликованы потом в International Journal of Nanotechnology — ученые неожиданно обнаружили, что у воды температурой от 50 до 60℃ меняется ряд свойств. Этот признак возможного существования второго жидкого состояния воды разжег горячую дискуссию в научных кругах. Если это подтвердится, то открытие найдет применение во множестве областей, включая нанотехнологии и биологию.
Агрегатные состояния, которые еще называют «фазами», — ключевое понятие учения о системах атомов и молекул. Грубо говоря, система, состоящая из множества молекул, может быть организована в виде определенного числа конфигураций в зависимости от ее общего количества энергии. При высоких температурах (а значит, при большем уровне энергии) молекулам доступно большее число конфигураций, то есть они менее жестко организованы и двигаются относительно свободно (газовая фаза). При более низких температурах у молекул в распоряжении меньше конфигураций и они находятся в более организованной фазе (жидкой). Если температура опустится еще ниже, они примут одну определенную конфигурацию и образуют твердое тело.
Эта общее положение вещей для относительно простых молекул, таких как диоксид углерода или метан, у которых три ясно различаемых состояния (жидкость, твердое тело и газ). Но у более сложных молекул есть большее число возможных конфигураций, а значит и количество фаз возрастает. Прекрасная иллюстрация этого — двойственное поведение жидких кристаллов, которые формируются из комплексов органических молекул и могут течь, как жидкости, но сохраняют при этом твердую кристаллическую структуру.
Так как фазы вещества определяются его молекулярной конфигурацией, многие физические свойства кардинально меняются, когда вещество переходит из одного состояния в другое. В вышеупомянутом исследовании ученые измеряли несколько контрольных свойств воды температурой от 0 до 100 ℃ при нормальных атмосферных условиях (чтобы вода была жидкостью). Неожиданно они обнаружили резкие отклонения в таких свойствах как, например, поверхностное натяжение воды и коэффициент преломления (показатель, отражающий, как свет проходит через воду) при температуре около 50℃.
Особая структура
Как это возможно? Структура молекулы воды, H₂O, очень интересна и может быть изображена в виде своего рода стрелки, где атом кислорода располагается вверху, а два атома водорода «сопровождают» его с флангов. Электроны в молекулах стремятся распределиться ассиметричным образом, из-за чего со стороны кислорода молекула получает отрицательный заряд по сравнению со стороной водорода. Эта простая структурная особенность ведет к тому, что молекулы воды начинают определенным образом взаимодействовать друг с другом, их противоположные заряды притягиваются, образуя так называемую водородную связь.
Это позволяет воде во многих случаях вести себя иначе, чем это делают, согласно наблюдениям, другие простые жидкости. Например, в отличие от большинства других веществ определенная масса воды занимает больше места в твердом состоянии (в виде льда), чем в жидком, из-за того, что ее молекулы образуют специфическую регулярную структуру. Другой пример — поверхностное натяжение жидкой воды, которое в два раза больше, чем у других неполярных, более простых жидкостей.
Вода довольно проста, но не слишком. Это значит, что единственное объяснение проявившейся дополнительной фазе воды — то, что она ведет себя немного как жидкий кристалл. Водородные связи между молекулами поддерживают определенный порядок при низких температурах, но могут приходить и в другое, более свободное состояние при повышении температуры. Этим объясняются значительные отклонения, наблюдаемые учеными во время исследований.
Если все подтвердится, выводы авторов могу найти множество применений. Например, если изменения в окружающей среде (скажем, температуры) влекут за собой изменения в физических свойствах вещества, теоретически это можно использовать при создании аппаратуры зондирования. Или можно подойти более фундаментально — биологические системы состоят в основном из воды. То, как органические молекулы (например, протеины) взаимодействуют друг с другом, вероятно, зависит от того, как молекулы воды образуют жидкую фазу. Если понять, как молекулы воды в среднем ведут себя при разных температурах, можно прояснить, как они взаимодействуют в биологических системах.Это открытие — отличная возможность для теоретиков и экспериментаторов, а также прекрасный пример того, что даже самое привычное вещество может скрывать в себе секреты.
Источник: www.kramola.info
www.ewater.ru
Вода жидкая - Справочник химика 21
A. Примесь — газовая фаза вода — жидкая фаза [c.16]Каждое вещество в данном растворителе и при данных условиях характеризуется определенной степенью ионизации. Степенью ионизации вещества в растворе называется отношение числа ионизированных молекул к общему числу растворенных. Степень ионизации в основном определяется электроно-донорными и электроно-акцеп-торными свойствами растворенного вещества и растворителя. Для многих соединений наиболее сильно ионизирующими растворителями являются вода, жидкие аммиак и фторид водорода. Эти соединения состоят из дипольных молекул и склонны к донорно-акцепторному взаимодействию и образованию водородной связи. Например, НС1 хорошо ионизируется в воде, что связано с превращением водородной связи НаО- -H l в донорно-акцепторную [НгО—Н] + [c.161]
Примечание. Величину А5 можно подсчитать, пользуясь стандартной таблицей термодинамических величии (см. табл. 22). Для этого определяем Д5 перехода воды жидкой в газообразную [c.165]Почти все реакции, с которыми приходится иметь дело химикам, происходят в растворах, а не в газовой или твердой фазах. Причем в большинстве случаев эти реакции протекают в водных растворах, где растворителем является вода. Жидкие среды создают много удобств для осуществления реакций. Чтобы произошла реакция, молекулы должны входить в контакт друг с другом, а скорость миграции атомов или молекул в кристаллах обычно слишком мала для этого. Молекулы газов имеют высокую подвижность, но газы занимают слишком большие объемы, а многие вещества вообще не удается перевести в газовую фазу без разложения. Растворы реагирующих молекул в жидкостях обладают оптимальной комбинацией всех требуемых свойств-компактностью, легкостью в обращении, позволяют быстро смешивать различные вещества. [c.208]
Необходимость очистки коксового газа определяется наличием в нем токсичных, коррозионно-активных веществ (НгЗ, КНз, НСК). Их удаление из газа позволяет также получать ценные товарные продукты серу, серную кислоту, пиридин и его гомологи, аммиачную воду, жидкий аммиак. [c.62]
В промышленных условиях ддя разделения различных жидких нефтепродуктов путем экстракции используют такие растворители, как фенол, фурфурол, Л/-метил-2-пирролидон, диэтиленгликоль, вода, жидкий пропан, бензол, диметилсульфоксид, производные морфолина и пр. При экстракции озокерита и церезина из горных пород в качестве растворителя применяют бензин. [c.295]
В настоящее время общепринята теория органического (биогенного) происхождения нефти, согласно которой она образовалась в результате воздействия бактериального и геологических факторов на останки низших животных и растительных организмов, обитавших в толще воды (планктон) и на дне водоемов (бентос). В верхних слоях осадочных пород этот захороненный органический материал подвергался воздействию кислорода и бактерий и разлагался с образованием газов (оксид углерода, азот, аммиак, метан и др.) и растворимых в воде жидких продуктов. [c.114]
В верхних слоях осадочной породы захороненный органический материал подвергается воздействию кислорода и бактерий и в значительной мере разлагается с образованием газов (СО2, N2, ЫНз, СН4 и др.) и растворимых в воде жидких продуктов. Наиболее устойчивая к химическому и бактериальному воздействию часть исходного органического материала остается в осадке. [c.8]
Растворимость (в граммах на 100 г воды) жидкого брома — 3,60, иода — 0,029, фосфора — 0,0003. Бром и хлор, растворяясь в воде, химически взаимодействуют с ней. [c.24]
Допускается, что результаты измерений отнесены к стандартным условиям 298 К, 101325 Па, вода — жидкая, горение — полное. [c.71]
Огромную роль в свойствах жидкостей играет объем молекул, их форма и полярность. Если молекулы жидкости полярны, то происходит ассоциация (объединение) двух или более молекул в сложный комплекс (рис. 13). В таких жидкостях, как вода, жидкий аммиак, большую роль в ассоциации молекул играет наличие так называемой водородной связи. [c.39]
Уравнение Шишковского выполняется н при адсорбции поверхностно-активных веществ на границе вода — жидкие углеводороды. Оно было экспериментально подтверждено при адсорбции стероидов на границе вода — вазелиновое масло (Р. Ру и Ж- Баре). [c.58]
Выполнение. Наполненный на Vs объема водой большой стакан поместить на демонстрационный столик и из стакана Дьюара вылить в стакан немного жидкого воздуха. В воде жидкий воздух образует отдельные капли, которые бурно кипят и двигаются по поверхности. Затем видно, что капли жидкого воздуха то погружаются в воду, то всплывают вверх. Это происходит потому, что по мере испарения азота (а он улетучивается легче) увеличив [c.30]
Давление насыщенного пара воды и льда (ниже 0°С вода жидкая в переохлажденном состоянии) [c.14]
Такая капиллярная или адсорбированная вода, жидкая при температуре несколько ниже 0° С, находится не в переохлажденном, а в устойчивом равновесном состоянии. Никакая затравка льда не вызовет ее кристаллизации. [c.36]
Табличные значения энтальпий образования компоненты реакции равны соответственно для Peu — 463 кДж/моль, для воды (жидкой) — 286,2 кДж/моль, [c.213]
Получаемые таким способом соли сульфокислот обладают высокими качествами, поэтому их можно перерабатывать вместе с натуральным мылом, хотя присутствие поваренной соли сильно мешает смешению обоих компонентов. Соли сульфокислот, которые поступают в продажу под названием мерзолятов (исходный сульфохлорид известен под названием мерзол ), могут быть переработаны в смеси с сульфатом натрия в известные нейтральные высококачественные моющие средства для шерсти или в смеси с водой, жидким стеклом итилозой НВР — в мыльные порошки для хлопчатобумажного белья тонких и грубых сортов. Соли сульфокислот, получаемые сульфохлорированием на основе когазина И, производят и в настоящее время. [c.417]
На установке для получения винилхлоридных мономеров произошла авария, в результате которой наполовину был разрушен завод [27] (фирма Но-букоси Кагаку). Оказалось, что один из вентилей (диаметром 3 дюйма) дал течь. Чтобы прекратить утечку необработанного мономера, попытались плотно закрыть вентиль. Под нажатием вентиль разрушился и 3,5 т мономера вытекло наружу. Образовавшаяся газовоздушная смесь взорвалась. Результаты расследования показали, что на участке уплотнения между клапаном вентиля и седлом была раковина глубиной 0,3—0,8 мм, через которую просачивался мономер даже прн закрытом вентиле. Корпус вентиля был изготовлен по стандарту из чугуна Л18В-2041, седло клапана —из стали 5и8-52, клапан — из 5и5-53. В присутствии даже небольшого количества воды жидкие внннлхлорндные мономеры разъедают эти металлы. [c.71]
Прореагировавшая газовая смесь с температурой около 400°С отводится из нижней части колонны синтеза 14 в котел-утилизатор //на охлаждение до 200°С. Дальнейшее охлаждение газовой смеси до 20°С происходит в теплообменнике 10, водянохм холодильнике первичной конденсации и холодном газовом теплообменнике 5. По выходе из теплообменника 5 циркуляционная (прореагировавшая) газовая смесь смешивается со свежей азотоводородной смесью, и цикл повторяется. Жидкий аммиак выделяется в первичном 8 и вторичном 6 сепараторах, проходит магнитные фильтры 7 и направляется в сборники жидкого Эхммиака 12 и 13. При понижении давления до 2—2,5 МПа из жидкого аммиака выделяются растворенные газы, которые называют танковыми. В установке улавливания паров аммиака из танковых газов получают аммиачную воду. Жидкий аммиак из промежуточного сборника поступает на склад. [c.62]
Товарное жидкое стекло разбавляется водой до получения раствора с плотностью 1,4. Этот раствор смешивается с равным объемом воды и титрованием пробы смеси устанавливается количество НС1, необходимое для полной нейтрализации. Затем к разбавленному водой жидкому стеклу приливается при перемешивании 5 и. раствор H I, взятый с 20 %-нь)М избытком. Образовавшийся гель, который после застывания разламывается на куски, отмывается горячей водой до удаления следов иона хлора и переносится в 0,2 п. раствор сульфата алюминия, причем количество последнего берется из расчета 200 мл на 100 мл раствора жидкого стекла. (]1месь геля исул1,фата алюминия нагревается 3—4 ч па водяной бане, а затем, овгорячей водой до исчезновения иона SO4. Для полного удаления сульфатов гель повторно кипятят с водой, затем отделяют от воды и просушивают в сушильном шкафу. В процессе сушки температура в течение 6 ч медленно новыша( тся от комнатной до 110 °С. Высушенный таким образом гель активируется пропусканием через него воздуха при 350 °С в продолжение 2—3 ч. [c.56]
Контур рабочего тела аммиачной компрессионной холодильной машины включает основное хол1)дильное оборудование (компрессоры X, конденсаторы V///, испарители ///, автоматические дроссельные устройства /V) и вспомогательные аппараты (отделители жидкости X/, маслоотделители /X, ресиверы V, приборы автоматического регулирования и контроля, арматуру). Пары аммиака из испарителя III отсасываются компрессором X и нагнетаются в конденсатор VII (, где сжижаются, отдавая тепло охлаждающей воде. Жидкий аммиак через дроссельное устройство IV подается в испаритель, где превращается в пар, воспринимая тепло. [c.174]
Процесс осуществляют в реакторах типа барботажных колонн, причем схема реакционного узла аналогична изображенному на рис. 42,а (стр. 126). Из отходящего газа после холодильника отделяют конденсат, а избыточный хлористый водород направляют на абсорбцию водой. Жидкий продукт, стекающий через боковой перелив колонны, нейтрализуют щелочью и перегоняют. В случае синтеза хлорнстого этила кроме описанной схемы возможна и другая (рис. 42,6), когда выделяющееся тепло отводится только обратным конденсатом за счет испарения продукта в реакторе. Из-за высокой летучести хлористого этила его необходимо извлекать из отходящего газа (абсорбцией или адсорбцией). [c.132]
Схема приема аммиака с применением компрессора, создаю--щего в приемной емкости более низкое давление, чем в железнодорожной цистерне, приведена на рис. VIII. 10. Этим же компрессором отсасываются -остатки аммиака из цистерны после ее опорожнения. Пары аммиака через отделитель жидкости 2 отсасываются из емкости 8, сжимаются компрессором 4 до 1,4 МПа и поступают в маслоотделитель 5 и конденсатор-холодильник 6. В аппаратах 5 и 6 происходит конденсация паров аммиака (в, маслоотделителе 5 за счет непосредственного контакта с холодным аммиаком, а в конденсаторе-холодильнике 6 —в результате охлаждения водой). Жидкий аммиак из цистерны 1 самотеком поступает в емкость для хранения аммиака 8. Сюда же подается жидкий аммиак из линейных ресиверов 3. Из емкости 8 аммиак откачивается потребителям за счет разности давлений, создаваемой в приемных резервуарах установок-потребителей компрессорами этих установок. [c.237]
Низкотемпературная конденсация, при которой газ в результате охлаждения превращается в двухфазную систему, механически затем разделяемую на жидкость и газ. В качестве охлаждающих агентов используются вода, жидкий аммиак и сжиженные этан и пропан. В некоторых случаях конденсация сочетается со сжатием газа, что способствует сжижению тяже-локипящих компонентов разделяемого газа. [c.197]
Чтобы затраты энергии на процесс опреснения были минимальными, необходимо избегать колебаний температуры подаваемой на вымораживание воды, поскольку в противном случае возможно попеременное протекание процессов ее замерзания и таяния. Для обеспечения постоянства температуры замораживания следует применять один и тот же хладагент. Так как точка замерзания водносолевых растворов практически равна О °С, желательно, чтобы температура замораживания была немного ниже (чистый нормальный бутан при атмосферном давлении закипает при —1 °С). Процесс вымораживания морской воды осуществляется путем продувки через исходную сырьевую воду жидкого нормального бутана, который, испаряясь, барботнрует воду и в виде паровой фазы покидает раствор, где идет процесс опреснения. Образовавшийся лед снимается с поверхностного слоя рапы, в котором концентрация солей наиболее высокая. Для предотвращения нагрева рапы и образующегося льда сырую воду предварительно охлаждают, а пары нор- [c.367]
Ввиду большого содержания жидкости в потоке ГЖС, а также воды в жидкости, то есть при относительно высоком значении соотношения вода жидкие углеводороды , для обработки трубопроводов рекомендуют применять водорастворимые или высоковододиспергируемые ингибиторы. При введении в трубопровод сверху через газовую фазу такой ингибитор должен преодолеть слой углеводородной жидкости, рассола и достичь поверхности металла. Одно из важных требований к ингибитору в данном случае — необходимость распределения между жидкими фазами вода углеводороды в соотношении 5 1 соответственно. Причем в водной фазе концентрация ингибитора должна составлять 200 мг/л, а в углеводородной — около 40 мг/л. При приведенных концентрациях ингибитор обеспечивает степень защиты не менее 80%. [c.332]
Действительно, если бы выбранное Вами соотношение было справедливо, переход воды из парообразного в жидкое состояние сопровождался бы понижением ее изобарно-изотермического потенциала, что, в свою очередь, приводило бы к уменьшению изобарногв потенциала рассматриваемой системы, состояш,ей из воды (жидкой) и влажного воздуха (строго говоря, для водяного пара, входящего в состав газовой смеси, следовало бы пользоваться химическим потенциалом, однако при нормальном давлении компоненты атмо- [c.168]
Основными методами повышения нефтеотдачи пластов являются такие методы интенсификации добычи нефти, как поддержание пластового давления путем законтурного и внутрикон-турного заводнений с разрезанием крупных площадей на отдельные участки, осевого и сводового заводнений (при разработке нефтяных залежей с резко ухудшенной проницаемостью в законтурной части пласта), очагового заводнения и др. В настоящее время широко применяются новые методы разработки нефтяных месторождений путем применения для закачки растворов неионогенных ПАВ карбонизированной воды жидких растворителей сухого газа при высоком давлении горячей воды пара (внутри-пластового движущегося очага горения) шахтного способа разработки. Эти методы разработки наряду с интенсификацией добычи нефти направлены в основном на увеличение конечной нефтеотдачи. [c.172]
Поверхностно-активные свойства веществ обусловлены ди-фильиостью (или амфифильностью) их молекул. Так, молекулы мыл и СМС имеют гидрофобный углеводородный хвост и гидро-филы1ую головку (диссоциирующую солевую, например карбонатную или сульфитную фуппировку, цвиттер-ионную фуппировку и т.п.). При этом за счет гидрофобно-гидрофильных взаимодействий в системах с водными растворами такие молекулы выстраиваются на поверхности раздела водный раствор/гидрофобная твердая или не смешивающаяся с водой жидкая фаза , ориентируя гидрофильные головки в сторону воды, а гидрофобный хвост — в сторону гидрофобной фазы (рис. 14.3). [c.267]
В парах фторовопорода находятся полимерные молекулы (НР)я при температуре кипения НР среднее значение п близко к 4. Способность к ассоциации молекул характерна для воды, жидкого аммиака, спиртов и многих других жидкостей (в отличие от неассоциированных жидкостей, например углеводородов). Ассоциация приводит к повышению температуры плавления, температуры кипения и теплоты парообразования и др. [c.141]
chem21.info
Криоланг | Журнал Популярная Механика
Об истории советских дыхательных аппаратов на жидком воздухе — криолангов — известно совсем немного. Фактически единственный источник достоверной информации по этой теме — это статья в журнале «Спортсмен-подводник» за 1977 год, где описывается АК-3, разработанный в Харьковском физико-техническом институте низких температур (ХФТИНТ). Зато о криолангах ходит множество слухов.

Дмитрий Мамонтов
23 июня 2009 01:17
Говорят, что они были сложными, громоздкими, тяжелыми и ненадежными. Еще говорят, что, поскольку газ в них хранился в жидком виде, вдыхаемый воздух был очень холодным и у аппаратов часто обмерзали редукторы. Еще утверждают, что они были экономически невыгодными. И все это не соответствует действительности.
Жизнь Анатолия Витюка, поступившего в 1969 году в Одесский технологический институт холодильной промышленности (ОТИХП), изменила заметка в иностранном научном журнале. В ней упоминался перспективный подход к конструированию дыхательного аппарата, в котором воздух хранился не в толстостенных баллонах высокого давления, а в легких и компактных сосудах Дьюара. Это позволяло увеличить время автономной работы в три раза и значительно снизить массу и габариты аппаратов. «Я увлекался подводным плаванием с аквалангом, закончил курсы ДОСААФ, — вспоминает Анатолий. — Приходилось постоянно таскать тяжелые баллоны, и я тогда подумал — почему бы не разработать такой аппарат? Как известно, лень — двигатель прогресса. Это и предопределило тему моих диплома и диссертации, а также дальнейших работ».

Немного истории
Первые попытки создания криогенных дыхательных аппаратов относятся к началу XX века. Тогда в Германии (1905) и в России (1911) были предложены подобные аппараты для горноспасательных работ в шахтах (низкая температура жидкого кислорода к тому же позволяла снизить температуру вдыхаемого газа, что уменьшало вероятность перегрева). Криогенные аппараты для подводных погружений начали разрабатываться в конце 1960-х. Американские и французские инженеры планировали применять криоланги при обслуживании морских буровых платформ. В СССР первые аппараты были разработаны и изготовлены в ХФТИНТ. По заказу военных там создавали криогенные аппараты с замкнутым циклом дыхания с использованием жидкого кислорода и азота и газообразного гелия, причем состав смеси регулировался в зависимости от глубины без всякой электроники — на основе зависимости температуры кипения газа от давления. В Харькове были сконструированы и более простые в использовании гражданские аппараты с открытой схемой дыхания — криоланги АК-3 и АК-5, опытная партия последних была передана в середине 1970-х в Аварийно-спасательную службу Киева для испытаний.
В 1974 году Анатолий Витюк, к тому времени уже закончивший институт, предложил организовать на базе кафедры криогенной техники, которую возглавлял профессор Вячеслав Андреевич Наер, новую лабораторию криогенных систем жизнеобеспечения. Завкафедрой поддержал начинание, и в новой лаборатории началась работа. «За шесть лет я и мои коллеги Александр Балетов, Александр Сысоев и Николай Тешин разработали несколько моделей газотеплозащитных систем для работы при высоких температурах для пожарных и спасателей, — вспоминает Анатолий. — Но нашей самой любимой темой оставались перспективные водолазные системы».
 Криогенный водолазный комплекс (КВК) А) Водолазная бортовая криогенная станция (БКС-2). 1 — криогенный блок (БК), 2 — пульт контроля и управления (ПКУ, на снимке вверху), 3 — водолазный шланг, 4 — плавсредство. Б) Легководолазная станция «МАКС-1». 1 — БК, 2 — балластная емкость, 3 — водолазный шланг, 4 — основание. В) Буксируемый аппарат «ЮГ-7м». 1 — БК, 2 — аппарат. Г) Система заправки. 1 — БК, 2 — АКДА-2, 3 — сосуды Дьюара.
Криогенный водолазный комплекс (КВК) А) Водолазная бортовая криогенная станция (БКС-2). 1 — криогенный блок (БК), 2 — пульт контроля и управления (ПКУ, на снимке вверху), 3 — водолазный шланг, 4 — плавсредство. Б) Легководолазная станция «МАКС-1». 1 — БК, 2 — балластная емкость, 3 — водолазный шланг, 4 — основание. В) Буксируемый аппарат «ЮГ-7м». 1 — БК, 2 — аппарат. Г) Система заправки. 1 — БК, 2 — АКДА-2, 3 — сосуды Дьюара.
Закрытый и открытый цикл
В лаборатории был разработан автономный криогенный дыхательный аппарат замкнутого цикла дыхания АКДА-1, который обеспечивал дыхание человека в загазованной среде или при погружениях на небольшие глубины. Придумать более простую конструкцию было просто невозможно. Аппарат имел два регенератора, пористую насадку, пропитанную жидким кислородом, дыхательный мешок и загубник. При выдохе газ поступал во влагонакопитель, а затем в регенератор, где охлаждался за счет испарения жидкого кислорода. Углекислый газ в выдыхаемом воздухе вымерзал, никаких химических поглотителей не требовалось. Пройдя через второй регенератор, газ нагревался и попадал в дыхательный мешок. При вдохе он вновь проходил через регенераторы, а затем, очищенный от углекислоты и увлажненный во влагонакопителе, поступал к загубнику. Аппарат весом 3 кг обеспечивал дыхание в течение 30 минут. Для работы под водой к дыхательному мешку подсоединялся через редуктор баллон с азотом, что обеспечивало необходимое снижение концентрации кислорода в смеси.
 Как устроен криоланг АКДА-2 Аппарат состоит из двухстенного баллона 1, выполненного в виде сосуда Дьюара с экранно-вакуумной изоляцией 2 и заправочной горловины 3. Внутри баллона, в верхней и нижней части, установлены криогенные разделители фаз 4 с насадками из пористого никеля (диаметр пор 6−10 мкм), которые обеспечивают отбор жидкого воздуха при любом положении аппарата под водой. Для испарения и подогрева жидкого воздуха в аппарате предусмотрены теплообменники 5,6,7 и 8. Для регулирования рабочего давления и подачи воздуха для дыхания установлены автоматический клапан 9, вентиль резерва 10, предохранительный клапан 11 и легочный автомат 12. После заправки методом перелива горловина закрывается завинчивающейся пробкой; за счет небольших теплопритоков из окружающей среды давление внутри баллона поднимается. При включении клапана легочного автомата 12 жидкий воздух поступает из разделителей фаз 4 последовательно в теплообменники 8,5 и 6, где происходит его испарение и подогрев. Тепло в теплообменнике 5 передается жидкому воздуху, что вызывает рост давления в баллоне. Подогретый в теплообменнике 6 воздух через автоматический клапан 9 поступает в легочный автомат. При достижении в баллоне 1 рабочего давления клапан 9 перекрывает подачу воздуха через теплообменники 5 и 6, и дальнейшая подача воздуха к легочному автомату происходит только через теплообменник 8. Аппарат готов к работе. После расходования жидкого воздуха в аппарате остается резервный (около 0,5 кг), так как разделители фаз установлены не у самых днищ. Пористые насадки перестают смачиваться жидкостью, возникает сопротивление дыханию: газовая фаза из-за малого размера пор плохо проходит через насадки. В этом случае водолаз устанавливает вентиль 10 в положение «Резерв», и воздух начинает поступать из баллона напрямую через теплообменник 7. Уровень жидкого воздуха контролируется магнитным поплавком и набором герконов.
Как устроен криоланг АКДА-2 Аппарат состоит из двухстенного баллона 1, выполненного в виде сосуда Дьюара с экранно-вакуумной изоляцией 2 и заправочной горловины 3. Внутри баллона, в верхней и нижней части, установлены криогенные разделители фаз 4 с насадками из пористого никеля (диаметр пор 6−10 мкм), которые обеспечивают отбор жидкого воздуха при любом положении аппарата под водой. Для испарения и подогрева жидкого воздуха в аппарате предусмотрены теплообменники 5,6,7 и 8. Для регулирования рабочего давления и подачи воздуха для дыхания установлены автоматический клапан 9, вентиль резерва 10, предохранительный клапан 11 и легочный автомат 12. После заправки методом перелива горловина закрывается завинчивающейся пробкой; за счет небольших теплопритоков из окружающей среды давление внутри баллона поднимается. При включении клапана легочного автомата 12 жидкий воздух поступает из разделителей фаз 4 последовательно в теплообменники 8,5 и 6, где происходит его испарение и подогрев. Тепло в теплообменнике 5 передается жидкому воздуху, что вызывает рост давления в баллоне. Подогретый в теплообменнике 6 воздух через автоматический клапан 9 поступает в легочный автомат. При достижении в баллоне 1 рабочего давления клапан 9 перекрывает подачу воздуха через теплообменники 5 и 6, и дальнейшая подача воздуха к легочному автомату происходит только через теплообменник 8. Аппарат готов к работе. После расходования жидкого воздуха в аппарате остается резервный (около 0,5 кг), так как разделители фаз установлены не у самых днищ. Пористые насадки перестают смачиваться жидкостью, возникает сопротивление дыханию: газовая фаза из-за малого размера пор плохо проходит через насадки. В этом случае водолаз устанавливает вентиль 10 в положение «Резерв», и воздух начинает поступать из баллона напрямую через теплообменник 7. Уровень жидкого воздуха контролируется магнитным поплавком и набором герконов.
А вот при конструировании аппарата открытого цикла дыхания АКДА-2 конструкторы столкнулись с проблемой. Дело в том, что жидкий воздух представляет собой смесь жидких азота (79%) и кислорода (21%), температуры кипения которых отличаются. Азот кипит при более низкой температуре, поэтому в газовой фазе содержание кислорода составляет всего около 7%, и использовать ее для дыхания нельзя. Нужно забирать из сосуда жидкий воздух, испарять его (газифицировать) с помощью теплообменников и подавать для дыхания к легочному автомату, причем при любом положении сосуда Дьюара. «В харьковских аппаратах для этого использовались качающиеся на сильфонах заборные патрубки и подвижный гравитационный клапан, — говорит Анатолий. — Патрубки во время движения постукивали по стенкам сосуда изнутри, что нервировало водолазов, поэтому мы использовали другое решение. Я 'подсмотрел' его у конструкторов космической техники, которые для подвода топлива из баков к двигателям в условиях невесомости используют капиллярный эффект, устанавливая на топливозаборниках специальные 'губки'. Эксперименты с водой и войлоком показали работоспособность концепции, а для работы с жидким воздухом в итоге был выбран пористый никель с размерами пор 6−10 мкм». Насадки из пористого никеля работали как разделители фаз — они за счет смачиваемости отбирали жидкий воздух, а газовую фазу не пропускали. Две такие насадки в верхней и нижней частях баллона обеспечивали подачу воздуха при любом положении водолаза. Такая система позволила значительно упростить аппарат, оставив только два клапана и убрав редуктор (в АК-5 использовались редуктор и восемь клапанов), что положительно сказалось на его надежности.
 Легководолазная станция С помощью станции «МАКС-1» осуществлялись подъем и спуск водолазов, рабочего инструмента, питание воздухом и продувка небольших понтонов и балластных емкостей. Отсутствие шлангов, связывающих водолазов с плавсредствами, и габаритных дыхательных аппаратов за спиной водолаза делало возможным проведение подводных работ в труднодоступных местах. Конструкция станции: 1 — блок хранения, 1 — компенсатор плавучести, 3 — теплоизолированные емкости, 4 — верхний колпак с приборами и рукоятками управления, 5 — нижний колпак с теплообменной аппаратурой, 6 — шланги для подачи дыхательной смеси и горячей воды.
Легководолазная станция С помощью станции «МАКС-1» осуществлялись подъем и спуск водолазов, рабочего инструмента, питание воздухом и продувка небольших понтонов и балластных емкостей. Отсутствие шлангов, связывающих водолазов с плавсредствами, и габаритных дыхательных аппаратов за спиной водолаза делало возможным проведение подводных работ в труднодоступных местах. Конструкция станции: 1 — блок хранения, 1 — компенсатор плавучести, 3 — теплоизолированные емкости, 4 — верхний колпак с приборами и рукоятками управления, 5 — нижний колпак с теплообменной аппаратурой, 6 — шланги для подачи дыхательной смеси и горячей воды.
Плюсы и минусы
Первыми оценили новые аппараты водолазы Михаил Боргуль и Владимир Бернатович. По отзывам испытателей, криоланги не только не уступали обычным аквалангам по простоте и удобству эксплуатации, но и превосходили их по многим параметрам. Аппарат заправлялся жидким воздухом простым переливом из сосудов Дьюара, при этом можно было легко и быстро обеспечить любую концентрацию кислорода. Анатолий Витюк вспоминает: «Мы просто ставили сосуд Дьюара на весы и по весу смешивали необходимые количества жидких газов. Занимало это считанные минуты, но для непосвященных выглядело как алхимические эксперименты — с кипящим воздухом и клубами пара». Еще одним важным достоинством криолангов было то, что в жидком воздухе гарантированно отсутствовали углекислота и угарный газ. При заправке обычных аквалангов для очистки воздуха от этих газов используются специальные фильтры, поскольку под давлением они могут быть смертельны для человека: известен случай, когда Жак-Ив Кусто и его напарник Фредерик Дюма едва не погибли во время погружения в августе 1946 года, из-за того что в баллоны попал угарный газ от выхлопа двигателя компрессора.
Аппарат был очень компактным и легким: скажем, двухбаллонный акваланг имеет объем 14 л и весит более 25 кг, а криоланг с таким же запасом воздуха — 3 л и 4 кг. Разумеется, при погружениях с аквалангом вес на воздухе не играет особой роли, потому что все равно приходится брать множество грузов для компенсации плавучести гидрокостюма. С этой точки зрения небольшой вес криоланга — скорее минус (требуется брать больше грузов), а вот компактность очень полезна при погружениях в тесном пространстве (например, на затонувшие объекты).
www.popmech.ru
Почему вода жидкая?! Помогите плз
Почему вода жидкая?! Помогите плз
Ответы:
Вода имеет особую структуру, благодаря которой принимает вид жидкости. Она может литься, течь и капать. В кристаллах твердых веществ имеется строго упорядоченная структура. В газообразных веществах структура выражена как полный хаос. Вода же – промежуточная структура между твердым и газообразным веществом. Частицы в структуре воды расположены на небольших расстояниях друг от друга и относительно упорядоченно. Но поскольку частицы со временем удаляются друг от друга, то и порядок структуры быстро исчезает. Силы межатомного и межмолекулярного воздействия задают между частицами среднее расстояние. Молекулы воды состоят из атомов кислорода и водорода, где атомы кислорода одной молекулы притягиваются к атомам водорода другой молекулы. Образуется уникальная цепочка водородных связей, которая и придает воде определенные свойства текучести, при этом структура самой воды практически идентична структуре кристалла. С помощью многочисленных опытов было выявлено то, что вода сама задает себе структуру в свободном объеме.
Вода имеет особую структуру, благодаря которой принимает вид жидкости. Она может литься, течь и капать. В кристаллах твердых веществ имеется строго упорядоченная структура. В газообразных веществах структура выражена как полный хаос. Вода же – промежуточная структура между твердым и газообразным веществом. Частицы в структуре воды расположены на небольших расстояниях друг от друга и относительно упорядоченно. Но поскольку частицы со временем удаляются друг от друга, то и порядок структуры быстро исчезает. Силы межатомного и межмолекулярного воздействия задают между частицами среднее расстояние. Молекулы воды состоят из атомов кислорода и водорода, где атомы кислорода одной молекулы притягиваются к атомам водорода другой молекулы. Образуется уникальная цепочка водородных связей, которая и придает воде определенные свойства текучести, при этом структура самой воды практически идентична структуре кристалла. С помощью многочисленных опытов было выявлено то, что вода сама задает себе структуру в свободном объеме. При соединении воды с твердыми поверхностями, структура воды начинает объединяться со структурой поверхности. Так как структура граничащего слоя воды остается без изменений, то начинают меняться его физико-химические свойства. Меняется вязкость воды. Появляется возможность растворять вещества с определенной структурой и свойствами. Вода изначально представляет собой прозрачную бесцветную жидкость. Физические свойства воды можно называть аномальными, так как она имеет довольно высокую температуру кипения и замерзания. У воды имеется поверхностное натяжение. Например, она имеет аномально высокие температуры замерзания и кипения, а также поверхностное натяжение. Удельные пороги испарения и плавления у воды значительно выше, чем у каких-либо других веществ. Удивительная особенность в том, что плотность воды выше, чем плотность льда, что позволяет льду плавать на поверхности воды. Все эти чудесные свойства воды, как жидкости, снова объясняются существованием в ней тех водородных связей, которыми связаны молекулы. Строение молекулы воды из трех атомов в геометрической проекции тетраэдра приводит к возникновению очень сильного взаимного притяжения молекул воды друг к другу. Всё дело в водородных связях молекул, ведь каждая молекула может образовать четыре абсолютно одинаковые водородные связи с другими молекулами воды. Этот факт и объясняет то, что вода – жидкая. Не секрет, что пресной воды на земле становиться меньше и ученые задумываются, как можно решить вопрос с помощью химических свойств добывать пресную воду. Текучие свойства воды позволяют выяснить, каким образом можно изменить и повлиять на воду для получения пресной, пригодной для питья, воды. Вода в жидком состоянии может производить энергию, насыщать землю, питать растения и организмы, давая возможность жизни. От воды и ее поведения на земле зависят многие события и погода.
cwetochki.ru

 NaHCO3+Ch4COOH→Ch4COONa+h3O+CO2↑{\displaystyle {\mathsf {NaHCO_{3}+CH_{3}COOH\rightarrow CH_{3}COONa+H_{2}O+CO_{2}\uparrow }}}
NaHCO3+Ch4COOH→Ch4COONa+h3O+CO2↑{\displaystyle {\mathsf {NaHCO_{3}+CH_{3}COOH\rightarrow CH_{3}COONa+H_{2}O+CO_{2}\uparrow }}} 2Ch4COOH+CaCO3→Ca(Ch4COO)2+h3O+CO2↑{\displaystyle {\mathsf {2CH_{3}COOH+CaCO_{3}\rightarrow Ca(CH_{3}COO)_{2}+H_{2}O+CO_{2}\uparrow }}}
2Ch4COOH+CaCO3→Ca(Ch4COO)2+h3O+CO2↑{\displaystyle {\mathsf {2CH_{3}COOH+CaCO_{3}\rightarrow Ca(CH_{3}COO)_{2}+H_{2}O+CO_{2}\uparrow }}} h3SO4+2KOH→K2SO4+2h3O{\displaystyle {\mathsf {H_{2}SO_{4}+2KOH\rightarrow K_{2}SO_{4}+2H_{2}O}}}
h3SO4+2KOH→K2SO4+2h3O{\displaystyle {\mathsf {H_{2}SO_{4}+2KOH\rightarrow K_{2}SO_{4}+2H_{2}O}}} HNO3+Nh5OH→Nh5NO3+h3O{\displaystyle {\mathsf {HNO_{3}+NH_{4}OH\rightarrow NH_{4}NO_{3}+H_{2}O}}}
HNO3+Nh5OH→Nh5NO3+h3O{\displaystyle {\mathsf {HNO_{3}+NH_{4}OH\rightarrow NH_{4}NO_{3}+H_{2}O}}} 2Ch4COOH+Ba(OH)2→Ba(Ch4COO)2+2h3O{\displaystyle {\mathsf {2CH_{3}COOH+Ba(OH)_{2}\rightarrow Ba(CH_{3}COO)_{2}+2H_{2}O}}}
2Ch4COOH+Ba(OH)2→Ba(Ch4COO)2+2h3O{\displaystyle {\mathsf {2CH_{3}COOH+Ba(OH)_{2}\rightarrow Ba(CH_{3}COO)_{2}+2H_{2}O}}}



 h3O+F2→HF+HOF{\displaystyle {\mathsf {H_{2}O+F_{2}\rightarrow HF+HOF}}}
h3O+F2→HF+HOF{\displaystyle {\mathsf {H_{2}O+F_{2}\rightarrow HF+HOF}}} (при низких температурах) 3h3O+2IF5→5HF+HIO3{\displaystyle {\mathsf {3H_{2}O+2IF_{5}\rightarrow 5HF+HIO_{3}}}}
(при низких температурах) 3h3O+2IF5→5HF+HIO3{\displaystyle {\mathsf {3H_{2}O+2IF_{5}\rightarrow 5HF+HIO_{3}}}} 9h3O+5BrF3→15HF+Br2+3HBrO3{\displaystyle {\mathsf {9H_{2}O+5BrF_{3}\rightarrow 15HF+Br_{2}+3HBrO_{3}}}}
9h3O+5BrF3→15HF+Br2+3HBrO3{\displaystyle {\mathsf {9H_{2}O+5BrF_{3}\rightarrow 15HF+Br_{2}+3HBrO_{3}}}}

 h3O+C⇄ CO+h3{\displaystyle {\mathsf {H_{2}O+C\rightleftarrows \ CO+H_{2}}}}
h3O+C⇄ CO+h3{\displaystyle {\mathsf {H_{2}O+C\rightleftarrows \ CO+H_{2}}}}
 в основном состоянии: (1a1)1(1b2)2(1b1)2(2b2)0(3a1)0.{\displaystyle (1a_{1})^{1}(1b_{2})^{2}(1b_{1})^{2}(2b_{2})^{0}(3a_{1})^{0}.}
в основном состоянии: (1a1)1(1b2)2(1b1)2(2b2)0(3a1)0.{\displaystyle (1a_{1})^{1}(1b_{2})^{2}(1b_{1})^{2}(2b_{2})^{0}(3a_{1})^{0}.} Молекула имеет замкнутую оболочку, неспаренных электронов нет. Заняты электронами четыре молекулярные орбитали (МО) — по два электрона на каждой МО ϕi{\displaystyle \phi _{i}}
Молекула имеет замкнутую оболочку, неспаренных электронов нет. Заняты электронами четыре молекулярные орбитали (МО) — по два электрона на каждой МО ϕi{\displaystyle \phi _{i}} , один со спином α{\displaystyle \alpha }
, один со спином α{\displaystyle \alpha } , другой со спином β{\displaystyle \beta }
, другой со спином β{\displaystyle \beta } , или 8 спин-орбиталей ψ{\displaystyle \psi }
, или 8 спин-орбиталей ψ{\displaystyle \psi } . Волновая функция молекулы, Ψ{\displaystyle \Psi }
. Волновая функция молекулы, Ψ{\displaystyle \Psi } , представленная единственным детерминантом Слэтера Ф, имеет вид
, представленная единственным детерминантом Слэтера Ф, имеет вид 




















