Содержание
Физика воды | Обучонок
Автор работы:
Бадакшанова Фяридя Рамильевна
Руководитель проекта:
Новинская Елена Алексеевна
Учреждение:
МКОУ «СОШ №2 ЗАТО п. Солнечный»
В процессе работы над исследовательским проектом по физике «Физика воды» ученицей 7 класса была поставлена цель выяснить особенности, некоторые свойства воды и возможности их использования в жизни человека.
Подробнее о работе:
В исследовательской работе по физике «Физика воды» изложена теоретическая информация о воде, дана ее химическая и физическая характеристика, изучена роль воды в организме человека, а также представлен список невероятных фактов о воде, которые расширят энциклопедические знания об изучаемом веществе.
В предложенном проекте по физике «Физика воды» автором были проведены опыты с водой, с помощью которых были выяснены результаты взаимодействия воды с другими предметами, а также свойства воды и сфера ее применения в жизни человека в разных ее состояниях и при разном температурном режиме.
Оглавление
Введение
1. Значение воды.
2. Состав воды.
3. Физические свойства воды.
4. Опыт с яйцом.
5. Опыт с растительным маслом.
6. Опыт со сверхохлажденной водой.
7. Опыт с кипятком на морозе (#дубакчеллендж).
8. Интересные факты о воде.
10. Применение воды в жизни человека.
Заключение
Список литературы
Приложения
Введение
Актуальность. Тема моей исследовательской работы «Физика воды». Вода – драгоценный дар природы, обеспечивающая жизнь на Земле. Но многие люди думают что вода не имеет какие-либо особенности.
На самом деле, окружающая нас вода — это вещество с уникальными свойствами, которые не только еще полностью не объяснены, но далеко не все известны. Нет вещества, более удивительного и загадочного, чем обыкновенная вода. Мне стало интересно узнать об этой жидкости, о её необычных свойствах и я решила их изучить, проделав некоторые опыты.
Цель работы: Выяснить особенности, некоторые свойства воды и возможности их использования в жизни человека.
Задачи:
- Собрать и проанализировать информацию о воде.
- Изучить физические свойства воды.
- Провести опыты с водой.
- Узнать области применения воды.
- Сравнить результат с теоретическими знаниями.
Методы исследования:
- Изучение теоретических материалов
- Наблюдение
- Проведение опытов
- Анализ.
- Фото- и видеосъёмка
Вода, у тебя нет ни вкуса, ни цвета, ни запаха. Тебя невозможно описать, тобой наслаждаются, не ведая, что ты такое! Нельзя сказать, что ты необходима для жизни: ты — сама жизнь. Ты самое большое богатство на свете.
Антуан де Сент-Экзюпери
Нет на Земле вещества более важного для нас, чем обыкновенная вода, и в то же время не существует другого такого же вещества, в свойствах которого было бы столько противоречий и аномалий, сколько в её свойствах. Молекулы воды обнаружены в межзвёздном пространстве. Вода входит в состав комет, большинства планет солнечной системы и их спутников.
Молекулы воды обнаружены в межзвёздном пространстве. Вода входит в состав комет, большинства планет солнечной системы и их спутников.
Чистая вода без примесей — это жидкость без запаха, вкуса и цвета с температурой кипения + 100 С и температурой замерзания = 0 С. Распространение воды на Земле: 95% — мировой океан 2% — подземные воды 2% — ледники 0,02% — рек. Все живые животные и растительные существа также состоят из воды: животные – на 75%, рыбы – на 75%, медузы – на 99%, картофель — на 76%, яблоки — на 85%, помидоры — на 90%, огурцы — на 95%, арбузы — на 96%. Тело человека почти на 63 – 68 % состоит из воды. 86% воды содержится в теле у новорожденного и до 50% у пожилых людей.
Т.к. вода имеет очень большую удельную теплоемкость, она является хорошим теплоносителем. Вспомните, например, водяное отопление у нас дома или «отопление» Европы теплым течением Гольфстрим. Медленное повышение температуры воды при нагревании и соответственно выделение значительных количеств теплоты при охлаждении смягчают колебания температуры вблизи больших водоемов.
Благодаря высокой теплоте парообразования живые организмы (не только животные, но и растения) получили возможность избавляться от избытков тепла в организме, испаряя воду с поверхности тел. В отличие от других способов теплообмена живых организмов с окружающей средой (излучения, конвекции, теплопередачи) испарение позволяет охлаждать тело даже в том случае, когда температура окружающей среды выше, чем температура тела.
Вода – это важный источник энергоресурсов. Вода — это вещество, которое создало нашу планету, и наша жизнь без нее невозможна!
Перейти к разделу: 2. Состав воды
Физики показали, что вода превращается в две жидкости при низких температурах
Наука
19 августа 2022
Далее
Александр
Шереметьев
новостной редактор
Александр
Шереметьев
новостной редактор
Исследователи подтвердили, что при низких температурах вода может превращаться в другую, более плотную жидкость.
Читайте «Хайтек» в
Новый вид «фазового перехода» в воде был впервые предложен 30 лет назад в исследовании ученых из Бостонского университета. Авторы исследования тогда предположили, что при значительном охлаждении жидкая вода должна разделяться на две формы с разной плотностью.
Однако экспериментально подтвердить эту гипотезу пока не удавалось, потому что переход должен происходить при температурах, когда в нормальных условиях вода превращается в лед. В статье, опубликованной в журнале Nature Physics, исследователи из Бирмингемского университета и университета Сапиенца в Риме приводят доказательства существования «плотной воды».
Физики использовали компьютерное моделирование, чтобы объяснить, какие особенности отличают две жидкости на микроскопическом уровне. Они обнаружили, что молекулы воды в жидкости с высокой плотностью образуют структуры, которые считаются «топологически сложными», такие как узел-трилистник (похоже на крендель) или связь Хопфа (напоминает звенья цепи). Напротив, молекулы в жидкости с низкой плотностью в основном образуют простые кольца, и, следовательно, молекулы в жидкости с низкой плотностью не запутаны.
Напротив, молекулы в жидкости с низкой плотностью в основном образуют простые кольца, и, следовательно, молекулы в жидкости с низкой плотностью не запутаны.
Компьютерная модель состояния воды с высокой плотностью. Изображение: Andreas Neophytou et al., Nature Physics
Исследователи использовали в своем моделировании коллоидную и молекулярные модели воды. Коллоиды — это частицы, которые могут быть в тысячу раз больше, чем одна молекула воды. Благодаря своему относительно большему размеру и, следовательно, более медленному движению, коллоиды используются для наблюдения и объяснения физических явлений, которые также происходят в гораздо меньших атомных и молекулярных масштабах.
В этой работе мы впервые предлагаем взгляд на фазовый переход жидкость-жидкость, основанный на идеях сетевой запутанности. Я уверен, что эта работа вдохновит на новое теоретическое моделирование, основанное на топологических концепциях.
Франческо Шортино, профессор университета Сапиенца и соавтор исследования
Исследователи полагают, что разработанная ими модель, поможет спроектировать экспериментальные условия для подтверждения фазового перехода в жидкости. Кроме того, они считают, что аналогичные состояния могут наблюдаться и у других веществ, например, кремния.
Кроме того, они считают, что аналогичные состояния могут наблюдаться и у других веществ, например, кремния.
Читать далее:
Рекордный корональный выброс массы на Бетельгейзе в 400 млрд раз больше солнечного
Мегалодон съедал животное размером с косатку за раз
На Эвересте нашли следы ДНК, которой там быть не должно
Читать ещё
Физика воды | Encyclopedia.com
Почему вода мокрая? Многие люди ответят на этот вопрос, просто сказав: «Потому что это так». Физические свойства воды имеют фундаментальное значение для жизни и природы на Земле и часто принимаются как простые истины. Вода настолько распространена на Земле, что ее физические характеристики оказывают большое влияние на физику Земли в целом. (Физика изучает материю и энергию, а также взаимодействие между ними.) Вода покрывает почти три четверти поверхности планеты. Это единственное природное химическое вещество, которое существует в виде жидкости, твердого вещества (лед) и газа (водяной пар) в пределах нормального диапазона температур Земли. Вода жидкая
Вода жидкая
находится в критическом для биологической жизни диапазоне (0–100 °C, 32–212 °F), а жидкая вода присутствует практически везде на Земле. Способность воды поглощать тепло регулирует климат и погоду Земли.
Фазовые превращения
Материя существует в трех состояниях или фазах: твердом, жидком и газообразном. (Материя — это все, что имеет массу и занимает пространство). Такие вещества, как вода, переходят из одной фазы в другую при определенных температурах и давлениях. Добавьте тепло (или давление), и вещество начнет переходить из твердого состояния в жидкое при температуре плавления. Добавьте больше тепла, и вещество начнет испаряться, превращаться из жидкости в газ при температуре кипения. Уберите тепло (или давление), и вещество сконденсируется из газа в жидкость, а затем замерзнет из жидкости в твердое состояние. В твердой фазе воды ее молекулы связаны друг с другом в жестком каркасе, называемом кристаллом. (Молекула — это совокупность двух или более атомов, удерживаемых вместе химическими связями, а атом — это наименьшая единица элемента.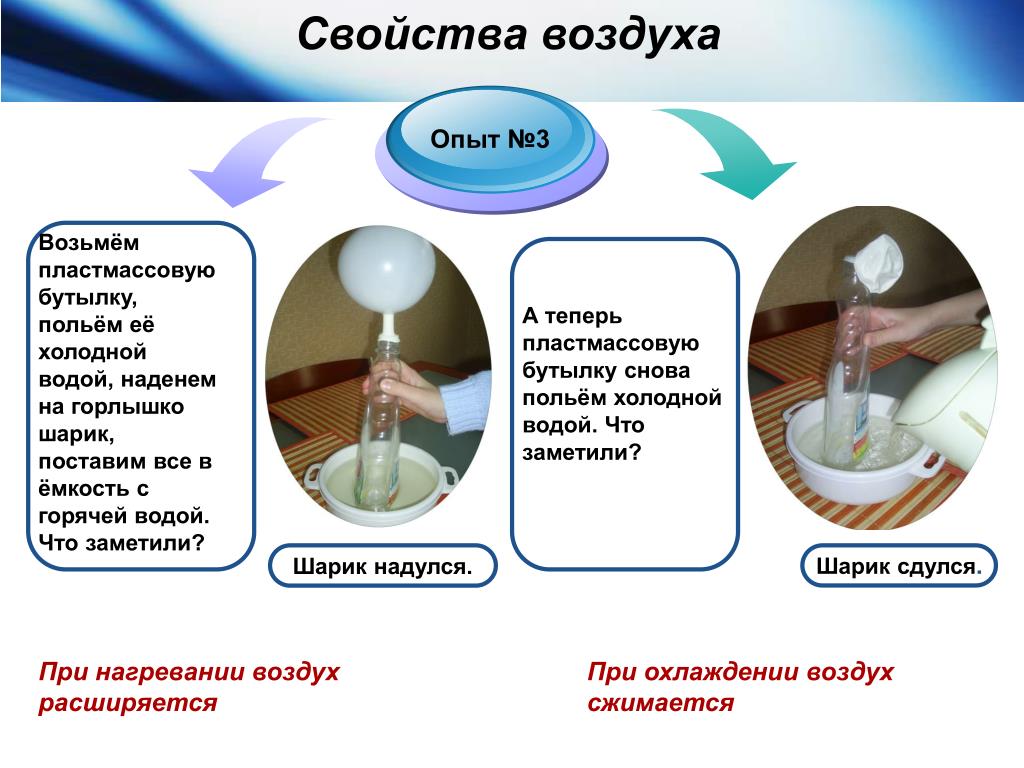 ) Молекула воды, известная под своим химическим символом H 2 O, представляет собой группу из двух атомов водорода и одного атома кислорода. В жидкой воде молекулы все еще связаны, но менее сильно, и они могут двигаться более свободно. Молекулы водяного пара полностью отделены друг от друга и смешиваются с другими типами атомов и молекул воздуха.
) Молекула воды, известная под своим химическим символом H 2 O, представляет собой группу из двух атомов водорода и одного атома кислорода. В жидкой воде молекулы все еще связаны, но менее сильно, и они могут двигаться более свободно. Молекулы водяного пара полностью отделены друг от друга и смешиваются с другими типами атомов и молекул воздуха.
Фазовые превращения используют или выделяют тепловую энергию. Плавление и кипение являются эндотермическими фазовыми переходами; они поглощают тепло. Противоположные процессы, замерзание и конденсация, выделяют тепло и называются экзотермическими фазовыми переходами. Глыба льда, находящаяся на солнце, нагревается до точки плавления воды (0°C или 32°F на уровне моря на Земле), а затем начинает таять. Температура льда остается ровно 32°F, пока он полностью не растает. В этом эндотермическом процессе тепло разрушает связи между молекулами внутри кристалла льда. После того, как лед растаял, образовавшаяся жидкая вода начинает поглощать тепло, и температура воды повышается. Когда температура воды достигает точки кипения, 212°F (100°C), химические связи между молекулами разрываются, и вода испаряется в газовую фазу. Опять же, жидкая вода остается при температуре точно 212 ° F (100 ° C) до тех пор, пока не завершится фазовый переход. Во время экзотермических реакций температура также остается неизменной до тех пор, пока не будет выделено достаточно тепла для завершения фазового перехода, например плавления.
Когда температура воды достигает точки кипения, 212°F (100°C), химические связи между молекулами разрываются, и вода испаряется в газовую фазу. Опять же, жидкая вода остается при температуре точно 212 ° F (100 ° C) до тех пор, пока не завершится фазовый переход. Во время экзотермических реакций температура также остается неизменной до тех пор, пока не будет выделено достаточно тепла для завершения фазового перехода, например плавления.
Изменения давления также могут вызвать фазовые изменения. У альпинистов в Гималаях могут быть проблемы с приготовлением пищи, потому что на большой высоте вода кипит при более низкой температуре (давление воздуха на большой высоте снижается). По этой причине они иногда носят с собой скороварки, которые повышают температуру в кастрюле, захватывая
пар и повышение давления. Смеси для тортов имеют специальные инструкции по приготовлению на высоте, напечатанные на коробке. Конькобежцы могут скользить по льду, потому что давление лезвий их коньков временно растапливает лед и образует скользкую пленку жидкой воды.
Плавучесть: Архимед и королевская корона
Архимед, математик, родившийся в 287 г. до н.э., впервые объяснил принципы перемещения жидкости и плавучести. Легенда гласит, что царь Сиракуз на острове Сицилия попросил Архимеда узнать, сделана ли его прекрасная корона из чистого золота. Король подозревал, что производитель короны украл часть золота, заменив корону серебром. Архимед рассматривал проблему царя во время купания. Он знал, что серебро менее плотное, чем золото, поэтому частично серебряная корона будет весить меньше, чем золотая корона того же размера. Когда он обдумывал способы измерения объема (количества занимаемого пространства) короны неправильной формы, он заметил, что уровень воды в бассейне поднимался, когда он входил в ванну, и падал, когда он выходил из ванны. Он поставил корону в таз, наполненный отмеренным количеством воды. Рассчитав количество воды, вытесненной короной, он правильно оценил ее объем. (По сей день кондитеры используют метод смещения Архимеда для измерения масла или жира. ) Затем он поместил корону на весы и измерил ее против груды золотых блоков того же объема. К несчастью для лживого мастера, весы склонились к золотым блокам вместо того, чтобы уравновесить корону.
) Затем он поместил корону на весы и измерил ее против груды золотых блоков того же объема. К несчастью для лживого мастера, весы склонились к золотым блокам вместо того, чтобы уравновесить корону.
Принцип плавучести Архимеда гласит, что полностью погруженный в воду объект вытесняет объем жидкости, равный его собственному объему. Восходящая сила, действующая на объект, называется выталкивающей силой и равна весу вытесненной жидкости. Если объект весит больше (имеет большую массу), чем вытесняемая им жидкость, он тонет. Если он весит меньше, выталкивающая сила толкает его вверх, и он всплывает. Бросьте стальной шар в бассейн, и он утонет, потому что его плотность больше плотности воды. Деревянный шар такого же размера будет плавать. Корабль со стальным корпусом плавает, потому что он полый, а воздух вносит свой вклад в общую массу. Добавьте груз, и корабль опустится ниже в воду. Добавьте слишком много груза, и он утонет. Подводная лодка погружается, наполняя баки водой, и всплывает, наполняя баки воздухом.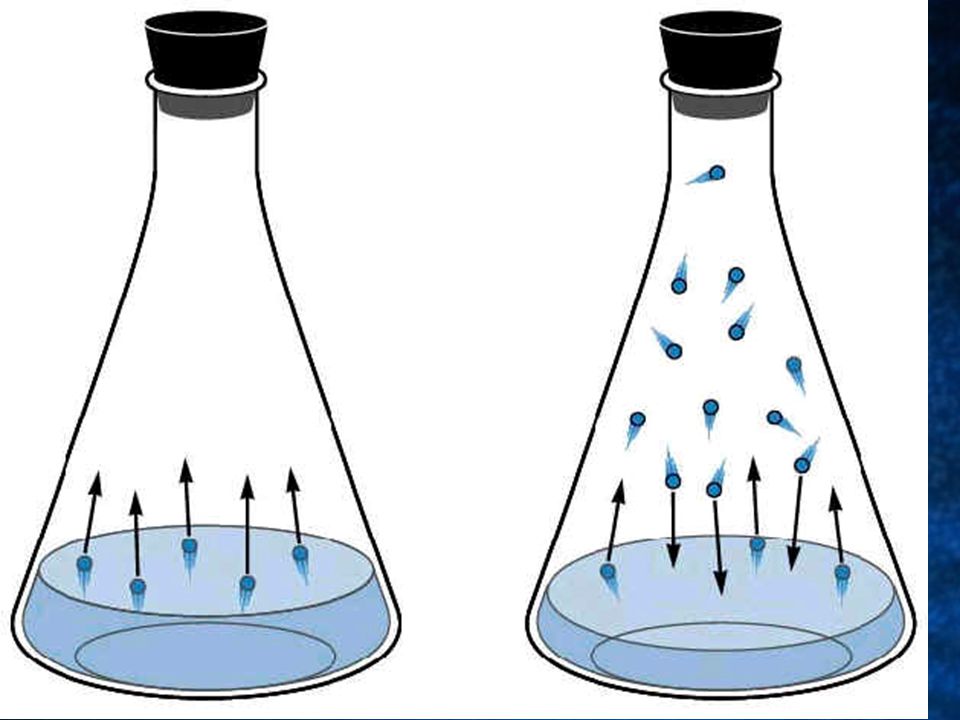 Принцип плавучести Архимеда также правильно предсказывает, что верхушка айсберга составляет примерно одну восьмую части плавучей ледяной глыбы. Лед менее плотный, чем вода, поэтому айсберги плавают. Однако они плавают большей частью своего объема ниже ватерлинии.
Принцип плавучести Архимеда также правильно предсказывает, что верхушка айсберга составляет примерно одну восьмую части плавучей ледяной глыбы. Лед менее плотный, чем вода, поэтому айсберги плавают. Однако они плавают большей частью своего объема ниже ватерлинии.
Жидкая вода
Молекулы в жидкой воде слипаются. Требуется много тепловой энергии, чтобы разрушить электрическое притяжение, называемое водородными связями, между молекулами воды. Из-за этого вода имеет высокую удельную теплоемкость; он может поглотить много тепловой энергии, прежде чем изменит температуру. Как правило, нагревание повышает температуру жидкости, заставляя ее молекулы двигаться быстрее по отношению друг к другу. В воде часть тепловой энергии используется для разрыва водородных связей между молекулами. Когда вода охлаждается, водородные связи восстанавливаются, и выделяется тепло. Из-за своей высокой удельной теплоемкости жидкая вода может хранить много энергии, и это свойство имеет серьезные последствия для климата Земли и биологической жизни.
Океаны, огромные резервуары жидкой воды на Земле, хранят и распределяют тепловую энергию солнца. Они поглощают интенсивный солнечный свет в дневное и летнее время, а затем медленно выделяют его ночью и зимой в виде океанских течений. Эти течения переносят накопленное тепло из тропиков вблизи экватора (воображаемая линия вокруг Земли между Северным и Южным полюсами) к Северному и Южному полюсам. Прибрежный и влажный климат обычно мягче, чем внутренний или засушливый (сухой) климат. Температура воды в океанах остается относительно постоянной, создавая стабильную среду для морских (океанических) экосистем (сообществ живых организмов). Вода защищает организмы от перепадов температуры. Люди, состоящие в основном из воды, могут пережить экстремальную жару и холод отчасти потому, что высокая удельная теплоемкость воды поддерживает температуру человеческого тела на уровне около 9 градусов тепла.8,6°F (37°C).
Твердая вода: лед
Ледяные поплавки. Большинство жидкостей сжимаются (стягиваются) при охлаждении и достигают максимальной плотности (массы на единицу объема) в твердом состоянии. Вода разная. Он сжимается, пока не достигает примерно 39°F (4°C), а затем расширяется, пока все его молекулы не замерзнут в кристаллическую форму воды при 32°F (0°C). Итак, холодная вода тонет, а лед плавает. Вода — единственное природное вещество на Земле, плотность которого в твердом состоянии меньше, чем в жидком. Если бы не это свойство воды, водоемы промерзали бы снизу вверх, кубики льда тонули бы в стакане с водой, и не было бы такого понятия, как айсберг (кусочки плавающего льда).
Вода разная. Он сжимается, пока не достигает примерно 39°F (4°C), а затем расширяется, пока все его молекулы не замерзнут в кристаллическую форму воды при 32°F (0°C). Итак, холодная вода тонет, а лед плавает. Вода — единственное природное вещество на Земле, плотность которого в твердом состоянии меньше, чем в жидком. Если бы не это свойство воды, водоемы промерзали бы снизу вверх, кубики льда тонули бы в стакане с водой, и не было бы такого понятия, как айсберг (кусочки плавающего льда).
Газообразная вода: водяной пар
Фазовое превращение воды из жидкости в газ происходит, когда молекулы жидкой воды высвобождаются и поднимаются, чтобы смешаться с другими типами молекул и атомов в атмосфере (массе воздуха, окружающей Землю). Кипение происходит, когда температура в объеме жидкости достигает точки, при которой все молекулы колеблются слишком быстро, чтобы оставаться связанными друг с другом. Пузырьки газа улетучиваются, и в конце концов жидкость исчезает. Молекулы воды также переходят в газообразную фазу путем испарения с поверхности воды. Молекулы воды в жидкой воде постоянно движутся. Даже при низких температурах часть менее замкнутых поверхностных молекул движется достаточно, чтобы разорвать свои связи со своими соседями и уйти в атмосферу. Вода из земных океанов, озер и рек попадает в атмосферу путем испарения и, к счастью для жизни на Земле, не путем кипячения.
Молекулы воды в жидкой воде постоянно движутся. Даже при низких температурах часть менее замкнутых поверхностных молекул движется достаточно, чтобы разорвать свои связи со своими соседями и уйти в атмосферу. Вода из земных океанов, озер и рек попадает в атмосферу путем испарения и, к счастью для жизни на Земле, не путем кипячения.
Для разрыва водородных связей в жидкой воде и образования водяного пара требуется много тепла. А притяжение молекул водяного пара друг к другу заставляет их легко конденсироваться в капли жидкой воды. Вода предпочитает быть жидкой. Вода, испаряясь с поверхности земных океанов и других водоемов, отдает тепло в атмосферу. Когда водяной пар конденсируется в капли жидкости в облаках, выделяется тепло, и воздух остается теплым. Водяной пар является важным парниковым газом в атмосфере Земли. Теплица задерживает тепло в атмосфере. Естественные парниковые газы в атмосфере согревают Землю, но не слишком. Фаза водяного пара переходит из жидкой в газообразную и обратно в жидкую, чтобы улавливать поступающую солнечную энергию.
Лори Дункан, доктор философии.
Для получения дополнительной информации
Книги
Фарндон, Джон. Вода (Научные эксперименты). Солт-Лейк-Сити: Benchmark Books, 2000.
Роуз, Кэлвин. Введение в физику окружающей среды почвы, воды и водоразделов. Нью-Йорк: Издательство Кембриджского университета, 2004.
Веб-сайты
«Архимед Сиракузский, отец плавучести». Младший инженер Университета штата Юта. http://www.engineering.usu.edu/jrestate/workshops/buoyancy/buoyancy.php (по состоянию на 1 августа 2003 г.).
«Причины цвета, почему океан синий?» Веб-выставки. http://webexhibits.org/causesofcolor/5.html (по состоянию на 6 апреля 2004 г.).
«Айсберги». Солкомхаус. http://www.solcomhouse.com/iceberg.htm (по состоянию на 16 апреля 2004 г.).
«Океан звука». Оушенлинк. http://oceanlink.island.net/oinfo/acoustics/acoustics.html (по состоянию на 4 декабря 2003 г. ).
).
«Физические свойства воды». PhysicalGeography.net. http://www.physicalgeography.net/fundamentals/8a.html (по состоянию на 16 февраля 2004 г.).
Физика воды — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 37366
Физические свойства воды
Химические и физические свойства воды часто обсуждают вместе. Эти свойства лежат в основе многих дисциплин, таких как гидрология, экологические исследования, химическая инженерия, экологическая инженерия, гражданское строительство и т. д. Они, конечно, представляют интерес для химиков и физиков.
Вот некоторые основные сведения о физических свойствах воды. Чистая жидкая вода имеет высокую теплоемкость 4,182 Дж·К9.0102 -1 г -1 ; это хороший проводник тепла, но плохой проводник электричества. Он является растворителем для растворения ионных и полярных веществ, но слабо взаимодействует с неполярными веществами. Поверхностное натяжение воды довольно велико, и небольшое количество воды скапливается в капли, а не растекается тонкими слоями.
Чистая жидкая вода имеет высокую теплоемкость 4,182 Дж·К9.0102 -1 г -1 ; это хороший проводник тепла, но плохой проводник электричества. Он является растворителем для растворения ионных и полярных веществ, но слабо взаимодействует с неполярными веществами. Поверхностное натяжение воды довольно велико, и небольшое количество воды скапливается в капли, а не растекается тонкими слоями.
Водородная связь влияет на многие физические и химические свойства, такие как необычная, но обычно известная температура замерзания 273,15 К и 373,15 К соответственно. Критические температура и давление составляют 647,3 К и 220,5 бар (22050 кПа), а критический объем = 0,056 м 9 .0102 3 кмоль -1 .
Из-за многочисленных применений воды желательны некоторые дополнительные сведения о свойствах воды. Таким образом, отслеживание свойств воды представляет национальный интерес. Например, такой организацией является Американское общество инженеров-механиков (ASME). Международное сотрудничество в области исследований и обмена информацией более экономично, а для тепловых свойств создана Международная ассоциация свойств воды и пара (IAPWS). Канада является членом этой организации.
Международное сотрудничество в области исследований и обмена информацией более экономично, а для тепловых свойств создана Международная ассоциация свойств воды и пара (IAPWS). Канада является членом этой организации.
С точки зрения применения требуются изменения следующих свойств в зависимости от температуры и давления.
- Сжимаемость пара и воды в зависимости от давления при различной температуре
- Плотность воды как функция температуры
- Вязкость воды как функция температуры
- Энтальпия воды для различных термодинамических оценок
- Молярные объемы и коэффициенты расширения воды и пара в зависимости от давления и температуры
- Скорость звука в воде и паре и скорость звука в паровоздушной смеси в зависимости от температуры и давления
- Энтропия воды как функция температуры и давления
- Теплопроводность воды и пара
- Вязкость воды при любой температуре для труб и насосов
- Диэлектрическая проницаемость в зависимости от температуры и давления
- Поверхностное натяжение в зависимости от температуры и давления
- Энергия Гиббса при различной температуре и давлении
- Свойства, такие как диэлектрическая проницаемость и ионные продукты сверхкритической воды (жидкости)
- Применение сверхкритической воды: переработка пластиковых отходов, восстановление толуолдиамина, гидролиз ПЭТ (полиэтилентерефталата) и т.
 д.
д.
Мы обсудим некоторые из них, чтобы проиллюстрировать суть, но не все.
Плотность воды
| Плотность воды | ||
|---|---|---|
| Т/К | Плотность г/мл | Д 2 О |
| 273 | 0,999841 | 1.10469 |
| 274 | 0,999900 | |
| 275 | 0,999941 | |
| 276 | 0,999965 | |
| 277 | 0,999973 | 1. 1057 1057 |
| 278 | 0,999965 | 1.10562 |
| 279 | 0,999941 | |
| 280 | 0,999902 | |
| 281 | 0,999849 | |
| 282 | 0,999781 | |
| 281 | 0,999700 | |
Плотность — это масса на единицу объема. Плотность воды обычно принимается равной 1,0 г/мл или 1,000e3 кг м 90 102 -3 90 103 при 277 К. Это говорит о том, что плотность меняется в зависимости от температуры, и плотность воды самая высокая при 277 К, а плотность находится между 273 и 281 K из CRC Handbook of Chemistry and Physics приведены в таблице здесь. Эти данные рассчитаны на основе экспериментальных данных для чистой воды на основе эталона при 276,98 К. Тот же источник дает плотность обычной воды 1,000000 г/мл при 277 К.
Это говорит о том, что плотность меняется в зависимости от температуры, и плотность воды самая высокая при 277 К, а плотность находится между 273 и 281 K из CRC Handbook of Chemistry and Physics приведены в таблице здесь. Эти данные рассчитаны на основе экспериментальных данных для чистой воды на основе эталона при 276,98 К. Тот же источник дает плотность обычной воды 1,000000 г/мл при 277 К.
Объем, занимаемый одним молем вещества, называется молярным объемом . Молярный объем жидкой воды равен 18,016/, плотность . При 277 К молярный объем составляет 18,016 мл. Для жидкой воды молярные объемы жидкой воды увеличиваются до 18,03 мл как при 269 К, так и при 285 К.
Плотность льда составляет 0,917 при 273 К, а молярный объем составляет 19,65 мл, что на 9 % больше, чем молярная масса жидкости. . Таким образом, 9% кубика льда, не содержащего пузырьков воздуха, плавает над поверхностью, а 91% его находится ниже ватерлинии. Плотность делает поведение айсбергов интересным. Айсберги являются основными туристическими достопримечательностями в Ньюфаундленде и Лабрадоре, Канада.
Айсберги являются основными туристическими достопримечательностями в Ньюфаундленде и Лабрадоре, Канада.
Электрический дипольный момент и диэлектрическая проницаемость
Заряженные ионы взаимодействуют друг с другом за счет электростатического притяжения или отталкивания. Сила F между двумя заряженными частицами с зарядами q 1 и q 2 разделены расстоянием r is
q1 q2
F = ————
4 p eo r2
| 2 Cl 7 d- 6 | Na д+ |
Незаряженные молекулы все еще взаимодействуют друг с другом, но не за счет электростатического взаимодействия, а за счет электрического дипольного взаимодействия. Электрический дипольный момент представляет собой вектор из-за неравномерного распределения разноименных зарядов. В двухатомных системах величину электрического дипольного момента можно оценить как разность электроотрицательностей Полинга двух атомов. Для удобства предположим, что центры положительного и отрицательного полюсов Na-Cl разнесены на расстояние l, тогда электрический дипольный момент \(\mu\) равен
Для удобства предположим, что центры положительного и отрицательного полюсов Na-Cl разнесены на расстояние l, тогда электрический дипольный момент \(\mu\) равен
m = q l
Традиционно дипольные моменты молекул табулировались в электростатических единицах, и в этом случае заряд электрона равен 4,80e-10 esu (= (1,6e-19 Кл) (3e9 esu/C) ). В кристаллах NaCl расстояние между ионами Na и Cl составляет 240 пм. Если молекула NaCl (в газе) имеет такое же расстояние между идеализированными ионами, то дипольный момент рассчитывается ниже: 29 см. м.
или в единицах cgs-esu
м = 4,8e-10 esu * 2,40e-8 см
= 11,5e-18 esu см
В единицах cgs-esu 1e-18 esu см определяют дебаев (символ D). Таким образом, мы имеем
1 D = 1e-18 esu см
= 3,355e-30 C·м (из расчета выше)
m = 11,5 D для идеализированной молекулы газа NaCl
, но
mobserved = 9 D в газе NaCl =3e -29 С м.
| Электрический дипольный момент некоторых молекул газа | |
|---|---|
| Молекула | м /Д |
| NaCl | 9,0 |
| KCl | 10,3 |
| СО | 0,1 |
| ВЧ | 1,8 |
| HCl | 1,1 |
| HBr | 0,8 |
| Н 2 О | 1,8 |
| СО 2 | 1,6 |
| Н 2 О | 0,2 |
| НХ 3 | 1,5 |
Однако экспериментальный дипольный момент = 9 D для газа NaCl. Таким образом, модель для расчета должна быть изменена для учета частичной делокализации зарядов или путем включения некоторого ковалентного характера в связь Na-Cl. В любом случае модель показывает физический метод (модель) для оценки дипольного момента. Дипольные моменты некоторых молекул газа приведены здесь в таблице.
Таким образом, модель для расчета должна быть изменена для учета частичной делокализации зарядов или путем включения некоторого ковалентного характера в связь Na-Cl. В любом случае модель показывает физический метод (модель) для оценки дипольного момента. Дипольные моменты некоторых молекул газа приведены здесь в таблице.
Дипольный момент представляет собой вектор от отрицательного заряда к положительному вдоль связи. Для трехатомных молекул, таких как молекулы воды, полный электрический дипольный момент представляет собой сумму аль-диполей для каждой связи. Экспериментальный дипольный момент для воды равен 1,8 D, что совпадает с моментом H-F. Вода — очень полярное соединение. Аммиак с тремя связями N-H имеет дипольный момент 1,5 D.
Одноатомные двухатомные молекулы, конечно, имеют нулевой дипольный момент. Так же линейные CO 2 и CS 2 молекул.
Высокий дипольный момент делает воду особым веществом. Вода имеет очень высокую диэлектрическую постоянную, 80. Благодаря взаимодействию дипольного заряда вода является универсальным растворителем ионных веществ, особенно одновалентных ионов. На приведенной ниже диаграмме показаны некоторые типичные ион-дипольные и диполь-дипольные взаимодействия в растворах. Растворение в воде называется гидратацией.
Благодаря взаимодействию дипольного заряда вода является универсальным растворителем ионных веществ, особенно одновалентных ионов. На приведенной ниже диаграмме показаны некоторые типичные ион-дипольные и диполь-дипольные взаимодействия в растворах. Растворение в воде называется гидратацией.
Дипольный момент как-то связан с его взаимодействием с микроволнами. «Применение георадара в гляциологии» — это веб-сайт, на котором излагается теория радиолокации и обсуждается взаимодействие радара с водой. Это также иллюстрирует применение в гляциологии.
Сверхкритическая вода, напротив, имеет низкую диэлектрическую проницаемость, что делает ее хорошим растворителем для неполярных веществ.
Пример 1
Предположим, что молекула H-F состоит из двух ионов, положительного и отрицательного. Какое расстояние разделяет эти два иона, чтобы дать дипольный момент 1,8 D?
Решение
Вспомните первую формулу из приведенного выше обсуждения дипольного момента и выполните вычисления, как показано:
м = q л
q л = 4,8е-10 е.

 д.
д.