Содержание
Фізичні властивості води. Статті компанії «МЕД-ПРОМ РЕСУРС Лабораторне Обладнання»
- Стан (ст. ум.): рідина
- Щільність: 0,9982 г/куб. см
- Динамічна в’язкість (ст. ум.): 0,00101 Па•с (при 20°C)
- Кінематична в’язкість (ст. ум.): 0,01012 кв. см/с (при 20°C)
Термічні властивості води:
- Температура плавлення: 0°C
- Температура кипіння: 99,974°C
- Потрійна точка: 0,01 °C, 611,73 Па
- Критична точка: 374°C, 22,064 МПа
- Молярна теплоємність(ст. ум.): 75,37 Дж/(моль•К)
- Теплопровідність(ст. ум.): 0,56 Вт/(м•K)
Агрегатні стани води:
- Тверда ― лід.
- Рідке ― вода.
- Газоподібний ― водяний пар.
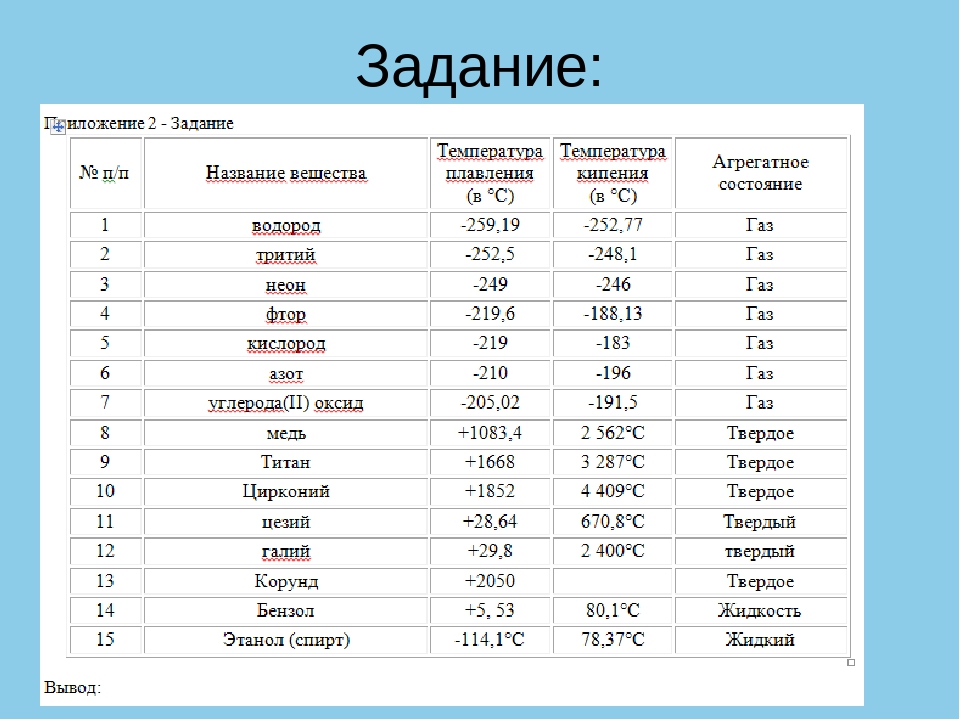
1. При атмосферному тиску вода замерзає (перетворюється в лід) при температурі 0°C і кипить (перетворюється у водяну пару) при температурі 100°C.
2. При зниженні тиску температура плавлення води повільно зростає, а температура кипіння ― падає.
3. При тиску в 611,73 Па (близько 0,006 атм) температура кипіння і плавлення збігається і стає рівною 0,01°C. Такий тиск і температура називаються потрійною точкою води.
4. При більш низькому тиску вода не може знаходитися в рідкому стані, і лід перетворюється безпосередньо в пар. Температура сублімації льоду падає зі зниженням тиску.
5. При зростанні тиску температура кипіння води зростає, щільність водяної пари в точці кипіння теж зростає, а рідкої води ― падає.
6. При температурі 374°C (647 K) і тиску 22,064 МПа (218 атм), вода проходить критичну точку. В цій точці щільність і інші властивості рідкої і газоподібної води збігаються.
7. При більш високому тиску немає різниці між рідкою водою і водяною парою, отже, немає і кипіння або випаровування.
8. Так само можливі метастабільні стани ― пересичений пара, перегріта рідина, переохлажденная рідина.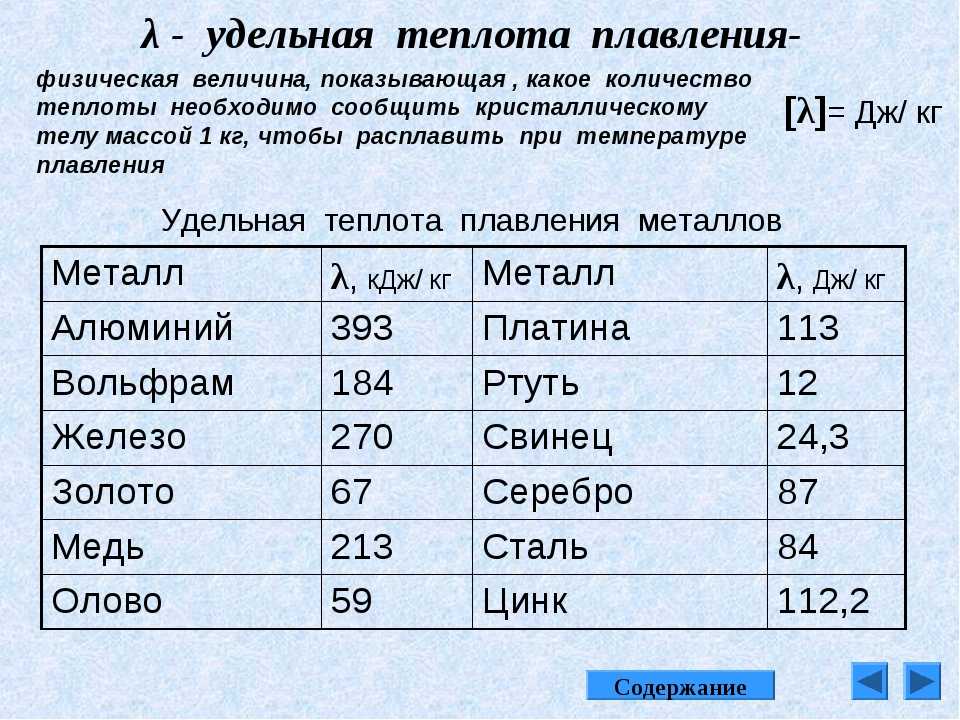 Ці стани можуть існувати тривалий час, проте вони нестійкі і при зіткненні з більш стійкою фазою відбувається перехід. Наприклад, неважко отримати переохлажденную рідина, охолодивши чисту воду в посудині чистій нижче 0°C, проте при появі центру кристалізації рідка вода швидко перетворюється в лід.
Ці стани можуть існувати тривалий час, проте вони нестійкі і при зіткненні з більш стійкою фазою відбувається перехід. Наприклад, неважко отримати переохлажденную рідина, охолодивши чисту воду в посудині чистій нижче 0°C, проте при появі центру кристалізації рідка вода швидко перетворюється в лід.
Вода володіє рядом незвичайних особливостей:
- При таненні льоду, його щільність збільшується (з 0,9 до 1 г/куб. см). Майже у всіх інших речовин при плавленні густина зменшується.
- При нагріванні від 0°C до 4°C (точніше 3,98°C), вода стискається. Завдяки цьому можуть жити риби у замерзаючих водоймах: коли температура падає нижче 4°C, холодна вода, як менш щільна залишається на поверхні, замерзає, а під льодом зберігається позитивна температура.
- Висока температура і питома теплота плавлення (0°C і 333,55 кДж/кг), температура кипіння (100°C) і питома теплота пароутворення (2250 КДж/кг), порівняно з сполуками водню з схожим молекулярною вагою.
- Висока теплоємність рідкої води.

- Висока в’язкість.
- Високий поверхневий натяг.
- Негативний електричний потенціал поверхні води.
Всі ці особливості пов’язані з наявністю водневих зв’язків. З-за великої різниці електронегативностей атомів водню і кисню електронні хмари сильно зміщені в бік кисню. Унаслідок цього, а також того, що іон водню не має внутрішніх електронних шарів і володіє малими розмірами, він може проникати в електронну оболонку негативно поляризованого атома сусідньої молекули. Завдяки цьому, кожен атом кисню притягається до атомів водню інших молекул і навпаки. Кожна молекула води може брати участь максимум у чотирьох водневих зв’язках: 2 атома водню ― кожний в одній, а атом кисню ― в двох; в такому стані молекули знаходяться в кристалі льоду. При таненні льоду частина зв’язків рветься, що дозволяє укласти молекули води щільніше; при нагріванні води зв’язку продовжують рватися, і щільність її зростає, але при температурі вище 4°С цей ефект стає слабкіше, ніж теплове розширення.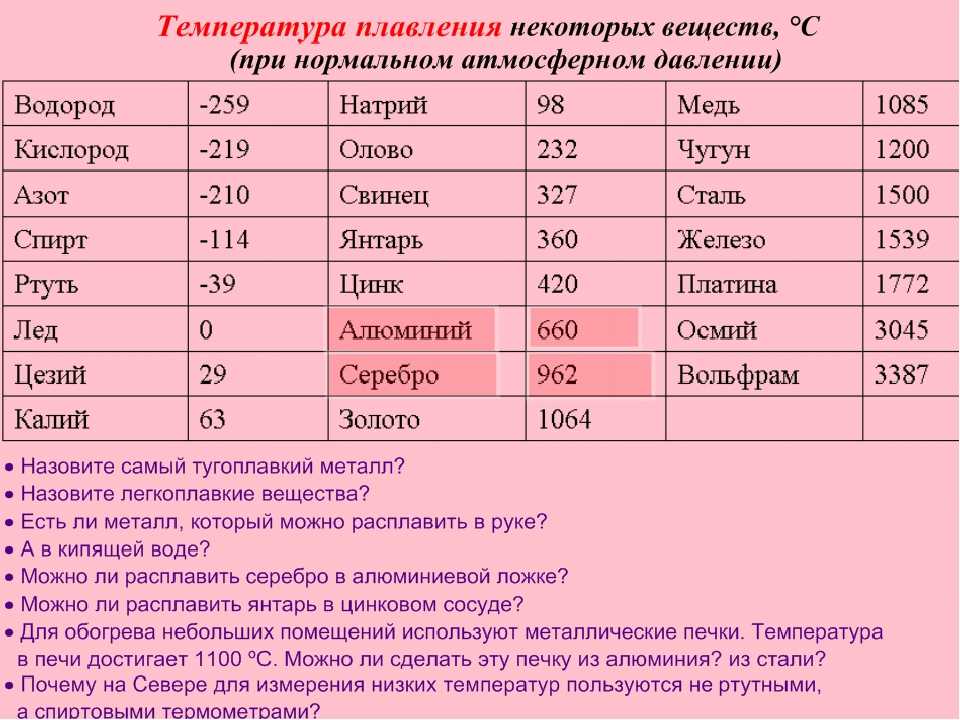 При випаровуванні рвуться всі залишилися зв’язку. Розрив зв’язків вимагає багато енергії, звідси висока температура і питома теплота плавлення і кипіння і висока теплоємність. В’язкість води обумовлена тим, що водневі зв’язки заважають молекулам води рухатися з різними швидкостями.
При випаровуванні рвуться всі залишилися зв’язку. Розрив зв’язків вимагає багато енергії, звідси висока температура і питома теплота плавлення і кипіння і висока теплоємність. В’язкість води обумовлена тим, що водневі зв’язки заважають молекулам води рухатися з різними швидкостями.
За подібним причин вода є добрим розчинником полярних речовин. Кожна молекула растворяемого речовини оточується молекулами води, причому позитивно заряджені ділянки молекули растворяемого речовини притягують атоми кисню, а негативно заряджені ― атоми водню. Оскільки молекула води мала за розмірами, багато молекул води можуть оточити кожну молекулу растворяемого речовини.
Це властивість води використовується живими істотами. У живій клітині і в міжклітинному просторі вступають у взаємодію розчини різних речовин у воді. Вода необхідна для життя всіх без винятку одноклітинних і багатоклітинних живих істот на Землі.
Чиста (не містить домішок) вода ― хороший ізолятор. При нормальних умовах вода слабо диссоциирована і концентрація протонів (точніше, іонів гидроксония H3O+) і гідроксильних іонів HO ― становить 0,1 мкмоль/л. Але оскільки вода ― добрий розчинник, у ній практично завжди розчинені ті чи інші солі, тобто у воді присутні позитивні і негативні іони. Завдяки цьому вода проводить електрику. По електропровідності води можна визначити її чистоту.
Але оскільки вода ― добрий розчинник, у ній практично завжди розчинені ті чи інші солі, тобто у воді присутні позитивні і негативні іони. Завдяки цьому вода проводить електрику. По електропровідності води можна визначити її чистоту.
Вода має показник заломлення n=1,33 в оптичному діапазоні. Однак вона сильно поглинає інфрачервоне випромінювання, і тому водяна пара є основним природним парниковим газом, відповідає більш ніж за 60% парникового ефекту. Завдяки великому дипольному моменту молекул, вода також поглинає мікрохвильове випромінювання, на чому заснований принцип дії мікрохвильової печі.
Найважливіше про медНайважливіше про мед
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Поиск на сайте DPVA Поставщики оборудования Полезные ссылки О проекте Обратная связь Ответы на вопросы. Оглавление
| Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация/ / Физический справочник / / Тепловые величины: теплоемкость, теплопроводность, температуры кипения, плавления, пламени. Удельные теплоты сгорания и парообразования. Термические константы. Коэффициенты теплообмнена и расширения/ / Температуры, кипения, плавления, прочие. Поделиться:
Поиск в инженерном справочнике DPVA. Введите свой запрос: | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Коды баннеров проекта DPVA.ru Консультации и техническая | Проект является некоммерческим. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Владельцы сайта www.dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Владельцы сайта www.dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса.Free xml sitemap generator | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Температура плавления и кипения воды
Без рубрики
- Сообщение от
Амина Ахмед
13
Sep
Основная концепция
В этом уроке вы узнаете о температуре плавления, замерзания и кипения воды, а также о некоторых важных понятиях.
Что такое вода?
Вода представляет собой молекулу, состоящую из трех атомов, одного атома кислорода и двух атомов водорода. Благодаря силе, называемой водородной связью, молекулы воды прилипают друг к другу. Вода существует в газообразном, жидком и твердом состояниях в зависимости от ее температуры.
Почему важна вода?
Вода является одним из наиболее распространенных соединений, которое также очень важно. Он безвкусный, без запаха, в небольших количествах даже кажется бесцветным, но имеет слегка голубоватый цвет. Вода очень важна для земли и жизни.
Состояния воды
Ежедневно можно встретить воду в трех агрегатных состояниях: твердое, жидкое и газообразное. Когда вода находится в твердом состоянии, она не меняет форму или объем из-за того, что атомы находятся в фиксированном положении, зависящем друг от друга. Когда вода находится в жидкой форме, она может изменить форму, чтобы заполнить то пространство, которое она в настоящее время занимает. Атомы, из которых состоит вода, не являются жесткими, а свободно перемещаются в жидкости. Наконец, когда вода находится в газообразном состоянии, ее называют паром или паром.
Температура плавления воды
Плавление — это превращение твердого вещества в жидкое при воздействии тепла.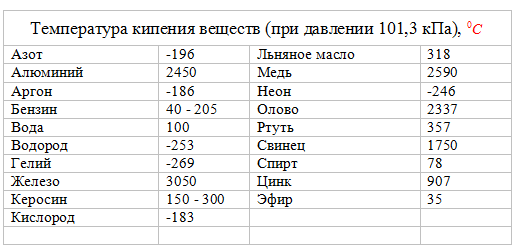 По мере повышения температуры энергия молекул увеличивается, что приводит к ускорению движения молекул. Как только они достигают определенной температуры, они освобождаются от своей жесткой структуры и начинают двигаться более свободно. В чистом кристаллическом твердом теле этот процесс происходит при фиксированной температуре. Это известно как переход вещества из твердого состояния в жидкое. Температура плавления воды составляет около 32 градусов по Фаренгейту (0 градусов по Цельсию) для чистой воды на уровне моря (нормальная высота). На других высотах точка плавления будет меняться из-за различных атмосферных давлений. Эти изменения обсуждаются далее в разделе ниже.
По мере повышения температуры энергия молекул увеличивается, что приводит к ускорению движения молекул. Как только они достигают определенной температуры, они освобождаются от своей жесткой структуры и начинают двигаться более свободно. В чистом кристаллическом твердом теле этот процесс происходит при фиксированной температуре. Это известно как переход вещества из твердого состояния в жидкое. Температура плавления воды составляет около 32 градусов по Фаренгейту (0 градусов по Цельсию) для чистой воды на уровне моря (нормальная высота). На других высотах точка плавления будет меняться из-за различных атмосферных давлений. Эти изменения обсуждаются далее в разделе ниже.
Температура кипения воды
Кипение — это когда жидкость меняет свое состояние и превращается в газ. При повышении температуры молекула набирает достаточно энергии, чтобы стать газом. Температура кипения воды составляет 100 градусов по Цельсию (212 градусов по Фаренгейту), тогда как точка кипения соленой воды составляет около 102º по Цельсию.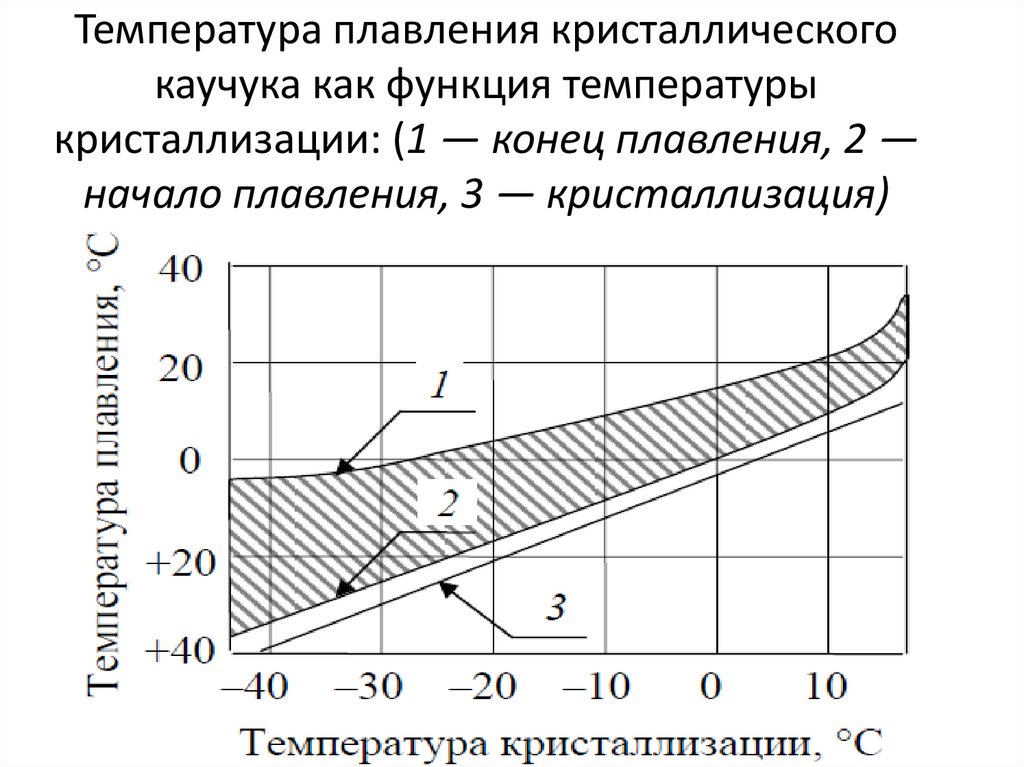 Температура кипения воды также изменится при нестандартном давлении.
Температура кипения воды также изменится при нестандартном давлении.
Кипящая вода в кастрюле (Источник: Wikimedia Commons)
Температура замерзания воды
Вода замерзает при температуре 32 градуса по Фаренгейту (0 градусов по Цельсию), тогда как соленая вода замерзает при температуре около 28,4 по Фаренгейту (-1,8º по Цельсию). Замораживание – это переход воды из жидкой фазы в твердую.
Кипение на большой высоте
Стандартная температура кипения воды применяется только при стандартном давлении, то есть на уровне моря. По мере продвижения к более высоким высотам (более низкое давление) температура кипения будет снижаться.
Например, хотя вода обычно кипит при температуре 100 o C (212 o F), на горе Эверест (высота около 27 000 футов) вода кипит при 68oC (154oF). Это драматическая разница. Иногда вы также видите пример этого в выпечке. На больших высотах пищу приходится готовить дольше, а соотношение ингредиентов может немного измениться.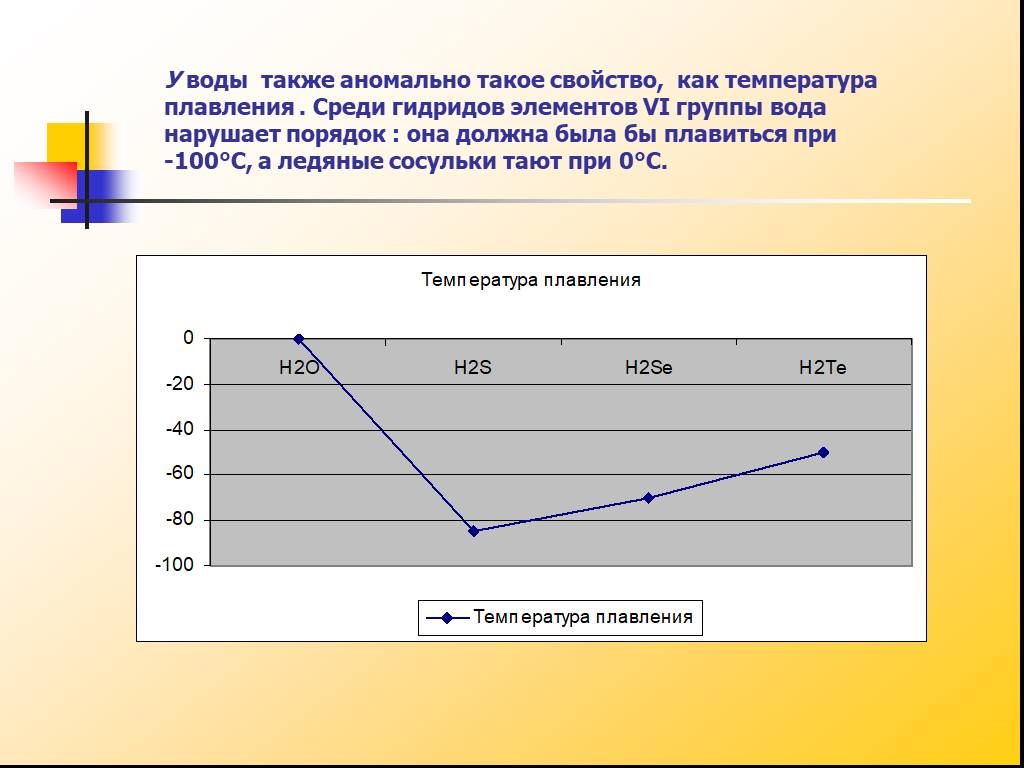
Гора Эверест. В лагерях для Эвереста вода будет кипеть при более низкой температуре, чем кипяток на пляже (уровень моря). (Источник: Wikimedia Commons)
Что, если мы попытаемся вскипятить воду глубоко в океане? В некоторых из самых глубоких частей океана вода будет оставаться в жидком состоянии до температуры 400°С.0059 или С (750 или Ф). Здесь давление намного выше, чем на обычном уровне моря, поэтому для кипячения воды требуется больше энергии (более высокая температура).
Определения:
Температура плавления — температура, при которой вещество может перейти из твердого состояния в жидкое.
Температура замерзания — температура, при которой вещество претерпевает фазовый переход из жидкого состояния в твердое.
Температура кипения – температура, при которой жидкость претерпевает фазовое превращение и превращается в пар.
Интересные факты
- Вода в твердом состоянии плавает, а не тонет в жидкой воде.
 Это отличается от большинства других твердых тел.
Это отличается от большинства других твердых тел. - Газ можно превратить в жидкость под давлением.
- Точки кипения и замерзания могут различаться в зависимости от того, сколько соли содержится в воде.
- На больших высотах температура кипения воды ниже.
Прочие материалы о воде
- Свойства воды
- Реакция натрия в воде
- Полярность воды
Температура плавления, температура замерзания, температура кипения
Температура плавления, температура замерзания
Точка кипения
| Точка плавления и точка замерзания | Точка кипения |
Температура плавления и замерзания
Пункт
Чистые кристаллические твердые вещества имеют характерную температуру плавления ,
температура, при которой твердое тело плавится и становится жидкостью. Переход между твердым телом
Переход между твердым телом
а жидкость настолько острая для небольших образцов чистого вещества, что точки плавления могут
0,1 o C. Температура плавления твердого кислорода, например, равна
-218.4 o C.
Жидкости имеют характерную температуру, при которой они превращаются в твердые тела, известную как
их точка замерзания . Теоретически температура плавления твердого тела должна быть
то же, что температура замерзания жидкости. На практике небольшие различия между этими
количества можно наблюдать.
Трудно, если вообще возможно, нагреть твердое тело выше его точки плавления, потому что
тепло, поступающее в твердое тело при его температуре плавления, используется для превращения твердого тела в
жидкость. Однако некоторые жидкости можно охладить до температуры ниже точки их замерзания.
точки, не образуя твердого тела. Когда это сделано, говорят, что жидкость равна переохлажденный .
Пример переохлажденной жидкости можно получить путем нагревания твердого ацетата натрия.
тригидрат (NaCH 3 CO 2 3 H 2 O). Когда это твердое вещество плавится,
ацетат натрия растворяется в воде, которая была захвачена кристаллом, с образованием раствора.
Когда раствор остынет до комнатной температуры, он должен затвердеть. Но это часто не так. Если
к жидкости добавляют небольшой кристалл тригидрата ацетата натрия, однако содержимое
колбы затвердевают в течение нескольких секунд.
Жидкость может стать переохлажденной, потому что частицы в твердом теле упакованы в
регулярная структура, характерная для данного конкретного вещества. Что-нибудь из этого
твердые вещества образуются очень легко; другие нет. Некоторым нужна пылинка или затравочный кристалл,
действовать как место, на котором может расти кристалл. Для образования кристаллов натрия
тригидрат ацетата, ионы Na + , ионы CH 3 CO 2 — ,
и молекулы воды должны собраться вместе в правильной ориентации. Это трудно для
эти частицы самоорганизуются, но затравочный кристалл может обеспечить основу для
которые могут вырасти при правильном расположении ионов и молекул воды.
Поскольку трудно нагреть твердые вещества до температуры выше их температуры плавления, и
Поскольку чистые твердые вещества склонны плавиться в очень небольшом диапазоне температур, температуры плавления
часто используется для идентификации соединений. Мы можем различить три известных сахара.
как глюкоза ( МП = 150 o C), фруктоза ( МП =
103-105 o С), и сахарозы ( т.пл. = 185-186 o С), для
Например, путем определения температуры плавления небольшого образца.
Измерения температуры плавления твердого вещества также могут предоставить информацию о
чистота вещества. Чистые кристаллические твердые вещества плавятся в очень узком диапазоне температур.
температуры, тогда как смеси плавятся в широком диапазоне температур. Смеси также склонны
плавятся при температурах ниже температуры плавления чистых твердых веществ.
Температура кипения
Когда жидкость нагревается, она в конце концов достигает температуры, при которой пар
давление настолько велико, что внутри тела жидкости образуются пузырьки.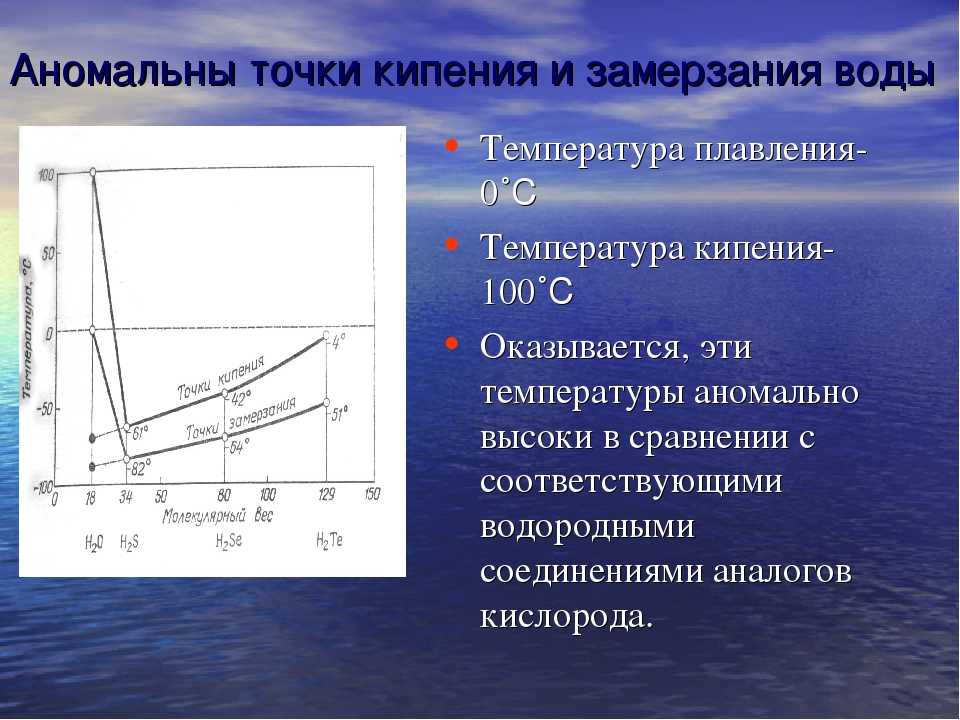 Эта температура
Эта температура
называется точка кипения . Как только жидкость начнет кипеть,
температура остается постоянной до тех пор, пока вся жидкость не превратится в газ.
Нормальная температура кипения воды 100 o C. Но если вы попытаетесь сварить яйцо в
кипящей воды во время кемпинга в Скалистых горах на высоте 10 000 футов, вы
обнаружат, что яйцо готовится дольше, потому что вода кипит только при 90 o C
на этой возвышенности.
Теоретически вы не сможете нагреть жидкость до температуры выше нормальной
точка кипения. Однако до того, как микроволновые печи стали популярными, использовались скороварки.
чтобы сократить время приготовления пищи. В обычной скороварке вода
может оставаться в жидком состоянии при температурах до 120 o C, и пища готовится в
почти треть нормального времени.
Объяснить, почему вода кипит при температуре 90 o C в горах и 120 o C в
скороварке, хотя нормальная температура кипения воды 100 o C, мы
нужно понять, почему жидкость кипит. По определению жидкость кипит, когда пар
По определению жидкость кипит, когда пар
Давление газа, выходящего из жидкости, равно давлению, действующему на
жидкости окружающей средой, как показано на рисунке ниже.
| Жидкости кипят, когда давление их паров равно давлению, оказываемому на жидкость своим окружением. |
Нормальная температура кипения воды составляет 100 o C, потому что это температура
при котором давление паров воды равно 760 мм рт.ст., или 1 атм. В обычных условиях, когда
давление атмосферы примерно 760 мм рт.ст., вода кипит при 100 или С.
На высоте 10 000 футов над уровнем моря атмосферное давление составляет всего 526 мм ртутного столба. На этих
высотах вода закипает при давлении ее паров 526 мм рт.ст., что происходит при температуре
из 90 o C.
Скороварки оснащены клапаном, который позволяет газу выходить, когда давление
внутри горшка превышает некоторое фиксированное значение.


 Таблица.
Таблица.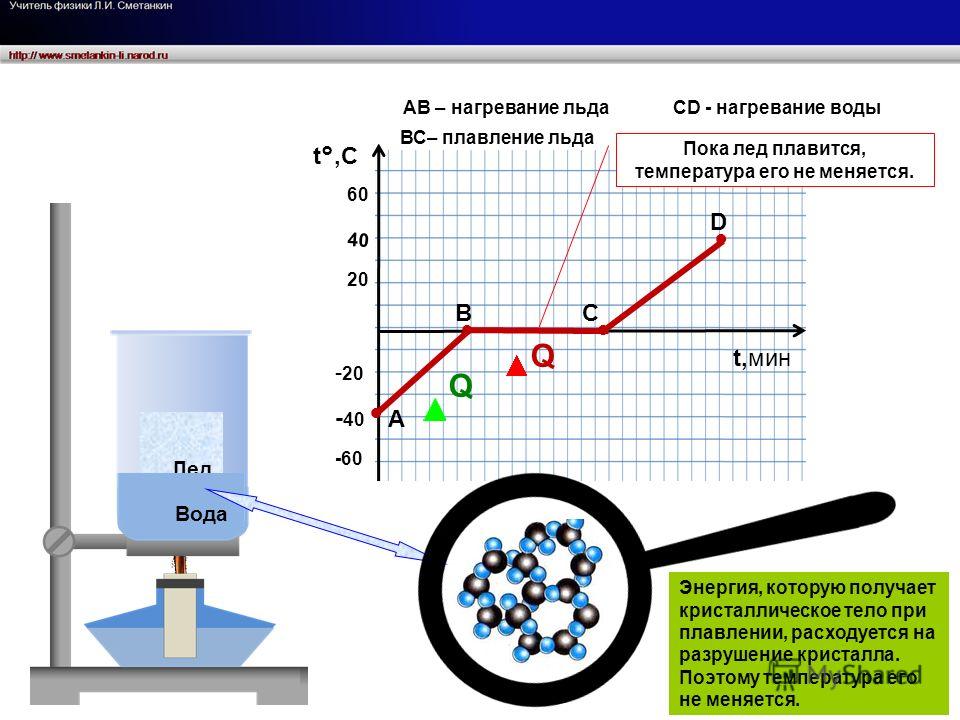 .. Перевод единиц измерения температуры. Воспламеняемость./ / Температуры плавления, застывания, замерзания / / Температура плавления льда = температура замерзания воды в зависимости от давления 1-2100 бар. Таблица.
.. Перевод единиц измерения температуры. Воспламеняемость./ / Температуры плавления, застывания, замерзания / / Температура плавления льда = температура замерзания воды в зависимости от давления 1-2100 бар. Таблица.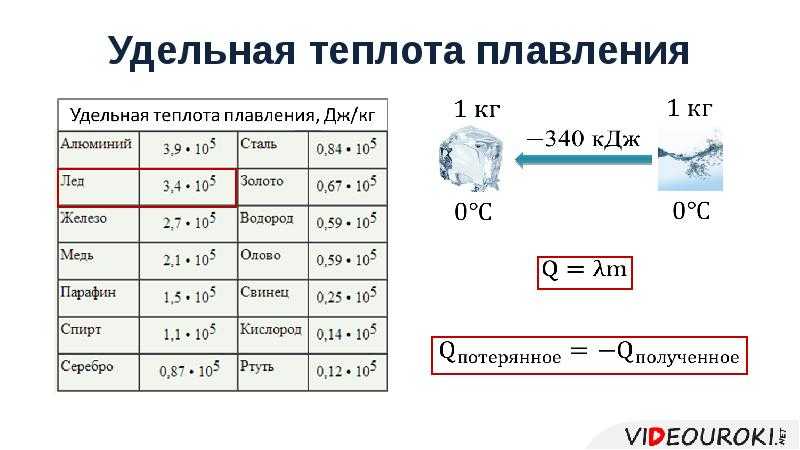 , Saul A., Pruss A. International equations for the pressure along the melting and along the sublimation curve of ordinary water substance // J. Phys. 1994
, Saul A., Pruss A. International equations for the pressure along the melting and along the sublimation curve of ordinary water substance // J. Phys. 1994
 Это отличается от большинства других твердых тел.
Это отличается от большинства других твердых тел.