Содержание
Соляная кислота, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
11 фактов о Hcl + h3O: реакция нескольких элементов
В этой статье мы собираемся обсудить детали реакции между HCl + H2О, а также как сбалансировать реакции с примерами. HCl является одним из компонентов желудочного сока.
Газообразный хлороводород (HCl), хорошо растворимый в воде, при растворении в воде образует соляную кислоту. Формула соляной кислоты также HCl. Затем соляная кислота диссоциирует в воде с образованием ионов.
| HCl + Н2O Тип реакции | Экзотермическая реакция (с выделением тепла) Rвыворачивающаяся химическая реакция (как равновесие сформирован) Реакция ионизации (поскольку в реакции образуются ионы) |
| Конъюгированная кислота | Имеет на один водород больше, чем основание |
| Конъюгированная база | Имеет на один водород меньше, чем кислота |
| Сопряженные кислотно-основные пары в HCl + H2O | HCl и Cl– H3O+ и Н2O |
| Тип ионов, образующихся в HCl + H2О реакция | H+(Водно) или Н3O+ и Cl–(Водно) |
| В HCl + H2О реакция Кислота | HCl (донор протонов) |
| В HCl + H2О реакция Основание | H2O (акцептор протонов) |
Детали реакции HCl + h3OРастворение HCl в воде (HCl+H2O)
Что происходит, когда HCl взаимодействует с h3O?
Когда газообразный хлористый водород (HCl) реагирует с водой, он образует соляную кислоту.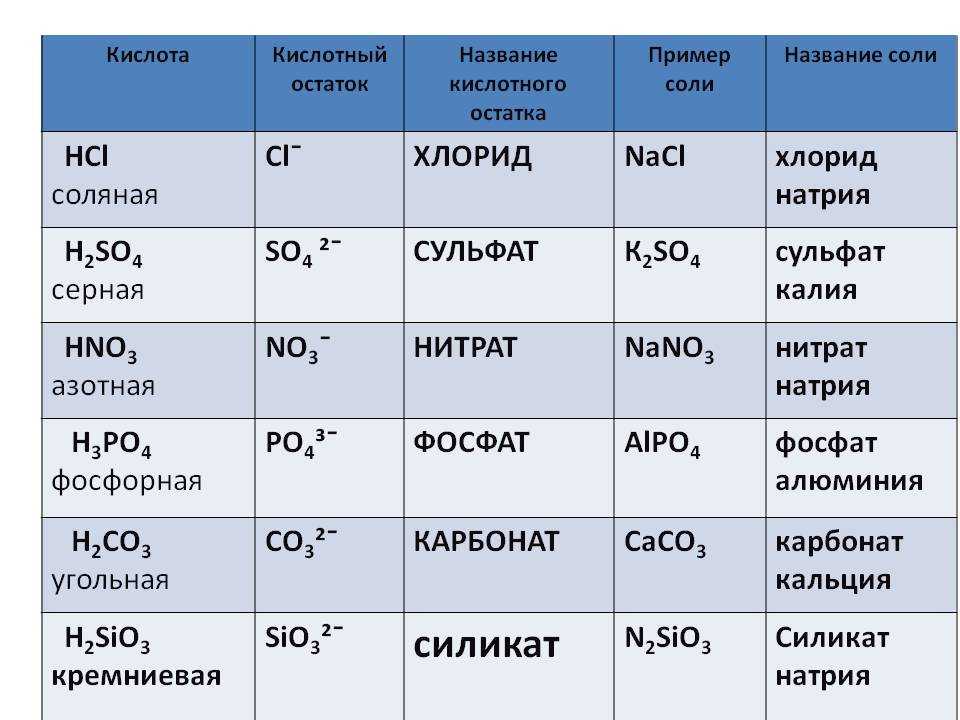
Образовавшаяся таким образом соляная кислота (также имеет формулу HCl) полностью диссоциирует в воде с образованием H+ и Cl– ионов, и в этой реакции выделяется большое количество тепла. Таким образом, это экзотермическая и ионизационная реакция.
Таким образом, реакцию можно представить в виде –
Какой тип реакции HCl и H2O?
Реакция между HCl и H2O представляет собой экзотермическую обратимую химическую реакцию и реакцию ионизации.
- Экзотермические реакции – это реакции, при которых выделяется тепло и повышается температура раствора.
- Обратимые химические реакции — это такие реакции, в которых реагенты реагируют с образованием продуктов, а продукты могут реагировать с возвратом реагентов. Короче говоря, обратимые реакции — это те реакции, которые можно обратить вспять.
- Реакция ионизации — это химическая реакция, в которой нейтральные атомы или молекулы превращаются в заряженные атомы или ионы за счет отдачи или отдачи электронов.

Что такое сопряженная кислотно-основная пара? Объясните, приведя пример HCl + H2О реакция.
Согласно теории Бренстеда и Лоури –
Кислота — это соединение, которое отдает протон (H+), а основание — это частицы, которые принимают протон (H+).
- Сопряженное основание представляет собой вещество, образующееся, когда кислота теряет протон (H+) к базе.
- Сопряженная кислота представляет собой вещество, образующееся, когда основание приобретает протон (H+) от кислоты.
Таким образом, вкратце, кислотно-основная пара отличаются друг от друга либо наличием протона, либо отсутствием протона.
Например —
В приведенном выше примере –
HCl и Cl– представляют собой сопряженные кислотно-основные пары, а H2O и H3O+ являются сопряженными кислотно-основными парами.
HCl и H2O Экзотермическая или эндотермическая реакция?
HCl + Н2О является экзотермической реакцией, так как в этой реакции выделяется большое количество тепла и температура раствора повышается.
Напишите чистое ионное уравнение HCl + H.2О реакция.
Реакция HCl + H2О происходит следующим образом –
Уравнение 3) представляет собой результирующее ионное уравнение HCl + H.2О реакция.
В реакции HCl + H2О, какая из них действует как кислота, а какая как основание?
По Бренстеду-Лоури определение кислот и оснований –
Кислота — это соединение, которое отдает протон (H+)
Основание — это вид, который принимает протон (H+).
Теперь наша реакция –
В приведенном выше уравнении один и тот же нижний индекс используется для каждой пары кислота-основа.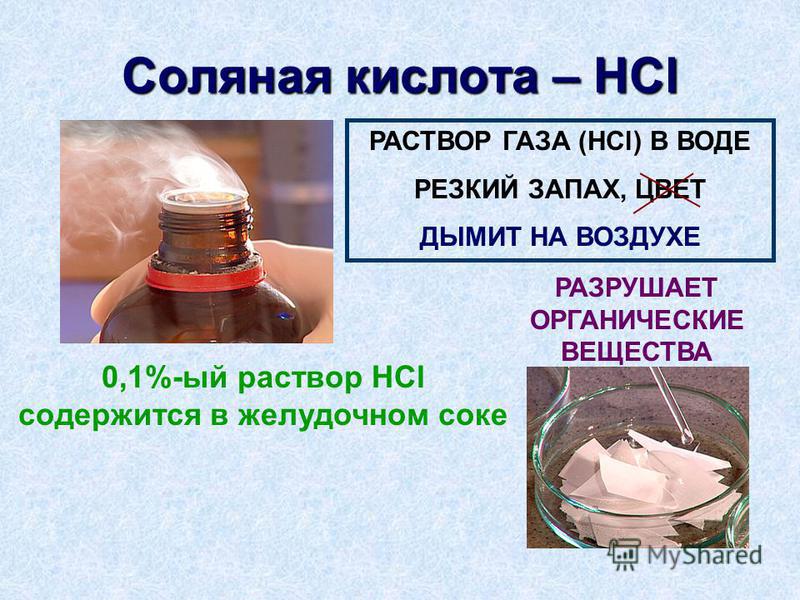 Согласно теории Бренстеда-Лоури, кислота представляет собой соединение, которое отдает протон основанию, поэтому в приведенном выше уравнении –
Согласно теории Бренстеда-Лоури, кислота представляет собой соединение, которое отдает протон основанию, поэтому в приведенном выше уравнении –
- HCl представляет собой кислоту, которая отдает протон основанию H.2O и при этом HCl превращается в Cl–который является сопряженным основанием HCl.
- H2O представляет собой основание, которое принимает протон от HCl, и при этом H2O превратиться в H3O+которая является сопряженной кислотой H2O
Сопряженное основание, Cl– на один водород меньше, чем его кислота HCl
Сопряженная кислота, H3O+ на один водород больше, чем его основание H2O
Как сбалансировать следующую реакцию?
Данная реакция-
Когда газообразный хлористый водород вступает в реакцию с водой, он образует соляную кислоту, которая, будучи сильной диссоциацией, полностью диссоциирует в воде с образованием иона водорода и иона хлора.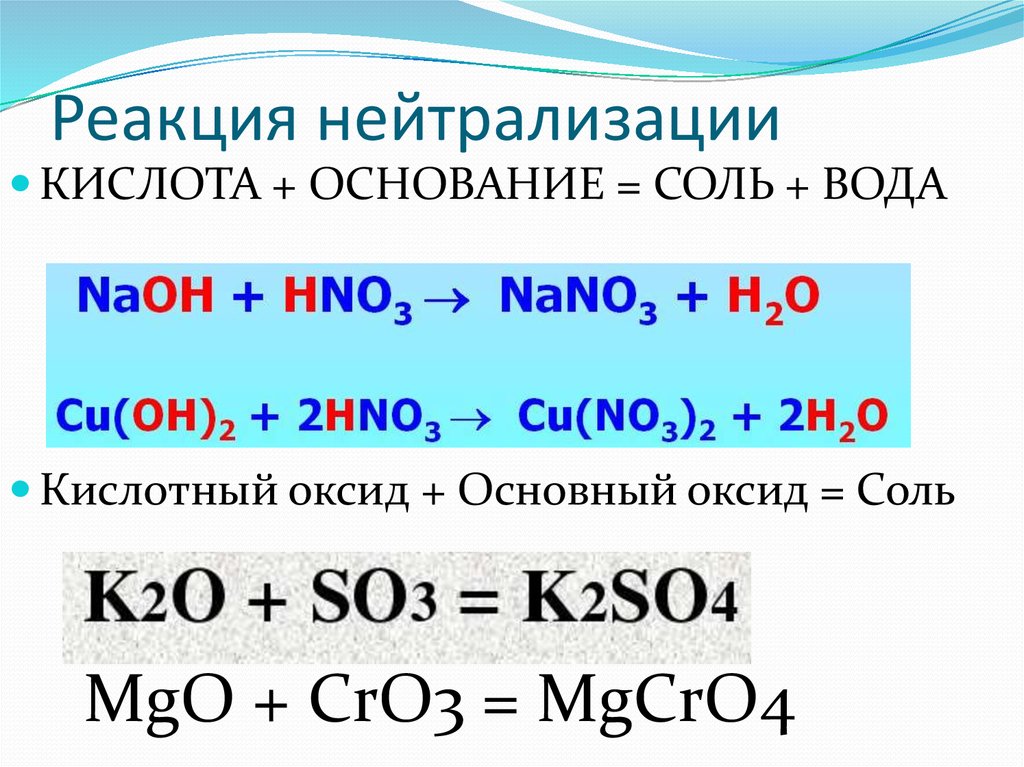
Чтобы сбалансировать это уравнение, мы посчитаем атомы как со стороны реагента, так и со стороны продукта.
| Элемент | Количество атомов в реагентах (LHS) | Количество атомов в продуктах (справа) |
| водород | 3 | 3 |
| Хлор | 1 | 1 |
| Кислород | 1 | 1 |
Баланс количества элементов на стороне Реагента и Продукта
TЧисло атомов как со стороны реагента, так и со стороны продукта одинаково, поэтому реакция является сбалансированной.
поэтому сбалансированное уравнение —
Как сбалансировать реакцию Al2O3 + HCl?
Al2O3 (оксид алюминия) реагирует с разбавленной HCl (соляной кислотой) с образованием AlCl.3 (хлорид алюминия) и H2О (вода)
Данная реакция –
Уравновешивание реакции –
| Элемент | Количество атомов в реагентах (LHS) | Количество атомов в продуктах (справа) |
| алюминий | 2 * 2 = 4 | 1 * 4 = 4 |
| Кислород | 3 * 2 = 6 | 1 * 6 = 6 |
| водород | 1 * 12 = 12 | 2 * 6 = 12 |
| Хлор | 1 * 12 = 12 | 3 * 4 = 12 |
Баланс количества элементов на стороне Реагента и Продукта
Поскольку все атомы стали равными по обе стороны реакции, реакция уравновешивается.
Равновесная реакция –
Как сбалансировать реакцию COCl2 + HCl?
Хлорид кобальта (II) реагирует с хлористым водородом с образованием тетрахлоркобальтата (2-) и газообразного водорода.
Данная реакция –
Уравновешивание реакции –
| Элемент | Количество атомов в реагентах (LHS) | Количество атомов в продуктах (справа) |
| Кобальт | 1 | 1 |
| Хлор | 2 + 1*2 = 4 | 4 |
| водород | 1 * 2 = 2 | 2 |
Баланс количества элементов на стороне Реагента и Продукта
Поскольку все атомы стали равными по обе стороны реакции, реакция уравновешивается.
Равновесная реакция –
Является ли HCl(L) + H2O(L) равно HCl(Водно)?
Нет, это не правильное уравнение. Это должно быть написано как –
Это должно быть написано как –
Термин водный означает раствор, в котором растворителем является вода, поэтому, когда мы пишем фазу вещества как водную, нет необходимости писать плюс вода (см. уравнение 2)
Поскольку хлористый водород (HCl) существует в виде газа при стандартной температуре и давлении, то HCl обычно хранится в виде концентрированного водного раствора, представляющего собой соляную кислоту.
Когда HCl растворяется в воде, он полностью диссоциирует на H+ и Cl–(Водно). Н+ образовавшийся соединяется с водой с образованием H3O+это ион гидроксония.
Вывод:
HCl + Н2О – обратимая реакция. Это экзотермическая реакция, и в этой реакции выделяется большое количество тепла, а Hвода)и Cl–(Водно) образуются ионы.
Влияние пластовой воды и соляной кислоты на физико-химические свойства полимерных материалов трубопроводов высокого давления, используемых для транспортировки нефти
Открытый доступ
| Проблема | Веб-конференция E3S. Том 121, 2019 I Международная конференция «Коррозия в нефтегазовой промышленности» | |
|---|---|---|
| Номер статьи | 04001 | |
| Количество страниц) | 5 | |
| Секция | Выбор материалов и проектирование | |
| ДОИ | https://doi.org/10.1051/e3sconf/201912104001 | |
| Опубликовано онлайн | 14 октября 2019 г. | |
E3S Web of Conferences 121 , 04001 (2019)
Влияние пластовой воды и соляной кислоты на физико-химические свойства полимерных материалов трубопроводов высокого давления для транспортировки нефти
Дмитрий Айдуганов 8
* , Динар Балкаев 2 , Михаил Варфоломеев 2 и Дмитрий Емельянов 2
1
Инженерно-производственный центр (ИПЦ), 423233, Бугульма, Россия
2
Казанский федеральный университет, 420008, г. Казань, Россия
Казань, Россия
* Автор, ответственный за переписку: [email protected]
Реферат
Цель работы — провести сравнительный анализ стабильности двух типов полимеров покрытий к воздействию пластовой воды и соляной кислоты на основе анализа механических свойств, термостойкости и морфологии поверхности. Для решения поставленной задачи использовались современные физико-химические методы: дифференциальная сканирующая калориметрия, микроскопия, электромеханическая универсальная испытательная машина, дилатометр. Моделирование воздействия воды при повышенных температурах и давлениях на образцы полимерных покрытий проводили в автоклаве-реакторе, исследование действия кислоты проводили в стеклянном стакане. На основе проведенной работы были получены результаты, показывающие сходство и различие в поведении исследуемых образцов полимеров. Исследовано изменение динамического модуля упругости и коэффициента линейного теплового расширения при повышении температуры. В целом было показано, что полимер PE-RT имеет лучшие характеристики, чем полимер PE. Однако оба они устойчивы к воздействию пластовой воды и соляной кислоты и могут защитить от коррозии соединения трубопроводов высокого давления.
В целом было показано, что полимер PE-RT имеет лучшие характеристики, чем полимер PE. Однако оба они устойчивы к воздействию пластовой воды и соляной кислоты и могут защитить от коррозии соединения трубопроводов высокого давления.
© The Authors, опубликовано EDP Sciences, 2019
Это статья с открытым доступом, распространяемая в соответствии с лицензией Creative Commons Attribution License 4.0, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии, что оригинал работа цитируется правильно.
Показатели текущего использования показывают совокупное количество просмотров статей (просмотры полнотекстовых статей, включая просмотры HTML, загрузки PDF и ePub, согласно имеющимся данным) и просмотров рефератов на платформе Vision4Press.
Данные соответствуют использованию на платформе после 2015 года. Текущие показатели использования доступны через 48-96 часов после онлайн-публикации и обновляются ежедневно в рабочие дни.
Использование соляной кислоты в домашних бассейнах
Если у вас дома есть бассейн, важно принять необходимые меры предосторожности для поддержания уровня pH воды и загрязнения самого бассейна. Когда уровень pH воды в вашем домашнем бассейне находится на недопустимом уровне, плавание в бассейне может вызвать значительный дискомфорт из-за потенциальных загрязнений.
Если вы хотите должным образом поддерживать уровень pH в вашем бассейне, вы можете подумать о приобретении датчика pH, которых существует множество различных типов. Эти датчики помогут вам определить, когда уровень pH достиг точки, которая ниже или выше нейтрального уровня pH, что указывает на то, что вы должны предпринять необходимые шаги для очистки воды.
Поддержание надлежащего химического состава воды
Вероятно, лучшим методом поддержания надлежащего химического состава воды является использование соляной кислоты — прозрачная бесцветная жидкость, полученная путем соединения воды с хлористым водородом. При попадании в воду бассейна соляная кислота доказала свою высокую эффективность в удалении водорослей с пола и стен бассейна, а также в снижении уровня pH, который стал вредным для вашего здоровья .
При попадании в воду бассейна соляная кислота доказала свою высокую эффективность в удалении водорослей с пола и стен бассейна, а также в снижении уровня pH, который стал вредным для вашего здоровья .
Если вы хотите, чтобы члены вашей семьи и гости были в безопасности, когда они плавают в вашем бассейне, вам необходимо постоянно поддерживать химический состав воды в бассейне. Однако эта соляная кислота очень эффективна и может быть опасна в обращении, если вы не знаете, как правильно ее использовать, поэтому очень важно научиться правильно с ней обращаться.
Что такое соляная кислота?
Соляная кислота — очень распространенное вещество, также известное как соляная кислота . Когда вы смешиваете воду с хлористым водородом, конечным результатом является соляная кислота, которая представляет собой коррозионное вещество, имеющее множество различных применений. Хотя это вещество идеально подходит для ухода за домашними бассейнами, оно также имеет множество промышленных применений, о которых вам следует знать. Например, эта кислота обычно используется в промышленных условиях для таких целей, как гидрометаллургическая переработка, синтез диоксида хлора, производство водорода, различные операции по очистке и травлению, очистка готовой кирпичной кладки.
Например, эта кислота обычно используется в промышленных условиях для таких целей, как гидрометаллургическая переработка, синтез диоксида хлора, производство водорода, различные операции по очистке и травлению, очистка готовой кирпичной кладки.
Из-за невероятной коррозионной активности этой кислоты она доказала свою высокую эффективность в поддержании чистоты и надлежащем обслуживании домашних бассейнов. Когда вы добавляете соляную кислоту в воду бассейна, это может помочь удалить любые стойкие водоросли с пола и стен вашего бассейна, что часто позволяет вам эффективно отфильтровывать водоросли из вашего бассейна навсегда!
Добавление этой кислоты в воду вашего бассейна также должно позволить вам снизить уровень pH , что полезно, если уровень pH становится повышенным. Когда вы покупаете соляную кислоту для использования в своем домашнем бассейне, вам следует поискать эту кислоту в магазинах товаров для дома или в магазинах товаров для бассейнов. Это вещество часто находится в отделах товаров для сада или строительства в магазине. Прежде чем использовать его в бассейне, убедитесь, что вы прочитали все указания и меры предосторожности.
Это вещество часто находится в отделах товаров для сада или строительства в магазине. Прежде чем использовать его в бассейне, убедитесь, что вы прочитали все указания и меры предосторожности.
Достижение оптимального pH в вашем бассейне
Прежде чем начать использовать соляную кислоту для восстановления pH воды в вашем бассейне до надлежащего уровня, вы должны сначала узнать о химии бассейна и о том, как достичь оптимального pH для вашего бассейна. Уровень pH воды в бассейне показывает, насколько кислой или щелочной является вода. Хотя вы, вероятно, понимаете, что слишком кислая вода может быть опасной, щелочная вода также может быть проблематичной.
Избыток щелочи может вызвать раздражение кожи и проблемы с желудочно-кишечным трактом. Слишком высокая щелочность также может вызвать проблемы с нормальным рН вашего тела, что может привести к состоянию, известному как метаболический алкалоз . Развитие этого состояния здоровья может вызвать такие симптомы, как рвота, тошнота, спутанность сознания, тремор рук и подергивание мышц.
Уровень pH воды в вашем бассейне напрямую влияет на любой другой тип химического баланса в воде. Когда вы используете датчик pH Sensorex для проверки уровня pH вашей воды, показание, равное нулю, указывает на очень кислую воду. С другой стороны, максимальное значение 14 указывает на то, что в воде слишком много щелочи. Нейтральное значение pH равно семи. Для воды в бассейне ваши показания обычно должны быть между 7,2-7,6. При таком уровне pH вашей коже и глазам может быть очень комфортно, когда вы находитесь в воде. Этот уровень pH также указывает на идеальный уровень хлора в воде, что гарантирует минимальный рост грибков, бактерий и водорослей. При правильном уровне pH в вашем бассейне не образуется накипь.
Снижение щелочности воды
Если вода в вашем бассейне становится слишком щелочной или щелочной, вы можете использовать соляную кислоту для снижения уровня pH. Если вода в вашем бассейне становится слишком щелочной, хлор в воде не будет работать должным образом, что может привести к образованию накипи, раздражению глаз, если кто-то плавает в воде, а также помутнению и обесцвечиванию воды в бассейне. . Хотя вещество, известное как бисульфат натрия, также может снижать pH, соляная кислота обеспечивает дополнительные преимущества , наиболее заметным из которых является повышение концентрации свободного хлора в воде бассейна.
. Хотя вещество, известное как бисульфат натрия, также может снижать pH, соляная кислота обеспечивает дополнительные преимущества , наиболее заметным из которых является повышение концентрации свободного хлора в воде бассейна.
Когда вы добавляете этот кислый раствор в щелочную воду, вы эффективно снижаете щелочность воды, одновременно повышая ее кислотность. Если вы используете правильное количество в воде вашего бассейна, вы сможете снизить уровень pH до нужного числа. Наряду с поддержанием чистоты воды и отсутствием накипи в бассейне, поддержание надлежащего химического состава воды в бассейне часто также удерживает пловцов.0128 безопасный и здоровый .
Общие инструкции и указания по технике безопасности при работе с соляной кислотой
Соляная кислота считается сильно коррозионной, а это означает, что ее использование может быть опасным при неправильном обращении. Прежде всего, необходимо еженедельно проверять уровень pH в бассейне. Если вы обнаружите, что эти уровни достигли уровня pH выше 7,6, возможно, пришло время добавить эту кислоту в воду. Прежде чем обращаться с этим веществом, необходимо принять несколько мер предосторожности. При использовании соляной кислоты необходимо избегать контакта вещества с глазами и кожей.
Если вы обнаружите, что эти уровни достигли уровня pH выше 7,6, возможно, пришло время добавить эту кислоту в воду. Прежде чем обращаться с этим веществом, необходимо принять несколько мер предосторожности. При использовании соляной кислоты необходимо избегать контакта вещества с глазами и кожей.
Когда эта кислота вступает в контакт с кожей, она может вызвать серьезные ожоги, которые часто требуют медицинской помощи. Что касается глаз, соляная кислота нанесет непоправимый вред и может даже вызвать слепоту. Также важно не вдыхать пары соляной кислоты. Это может привести к серьезному повреждению дыхательных путей. Чтобы безопасно использовать это вещество, вы должны носить сапоги, защитные очки и резиновые перчатки. Прежде чем поместить кислоту в воду бассейна, убедитесь, что все пловцы вышли из бассейна. Если вы примете эти меры предосторожности, использование соляной кислоты должно быть относительно простым и безопасным процессом.
Очистка вашего домашнего бассейна
Чтобы начать процесс очистки бассейна, вы должны начать с добавления соляной кислоты в пластиковое ведро с водой вашего бассейна. Имейте в виду, что вы всегда должны добавлять кислоту в воду, так как добавление воды в кислоту может быть опасным. После того, как вы создали смесь и правильно разбавили кислоту, вам нужно дать раствору отдохнуть в течение 30 минут. Прежде чем продолжить, убедитесь, что вы включили фильтры в своем пуле. Во время работы фильтра добавляйте очень небольшое количество раствора в воду бассейна, что следует делать по всему периметру вашего бассейна.
Имейте в виду, что вы всегда должны добавлять кислоту в воду, так как добавление воды в кислоту может быть опасным. После того, как вы создали смесь и правильно разбавили кислоту, вам нужно дать раствору отдохнуть в течение 30 минут. Прежде чем продолжить, убедитесь, что вы включили фильтры в своем пуле. Во время работы фильтра добавляйте очень небольшое количество раствора в воду бассейна, что следует делать по всему периметру вашего бассейна.
Если вы хотите эффективно очистить свой бассейн, убедитесь, что вы не добавляете в бассейн значительное количество вещества за один раз. Оставьте фильтр включенным на 2–4 часа, прежде чем снова проверить уровень pH воды. В этот момент ваша вода должна иметь соответствующий уровень pH 7,2-7,6. Чтобы получить правильные показания, вам нужно, чтобы кислота правильно рассеялась после того, как она окажется в воде, что лучше всего работает в ранние утренние часы.
Самым сложным аспектом использования соляной кислоты для очистки домашнего бассейна является определение того, сколько кислоты необходимо добавить в бассейн. Если вы хотите, чтобы ваши показания pH были правильными, а вода в вашем бассейне оставалась безопасной для использования, важно использовать правильное количество кислоты. Если вы проверяете уровень pH с помощью датчика, такого как ph2000, вам необходимо записать полученные показания. Если уровень pH ниже 7,2, ни в коем случае нельзя использовать соляную кислоту. В то время как низкий уровень pH может быть вредным и за ним следует следить, соляная кислота способна только снизить уровень pH. Если уровень pH находится в пределах 7,2-7,6, эти значения считаются оптимальными, а это означает, что соляная кислота не нужна.
Если вы хотите, чтобы ваши показания pH были правильными, а вода в вашем бассейне оставалась безопасной для использования, важно использовать правильное количество кислоты. Если вы проверяете уровень pH с помощью датчика, такого как ph2000, вам необходимо записать полученные показания. Если уровень pH ниже 7,2, ни в коем случае нельзя использовать соляную кислоту. В то время как низкий уровень pH может быть вредным и за ним следует следить, соляная кислота способна только снизить уровень pH. Если уровень pH находится в пределах 7,2-7,6, эти значения считаются оптимальными, а это означает, что соляная кислота не нужна.
Измерение уровня pH
Если вы получили значение 8,0, количество используемой соляной кислоты должно составлять 110 мл на 10 000 литров воды в бассейне, 320 мл на 30 000 литров воды в бассейне, 540 мл на 50 000 литров воды, и 1,1 литра кислоты на 100 000 литров воды. Если показания pH воды в вашем бассейне достигли 8,4 или выше, количество используемой кислоты должно составлять 180 мл на 10 000 литров, 540 мл на 30 000 литров, 900 мл на 50 000 литров и 1,8 литра на 100 000 литров воды.


