Содержание
Всё о родниковой воде Хьовра-хий — «Ингушетия» — интернет-газета
Желание узнать больше об этой чудодейственной воде появилось у меня после беседы с одним моим знакомым, который рассказал, как эта вода вылечила от панкреатита, а потом и от язвы, его родственников.
«Это было после событий осени 1992 года, — вспоминает мой собеседник Ахмед Барахоев. — Я был беженцем из Пригородного района и проживал тогда в станице Троицкой в Ингушетии (ныне с. п. Троицкое). А про воду из Хьовра-хьаст (Хьовра-родник) слышал ещё в 80-х годах. Нам её привез для бабушки, которая болела панкреатитом, Багаудин Долаков из селения Ангушт.
После употребления этой воды, недели через две, бабушка оправилась, взбодрилась, можно сказать, встала на ноги. После этого мы как-то забыли про эту воду. Жили в пригороде Владикавказа и лечились, как и многие, по-современному — таблетками и уколами. Но спустя годы обострилась язва у моего отца. А времена были тяжёлые, в стране экономический и политический кризис, Ингушетия переполнена беженцами, врачей не хватает, денег и подавно нет, да и с лекарствами кризис. Вот и вспомнили про народную медицину и про этот родник. Тогда только пробили дорогу в горах, ещё лежали деревянные мосты, их было пять через реку Ассу. Подъехали мы к тому месту, откуда надо было спуститься вниз, метров на 100, к источнику. Спускаться приходилось по старой лестнице, выложенной из камней в 40-50-х годах, по рассказам стариков, грузинами, которые жили тогда в наших домах после высылки ингушей. Когда ингуши вернулись в свои родные сёла, они освободили дома и возвратились в Грузию, а лестница осталась, как добрая память о них. Говорят, наши старики долгие годы возносили хвалу в их честь.
Вот и вспомнили про народную медицину и про этот родник. Тогда только пробили дорогу в горах, ещё лежали деревянные мосты, их было пять через реку Ассу. Подъехали мы к тому месту, откуда надо было спуститься вниз, метров на 100, к источнику. Спускаться приходилось по старой лестнице, выложенной из камней в 40-50-х годах, по рассказам стариков, грузинами, которые жили тогда в наших домах после высылки ингушей. Когда ингуши вернулись в свои родные сёла, они освободили дома и возвратились в Грузию, а лестница осталась, как добрая память о них. Говорят, наши старики долгие годы возносили хвалу в их честь.
К тому времени, когда мне самому пришлось поехать к этому источнику, лестница практически была разбита, но спускаться по ней ещё можно было. Время было уже за полдень, я увидел стоящую в стороне грузовую машину. А внизу у родника сидели двое пожилых грузин. Я поздоровался и решил, что они ждут, пока наберется вода, но под тоненькой струёй не было никакой ёмкости. Я спросил у них: «Вы за водой?» «Да, — ответили они, — но ждём, пока зайдёт солнце. Ваши старики нам советовали набирать её только ночью, и желательно в глиняную посуду. Она ночью обогащается серебром, а в глиняной посуде лучше сохраняет свои целебные свойства». В тот день я всё же набрал воду из источника в свою флягу, однако в следующий раз набирал её до восхода солнца. Но вот с глиняной посудой мне не везло, а вот у грузин в тот день были большие глиняные кувшины с двумя ручками, где они хранят обычно вино, плотно укреплённые в деревянных ящиках«.
Ваши старики нам советовали набирать её только ночью, и желательно в глиняную посуду. Она ночью обогащается серебром, а в глиняной посуде лучше сохраняет свои целебные свойства». В тот день я всё же набрал воду из источника в свою флягу, однако в следующий раз набирал её до восхода солнца. Но вот с глиняной посудой мне не везло, а вот у грузин в тот день были большие глиняные кувшины с двумя ручками, где они хранят обычно вино, плотно укреплённые в деревянных ящиках«.
О том, что есть такой источник в горах, недалеко от горного селения Гули, между селениями Бишт и Кязи, знают почти все ингуши. Говорят, впервые о целебных свойствах воды люди узнали тогда, когда больные животные, раненные в схватках или при каких-либо других ситуациях, излечивали здесь свои недуги. Само слово «хьовра» в переводе с ингушского языка означает «нарыв» или «рана». Целебность этого источника подтвердилась уже позже научными исследователями из Санкт-Петербурга. Выяснилось, что вода содержит большой процент серебра. А вода с серебром, как известно, является сильнейшим природным консервантом, и она ничуть не хуже настойки йода или раствора хлора, но плюс серебро не портит вкусовых качеств воды, как это делает, например, хлор, хотя действует длительнее. Серебряная вода способна накапливать частички биоэнергии и отдавать их людям. Воду, обогащенную серебром, используют сегодня для консервации соков, детского питания, напитков, молокопродуктов. Цветы, поставленные в вазу с серебряной водой, не вянут в течение месяца. Семена овощных культур, промытые такой водой перед посадкой, прорастают быстрее обычного и дают высокие урожаи.
А вода с серебром, как известно, является сильнейшим природным консервантом, и она ничуть не хуже настойки йода или раствора хлора, но плюс серебро не портит вкусовых качеств воды, как это делает, например, хлор, хотя действует длительнее. Серебряная вода способна накапливать частички биоэнергии и отдавать их людям. Воду, обогащенную серебром, используют сегодня для консервации соков, детского питания, напитков, молокопродуктов. Цветы, поставленные в вазу с серебряной водой, не вянут в течение месяца. Семена овощных культур, промытые такой водой перед посадкой, прорастают быстрее обычного и дают высокие урожаи.
Серебряной водой пользовались издревле и пользуются сегодня. Известны случаи исцеления от тяжёлых болезней почек, печени, мочевого пузыря, сердца и сосудов, а также онкологических заболеваний. Известный хирург Пирогов, изучавший методы лечения огнестрельных и гнойных ран горцами, тоже писал об этой чудодейственной воде. На основании его трудов серебро получило довольно широкое распространение во время Великой Отечественной войны. Этой водой лечили даже тогда, когда не получали эффекта от известной мази Вишневского при лечении не заживающихся огнестрельных ран. Можно ещё долго перечислять достоинства серебряной воды.
Этой водой лечили даже тогда, когда не получали эффекта от известной мази Вишневского при лечении не заживающихся огнестрельных ран. Можно ещё долго перечислять достоинства серебряной воды.
Интересно было выяснить, почему воду из этого источника следовало набирать после захода солнца. Оказывается, из-за высокой чувствительности ионов серебра к солнечному свету лечебная активность серебряной воды снижается. Известно, что когда концентрация серебра в воде доходит до 4 мг в литре, она оказывает серьезное бактерицидное воздействие на патогенные микроорганизмы и положительно влияет на организм в целом, а под солнечным светом эта цифра снижается в разы. То есть с восходом солнца концентрация серебра в воде сокращается и доходит до минимума в полдень. Видимо, по этой же причине с восходом солнца сокращается и толпа паломников, которая совершает таинства омовения в «святых купелях» священной реки Ганг в Индии, которая также богата ионами серебра.
Полезную информацию о свойствах серебряной воды даёт нам в своих исследованиях и М. Ершов в книге «Самые распространенные способы очистки воды». Он отмечает, что в научно-исследовательских институтах России, Украины, и Таджикистана изучалось действие серебра на возбудителей инфекционных заболеваний, передающихся через воду, таких как холера, дизентерия, брюшной тиф и другие. Исследования показали, что антимикробный эффект серебра очень высок, а бактерицидный эффект серебра проявляется уже при концентрации 1-2 мг в литре и времени контакта от 10 до 60 минут. Наиболее чувствительными оказались возбудители холеры, затем возбудители тифопаратифозных инфекций и дизентерийные бактерии. Серебро обладает более высоким антимикробным эффектом, чем пенициллин, биомицин и другие антибиотики, и оказывает губительное действие на антибиотикоустойчивые штаммы бактерий, то есть серебро обладает несравненным преимуществом перед всеми антимикробными средствами. Вода, содержащая серебро в количестве 1 мг в литре, хорошо инактивирует вирусы гриппа различных штаммов. Даже при значительно меньших концентрациях она способна убивать многие патогенные организмы, вызывающие опасные водные эпидемии.
Ершов в книге «Самые распространенные способы очистки воды». Он отмечает, что в научно-исследовательских институтах России, Украины, и Таджикистана изучалось действие серебра на возбудителей инфекционных заболеваний, передающихся через воду, таких как холера, дизентерия, брюшной тиф и другие. Исследования показали, что антимикробный эффект серебра очень высок, а бактерицидный эффект серебра проявляется уже при концентрации 1-2 мг в литре и времени контакта от 10 до 60 минут. Наиболее чувствительными оказались возбудители холеры, затем возбудители тифопаратифозных инфекций и дизентерийные бактерии. Серебро обладает более высоким антимикробным эффектом, чем пенициллин, биомицин и другие антибиотики, и оказывает губительное действие на антибиотикоустойчивые штаммы бактерий, то есть серебро обладает несравненным преимуществом перед всеми антимикробными средствами. Вода, содержащая серебро в количестве 1 мг в литре, хорошо инактивирует вирусы гриппа различных штаммов. Даже при значительно меньших концентрациях она способна убивать многие патогенные организмы, вызывающие опасные водные эпидемии. При этом серебро не меняет ни цвета, ни вкуса, ни запаха воды, и агрегатное состояние тоже остаётся неизменным.
При этом серебро не меняет ни цвета, ни вкуса, ни запаха воды, и агрегатное состояние тоже остаётся неизменным.
Если воду, содержащую ионы серебра, прокипятить, серебро восстанавливается и переходит в физиологически неактивные формы. Кроме того, автор подтверждает, что водный раствор серебра по своему эффекту во много раз превосходит все другие средства, используемые для обеззараживания воды. Серебро, действуя медленнее хлора и сохраняя в течение длительного времени бактерицидные свойства, может с успехом применяться в тех случаях, когда использование хлора противопоказано. Например, на кораблях, в плавательных бассейнах, в полевых условиях и т. д., а также тогда, когда хлор при взаимодействии с примесями воды дает токсические или сильно пахнущие соединения. Эти ценные качества серебра находят применение в медицине, пищевой и других отраслях народного хозяйства. Серебро — это единственный препарат, который позволяет сохранять высокие санитарно-гигиенические показатели питьевой воды в течение многих месяцев и даже лет. Ершов отмечает также, что серебряная вода используется при лечении желудочно-кишечных заболеваний, язвенной болезни, холециститов, воспалительных процессов носа, глаз, в дерматологии, в венерологии, в стоматологии. Даже в малых дозах серебра в воде она оказывает «омолаживающее» действие на кровь в течение 15 суток, задерживает процессы старения, обеспечивает нормальную работу мозга, стимулирует иммунитет, успокаивает и повышает настроение. Ее используют при полетах космонавты, для очистки плавательных бассейнов в Японии и США, широко применяют в Англии, Швейцарии, Германии, Чехии, Словакии, Франции и других странах.
Ершов отмечает также, что серебряная вода используется при лечении желудочно-кишечных заболеваний, язвенной болезни, холециститов, воспалительных процессов носа, глаз, в дерматологии, в венерологии, в стоматологии. Даже в малых дозах серебра в воде она оказывает «омолаживающее» действие на кровь в течение 15 суток, задерживает процессы старения, обеспечивает нормальную работу мозга, стимулирует иммунитет, успокаивает и повышает настроение. Ее используют при полетах космонавты, для очистки плавательных бассейнов в Японии и США, широко применяют в Англии, Швейцарии, Германии, Чехии, Словакии, Франции и других странах.
Автор подтверждает, что при длительном хранении для обеспечения высоких санитарно-гигиенических показателей питьевой воды необходимо содержать ее в ёмкостях из металлов, которые в периодической системе элементов Менделеева стоят левее серебра (у серебра 47-й номер). Значит, посуда из стали, алюминия, оцинкованного железа и др. непригодна для долговременного хранения воды, содержащей серебро, так как его бактерицидное действие при взаимодействии с этими металлами полностью прекращается. Кроме того, ёмкость подвергается ещё и коррозии. Однако ёмкости, покрытые силикатным или органическим стеклом, высококачественной цементной штукатуркой (например, колодцы для воды) или стойкими силикатными эмалями, можно использовать для хранения питьевой воды, содержащей ионы серебра. По истечении 6-12 месяцев вода в этих емкостях соответствует всем требованиям, предъявляемым к ней. Серебряную воду можно длительно хранить в стеклянной и полиэтиленовой посуде в недоступном для солнечных лучей месте. Однако полиэтиленовая тара несколько снижает санитарно-гигиенические показатели воды: ухудшается ее вкус и повышается окисляемость.
Кроме того, ёмкость подвергается ещё и коррозии. Однако ёмкости, покрытые силикатным или органическим стеклом, высококачественной цементной штукатуркой (например, колодцы для воды) или стойкими силикатными эмалями, можно использовать для хранения питьевой воды, содержащей ионы серебра. По истечении 6-12 месяцев вода в этих емкостях соответствует всем требованиям, предъявляемым к ней. Серебряную воду можно длительно хранить в стеклянной и полиэтиленовой посуде в недоступном для солнечных лучей месте. Однако полиэтиленовая тара несколько снижает санитарно-гигиенические показатели воды: ухудшается ее вкус и повышается окисляемость.
Можно, само собой разумеется, содержать воду и в серебряной посуде. Ещё в V веке до нашей эры персидский царь Кир Старший, отправляясь в поход, брал с собой большие запасы чистейшей воды из целебного источника и перевозил ее в серебряных «священных» сосудах, чтобы она сохранила свежесть. Можно хранить её и в сосудах из золота и меди. Исходя из сказанного, становится ясным, почему наши предки советовали хранить воду в глиняной посуде, наиболее доступной и надёжной для серебряной воды в те годы.
Информацию эту я посчитала полезной, потому как в наше время люди обратили свои взоры к целебным источникам горной Ингушетии и обычно её набирают, а потом и хранят в пластиковой посуде, получившей широкое распространение в последние годы. Становится ясным и то, что Хьовра-хий наиболее высокую концентрацию серебра содержит в себе ночью, а значит, удваиваются и целебные свойства воды. Набирать же ее, исходя из того, что мы сегодня имеем под рукой, можно в пластиковую посуду, хотя предпочтение отдаётся стеклянной, но вот хранить её, как советует исследователь Ершов, желательно в стеклянной или эмалированной посуде, но в недоступном для солнца месте. Или, как советовали наши предки, набирать и хранить в глиняных сосудах, которые жителям нашего времени менее доступны.
Получить серебряную воду можно и в домашних условиях. Для этого рекомендуют дистиллированную воду хранить в серебряной посуде, или серебряную ложку либо серебряные монеты опустить на время в воду, или с помощью электричества, взяв за «плюс» серебряный предмет и за «минус» нержавеющую сталь, например обычное лезвие. Продаются сегодня для этих целей и электрические ионаторы. Но это всё явления технического прогресса, а предпочтительней всё же дар Всевышнего, Божий источник, насыщенный святостью и благодатью. Наши предки жили в гармонии с природой и знали, как пользоваться этими дарами.
Продаются сегодня для этих целей и электрические ионаторы. Но это всё явления технического прогресса, а предпочтительней всё же дар Всевышнего, Божий источник, насыщенный святостью и благодатью. Наши предки жили в гармонии с природой и знали, как пользоваться этими дарами.
Оксид серебра (I), свойства и получение, химические реакции
Оксид серебра (I), свойства и получение, химические реакции.
Оксид серебра (I) – неорганическое вещество, имеет химическую формулу Ag2O.
Краткая характеристика оксида серебра (I)
Физические свойства оксида серебра (I)
Получение оксида серебра (I)
Химические свойства оксида серебра (I)
Химические реакции оксида серебра (I)
Применение и использование оксида серебра (I)
Краткая характеристика оксида серебра (I):
Оксид серебра (I) – неорганическое вещество коричнево-черного цвета.
Химическая формула оксида серебра (I) Ag2O.
В воде практически не растворяется. Растворимость оксида серебра (I) в воде 0,017 грамм на литр. При растворении в воде оксид серебра (I) придает воде слабощелочную реакцию.
Оксид серебра (I) под воздействием солнечного света медленно чернеет, высвобождая кислород.
Имеет почти такую же электрическую проводимость, как и у чистого серебра.
Физические свойства оксида серебра (I):
| Наименование параметра: | Значение: |
| Химическая формула | Ag2O |
| Синонимы и названия иностранном языке | silver oxide (англ.) |
| Тип вещества | неорганическое |
| Внешний вид | буро-черные кубические кристаллы |
| Цвет | коричнево-черный |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 7140 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 7,14 |
| Температура разложения, °C | 280 |
| Молярная масса, г/моль | 231,735 |
* Примечание:
— нет данных.
Получение оксида серебра (I):
Оксид серебра (I) получается в результате следующих химических реакций:
- 1. путем взаимодействия нитрата серебра со щёлочью (например, гидроксидом натрия или гидроксидом калия) в водном растворе:
2AgNO3 + 2NaOH → Ag2O + 2NaNO3 + H2O,
2AgNO3 + 2KOH → Ag2O + 2KNO3 + H2O.
В ходе химической реакции образуется гидроксид серебра, который быстро разлагается на оксид серебра (I) и воду:
2AgOH → Ag2O + H2O.
- 2. путем анодного окисления металлического серебра в дистиллированной воде.
- 3. путем нагревания гидроксида серебра:
2AgOH → Ag2O + H2O (to).
- 4. путем термического разложения карбоната серебра:
Ag2CO3 → Ag2O + CO2 (t = 100-140 oC).
Химические свойства оксида серебра (I). Химические реакции оксида серебра (I):
Оксид серебра (I) – основный оксид.
Химические свойства оксида серебра (I) аналогичны свойствам оксидов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция оксида серебра (I) с водородом:
Ag2О + H2 → 2Ag + H2O (t = 150 oC).
В результате реакции оксида серебра (I) и водорода происходит восстановление серебра: образуется чистое серебро и вода.
2. реакция оксида серебра (I) с оксидом углерода (углекислым газом):
Ag2O + CO2 → Ag2CO3.
Оксид серебра (I) реагирует с углекислым газом (являющийся кислотным оксидом), образуя соль – карбонат серебра. При этом в качестве исходного вещества используется оксид серебра (I) в виде суспензии.
3. реакция оксида серебра (I) с угарным газом:
Ag2О + CO → 2Ag + CO2.
В результате реакции оксида серебра (I) с угарным газом происходит восстановление серебра: образуется чистое серебро и углекислый газ.
4. реакция оксида серебра (I) с водой:
Ag2O + H2O = 2Ag+ + 2OH-.
Оксид серебра (I) плохо растворяется в воде и придает ей слабощелочную реакцию.
5. реакция оксида серебра (I) с оксидом теллура:
TeO3 + 3Ag2O → Ag6TeO6 (t = 200 oC).
В результате реакции образуется теллурат серебра (I) .
6. реакция оксида серебра (I) с плавиковой кислотой:
Ag2O + 2HF → 2AgF + H2O.
В результате химической реакции получается соль – фторид серебра (I) и вода.
7. реакция оксида серебра (I) с азотной кислотой:
Ag2O + 2HNO3 → 2AgNO3 + H2O.
В результате химической реакции получается соль – нитрат серебра (I) и вода.
Аналогично проходят реакции оксида серебра (I) и с другими кислотами.
8. реакция оксида серебра (I) с бромистым водородом (бромоводородом):
Ag2O + 2HBr → 2AgBr + H2O.
В результате химической реакции получается соль – бромид серебра (I) и вода.
9. реакция оксида серебра (I) с йодоводородом:
Ag2O + 2HI → 2AgI + H2O.
В результате химической реакции получается соль – йодид серебра (I) и вода.
10. реакция оксида серебра (I) с аммиаком и водой:
Ag2O + 4NH3 + H2O → 2[Ag(NH3)2]OH.
В результате химической реакции получается гидроксид диамминсеребра.
11. реакция термического разложения оксида серебра (I):
2Ag2O → 4Ag + O2 (t = 160-300 oC).
В результате химической реакции образуется чистое серебро и кислород.
12. реакция оксида серебра (I) с гидроксидом натрия и водой:
Ag2O + 2NaOH + H2O ⇄ 2Na[Ag(OH)2].
В результате химической реакции получается дигидроксоаргенатат натрия.
13. реакция оксида серебра (I) с гидроксидом калия и водой:
Ag2O + 2KOH + H2O → 2K[Ag(OH)2].
В результате химической реакции получается дигидроксоаргентат калия.
14. реакция оксида серебра (I) с пероксидом водорода:
Ag2O + H2O2 → 2Ag + H2O + O2.
В результате реакции оксида серебра (I) и пероксида водорода происходит восстановление серебра: образуется чистое серебро, кислород и вода.
Применение и использование оксида серебра (I):
Оксид серебра (I) используется в медицине как антисептическое средство.
Примечание: © Фото //www.pexels.com, //pixabay.com
карта сайта
оксид серебра (I) реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида серебра (I)
реакции с оксидом серебра (I)
Коэффициент востребованности 0
comments powered by HyperComments
Источник публикации
Читайте также
Накопление серебра из питьевой воды в мозжечке и камбаловидной мышце у мышей
. 2003 г., 15 апреля; 186 (1–2): 151–7.
2003 г., 15 апреля; 186 (1–2): 151–7.
doi: 10.1016/s0300-483x(02)00743-6.
Кай ХО Пелконен
1
, Хельви Хейнонен-Тански, Осмо О П Ханнинен
Филиалы
принадлежность
- 1 Кафедра физиологии, Университет Куопио, POB 1627, FIN 70211 Куопио, Финляндия.
PMID:
12604179
DOI:
10.1016/s0300-483x(02)00743-6
Кай Х. О. Пелконен и соавт.
Токсикология.
.
. 2003 г., 15 апреля; 186 (1–2): 151–7.
2003 г., 15 апреля; 186 (1–2): 151–7.
doi: 10.1016/s0300-483x(02)00743-6.
Авторы
Кай ХО Пелконен
1
, Хельви Хейнонен-Тански, Осмо О П Ханнинен
принадлежность
- 1 Кафедра физиологии, Университет Куопио, POB 1627, FIN 70211 Куопио, Финляндия.
PMID:
12604179
DOI:
10.1016/s0300-483x(02)00743-6
Абстрактный
Несмотря на общую токсичность, экотоксичность и малоизвестный метаболизм серебра, ВОЗ допускает использование ионов серебра (Ag) до 0,1 мг/л при обеззараживании питьевой воды.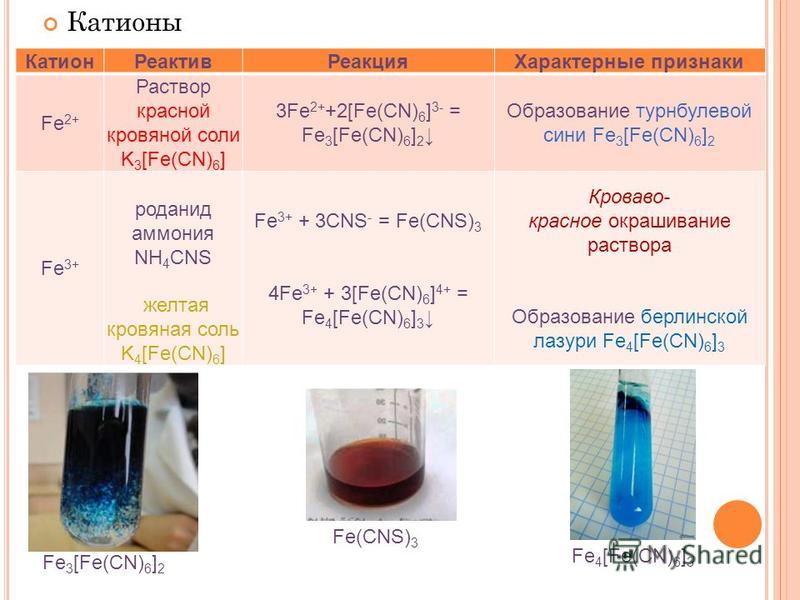 Для определения накопления и распределения серебра в организме млекопитающих мышам в течение 1 и 2 недель давали питьевую воду, содержащую в 3 раза меньшую концентрацию, а именно 0,03 мг/л ионов серебра в виде нитрата серебра, меченного 110 мАг. Концентрации серебра в различных тканях анализировали по гамма-радиоактивности. Насыщение тканей серебром, по-видимому, происходит быстро, так как не было статистических различий между содержанием серебра в тканях мышей, несмотря на дизайн исследования, согласно которому мышам вводили серебро в течение 1 или 2 недель. Самые высокие концентрации были обнаружены в камбаловидной мышце (m. soleus), мозжечке, селезенке, двенадцатиперстной кишке и мышце миокарда в порядке ранжирования. Было обнаружено, что концентрации серебра в икроножной мышце (m. gastrocnemius) отрицательно коррелируют с головным мозгом и положительно — с кровью и почками. Накопление серебра в органах и тканях, важных для двигательных функций, может иметь значение, особенно в чрезвычайных ситуациях и ситуациях катастроф, когда точные двигательные функции могут иметь решающее значение.
Для определения накопления и распределения серебра в организме млекопитающих мышам в течение 1 и 2 недель давали питьевую воду, содержащую в 3 раза меньшую концентрацию, а именно 0,03 мг/л ионов серебра в виде нитрата серебра, меченного 110 мАг. Концентрации серебра в различных тканях анализировали по гамма-радиоактивности. Насыщение тканей серебром, по-видимому, происходит быстро, так как не было статистических различий между содержанием серебра в тканях мышей, несмотря на дизайн исследования, согласно которому мышам вводили серебро в течение 1 или 2 недель. Самые высокие концентрации были обнаружены в камбаловидной мышце (m. soleus), мозжечке, селезенке, двенадцатиперстной кишке и мышце миокарда в порядке ранжирования. Было обнаружено, что концентрации серебра в икроножной мышце (m. gastrocnemius) отрицательно коррелируют с головным мозгом и положительно — с кровью и почками. Накопление серебра в органах и тканях, важных для двигательных функций, может иметь значение, особенно в чрезвычайных ситуациях и ситуациях катастроф, когда точные двигательные функции могут иметь решающее значение.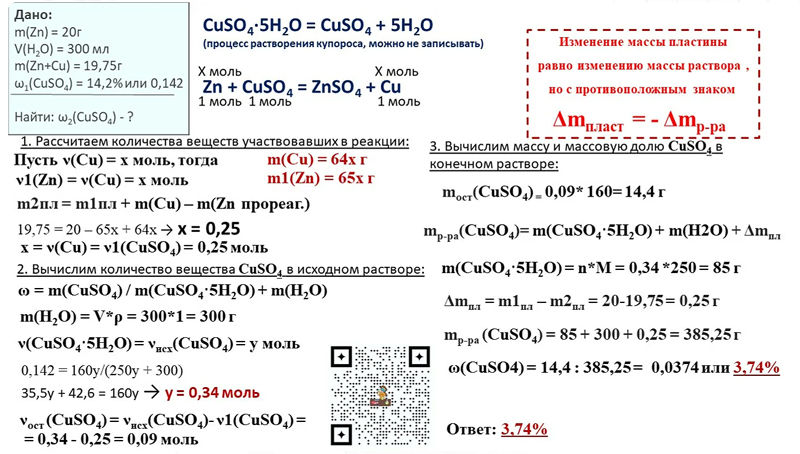 Возможно, потребуется переоценка настоящих рекомендаций по использованию солей серебра для дезинфекции питьевой воды.
Возможно, потребуется переоценка настоящих рекомендаций по использованию солей серебра для дезинфекции питьевой воды.
Похожие статьи
Распределение и накопление наночастиц серебра размером 10 нм в тканях матери и висцеральном желточном мешке беременных мышей и потенциальное влияние на рост эмбриона.
Остин К.А., Хинкли Г.К., Мишра А.Р., Чжан К., Умбрейт Т.Х., Бетц М.В., Э. Вильдт Б., Кейси Б.Дж., Франке-Кэрролл С., Хуссейн С.М., Робертс С.М., Браун К.М., Геринг П.Л.
Остин, Калифорния, и соавт.
Нанотоксикология. 2016 авг; 10 (6): 654-61. дои: 10.3109/17435390.2015.1107143. Epub 2015 23 ноября.
Нанотоксикология. 2016.PMID: 26593872
Токсичность и поглощение серебра жаберными и кишечными органами у морских костистых рыб Parophrys vetulus.

Гроселл М, Вуд СМ.
Гроселл М. и соавт.
J Comp Physiol B. 2001 Oct; 171 (7): 585-94. doi: 10.1007/s003600100209.
J Comp Physiol B. 2001.PMID: 11686617
Наносеребро в питьевой воде и источниках питьевой воды: стабильность и влияние на образование побочных продуктов дезинфекции.
Тугулеа А.М., Берубе Д., Гиддингс М., Лемье Ф., Хнатив Дж., Прием Дж., Аврамеску М.Л.
Тугулеа А.М. и др.
Environ Sci Pollut Res Int. 2014 Октябрь; 21 (20): 11823-31. doi: 10.1007/s11356-014-2508-5. Epub 2014 24 января.
Environ Sci Pollut Res Int. 2014.PMID: 24458938
Бесплатная статья ЧВК.Селективная индукция аутоантител против фибрилларина нитратом серебра у мышей.
Халтман П., Энестрём С., Терли С.
 Дж., Поллард К.М.
Дж., Поллард К.М.
Халтман П. и др.
Клин Эксп Иммунол. 1994 г., май; 96 (2): 285–91. doi: 10.1111/j.1365-2249.1994.tb06555.x.
Клин Эксп Иммунол. 1994.PMID: 8187336
Бесплатная статья ЧВК.Суммарные допустимые концентрации мономерного неорганического алюминия и гидратированных алюмосиликатов в питьевой воде.
Уилхайт К.С., Болл Г.Л., Маклеллан К.Дж.
Уилхайт С.С. и др.
Критический преподобный Toxicol. 2012 май; 42(5):358-442. doi: 10.3109/10408444.2012.674101.
Критический преподобный Toxicol. 2012.PMID: 22512666
Рассмотрение.
Посмотреть все похожие статьи
Цитируется
Явление токсичности и связанное с ним явление в наночастицах металлов и оксидов металлов: краткий обзор с биомедицинской точки зрения.

Аттарилар С., Ян Дж., Эбрахими М., Ван К., Лю Дж., Тан Й., Ян Дж.
Аттарилар С. и др.
Фронт Биоэнг Биотехнолог. 2020 17 июля; 8:822. doi: 10.3389/fbioe.2020.00822. Электронная коллекция 2020.
Фронт Биоэнг Биотехнолог. 2020.PMID: 32766232
Бесплатная статья ЧВК.Рассмотрение.
Общие паттерны экспрессии генов в организмах модели окружающей среды, подвергшихся воздействию инженерных наноматериалов: метаанализ.
Буркард М., Бетц А., Ширмер К., Зупаник А.
Буркард М. и соавт.
Технологии экологических наук. 2020 7 января; 54 (1): 335-344. doi: 10.1021/acs.est.9b05170. Epub 2019 13 декабря.
Технологии экологических наук. 2020.PMID: 31752483
Бесплатная статья ЧВК.Ингибирование Ca2+-активированных K+-каналов с большой проводимостью наномолярными концентрациями Ag+.

Чжоу Ю, Ся Х, Лингл Си Джей.
Чжоу Ю и др.
Мол Фармакол. 2010 ноябрь;78(5):952-60. doi: 10.1124/мол.110.066407. Epub 2010 20 августа.
Мол Фармакол. 2010.PMID: 20729303
Бесплатная статья ЧВК.
термины MeSH
вещества
Как и почему нитрат серебра растворяется в воде?
Растворим ли нитрат серебра в воде ? Серебро является очень востребованным металлом и существует в виде множества различных соединений. Нитрат серебра является одним из таких соединений и имеет множество применений, от медицины до фотографии.
При работе с любым соединением важно знать, растворяется ли это соединение в воде, чтобы можно было сохранить его стабильность при использовании.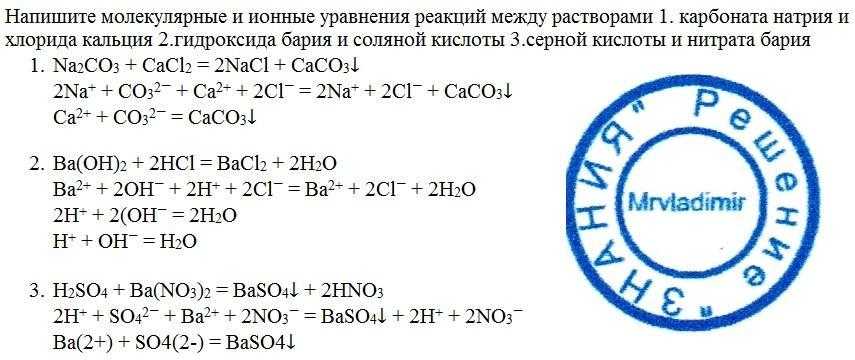 Интересно отметить, что нитрат серебра легко растворяется в воде . Но прежде чем мы углубимся в химию этого растворения, давайте разберемся, что такое нитрат серебра со структурной точки зрения.
Интересно отметить, что нитрат серебра легко растворяется в воде . Но прежде чем мы углубимся в химию этого растворения, давайте разберемся, что такое нитрат серебра со структурной точки зрения.
Что такое нитрат серебра?
Химическая формула нитрата серебра – AgNO3. Здесь Ag — химический символ серебра, а NO3 — нитрат. Структура нитрата может быть далее разбита на четыре атома, один атом азота (N) и три атома кислорода (O). Когда вы представляете нитрат серебра в виде химической диаграммы, это выглядит так.
О
||
Ag+ N
/ \
O O
В лаборатории ученые получают нитрат серебра, смешивая продукт серебра с азотной кислотой. Обычно они используют серебряные слитки и фольгу. В результате реакции образуется нитрат серебра и вода, а также оксид азота. Но здесь речь идет о том, как и почему нитрат серебра растворим в воде. Итак, давайте рассмотрим это в следующих разделах.
Почему нитрат серебра растворим в воде?
Молекула нитрата серебра образована прочной ионной связью. Это означает, что два компонента соединения, а именно серебро и нитрат, имеют противоположные заряды и притягиваются друг к другу.
Здесь серебро удерживает положительный заряд, а нитрат — отрицательный. Серебро заряжено положительно при образовании нитрата серебра, поскольку оно имеет дополнительный ион. Нитрат, с другой стороны, теряет ион.
Таким образом, они комбинируют и уравновешивают заряды друг друга. Но при помещении в воду серебро и нитрат разделяются. Это объясняет, почему нитрат серебра растворим в воде .
Какие ионы образует нитрат серебра при растворении в воде?
Теперь вы знаете, что серебро и нитрат разделяются, когда нитрат серебра растворяется в воде . Но что с ними становится? Ну, они возвращаются к своим ионным структурам, то есть серебро становится положительно заряженным ионом, а нитрат становится отрицательно заряженным ионом. Положительный ион также называют катионом, а отрицательный ион — анионом.
Положительный ион также называют катионом, а отрицательный ион — анионом.
Как серебро, так и нитраты обладают набором свойств, позволяющих идентифицировать их в окружающем нас мире. Ионы нитратов встречаются в природе в некоторых овощах и могут также использоваться в удобрениях. Однако слишком большое количество нитратов может быть токсичным. Серебро также имеет множество применений.
Обратите внимание, что даже после растворения нитрата серебра в воде серебро и нитраты не единственные ионы, которые вы там найдете. Вы, вероятно, найдете ионы натрия и хлорида, в зависимости от чистоты воды. Даже если вода очень чистая, в ней все равно можно найти ионы водорода и гидроксида.
Характеристики нитрата серебра до растворения в воде
Итак, до растворения нитрата серебра в воде , как он выглядит и ощущается? Нитрат серебра не имеет цвета и запаха. Но не заблуждайтесь, потому что это может быть опасно и токсично.
Это также высококоррозионное соединение. А при работе с нитратом серебра всегда следует избегать этанола. Нитрат серебра при смешивании с этанолом может быть взрывоопасен.
Несмотря на то, что нитрат серебра дает вам ионы серебра после растворения в воде, может быть трудно извлечь из него стабильную форму серебра. Но когда нитрат серебра нагревается до 440 градусов по Цельсию или 824 по Фаренгейту, он может разлагаться до элементарного серебра.
Для чего используется растворение нитрата серебра в воде?
Нитрат серебра находит широкое применение во многих отраслях промышленности. Одна из причин заключается в том, что отделение нитрат-иона после растворение нитрата серебра в воде открывает возможность легкого связывания других отрицательных ионов с ионом серебра. Одним из примеров является образование галогенидов серебра, которые широко используются в фотографии.
Нитрат серебра также может действовать как антисептик в чрезвычайно разбавленной форме.


 Дж., Поллард К.М.
Дж., Поллард К.М.
