вода. Вода название
вода
| Вода | |
 | |
 | |
 | |
| Систематическое наименование | Оксид водородаВода |
| Традиционные названия | вода |
| Химическая формула | Н2O |
| Молярная масса | 18,01528г/моль |
| Состояние (ст.усл.) | жидкость |
| Плотность | 0,9982г/см³ |
| Динамическая вязкость (ст.усл.) | 0,00101 Па·с(при 20°C) |
| Кинематическая вязкость (ст.усл.) | 0,01012см²/с(при 20°C) |
| Температура плавления | 0°C |
| Температура кипения | 99,974°C |
| Тройная точка | 0,01 °C, 611,73 Па |
| Критическая точка | 374 °C, 22,064 МПа |
| Молярная теплоёмкость (ст.усл.) | 75,37Дж/(моль·К) |
| Теплопроводность (ст.усл.) | 0,56Вт/(м·K) |
| Токсичность |  0 |
Вода — оксид водорода — химическое вещество в виде прозрачной жидкости, не имеющей цвета (в малом объёме), запаха и вкуса (при нормальных условиях). Химическая формула: Н2O. В твёрдом состоянии называется льдом или снегом, а в газообразном— водяным паром. Около 71% поверхности Земли покрыто водой (океаны, моря, озёра, реки, лёд). Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы). Вода имеет ключевое значение в создании и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды.
Вода — виды воды
Вода на Земле может существовать в трёх основных состояниях— жидком, газообразном и твёрдом и приобретать различные формы, которые могут одновременно соседствовать друг с другом: водяной пар и облака в небе, морская вода и айсберги, ледники и реки на поверхности земли, водоносные слои в земле. Вода способна растворять в себе много веществ, приобретая тот или иной вкус. Из-за важности воды, «как источника жизни», её нередко подразделяют на типы по различным принципам.
По особенностям происхождения, состава или применения, выделяют, в числе прочего:
- Мягкая вода и жёсткая вода— по содержанию катионов кальция и магния.
- По изотопам молекулы:
- Лёгкая вода (по составу почти соответствует обычной)
- Тяжёлая вода (дейтериевая)
- Сверхтяжёлая вода (тритиевая)
- Талая вода
- Пресная вода
- Дождевая вода
- Морская вода
- Подземные воды
- Минеральная вода
- Солоноватая вода (en:Brackish water)
- Питьевая вода, Водопроводная вода
- Дистиллированная вода и деионизированная вода
- Сточные воды
- Ливневая вода или поверхностные воды
- Мёртвая вода и Живая вода— виды воды из сказок (со сказочными свойствами)
- Святая вода— особый вид воды согласно религиозным учениям
- Поливода
- Структурированная вода— термин, применяемый в различных неакадемических теориях.
Химические названия воды
С формальной точки зрения вода имеет несколько различных корректных химических названий:
- Оксид водорода
- Гидроксид водорода
- Монооксид дигидрогена
- Гидроксильная кислота
- англ.hydroxic acid
- Оксидан
- Дигидромонооксид
Свойства
Физические свойства
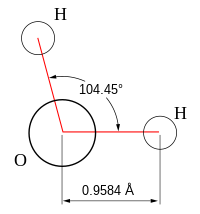
Вода в нормальных атмосферных условиях сохраняет жидкое агрегатное состояние, тогда как аналогичные водородные соединения являются газами. Это объясняется особыми характеристиками слагающих молекулы атомов и присутствием связей между ними. Атомы водорода присоединены к атому кислорода, образуя угол 104,45°, и эта конфигурация строго сохраняется. Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По этой причине молекула воды является активным диполем, где кислородная сторона отрицательна, а водородная положительна. В результате молекулы воды притягиваются своими противоположными полюсами, и образуют полярные связи, на разрыв которых требуется много энергии. В составе каждой молекулы Ион водорода (протон) не имеет внутренних электронных слоев и обладает малыми размерами, в результате чего он может проникать в электронную оболочку отрицательно поляризованного атома кислорода соседней молекулы, образуя водородную связь с другой молекулой. Каждая молекула связана с четырьмя другими посредством водородных связей — две из них образует атом кислорода и две атомы водорода. Комбинация этих связей между молекулами воды — полярной и водородной и определяет очень высокую температуру её кипения и удельную теплоты парообразования. В результате этих связей в водной среде возникает давление в 15-20 тыс. атмосфер, которое и объясняет причину трудносжимаемости воды, так при увеличении атмосферного давления на 1 бар, вода сжимается на 0,00005 доли её начального объёма.
Структуры воды и льда между собой очень похожи. В воде как и во льду молекулы стараются расположиться в определённом порядке — образовать структуру, однако тепловое движение этому препятствует. При температуре перехода в твёрдое состояние тепловое движение молекул более не препятствует образованию структуры, и молекулы воды упорядочиваются, в процессе этого объёмы пустот между молекулами увеличиваются и общая плотность воды падает, что и объясняет причину меньшей плотности воды в фазе льда. При испарении, напротив, рвутся все связи. Разрыв связей требует много энергии, отчего у воды самая большая удельная теплоёмкость среди прочих жидкостей и твёрдых веществ. Для того чтобы нагреть один литр воды на один градус, требуется затратить 4,1868 кДж энергии. Благодаря этому свойству вода нередко используется как теплоноситель. Однако удельная теплоёмкость воды, в отличие от других веществ непостоянна: при нагреве от 0 до 35 градусов Цельсия её удельная теплоёмкость падает, в то время как у других веществ она постоянна при изменении температуры. Помимо большой удельной теплоёмкости, вода также имеет большие значения удельной теплоты плавления (0 °C и 333,55 кДж/кг) и парообразования (2250 кДж/кг).
| -60 (лёд) | 1,64 |
| -20 (лёд) | 2,01 |
| -10 (лёд) | 2,22 |
| 0 (лёд) | 2,11 |
| 0 (чистая вода) | 4,218 |
| 10 | 4,192 |
| 20 | 4,182 |
| 40 | 4,178 |
| 60 | 4,184 |
| 80 | 4,196 |
| 100 | 4,216 |
Вода обладает также высоким поверхностным натяжением среди жидкостей, уступая в этом только ртути. Относительно высокая вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями. По сходным причинам вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде. Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле. Вода обладает отрицательным электрическим потенциалом поверхности.
Чистая (не содержащая примесей) вода — хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация протонов (точнее, ионов гидроксония h4O+) и гидроксильных ионов HO− составляет 0,1 мкмоль/л. Но поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные соли, то есть в воде присутствуют положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60 % парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи.
Вода агрегатные состояния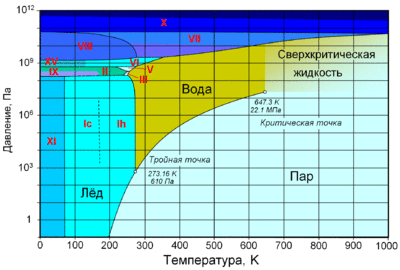
Фазовая диаграмма воды: по вертикальной оси — давление в Па, по горизонтальной — температура в Кельвинах. Отмечены критическая (647,3 K; 22,1 МПа) и тройная (273,16 K; 610 Па) точки. Римскими цифрами отмечены различные структурные модификации льда
.
По состоянию различают:
- Твёрдое— лёд
- Жидкое— вода
- Газообразное— водяной пар
При (оксид водорода)— химическое вещество в виде прозрачной жидкости, не имеющей цвета (в малом объёме), запаха и вкуса (при нормальных условиях). Химическая формула: Н2O. В твёрдом состоянии называется льдом или снегом, а в газообразном— водяным паром. Около 71% поверхности Земли покрыто водой (океаны, моря, озёра, реки, лёд).
Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Вода имеет ключевое значение в создании и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды.
Виды воды
Вода на Земле может существовать в трёх основных состояниях— жидком, газообразном и твёрдом и приобретать различные формы, которые могут одновременно соседствовать друг с другом: водяной пар и облака в небе, морская вода и айсберги, ледники и реки на поверхности земли, водоносные слои в земле. Вода способна растворять в себе много веществ, приобретая тот или иной вкус. Из-за важности воды, «как источника жизни», её нередко подразделяют на типы по различным принципам.
По особенностям происхождения, состава или применения, выделяют, в числе прочего:
| нормальные условия | +98,9° |
| 1 | +100° |
| 2 | +120° |
| 6 | +158° |
| 218,5 | +374,1° |
При росте давления температура кипения воды растёт, плотность водяного пара в точке кипения тоже растёт, а жидкой воды— падает. При температуре 374°C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении нет разницы между жидкой водой и водяным паром, следовательно, нет и кипения или испарения. Так же возможны метастабильные состояния— пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, нетрудно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0°C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Чистая вода способна как переохлаждаться не замерзая до температуры -33°C, так и быть перегрета до +200°C. За это её свойство она получила применение в промышленности (например в паровых турбинах). Существует тип воды, которая имеет плотность на 40% выше нормальной и закипает при температуре +300°С. Эта разновидность воды была открыта советским учёным Б. В. Дерягиным на поверхности кристаллов кварца.
Изотопные модификации воды
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов водорода, входящих в молекулу, выделяют следующие виды воды:
- Лёгкая вода (основная составляющая привычной людям воды) h3O.
- Тяжёлая вода (дейтериевая) D2O.
- Сверхтяжёлая вода (тритиевая) T2O.
- тритий-дейтериевая вода TDO
- тритий-протиевая вода THO
- дейтерий-протиевая вода DHO
Последние три вида возможны, так как молекула воды содержит два атома водорода. Протий — самый легкий изотоп водорода, дейтерий имеет атомную массу 2,0141017778 а.е.м., тритий — самый тяжелый, атомная масса 3,0160492777 а.е.м.
Известно, что тяжёлая вода не поддерживает жизни, то есть большинство живых организмов (за исключением некоторых микроорганизмов и грибов) в такой воде умирает.
По стабильным изотопам кислорода 16O, 17O и 18O существуют три разновидности молекул воды. Таким образом, по изотопному составу существуют 18 различных молекул воды. В действительности любая вода содержит все разновидности молекул.Химические свойства
Вода является наиболее распространённым растворителем на планете Земля, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ. Её иногда рассматривают, как амфолит — и кислоту и основание одновременно (катион H+ анион OH−). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa ≈ 16.
Вода химически довольно активное вещество. Сильно полярные молекулы воды сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности. Вода реагирует при комнатной температуре:
- с активными металлами (натрий, калий, кальций, барий и др.)
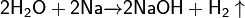
- с галогенами (фтором, хлором) и межгалоидными соединениями
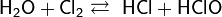
- с солями, образованными слабой кислотой и слабым основанием, вызывая их полный гидролиз
- с ангидридами и галогенангидридами карбоновых и неорганических кислот
- с активными металлорганическими соединениями (диэтилцинк, реактивы Гриньяра, метилнатрий ит.д.)
- с карбидами, нитридами, фосфидами, силицидами, гидридами активных металлов (кальция, натрия, лития и др.)
- со многими солями, образуя гидраты
- с боранами, силанами
- с кетенами, недоокисью углерода
- с фторидами благородных газов
Вода реагирует при нагревании:
- с железом, магнием
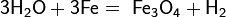
- с углем, метаном
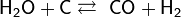
- с некоторыми алкилгалогенидами
Вода реагирует в присутствии катализатора:
- с амидами, эфирами карбоновых кислот
- с ацетиленом и другими алкинами
- с алкенами
- с нитрилами
Вода в природе
в атмосфере нашей планеты вода находится в виде капель малого размера, в облаках и тумане, а также в виде пара. При конденсации выводится из атмосферы в виде атмосферных осадков (дождь, снег, град, роса). В совокупности жидкая водная оболочка Земли называется гидросферой, а твёрдая криосферой. Вода является важнейшим веществом всех живых организмов на Земле. Предположительно, зарождение жизни на Земле произошло в водной среде. Мировой океан содержит более 96% земной воды, подземные воды — около 2%, ледники — около 2%, реки, озёра, болота — 0,02%.
Вода чрезвычайно распространённое вещество в космосе, однако из-за высокого внутрижидкостного давления вода не может существовать в жидком состоянии в условиях вакуума космоса, отчего она представлена только в виде пара или льда. Одним из наиболее важных вопросов, связанных с освоением космоса человеком и возможности возникновения жизни на других планетах, является вопрос о наличии воды за пределами Земли в достаточно большой концентрации. Известно, что некоторые кометы более, чем на 50 % состоят из водяного льда. Не стоит, впрочем, забывать, что не любая водная среда пригодна для жизни — в частности, аккумуляторная батарея содержит 25 % раствор серной кислоты в воде (но жизнь в нем, очевидно, маловероятна, тем более, её возникновение).
В результате бомбардировки лунного кратера, проведённого 9 октября 2009 года НАСА с использованием космического аппарата LCROSS, впервые были получены достоверные свидетельства наличия на спутнике Земли водяного льда в больших объёмах.
Вода широко распространена в Солнечной системе, она есть почти везде, даже в атмосфере Венеры присутствует небольшое количество водяного пара. Наличие воды (в основном в виде льда) подтверждено на многих спутниках Юпитера и Сатурна: Энцеладе, Тефии, Европе, Ганимеде и др. Вода присутствует в составе всех комет и многих астероидов. Учёными предполагается, что многие транснептуновые объекты имеют в своём составе воду.. Жидкая вода, предположительно, имеется под поверхностью некоторых спутников планет, наиболее вероятно, на Европе — спутнике Юпитера.
Исследования воды
Гидрология
— наука, изучающая природные воды, их взаимодействие с атмосферой и литосферой, а также явления и процессы, в них протекающие (испарение, замерзание и т. п.).
Предметом изучения гидрологии являются все виды вод гидросферы в океанах, морях, реках, озёрах, водохранилищах, болотах, почвенных и подземных вод.
Гидрология исследует круговорот воды в природе, влияние на него деятельности человека и управление режимом водных объектов и водным режимом отдельных территорий; проводит анализ гидрологических элементов для отдельных территорий и Земли в целом; даёт оценку и прогноз состояния и рационального использования водных ресурсов; пользуется методами, применяемыми в географии, физике и других науках. Данные гидрологии моря используются при плавании и ведении боевых действий надводными кораблями и подводными лодками.
Гидрология подразделяется на океанологию, гидрологию суши и гидрогеологию.
Океанология подразделяется на биологию океана, химию океана, геологию океана, физическую океанологию, и взаимодействие океана и атмосферы.
Гидрология суши подразделяется на гидрологию рек (речную гидрологию, потамологию), озероведение (лимнологию), болотоведение, гляциологию.
Гидрогеология
Гидрогеоло́гия (от др.-греч. ὕδωρ «водность» + геология) — наука, изучающая происхождение, условия залегания, состав и закономерности движений подземных вод. Также изучается взаимодействие подземных вод с горными породами, поверхностными водами и атмосферой. В сферу этой науки входят такие вопросы, как динамика подземных вод, гидрогеохимия, поиск и разведка подземных вод, а также мелиоративная и региональная гидрогеология. Гидрогеология тесно связана с гидрологией и геологией, в том числе и с инженерной геологией, метеорологией, геохимией, геофизикой и другими науками о Земле. Она опирается на данные математики, физики, химии и широко использует их методы исследования. Данные гидрогеологии используются, в частности, для решения вопросов водоснабжения, мелиорации и эксплуатации месторождений.
Биологическая роль
Вода играет уникальную роль как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений. Благодаря водородной связи, вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время.
Применение
Земледелие
Выращивание достаточного количества сельскохозяйственных культур на открытых засушливых землях требует значительных расходов воды на ирригацию, доходящих до 90 % в некоторых странах.
Питьё и приготовление пищи
Живое человеческое тело содержит от 55 % до 78 % воды, в зависимости от веса и возраста. Потеря организмом человека более 10 % воды может привести к смерти. Для нормального функционирования организма человеку нужно усвоить около 3 литров воды за день в зависимости от температуры и влажности окружающей среды, физической активности и т. д.
Растворитель
Вода является растворителем для многих веществ. Она используется для очистки как самого человека, так и различных объектов человеческой деятельности. Вода используется как растворитель в промышленности.
Теплоноситель
Среди существующих в природе жидкостей вода обладает наибольшей теплоёмкостью. Теплота её испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь аммиаку. В качестве теплоносителя воду используют в тепловых сетях, для передачи тепла по теплотрассам от производителей тепла к потребителям. Воду в качестве льда используют для охлаждения в системах общественного питания, в медицине. Большинство атомных электростанций используют воду в качестве теплоносителя.
Замедлитель
Во многих ядерных реакторах вода используется не только в качестве теплоносителя, но и замедлителя нейтронов для эффективного протекания цепной ядерной реакции. Также существуют тяжёловодные реакторы, в которых в качестве замедлителя используется тяжёлая вода.
Пожаротушение
В пожаротушении вода зачастую используется не только как охлаждающая жидкость, но и для изоляции огня от воздуха в составе пены.
Спорт
Многие виды спорта проходят на водных поверхностях, на льду, на снегу и даже в воде. Это подводное плавание, хоккей, лодочные виды спорта, биатлон и пр.
Инструмент
Вода используется как инструмент для разрыхления, раскалывания и даже резки пород и материалов. Она используется в добывающей промышленности, горном деле и в производстве. Достаточно распространены установки по резке водой различных материалов: от резины до стали. Вода, выходящая под давлением несколько тысяч атмосфер способна разрезать стальную пластину толщиной несколько миллиметров, или более при добавлении абразивных частиц.
Смазка
Вода применяется как смазочный материал для смазки подшипников из древесины, пластиков, текстолита, подшипников с резиновыми обкладками и др. Воду также используют в эмульсионных смазках.
Интересные факты
В среднем в организме растений и животных содержится более 50 % воды.
В составе мантии Земли воды содержится в 10-12 раз больше, чем количество воды в Мировом океане .
При средней глубине в 3,6 км Мировой океан покрывает около 71 % поверхности планеты и содержит 97,6 % известных мировых запасов свободной воды.
Если бы на Земле не было впадин и выпуклостей, вода покрыла бы всю Землю, и её толщина была бы 3 км .
Если бы все ледники растаяли, то уровень воды на Земле поднялся бы на 64 м и около 1/8 поверхности суши было бы затоплено водой .
Морская вода при обычной её солёности 35 ‰ замерзает при температуре −1,91 °C.
Иногда вода замерзает при положительной температуре. При определённых условиях (внутри нанотрубок) молекулы воды образуют новое состояние, при котором они сохраняют способность течь даже при температурах, близких к абсолютному нулю. Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света. Синий цвет чистой океанской воды объясняется избирательным поглощением и рассеянием света в воде. С помощью капель воды из кранов можно создать напряжение до 10 киловольт, опыт называется «Капельница Кельвина». Существует следующая поговорка с использованием формулы воды — h3O: «Сапоги мои того — пропускают h3O». Вместо сапог в поговорке может участвовать и другая дырявая обувь. Вода — это одно из немногих веществ на Земле, которые расширяются при переходе из жидкой фазы в твёрдую (кроме воды, таким свойством обладают висмут, галлий, свинец[источник не указан 15 дней] и некоторые соединения и смеси). Вода может гореть, если ее поместить в атмосферу с фтором, иногда даже со взрывом. При этом выделяется кислород.
www.himsnab-spb.ru
Вода - Знаешь как
Чистая вода — считается в состав которой не входят какие либо соли или другие вещества которые имеют положительные или отрицательные ионы . В нормальных условиях она очень слабо диссоциирована и концентрация протонов (ионов гидроксония h4O⁺) и гидроксильных ионов HO¯ составляет 10-7 моль/л , поэтому она хороший изолятор . Но так как она легко впитывает с окружающей среды ( газы , соли ) практически всегда загрязнена ими , то есть проводит электрический ток , по электропроводности воды можно судить о её чистоте .
Свойство воды имеет большое значение для живых организмов , так как для питания клеток нужны полезные вещества и соли , которые переносятся водой . Это проявляется тем , что молекулы воды очень малы в размерах и как бы ( смачивают , обволакивают ) с каждой стороны различные вещества . В органических в-вах( животные , растения ) это свойство проявляется в виде межклеточной жидкости . В неорганической химии проявляет роль растворителя , растворимых в воде солей и веществ .
Вода проявляет большой степенью поверхностного натяжения , проигрывая только ртути . Это свойство связано с тем , что молекулы двигаются с разными скоростями и могут удерживать на поверхности какие либо предметы ( водомерок , иглу ) .
Одним из самых главных свойств является преломление , что составляет n=1,33 в оптическом диапазоне. Но из за того , что она ( водяной пар )интенсивно поглощает инфракрасные излучения является естественным парниковым газом , которая составляет более чем 60% от всего парникового эффекта . Вода также интенсивно поглощает микроволновые излучения ( разогревая как бы из нутри ) проявляя дипольный момент молекул .
Изотопное состояние воды .
Так как в природе и искусственные изотопы водорода и кислорода бывают радиоактивные , то и их изотопы входящих в состав молекулы воды бывают несколько их видов :
Так всем известная всем людям вода называется ( лёгкая вода ) имеет простую формулу h3O , а тяжёлая вода ( дейтериевая ) имеет вид D2O , сверхтяжёлая вода ( тритиевая ) T2O и по некоторым подсчётам , что могут существовать тритий-дейтериевая вода TDO , тритий-протиевая вода THO , дейтерий-протиевая вода DHO .
По последним исследованиям тяжелая вода ранее считаемой ( мёртвой водой ) может быть населена некоторыми микроорганизмами , которые в результате ( селекции , приучению ) были получены искусственным путём .
В зависимости стабильности изотопа кислорода , в природе существуют три разновидности молекул воды , свою очередь по своему изотопному составу их насчитывается 18 разновидностей молекул воды , но на самом деле вода может одновременно содержать все разновидности молекул . Так к примеру любая вода содержит все изотопы ( лёгкая , тяжёлая , дейтериевая и тритиевая ) , но концентрация последних трёх настолько малы , что они не влияют не на какие жизненные формы .
Химические свойства .
Очень часто в технике и в быту употребляются такие термины , как ( раствор , растворение ) , например , всегда говорят о хорошей растворимости сахара в воде , о растворе поваренной соли , растворах кислот и т.д. Иногда её сравнивают как амфолит — кислота и основание .
Так как вода — химически активное вещество , сильно полярные молекулы воды сольванируют молекулы и ионы , образуя кристаллогидраты и гидраты , отсюда и названия например кристаллогидрат гипса CaSO4·2h3O и т.д.
Воду можно получить в ходе химической реакции водорода и кислорода реакция идёт при поджигании со взрывом :
2h3 + O2 = 2h3O
Разложением пероксида водорода :
2h3O2 = 2h3O + O2↑
Реакцией гидрокарбоната натрия с уксусной кислотой :
NaHCO3 + Ch4COOH = Ch4COONa + h3O + CO2↑
В ходе нейтрализации некоторых кислот гидроксидами :
h3SO4 + 2NaOH = Na2SO4 + 2h3O
HNO3 + NaOH = NaNO3 + h3O
Ch4COOH + NaOH = Ch4COONa + h3O
Восстановлением металлов из их оксидов водородом :
CuO + h3 = Cu + h3O
При воздействии высоких температур , электротока , а также некоторых катализаторов и ионизирующего излучения , вода распадается на простые элементы молекулярный кислород и молекулярный водород :
2h3O → 2h3 + O2↑
Реакция с активными металлами ( натрий , калий и т.д ) протекает иногда с воспламенением :
2h3O + 2Na = 2NaOH + h3↑
Со фтором реакция протекает с образованием фтороводорода и кислорода :
2h3O + 2F2 → 4HF + O2↑
Реакция с солями слабых кислот приводит к полному гидролизу :
Al2S3 + 6h3O → 2Al( OH ) + 3h3S↑
Вода реагирует при нагревании с металлами , особенно магнием и воспламенённым порошкообразным алюминием :
4h3O + 3Fe → Fe3O4 + 4h3↑
2h3O + Mg → Mg(OH)2+h3↑
2Al + 6h3O =3h3 + 2Al(OH)3
Вода реагирует с углеродом при нагревании с образованием угарного газа но реакция не стабильна поэтому обратима :
h3O + C ↔ CO + h3↑
znaesh-kak.com
Названия воды Зам-Зам и их значения
Сказано, что эта вода названа именем Зам-зам из-за ее обильности. Также есть версия, что Хаджар, когда вода Зам-зам забила, стала произносить: «Зам, зам» (в форме приказа), что означало: давай расти и увеличивайся. А еще было сказано, что она названа так потому, что в давние времена приходила к ней лошадь и фыркала около нее.
Названий для воды Зам-зам стало очень много, что только свидетельствует о ее ценности.
Ал-Факихи рассказал со слов стариков Мекки: «У этого колодца много имен и одно из них Зам-зам. Это из-за звука воды в нем или из-за ее обилия. Когда говорят «вода Зам-Зам» — это значит много воды. А может быть, источник назван так из-за шума крыльев Джибрила и звука его голоса».
Забиййа  : колодец назван так из-за того, что его форма напоминает забиййу — сосуд, широкий сверху и узкий снизу.
: колодец назван так из-за того, что его форма напоминает забиййу — сосуд, широкий сверху и узкий снизу.
Добрый  : поскольку он для хороших и добрых Людей, потомков Пророка
: поскольку он для хороших и добрых Людей, потомков Пророка  . Эта версия принадлежит Ас-Сухайли.
. Эта версия принадлежит Ас-Сухайли.
Праведность и непорочность  : потому что он — Для благочестивых, а для грешников— бесполезен. Скупой
: потому что он — Для благочестивых, а для грешников— бесполезен. Скупой  : потому что он скупится для неверующих, а лицемер не может насытиться из него. Эта версия принадлежит Вахбу ибн Мунаббиху. Насыщение младенцев
: потому что он скупится для неверующих, а лицемер не может насытиться из него. Эта версия принадлежит Вахбу ибн Мунаббиху. Насыщение младенцев  : потому что семьидо Ислама отправлялись к этому колодцу ранним утром, кормили своих младенцев из этого колодца — и таковым было их утро.
: потому что семьидо Ислама отправлялись к этому колодцу ранним утром, кормили своих младенцев из этого колодца — и таковым было их утро.
Помощь  : так как мусульмане находили в этой воде помощь для своих детей.
: так как мусульмане находили в этой воде помощь для своих детей.
Питье Аллаха для Исмаила  : потому Что Мекка была местом, в котором не было воды и Аллах напоил его ею.
: потому Что Мекка была местом, в котором не было воды и Аллах напоил его ею.
Господин  : потому что этот колодец господин всех вод и источников.
: потому что этот колодец господин всех вод и источников.
Польза  : потому что он приносит пользу верующим Сладость
: потому что он приносит пользу верующим Сладость  : потому что верующий, когда насыщается ею, чувствует удовольствие и наслаждение, как будто это не вода, а молоко.
: потому что верующий, когда насыщается ею, чувствует удовольствие и наслаждение, как будто это не вода, а молоко.
Чистый  : потому что вода Зам-зам предназна чена только для рта верующего, а руки неверующих не касаются ее; и потому что Аллах очистил ее, согласно Его словам: «И напоил их Господь их питьем очищенным».
: потому что вода Зам-зам предназна чена только для рта верующего, а руки неверующих не касаются ее; и потому что Аллах очистил ее, согласно Его словам: «И напоил их Господь их питьем очищенным».
Харамиййа  Из-за ее местоположения в Святой мечети.
Из-за ее местоположения в Святой мечети.
Орошающая  : потому что она проникает во все части тела, и оно питается ею, как питается пищей. Здоровая
: потому что она проникает во все части тела, и оно питается ею, как питается пищей. Здоровая  : потому что она не принимает фальши и обмана.
: потому что она не принимает фальши и обмана.
Благословенная  : потому что она — благословение и часть Сунны.
: потому что она — благословение и часть Сунны.
Благословенная  Потому что вода источника Никогда не заканчивается, и даже если все люди и джинны соберутся, чтобы напиться этой воды, то колодец не иссякнет.
Потому что вода источника Никогда не заканчивается, и даже если все люди и джинны соберутся, чтобы напиться этой воды, то колодец не иссякнет.
Достаточный  : потому что его воды достаточно, Даже когда нет еды или чего-то другого.
: потому что его воды достаточно, Даже когда нет еды или чего-то другого.
Здоровье  : потому что тот, кто пьет из него, не Худеет.
: потому что тот, кто пьет из него, не Худеет.
Сытная еда  : согласно словам Посланника Аллаха
: согласно словам Посланника Аллаха  :
:

Воистину, она — благословение, воистину, она — сытная еда. (Муслим и Абу Дауд)
Радующая  : потому что радует посетителей Святой мечети.
: потому что радует посетителей Святой мечети.
Лечение болезни  Потому что, если человек, Находясь в Мекке, заболеет чем-либо, то лечится водой из этого колодца, имея доброе намерение.
Потому что, если человек, Находясь в Мекке, заболеет чем-либо, то лечится водой из этого колодца, имея доброе намерение.
Понравилась статья? Добавь в закладки:
islammed.ru



















