Большая Энциклопедия Нефти и Газа. Константа воды
Константа диссоциации
Кд – константа диссоциации – это отношение произведения концентрации диссоциированных ионов к концентрации недиссоциированных молекул электролита. Например,
К
 АK++A-
АK++A-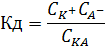
Кд – показывает во сколько раз скорость диссоциации больше скорости ассоциации. Чем больше Кд, тем сильнее электролит. Кд зависит от природы электролита и растворителя, температуры и не зависит от концентрации раствора.
Взаимосвязь степени диссоциации и константы диссоциации
Напомним, что степень диссоциации α - отношение числа молекул, распавшихся на ионы, к общему числу молекул, тогда для уравнения
К
 АK++A-
АK++A-
С∙ α – количество диссоциированных моль электролита КА,
(С-(С∙ α)) - количество недиссоциированных моль электролита КА.
Подставим эти значения в формулу выражения Кд:
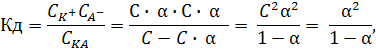
получим 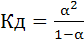 .
.
Это математическое выражение закона разбавления В. Оствальда (1888 г). Выражение можно упростить, если принять α→0. Величиной α в знаменателе пренебрегают и уравнение принимает вид:
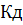 ≈ α2C, или α ≈
≈ α2C, или α ≈ 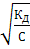
Формулировка закона разбавления В. Оствальда: «C разбавлением раствора слабого электролита степень диссоциации увеличивается».
Ионное произведение воды. Водородный показатель.
Согласно протолитической теории Брэнстеда и Лоури, вода не нейтральный растворитель. Ее молекула может быть донором и акцептором протонов, т.е. является амфолитом. Явление, когда молекулы одного и того же вещества одновременно выступают в качестве кислоты и основания, называются автопротолизом. Сокращенно автопротолиз воды можно записать как процесс ее диссоциации на ионы.
Н
 2О Н++ОН-
2О Н++ОН-
Применяя закон действующих масс, запишем константу диссоциации воды, значение которой можно вычислить по данным измерения электрической проводимости воды.
Кд=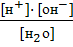 =1,8·10-16 (при 22ºС)
=1,8·10-16 (при 22ºС)
В знаменателе дроби - концентрация недиссоциированных молекул воды, которую можно считать постоянной и определить в 1 л, приняв массу 1л воды за 1000г.
[Н2О]=
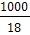 =55,56 молей,
=55,56 молей,
тогда
Кд==1,8·10-16
Или [Н+]·[ОН-]=1·10-14 моль-ион/л (ионное произведение воды или константа автопротолиза).
Ионное произведение воды - произведение равновесных концентраций катионов водорода и гидроксид ионов, величина постоянная и равна 10-14 моль-ион/л.
Таким образом, ионное произведение воды позволяет для любого водного раствора найти концентрацию ОН- по известной концентрации Н+, и наоборот.
Кислотность растворов обычно выражают через концентрацию ионов Н+. В нейтральных растворах [Н+]=[ОН-]=√10-14=10-7моль-ион/л. В кислых растворах [Н+]>10-7моль-ион/л, в щелочных [Н+]<10-7моль-ион/л.
Чтобы не писать числа с показателем степени, кислотность раствора выражают через отрицательный логарифм концентрации ионов водорода, называя эту величину водородным показателем и обозначая ее рН.
рН=-lg[Н+], рОН=-lg[ОН-], рН+рОН=14
Величина рН впервые была введена датским химиком С. Серенсоном. Буква «р» - начальная от датского слова potenz (степень), «Н»- символ водорода.
В кислых растворах рН <7, в нейтральных =7, в щелочных >7.
В обычной лабораторной практике рН измеряют с погрешностью 0,02. По этой причине не следует приводить значение рН раствора более чем с двумя цифрами после запятой.
В растворах слабых кислот НА кислотно-основное равновесие имеет вид
Н
 А+Н2О Н3О++А- или
А+Н2О Н3О++А- или
Н
 А Н++А-
А Н++А-
Константа кислотной диссоциации (константа кислотности) Ка равна:
Ка=[Н+]· [А-]/[НА]
В растворе слабых оснований В кислотно-основное равновесие имеет вид
В
 + Н2О ВН++ОН-
+ Н2О ВН++ОН-
Где В-основание, а ВН+ - сопряженная В кислота. Константа кислотно-основного равновесия в этом случае в соответствии с законом действующих масс равна:
Кb=[BН+]· [ОН-]/[В]
Константу Кb называют константой диссоциации основания В или константой основности.
Величины Ка и Кbдля сопряженной кислотно-основной пары связаны также простым соотношением.
Ка Кb=10-14 или рКа+рКb=14, рКb=14-рКа
Таким образом, сила кислот и оснований может быть выражена в общей шкале рКа, подобно тому, как реакция среды характеризуется водородным показателем рН.
studfiles.net
Константа - вода - Большая Энциклопедия Нефти и Газа, статья, страница 1
Константа - вода
Cтраница 1
Константы воды при этой температуре: ц 0 835 - 10-а кг / м-сек; К0 528 ккал / м - ч; с ккал / кг град. [1]
Кр иоекопическая константа воды равна 1 86 С. Следовательно, возрастанию концентрации на 10 - 2 М соответствует депрессия около 0 02 С. [3]
Сложная константа Гамакера для пленки декана в воде, рассчитанная на основании значений констант воды и декана по формулам (11.19) - (11.21), составляет А 2 10 - 10 - 14 эрг. [4]
Более точные значения констант полярных групп могут быть найдены на основе разницы натяжений в изоэлектрической точке и значений констант воды и углеводорода, рассчитанных по макроскопической теории. [5]
Пренебрегая образованием ионных пар, найдите интервал изменения рН при переходе от 10 - 3 F раствора сильной кислоты к 10 - 3 F раствору сильного основания в ледяной уксусной кислоте, константа автопротолиза которой ( p / ts 14 45) сравнима с константой воды. [6]
Согласно этому выражению, в чистой воде и в любом водном растворе при постоянной температуре) произведение активностей ионов водорода и гидроксила постоянно. Константа KB называется ионным произведением или аутопротолитической константой воды. [7]
Введем представление о рН изоэлектрической точки стекла, которую можно представить, как рН точки, равноудаленной от перегибов в кислой и в щелочной областях. Как и обычно, изоэлектрическая точка является функцией отношения константы воды к произведению констант гидроокиси кремния в стеклянной пленке как кислоты и как основания. [8]
Введем представление о рН изоэлек-трической точки стекла, которую можно представить как рН точки, равноудаленной от перегибов в кислой и в щелочной областях. Как и обычно, изоэлек-трическая точка является функцией отношения константы воды к произведению констант гидрата окиси кремния в стеклянной пленке как кислоты и как основания. [9]
Аномально высокие диэлектрические константы Nh4 и Н2О также связаны с ассоциацией, обусловленной образованием водородных связей, но прямой связи между величиной диэлектрической кин-станты и степенью ассоциации не существует. Например, диэлектрическая константа жидкой синильной кислоты больше, чем константа воды, однако это не означает, что степень ассоциации синильной кислоты больше, чем воды. Диэлектрическая константа зависит от дипольных моментов полимеров, а величины дипольных моментов, в свою очередь, зависят от взаимной ориентации водородных связей в полимерах. Полимеризация HF приводит к образованию нелинейных или кольцевых полимеров с малыми ( или равными нулю) дипольными моментами, тогда как полимеры синильной кислоты представляют собой линейные цепи с большими дипольными моментами. [10]
Подобные растворы кристаллизуются при Температуре, которая на определенное число градусов ниже температуры кристаллизации чистых растворителей. Это понижение температуры кристаллизации называется молекулярным понижением температуры кристаллизации данного растворителя или его криоскопической константой. Криоскопи-ческая константа воды составляет 1 86; это значит, что растворы, содержащие по 1 молю любого неэлектролита на 1000 г воды, кристаллизуются при температуре - 1 86 С. [11]
По крио-скопической константе воды / Ск, равной 1 86, и молальной концентрации раствора т вычислите ( по формуле А Ккт) понижение температуры кристаллизации, предположив, что исследуемое вещество является неэлектролитом. [12]
Важным моментом при расчете констант Гамакера является правильный выбор толщины пленки. Адсорбционные слои ПАВ в черных пленках приводят к резкой неоднородности в поперечном направлении по составу и характеру межмолекулярного взаимодействия. В эти формулы входят три константы, однако константы, учитывающие взаимодействие воды и углеводородной фазы с полярными группами, пока не могут быть рассчитаны. В углеводородных пленках такая модель может использоваться для оценки констант Гамакера полярных групп по известным значениям констант воды и углеводородной фазы. [13]
Амиды кислот как растворители характеризуются некоторыми замечательными свойствами. Два жидких растворителя, являющиеся представителями этой группы соединений, а именно амид муравьиной кислоты и М М - диметилформамид, производятся в промышленном масштабе и поступают в продажу по сравнительно ДОСТУПНОЙ цене. Релер [1570] указывает на сходство формамида и воды в отношении величины диэлектрической постоянной. В результате исследований амида муравьиной кислоты как растворителя неорганических солей и как ионизирующего растворителя он пришел к ВЫВОДУ, согласно которому при растворении солей в формамиде они сольватируются так же, как и при растворении их в воде. Вальден [ 1980] изучал свойства амида муравьиной кислоты как ионизирующего растворителя и показал, что он удивительным образом имитирует физические характеристики и константы воды. Вальден нашел, что при растворении в формамиде бинарных солей степень диссоциации последних может превышать степень их диссоциации в воде. Сильные же органические кислоты в этом растворителе заметно не ионизированы. [14]
Страницы: 1
www.ngpedia.ru
25. Константа воды. Водородный показатель (pH).
равновесия:  (произведение растворимости).
(произведение растворимости).
Таким образом, в насыщенном растворе малорастворимого электролита произведение концентраций его ионов, возведённых в степень с показателем, равным стехиометрическому коэффициенту при данном ионе, при данной температуре – величина постоянная.
Произведение растворимости  , как и коэффициент диссоциации
, как и коэффициент диссоциации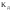 зависит от природы растворённого вещества, природы растворителя и температуры.
зависит от природы растворённого вещества, природы растворителя и температуры.
Произведение растворимости 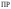 характеризует сравнительную растворимость однотипных веществ: чем больше произведение растворимости данного вещества, тем больше его растворимость.
характеризует сравнительную растворимость однотипных веществ: чем больше произведение растворимости данного вещества, тем больше его растворимость.
25. Константа воды. Водородный показатель (pH).
Вода является слабым электролитом.
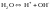
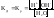
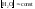
Концентрация воды в разбавленных растворах электролитов практически постоянная. Поэтому можно считать постоянным и ионное произведение воды. 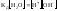
При 
 .При увеличении температуры
.При увеличении температуры возрастает.
возрастает.
В любом водном растворе присутствуют  и
и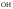 .
.
Кислотность и щёлочность среды обычно характеризуется концентрацией водородных ионов или водородным показателем pH
pH = 7 - нейтральный раствор
pH < 7 – кислотный раствор
pH > 7 – щёлочный раствор
Качественно определить реакцию среды можно с помощью индикатора:
| Реакция | Индикатор | ||
| лакмус | метилоранж | фенолфталеин | |
| кислотная | красный | розовый | бесцветный |
| щелочная | синий | жёлтый | малиновый |
Буферные растворы – растворы с определённой концентрацией ионов водорода, которая мало изменяется при разбавлении и при добавлении концентрированной кислоты или щёлочи. Они состоят, либо из слабой кислоты и её соли, образованной сильным основанием, либо из слабого основания и его соли, образованной сильной кислотой.
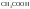 –слабая кислота
–слабая кислота
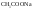 –соль диссоциирует нацело
–соль диссоциирует нацело 
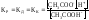
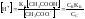
Под буферной ёмкостью понимают количество эквивалентной кислоты или щёлочи, которые необходимо добавить к одному литру раствора, чтобы водородный показатель pH изменился на единицу:
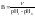 .
.
28. Окислительно-восстановительные реакции: степень окисления, окислитель и восстановитель (важнейшие окислители и восстановители), типы окислительно-восстановительных реакций.
Для характеристики состояния элементов в соединениях введено понятие степени окисления. Степень окисления – воображаемый заряд атома в соединении, вычисляемый, исходя из предположения, что соединение состоит из ионов (+, –, 0).
1. Степень окисления элемента в простом веществе, например в Na или в
 равна 0.
равна 0.2. Степень окисления элемента в виде одноатомного иона в ионном соединении, например
 ,
,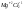 равна заряду данного иона.
равна заряду данного иона.3. В соединении с ковалентными полярными связями отрицательный заряд относят к более электроотрицательному элементу, причём применимы следующие степени окисления:
а.F = -1
b.O = -2 , исключение: пероксиды = -1; надпероксиды = - 1/2,; озониды = - 1/3;
c.H = +1 исключение солеобразующие гидриды LiH = -1
d.щелочные Me = + 1
e. Щелочноземельные Ме = +2
studfiles.net
константа диссоциации воды - это... Что такое константа диссоциации воды?
константа диссоциации водыFishery: dissociation constant of water
Универсальный русско-английский словарь. Академик.ру. 2011.
- константа диссоциации
- константа диссоциации комплекса фермента с ингибитором
Смотреть что такое "константа диссоциации воды" в других словарях:
Константа диссоциации — Константа диссоциации вид константы равновесия, которая показывает склонность большого объекта диссоциировать (разделяться) обратимым образом на маленькие объекты, как например когда комплекс распадается на составляющие молекулы, или когда… … Википедия
Константа автопротолиза — Константа автопротолиза физическая величина, характеризующая способность протонного растворителя к диссоциации. Обозначается KS. Является произведением концентраций иона лиония и иона лиата. Так, например, для растворителя, который… … Википедия
Ионное произведение воды — Ионное произведение воды произведение концентраций ионов водорода Н+ и ионов гидроксила OH− в воде или в водных растворах, константа автопротолиза воды. Содержание 1 Вывод значения ионного произведения воды … Википедия
Кислая реакция — Водородный показатель, pH (произносится «пэ аш»), это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным… … Википедия
Кислая реакция внутренней среды — Водородный показатель, pH (произносится «пэ аш»), это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным… … Википедия
Кислая среда — Водородный показатель, pH (произносится «пэ аш»), это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным… … Википедия
Кислотность — Водородный показатель, pH (произносится «пэ аш»), это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным… … Википедия
Кислотность реакционной среды — Водородный показатель, pH (произносится «пэ аш»), это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным… … Википедия
Кислотность среды — Водородный показатель, pH (произносится «пэ аш»), это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным… … Википедия
РН — Водородный показатель, pH (произносится «пэ аш»), это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным… … Википедия
Уровень кислотности — Водородный показатель, pH (произносится «пэ аш»), это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным… … Википедия
Книги
- Вода в истории Земли и планет, Орленок Вячеслав Владимирович. Приведены хорошо аргументированные и подкрепленные численными расчетами исследования земной гидросферы. Они ставят под сомнение давно утвердившиеся представления о вечности и неизменности… Подробнее Купить за 583 руб
- Вода в истории Земли и планет, Орленок В.В.. Приведены хорошо аргументированные и подкрепленные численными расчетами исследования земной гидросферы. Они ставят под сомнение давно утвердившиеся представления о вечности и неизменности… Подробнее Купить за 465 руб
- Вода в истории Земли и планет, В. В. Орленок. Приведены хорошо аргументированные и подкрепленные численными расчетами исследования земной гидросферы. Они ставят под сомнение давно утвердившиеся представления о вечности и неизменности… Подробнее Купить за 338 руб
universal_ru_en.academic.ru
Константа равновесия диссоциации воды - Справочник химика 21
Константа равновесия диссоциации воды (Н20 = Н++0Н-) [c.276]Наконец, само выражение для константы равновесия диссоциации воды [Н ][ОН ] = Кно = 10- (5-12) [c.212]
В табл. 5-3 указаны константы ионизации ряда кислот в водных растворах там же приведены оценки для сильных кислот, маскируемые растворителем в водном растворе. Диссоциация протонированного растворителя Н3О на гидратированные протоны и HjO представляет собой просто миграцию протонов от одних молекул воды к другим и должна характеризоваться константой равновесия = 1,00. Если в качестве растворителя используется аммиак, все кислоты, сопряженные основания которых слабее, чем NHj, вследствие выравнивающего действия растворителя окажутся полностью ионизованными сильными кислотами. Таким образом, как фтористоводородная, так и уксусная кислоты в жидком аммиаке являются сильными кислотами. [c.217]
Лимонная кислота, содержащаяся в цитрусовых, является трехосновной кислотой (способной отдавать воде три протона) формулы НзС НзО,. Составьте уравнения трех равновесий диссоциации и соответствующие им выражения для констант диссоциации каждой стадии. Какая из этих констант диссоциации имеет максимальное значение и какая-минимальное [c.106]Константа равновесия диссоциации воды имеет вид Н2О = Н+ -г он [c.238]
Помимо константы диссоциации воды Нп о и ее ионного нроиз-веления Ки-, важной характеристикой еюды является также константа равновесия К, отвечающая реакции [c.39]
Запишем выражение для константы равновесия диссоциации воды, учитывая, что безразмерная относительная концентрация Н20(ж) равна 1 (см. разд. 4.7.8) [c.272]
На основании зависимости констант равновесия диссоциации воды раньше было выведено уравнение [c.243]
Электропроводность химически чистой воды ничтожна, так как молекулы воды в очень малой степени диссоциированы на ионы при 22 С ан.о = l,8 10 . Так как это очень слабый электролит, то константу равновесия диссоциации воды можно вычислить по уравнению к = а с [c.164]
Выражение (4.17) также является константой равновесия диссоциации воды и получило название ионного произведения воды [c.60]
При повышении температуры диссоциация воды усиливает--ся и константа равновесия диссоциации возрастает, что указы-"вает на смещение равновесия в сторону образования ионов. Однако из выражения для AG° следует, что с повышением температуры положительное значение изменения изобарного потенциала увеличивается и, следовательно, вероятность прохождения процесса диссоциации уменьшается. Объясните это противоречие. Обсудите знак изменения энтропии при диссоциации. [c.192]
Если константа равновесия диссоциации ионного ассоциата в воде мала (/(таких растворов рассчитывают с использованием констант кислотности или основности. В данном случае речь идет о слабых кислотах или основаниях. При расчете следует учитывать равновесие [c.24]
Константа равновесия этой реакции пли константа электролитической диссоциации воды выражается уравнением [c.70]
Вода —типично амфотерное соединение она образует в равных количествах ионы водорода, являющиеся носителями кислотных свойств, и ионы гидроксила — носители щелочных (основных) свойств. Применяя закон действия масс, константу равновесия (диссоциации) можно выразить уравнением [c.353]
Поскольку вода в очень малой степени диссоциирует на ионы, то концентрацию молекул воды [Н2О] в момент установления динамического равновесия можно считать постоянной величиной, равной начальной концентрации 1000/18,015 = 55,5 моль/л. В разбавленных водных растворах концентрацию воды можно считать такой же. В этом случае константа электролитической диссоциации воды примет вид [c.353]
В выражении константы равновесия диссоциации воды находятся две постоянных [c.280]
Константу Кс вычисляют по уравнению (20). Таким образом были установлены следующие степени диссоциации и константы равновесия для воды при различных температурах [c.176]
Константа диссоциации (термодинамическая константа равновесия) реакции диссоциации воды [c.155]
У — плотность потока вещества Кр, Кд, Кн, Кг, К>, — константы равновесия, диссоциации, нестойкости, гидролиза, электропроводности Кв — полное произведение воды к, й — постоянная Больцмана, константа скорости реакции [c.5]
Поскольку обычно вода присутствует в большом избытке, реакция может быть охарактеризована двумя константами скорости реакций первого порядка йд — для диссоциации гидрата и — для гидратации. Любой метод, с помощью которого измеряются скорости достижения равновесия, дает общую константу скорости к == + к , однако некоторые методы позволяют определять кц и кг раздельно. Эти константы связаны с константой равновесия диссоциации гидрата соотношением / д//гг = /Сд. [c.249]
В растворе устанавливается равновесие, константа которого раина отношению истинных термодинамических констант диссоциации или, что то же самое, отношению термодинамических констант диссоциации Запишем реакции диссоциации воды и диссоциации гидроксония. В обоих случаях диссоциация протекает с участием одной молекулы воды, присоединяющей протон [c.477]
Константа равновесия для диссоциации воды определяется выражением общего вида [c.210]
Для 0,01 М раствора азотной кислоты этот источник действительно можно не учитывать. Концентрация ионов водорода, обусловленная кислотой, равна 10 моль-л , а концентрация [Н ] от диссоциации воды даже в чистой воде достигает всего 10 моль-л , т.е. в 100 тысяч раз меньше, чем от кислоты. Поскольку добавление ионов от кислоты подавляет диссоциацию воды, реальный вклад диссоциации воды в полную концентрацию ионов должен быть еще меньше. Можно найти концентрацию гидроксидного иона, которая обусловлена только диссоциацией воды, из выражения для константы равновесия [c.469]
Константа диссоциации кислоты К , или константа кислотности (разд. 15.5),-константа равновесия, характеризующая степень переноса протона от вещества к воде как к растворителю. [c.104]
Приведенный пример приводит к неправдоподобному результату последовательное разбавление раствора кислоты (до 10 М) делает его основным Ясно, что такой вывод неверен. Дело в том, что концентрация иона водорода от кислоты понизилась до уровня, сопоставимого с концентрацией иона водорода, обусловленной диссоциацией воды. В этом случае неприменимо простое выражение для константы равновесия, которым мы пользовались до сих пор. При строгом рассмотрении диссоциации произвольной кислоты общего вида НА приходится иметь дело с четырьмя неизвестными концентрациями, [Н" ], [НА], [А ] и [ОН"], и четырьмя уравнениями, связывающими эти неизвестные [c.471]
Как отличаются между собой константы равновесия реакции диссоциации воды в зависимости от способа написания уравнений [c.49]
В растворе существует преимущественно средний продукт, ко- горый не может образоваться в растворителях с высокой ДП, апример в воде. Таким образом, мы получаем две константы равновесия константу ионизации для первой ступени реакции К и константу диссоциации для второго процесса Кв [c.345]
Решение. Для реакции диссоциации воды НаО (ж) Н+ + + ОН константа равновесия выражется через активности [c.300]
Проблема оценки концентрации носителей заряда исследовалась де Майером и Эйгеном [93, 184]. Используемый ими метод состоял в измерении тока насыщения /, возникающего вследствие диссоциации молекул воды при наложении сильного поля. Константа равновесия диссоциации воды находится из соотношения [c.146]
До тех пор пока в растворе имеется твердый Ag l, его влияние на равновесие не изменяется. Подобно тому как мы поступаем с концентрацией Н2О при рассмотрении равновесия диссоциации воды, концентрацию твердой соли можно включить в константу равновесия. Тогда [c.249]
Поскольку константы диссоциации NH OH (l,79 10 j и НС2Н3О2 (1,86-10 a) почти одинаковы, связывание тех и других ионов должно происходить в одинаковой степени, а потому и реакция раствора остается нейтральной (рН=7). Однако в том, что гидролиз здесь происходит, и притом в весьма значительной степени (вследствие того, что уже не один, а сразу два процесса нарушают равновесие диссоциации воды), убедиться не трудно. Для этого стоит только понюхать раствор NH jHgO, он пахнет одновременно и уксусной кислотой и аммиаком. [c.101]
Располагая истинными термодинамическими константами диссоциации, можно легко и просто находить константы, характеризующие различные ионные равновесия. Рассмотрим, например, диссоциацию воды, состоящую в том, что одна молекула отдает протон, а другая этот протон присоединяет. Таким обра- [c.476]
Оба равновесия остаются, однако, сильно смени нными влево, поскольку константа диссоциации воды (К = 1,8 10 во много раз меньше константы диссоциации иона НСО., К2= 4,Н- 10 ") н константы диссоциации НРО4- (/(3 = 4,2 К) ). [c.133]
Равновесие в реакции диссоциации воды очень сильно смещено в сторону недиссоцнированной воды, однако устанавливается оно очень легко, и это делает реакцию (XII, ]5) весьма важной для многих свойств водных растворов. Степень диссоциации воды очень мала, поэтому мы не внесем ощутимых искажений, если активность (или концентрацию) недиссоциированных молекул (или с о) примем постоянной и, объединяя ее с константой диссоциации, представим соотношения (XII, 16) и (XII, 17) в [c.400]
Константа Куст — термодинамическая мера устойчивости комплекса. В табл. В. 15 приведены р/Суст некоторых важнейших комплексных соединений. Реакцией, обратной комплексообра-зованию, является реакция диссоциации. Диссоциация также протекает ступенчато, причем при обмене лигандов с водой координационное число обычно остается неизменным. Между константой равновесия и р/С прямой и обратной реакций имеет место следующее соотношение [c.421]
Значение /Са=Ю 3 соответствует истинной константе кислотной диссоциации Н2СО3. Если же учитывать и растворенный СО2, получают важную для практики кажущуюся константу К К кислотно-основное равновесие, устанавливающееся при растворении СО2, можно влиять, например сдвигать его в сторону образования ионов СОз путем добавления ионов ОН-. Следует заметить, что образование кислоты при растворении СО2 в воде происходит медленно (опыт 10), так как присоединение молекулы воды к двойной связи С = 0 идет не по ионному механизму. [c.561]
chem21.info
Константа диссоциации воды - Справочник химика 21
Измерение электропроводности чистой воды позволило определить константу диссоциации воды и чрезвычайно важное в химии ионное произведение воды [Н+] [0Н ] = при 25° (Кольрауш). [c.267]Помимо константы диссоциации воды Нп о и ее ионного нроиз-веления Ки-, важной характеристикой еюды является также константа равновесия К, отвечающая реакции [c.39]
Величины km, kiy и Kvi известны. Kyi — отношение второй константы диссоциации угольной кислоты к константе диссоциации воды при 20° С и бесконечном разбавлении K i IJ г-мол/л [1-3]. [c.126]
Вода является слабым электролитом. Константа диссоциации воды при 22°С составляет [c.115]
Концентрацию ионов водорода можно вычислить при помощи выражения для константы диссоциации воды, из которого следует, что [c.224]
Константа диссоциации воды увеличивается с температурой в большей степени, чем константы диссоциации про- [c.209]
Уравнение для константы диссоциации воды [c.471]
Константа диссоциации воды увеличивается с повышением температуры в большей степени, чем константы диссоциации продуктов гидролиза — слабых кислот и оснований. Поэтому при нагре- [c.268]
По численному значению константы диссоциации воды Н20 = Н++0Н-, [c.68]
Значение pH, равное 7, отвечает нейтральному раствору лишь при 25° С. Прп использовании шкалы )Н следует иметь в виду, что константа диссоциации воды Кш очень сильно зависит от температуры, увеличиваясь почти в сто раз в интервале от 20 до 100° С [c.39]
Напишем выражение для константы диссоциации воды [c.251]
Что означает отнощение первой и второй констант диссоциации воды и сероводорода [c.75]
Обозначив, как и прежде, искомую концентрацию иона водорода через у и пользуясь уравнением (2) для константы диссоциации воды, чтобы исключить из рассмотрения концентрацию [ОН ], можно преобразовать уравнение баланса зарядов к виду [c.472]
Рассчитайте константу диссоциации воды по уравнению [c.68]
Эта константа диссоциации воды определена опытным путем и при 25° С равна 1,86-Так как степень диссоциации воды очень мала, то мы не внесем заметных искажений, если примем концентрацию недиссоциирующих молекул воды постоянной, [c.47]
Сопоставить полученную удельную электропроводность воды с теоретической. Рассчитать последнюю, используя для ионов Н+ и ОН-, и константы диссоциации воды при соответствующих температурах. [c.97]
Рассчитайте константу диссоциации воды в соответствии с уравнением [c.203]
Каковы размерности и в каких единицах измеряются константа диссоциации воды и ионное произведение воды [c.203]
Е5еличпна К , н о представляет собой термодинамическую константу диссоциации воды, а произведение /(д.нзо н о обозначается через Кго и называется ионным произведением воды [c.461]
В водных растворах концентрации ионов Н+ и 0Н взаимосвязаны выражением константы диссоциации воды [c.298]
Ка — константа диссоциации воды в вакууме. [c.482]
Константа диссоциации воды увеличивается при повышении температуры в большей степени, чем константы диссоциации продуктов гидролиза - слабых кислот и оснований, поэтому при нагревании степень гидролиза возрастает. К этому выводу легко прийти и иначе так как реакция нейтрализации экзотермична, то гидролиз, будучи противоположным ей процессом, эндотермичен, поэтому в соответствии с принципом Ле Шателье нагревание вызывает усиление гидролиза. Рис. 2.31 иллюстрирует влияние температуры на гидролиз [c.286]
Поэтому вместо константы диссоциации воды обычно пользуются другой величиной К. [c.175]
Константа диссоциации воды, как слабого электролита, имеет следующее выражение [c.200]
Константа диссоциации воды [c.55]
Оба равновесия остаются, однако, сильно смени нными влево, поскольку константа диссоциации воды (К = 1,8 10 во много раз меньше константы диссоциации иона НСО., К2= 4,Н- 10 ") н константы диссоциации НРО4- (/(3 = 4,2 К) ). [c.133]
Константа диссоциации воды [c.127]
Из выражения для константы диссоциации воды видно, что [c.127]
Константа диссоциации воды Кш = [Н+] [ОН-] следовательно, из уравнений (IV,16) и (IV,21) найдем [c.75]
Примечание. Для задач Х-2-14—Х-2-19 константа диссоциации воды равна 1,00-Ю , [c.117]
Молекулы воды, хоть и незначительно, диссоциируют на цоны НзО и ОН". Константа диссоциации воды при 298 К [c.95]
Константа диссоциации воды /ионное произведение воды / w = 1 10 (см. Ионные процессы ). Ионное произведение воды сильно возрастает при повышении температуры водных растворов. При 100° С Kw = 59,29 10 [c.627]
Выражение константы гидролиза любого типа включает ионное произведение воды и константы диссоциации образующихся слабых электролитов. Так как при повыщении температуры константа диссоциации воды значительно в большей степени возрастает по сравнению с константами диссоциации слабых кислот и оснований, то при повышении температуры констайта гидролиза в целом должна увеличиваться и равновесие гидролиза смещается вправо (гидролиз сопровождается поглощением теплоты, ДЯг>0). Действительно, нагреванием удается сместить равновесие гидролиза вправо, но чаще это вызвано удалением одного из продуктов реакции. [c.317]
Поскольку степень диссоциации воды очень мала, то равновесная концентрация недиссоциироваиных молекул воды [Н2О] с достаточной точностью равна общей концентрации воды, т. е. 1000/18 = = 55,55 моль/л. В разбавленных водных растворах концеитрация воды мало изменяется, так что ее можио считать постоянной величиной. Тогда выражение для константы диссоциации воды можно преобразовать следующим образом [c.135]
Н20 (Нз0) + +0Н-Константа диссоциации воды имеет значение [c.214]
Мы рассмотрели условия раздельного титрования смесей двух кислот. Титрование одной кислоты можно рассмотреть с той же точки зрения, если воду рассматрпватЕ как одну из кислот. Если бы прп титровании сильным основанием вода и титруемая кислота были в эквивалентных количествах, то можно было бы титровать с точностью 0,1% кислоты, у которых константы больше константы диссоциации воды в 1000 раз. Так как константа диссоциации воды 10"то, следовательно, можно было бы титровать кислоты, константы диссоциации которых 10 1 . Но даже при титровании нормального раствора концентрация воды в 55,5 раза больше, чем кислоты. Отношение констант следует изме- [c.442]
Ввиду весьма малой степени диссоциации равновесная концентрация воды практически равна числу грамм-молекул воды в 1 л, а именно 1000 18= 55,55 моль1л, т. е. является постоянной величиной. Отсюда произведение константы диссоциации воды на ее равновесную концентрацию — также величина постоянная [c.127]
chem21.info
Константа - диссоциация - вода
Константа - диссоциация - вода
Cтраница 3
Поскольку вода является наиболее важным слабым электролитом, термодинамике процесса ее диссоциации было уделено большое внимание. Первые точные определения константы диссоциации воды были выполнены с помощью метода электропроводности [2] и путем измерения электродвижущих сил элементов с жидкостными соединениями. Если принять во внимание большие экспериментальные трудности, с которыми пришлось столкнуться в процессе этих исследований, то следует считать, что значения Kw ( 0 59 10 - при 18 и 1 04 10 - 14 при 25), полученные из данных по измерениям электропроводности, прекрасно совпадают со значениями ( 0 58 Ю-1 при 18 и 1 008 Ю-1 при 25), полученными в последнее время методом измерения электродвижущих сил. [31]
Поскольку вода является наиболее важным слабым электролитом, термодинамике процесса ее диссоциации было уделено большое внимание. Первые точные определения константы диссоциации воды были выполнены с помощью метода электропроводности [2] и путем измерения электродвижущих сил элементов с жидкостными соединениями. ЙГ № ( 0 59 1 ( Н4 при 18 и 1 04 1Q - 14 при 25), полученные из данных по измерениям электропроводности, прекрасно совпадают со значениями ( 0 58 10 - 14 при 18 и 1 008 10 - 14 при 25), полученными в последнее время методом измерения электродвижущих сил. [32]
Повторим опыты при различных температурах. В табл. 47 даны константы диссоциации воды при температурах от 0 до 30 С. [33]
Либо карбоната кальция должно раствориться больше, чем это было бы при других условиях, так что величина, данная в таблице для веса растворенного СаСОз, слишком мала, если верна величина произведения растворимости; либо, если вес растворенной соли верен, то приведенная в таблице величина произведения растворимости слишком велика. Степень гидролиза возможно вычислить по константам диссоциации воды, кислоты к основания, образующих соль, ИО это вычисление трудно, потому что связано с решением кубического уравнения. [34]
Энтропия ионов ОН - согласно такого рода расчетам равна около - 2 кал / моль-град. Способ определения энтропии иона по зависимости константы диссоциации воды от температуры не может дать точных результатов потому, что наклон кривой AG коси температур ( рис. 74, с) очень мал и неточность определения константы диссоциации приводит к значительным ошибкам в энтропии диссоциации. [35]
Что называют ионным произведением воды. В каком соотношении находится эта величина с константой диссоциации воды. [36]
Константа / Св показывает, чему равно ( при неизменно й температуре) произведение концентраций и нов водорода и гидроксид ионов в воде, и называется ионным произведением воды. Численное значение Ка нетрудно получить, так как константа диссоциации воды К. [37]
Спирты практически не являются электролитами. Константа диссоциации этилового спирта близка к 10 - 18, тогда как константа диссоциации воды - к 10 - 16, т.е. этиловый спирт является более слабой кислотой, чем вода. [38]
В табл. 8 - 2 приведены приближенные значения констант диссоциации для ряда веществ, обнаруживающих свойства кислот. Естественно, что соли наиболее слабых из этих кислот, имеющих константы диссоциации, значительно меньшие, чем константа диссоциации воды ( 10 - 1в), будут практически полностью гидролизованы в водных растворах. [39]
В табл. 8 - 2 приведены приближенные значения констант диссоциации для ряда веществ, обнаруживающих свойства кислот. Естественно, что соли наиболее слабых из этих кислот, имеющих константы диссоциации, значительно меньшие, чем константа диссоциации воды ( 10 - 1в), будут практически полностью гидролизованы в водных растворах. [40]
Числовые значения тепловых эффектов реакций определяют, насколько быстро или медленно меняется константа равновесия при повышении температуры. Например, тепловой эффект эндотермической реакции диссоциации воды имеет довольно большое положительное значение: АН0 55 81 кДж ( см. табл. 5.3), поэтому константа диссоциации воды быстро растет с температурой. Наоборот, реакции диссоциации ортофосфорной кислоты Н3РО4 сопровождаются малыми тепловыми эффектами, и поэтому ее константы диссоциации практически не зависят от температуры. [41]
Обычно эту величину и называют изобарно-изотермическим потенциалом диссоциации воды. Вызвано это тем, что для воды всегда принято иметь дело не с константой диссоциации, а именно с ионным произведением воды, которое широко используется для вычисления рН растворов и целого ряда других физико-химических характеристик водных растворов. Из-за того, что вместо константы диссоциации воды пользуются ее ионным произведением, удобнее изменение изобар-но-изотермического потенциала относить не к настоящей константе равновесия, а к ионному произведению воды. В табл. 48 приведены ионные произведения воды и отвечающие им изобарные потенциалы для различных температур. [42]
При нейтрализации карбоновых кислот щелочью образуются соли. В водном растворе соли щелочных металлов значительно гидролизуются. Константа гидролитического равновесия равна отношению константы диссоциации воды к константе диссоциации кислоты. [43]
Формы гидроксокомплексов: М: ц ( он) 4 и ZNifcOH5 1 определены в растворах при температурах: О, 25, НО, 60, 80, 100, 125, 150 С. Комстаиты гидролиза с повышением температуры увеличиваются. Повышение температуры способствует образованию свободных молекул воды в растворе, увеличению констант диссоциации воды [ l ] усилению гидролитических реакций. [44]
Почти все точные данные о зависимости констант диссоциации от температуры были получены путем измерения электродвижущих сил элементов без жидкостных соединений, содержащих слабые электролиты. Кроме того, все имеющиеся в настоящее время точные значения констант диссоциации для растворов в смесях воды с неводными растворителями в широком интервале температур были получены также путем измерения электродвижущих сил элементов без жидкостных соединений. В настоящей главе будут рассмотрены основы этого метода и его применение к определению констант диссоциации воды, слабых кислот и - амфолитов в воде и в водных растворах солей, а также в смесях воды с органическими растворителями. Будут описаны методы определения зависимости констант диссоциации от температуры и рассмотрены таблицы термодинамических величин, связанных с реакциями диссоциации. [45]
Страницы: 1 2 3 4
www.ngpedia.ru



















